Method Article
Влияние внутрисердечной нейронов на сердечной электрофизиологии и Arrhythmogenesis в системе Langendorff Ex Vivo
В этой статье
Резюме
Здесь мы представляем собой протокол для модуляции внутрисердечной вегетативной нервной системы и оценки его влияния на основные электрофизиологии, arrhythmogenesis и лагеря динамика, с помощью программы Langendorff установки ex vivo .
Аннотация
С момента своего изобретения в конце 19-го века Langendorff система перфузии ex vivo сердце продолжает быть важным инструментом для изучения широкий спектр физиологических, биохимических, морфологические и фармакологические параметры в централизованно денервированных сердца. Здесь мы описываем установку для модуляции внутрисердечной вегетативной нервной системы и оценки его влияния на основные электрофизиологии, arrhythmogenesis и динамика циклический аденозинмонофосфат (лагерь). Внутрисердечной вегетативной нервной системы модулируется механических рассечение предсердий жира колодки в котором мышиных ганглии расположены главным образом — или путем использования как глобальных, так и целевых фармакологического вмешательства. Octapolar электрофизиологические катетер вводится в правого предсердия и правого желудочка, и эпикардиальной размещены массивы несколькими электродами (МПС) для сопоставления с высоким разрешением используются для определения сердечной электрофизиологии и arrhythmogenesis. Фёрстер передачи энергии резонанса (ЛАДА) изображений выполняется для реального времени наблюдения за лагеря уровнях в различных регионах сердца. Нейроморфологию изучается с помощью на основе антител окрашивание всей сердца с помощью нейронов маркеров для идентификации и модуляции конкретных целевых показателей внутрисердечной вегетативной нервной системы в проведенных исследованиях. Langendorff ex vivo установки позволяет большое количество воспроизводимых экспериментах в короткое время. Тем не менее, частично открытый характер установки (например., во время измерений МПС) затрудняет контроль постоянной температуры и должны быть сведены к минимуму. Этот описан метод позволяет анализировать и модулировать внутрисердечной вегетативной нервной системы в децентрализованных сердцах.
Введение
Langendorff система перфузии ex vivo сердце продолжает быть важным инструментом для выполнения широкий спектр физиологических, биохимических, морфологические и фармакологические исследования в центре денервированных сердца1,2 ,3,,45 с момента его изобретения в конце 19 века6тыс . На сегодняшний день, эта система до сих пор широко используется для различных темы (например., ишемии-реперфузии) или для изучения сердца фармакологические эффекты7,8и является основным инструментом в сердечно-сосудистых исследований. Долговечность данного метода приводит к от несколько преимуществ (например., измерения выполняются без влияние центральной нервной системы или других органов, кровообращения или циркулирующих гормонов). При необходимости, Фармацевтика можно добавлять контролируемым образом буфер перфузии или непосредственно применяться к конкретным структурам. Воспроизводимость экспериментов, и относительно большое количество экспериментов могут быть выполнены в течение короткого времени. (Частично) открытый характер настройки можно сделать трудно регулирование температуры и необходимо принимать во внимание. Хотя в более крупных видов9также используется Langendorff система, мелкие животные используются главным образом как экспериментальной установки является менее сложной и большей биологической вариативности (например., трансгенные мыши модели) могут быть использованы.
В экспериментальной установки настоящего Протокола является влияние внутрисердечной вегетативной нервной системы на основные электрофизиологические параметры, желудочковой arrhythmogenesis, эпикардиальной теплопроводности и циклический аденозинмонофосфат (лагерь) динамика оценены. Большое количество внутрисердечной ганглии, которые расположены в основном в предсердной жировых отложений и теперь хорошо известны для контроля сердечной электрофизиологии независимо от центральной нейронные управления, являются либо оставить нетронутыми или вручную удалены с тщательной механической рассечение. Фармакологических модуляции вегетативной нервной системы осуществляется глобально добавив Фармацевтика в буфер перфузии или локально путем целенаправленных модуляции предсердий ганглиев. После экспериментов сердца хорошо подходят для оценки иммуногистохимического как все клетки крови были удалены из-за непрерывного перфузии, который может увеличить качество окрашивания.
Общая цель описанных методов является предложить новые перспективы для подробного исследования относительно влияния вегетативной нервной системы на сердечной электрофизиологии и arrhythmogenesis в самом сердце мыши. Причина использовать эту технику, что это можно изучить и изменить вегетативной нервной системы без влияние центральной нервной системы. Одним из основных преимуществ является легко занятости фармакологические эксперименты, в которых потенциальные про - антиаритмические свойств или старых и новых агентов могут быть протестированы. Кроме того для изучения механизмов аритмии, сердечной недостаточности или метаболических заболеваний доступны трансгенных и нокаут мыши модели различных кардиологических заболеваний. Такой подход укрепил наше понимание как вегетативной нервной системы на уровне предсердий может влиять желудочков сердца электрофизиологии и индукции аритмий.
протокол
Все процедуры с участием животных были утверждены местными властями государства Гамбурга, Гамбургский университет животных ухода и использования комитетов.
1. Подготовка аппарата Langendorff
Примечание: Коммерчески доступных Langendorff перфузии система используется.
- Подготовить измененный Кребса-Henseleit решение (119 мм хлорида натрия, бикарбонат натрия, 4,6 мм хлористого калия, 1,2 мм монокальций, Калия фосфат 1,1 мм магния сульфата, хлорида кальция, глюкозы 8.3 мм и 2 мм натрия 2,5 мм в 25 мм пируват). Добавьте смесь 95% двуокиси углерода в oxygen/5% перфузии решение для предотвращения кальция осадков. Фильтр буфер с размером пор 0,22 мкм.
- Добавление фармакологических агента в буфер расследовать его влияние на сердечной электрофизиологии и arrhythmogenesis при необходимости.
- Запустите ванну водой и поместите решение перфузии, включая смесь 95% двуокиси углерода в oxygen/5% в нем. Настройка температуры водяной бани, таким образом, чтобы температура раствора перфузии непосредственно перед канюлю ~ 37 градусов.
- Запустить насос ролик и заполняют раствором перфузии аппарат, как только температура не будет достигнута.
- Регулировать скорость насоса перед присоединением сердца, так, что нет пузырьков воздуха остаются в канюлю, когда крепления его к аппарату.
2. жесткий - и подготовка программного обеспечения
- Подключите систему сбора цифровых данных и соответствующего программного обеспечения к Langendorff аппарат для непрерывной записи перфузионного давления, скорости потока и частоты сердечных сокращений.
- Установите целевой перфузионного давления в общих настройках 80 мм рт..
- Начните запись.
- Используйте катетер электрофизиологии (Таблица материалов) с платиновыми электродами, поверхности электрода 0,5 х 0,5 мм и электрода расстояние 0,5 мм для записи данных и стимуляции с генератором назначенного цифровой стимул.
- Место катетера недалеко от района, где сердце будет располагаться после присоединения к аппарату.
- Подготовить стимуляции, выбрав 2 электроды из катетера и использовать цикл длиной 100 мс.
3. Подготовка сердца
- Добавьте холодной (~ 2-4 градусов) буфера перфузии (10-20 мл и 40-50 мл, так что весь блюдо покрыта) 2 Петри (диаметр 6 см и 10 см) и блюдо с канюлей и место их на льду, непосредственно следующий и под микроскопом. Подготовьте двойным узлом вокруг канюли.
- Быстро акцизных сердце после шейки матки дислокации, открыв грудную клетку, используя ножницы Майо и узкие шаблон щипцы. Затем сцепление аорты и полой выше диафрагмы, используя пинцет Лондон и акцизных легочное сердце блока путем разрезания всех сосудов и соединительной ткани рядом с корешком ножницами косоглазия.
- Легочное сердце блок в первое блюдо (6 см в диаметре), наполненный ледяной буфера передачи и тщательно удалить легких без повреждения сердца, используя ножницы косоглазия и Лондоне щипцами. Затем поместите сердце под микроскопом и тщательно удалить тимуса, трахеи и пищевода, используя ножницы весной и пинцет СС Дюмон.
- Используйте весной ножницы, чтобы вырезать отверстие 1,5-2 мм в верхней части правого предсердия для ввода катетера. Вырежьте отверстие в легочной артерии. Затем вырежьте аорты непосредственно под supraaortic ветвями и удаление ткани из аорты, так, что узел может быть легко.
- Держите предсердий жировых отложений, включая основные atrially находится ganglionated оргстекла, вокруг левого предсердия нетронутыми или полностью удалить их тщательное вскрытие.
- Передача сердце на блюдо с канюлю и поместите его под микроскопом. Натяните аорты канюлю с щипцами Дюмон СС и связать подготовленный узел плотно вокруг аорты. Убедитесь, что канюли находится не слишком глубоко в аорте, так что аортального клапана и коронарных сосудов, остаются бесплатно.
- Быстро прикрепите канюли Langendorff аппарата. Убедитесь, что нет пузырьков в канюлю.
- Переключатель перфузионного давления до 80 мм рт.ст., позволяя перфузии постоянное давление.
- Вставьте катетер тщательно правого предсердия и правого желудочка без прикосновения или повреждения сердца и закрепите катетер канюля с лентой.
- Запустите стимуляции с подготовленной цикл длиной 100 мс на период уравновешивания первоначальный 20 мин.
- Закройте камеру разрешить стабильную температуру.
4. Электрофизиологические параметры и Arrhythmogenesis
- Примените запрограммированных стимуляции через дистальной или проксимальной электроды катетера в два раза сокращение предсердий или желудочков стимуляции порог для оценки электрофизиологические параметры, как описано в следующих шагах.
- Определить время восстановления синусового узла как длина максимальный обратный цикл после 10 s фиксированного курса, ходить на S1S1 длину цикла 120 мс, 100 мс и 80 мс.
- Определить точку, Wenckebach как длинная длина цикла S1S1 (8 стимулы; S1S1: 100 мс; 2 мс поэтапного сокращения) с потерей 11 узловой AV проводимости. Определить предсердно узловой огнеупорных периодов как длинный S1S2 (12 стимулы; S1S1: 120 мс, 110 мс и МС; один короткий в сочетании с 2 мс поэтапного сокращения S1S2 extrastimulus) с потерей узловой AV проводимости.
- Определить предсердий и желудочков огнеупорных периодов как длинный S1S2 (12 стимулы; S1S1: 120 мс, 110 мс и МС; один короткий extrastimulus в сочетании с 2 мс поэтапного сокращения S1S2) отсутствует сокращение предсердий или желудочков ответ10,11.
- Выполнение запланированных extrastimulation (S1S1: 120 мс, 100 мс и 80 мс, а затем до 3 дополнительных ударов; 60-20 мс с 2 мс поэтапного сокращения) или взрыв, протоколы стимуляции (5 s в S1S1: 50-10 мс с 10 мс поэтапного сокращения) в соответствии с конвенций, Ламберт, Ева luate11,10,желудочковой arrhythmogenesis12.
5. эпикардиальной проведение измерения
Примечание: Запись однополярного эпикардиальной electrograms с помощью 128-канал, компьютерный запись системы с шагом дискретизации 25 кГц для сопоставления с высоким разрешением. Используйте массив 32 мульти электрода (МЭС; межэлектродный расстояние: 300 мкм; 1,8 х 1,8 мм). Обратите внимание, что данные были полосовой фильтрации (50 Гц) и оцифрованы с 12 бит и диапазон сигнала 20 МВ.
- Место МПС в области места для сердца и добавить заземление в другую часть сердца13,14,15.
- Место эпикардиальной стимуляции катетера недалеко от МПС и начать постоянной стимуляции.
- Начните запись после подтверждения хорошего контакта электродов, проверяя качество сигнала и амплитуды.
- Используйте автономный анализ для определения скорости распространения волн и дисперсии в направлении проводимости.
6. основанные на ладу передачи энергии Фёрстер резонанс циклический аденозинмонофосфат (лагерь) изображений
Примечание: Для измерений, основанных на ладу, урожай сердца из CAG-Epac1-лагеря трансгенных мышей16.
- Используйте систему самодельных изображений вокруг стереомикроскопом15,17.
- Место стереомикроскопом перед сердцем и настроить его для остроты зрения.
- Возбуждают лагеря датчик с источником света [например, использование одной длины волны света излучающих диодов (440 Нм)]. Разделение света выбросов в доноров и акцепторов каналы с использованием splitter луча (для пара голубой флуоресцентный белок/желтый флуоресцентный белок, использование 565dcxr дихроичное зеркало и фильтры выбросов D480/30 и D535/40).
- Обеспечить стабильную температуру, поставив пластиковые оберните вокруг камеры.
- Возьмите изображения с помощью камеры научных дополнительные металл оксид полупроводник (sCMOS). Координировать источник света и камеры образов с открытым исходным кодом программного обеспечения таких как микро-менеджер.
- Чтобы начать получение изображения, нажмите Multi-D Acq. кнопки и настроить промежуток времени, который приобретает изображение каждые 10 сек, с соответствующей экспозиции время, которое зависит от мощности флуоресцентного сигнала (около 100 мс).
- Используйте ранее описанных и доступны онлайн ладу и лад онлайн 2 плагины17 разделить изображение на два канала, выберите регионы интереса и контролировать соотношение трассировки.
- Во время приобретения perfuse сердце с модифицированных Кребса-Henseleit раствор, содержащий различные вещества, в зависимости от характера эксперимента.
- В конце эксперимента выключите приобретения, нажав кнопку остановить и сохранить стек изображений.
- Анализ данных ладу, автономно с помощью выделенного анализ программного обеспечения, которое можно разделить образы на двух идентичных секций для доноров и акцепторов каналов и может выполнять анализ лад в нескольких регионах интереса.
Примечание: Выделенный плагин (ладу автономно) необходима, которая предоставляется в Шпренгер et al. 17.- Запустите программное обеспечение. Откройте анализ, перейдя в меню плагинов , а затем нажмите на MicroManager, а затем на Открытых микро-менеджер файлов.
- Запустите ладу автономном режиме плагин для того, чтобы разделить два одинаковых изображения CFP и рекламы ЯФП каналов промежуток времени.
- Используйте средство Произвольной выборки для обозначения региона интерес рекламы ЯФП изображения. Нажмите кнопку Добавить , чтобы добавить выделение в окне Multi измерения .
- Выберите регион интерес в окне Multi измерения и нажмите Multi получить таблицу с средний серый значения для каждого кадра и региона. Скопируйте и вставьте все данные в листе Excel.
- Нажмите на Стек изображений СЛП. Выполните те же действия, что и в шаге 6.10.4 для стека CFP и вставьте значения среднего серого в тот же лист Excel.
- Исправьте необработанные данные автономно для фактор через кровь донора в акцепторной канал17.
- Используйте следующую формулу, где B — фактор кровотечение через:
Коэффициент = (рекламы ЯФП - B-x CFP) / СЛП - Определить фактор кровотечение через B изображения сердца, выражая CFP только и измерить процент доноров флуоресценции в канале рекламы ЯФП (B = рекламы ЯФП / CFP).
- Используйте следующую формулу, где B — фактор кровотечение через:
7. нейроморфологию
Примечание: Анализ внутрисердечной вегетативной нервной системы с помощью immunostainings целом гора нетронутыми мышиных сердец. Обратите внимание, что большинство внутрисердечной ганглиев локализованы в эпикардиальной жировой ткани рядом легочных вен.
- Использовать различные stainings изображением neurofilament (общая нейрональных структур; курица анти NF-H, 1:3, 000), тирозин-гидроксилазы (TH, симпатичная(ый) нейрональных структур; кролик α-й, 1:1, 000) и холин ацетилтрансфераза (чат, парасимпатической нейрональных структур; Коза α чат, 1:50).
- После перфузии в Langendorff аппарате исправить сердца мыши в 10 мл формалина за 24 часа и хранить их в фосфат амортизированное saline (PBS) на 4 градусов.
- Отбеливатель сердца в отбеливатель Дент (наименьшие метанола: перекиси водорода раствор 30% (w/w) в H2O: диметилсульфоксида (ДМСО)) за 1 неделю на 4 ° c и увлажняет их впоследствии в PBS в серии по убыванию метанола в PBS (100%, 75%, 50%, 25%; 1 h) 18.
- Выполните следующие инкубаций в формате 24-хорошо пластины с нежным агитации на 4 ° c:
- Разрушения сердца в 1% тритон-X-100/PBS (PBS-T) для 3 x 1 ч при комнатной температуре до блокировки их на ночь в блокирующем буфере [5% бычьим сывороточным альбумином (БСА) / PBS-T + азид натрия 0,2%].
- Разбавьте антитела следующим: Коза α чат (1:50), кролик α TH (1:1, 000), курица α neurofilament (1:3, 000); вторичные антитела для люминесцентные маркировки (1: 500; или согласно инструкциям производителя); биотинилированным вторичные антитела для маркировки Хромогенный (1: 200; или согласно инструкции производителя).
- Проинкубируйте образцы в первичных антител, разводят в блокирующем буфере 1 неделю на 4 градусов.
- Помыть сердца для 3 x 15 мин в PBS-T перед вторичное антитело инкубации в блокирующем буфере для 4 дней.
- Помыть сердца для 3 x 15 мин в PBS-T и хранить их в среде установки для флуоресцентной окраски за 3 ч при комнатной температуре или использовать авидин Биотин комплекс обнаружения kit согласно инструкциям производителя.
- Предварительно Инкубируйте сердца за 1 ч в коммерческих буфера для 3, 3'-диаминобензидин (DAB), до разработки их под визуальный контроль в буфере DAB-содержащих согласно инструкциям производителя.
- Храните образцы в двойной дистиллированной воды.
- Для парафиновых срезах обезвоживанию и внедрить сердца в парафин.
- Резать толстые секции 4-мкм и deparaffinize их по данным лаборатории рутинные процедуры. Ли и как антиген поиска необходимо выполнить должна быть создана для каждого индивидуальную настройку, поскольку она зависит от комбинации антител.
- Разрушения в разделах 10 мин в солевой раствор 0,2% Тритон X-100/трис буфере (TBS), следуют 3 x 5 мин моет в TBS.
- Блокировать их с 3% BSA/TBS 1 ч при комнатной температуре.
- Инкубировать их на ночь при 4 ° c [первичного антитела: Коза α чат (1:50), кролик α й (1: 500), курица α neurofilament (1:1, 000)] или 2 ч при комнатной температуре (помечены флуоресцентным вторичные антитела, 1: 500) в 1% BSA/TBS с 3 x 5 мин моет TBS между ними.
- Добавьте 1 мкг/мл bisbenzimide H33342 trihydrochloride вторичное антитело решение или использовать другой метод ядерной окрашивание.
- Смонтируйте слайды в среде установки для флуоресцентной окраски.
Результаты
Рисунок 1 показывает изображение Langendorff установки, включая 2 несколькими электродами массивы (МЭС). До эксперимента внутрисердечного катетера расположен близко к канюля для содействия быстрой и легкой вставки в желудочке прямо атриум и обеспечить за короткий период времени до тех пор, пока уравновешивания можно начать. В нижней части камеры может быть повышена (см. стрелки на рис. 1) так что камера полностью закрыт и гарантирует стабильную температуру.
Рисунок 2 изображает различных представительных сердечной stainings. В рисунке 2A гематоксилином и эозином (H & E) окрашивание парафиновых раздела представлен. В образцовую расширения (рис. 2B) иммуногистохимическое окрашивание одной предсердий ганглия демонстрирует преимущественно парасимпатической клетки (красный, чат позитивных), по сравнению с менее многочисленными симпатичная(ый) клетки (зеленый, TH положительных). В рисунке 2 c-E иммуногистохимическое окрашивание нейронных (рис. 2 c, зеленый, neurofilament) и симпатических волокон (Рисунок 2D, красный, TH) а также наложения двух изображений (Рисунок 2E) изображает как нервных волокон Пройдите от предсердий через коронарного синуса к задней желудочков.
Рисунок 3 показывает мышиных сердце подключен к канюля Langendorff аппарат с вставленной octapolar катетер в правого предсердия и правого желудочка и массив эпикардиальной несколькими электродами (MEA) размещены на передней левого желудочка ( Рисунок 3A). Желудочковой аритмии восприимчивость тестирования через электроды в RV представлена на рисунке 3B. Индукции желудочковая тахикардия в сердцах произошло более часто после частичная денервация предсердий. В расширенном МПС (рис. 3 c) представлена принципиальная схема электродов. Важно обеспечить стабильную эпикардиальной контакт всех электродов. В рисунке 3D изображен автономный анализ эпикардиальной проводимости, записанная в МЭС.
Рисунок 4 показывает ладу измерения в целом сердце, будучи retrogradely увлажненную в аппарате Langendorff. Различные области сердца могут быть проанализированы как необходимое (Рисунок 4A). В этой установки (рис. 4B) легко возможна как глобального, так и местные местного применения лекарственных препаратов.

Рисунок 1: Установка Langendorff, включая массивы многолетних электрода (МЭС). Octapolar стимуляции и записи катетер находится недалеко от района, в котором будет прилагаться сердце. В нижней части камеры будет перемещен вверх (белые стрелки) после того, как сердце был присоединен к аппарат таким образом, что обеспечивается стабильная температура. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
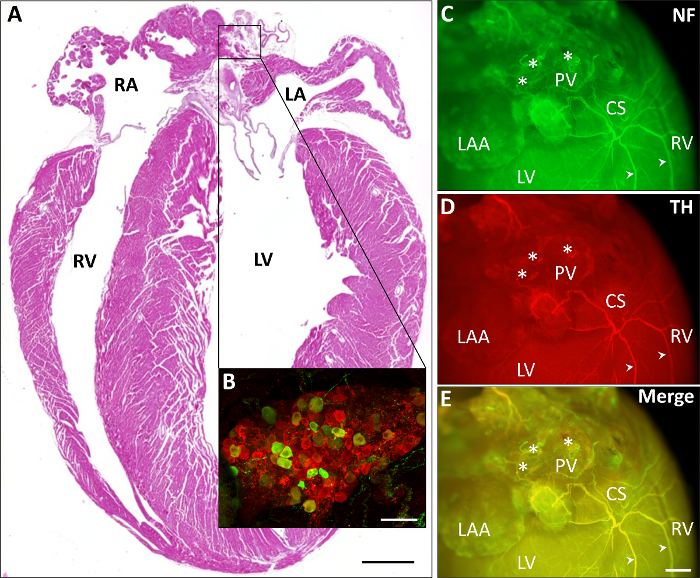
Рисунок 2: сердца всего горе stainings с изображением части вегетативной нервной системы. A) изображением сердца H & E-окрашенных парафин секции (шкала 1 мм). B) образцовую расширение одного immunohistochemically, окрашенных предсердий ганглия демонстрирует преимущественно парасимпатической клетки (красный, чат позитивных), по сравнению с менее многочисленными симпатичная(ый) клетки (зеленый, TH-позитивных; шкалы 75 мкм). C-E) Представитель иммуногистохимических stainings нейронных (рис. 2 c, зеленый, neurofilament, NF) и симпатических волокон (Рисунок 2D, красный, TH и их наложения в рисунке 2E) пройти от предсердий через коронарного синуса (CS) к задняя желудочков. Образцовое волокна отмечены наконечники стрел. Звездочками обозначения предсердий ганглии. Масштаб 1 мм бар. Ла, левое предсердие; LV, левого желудочка; Н.Ф., neurofilament; PV, легочных вен; РА, правое предсердие; САР, прямо предсердий придаток; RV, правый желудочек. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
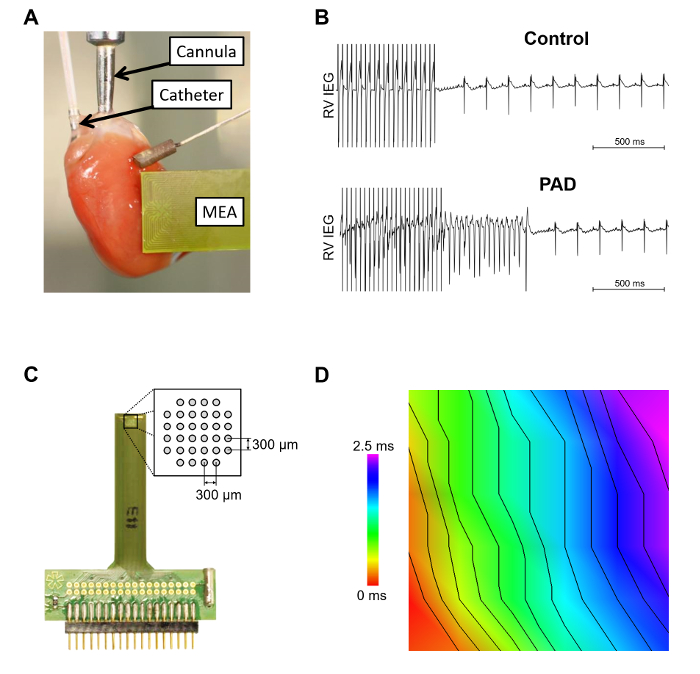
Рисунок 3: эпикардиальной измерений с использованием Langendorff установки внутри - и. А. Эта группа показывает пример мышиных сердца в системе Langendorff. Изображены внутрисердечной octapolar катетер, который вставляется в правое предсердие и желудочек и один массив эпикардиальной несколькими электродами (MEA). Б. аритмии восприимчивость тестирования с использованием взрыв стимуляция без (управления) или с индукции самостоятельного прекращения изображены желудочковая тахикардия [после частичная денервация предсердий (PAD)]. C. эпикардиальной МПС изображен с расширения макета схемы электрода. Д. скорости распространения волн была проанализирована с помощью специализированного программного обеспечения. Расстояние между изохрон-2 м/с. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Лада измерения в установке Langendorff. А. изображены два differentcAMP биосенсор флуоресценции каналы [желтый флуоресцентный белок (рекламы ЯФП) и голубой флуоресцентный белок (СЛП)] во время измерений лад в ретроградное перфузии сердце. При необходимости, могут быть проанализированы различные части сердца (например, предсердия и желудочка) (шкалы бар: 1 мм). Б. Эта группа показывает представитель ладу эксперимент, который измеряет лагеря уровни во время фармакологических стимуляции в атриум и левого желудочка. Во-первых сердце было системно увлажненную с adenylyl циклазы активатор NKH477, форсколин analogon, чтобы увеличить уровни лагеря. Затем никотина местно применяется и ориентированы на предсердий ганглии, которые резко сократили лагеря уровнях. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
В этой рукописи известный Langendorff ex vivo сердце перфузии системы представлен как инструмента для изучения влияния внутрисердечной нейронов на сердечной электрофизиологии и arrhythmogenesis с помощью различных карт и методы стимуляции включая эндокарда и эпикардиальной подходы.
Некоторые части протокола имеют решающее значение для установки. Во-первых важно использовать технику приготовления в котором предсердий жировых отложений остаются нетронутыми или быстро удаляются без ранив миокарда. Во-вторых правильно размера открытия должен быть сокращены в правое предсердие для легко вставки octapolar катетера в правого предсердия и правого желудочка. Катетер должен легко проскользнуть в правый желудочек без создания какого-либо давления. Во время приверженность катетера канюли катетер должен не окунуться глубже в желудочек, чтобы избежать травмы сердца. В-третьих контроль температуры является важной частью всех установок1,Langendorff2,5. Тепловые камеры закрыт в течение аритмии тестирования, обеспечивая стабильную температуру. Но для записи МПС или ладу, палата должна быть по крайней мере частично открыта, чтобы разрешить измерений. Время записи должны быть сведены к минимуму или другие методы, чтобы уменьшить потери температуры, как положить полиэтиленовую пленку вокруг камеры во время больше измерений, должны быть выполнены. В-четвертых МЭС должны находиться в тех же анатомических местах в всех экспериментов. Хороший поверхности контакта, который подтверждается большой амплитуды в реальном времени анализ, может достигаться с помощью двух МЭС на противоположной сайтах, так что противовес производится. В-пятых лада измерения находятся под влиянием движения. Чтобы уменьшить спонтанное движение, сердце темп стабильной частотой внутрисердечной катетером. Для дополнительной стабилизации трубка с небольшой вакуум может стабилизировать верхушки.
Одним из преимуществ системы Langendorff является, что сердца может использоваться впоследствии для оценки иммуногистохимического нервной системы сердца. Непрерывная перфузии удаляет большинство красные кровяные клетки, которые имеют высокий уровень аутофлюоресценция19, повышение качества окрашивания. После фиксации формалин сердца может храниться в среде контролируемых (4 ° c) температуры в фосфат амортизированное saline для до одного года без заметных изменений в окрашивания качества.
Наиболее важной особенностью этой установки является, что все измерения выполняются в централизованном порядке денервированных сердце. Преимущественно парасимпатической предсердий внутрисердечной ганглиев являются последней станции ретрансляции в сердце20 симпатичная(ый) ганглия stellatum расположен в intrathoracically и поэтому удаляется во время подготовки. Хотя внутрисердечной нейроны получают не центральный вход, было показано, что они по-прежнему активны в физиологических способом как photoactivation сердца симпатического нервов увеличивает ЧСС и сердечной сократительной силы21. В соответствии с этими выводами, поддерживая функциональное значение внутрисердечной нейронов в самом центре города денервированных мы недавно продемонстрировали их влияние на функции желудочка и arrhythmogenesis15.
Одним из преимуществ этой централизованно денервированных установки является, что она позволяет исследователю для изучения связи между различными внутрисердечной региональных нейронных сетей (например, взаимодействие между предсердие и желудочек)15. Эти различия могут иметь значение для больных после трансплантации сердца, в которых лечение с ivabradine модулятор селективного синусового узла улучшает выживания, по сравнению с лечения с бета-блокатор метопролола сукцината22. На будущем этапе прямая электростимуляция парасимпатическую (блуждающий нерв) или симпатичная(ый) структур (Ggl. stellatum23) поможет улучшить наши знания о взаимосвязи между экстра - и внутрисердечного вегетативной нервной системы.
Важно иметь в виду, что парасимпатической и симпатических волокон в основном совместно локализованных так что текущий терапии как аблацию сокращение предсердий или желудочков аритмий неизбежно изменит обеих структур. Здесь описаны настройки могут изучаться местные фармацевтические изменения целевых структур (например, конкретные стимуляцией парасимпатических ганглиев). Помимо целенаправленного изменения глобальные перфузии с различных фармацевтических препаратов (например, бета-блокаторы) легко можно, так что потенциальные proarrhythmic или антиаритмические свойства различных агентов могут быть изучены. С помощью этой установки, мероприятия и различные методы могут быть проверены во время стимуляции или ингибитированием различных частей внутрисердечной вегетативной нервной системы, разглашение информации о воздействии отдельных частей вегетативной нервной системы на функции сердца и arrhythmogenesis. Кроме того мышиных установка позволяет изучать сердца вегетативной нервной системы в государствах таких заболеваний, как инфаркт миокарда, сердечная недостаточность и диабет.
В заключение, простой и хорошо известных Langendorff ex vivo сердце перфузии система обеспечивает гибкую основу для изменения и изучения влияния внутрисердечной нейронов на сердечной электрофизиологии и arrhythmogenesis.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы хотели бы поблагодарить Hartwig Wieboldt за его прекрасную техническую помощь и УКЭ микроскопии изображений объекта (Umif) из университета медицинский центр Гамбург-Эппендорф для микроскопов и поддержки. Это исследование было финансируемых bythe Förderverein des Universitären Гамбург Herzzentrums е.в. и DZHK (Немецкий центр исследования сердечно-сосудистой системы) [FKZ 81Z4710141].
Материалы
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Sigma-Aldrich | S3014 | Modified Krebs-Henleit solution |
| Sodium hydrogencarbonate | Sigma-Aldrich | 401676 | Modified Krebs-Henleit solution |
| Potassium chloride | Sigma-Aldrich | P5405 | Modified Krebs-Henleit solution |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | Modified Krebs-Henleit solution |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | Modified Krebs-Henleit solution |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | Modified Krebs-Henleit solution |
| Glucose | Sigma-Aldrich | G5767 | Modified Krebs-Henleit solution |
| Sodium pyruvate bioXtra | Sigma-Aldrich | P8574 | Modified Krebs-Henleit solution |
| Carbogen (95% O2 / 5% CO2) | SOL-Group, TMG Technische und Medizinische Gas GmbH, Krefeld, Gersthofen, Germany | Modified Krebs-Henleit solution | |
| Sterile filter steritop-GP 0.22 | EMD Millipore | SCGPT05RE | Modified Krebs-Henleit solution |
| Atropine sulfate | Sigma-Aldrich | A0257 | Neuromodulation |
| Hexamethonium chloride | Sigma-Aldrich | H2138 | Neuromodulation |
| Nicotine free base 98-100% | Sigma-Aldrich | N3876 | Neuromodulation |
| Formalin solution neutral buffered 10% | Sigma-Aldrich | HT501128 | Whole mount staining |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | Whole mount staining |
| Methanol | Sigma-Aldrich | 34860 | Whole mount staining |
| Hydrogen peroxide solution 30% (w/w) in H2O | Merck, KGA, Darmstadt, Germany | H1009 | Whole mount staining |
| Dimethyl sulfoxide | Merck, KGA, Darmstadt, Germany | D8418 | Whole mount staining |
| Phosphate-buffered saline tablets | Gibco / Invitrogen | 18912-014 | Whole mount staining |
| Triton-x-100 | Sigma-Aldrich | T8787 | Whole mount staining |
| Albumin bovine fraction V | Biomol, Hamburg, Germany | 11924.03 | Whole mount staining |
| Chicken anti neurofilament | EMD Millipore | AB5539 | Whole mount staining |
| Rabbit anti tyrosine hydroxylase | EMD Millipore | AB152 | Whole mount staining |
| Goat anti choline acetyltransferase | EMD Millipore | AP144P | Whole mount staining |
| Donkey α rabbit IgG Alexa 488 | Thermo Fisher Scientific | A21206 | Whole mount staining |
| Donkey α goat IgG Alexa 568 | Thermo Fisher Scientific | A11057 | Whole mount staining |
| Donkey α chicken IgY Alexa 647 | Merck, KGA, Darmstadt, Germany | AP194SA6 | Whole mount staining |
| Biotin-conjugated donkey α rabbit igG | R&D Systems | AP182B | Whole mount staining |
| Biotin-conjugated donkey α goat igG | R&D Systems | AP192P | Whole mount staining |
| Biotin-conjugated goat α chicken igY | R&D Systems | BAD010 | Whole mount staining |
| Vectashield mounting medium | Vector laboratories, Burlingame, CA, USA | H-1000 | Immunohistochemistry |
| Vectastain ABC kit | Vector laboratories, Burlingame, CA, USA | PK-4000 | Immunohistochemistry |
| Steady DAB/Plus | Abcam plc, Cambridge, UK | ab103723 | Whole mount staining |
| HistoClear | DiaTec, Bamberg, Germany | HS2002 | Immunohistochemistry |
| BisBenzimide H33342 trihydrochloride (Hoechst) | Sigma-Aldrich, St. Louis, MO, USA | B2261 | Immunohistochemistry |
| Vectashield HardSet mounting medium | Vector laboratories, Burlingame, CA, USA | VEC-H-1400 | Immunohistochemistry |
| Perfusion system | HUGO SACHS ELEKTRONIK - HARVARD APPARATUS GmbH, March-Hugstetten, Germany | 73-4343 | Langendorff apparatus |
| Data acquisition system and corresponding software for catheter and physiological parameter | Powerlab 8/30 & Labchart, ADInstruments, Dunedin, New Zealand | PL3508 PowerLab 8/35 | Langendorff setup |
| Octapolar catheter | CIB’ER Mouse, NuMed Inc., Hopkinton, NY, USA | custom | Langendorff setup |
| Stimulus generator | STG4002, Multi Channel Systems, Reutlingen, Germany | STG4002-160µA | Stimulation setup |
| Stimulation software | Multi Channel Systems, Reutlingen, Germany | MC_Stimulus II | Stimulation setup |
| Data acquisition system and corresponding software for epicardial electrograms | ME128-FAI-MPA-System, Multi Channel Systems, Reutlingen, Germany | USB-ME128-System | MEA setup |
| Multi-electrode array | MEA, EcoFlexMEA36, Multi Channel Systems, Reutlingen, Germany | EcoFlexMEA36 | MEA setup |
| Multi-electrode array recording software | Multi Channel Systems, Reutlingen, Germany | MC_Rack | MEA setup |
| Spring scissors | Fine Science Tools GmbH, Heidelberg, Germany | 15003-08 | Heart Preparation |
| Strabismus Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14575-09 | Heart Preparation |
| Mayo Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14110-15 | Heart Preparation |
| Dumont SS Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11203-25 | Heart Preparation |
| London Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11080-02 | Heart Preparation |
| Narrow Pattern Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11003-13 | Heart Preparation |
| Plastic Wrap | Parafilm M, Bemis NA, based in Neenah, WI, United States | Consumable Materials | |
| Stereomicroscope | Leica M165FC; Leica Microsystems GmbH, Wetzlar, Germany | FRET | |
| LED | CoolLED, Andover, UK | pE-100 | FRET |
| DualView | Photometrics, Tucson, AZ, USA | DV2-SYS | FRET |
| DualView filter set | Photometrics, Tucson, AZ, USA | 05-EM | FRET |
| optiMOS scientific CMOS camera | Qimaging, Surrey, BC, Canada | 01-OPTIMOS-R-M-16-C | FRET |
| Imaging software | Micro-Manager; Vale Lab, University of California San Francisco, CA, USA | FRET | |
| Analysis Software | Image J software; Public Domain, NIH, USA | FRET |
Ссылки
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Hearse, D. J., Sutherland, F. J. Experimental models for the study of cardiovascular function and disease. Pharmacological Research. 41 (6), 597-603 (2000).
- Valentin, J. P., Hoffmann, P., De Clerck, F., Hammond, T. G., Hondeghem, L. Review of the predictive value of the Langendorff heart model (Screenit system) in assessing the proarrhythmic potential of drugs. Journal of Pharmacological and Toxicological Methods. 49 (3), 171-181 (2004).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff-still viable in the new millennium. Journal of Pharmacological and Toxicological Methods. 55 (2), 113-126 (2007).
- Langendorff, O. Investigation of the living mammalian heart. Pflügers Archiv. 61, 291-332 (1895).
- Matsumoto-Ida, M., Akao, M., Takeda, T., Kato, M., Kita, T. Real-time 2-photon imaging of mitochondrial function in perfused rat hearts subjected to ischemia/reperfusion. Circulation. 114 (14), 1497-1503 (2006).
- Rassaf, T., Totzeck, M., Hendgen-Cotta, U. B., Shiva, S., Heusch, G., Kelm, M. Circulating nitrite contributes to cardioprotection by remote ischemic preconditioning. Circulation Research. 114 (10), 1601-1610 (2014).
- Schechter, M. A., et al. An isolated working heart system for large animal models. Journal of Visualized Experiments. 88 (88), 51671 (2014).
- Stockigt, F., et al. Total beta-adrenoceptor knockout slows conduction and reduces inducible arrhythmias in the mouse heart. PLoS One. 7 (11), e49203 (2012).
- Berul, C. I. Electrophysiological phenotyping in genetically engineered mice. Physiological Genomics. 13 (3), 207-216 (2003).
- Curtis, M. J., et al. The Lambeth Conventions (II): guidelines for the study of animal and human ventricular and supraventricular arrhythmias. Pharmacology & Therapeutics. 139 (2), 213-248 (2013).
- Schrickel, J. W., et al. Enhanced heterogeneity of myocardial conduction and severe cardiac electrical instability in annexin A7-deficient mice. Cardiovascular Research. 76 (2), 257-268 (2007).
- Rudolph, V., et al. Myeloperoxidase acts as a profibrotic mediator of atrial fibrillation. Nature Medicine. 16 (4), 470-474 (2010).
- Jungen, C., et al. Disruption of cardiac cholinergic neurons enhances susceptibility to ventricular arrhythmias. Nature Communications. 8, 14155 (2017).
- Calebiro, D., et al. Persistent cAMP-signals triggered by internalized G-protein-coupled receptors. PLoS Biology. 7 (8), e1000172 (2009).
- Sprenger, J. U., Perera, R. K., Götz, K. R., Nikolaev, V. O. FRET microscopy for real-time monitoring of signaling events in live cells using unimolecular biosensors. Journal of Visualized Experiments. (66), e4081 (2012).
- Alanentalo, T., et al. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nature Methods. 4 (1), 31-33 (2007).
- Whittington, N. C., Wray, S. Suppression of red blood cell autofluorescence for immunocytochemistry on fixed embryonic mouse tissue. Current Protocols in Neuroscience. 81, 2.28.1-2.28.12 (2017).
- Fukuda, K., Kanazawa, H., Aizawa, Y., Ardell, J. L., Shivkumar, K. Cardiac innervation and sudden cardiac death. Circulation Research. 116 (12), 2005-2019 (2015).
- Wengrowski, A. M., Wang, X., Tapa, S., Posnack, N. G., Mendelowitz, D., Kay, M. W. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovascular Research. 105 (2), 143-150 (2015).
- Rivinius, R., et al. Control of cardiac chronotropic function in patients after heart transplantation: effects of ivabradine and metoprolol succinate on resting heart rate in the denervated heart. Clinical Research in Cardiology. , (2017).
- Ajijola, O. A., et al. Augmentation of cardiac sympathetic tone by percutaneous low-level stellate ganglion stimulation in humans: a feasibility study. Physiological Reports. 3 (3), e12328 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены