Method Article
Impatto dei neuroni intracardiaci elettrofisiologia cardiaca e aritmogenesi in un sistema di Langendorff Ex Vivo
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per la modulazione del sistema nervoso autonomo intracardiaco e la valutazione della sua influenza su base elettrofisiologia, aritmogenesi e accampamento dinamica utilizzando un'installazione di Langendorff ex vivo .
Abstract
Sin dalla sua invenzione nel tardo 19° secolo, il sistema di perfusione Langendorff ex vivo cuore continua ad essere uno strumento rilevante per lo studio di un ampio spettro di parametri fisiologici, biochimici, morfologici e farmacologici in cuore centrale denervato. Qui, descriviamo una configurazione per la modulazione del sistema nervoso autonomo intracardiaco e la valutazione della sua influenza su base elettrofisiologia, aritmogenesi e le dinamiche dell'adenosina monofosfato ciclico (cAMP). Il sistema nervoso autonomo intracardiaco è modulato da dissezione meccanica di grasso atriale pastiglie-in cui gangli murini si trovano principalmente — o dall'utilizzo degli interventi farmacologici globali, nonché mirati. Un catetere elettrofisiologici di octapolar è stato introdotto in atrio destro e ventricolo destro, e dell'epicardio-disposto multi-elettrodo matrici (MEA) per la mappatura ad alta risoluzione vengono utilizzate per determinare aritmogenesi ed elettrofisiologia cardiaca. Trasferimento di energia di risonanza di Förster (FRET) imaging viene eseguito per il monitoraggio in tempo reale dei livelli di cAMP in diverse regioni cardiache. Neuromorphology è studiato per mezzo di anticorpo-basato colorazione dei cuori interi usando marcatori neuronali per guidare l'identificazione e la modulazione degli obiettivi specifici del sistema nervoso autonomo intracardiaco negli studi eseguiti. L'impostazione di Langendorff ex vivo permette per un elevato numero di esperimenti riproducibili in breve tempo. Tuttavia, la natura in parte aperta del setup (ad es., durante le misurazioni MEA) rende difficile il controllo costante della temperatura e deve essere mantenuto al minimo. Questo metodo descritto rende possibile analizzare e modulano il sistema nervoso autonomo intracardiaco nei cuori decentralizzati.
Introduzione
Il sistema di perfusione Langendorff ex vivo cuore continua ad essere uno strumento rilevante per l'esecuzione di un ampio spettro di fisiologici, biochimici, morfologici e studi farmacologici in centrale denervato cuori1,2 ,3,4,5 sin dalla sua invenzione nel tardo 19th secolo6. Ad oggi, questo sistema è ancora ampiamente usato per vari argomenti (ad es., ischemia riperfusione) o per lo studio cardiaco farmacologico effetti7,8ed è uno strumento fondamentale nella ricerca cardiovascolare. La longevità di questo metodo risultati da diversi vantaggi (ad es., le misure sono eseguite senza l'influenza del sistema nervoso centrale o altri organi, la circolazione sistemica o ormoni circolanti). Se necessario, prodotti farmaceutici possono essere aggiunto in modo controllato il buffer di aspersione o applicati direttamente alle strutture specifiche. Gli esperimenti sono riproducibili, e un numero relativamente elevato di esperimenti può essere eseguito in un breve periodo di tempo. La natura aperta (in parte) dell'installazione può rendere difficile la regolazione della temperatura e deve essere presa in considerazione. Anche se il sistema di Langendorff è utilizzato anche in più grandi specie9, animali più piccoli vengono utilizzati principalmente come la messa a punto sperimentale è meno complesso e una maggiore variabilità biologica (ad es., transgenici modelli murini) può essere utilizzato.
Nel setup sperimentale del presente protocollo, è l'influenza del sistema nervoso autonomo intracardiaco su parametri elettrofisiologici di base, aritmogenesi ventricolare, conduzione dell'epicardio e dinamiche dell'adenosina monofosfato ciclico (cAMP) valutati. Un gran numero di gangli intracardiaci, che sono situate principalmente nei cuscinetti adiposi atriali e si sono affermati per il controllo indipendente dal controllo neurale centrale di elettrofisiologia cardiaca, è che sia lasciato intatto o manualmente rimosso con attenzione meccanica dissezione. Una modulazione farmacologica del sistema nervoso autonomo viene eseguito a livello globale con l'aggiunta di prodotti farmaceutici nel buffer di aspersione o localmente da modulazione mirata dei gangli atriali. Dopo gli esperimenti, i cuori sono adatti per una valutazione immunohistological come tutte le cellule del sangue sono stati rimossi a causa di aspersione di continuo, che può aumentare la qualità della colorazione.
L'obiettivo generale delle tecniche descritte è di offrire nuove prospettive per gli studi dettagliati per quanto riguarda l'impatto del sistema nervoso autonomo sulla elettrofisiologia cardiaca e aritmogenesi nel cuore del mouse. Un motivo per utilizzare questa tecnica è che è possibile studiare e alterare il sistema nervoso autonomo senza l'impatto del sistema nervoso centrale. Uno dei principali vantaggi è l'occupazione facile degli esperimenti farmacologici, in quali potenziali proprietà pro - o antiaritmico di vecchi e nuovi agenti possono essere testati. Inoltre, modelli murini transgenici e knockout di varie malattie cardiache sono disponibili per studiare i meccanismi alla base di aritmie, infarto o malattie metaboliche. Questo approccio ha migliorato la nostra comprensione di come il sistema nervoso autonomo a livello atriale possono avere un impatto elettrofisiologia cardiaca ventricolare e l'induzione di aritmie.
Protocollo
Tutte le procedure che coinvolgono gli animali sono state approvate dalle autorità locali, di stato di Amburgo, la cura degli animali Università di Amburgo e comitati di uso.
1. preparazione dell'apparato di Langendorff
Nota: Viene utilizzato un sistema di perfusione di Langendorff commercialmente disponibile.
- Preparare una soluzione modificata di Krebs-Henseleit (119 mM di cloruro di sodio, 25mm di bicarbonato di sodio, 4,6 mM di cloruro di potassio, 1,2 millimetri di fosfato di potassio monobasico, 1,1 mM di solfato di magnesio, 2,5 mM di cloruro di calcio, 8,3 di glucosio e 2 mM di sodio piruvato). Aggiungere una miscela di anidride carbonica oxygen/5% 95% per la soluzione di perfusione per impedire la precipitazione del calcio. Filtrare il buffer con una dimensione dei pori di 0,22 µm.
- Aggiungere un agente farmacologico il buffer per studiare il suo effetto sulla elettrofisiologia cardiaca e aritmogenesi come necessario.
- Avviare la vasca di acqua e mettere la soluzione di perfusione tra cui una miscela di anidride carbonica 95% oxygen/5% in esso. Regolare la temperatura del bagno d'acqua, in modo che la temperatura della soluzione di perfusione direttamente prima la cannula è ~ 37 ˚ c.
- Avviare la pompa roller e riempire l'apparecchio con la soluzione di perfusione, non appena viene raggiunta la temperatura corretta.
- Regolare la portata pompa prima di fissare il cuore, in modo che bolle d'aria non vengono lasciati nella cannula montando all'apparato.
2. hard - e Software di preparazione
- Collegare un sistema di acquisizione dati digitali e il relativo software corrispondente all'apparato di Langendorff per una registrazione continua di aspersione pressione, portata e frequenza cardiaca.
- Impostare la pressione di perfusione mirati nelle impostazioni generali a 80 mmHg.
- Avviare la registrazione.
- Utilizzare un catetere di elettrofisiologia (Tabella materiali) con elettrodi di platino, una superficie dell'elettrodo di 0.5 x 0.5 mm e una spaziatura di elettrodo di 0,5 mm per la registrazione dei dati e la stimolazione con un generatore di stimolo digitale designato.
- Posizionare il catetere vicino alla zona dove il cuore verrà posizionato dopo l'allegato all'apparecchio.
- Preparare la stimolazione selezionando 2 elettrodi dal catetere e utilizzare una lunghezza di ciclo di 100 ms.
3. preparazione del cuore
- Aggiungere il freddo (~ 2-4 ˚ c) buffer di aspersione (10-20 mL e 40-50 mL, affinché l'intera pietanza è coperto) per i 2 piatti Petri (diametro di 6 cm e 10 cm) e il piatto con la cannula e posto loro il ghiaccio direttamente successiva e sotto il microscopio. Preparare un doppio nodo intorno la cannula.
- Accise rapidamente il cuore dopo dislocazione cervicale con l'apertura del torace utilizzando Mayo forbici e pinze modello stretto. Poi afferrare l'aorta e la vena cava sopra il diaframma usando il forcipe di Londra e asportare il blocco cuore-polmoni tagliando tutti i vasi sanguigni e del tessuto connettivo vicino alla colonna vertebrale con le forbici di strabismo.
- Trasferire il blocco cuore-polmoni nel primo piatto (6 cm di diametro) riempito con il buffer ghiacciato e con attenzione rimuovere i polmoni senza danneggiare il cuore utilizzando strabismo forbici e pinze di Londra. Poi mettete il cuore sotto il microscopio e rimuovere con cautela il timo, l'esofago e trachea utilizzando forbici di primavera e forcipe Dumont SS.
- Utilizzare le forbici di primavera per praticare un foro di 1,5-2 mm nella parte superiore dell'atrio destro per l'inserimento del catetere. Praticare un foro nell'arteria polmonare. Quindi tagliare l'aorta direttamente sotto i rami di supraaortic e rimuovere il tessuto dall'aorta, in modo che il nodo può essere collegato facilmente.
- Tenere i cuscinetti adiposi atriali, comprese le principali atrially trova ganglionated plexi, intorno all'atrio sinistro intatto o rimuoverli completamente da dissezione accurata.
- Trasferire il cuore al piatto con la cannula e posizionarlo sotto il microscopio. Accostare l'aorta la cannula con il forcipe Dumont SS e legare il nodo preparato strettamente intorno all'aorta. Assicurarsi che la cannula non è collocata troppo in profondità nell'aorta, in modo che la valvola aortica e le arterie coronariche sono lasciate liberi.
- Collegare la cannula rapidamente all'apparato di Langendorff. Assicurarsi che non vi siano nessun bolle lasciato nella cannula.
- Passare la pressione di perfusione a 80 mmHg, permettendo un'aspersione di pressione costante.
- Inserire con cautela il catetere in atrio destro e ventricolo destro senza toccare o danneggiare il cuore e fissare il catetere alla cannula con nastro adesivo.
- Iniziare la stimolazione con la lunghezza di ciclo di preparati di 100 ms per un periodo di equilibrazione iniziale 20 min.
- Chiudere la camera per consentire una temperatura stabile.
4. aritmogenesi e parametri elettrofisiologici
- Applicare una stimolazione programmate tramite gli elettrodi distale o prossimale del catetere a due volte l'atriale o ventricolare Soglia pacing per valutare i parametri elettrofisiologici come descritto nei passaggi seguenti.
- Determinare il tempo di recupero del nodo del seno come la lunghezza del ciclo di ritorno massimo dopo 10 s di ritmo a una lunghezza di ciclo S1S1 di 120 ms, 100 ms e 80 ms a tasso fisso.
- Determinare il punto del Wenckebach come la più lunga durata del ciclo S1S1 (8 stimoli; S1S1: 100 ms; riduzione graduale di 2 ms) con una perdita di conduzione nodale AV 11. Determinare i periodi refrattari nodali atrioventricolari come la più lunga S1S2 (12 stimoli; S1S1: 120 ms, 110 ms e 100ms; una corta accoppiato extrastimulus con una riduzione di S1S2 graduale di 2 ms) con una perdita di conduzione nodale di avoirdupois.
- Determinare i periodi refrattari atriali e ventricolari come la più lunga S1S2 (12 stimoli; S1S1: 120 ms, 110 ms e 100ms; una corta accoppiato extrastimulus con una riduzione di S1S2 graduale di 2 ms) con una risposta ventricolare o atriale assente10,11.
- Eseguire un extrastimulation programmata (S1S1: 120 ms, 100 ms e ms 80, seguita da fino a 3 battiti extra; 60-20 ms con una riduzione graduale di 2 ms) o scoppio protocolli di stimolazione (5 s a S1S1: 50-10 ms con una riduzione graduale di 10 ms) in linea con le convenzioni di Lambeth da eva preso le ventricolare aritmogenesi10,11,12.
5. dell'epicardio conduzione misure
Nota: Registrare unipolare dell'epicardio elettrogrammi utilizzando un sistema di registrazione 128 canali, computer-assistita con una frequenza di campionamento di 25 kHz per la mappatura ad alta risoluzione. Utilizzare una matrice multi-elettrodo 32 (MEA; Inter-elettrodo distanza: 300 µm; 1.8 x 1.8 mm). Nota che i dati sono stati filtrati passa banda (50 Hz) e digitalizzati con 12 bit e una gamma di segnale di 20 mV.
- Inserire il MEA nell'area designata del cuore e aggiungere la messa a terra per un'altra parte del cuore13,14,15.
- Posizionare un catetere di stimolazione dell'epicardio vicino la MEA e iniziare una stimolazione costante.
- Avviare la registrazione dopo la conferma del buon contatto degli elettrodi controllando la qualità del segnale e l'ampiezza.
- Utilizzare un'analisi non in linea per la determinazione della velocità di propagazione dell'onda e dispersione in direzione di conduzione.
6. Förster Resonance Energy Transfer FRET-base ciclica monofosfato di adenosina (accampamento) Imaging
Nota: Per le misure basate su FRET, raccogliere cuori dal CAG-Epac1-accampamenti topi transgenici16.
- Utilizzare un sistema di imaging auto-costruito intorno un stereomicroscopio15,17.
- Posizionare lo stereomicroscopio davanti al cuore e regolarlo per acutezza.
- Eccitare il sensore per l'AMPc con una fonte di luce [ad esempio, utilizzare una singola lunghezza d'onda diodo luminescente (440 nm)]. Dividere l'emissione di luce nel donatore e accettore canali utilizzando un divisore di fascio (per una coppia di proteina fluorescente ciano/giallo fluorescente proteine, uso un 565dcxr specchio dicroico e filtri di emissione D480/30 e D535/40).
- Garantire una temperatura stabile mettendo un involucro di plastica intorno alla camera.
- Prendere immagini utilizzando una fotocamera di complementary metal-oxide-semiconductor scientifica (sCMOS). Coordinare la sorgente luminosa e la telecamera cattura di immagine con un open source software come Micro-Manager di imaging.
- Per avviare l'acquisizione dell'immagine, spingere la Multi-D Acq. pulsante e impostare un time-lapse, che acquisisce un'immagine ogni 10 s, con il tempo di esposizione appropriato, che dipende dalla forza del segnale fluorescente (circa 100 ms).
- Uso il precedentemente descritto e disponibile FRET online e FRET online 2 plugin17 per dividere l'immagine in due canali, selezionare le regioni di interesse e monitorare l'analisi del rapporto.
- Durante l'acquisizione, irrorare il cuore con la soluzione modificata di Krebs-Henseleit che contiene diverse sostanze, a seconda della natura dell'esperimento.
- Alla fine dell'esperimento, spegnete l'acquisizione premendo il tasto Stop e salvare nello stack di immagini.
- Analizzare i dati FRET offline utilizzando un software di analisi dedicato che può dividere le immagini in due sezioni identiche per i canali di donatore e accettore ed esegue analisi FRET in più regioni di interesse.
Nota: Una dedicata plug-in (FRET non in linea) è necessaria, che viene fornito in Sprenger et al. 17.- Avviare il software. Apri l'analisi accedendo al menu plugin , quindi fare clic su MicroManagere poi su Apri File di Micro-Manager.
- Eseguire il plugin FRET non in linea al fine di dividere il time-lapse in due immagini identiche per i canali di PCP e YFP.
- Utilizzare lo strumento di Selezione a mano libera per contrassegnare la regione di interesse nell'immagine YFP. Premere il pulsante Aggiungi per aggiungere la selezione alla finestra Multi misura .
- Scegliete la regione di interesse nella finestra Multi misura e premere Multi per ottenere una tabella con i valori medi di grigio per ogni fotogramma e la regione. Copiare e incollare tutti i dati in un foglio di Excel.
- Fare clic sulla serie di immagini di PCP. Eseguire le stesse azioni come nel passaggio 6.10.4 per lo stack di PCP e incollare i valori medi di grigio lo stesso foglio di Excel.
- Correggere i dati non elaborati non in linea per il fattore di trapasso del donatore nell'accettore canale17.
- Utilizzare la seguente formula, dove B è il fattore di trapasso:
Rapporto = (YFP - B x CFP) / PCP - Determinare il fattore di trapasso B da imaging un cuore solo esprimendo la PCP e misurare la percentuale di fluorescenza donatore nel canale YFP (B = YFP / CFP).
- Utilizzare la seguente formula, dove B è il fattore di trapasso:
7. Neuromorphology
Nota: Analizzare il sistema nervoso autonomo intracardiaco utilizzando intero-monta immunostainings del cuore murino intatto. Si noti che la maggior parte dei gangli intracardiaci è localizzata nel tessuto adiposo epicardico vicino alle vene polmonari.
- Utilizzare diverse colorazioni per la raffigurazione di neurofilament (generale strutture neuronali; pollo anti-NF-H, 1:3, 000), tirosina idrossilasi (TH, strutture di un neurone simpatici; coniglio α TH, 1:1, 000) e la colina acetiltransferasi (ChAT, parasimpatico strutture di un neurone; capra α ChAT, 01:50).
- Dopo l'aspersione nell'apparato di Langendorff, difficoltà i cuori di topo in 10 mL di formalina per 24 h e memorizzarli in tampone fosfato salino (PBS) a 4 ˚ c.
- Candeggina i cuori in candeggina di Dent (4:1:1 metanolo: soluzione di perossido di idrogeno 30% (w/w) in H2o: il solfossido dimetilico (DMSO)) per 1 settimana a 4 ˚ c e reidratare successivamente a PBS in una serie di discendenti di metanolo in PBS (100%, 75%, 50%, 25%; 1h ciascuna) 18.
- Eseguire le seguenti incubazioni in un formato di piastra a 24 pozzetti con una movimentazione delicata a 4 ˚ c:
- Permeabilize i cuori nel 1% Triton X-100/PBS (PBS-T) per 3 x 1 h a temperatura ambiente prima di bloccare loro durante la notte in un tampone bloccante [5% albumina di siero bovino (BSA) / PBS-T + 0,2% sodio azide].
- Diluire gli anticorpi come segue: capra α ChAT (01:50), coniglio α TH (1:1, 000), neurofilament di pollo α (1:3, 000); anticorpi secondari per la etichettatura fluorescente (1: 500; o secondo le istruzioni del produttore); gli anticorpi secondari biotinilati per etichettatura cromogenico (1: 200; o secondo le istruzioni del produttore).
- Incubare i campioni in anticorpi primari diluiti in un tampone bloccante per 1 settimana a 4 ˚ c.
- Lavare i cuori per 3 x 15 min in PBS-T prima l'incubazione anticorpo secondario in un tampone bloccante per 4 giorni.
- Lavare i cuori per 3 x 15 min in PBS-T e memorizzarli in un mezzo di montaggio per la colorazione fluorescente per 3 h a temperatura ambiente o utilizzare un kit di rilevazione complesso avidina-biotina secondo le istruzioni del produttore.
- Pre-Incubare i cuori per 1h in un buffer commerciale per 3, 3'-diaminobenzidina (DAB), prima di sviluppare loro sotto un controllo visivo in un buffer contenente DAB secondo le istruzioni del produttore.
- Conservare i campioni in doppio acqua distillata.
- Per sezioni di paraffina, disidratare e incorporare i cuori in paraffina.
- Tagliare sezioni spesse 4-µm e deparaffinizzare li secondo le procedure di routine del laboratorio. Se e come ricupero dell'antigene deve essere eseguita deve essere stabilito per ogni singolo programma di installazione, poiché esso dipende dalla combinazione dell'anticorpo.
- Permeabilize le sezioni per 10 min a 0,2% Triton X-100/Tris-buffered saline (TBS), seguita da 3 x 5 min lavaggi in TBS.
- Bloccarli con 3% BSA/TBS per 1 h a temperatura ambiente.
- Incubare per una notte a 4 ˚ c [anticorpi primari: capra α ChAT (01:50), coniglio α TH (1: 500), pollo neurofilamento α (1:1, 000)] o a 2 h a temperatura ambiente (fluorescenza-etichettato anticorpi secondari, 1: 500) in 1% BSA/TBS con 3 x 5 min lava TBS in mezzo.
- Aggiungere 1 µ g/mL di bisbenzimide H33342 triidrocloruro per la soluzione di anticorpo secondario o utilizzare un diverso metodo di macchiatura nucleare.
- Montare i vetrini in un mezzo di montaggio per la colorazione fluorescente.
Risultati
La figura 1 Mostra un'immagine dell'installazione Langendorff comprese 2 matrici multi-elettrodo (MEA). Prima dell'esperimento, il catetere intracardiaco è posizionato vicino la cannula per facilitare una rapida e facile inserimento nel ventricolo di destra atrio/destra e garantire un breve periodo di tempo fino a quando l'equilibrazione può iniziare. La parte inferiore della camera può essere intensificata (vedere le frecce nella Figura 1) affinché la camera è completamente chiuso e garantisce una temperatura stabile.
Figura 2 descrive diverse rappresentative stainings cardiaco. In Figura 2A un ematossilina ed eosina (H & E) colorazione di una sezione di paraffina è presentato. Nell'esemplare allargamento (Figura 2B), una macchiatura di immunohistochemical di un ganglio atriale dimostra le cellule prevalentemente parasimpatiche (rosso, ChAT-positivo) rispetto al meno numerose cellule simpatici (verde, TH positivo). In Figura 2-E una macchiatura di immunohistochemical del neurale (Figura 2, verde, neurofilament) e fibre simpatiche (Figura 2D, rosso, TH) così come la sovrapposizione delle due immagini (Figura 2E) raffigura fibre neurali come attraversare dagli atri via il seno coronario verso i ventricoli posteriori.
La figura 3 Mostra la murino cuore collegato alla cannula dell'apparato di Langendorff con un catetere inserito octapolar nel atrio destro e ventricolo destro e matrice multi-elettrodo dell'epicardio (MEA) immessi sul ventricolo sinistro anteriore ( Figura 3A). Antibiogramma di aritmia ventricolare tramite gli elettrodi nel camper è presentato nella Figura 3B. L'induzione di una tachicardia ventricolare nei cuori si è verificato più frequentemente dopo la parziale denervazione atriale. Nel MEA allargato (Figura 3) è presentato il layout schematico degli elettrodi. È importante garantire un contatto stabile dell'epicardio di tutti gli elettrodi. In Figura 3D è raffigurata la conduzione dell'epicardio analizzati non in linea, registrata da un MEA.
La figura 4 Mostra FRET misure in tutto il suo cuore viene irrorato retrogradely nell'apparato di Langendorff. Diverse aree del cuore possono essere analizzate come necessari (Figura 4A). Una globale, nonché locale l'applicazione topica di prodotti farmaceutici è facilmente possibile in questa configurazione (Figura 4B).

Figura 1: installazione di Langendorff incluse le matrici multi-elettrodo (MEAs). Il catetere di stimolazione e registrazione di octapolar è posizionato vicino alla zona in cui verrà allegato il cuore. La parte inferiore della camera verrà spostata verso l'alto (bianco frecce) dopo il cuore è stato associato all'apparato in modo da garantire una temperatura stabile. Clicca qui per visualizzare una versione più grande di questa figura.
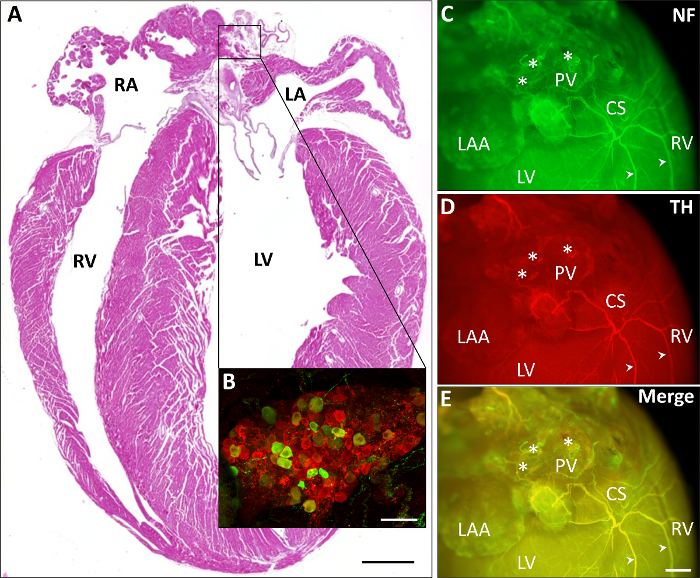
Figura 2: cardiaco intero Monte stainings raffiguranti parti del sistema nervoso autonomo. A) raffigurazione di un cardiaco H & colorati paraffina sezione (scala 1 mm). B) un esemplare ingrandimento di uno immunohistochemically macchiate del ganglio atriale dimostra le cellule prevalentemente parasimpatiche (rosso, ChAT-positivo) rispetto al meno numerose cellule simpatici (verde, TH-positivo; scala bar 75 µm). C-E) Gli stainings di immunohistochemical rappresentante di neurale (Figura 2, verde, neurofilament, n-f) e fibre simpatiche (Figura 2D, rosso, TH e la loro sovrapposizione in Figura 2E) attraversare dagli atri via il seno coronario (CS) verso il ventricoli posteriori. Fibre di esemplare sono contrassegnati da frecce. Asterischi denotano gangli atriali. Scala bar 1 mm. LA, atrio di sinistra; LV, ventricolo sinistro; NF, neurofilament; PV, vene polmonari; RA, atrio di destra; RAA, dell'auricola atriale di destra; RV, ventricolo destro. Clicca qui per visualizzare una versione più grande di questa figura.
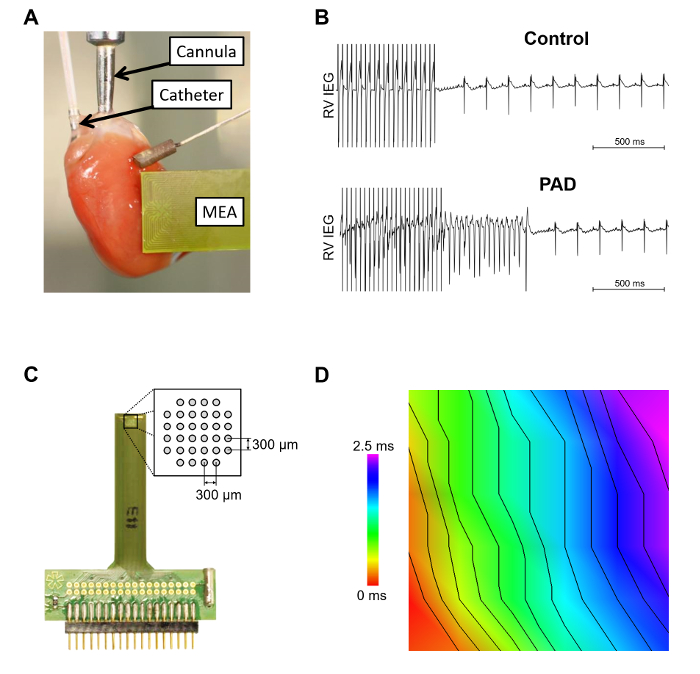
Figura 3: Intra - e dell'epicardio misurazioni utilizzando il programma di installazione di Langendorff. A. questo pannello mostra un esempio di un cuore murino all'interno del sistema di Langendorff. Sono raffigurati il catetere intracardiaco octapolar, che viene inserito nell'atrio destro e ventricolo e una matrice multi-elettrodo dell'epicardio (MEA). B. aritmia antibiogramma utilizzando burst stimolazione senza (controllo) o con l'induzione di un auto-terminazione tachicardia ventricolare [dopo denervazione atriale parziale (PAD)] sono raffigurati. C. il MEA dell'epicardio è raffigurato con un ingrandimento del layout schematico dell'elettrodo. D. velocità di propagazione dell'onda è stato analizzato utilizzando un software su misura. La distanza tra l'isocrone è 2 m/s. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: misure della FRET in un setup di Langendorff. A. sono raffigurati i due differentcAMP biosensore fluorescenza canali [proteina fluorescente gialla (YFP) e ciano proteina fluorescente (CFP)] durante le misurazioni di FRET in un cuore irrorato retrograda. Se necessario, possono essere analizzati diverse parti del cuore (ad es., atri e ventricolo) (barra della scala: 1 mm). B. questo pannello mostra un esperimento FRET rappresentativo, che misura i livelli del campo durante una stimolazione farmacologica nell'atrio e nel ventricolo sinistro. In primo luogo, il cuore è stato sistematicamente irrorato con l'attivatore di ciclasi di adenylyl NKH477, un analogo di forskolin, per aumentare i livelli del campo. Quindi nicotina era d'attualità applicata e mirata presso i gangli atriali, che acutamente ridotto i livelli del campo. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo manoscritto, sistema di perfusione la Langendorff ben noto ex vivo cuore è presentato come uno strumento per studiare l'impatto dei neuroni intracardiaci elettrofisiologia cardiaca e aritmogenesi utilizzando mapping diverso e tecniche di stimolazione inclusi gli approcci endocardial e dell'epicardio.
Parecchie parti del protocollo sono cruciali per l'installazione. In primo luogo, è importante utilizzare una tecnica di preparazione in cui i cuscinetti adiposi atriali rimangono inalterati, o vengono rimossi rapidamente senza danneggiare il miocardio. In secondo luogo, un'apertura correttamente dimensionata deve essere tagliato nell'atrio di destra per un facile inserimento del catetere octapolar nell'atrio destro e ventricolo destro. Il catetere dovrebbe scivolare facilmente nel ventricolo destro senza generare alcuna pressione. Durante il pignoramento del catetere alla cannula, il catetere dovrebbe non immergere più in profondità nel ventricolo, per evitare lesioni cardiache. In terzo luogo, il controllo della temperatura è una parte cruciale di tutti Langendorff configurazioni1,2,5. La camera termica è chiusa durante l'aritmia test, garantendo una temperatura stabile. Ma per registrazioni MEA o FRET, la camera deve essere almeno parzialmente aperto per consentire misurazioni. Tempo di registrazione dovrebbe essere ridotto al minimo, o altre tecniche per ridurre la perdita di temperatura, come mettere un involucro di plastica intorno alla camera durante le misurazioni più lungo, devono essere eseguite. In quarto luogo, MEAs devono trovarsi nelle stesse posizioni anatomiche in tutti gli esperimenti. Buona superficie di contatto, che è confermato dalle grandi ampiezze nell'analisi in tempo reale, può essere realizzato utilizzando due MEAs su siti opposti, in modo che un contrappeso è prodotto. In quinto luogo, FRET misure sono influenzate dal movimento. Per ridurre il movimento spontaneo, il cuore è stimolato ad una frequenza stabile dal catetere intracardiaco. Per ulteriore stabilizzazione, un tubo con un leggero vuoto può stabilizzare l'apice.
Uno dei vantaggi del sistema Langendorff è che il cuore può essere utilizzato successivamente per le valutazioni di immunohistological del sistema nervoso cardiaco. La perfusione continua rimuove la maggior parte dei globuli rossi che hanno un alto livello di autofluorescenza19, migliorare la qualità della colorazione. Dopo la fissazione in formalina, i cuori sono memorizzabili in un ambiente a temperatura controllata (4 ˚ c) in tampone fosfato salino per fino ad un anno senza cambiamenti notevoli nella qualità di colorazione.
La caratteristica più importante di questa configurazione è che tutte le misurazioni vengono eseguite in un cuore denervato centralmente. I gangli intracardiaci atriali prevalentemente parasimpatici sono l'ultima stazione di relè all'interno il cuore20 come il ganglio simpatico stellatus si trova intrathoracically ed è quindi rimosso durante la preparazione. Anche se i neuroni intracardiaci non ottenere nessun input centrale, esso ha dimostrato che esse sono ancora attive in modo fisiologico come la fotoattivazione dei nervi simpatici cardiaci aumenta la frequenza cardiaca e la forza contrattile cardiaca21. In linea con questi risultati supportano l'importanza funzionale dei neuroni intracardiaci nel cuore centrale denervato, recentemente abbiamo dimostrato il loro impatto sulla funzione ventricolare e aritmogenesi15.
Uno dei vantaggi di questa configurazione centrale denervato è che permette al ricercatore di studiare la comunicazione tra diverse reti neurali regionale intracardiaco (ad es., l'interazione tra atrio e ventricolo)15. Queste differenze potrebbero essere rilevanti per i pazienti dopo trapianto di cuore in quale il trattamento con l'ivabradina modulatore selettivo di nodo del seno migliora la sopravvivenza, rispetto al trattamento con il beta-bloccante metoprololo succinato22. In una fase futura, stimolazione elettrica diretta del parasimpatico (nervo vago) o strutture simpatici (Ggl. stellatus23) contribuirà a migliorare la nostra conoscenza dell'interazione tra supplementari ed intracardiaca del sistema nervoso autonomo.
È importante tenere a mente quello parasimpatico e fibre simpatiche sono per lo più co-localizzati in modo che le attuali terapie come l'ablazione del catetere di aritmie atriali o ventricolari modificherà inevitabilmente entrambe le strutture. Nella configurazione descritta qui, modifica locale farmaceutico delle strutture mirate (ad es., stimolazione specifica dei gangli parasimpatici) può essere studiato. Oltre a modifiche mirate, aspersione globale con diversi prodotti farmaceutici (ad es., beta-bloccanti) è facilmente possibile, in modo che potenziali proprietà proaritmici o antiaritmico di vari agenti possono essere studiate. Utilizzando questa configurazione, gli interventi e le diverse tecniche possono essere testati durante la stimolazione o l'inibizione delle diverse parti del sistema nervoso autonomo intracardiaco, rivelando informazioni dell'impatto di specifiche parti del sistema nervoso autonomo su funzione cardiaca e aritmogenesi. Ulteriormente, il programma di installazione di murino permette di studiare il sistema nervoso autonomo cardiaco negli Stati di malattia come infarto del miocardio, insufficienza cardiaca o il diabete.
In conclusione, il sistema semplice e ben noto Langendorff ex vivo cuore aspersione fornisce una base flessibile per modificare e studiare l'impatto dei neuroni intracardiaci elettrofisiologia cardiaca e aritmogenesi.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori vorrei ringraziare Hartwig Wieboldt per la sua ottima assistenza tecnica e l'UKE microscopia Imaging Facility (Umif) della University Medical Center Hamburg-Eppendorf per fornire supporto e microscopi. Questa ricerca è stata finanziata bythe Förderverein des Universitären Herzzentrums Hamburg e.V. e di DZHK (centro tedesco per la ricerca cardiovascolare) [FKZ 81Z4710141].
Materiali
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Sigma-Aldrich | S3014 | Modified Krebs-Henleit solution |
| Sodium hydrogencarbonate | Sigma-Aldrich | 401676 | Modified Krebs-Henleit solution |
| Potassium chloride | Sigma-Aldrich | P5405 | Modified Krebs-Henleit solution |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | Modified Krebs-Henleit solution |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | Modified Krebs-Henleit solution |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | Modified Krebs-Henleit solution |
| Glucose | Sigma-Aldrich | G5767 | Modified Krebs-Henleit solution |
| Sodium pyruvate bioXtra | Sigma-Aldrich | P8574 | Modified Krebs-Henleit solution |
| Carbogen (95% O2 / 5% CO2) | SOL-Group, TMG Technische und Medizinische Gas GmbH, Krefeld, Gersthofen, Germany | Modified Krebs-Henleit solution | |
| Sterile filter steritop-GP 0.22 | EMD Millipore | SCGPT05RE | Modified Krebs-Henleit solution |
| Atropine sulfate | Sigma-Aldrich | A0257 | Neuromodulation |
| Hexamethonium chloride | Sigma-Aldrich | H2138 | Neuromodulation |
| Nicotine free base 98-100% | Sigma-Aldrich | N3876 | Neuromodulation |
| Formalin solution neutral buffered 10% | Sigma-Aldrich | HT501128 | Whole mount staining |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | Whole mount staining |
| Methanol | Sigma-Aldrich | 34860 | Whole mount staining |
| Hydrogen peroxide solution 30% (w/w) in H2O | Merck, KGA, Darmstadt, Germany | H1009 | Whole mount staining |
| Dimethyl sulfoxide | Merck, KGA, Darmstadt, Germany | D8418 | Whole mount staining |
| Phosphate-buffered saline tablets | Gibco / Invitrogen | 18912-014 | Whole mount staining |
| Triton-x-100 | Sigma-Aldrich | T8787 | Whole mount staining |
| Albumin bovine fraction V | Biomol, Hamburg, Germany | 11924.03 | Whole mount staining |
| Chicken anti neurofilament | EMD Millipore | AB5539 | Whole mount staining |
| Rabbit anti tyrosine hydroxylase | EMD Millipore | AB152 | Whole mount staining |
| Goat anti choline acetyltransferase | EMD Millipore | AP144P | Whole mount staining |
| Donkey α rabbit IgG Alexa 488 | Thermo Fisher Scientific | A21206 | Whole mount staining |
| Donkey α goat IgG Alexa 568 | Thermo Fisher Scientific | A11057 | Whole mount staining |
| Donkey α chicken IgY Alexa 647 | Merck, KGA, Darmstadt, Germany | AP194SA6 | Whole mount staining |
| Biotin-conjugated donkey α rabbit igG | R&D Systems | AP182B | Whole mount staining |
| Biotin-conjugated donkey α goat igG | R&D Systems | AP192P | Whole mount staining |
| Biotin-conjugated goat α chicken igY | R&D Systems | BAD010 | Whole mount staining |
| Vectashield mounting medium | Vector laboratories, Burlingame, CA, USA | H-1000 | Immunohistochemistry |
| Vectastain ABC kit | Vector laboratories, Burlingame, CA, USA | PK-4000 | Immunohistochemistry |
| Steady DAB/Plus | Abcam plc, Cambridge, UK | ab103723 | Whole mount staining |
| HistoClear | DiaTec, Bamberg, Germany | HS2002 | Immunohistochemistry |
| BisBenzimide H33342 trihydrochloride (Hoechst) | Sigma-Aldrich, St. Louis, MO, USA | B2261 | Immunohistochemistry |
| Vectashield HardSet mounting medium | Vector laboratories, Burlingame, CA, USA | VEC-H-1400 | Immunohistochemistry |
| Perfusion system | HUGO SACHS ELEKTRONIK - HARVARD APPARATUS GmbH, March-Hugstetten, Germany | 73-4343 | Langendorff apparatus |
| Data acquisition system and corresponding software for catheter and physiological parameter | Powerlab 8/30 & Labchart, ADInstruments, Dunedin, New Zealand | PL3508 PowerLab 8/35 | Langendorff setup |
| Octapolar catheter | CIB’ER Mouse, NuMed Inc., Hopkinton, NY, USA | custom | Langendorff setup |
| Stimulus generator | STG4002, Multi Channel Systems, Reutlingen, Germany | STG4002-160µA | Stimulation setup |
| Stimulation software | Multi Channel Systems, Reutlingen, Germany | MC_Stimulus II | Stimulation setup |
| Data acquisition system and corresponding software for epicardial electrograms | ME128-FAI-MPA-System, Multi Channel Systems, Reutlingen, Germany | USB-ME128-System | MEA setup |
| Multi-electrode array | MEA, EcoFlexMEA36, Multi Channel Systems, Reutlingen, Germany | EcoFlexMEA36 | MEA setup |
| Multi-electrode array recording software | Multi Channel Systems, Reutlingen, Germany | MC_Rack | MEA setup |
| Spring scissors | Fine Science Tools GmbH, Heidelberg, Germany | 15003-08 | Heart Preparation |
| Strabismus Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14575-09 | Heart Preparation |
| Mayo Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14110-15 | Heart Preparation |
| Dumont SS Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11203-25 | Heart Preparation |
| London Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11080-02 | Heart Preparation |
| Narrow Pattern Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11003-13 | Heart Preparation |
| Plastic Wrap | Parafilm M, Bemis NA, based in Neenah, WI, United States | Consumable Materials | |
| Stereomicroscope | Leica M165FC; Leica Microsystems GmbH, Wetzlar, Germany | FRET | |
| LED | CoolLED, Andover, UK | pE-100 | FRET |
| DualView | Photometrics, Tucson, AZ, USA | DV2-SYS | FRET |
| DualView filter set | Photometrics, Tucson, AZ, USA | 05-EM | FRET |
| optiMOS scientific CMOS camera | Qimaging, Surrey, BC, Canada | 01-OPTIMOS-R-M-16-C | FRET |
| Imaging software | Micro-Manager; Vale Lab, University of California San Francisco, CA, USA | FRET | |
| Analysis Software | Image J software; Public Domain, NIH, USA | FRET | |
Riferimenti
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Hearse, D. J., Sutherland, F. J. Experimental models for the study of cardiovascular function and disease. Pharmacological Research. 41 (6), 597-603 (2000).
- Valentin, J. P., Hoffmann, P., De Clerck, F., Hammond, T. G., Hondeghem, L. Review of the predictive value of the Langendorff heart model (Screenit system) in assessing the proarrhythmic potential of drugs. Journal of Pharmacological and Toxicological Methods. 49 (3), 171-181 (2004).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff-still viable in the new millennium. Journal of Pharmacological and Toxicological Methods. 55 (2), 113-126 (2007).
- Langendorff, O. Investigation of the living mammalian heart. Pflügers Archiv. 61, 291-332 (1895).
- Matsumoto-Ida, M., Akao, M., Takeda, T., Kato, M., Kita, T. Real-time 2-photon imaging of mitochondrial function in perfused rat hearts subjected to ischemia/reperfusion. Circulation. 114 (14), 1497-1503 (2006).
- Rassaf, T., Totzeck, M., Hendgen-Cotta, U. B., Shiva, S., Heusch, G., Kelm, M. Circulating nitrite contributes to cardioprotection by remote ischemic preconditioning. Circulation Research. 114 (10), 1601-1610 (2014).
- Schechter, M. A., et al. An isolated working heart system for large animal models. Journal of Visualized Experiments. 88 (88), 51671 (2014).
- Stockigt, F., et al. Total beta-adrenoceptor knockout slows conduction and reduces inducible arrhythmias in the mouse heart. PLoS One. 7 (11), e49203 (2012).
- Berul, C. I. Electrophysiological phenotyping in genetically engineered mice. Physiological Genomics. 13 (3), 207-216 (2003).
- Curtis, M. J., et al. The Lambeth Conventions (II): guidelines for the study of animal and human ventricular and supraventricular arrhythmias. Pharmacology & Therapeutics. 139 (2), 213-248 (2013).
- Schrickel, J. W., et al. Enhanced heterogeneity of myocardial conduction and severe cardiac electrical instability in annexin A7-deficient mice. Cardiovascular Research. 76 (2), 257-268 (2007).
- Rudolph, V., et al. Myeloperoxidase acts as a profibrotic mediator of atrial fibrillation. Nature Medicine. 16 (4), 470-474 (2010).
- Jungen, C., et al. Disruption of cardiac cholinergic neurons enhances susceptibility to ventricular arrhythmias. Nature Communications. 8, 14155 (2017).
- Calebiro, D., et al. Persistent cAMP-signals triggered by internalized G-protein-coupled receptors. PLoS Biology. 7 (8), e1000172 (2009).
- Sprenger, J. U., Perera, R. K., Götz, K. R., Nikolaev, V. O. FRET microscopy for real-time monitoring of signaling events in live cells using unimolecular biosensors. Journal of Visualized Experiments. (66), e4081 (2012).
- Alanentalo, T., et al. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nature Methods. 4 (1), 31-33 (2007).
- Whittington, N. C., Wray, S. Suppression of red blood cell autofluorescence for immunocytochemistry on fixed embryonic mouse tissue. Current Protocols in Neuroscience. 81, 2.28.1-2.28.12 (2017).
- Fukuda, K., Kanazawa, H., Aizawa, Y., Ardell, J. L., Shivkumar, K. Cardiac innervation and sudden cardiac death. Circulation Research. 116 (12), 2005-2019 (2015).
- Wengrowski, A. M., Wang, X., Tapa, S., Posnack, N. G., Mendelowitz, D., Kay, M. W. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovascular Research. 105 (2), 143-150 (2015).
- Rivinius, R., et al. Control of cardiac chronotropic function in patients after heart transplantation: effects of ivabradine and metoprolol succinate on resting heart rate in the denervated heart. Clinical Research in Cardiology. , (2017).
- Ajijola, O. A., et al. Augmentation of cardiac sympathetic tone by percutaneous low-level stellate ganglion stimulation in humans: a feasibility study. Physiological Reports. 3 (3), e12328 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon