Method Article
Auswirkungen der intrakardialen Neuronen auf kardiale Elektrophysiologie und Arrhythmogenesis in einem Ex-Vivo -Langendorff-System
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll für die Modulation der intrakardialen vegetative Nervensystem und die Bewertung ihres Einflusses auf grundlegende Elektrophysiologie, Arrhythmogenesis und Lager Dynamik mit einem ex-Vivo Langendorff Setup.
Zusammenfassung
Seit seiner Erfindung imspäten 19 Jahrhundert weiter Langendorff ex Vivo Herz-Perfusions-System zu einem wichtigen Instrument für das Studium eines breiten Spektrums an physiologische, biochemische, morphologische und pharmakologischen Parameter in Zentral denervierten Herzen. Hier beschreiben wir eine Setup für die Modulation der intrakardialen vegetative Nervensystem und die Bewertung ihres Einflusses auf grundlegende Elektrophysiologie, Arrhythmogenesis und zyklische Adenosin Monophosphate (cAMP) Dynamik. Die intrakardiale vegetative Nervensystem moduliert durch die mechanische Zerlegung von Vorhofflimmern Fett Pads-in welche murinen Ganglien sich hauptsächlich befinden — oder durch die Nutzung des globalen sowie gezielte pharmakologische Interventionen. Ein Octapolar elektrophysiologische Katheter wird in den rechten Vorhof und der rechten Herzkammer eingeführt, und epicardial platziert Multi-Elektroden (MEA) für hochauflösende Abbildung dienen, kardiale Elektrophysiologie und Arrhythmogenesis zu bestimmen. Förster Resonanz Energietransfer (FRET) imaging wird für die Echtzeit-Überwachung von cAMP Ebenen in verschiedenen kardialen Regionen durchgeführt. Neuromorphology wird untersucht mittels Antikörper-basierten Färbung von ganzem Herzen mit neuronalen Marker, um die Identifikation und Modulation der spezifischen Ziele des intrakardialen Nervensystem in den durchgeführten Studien zu führen. Das ex-Vivo Langendorff Setup ermöglicht eine hohe Anzahl von reproduzierbare Experimente in kurzer Zeit. Dennoch, der teilweise offene Charakter des Setups (zB., während MEA Messungen) Konstante Temperaturregelung erschwert und sollte auf ein Minimum gehalten werden. Das beschriebene Verfahren ermöglicht es, zu analysieren und zu modulieren die intrakardiale vegetative Nervensystem in dezentralen Herzen.
Einleitung
Langendorff ex Vivo Herz Perfusion System weiter zu einem wichtigen Instrument für die Durchführung eines breiten Spektrums an morphologische, physiologische, Biochemische und pharmakologische Studien in Zentral denervierten Herzen1,2 ,3,4,5 seit ihrer Erfindung in den späten 19th Jahrhundert6. Bis heute ist dieses System noch weit verbreitet zu verschiedenen Themen (zB., Ischämie Reperfusion) oder zum Studium Herz-pharmakologische Effekte7,8, und ist ein grundlegendes Instrument in der Herz-Kreislauf-Forschung. Die Langlebigkeit dieser Methode ergibt sich aus mehrere Vorteile (zB., Messungen ohne den Einfluss des zentralen Nervensystems oder anderer Organe, systemischen Kreislauf oder zirkulierenden Hormone). Bei Bedarf können Arzneimittel kontrolliert Perfusion Puffer hinzugefügt oder direkt an bestimmte Strukturen angewendet werden. Experimente sind reproduzierbar und eine relativ hohe Anzahl von Experimenten kann in kurzer Zeit durchgeführt werden. Die (teilweise) offene Natur des Setups machen Temperaturregulierung schwierig und muss berücksichtigt werden. Obwohl das Langendorff-System auch in größeren Arten9verwendet wird, kleinere Tiere dienen in erster Linie als der experimentelle Aufbau weniger komplex und eine größere biologische Variabilität ist (zB., transgenen Maus Modelle) verwendet werden.
In der Versuchsanordnung dieses Protokolls ist der Einfluss des intrakardialen Nervensystem auf elektrophysiologische Grundparameter, ventrikuläre Arrhythmogenesis, epicardial Wärmeleitung und zyklische Adenosin Monophosphate (cAMP) Dynamik ausgewertet. Eine große Anzahl von intrakardialen Ganglien, die befinden sich hauptsächlich in der atrial Fettpolster und sind nun bekannt, kardiale Elektrophysiologie unabhängig von zentralen neuronalen Kontrolle zu kontrollieren, sind entweder intakt oder manuell entfernt mit sorgfältigen mechanischen Links Dissektion. Eine pharmakologische Modulation des autonomen Nervensystems wird weltweit durch Zugabe von Arzneimitteln auf den Puffer, Perfusion oder lokal durch gezielte Modulation von Vorhofflimmern Ganglien durchgeführt. Nach den Experimenten sind die Herzen gut geeignet für eine immunohistologische Bewertung, wie alle Blutzellen durch die kontinuierliche Perfusion entfernt worden sind, die wodurch die Qualität der Färbung erhöht werden kann.
Das übergeordnete Ziel der beschriebenen Techniken ist es, neuartige Perspektiven für detaillierte Studien über die Auswirkungen des autonomen Nervensystems auf kardiale Elektrophysiologie und Arrhythmogenesis im Herzen Maus bieten. Ein Grund für die Verwendung dieser Technik ist, dass es möglich ist, zu studieren und das vegetative Nervensystem ohne Auswirkungen auf das zentrale Nervensystem zu ändern. Ein großer Vorteil ist die einfache Beschäftigung pharmakologische Experimente, in welche möglichen pro- oder antiarrhythmische Eigenschaften des alten und neuen Agenten können getestet werden. Darüber hinaus stehen transgenen und Knockout Maus-Modellen der verschiedenen Herzerkrankungen untersuchen die Mechanismen, Herzrhythmusstörungen, Herzinsuffizienz oder Stoffwechselerkrankungen. Dieser Ansatz wurde erweitert unser Verständnis der Auswirkungen des autonomen Nervensystems auf das Vorhofflimmern Niveau auf ventrikulären kardialen Elektrophysiologie und die Induktion von Arrhythmien.
Protokoll
Alle Verfahren, die Tiere wurden von den lokalen Behörden das Hamburg, Universität Hamburg Tierbetreuung und Nutzung Ausschüsse genehmigt.
1. Vorbereitung des Apparates Langendorff
Hinweis: Ein handelsübliches Langendorff Perfusion System wird verwendet.
- Bereiten Sie eine modifizierte Krebs-Henseleit-Lösung (119 mM von Natrium-Chlorid, 25 mM von Natriumbicarbonat, 4,6 mM Kaliumchlorid, 1,2 mM von Kalium Phosphat monobasic, 1,1 mM von Magnesiumsulfat, 2,5 mM von Kalzium-Chlorid, 8,3 mM von Glukose und 2 mM von Natrium Pyruvat). Fügen Sie ein Gemisch aus 95 % oxygen/5% Kohlendioxid zur Perfusion Lösung zu verhindern, dass Kalzium Niederschlag. Filtern Sie den Puffer mit einer Porengröße von 0,22 µm.
- Fügen Sie einen pharmakologischen Agenten in den Puffer zu untersuchen, ihre Wirkung auf kardiale Elektrophysiologie und Arrhythmogenesis nach Bedarf hinzu.
- Starten Sie das Wasserbad und platzieren Sie die Perfusion-Lösung mit einer Mischung von 95 % oxygen/5% Kohlendioxid drin. Einstellen Sie die Temperatur des Wasserbades, so, dass die Temperatur der Perfusion Lösung direkt vor die Kanüle ~ 37 ° c ist.
- Starten Sie die Walze Pumpe und füllen Sie das Gerät mit der Perfusion Lösung, sobald die richtige Temperatur erreicht ist.
- Einstellen Sie die Pumprate vor dem Anbringen der Herzen so, dass keine Luftblasen in die Kanüle übrig sind, bei der Montage auf den Apparat.
2. hard - und Software-Erstellung
- Verbinden Sie ein digitales Datenerfassungssystem und die entsprechende Software mit Langendorff Vorrichtung für eine kontinuierliche Aufzeichnung der Perfusionsdruck, Durchfluss und Herzfrequenz.
- Legen Sie die gezielte Perfusionsdruck in den allgemeinen Einstellungen zu 80 MmHg.
- Die Aufnahme starten.
- Verwenden Sie einen Elektrophysiologie Katheter (Table of Materials) mit Platin-Elektroden, eine Elektrodenoberfläche von 0,5 x 0,5 mm und einer Elektrode Abstand von 0,5 mm für die Datenaufzeichnung und Anregung mit einem ausgewiesenen digitalen Impuls-Generator.
- Platzieren Sie den Katheter in der Nähe der Gegend, wo das Herz nach dem Anbau auf den Apparat positioniert wird.
- Bereiten Sie die Stimulation durch den Katheter 2 Elektroden auswählen und verwenden Sie eine Zykluslänge von 100 ms.
3. Vorbereitung des Herzens
- Fügen Sie die Kälte (~ 2 bis 4 ° c) Perfusion-Puffer (10-20 mL und 40-50 mL, so dass die ganze Schüssel abgedeckt ist) 2 Petrischalen (Durchmesser von 6 cm und 10 cm) und die Schale mit der Kanüle und Stelle sie auf Eis direkt neben und unter dem Mikroskop. Bereiten Sie ein doppelknoten um die Kanüle.
- Verbrauchsteuern Sie schnell das Herz nach zervikale Dislokation durch Öffnen den Thorax mit Mayo Schere und Zange schmal Muster. Dann greifen Sie die Aorta und Vena Cava oberhalb des Zwerchfells mit London-Pinzette und Verbrauchsteuern des Herz-Lungen-Blocks durch Schneiden alle Gefäße und Bindegewebe in der Nähe der Wirbelsäule mit der Schere Strabismus.
- Übertragen Sie die Herz-Lungen-Block in die erste Schüssel (6 cm Durchmesser) mit dem eiskalten Puffer gefüllt und entfernen Sie vorsichtig die Lunge ohne Beschädigung das Herz mithilfe von Strabismus Scheren und Pinzetten London. Dann legen Sie das Herz unter dem Mikroskop und entfernen Sie vorsichtig die Thymusdrüse, die Speiseröhre und Luftröhre mit Frühling Scheren und Pinzetten Dumont SS.
- Verwenden Sie die Feder-Schere, schneiden Sie ein Loch von 1,5-2 mm im oberen Teil der rechten Vorhof für das Einführen des Katheters. Schneiden Sie ein Loch in die Lungenarterie. Dann schneiden Sie die Aorta direkt unter den Supraaortic Ästen und entfernen Sie das Gewebe aus der Aorta, zu, so dass der Knoten leicht angebracht werden kann.
- Halten Sie das Vorhofflimmern Fettpolster, darunter die großen befindet sich atrially ganglionated Plexiglas, um den linken Vorhof intakt oder vollständig zu entfernen durch sorgfältige Präparation.
- Übertragen Sie das Herz in die Schale mit der Kanüle zu, und legen Sie sie unter die Lupe genommen. Ziehen Sie die Aorta über die Kanüle mit der Dumont SS-Zange und binden Sie den vorbereiteten Knoten eng um die Aorta. Stellen Sie sicher, dass die Kanüle nicht zu tief in die Aorta platziert wird, so dass die Aortenklappe und die Herzkranzgefäße frei gelassen werden.
- Befestigen Sie die Kanüle schnell Langendorff-Apparat. Stellen Sie sicher, dass gibt es keine Luftblasen in die Kanüle Links.
- Wechseln Sie den Perfusionsdruck zu 80 MmHg, so dass ein konstanter Druck Perfusion.
- Einführen Sie den Katheter vorsichtig in den rechten Vorhof und Rechte Herzkammer ohne zu berühren oder das Herz schädigen und befestigen Sie den Katheter an der Kanüle mit Klebeband.
- Starten Sie die Stimulation mit den vorbereiteten Zykluslänge von 100 ms für einen anfänglichen 20 min Gleichgewichtherstellung Zeitraum.
- Schließen Sie die Kammer um eine gleichbleibende Temperatur zu ermöglichen.
4. elektrophysiologische Parameter und Arrhythmogenesis
- Wenden Sie eine programmierte Stimulation über die distal oder proximalen Elektroden des Katheters an zweimal das Vorhofflimmern oder ventrikuläre Tempo Schwelle, die elektrophysiologische Parameter zu bewerten, wie in den folgenden Schritten beschrieben.
- Bestimmen der Sinusknoten Erholungszeit als die maximale Rückkehr Zykluslänge nach 10 s festverzinsliche Tempo auf eine S1S1 Zykluslänge von 120 ms, 100 ms und 80 ms.
- Bestimmen Sie den Wenckebach-Punkt als die längste S1S1 Zykluslänge (8 Stimuli; S1S1: 100 ms; 2 ms schrittweise Reduktion) mit einem Verlust von 11 AV-Knoten-Leitung. Bestimmen der ventrikulären Knoten feuerfesten Perioden als die längste S1S2 (12 Stimuli; S1S1: 120 ms, 110 ms und 100 MS; ein kurzer gekoppelt mit 2 ms schrittweise S1S2 Extrastimulus) mit einem Verlust der AV-Knoten-Leitung.
- Vorhofflimmern und ventrikuläre feuerfesten Zeiträume als die längste S1S2 zu bestimmen (12 Stimuli; S1S1: 120 ms, 110 ms und 100 MS; ein kurzer gekoppelt mit 2 ms schrittweise S1S2 Extrastimulus) mit einer abwesenden Vorhofflimmern oder ventrikuläre Antwort10,11.
- Führen Sie eine programmierte Extrastimulation (S1S1: 120 ms, 100 ms und 80 ms, gefolgt von bis zu 3 zusätzliche Schläge; 60-20 ms mit einer schrittweisen Reduzierung der 2 ms) oder Burst Stimulation Protokolle (5 s bei S1S1: 50 – 10 ms mit einer schrittweisen Reduzierung der 10 ms) im Einklang mit der Lambeth Konventionen Eva Zentrum der linksventrikulären Arrhythmogenesis10,11,12.
5. epicardial Wärmeleitung Messungen
Hinweis: Datensatz unipolaren epicardial elektrogrammen mit einem 128-Kanal, EDV-gestützte Erfassung-System mit einer Sampling-Rate von 25 kHz für hochauflösende Kartierung. Verwenden Sie ein 32 Multi-Elektroden-Array (MEA; Inter Elektrodenabstand: 300 µm; 1,8 x 1,8 mm). Beachten Sie, dass die Daten Bandpass gefiltert (50 Hz waren) und mit 12 Bit und einer Reichweite von 20 digitalisiert mV.
- Die MEA in dem dafür vorgesehenen Bereich des Herzens geben Sie und die Erdung zu einem anderen Teil der Herzen13,14,15.
- Legen Sie einen epicardial Stimulation Katheter in der Nähe der MEA und beginnen Sie eine ständige Stimulation.
- Aufnahme nach der Bestätigung der guten Kontakt der Elektroden durch Überprüfung der Signalqualität und Amplitude.
- Verwenden Sie eine offline-Analyse zur Bestimmung der Ausbreitungsgeschwindigkeit der Welle und Dispersion in Pfeilrichtung Wärmeleitung.
6. Förster Resonance Energy Transfer FRET-basierte zyklische Adenosin Monophosphate (cAMP) Bildgebung
Hinweis: Für Bund-basierten Messungen, Ernten Sie Herzen von CAG-Epac1-Lager Transgene Mäuse16.
- Verwenden Sie eine selbstgebaute imaging-System um ein Stereomikroskop15,17.
- Legen Sie das Stereomikroskop vor das Herz und für Schärfe anpassen.
- Die cAMP-Sensor mit einer Lichtquelle zu begeistern [z. B.mit einem Einzel-Wellenlänge Licht emittierende Diode (440 nm)]. Die helle Emission in Donor und Akzeptor-Kanäle mit einem Strahlteiler (für ein paar Cyan fluoreszierenden Proteinen/gelb fluoreszierenden Proteins, Gebrauch ein 565dcxr dichroitischen Spiegel und D480/30 und D535/40 Emission Filter) aufgeteilt.
- Eine stabile Temperatur zu gewährleisten, indem man eine Plastikfolie um die Kammer.
- Nehmen Sie Bilder mithilfe einer wissenschaftlichen ergänzende Metall-Oxid-Halbleiter (sCMOS) Kamera. Koordinieren Sie die Lichtquelle und Kamera Bildaufnahme mit einer open-Source imaging-Software wie Micro-Manager.
- Um die Bildaufnahme zu starten, drücken Sie die Multi Acq. Taste und richten Sie ein Zeitraffer, die erwirbt ein Bild alle 10 s, mit den entsprechenden Belichtungszeit, die Stärke das Fluoreszenzsignal (ca. 100 ms) abhängt.
- Verwenden Sie die zuvor beschriebenen und verfügbar online Bund und Bund Online-2 Plugins17 teilen das Bild in zwei Kanäle, wählen die Regionen von Interesse, und überwachen die Verhältnis-Ablaufverfolgung.
- Perfundieren Sie bei der Übernahme Herzen mit der modifizierten Krebs-Henseleit-Lösung, die verschiedene Stoffe enthalten, abhängig von der Art des Experiments.
- Am Ende des Experiments die Übernahme durch Drücken der Stop -Taste schalten Sie aus und sparen Sie den Stapel von Bildern.
- Analysieren Sie die Bund-Daten offline auf eine dedizierte Analysesoftware, die kann Bilder in zwei identische Abschnitte für die Spender und Akzeptor-Kanäle aufgeteilt und kann in mehreren Regionen von Interesse Bund-Analyse durchführen.
Hinweis: Eine spezielle Plug-in (ÄRGERN Sie sich offline) wird benötigt, hat Sprenger Et Al. , 17.- Starten Sie die Software. Die Analyse zu öffnen, indem Sie auf das Menü Plugins , dann klicke auf Mittelmanagement, und dann auf Datei öffnen Micro-Manager.
- Führen Sie das ÄRGERN Sie sich offline Plugin um den Zeitraffer in zwei identische Bilder für die CFP und YFP Kanäle aufgeteilt.
- Verwenden Sie das Freihand-Auswahl -Werkzeug des Interessenbereichs im YFP Bild markieren. Drücken Sie die Schaltfläche " Hinzufügen ", um die Auswahl der Fenster " Multi " hinzuzufügen.
- Wählen Sie die Region von Interesse in das Fenster " Multi " und drücken Sie Multi , eine Tabelle mit grauen Mittelwerte für jeden Frame und Region zu erhalten. Kopieren Sie und fügen Sie die Daten in einer Excel-Tabelle.
- Klicken Sie auf den GFP-Bildstapel. Führen Sie die gleichen Aktionen wie in Schritt 6.10.4 für den GFP-Stack und fügen Sie die mittleren Grauwerte in der gleichen Excel-Tabelle ein.
- Korrigieren Sie die raw-Daten offline für den Faktor durchscheinen des Spenders in den Akzeptor Kanal17.
- Verwenden Sie die folgende Formel, wo B ist der durchscheinen-Faktor:
Ratio = (YFP - B-X CFP) / GFP - Durchbluten Faktor B von imaging ein Herz mit dem Ausdruck nur GFP bestimmen und messen den Prozentsatz der Spender Fluoreszenz im YFP Kanal (B = YFP / GFP).
- Verwenden Sie die folgende Formel, wo B ist der durchscheinen-Faktor:
(7) Neuromorphology
Hinweis: Analysieren Sie die intrakardiale vegetative Nervensystem mithilfe vollständig-hängen Immunostainings intakt murinen Herzen. Beachten Sie, dass die Mehrheit der intrakardialen Ganglien im epicardial Fettgewebe in der Nähe der Lungenvenen lokalisiert sind.
- Verwenden Sie unterschiedliche Färbungen für die Darstellung der Neurofilamente (allgemeine neuronalen Strukturen, Huhn Anti-NF-H, 1:3 000), Tyrosin-Hydroxylase (TH, sympathischen neuronalen Strukturen, Kaninchen α TH, 1:1 000) und Cholin-Acetyltransferase (ChAT, parasympathischen neuronalen Strukturen; Ziege α ChAT, 01:50).
- Beheben Sie nach der Durchblutung in den Apparat Langendorff die Mäuseherzen in 10 mL Formalin für 24 h und an Phosphat gepufferte Kochsalzlösung (PBS) bei 4 ° c aufbewahren.
- Die Herzen in Dent Bleichmittel Bleichen (4:1:1 Methanol: Wasserstoffperoxid-Lösung 30 % (w/w) in H2o: Dimethyl Sulfoxid (DMSO)) für 1 Woche bei 4 ° c und rehydrieren sie anschließend auf PBS in einer Reihe von Methanol in PBS absteigend (100 %, 75 %, 50 %, 25 %; 1 h) 18.
- Führen Sie die folgenden Inkubationen in einer 24-Well-Platte-Format mit einer sanften Agitation bei 4 ° c:
- Permeabilize die Herzen in 1 % Triton-X-100/PBS (PBS-T) für 3 x 1 h bei Raumtemperatur vor dem Blockieren sie über Nacht in einem blockierenden Puffer [5 % Rinderserumalbumin (BSA) / PBS-T + 0,2 % Natriumazid].
- Verdünnen Sie die Antikörper wie folgt: Ziege α ChAT (01:50), Kaninchen α TH (1:1 000), Huhn α Neurofilamente (1:3 000); sekundäre Antikörper zur Kennzeichnung von Leuchtstofflampen (1: 500; oder nach den Anweisungen des Herstellers); biotinylierte Sekundärantikörper chromogenen Kennzeichnung (1: 200; oder nach den Anweisungen des Herstellers).
- Inkubieren Sie die Exemplare in Primärantikörper verdünnt in einem blockierenden Puffer für 1 Woche bei 4 ° c.
- Waschen Sie die Herzen für 3 x 15 min in PBS-T vor der Sekundärantikörper Inkubation in einem blockierenden Puffer für 4 Tage.
- Waschen Sie die Herzen für 3 x 15 min in PBS-T und an einem Eindeckmittel für fluoreszierende Färbung für 3 h bei Raumtemperatur bewahren Sie auf oder verwenden Sie eine Avidin-Biotin-Komplex Erkennung-Kit gemäß den Anweisungen des Herstellers.
- Pre-inkubieren Sie die Herzen für 1 Stunde in einem kommerziellen Puffer für 3, 3'-Diaminobenzidine (DAB), bevor sie unter Sichtkontrolle in einem DAB-haltigen Puffer entsprechend den Anweisungen des Herstellers zu entwickeln.
- Speichern Sie die Exemplare in doppelt destilliertem Wasser.
- Für Paraffin Abschnitte entwässern und die Herzen in Paraffin einbetten.
- 4 µm Dicke Abschnitte schneiden und deparaffinize sie nach Routine Laborverfahren. Ob und wie Antigen-Retrieval durchgeführt werden muss, muss für jedes einzelnen Setup festgelegt werden, da es die Antikörper-Kombination abhängig.
- Die Abschnitte für 10 min in 0,2 % Triton-X-100/Tris-gepufferte Kochsalzlösung (TBS), gefolgt von 3 x 5 min Wäschen in El permeabilize
- Blockieren sie mit 3 % BSA/TBS für 1 h bei Raumtemperatur.
- Brüten sie über Nacht bei 4 ° c [Primärantikörper: Ziege α ChAT (01:50), Kaninchen α TH (1: 500), Huhn α Neurofilamente (1:1 000)] oder 2 h bei Raumtemperatur (Fluoreszenz-markierten Sekundärantikörper, 1: 500) in 1 % BSA/TBS mit 3 x 5 min TBS dazwischen wäscht.
- 1 µg/mL Bisbenzimide H33342 Trihydrochloride der Sekundärantikörper Projektmappe hinzufügen oder eine andere nukleare Färbung Methode verwenden.
- Montieren Sie die Folien in einem Eindeckmittel für fluoreszierende Färbung.
Ergebnisse
Abbildung 1 zeigt ein Bild von Langendorff Setup inklusive 2 Multi-Elektroden (MEAs). Vor dem Experiment ist der intrakardiale Katheter positioniert, in der Nähe der Kanüle, eine schnelle und einfache Einfügung in den rechten Atrium/rechten Ventrikel zu erleichtern und eine kurze Zeit bis die Gleichgewichtherstellung anfangen kann zu gewährleisten. Der untere Teil der Kammer kann (siehe die Pfeile in Abbildung 1) erhöht werden damit die Kammer vollständig geschlossen ist und eine stabile Temperatur garantiert.
Abbildung 2 zeigt verschiedene repräsentative kardiale Färbungen. In Abbildung 2A eine Hämatoxylin und Eosin (H & E) Färbung eines Paraffin-Abschnitts präsentiert. Eine immunhistochemische Färbung von einem Vorhofflimmern Ganglion zeigt in die vorbildliche Erweiterung (Abb. 2 b) die überwiegend parasympathischen Zellen (rot, ChAT-positiv) im Vergleich zu weniger zahlreichen sympathischen Zellen (grün, TH positiv). In Abbildung 2-E zeigt eine immunhistochemische Färbung des neuronalen (Abbildung 2, grün, Neurofilament) und sympathischen Fasern (Abb. 2D, rot, TH) sowie die Überlagerung der beiden Bilder (Abb. 2E) wie neuronale Fasern von den Vorhöfen über den Koronarsinus in Richtung der hinteren Ventrikel zu durchqueren.
Abbildung 3 zeigt das Murine Herz an der Kanüle von Langendorff Apparat mit einem eingefügten Octapolar Katheter in den rechten Vorhof und Rechte Herzkammer angeschlossen und ein epicardial Multi-Elektroden-Array (MEA) auf dem vorderen linken Ventrikel ( gelegt Abbildung 3A). Ventrikuläre Arrhythmie Anfälligkeit Tests über die Elektroden in der RV ist in Abbildung 3 bdargestellt. Die Induktion einer Kammertachykardie im Herzen traten immer häufiger nach teilweise Vorhofflimmern Denervierung. In der erweiterten MEA (Abbildung 3) präsentiert die schematische Anordnung der Elektroden. Es ist wichtig, einen stabilen epicardial Kontakt alle Elektroden zu gewährleisten. In Abbildung 3D ist der offline analysiert epicardial Wärmeleitung durch eine MEA aufgezeichnet dargestellt.
Abbildung 4 zeigt FRET Messungen in ganzem Herzen doppelthebel im Apparat Langendorff durchblutet wird. Verschiedene Bereiche des Herzens können als benötigt (Abbildung 4A) analysiert werden. Eine globale als auch lokale topische Anwendung von Arzneimitteln ist in diesem Setup (Abbildung 4 b) problemlos möglich.

Abbildung 1: Langendorff Einrichtung einschließlich Multi-Elektroden (MEAs). Der Octapolar Stimulation und Aufnahme Katheter befindet sich in der Nähe der in dem Herzen befestigt werden. Der untere Teil der Kammer nach oben bewegt werden (weiße Pfeile) nach Herzen auf das Gerät gelegt wird, so dass eine stabile Temperatur gewährleistet ist. Bitte klicken Sie hier für eine größere Version dieser Figur.
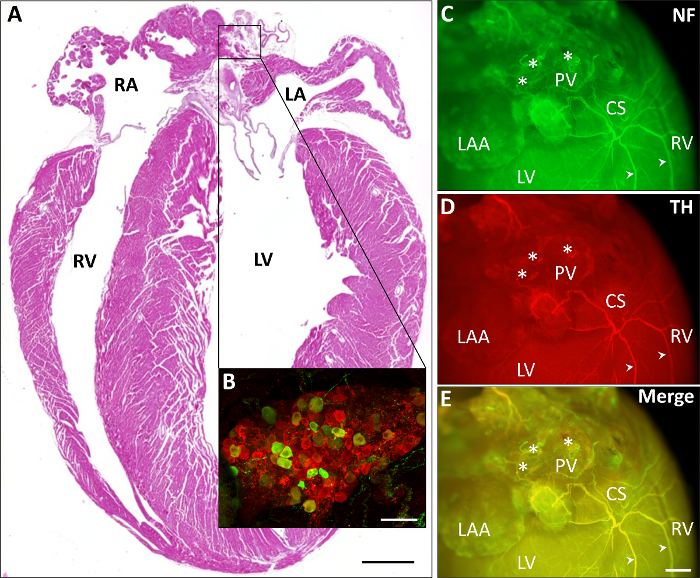
Abbildung 2: Cardiac ganze Berg Keramikschalen, Teile des autonomen Nervensystems darstellen. A) Darstellung eines kardialen H & E-gefärbten Paraffin Abschnitt (Skala 1 mm). B) eine beispielhafte Erweiterung der ein-Proteins gebeizt Vorhofflimmern Ganglion zeigt die überwiegend parasympathischen Zellen (rot, ChAT-positiv) im Vergleich zu weniger zahlreichen sympathischen Zellen (grün, TH-positives; Waage bar 75 µm). C-E) Vertreter immunhistochemische Färbungen der neuronalen (Abbildung 2, grün, Neurofilament, NF) und sympathischen Fasern (Abbildung 2D, rot, TH und deren Überlagerung in Abbildung 2E) durchqueren von den Vorhöfen über den Koronarsinus (CS) in Richtung der Posterior Ventrikel. Beispielhafte Fasern zeichnen sich durch Pfeilspitzen. Sternchen bezeichnen Vorhofflimmern Ganglien. Skala bar 1 mm. LA, linken Vorhof; LV, linken Ventrikel; NF, Neurofilament; PV, Lungenvenen; RA, rechten Vorhof; RAA, rechts atrial Appendage; RV, rechten Ventrikel. Bitte klicken Sie hier für eine größere Version dieser Figur.
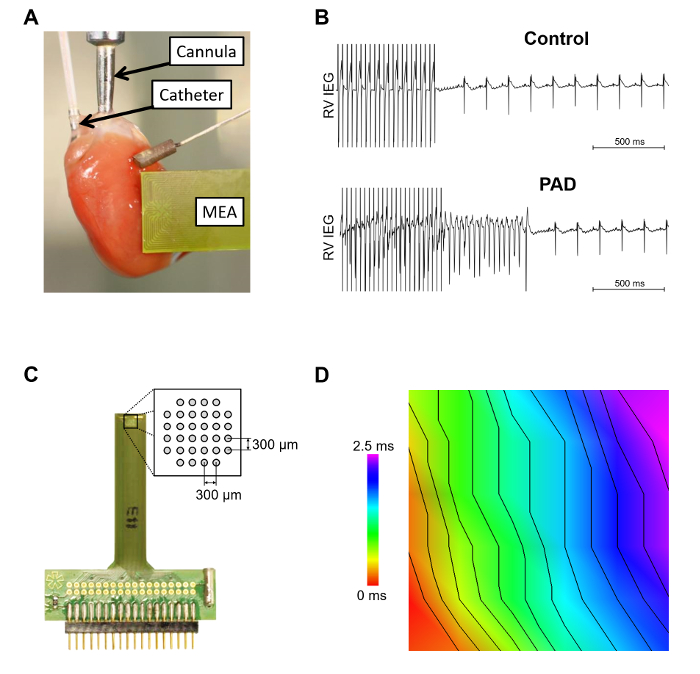
Abbildung 3: Intra- und epicardial Messungen mit dem Setup Langendorff. A. dieses Panel zeigt ein Beispiel eines murinen Herzens innerhalb des Systems der Langendorff. Der intrakardialen Octapolar Katheter, der in den rechten Vorhof und Ventrikel und eine epicardial Multi-Elektroden-Array (MEA) eingefügt werden dargestellt. B. Arrhythmie empfindlichkeitsprüfungen mit burst Stimulation ohne (Steuerung) oder mit der Induktion einer selbst zu beenden, ventrikuläre Tachykardie [nach teilweiser Vorhofflimmern Denervierung (PAD)] dargestellt. C. epicardial MEA ist mit einer Erweiterung des schematischen Elektrode Layouts dargestellt. D. Ausbreitungsgeschwindigkeit der Welle war mit einer maßgeschneiderten Software analysiert. Der Abstand zwischen den isochronen beträgt 2 m/s. Klicken Sie bitte hier, um eine größere Version dieser Figur.

Abbildung 4: FRET Messungen in einem Setup Langendorff. A. die beiden DifferentcAMP Biosensor Fluoreszenz Kanäle [gelb fluoreszierenden Proteins (YFP) und Cyan fluoreszierenden Proteins (GFP)] während FRET Messungen in einem retrograden PERFUNDIERTEN Herzen dargestellt. Bei Bedarf können unterschiedliche Teile des Herzens (z.B., Vorhöfe und Ventrikel) analysiert werden (Maßstab: 1 mm). B. dieses Panel zeigt eine repräsentative FRET-Experiment, das cAMP Ebenen während einer pharmakologischen Stimulation in den Vorhof und die linke Herzkammer misst. Erstens war das Herz systemisch mit dem Adenylyl Cyclase Aktivator NKH477, ein Forskolin Analoga, cAMP erhöhen durchblutet. Dann war Nikotin topisch angewendet und richtet sich an Vorhofflimmern Ganglien, die akut cAMP Ebenen reduziert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
In diesem Manuskript ist das bekannte Langendorff ex Vivo Herz Perfusion System als Instrument zur Untersuchung der Auswirkungen von intrakardialen Neuronen auf kardiale Elektrophysiologie und Arrhythmogenesis mit unterschiedlichen Mapping und stimulationstechniken vorgestellt. einschließlich endokardialen und epicardial Ansätze.
Mehrere Teile des Protokolls sind entscheidend für das Setup. Erstens ist es wichtig, eine Vorbereitung Technik zu verwenden, in der das Vorhofflimmern Fettpolster bleiben erhalten oder werden schnell entfernt, ohne zu verletzen das Myokard. Zweitens muss eine korrekt dimensionierte Öffnung in den rechten Vorhof für ein leichtes Einführen des Katheters Octapolar in den rechten Vorhof und Rechte Herzkammer geschnitten werden. Der Katheter sollte leicht in den rechten Ventrikel Rutschen, ohne jeglichen Druck zu generieren. Während der Anlage des Katheters an der Kanüle sollte der Katheter in die Herzkammer, kardiale Schädigung zu vermeiden nicht tiefer eintauchen. Drittens ist die Temperaturregelung ein wesentlicher Bestandteil aller Langendorff Setups1,2,5. Während die Arrhythmie testen, die Gewährleistung einer stabilen Temperatur ist die Wärmekammer geschlossen. Aber für MEA oder Bund Aufnahmen muss die Kammer für Messungen erlauben zumindest teilweise offen. Aufnahmezeit sollte auf ein Minimum gehalten werden oder andere Techniken, um Temperatur, wie wenn man eine Plastikfolie um die Kammer bei längeren Messungen zu reduzieren sollte durchgeführt werden. Viertens sollte MEAs an den gleichen anatomischen Standorten in allen Experimenten platziert werden. Gute Kontaktfläche, die durch große Amplituden in die Echtzeit-Analyse bestätigt ist, lässt sich mit zwei MEAs auf gegenüberliegenden Seiten, so dass ein Gegengewicht erzeugt wird. Fünftens sind FRET Messungen durch Bewegung beeinflusst. Um spontane Bewegung zu reduzieren, wird das Herz mit einer stabilen Frequenz durch den intrakardialen Katheter geschritten. Zur zusätzlichen Stabilisierung kann ein Rohr mit einem leichten Vakuum Apex stabilisieren.
Ein Vorteil von Langendorff-System ist, dass das Herz anschließend für die immunohistologische Beurteilung des kardialen Nervensystems verwendet werden kann. Die kontinuierliche Perfusion entfernt die meisten roten Blutkörperchen, die ein hohes Maß an Autofluoreszenz19, Verbesserung der Qualität der Färbung haben. Nach Formalin Fixierung können die Herzen einer Temperatur kontrollierten (4 ° c) in Phosphat-gepufferte Kochsalzlösung für bis zu einem Jahr ohne spürbare Veränderungen in der Färbung Qualität gelagert werden.
Das wichtigste Merkmal dieses Aufbaus ist, dass alle Messungen in einem zentral denervierten Herzen durchgeführt werden. Die überwiegend parasympathischen Vorhofflimmern intrakardialen Ganglien sind die letzten Relais-Station innerhalb der Herzen20 der sympathischen Ganglion Stellatum befindet sich intrathoracically und wird daher während der Zubereitung entfernt. Obwohl die intrakardialen Neuronen keine zentrale Eingabe bekommen, hat sich gezeigt, dass sie noch aktiv in physiologischer Weise sind, wie die photoaktivierungen der kardialen sympathischen Nerven die Herzfrequenz und kardialen Kontraktionskraft21 erhöht. Auf der Grundlage dieser Ergebnisse unterstützen die funktionelle Bedeutung der intrakardialen Neuronen im zentral denervierten Herzen haben wir vor kurzem ihre Auswirkungen auf die Linksventrikuläre Funktion und Arrhythmogenesis15gezeigt.
Ein Vorteil von diesem zentral denervierten Setup ist, dass es die Forscher, die Kommunikation zwischen verschiedenen intrakardialen regionale neuronale Netze (z.B. die Interaktion zwischen Atrium und Ventrikel)15zu studieren. Diese Unterschiede für Patienten nach Herztransplantation möglicherweise relevant in die Behandlung mit selektiven Sinusknoten Modulator Ivabradin überleben, im Vergleich zu einer Behandlung mit dem Beta-Blocker Metoprolol Succinat22verbessert. In einem späteren Schritt wird direkte elektrische Stimulation des Parasympathikus (Nervus Vagus) oder sympathischen Strukturen (Ggl. Stellatum23) helfen, um unser Wissen über das Zusammenspiel zwischen extra- und intrakardialen vegetative Nervensystem zu verbessern.
Es ist wichtig zu beachten, dass parasympathischen und sympathische Fasern sind meist Co lokalisierte, so dass die aktuellen Therapien wie Katheterablation von Vorhofflimmern oder ventrikuläre Rhythmusstörungen zwangsläufig beide Strukturen ändern werden. In den hier beschriebenen Einstellungen kann lokale pharmazeutische Modifikation der gezielte Strukturen (z.B. spezifische Stimulierung des parasympathischen Ganglien) studiert werden. Neben gezielte Modifikationen ist global Perfusion mit verschiedene Arzneimittel (z. B. Betablocker) ohne weiteres möglich, so dass potenzielle Proarrhythmic oder antiarrhythmische Eigenschaften der verschiedenen Akteure untersucht werden können. Mit diesem Setup, können Interventionen und verschiedene Techniken während der Stimulation oder Hemmung der verschiedenen Teile der intrakardialen vegetative Nervensystem, Offenlegung von Informationen über die Auswirkungen von bestimmten Teilen des autonomen Nervensystems auf getestet werden Herzfunktion und Arrhythmogenesis. Darüber hinaus ermöglicht das murine Setup des kardialen autonomen Nervensystems in Staaten der Krankheit wie Herzinfarkt, Herzinsuffizienz oder Diabetes zu studieren.
Abschließend bietet die einfache und bekannte Langendorff ex Vivo Herz Perfusion System flexibel zu ändern und die Auswirkungen der intrakardialen Neuronen auf kardiale Elektrophysiologie und Arrhythmogenesis zu untersuchen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchten Hartwig Wieboldt für seine hervorragenden technischen Betreuung und dem UKE Microscopy Imaging Facility (Umif) der des Universitätsklinikums Hamburg-Eppendorf für die Mikroskope und Unterstützung zu danken. Diese Forschung wurde finanzierte Bythe Förderverein des Universitären Herzzentrums Hamburg e.V. und durch das DZHK (Deutsches Zentrum für Herz-Kreislauf-Forschung) [FKZ 81Z4710141].
Materialien
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Sigma-Aldrich | S3014 | Modified Krebs-Henleit solution |
| Sodium hydrogencarbonate | Sigma-Aldrich | 401676 | Modified Krebs-Henleit solution |
| Potassium chloride | Sigma-Aldrich | P5405 | Modified Krebs-Henleit solution |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | Modified Krebs-Henleit solution |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | Modified Krebs-Henleit solution |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | Modified Krebs-Henleit solution |
| Glucose | Sigma-Aldrich | G5767 | Modified Krebs-Henleit solution |
| Sodium pyruvate bioXtra | Sigma-Aldrich | P8574 | Modified Krebs-Henleit solution |
| Carbogen (95% O2 / 5% CO2) | SOL-Group, TMG Technische und Medizinische Gas GmbH, Krefeld, Gersthofen, Germany | Modified Krebs-Henleit solution | |
| Sterile filter steritop-GP 0.22 | EMD Millipore | SCGPT05RE | Modified Krebs-Henleit solution |
| Atropine sulfate | Sigma-Aldrich | A0257 | Neuromodulation |
| Hexamethonium chloride | Sigma-Aldrich | H2138 | Neuromodulation |
| Nicotine free base 98-100% | Sigma-Aldrich | N3876 | Neuromodulation |
| Formalin solution neutral buffered 10% | Sigma-Aldrich | HT501128 | Whole mount staining |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | Whole mount staining |
| Methanol | Sigma-Aldrich | 34860 | Whole mount staining |
| Hydrogen peroxide solution 30% (w/w) in H2O | Merck, KGA, Darmstadt, Germany | H1009 | Whole mount staining |
| Dimethyl sulfoxide | Merck, KGA, Darmstadt, Germany | D8418 | Whole mount staining |
| Phosphate-buffered saline tablets | Gibco / Invitrogen | 18912-014 | Whole mount staining |
| Triton-x-100 | Sigma-Aldrich | T8787 | Whole mount staining |
| Albumin bovine fraction V | Biomol, Hamburg, Germany | 11924.03 | Whole mount staining |
| Chicken anti neurofilament | EMD Millipore | AB5539 | Whole mount staining |
| Rabbit anti tyrosine hydroxylase | EMD Millipore | AB152 | Whole mount staining |
| Goat anti choline acetyltransferase | EMD Millipore | AP144P | Whole mount staining |
| Donkey α rabbit IgG Alexa 488 | Thermo Fisher Scientific | A21206 | Whole mount staining |
| Donkey α goat IgG Alexa 568 | Thermo Fisher Scientific | A11057 | Whole mount staining |
| Donkey α chicken IgY Alexa 647 | Merck, KGA, Darmstadt, Germany | AP194SA6 | Whole mount staining |
| Biotin-conjugated donkey α rabbit igG | R&D Systems | AP182B | Whole mount staining |
| Biotin-conjugated donkey α goat igG | R&D Systems | AP192P | Whole mount staining |
| Biotin-conjugated goat α chicken igY | R&D Systems | BAD010 | Whole mount staining |
| Vectashield mounting medium | Vector laboratories, Burlingame, CA, USA | H-1000 | Immunohistochemistry |
| Vectastain ABC kit | Vector laboratories, Burlingame, CA, USA | PK-4000 | Immunohistochemistry |
| Steady DAB/Plus | Abcam plc, Cambridge, UK | ab103723 | Whole mount staining |
| HistoClear | DiaTec, Bamberg, Germany | HS2002 | Immunohistochemistry |
| BisBenzimide H33342 trihydrochloride (Hoechst) | Sigma-Aldrich, St. Louis, MO, USA | B2261 | Immunohistochemistry |
| Vectashield HardSet mounting medium | Vector laboratories, Burlingame, CA, USA | VEC-H-1400 | Immunohistochemistry |
| Perfusion system | HUGO SACHS ELEKTRONIK - HARVARD APPARATUS GmbH, March-Hugstetten, Germany | 73-4343 | Langendorff apparatus |
| Data acquisition system and corresponding software for catheter and physiological parameter | Powerlab 8/30 & Labchart, ADInstruments, Dunedin, New Zealand | PL3508 PowerLab 8/35 | Langendorff setup |
| Octapolar catheter | CIB’ER Mouse, NuMed Inc., Hopkinton, NY, USA | custom | Langendorff setup |
| Stimulus generator | STG4002, Multi Channel Systems, Reutlingen, Germany | STG4002-160µA | Stimulation setup |
| Stimulation software | Multi Channel Systems, Reutlingen, Germany | MC_Stimulus II | Stimulation setup |
| Data acquisition system and corresponding software for epicardial electrograms | ME128-FAI-MPA-System, Multi Channel Systems, Reutlingen, Germany | USB-ME128-System | MEA setup |
| Multi-electrode array | MEA, EcoFlexMEA36, Multi Channel Systems, Reutlingen, Germany | EcoFlexMEA36 | MEA setup |
| Multi-electrode array recording software | Multi Channel Systems, Reutlingen, Germany | MC_Rack | MEA setup |
| Spring scissors | Fine Science Tools GmbH, Heidelberg, Germany | 15003-08 | Heart Preparation |
| Strabismus Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14575-09 | Heart Preparation |
| Mayo Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14110-15 | Heart Preparation |
| Dumont SS Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11203-25 | Heart Preparation |
| London Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11080-02 | Heart Preparation |
| Narrow Pattern Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11003-13 | Heart Preparation |
| Plastic Wrap | Parafilm M, Bemis NA, based in Neenah, WI, United States | Consumable Materials | |
| Stereomicroscope | Leica M165FC; Leica Microsystems GmbH, Wetzlar, Germany | FRET | |
| LED | CoolLED, Andover, UK | pE-100 | FRET |
| DualView | Photometrics, Tucson, AZ, USA | DV2-SYS | FRET |
| DualView filter set | Photometrics, Tucson, AZ, USA | 05-EM | FRET |
| optiMOS scientific CMOS camera | Qimaging, Surrey, BC, Canada | 01-OPTIMOS-R-M-16-C | FRET |
| Imaging software | Micro-Manager; Vale Lab, University of California San Francisco, CA, USA | FRET | |
| Analysis Software | Image J software; Public Domain, NIH, USA | FRET | |
Referenzen
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Hearse, D. J., Sutherland, F. J. Experimental models for the study of cardiovascular function and disease. Pharmacological Research. 41 (6), 597-603 (2000).
- Valentin, J. P., Hoffmann, P., De Clerck, F., Hammond, T. G., Hondeghem, L. Review of the predictive value of the Langendorff heart model (Screenit system) in assessing the proarrhythmic potential of drugs. Journal of Pharmacological and Toxicological Methods. 49 (3), 171-181 (2004).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff-still viable in the new millennium. Journal of Pharmacological and Toxicological Methods. 55 (2), 113-126 (2007).
- Langendorff, O. Investigation of the living mammalian heart. Pflügers Archiv. 61, 291-332 (1895).
- Matsumoto-Ida, M., Akao, M., Takeda, T., Kato, M., Kita, T. Real-time 2-photon imaging of mitochondrial function in perfused rat hearts subjected to ischemia/reperfusion. Circulation. 114 (14), 1497-1503 (2006).
- Rassaf, T., Totzeck, M., Hendgen-Cotta, U. B., Shiva, S., Heusch, G., Kelm, M. Circulating nitrite contributes to cardioprotection by remote ischemic preconditioning. Circulation Research. 114 (10), 1601-1610 (2014).
- Schechter, M. A., et al. An isolated working heart system for large animal models. Journal of Visualized Experiments. 88 (88), 51671 (2014).
- Stockigt, F., et al. Total beta-adrenoceptor knockout slows conduction and reduces inducible arrhythmias in the mouse heart. PLoS One. 7 (11), e49203 (2012).
- Berul, C. I. Electrophysiological phenotyping in genetically engineered mice. Physiological Genomics. 13 (3), 207-216 (2003).
- Curtis, M. J., et al. The Lambeth Conventions (II): guidelines for the study of animal and human ventricular and supraventricular arrhythmias. Pharmacology & Therapeutics. 139 (2), 213-248 (2013).
- Schrickel, J. W., et al. Enhanced heterogeneity of myocardial conduction and severe cardiac electrical instability in annexin A7-deficient mice. Cardiovascular Research. 76 (2), 257-268 (2007).
- Rudolph, V., et al. Myeloperoxidase acts as a profibrotic mediator of atrial fibrillation. Nature Medicine. 16 (4), 470-474 (2010).
- Jungen, C., et al. Disruption of cardiac cholinergic neurons enhances susceptibility to ventricular arrhythmias. Nature Communications. 8, 14155 (2017).
- Calebiro, D., et al. Persistent cAMP-signals triggered by internalized G-protein-coupled receptors. PLoS Biology. 7 (8), e1000172 (2009).
- Sprenger, J. U., Perera, R. K., Götz, K. R., Nikolaev, V. O. FRET microscopy for real-time monitoring of signaling events in live cells using unimolecular biosensors. Journal of Visualized Experiments. (66), e4081 (2012).
- Alanentalo, T., et al. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nature Methods. 4 (1), 31-33 (2007).
- Whittington, N. C., Wray, S. Suppression of red blood cell autofluorescence for immunocytochemistry on fixed embryonic mouse tissue. Current Protocols in Neuroscience. 81, 2.28.1-2.28.12 (2017).
- Fukuda, K., Kanazawa, H., Aizawa, Y., Ardell, J. L., Shivkumar, K. Cardiac innervation and sudden cardiac death. Circulation Research. 116 (12), 2005-2019 (2015).
- Wengrowski, A. M., Wang, X., Tapa, S., Posnack, N. G., Mendelowitz, D., Kay, M. W. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovascular Research. 105 (2), 143-150 (2015).
- Rivinius, R., et al. Control of cardiac chronotropic function in patients after heart transplantation: effects of ivabradine and metoprolol succinate on resting heart rate in the denervated heart. Clinical Research in Cardiology. , (2017).
- Ajijola, O. A., et al. Augmentation of cardiac sympathetic tone by percutaneous low-level stellate ganglion stimulation in humans: a feasibility study. Physiological Reports. 3 (3), e12328 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten