Method Article
Impact des neurones intracardiaques sur l’électrophysiologie cardiaque et arythmogenèse dans un système de Langendorff Ex Vivo
Dans cet article
Résumé
Nous présentons ici un protocole pour la modulation du système nerveux autonome intracardiaque et l’évaluation de son influence sur l’électrophysiologie fondamentale, arythmogenèse et cAMP dynamique en utilisant une configuration de Langendorff ex vivo .
Résumé
Depuis son invention à la fin du 19ème siècle, le système de perfusion Langendorff ex vivo le cœur continue d’être un outil pertinent pour étudier un large éventail de paramètres physiologiques, morphologiques, biochimiques et pharmacologiques coeurs au centre dénervés. Nous décrivons ici une configuration pour la modulation du système nerveux autonome intracardiaque et l’évaluation de son influence sur l’électrophysiologie fondamentale, arythmogenèse et dynamique de l’adénosine monophosphate cyclique (AMPc). Système nerveux autonome intracardiaque est modulé par la dissection mécanique de graisse auriculaire tampons-dans les ganglions murines sont situées principalement — ou par l’utilisation d’interventions pharmacologiques ciblées mais aussi mondiales. Un cathéter électrophysiologiques octapolar est introduit dans l’oreillette droite et le ventricule droit et tableaux multi-électrode épicardique placés (MEA) pour la cartographie à haute résolution sont utilisés pour déterminer l’arythmogenèse et électrophysiologie cardiaque. Transfert d’énergie par résonance Förster (FRET) d’imagerie est réalisée pour la surveillance en temps réel du taux d’AMPc dans différentes régions cardiaques. Neuromorphology est étudié au moyen d’anticorps-basée la coloration des coeurs entiers à l’aide de marqueurs neurones pour guider l’identification et la modulation des objectifs spécifiques du système nerveux autonome intracardiaque dans les études effectuées. La configuration de Langendorff ex vivo permet pour un grand nombre d’expériences reproductibles en peu de temps. Néanmoins, la nature en partie ouverte de l’installation (p. ex.., pendant les mesures de la MEA) contrôle de température constante est difficile et doit être maintenue à un minimum. Cette méthode décrite permet d’analyser et de moduler l’intracardiaque système nerveux dans les coeurs décentralisé.
Introduction
Le système de perfusion Langendorff ex vivo le cœur continue d’être un outil pertinent pour effectuer un large éventail de morphologiques, biochimiques et physiologiques, et des études pharmacologiques dans dénervé centralement coeurs1,2 ,3,4,5 depuis son invention en fin 19ème siècle6. A ce jour, ce système est encore largement utilisé pour divers sujets (p. ex.., ischémie reperfusion) ou étudier cardiaque pharmacologique effets7,8et est un outil de base en recherche cardiovasculaire. La longévité de cette méthode résulte de plusieurs avantages (p. ex.., les mesures sont effectuées sans l’influence du système nerveux central ou autres organes, circulation systémique ou hormones circulantes). Si nécessaire, produits pharmaceutiques peuvent être ajoutés de façon contrôlée dans la mémoire tampon de perfusion ou appliqués directement à des structures spécifiques. Des expériences sont reproductibles, et un nombre relativement élevé d’expériences peut être effectué dans un court laps de temps. La nature ouverte (en partie) de l’installation peut faire la régulation de la température difficile et doit être pris en compte. Bien que le système de Langendorff est également utilisé dans la plus grande espèce9, petits animaux sont principalement utilisés comme le montage expérimental est moins complexe et une plus grande variabilité biologique (p. ex.., transgéniques modèles murins) peut être utilisé.
Le dispositif expérimental du présent protocole, l’influence du système nerveux autonome intracardiaque sur base paramètres électrophysiologiques, arythmogenèse ventriculaire, conduction épicardique et dynamique de l’adénosine monophosphate cyclique (AMPc) est évalué. Un grand nombre de ganglions intracardiaques, qui sont principalement situées dans les coussinets adipeux auriculaires et sont désormais bien connus pour contrôler l’électrophysiologie cardiaque indépendant de contrôle nerveux central, est que soit laissés intacts ou supprimé manuellement avec soin mécanique dissection. Une modulation pharmacologique du système nerveux autonome est réalisée à l’échelle mondiale en ajoutant des produits pharmaceutiques vers le tampon de perfusion ou localement par modulation ciblée des ganglions auriculaires. Après les expériences, les coeurs sont bien adaptés pour une évaluation immunohistological comme toutes les cellules sanguines ont été supprimées en raison de la perfusion continue, qui permet d’augmenter la qualité de la coloration.
L’objectif global des techniques décrites est d’offrir de nouvelles perspectives pour des études détaillées concernant l’incidence du système nerveux autonome sur l’électrophysiologie cardiaque et arythmogenèse dans le coeur de souris. Une raison d’utiliser cette technique est qu’il est possible d’étudier et de modifier le système nerveux sans l’impact du système nerveux central. Un avantage majeur est l’emploi facile des expériences pharmacologiques, dans quelles propriétés antiarythmiques ou pro - potentielles de vieux et nouveaux agents peuvent être testés. En outre, des modèles de souris transgéniques et knock-out de diverses maladies cardiaques sont disponibles pour étudier les mécanismes qui sous-tendent les arythmies, insuffisance cardiaque ou des maladies métaboliques. Cette approche a amélioré notre compréhension de la façon dont le système nerveux autonome au niveau auriculaire peut avoir des répercussions électrophysiologie cardiaque ventriculaire et l’induction des arythmies.
Protocole
Toutes les procédures impliquant des animaux ont été approuvées par les autorités locales des comités de l’utilisation, soins aux animaux de l’Université de Hambourg et l’état de Hambourg.
1. préparation de l’appareil de Langendorff
NOTE : Un système de perfusion Langendorff commercialement disponible est utilisé.
- Préparer une solution de Krebs-Henseleit modifiée (119 mM de 25 mM de bicarbonate de sodium, 4,6 mM de 1,2 mM de phosphate de potassium monobasique, 1,1 mM de sulfate de magnésium, 2,5 mM de chlorure de calcium, 8,3 mM de glucose et de 2 millimètres de sodium, le chlorure de potassium, le chlorure de sodium pyruvate). Ajouter un mélange de 95 % de dioxyde de carbone oxygen/5% à la solution de perfusion afin d’éviter la précipitation de calcium. Filtrer le tampon avec une taille de pore de 0,22 µm.
- Ajouter un agent pharmacologique au tampon pour étudier ses effets sur l’électrophysiologie cardiaque et arythmogenèse selon les besoins.
- Commencer le bain d’eau et placer la solution de perfusion comprenant un mélange de 95 % de dioxyde de carbone oxygen/5% en elle. Réglez la température du bain, afin que la température de la solution de perfusion directement avant la canule est ~ 37 ˚C.
- Démarrer la pompe à rouleaux et remplir l’appareil avec la solution de perfusion dès que la température voulue est atteinte.
- Régler la vitesse de la pompe avant d’attacher le coeur, afin qu’aucune bulle d’air n’est laissés dans la canule, lors du montage de l’appareil.
2. hard - et Software préparation
- Raccorder un système d’acquisition de données numérique et son logiciel correspondant à l’appareil de Langendorff pour un enregistrement continu de la pression de perfusion, le débit et la fréquence cardiaque.
- Réglez la pression de perfusion ciblées dans les paramètres généraux à 80 mmHg.
- Démarrer l’enregistrement.
- Utiliser un cathéter d’électrophysiologie (Table des matières) avec électrodes de platine, une surface de l’électrode de 0,5 x 0,5 mm et un espacement de l’électrode de 0,5 mm pour l’enregistrement des données et de la stimulation avec un générateur numérique de stimulus désigné.
- Placer le cathéter à proximité de la zone où le cœur sera positionné après l’attachement à l’appareil.
- Préparer la stimulation en sélectionnant 2 électrodes dans le cathéter et utiliser une longueur de cycle de 100 ms.
3. préparation du cœur
- Ajouter le froid (~ 2-4 ° c) tampon de perfusion (10-20 et 40-50 mL, pour que le plat entier est couvert) pour les 2 boîtes de Pétri (diamètre de 6 cm et 10 cm) et le plat avec la canule et le lieu sur glace directement et sous le microscope. Préparer un double noeud autour de la canule.
- Rapidement l’accise cœur après la dislocation cervicale en ouvrant le thorax à l’aide de ciseaux de Mayo et pinces modèle étroit. Puis saisissez l’aorte et la veine cave supérieure au-dessus du diaphragme à l’aide de la pince de Londres et excise le bloc coeur-poumons en coupant tous les navires et les tissus conjonctifs à proximité de la colonne vertébrale avec les ciseaux strabisme.
- Transférer le bloc coeur-poumons dans le premier plat (6 cm de diamètre) rempli avec le tampon glacé et retirer délicatement les poumons sans endommager le cœur à l’aide de ciseaux strabisme et pinces à Londres. Placez ensuite le coeur sous le microscope et retirer délicatement le thymus, le œsophage et la trachée, à l’aide de ciseaux de printemps et pinces Dumont SS.
- Les ciseaux de printemps permet de découper un trou de 1,5 à 2 mm dans la partie supérieure de l’oreillette droite par l’insertion du cathéter. Découper un trou dans l’artère pulmonaire. Puis couper l’aorte directement sous les branches supraaortic et retirer le tissu de l’aorte, afin que le noeud peut être fixé facilement.
- Gardez les coussinets adipeux auriculaires, dont le major atrially situé ganglionated plexi, autour de l’atrium gauche intact ou de les supprimer complètement par une dissection minutieuse.
- Transférer le cœur dans le plat avec la canule et le placer sous le microscope. Rangez-vous l’aorte la canule avec la pince Dumont SS et attacher le noeud disposé autour de l’aorte. Assurez-vous que la canule n’est pas placée trop profondément dans l’aorte afin que la valve aortique et les vaisseaux coronaires sont laissées libres.
- Fixer la canule rapidement à l’appareil de Langendorff. Assurez-vous qu’il n’y a pas de bulles dans la canule.
- Passer la pression de perfusion à 80 mmHg, ce qui permet une perfusion de pression constante.
- Placer le cathéter avec soin dans l’oreillette droite et le ventricule droit sans toucher ni endommager le coeur et fixer le cathéter à la canule avec du ruban adhésif.
- Commencer la stimulation avec la longueur du cycle de prêt de 100 ms pour une période d’équilibration initiale de 20 min.
- Fermer la chambre pour permettre à une température stable.
4. arythmogenèse et paramètres électrophysiologiques
- Appliquer une stimulation programmée via les électrodes distales ou proximales du cathéter à deux fois le seuil stimulation d’auriculaire ou ventriculaire pour évaluer les paramètres électrophysiologiques, tel que décrit dans les étapes suivantes.
- Déterminer le temps de récupération du n ud sinusal comme la durée maximale de retour après 10 s de taux fixe une stimulation à une longueur de cycle S1S1 de 120 ms, ms 100 et 80 ms.
- Déterminer le point de Wenckebach comme la longueur plus longue du cycle S1S1 (8 stimuli ; S1S1 : 100 ms ; réduction par étapes de 2 ms) avec une perte de 11 conduction nodale AV. Déterminer les périodes réfractaires nodales auriculoventriculaire comme la plus longue S1S2 (12 stimulus ; S1S1 : 120 ms, ms 110 et 100 ms ; une courte associée extrastimulus 2 ms stepwise S1S2) avec une perte de conduction nodale AV.
- Déterminer les périodes réfractaires auriculaires et ventriculaires, comme la plus longue S1S2 (12 stimulus ; S1S1 : 120 ms, ms 110 et 100 ms ; une courte associée extrastimulus 2 ms stepwise S1S2) avec une réponse auriculaire ou ventriculaire absente10,11.
- Effectuer une extrastimulation programmée (S1S1 : 120 ms, ms 100 et 80 ms, suivies jusqu'à 3 battements supplémentaires ; 60-20 ms avec une réduction progressive de 2 ms) ou éclatement des protocoles de stimulation (5 s à S1S1 : 50-10 ms avec une réduction par étapes de 10 ms) conformément aux Conventions de Lambeth à eva luate l’arythmogenèse ventriculaire10,11,12.
5. les mesures de Conduction épicardique
Remarque : Enregistrer électrogrammes épicardique en utilisant un système d’enregistrement 128 canaux, assistée par ordinateur avec une fréquence d’échantillonnage de 25 kHz pour la cartographie à haute résolution. Utiliser un tableau multi-électrode 32 (MEA ; inter-électrode distance : 300 µm ; 1,8 x 1,8 mm). Notez que les données étaient passe-bande filtré (50 Hz) et numérisé avec 12 bits et une gamme de signal de 20 mV.
- Placez la MEA dans la zone désignée du cœur et ajouter la mise à la terre à une autre partie du cœur13,14,15.
- Placer un cathéter de stimulation épicardique à proximité de la MEA et commencer une stimulation constante.
- Démarrer l’enregistrement après la confirmation du bon contact des électrodes en vérifiant la qualité du signal et l’amplitude.
- Utiliser une analyse hors ligne pour la détermination de la vitesse de propagation des ondes et de la dispersion dans le sens de conduction.
6. Förster Resonance Energy Transfer frette cyclique l’adénosine monophosphate cyclique (AMPc) imagerie
Remarque : Pour les mesures axées sur la frette, récolter des coeurs de CAG-Epac1-camps souris transgéniques16.
- Utiliser un système d’imagerie auto-construits autour un stéréomicroscope15,17.
- Placez le stéréomicroscope devant le cœur et l’ajuster d’acuité.
- Exciter le capteur cAMP avec une source lumineuse [par exemple, l’aide d’une seule longueur d’onde lumière diode électroluminescente (440 nm)]. Diviser l’émission lumineuse dans des canaux donneur et accepteur en utilisant un séparateur de faisceau (pour une paire de protéine fluorescente cyan fluorescent protein/jaune, utiliser un 565dcxr miroir dichroïque et filtres d’émission D480/30 et D535/40).
- Assurer une température stable en mettant une pellicule de plastique autour de la chambre.
- Prendre des photos en utilisant une caméra scientifique complementary metal-oxide-semiconductor (sCMOS). Coordonner la source lumineuse et la caméra capture d’image avec un open source logiciel tel que Micro-Manager d’imagerie.
- Pour démarrer l’acquisition de l’image, poussez l' Acq Multi-D. bouton et de mettre en place un Time-lapse, qui acquiert une image toutes les 10 s, avec le temps d’exposition appropriée, qui dépend de la puissance du signal fluorescent (environ 100 ms).
- Le précédemment décrite et disponible vous inquiétez pas en ligne et la base en ligne 2 plugins17 permet de diviser l’image en deux canaux, sélectionnez les régions d’intérêt et surveiller le traçage de ratio.
- Lors de l’acquisition, perfuse le cœur avec la solution de Krebs-Henseleit modifiée contenant des substances différentes, selon la nature de l’expérience.
- À la fin de l’expérience, éteignez l’acquisition en appuyant sur le bouton arrêter et enregistrer la pile d’images.
- Analyser les données FRET hors ligne en utilisant un logiciel d’analyse dédié qui peut diviser les images en deux sections identiques pour les canaux donneur et accepteur et pouvant effectuer des analyses de frette dans plusieurs régions d’intérêt.
Remarque : Un dédié plug-in (vous inquiétez pas en mode hors connexion) est nécessaire, ce qui est fourni dans Sprenger et al. 17.- Lancez le logiciel. Ouvrir l’analyse en allant dans le menu Plugins , puis cliquez sur MicroManager, puis sur Ouvrir le fichier Micro-Manager.
- Exécuter le plugin vous inquiétez pas en mode hors connexion pour le Time-lapse scindée en deux images identiques pour les canaux de la PCP et la YFP.
- Utilisez l’outil de Sélection à main levée à l’occasion de la région d’intérêt dans l’image de la YFP. Appuyez sur le bouton Ajouter pour ajouter la sélection à la fenêtre de Mesure Multi .
- Choisissez la région d’intérêt dans la fenêtre de Mesure Multi et appuyez sur Multi pour obtenir un tableau avec des valeurs moyennes de gris pour chaque cadre et chaque région. Copiez et collez les données dans une feuille Excel.
- Cliquez sur la PCP Image pile. Effectuer les mêmes opérations qu’à l’étape 6.10.4 pour la pile de la CFP et collez les valeurs moyennes de gris dans la même feuille Excel.
- Corriger les données brutes en mode hors connexion pour le facteur cordeau du donateur dans l’accepteur canal17.
- Utilisez la formule suivante, où B est le facteur le cordeau :
Ratio = (YFP - B x CFP) / CFP - Déterminer le facteur de cordeau B Imaging un cœur exprimant CFP seulement et de mesurer le pourcentage de la fluorescence du donneur dans le chenal de la YFP (B = YFP / CFP).
- Utilisez la formule suivante, où B est le facteur le cordeau :
7. Neuromorphology
NOTE : Analyser l’intracardiaque système nerveux à l’aide d’immunostainings entier-montent des cœurs murine intact. Notez que la majorité des ganglions intracardiaques est localisée dans le tissu adipeux épicardique près les veines pulmonaires.
- Utiliser différentes salissures pour la représentation des neurofilaments (structures neuronales générales ; poulet anti-NF-H, 1:3, 000), tyrosine hydroxylase (TH, des structures neuronales sympathiques ; lapin α TH, 1:1, 000) et la choline acétyltransférase (ChAT, parasympathique structures neuronales ; chèvre α ChAT, 01:50).
- Après la perfusion dans l’appareil de Langendorff, fixer le cœur de souris dans 10 mL de formol pendant 24 h et stockez-les en solution saline tamponnée au phosphate (PBS) à 4 ° c.
- Blanchir les cœurs en agent de blanchiment de Dent (4:1:1 méthanol : peroxyde d’hydrogène solution 30 % (p/p) dans H2o : le diméthylsulfoxyde (DMSO)) pendant 1 semaine à 4 ° c et réhydrater par la suite aux PBS d’une série de descendant de méthanol dans du PBS (100 %, 75 %, 50 %, 25 % ; 1 h chaque) 18.
- Effectuez les incubations suivantes dans un format de 24-puits-plat avec une agitation modérée à 4 ° c :
- Permeabilize âmes en 1 % Triton-X-100/PBS (PBS-T) 3 x 1 h à température ambiante avant de les bloquer du jour au lendemain dans un tampon de blocage [5 % d’albumine sérique bovine (BSA) / PBS-T + 0,2 % d’azide de sodium].
- Diluer les anticorps comme suit : chèvre α ChAT (01:50), lapin α TH (1:1, 000), neurofilaments α de poulet (1:3, 000) ; Anticorps secondaires pour le marquage fluorescent (1/500 ; ou selon les instructions du fabricant) ; Anticorps secondaires biotinylés d’étiquetage chromogène (1 : 200 ; ou selon les instructions du fabricant).
- Incuber les échantillons à l’anticorps primaires dilués dans un tampon bloquant pendant 1 semaine à 4 ° c.
- Laver les coeurs pour 3 x 15 min à PBS-T avant l’incubation de l’anticorps secondaire dans un tampon bloquant pendant 4 jours.
- Laver les coeurs pour 3 x 15 min à PBS-T et stockez-les dans un milieu de montage pour une coloration fluorescente pendant 3 h à température ambiante ou utiliser un kit de détection complexe avidine-biotine selon les instructions du fabricant.
- Avant Incuber les coeurs dans un tampon commercial pour 3, 3'-diaminobenzidine (DAB), pendant 1 heure avant de les développer sous un contrôle visuel dans un tampon contenant du DAB selon les instructions du fabricant.
- Stocker les échantillons dans l’eau bidistillée.
- Pour les sections de paraffine, déshydrater et incorporer les cœurs à la paraffine.
- Coupes épaisses de 4 µm et les Déparaffiner selon les procédures du laboratoire de routine. Si et comment recherche d’antigène doit être effectuée doit être établie pour chaque installation individuelle puisque cela dépend de la combinaison de l’anticorps.
- Permeabilize les sections pendant 10 min dans 0,2 % Triton X-100/Tris-salin (SCT), suivie de 3 x 5 min lavages dans les directives du SCT.
- Les bloquer avec 3 % BSA/SCT pendant 1 h à température ambiante.
- Les incuber une nuit à 4 ° c [anticorps primaires : chèvre α ChAT (01:50), lapin α TH (1/500), poulet neurofilament α (1:1, 000)] ou 2 h à température ambiante (anticorps secondaires marqués par fluorescence, 1/500) chez 1 % BSA/SCT avec 3 x 5 min lave SCT entre les deux.
- Ajouter 1 µg/mL de TRIHYDROCHLORURE de H33342 bisbenzimide à la solution d’anticorps secondaire ou utilisez une autre méthode de coloration nucléaire.
- Monter les diapositives dans un milieu de montage pour une coloration fluorescente.
Résultats
La figure 1 montre une image de l’installation de Langendorff dont 2 rangées d’électrodes multiples (AME). Avant l’expérience, le cathéter intracardiaque est positionné à proximité de la canule pour faciliter une insertion rapide et facile dans le ventricule droit atrium/droit tout en assurant une courte période de temps jusqu'à ce que l’équilibration peut commencer. La partie inférieure de la chambre peut être accrue (voir les flèches dans la Figure 1) afin que la chambre est totalement fermée et garantit une température stable.
La figure 2 illustre différentes salissures cardiaque représentatif. Dans la Figure 2 a un hématoxyline et éosine (H & E) souillant d’une section de paraffine est présenté. Dans l’élargissement exemplaire (Figure 2 b), une coloration immunohistochimique d’un ganglion auriculaire montre les cellules prédominance parasympathiques (rouge, ChAT-positive) par rapport aux moins nombreuses cellules sympathiques (vert, TH positive). Dans la Figure 2-E une coloration immunohistochimique des neurones (Figure 2, vert, neurofilaments) et des fibres sympathiques (Figure 2D, rouge, TH) ainsi que la superposition des deux images (Figure 2E) dépeint comment neurales fibres traverse de l’oreillette via le sinus coronaire vers les ventricules postérieures.
La figure 3 montre le murin coeur relié à la canule de l’engin de Langendorff avec un cathéter inséré octapolar dans l’oreillette droite et le ventricule droit et un tableau de multi-électrode épicardique (MEA) placé sur le ventricule gauche antérieur ( Figure 3 a). Antibiogramme d’arythmie ventriculaire par l’intermédiaire des électrodes dans le RV est présenté dans la Figure 3 b. L’induction d’une tachycardie ventriculaire dans les coeurs se sont produites plus fréquemment après une dénervation partielle auriculaire. La MEA élargie (Figure 3) présente la disposition schématique des électrodes. Il est important d’assurer un contact épicardique stable de toutes les électrodes. En Figure 3D la conduction épicardique hors ligne analysé, enregistrée par un MEA est représentée.
La figure 4 montre la frette mesures dans un coeur entier étant marqués perfusé dans l’appareil de Langendorff. Différentes zones du coeur peuvent être analysés comme nécessaire (Figure 4 a). Une application topique locale mais aussi mondiale des produits pharmaceutiques est facilement possible dans cette configuration (Figure 4 b).

Figure 1 : installation de Langendorff notamment rangées d’électrodes multiples (AME). La sonde de stimulation et d’enregistrement d’octapolar est placée à proximité de la zone dans laquelle le cœur sera fixé. La partie inférieure de la chambre sera déplacée vers le haut (blanc flèches) après que le cœur a été attaché à l’appareil afin d’assurer une température stable est. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
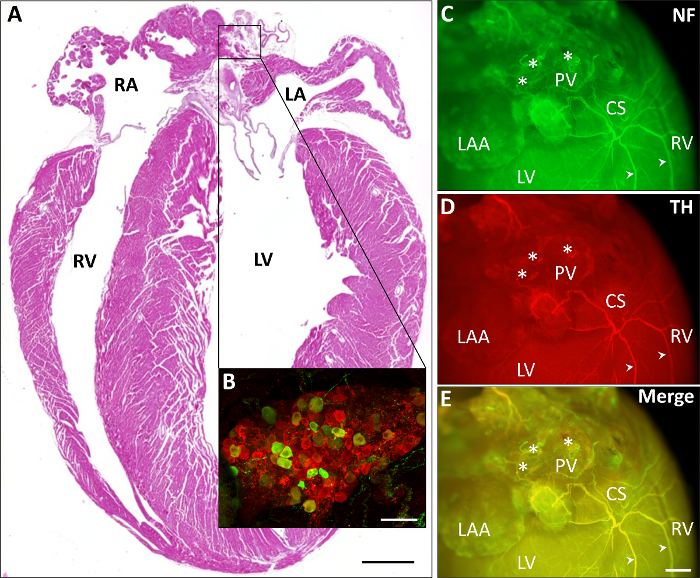
Figure 2 : cardiaque toute monture salissures représentant les parties du système nerveux autonome. A) représentation d’un cardiaque H & E-teint paraffine section (échelle bar 1 mm). B) un élargissement exemplaire d’un immunohistochimique teinté ganglion auriculaire montre les cellules prédominance parasympathiques (rouge, ChAT-positive) par rapport aux moins nombreuses cellules sympathiques (vert, TH-positifs ; échelle bar 75 µm). C-E) Salissures représentant immunohistochemical des neurones (Figure 2, vert, neurofilaments, NF) et des fibres sympathiques (Figure 2D, rouge, TH et leur superposition dans Figure 2E) traverser de l’oreillette via le sinus coronaire (CS) vers le ventricules postérieures. Fibres exemplaires sont marqués par des pointes de flèches. Astérisques correspondent aux ganglions de l’auriculaires. L’échelle bar 1 mm. LA, oreillette gauche ; LV, ventricule gauche ; NF, neurofilaments ; PV, veines pulmonaires ; RA, oreillette droite ; RAA, appendice auriculaire droite ; RV, ventricule droit. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
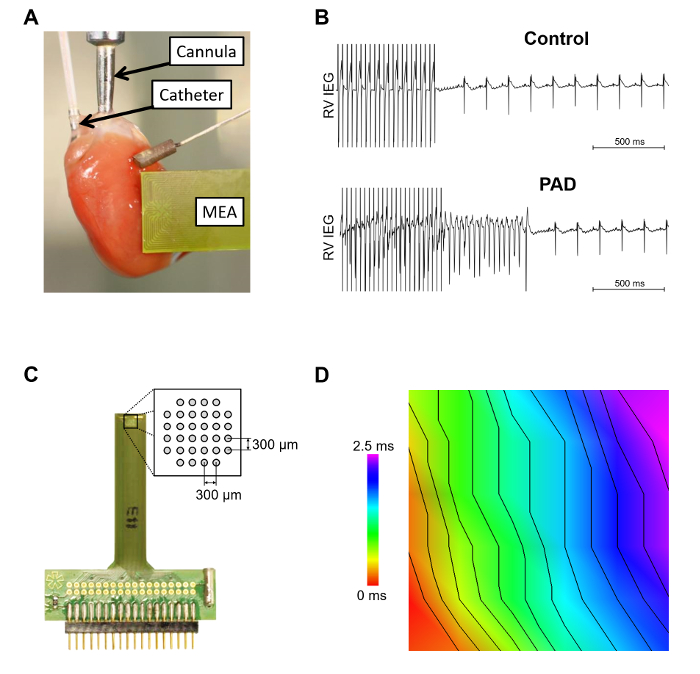
Figure 3 : Intra - et épicardiques Mensurations à l’aide de la configuration de Langendorff. A. ce panneau montre un exemple d’un cœur murin au sein du système de Langendorff. Le cathéter intracardiaque octapolar, qui est inséré dans l’oreillette droite et ventricule et un tableau de multi-électrode épicardique (MEA) sont représentés. B. à l’aide de tests de sensibilité à arythmie éclater stimulation sans (contrôle) ou avec l’induction d’une résiliation automatique tachycardie ventriculaire [après dénervation partielle auriculaire (PAD)] sont représentés. C. la MEA épicardique est représentée avec un élargissement de la présentation schématique d’électrode. D. vitesse de propagation des ondes a été analysée à l’aide d’un logiciel sur mesure. La distance entre les isochrones est 2 m/s. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : mesures de FRET dans une configuration de Langendorff. A. les deux differentcAMP biocapteur fluorescence canaux [protéine fluorescente jaune (YFP) et protéine fluorescente cyan (PCP)] lors des mesures de FRET dans un coeur perfusé rétrograde sont représentés. Le cas échéant, les différentes parties du cœur (p. ex., les oreillettes et le ventricule) peuvent être analysés (Echelle : 1 mm). B. ce panneau montre une expérience représentative de frette, qui mesure le taux d’AMPc pendant une stimulation pharmacologique de l’oreillette et le ventricule gauche. Tout d’abord, le coeur est systémiquement perfusé l’adénylyl cyclase utilisant l’activateur NKH477, un analogon de la forskoline, d’augmenter les taux d’AMPc. La nicotine était alors par voie topique appliquée et ciblant les ganglions auriculaires, qui a gravement réduit taux d’AMPc. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Dans ce manuscrit, le système de perfusion du Langendorff ex vivo coeur bien connu est présenté comme un outil pour étudier l’impact des neurones intracardiaques sur l’électrophysiologie cardiaque et arythmogenèse en utilisant la cartographie différente et les techniques de stimulation y compris les approches endocardiques et épicardiques.
Plusieurs parties du protocole sont cruciales pour le programme d’installation. Tout d’abord, il est important d’utiliser une technique de préparation dans lequel les coussinets adipeux auriculaires restent intactes ou disparaissent rapidement sans blesser le myocarde. Deuxièmement, une ouverture de taille appropriée doit être coupé dans l’oreillette droite pour une insertion facile du cathéter octapolar dans l’oreillette droite et le ventricule droit. Le cathéter doit glisser facilement dans le ventricule droit sans générer aucune pression. Lors de la fixation du cathéter à la canule, le cathéter ne doit pas plonger plus profondément dans le ventricule, afin d’éviter des lésions cardiaques. En troisième lieu, contrôle de température est un élément crucial de Langendorff toutes les configurations1,2,5. La chambre thermique est fermée pendant l’arythmie stable, ce qui garantit une température stable. Mais pour les enregistrements MEA ou frette, la chambre doit être au moins partiellement ouvert pour permettre des mesures. Temps d’enregistrement devraient être réduites au minimum, ou autres techniques pour réduire la perte de température, comme mettre une pellicule de plastique autour de la chambre lors des mesures plus longues, doivent être effectuées. Quatrièmement, Ame doit être placés aux mêmes endroits anatomiques dans toutes les expériences. Bonne surface de contact, qui est confirmé par grandes amplitudes dans l’analyse en temps réel, peut être obtenu en utilisant deux ame sur sites opposés afin qu’un contrepoids est produit. Cinquièmement, frette mesures sont influencés par le mouvement. Pour réduire le mouvement spontané, le cœur est rythmé à une fréquence stable par le cathéter intracardiaque. Pour la stabilisation supplémentaire, un tube avec un léger vide peut stabiliser l’apex.
Un des avantages du système Langendorff est que le cœur peut être utilisé ultérieurement pour les évaluations d’immunohistological du système nerveux cardiaque. La perfusion continue supprime la plupart globules rouges qui ont un niveau élevé de l’autofluorescence19, amélioration de la qualité de la coloration. Après fixation au formol, les coeurs peuvent être stockés dans un environnement à température contrôlée (4 ° c) dans une solution saline tamponnée au phosphate pour jusqu'à un an sans changements notables dans la coloration de qualité.
La caractéristique la plus importante de cette configuration est que toutes les mesures sont effectuées dans un coeur central dénervé. Les ganglions intracardiaques auriculaires prédominance parasympathiques sont la dernière station de relais au sein du cœur20 car le ganglion sympathique stellatum se trouve intrathoracically et est donc supprimée lors de la préparation. Bien que les neurones intracardiaques n’obtenir aucun apport central, il a été démontré qu’ils sont toujours actifs de façon physiologique comme la photoactivation des nerfs sympathiques cardiaques augmente le rythme cardiaque et la force contractile cardiaque21. Conformément à ces constatations étayant l’importance fonctionnelle des neurones intracardiaques en plein central dénervé, nous a récemment démontré leur impact sur la fonction ventriculaire et arythmogenèse15.
Un des avantages de cette configuration centralisée dénervé, c’est qu’il permet au chercheur à étudier la communication entre les différents réseaux de neurones régional intracardiaque (par exemple, l’interaction entre l’oreillette et le ventricule)15. Ces différences peuvent concerner des patients après une transplantation cardiaque chez qui un traitement avec l’ivabradine de modulateur sélectif du noeud sinusal améliore la survie, comparée au traitement par bêta-bloquant metoprolol succinate22. Dans une étape ultérieure, la stimulation électrique directe du parasympathique (nerf vague) ou structures sympathiques (Ggl. stellatum23) contribuera à améliorer notre connaissance de l’interaction entre l’extra - et intracardiaque système nerveux.
Il est important de garder à l’esprit que parasympathique et fibres sympathiques sont pour la plupart localisées conjointement afin que les traitements actuels comme l’ablation par cathéter des arythmies auriculaires ou ventriculaires modifiera inévitablement les deux structures. Dans la configuration décrite ICIE, modification pharmaceutique locale des structures ciblées (par exemple, la stimulation spécifique des ganglions parasympathiques) peut être étudiée. En plus des modifications ciblées, perfusion globale avec différents produits pharmaceutiques (par exemple, les béta-bloquants) est facilement possible, afin que les propriétés potentielles de proarythmiques ou antiarythmiques de divers agents peuvent être étudiées. En utilisant cette configuration, des interventions et des différentes techniques peuvent être testés au cours de la stimulation ou l’inhibition des différentes parties de l’intracardiaque système nerveux, révélant des informations de l’impact des différentes parties du système nerveux autonome sur la fonction cardiaque et arythmogenèse. En outre, la configuration murine permet étudier le système nerveux autonome cardiaque dans les États de la maladie comme l’infarctus du myocarde, insuffisance cardiaque ou de diabète.
En conclusion, le système simple et bien connu Langendorff ex vivo coeur perfusion fournit une base flexible pour modifier et étudier l’impact des neurones intracardiaques sur l’électrophysiologie cardiaque et arythmogenèse.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs aimeraient remercier Hartwig Wieboldt pour son excellente assistance technique et l’UKE Microscopy Imaging Facility (Umif) du centre médical universitaire Hamburg-Eppendorf de fournir microscopes et soutien. Cette recherche a été financée bythe Förderverein des universitaire Herzzentrums Hamburg e.V. et par le DZHK (Centre allemand de recherche cardiovasculaire) [FKZ 81Z4710141].
matériels
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Sigma-Aldrich | S3014 | Modified Krebs-Henleit solution |
| Sodium hydrogencarbonate | Sigma-Aldrich | 401676 | Modified Krebs-Henleit solution |
| Potassium chloride | Sigma-Aldrich | P5405 | Modified Krebs-Henleit solution |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | Modified Krebs-Henleit solution |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | Modified Krebs-Henleit solution |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | Modified Krebs-Henleit solution |
| Glucose | Sigma-Aldrich | G5767 | Modified Krebs-Henleit solution |
| Sodium pyruvate bioXtra | Sigma-Aldrich | P8574 | Modified Krebs-Henleit solution |
| Carbogen (95% O2 / 5% CO2) | SOL-Group, TMG Technische und Medizinische Gas GmbH, Krefeld, Gersthofen, Germany | Modified Krebs-Henleit solution | |
| Sterile filter steritop-GP 0.22 | EMD Millipore | SCGPT05RE | Modified Krebs-Henleit solution |
| Atropine sulfate | Sigma-Aldrich | A0257 | Neuromodulation |
| Hexamethonium chloride | Sigma-Aldrich | H2138 | Neuromodulation |
| Nicotine free base 98-100% | Sigma-Aldrich | N3876 | Neuromodulation |
| Formalin solution neutral buffered 10% | Sigma-Aldrich | HT501128 | Whole mount staining |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | Whole mount staining |
| Methanol | Sigma-Aldrich | 34860 | Whole mount staining |
| Hydrogen peroxide solution 30% (w/w) in H2O | Merck, KGA, Darmstadt, Germany | H1009 | Whole mount staining |
| Dimethyl sulfoxide | Merck, KGA, Darmstadt, Germany | D8418 | Whole mount staining |
| Phosphate-buffered saline tablets | Gibco / Invitrogen | 18912-014 | Whole mount staining |
| Triton-x-100 | Sigma-Aldrich | T8787 | Whole mount staining |
| Albumin bovine fraction V | Biomol, Hamburg, Germany | 11924.03 | Whole mount staining |
| Chicken anti neurofilament | EMD Millipore | AB5539 | Whole mount staining |
| Rabbit anti tyrosine hydroxylase | EMD Millipore | AB152 | Whole mount staining |
| Goat anti choline acetyltransferase | EMD Millipore | AP144P | Whole mount staining |
| Donkey α rabbit IgG Alexa 488 | Thermo Fisher Scientific | A21206 | Whole mount staining |
| Donkey α goat IgG Alexa 568 | Thermo Fisher Scientific | A11057 | Whole mount staining |
| Donkey α chicken IgY Alexa 647 | Merck, KGA, Darmstadt, Germany | AP194SA6 | Whole mount staining |
| Biotin-conjugated donkey α rabbit igG | R&D Systems | AP182B | Whole mount staining |
| Biotin-conjugated donkey α goat igG | R&D Systems | AP192P | Whole mount staining |
| Biotin-conjugated goat α chicken igY | R&D Systems | BAD010 | Whole mount staining |
| Vectashield mounting medium | Vector laboratories, Burlingame, CA, USA | H-1000 | Immunohistochemistry |
| Vectastain ABC kit | Vector laboratories, Burlingame, CA, USA | PK-4000 | Immunohistochemistry |
| Steady DAB/Plus | Abcam plc, Cambridge, UK | ab103723 | Whole mount staining |
| HistoClear | DiaTec, Bamberg, Germany | HS2002 | Immunohistochemistry |
| BisBenzimide H33342 trihydrochloride (Hoechst) | Sigma-Aldrich, St. Louis, MO, USA | B2261 | Immunohistochemistry |
| Vectashield HardSet mounting medium | Vector laboratories, Burlingame, CA, USA | VEC-H-1400 | Immunohistochemistry |
| Perfusion system | HUGO SACHS ELEKTRONIK - HARVARD APPARATUS GmbH, March-Hugstetten, Germany | 73-4343 | Langendorff apparatus |
| Data acquisition system and corresponding software for catheter and physiological parameter | Powerlab 8/30 & Labchart, ADInstruments, Dunedin, New Zealand | PL3508 PowerLab 8/35 | Langendorff setup |
| Octapolar catheter | CIB’ER Mouse, NuMed Inc., Hopkinton, NY, USA | custom | Langendorff setup |
| Stimulus generator | STG4002, Multi Channel Systems, Reutlingen, Germany | STG4002-160µA | Stimulation setup |
| Stimulation software | Multi Channel Systems, Reutlingen, Germany | MC_Stimulus II | Stimulation setup |
| Data acquisition system and corresponding software for epicardial electrograms | ME128-FAI-MPA-System, Multi Channel Systems, Reutlingen, Germany | USB-ME128-System | MEA setup |
| Multi-electrode array | MEA, EcoFlexMEA36, Multi Channel Systems, Reutlingen, Germany | EcoFlexMEA36 | MEA setup |
| Multi-electrode array recording software | Multi Channel Systems, Reutlingen, Germany | MC_Rack | MEA setup |
| Spring scissors | Fine Science Tools GmbH, Heidelberg, Germany | 15003-08 | Heart Preparation |
| Strabismus Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14575-09 | Heart Preparation |
| Mayo Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14110-15 | Heart Preparation |
| Dumont SS Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11203-25 | Heart Preparation |
| London Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11080-02 | Heart Preparation |
| Narrow Pattern Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11003-13 | Heart Preparation |
| Plastic Wrap | Parafilm M, Bemis NA, based in Neenah, WI, United States | Consumable Materials | |
| Stereomicroscope | Leica M165FC; Leica Microsystems GmbH, Wetzlar, Germany | FRET | |
| LED | CoolLED, Andover, UK | pE-100 | FRET |
| DualView | Photometrics, Tucson, AZ, USA | DV2-SYS | FRET |
| DualView filter set | Photometrics, Tucson, AZ, USA | 05-EM | FRET |
| optiMOS scientific CMOS camera | Qimaging, Surrey, BC, Canada | 01-OPTIMOS-R-M-16-C | FRET |
| Imaging software | Micro-Manager; Vale Lab, University of California San Francisco, CA, USA | FRET | |
| Analysis Software | Image J software; Public Domain, NIH, USA | FRET |
Références
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Hearse, D. J., Sutherland, F. J. Experimental models for the study of cardiovascular function and disease. Pharmacological Research. 41 (6), 597-603 (2000).
- Valentin, J. P., Hoffmann, P., De Clerck, F., Hammond, T. G., Hondeghem, L. Review of the predictive value of the Langendorff heart model (Screenit system) in assessing the proarrhythmic potential of drugs. Journal of Pharmacological and Toxicological Methods. 49 (3), 171-181 (2004).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff-still viable in the new millennium. Journal of Pharmacological and Toxicological Methods. 55 (2), 113-126 (2007).
- Langendorff, O. Investigation of the living mammalian heart. Pflügers Archiv. 61, 291-332 (1895).
- Matsumoto-Ida, M., Akao, M., Takeda, T., Kato, M., Kita, T. Real-time 2-photon imaging of mitochondrial function in perfused rat hearts subjected to ischemia/reperfusion. Circulation. 114 (14), 1497-1503 (2006).
- Rassaf, T., Totzeck, M., Hendgen-Cotta, U. B., Shiva, S., Heusch, G., Kelm, M. Circulating nitrite contributes to cardioprotection by remote ischemic preconditioning. Circulation Research. 114 (10), 1601-1610 (2014).
- Schechter, M. A., et al. An isolated working heart system for large animal models. Journal of Visualized Experiments. 88 (88), 51671 (2014).
- Stockigt, F., et al. Total beta-adrenoceptor knockout slows conduction and reduces inducible arrhythmias in the mouse heart. PLoS One. 7 (11), e49203 (2012).
- Berul, C. I. Electrophysiological phenotyping in genetically engineered mice. Physiological Genomics. 13 (3), 207-216 (2003).
- Curtis, M. J., et al. The Lambeth Conventions (II): guidelines for the study of animal and human ventricular and supraventricular arrhythmias. Pharmacology & Therapeutics. 139 (2), 213-248 (2013).
- Schrickel, J. W., et al. Enhanced heterogeneity of myocardial conduction and severe cardiac electrical instability in annexin A7-deficient mice. Cardiovascular Research. 76 (2), 257-268 (2007).
- Rudolph, V., et al. Myeloperoxidase acts as a profibrotic mediator of atrial fibrillation. Nature Medicine. 16 (4), 470-474 (2010).
- Jungen, C., et al. Disruption of cardiac cholinergic neurons enhances susceptibility to ventricular arrhythmias. Nature Communications. 8, 14155 (2017).
- Calebiro, D., et al. Persistent cAMP-signals triggered by internalized G-protein-coupled receptors. PLoS Biology. 7 (8), e1000172 (2009).
- Sprenger, J. U., Perera, R. K., Götz, K. R., Nikolaev, V. O. FRET microscopy for real-time monitoring of signaling events in live cells using unimolecular biosensors. Journal of Visualized Experiments. (66), e4081 (2012).
- Alanentalo, T., et al. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nature Methods. 4 (1), 31-33 (2007).
- Whittington, N. C., Wray, S. Suppression of red blood cell autofluorescence for immunocytochemistry on fixed embryonic mouse tissue. Current Protocols in Neuroscience. 81, 2.28.1-2.28.12 (2017).
- Fukuda, K., Kanazawa, H., Aizawa, Y., Ardell, J. L., Shivkumar, K. Cardiac innervation and sudden cardiac death. Circulation Research. 116 (12), 2005-2019 (2015).
- Wengrowski, A. M., Wang, X., Tapa, S., Posnack, N. G., Mendelowitz, D., Kay, M. W. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovascular Research. 105 (2), 143-150 (2015).
- Rivinius, R., et al. Control of cardiac chronotropic function in patients after heart transplantation: effects of ivabradine and metoprolol succinate on resting heart rate in the denervated heart. Clinical Research in Cardiology. , (2017).
- Ajijola, O. A., et al. Augmentation of cardiac sympathetic tone by percutaneous low-level stellate ganglion stimulation in humans: a feasibility study. Physiological Reports. 3 (3), e12328 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon