Method Article
心内神经元对体外 Langendorff 系统心脏电生理和心脏交感神经的影响
摘要
在这里, 我们提出了一个调节心内自主神经系统的协议, 并评估其对基本的电生理, 心脏交感神经和阵营动力学的影响使用前体 Langendorff 设置.
摘要
自19晚期th世纪的发明以来, Langendorff前体心脏灌注系统继续是研究广泛的生理、生物化学、形态学和药理学参数的相关工具。中枢失神心。在这里, 我们描述了调节心脏内自主神经系统的设置和评估其对基本电生理, 心脏交感神经和循环腺苷 (阵营) 动力学的影响。心内自主神经系统由心房脂肪垫的机械解剖调节--小鼠神经节主要位于--或使用全球以及靶向的药理干预。将 octapolar 电生理导管引入右心房和右心室, 用心外膜放置的多电极阵列进行高分辨率映射, 以确定心脏电生理和心脏交感神经。Förster 共振能量转移 (焦虑) 成像进行实时监测的营地水平在不同的心脏地区。采用神经标记法对 Neuromorphology 的全心抗体染色方法进行研究, 以指导心脏自主神经系统特定靶点的识别和调制。前体 Langendorff 设置允许在短时间内进行大量的可重现实验。然而, 设置的部分开放性质 (e. g) 使恒温控制变得困难, 应保持在最低限度。该方法可以对分散心内心脏自主神经系统进行分析和调节。
引言
Langendorff 体外心脏灌注系统继续是一个相关的工具, 以执行广泛的生理, 生物化学, 形态学和药理学研究中枢失神经心脏 1,2 ,3,4,5自其发明在后期 19th世纪6。迄今为止, 该系统仍然广泛用于各种主题 (e. g, 缺血再灌注) 或研究心脏药理作用7,8, 是心血管研究的基本工具。这种方法的长寿源于几个优点 (e. g), 测量结果不受中枢神经系统或其他器官、系统循环或循环激素的影响。如有需要, 可以以控制方式将药物添加到灌注缓冲器或直接应用于特定结构。实验是可重现的, 在很短的时间内可以进行比较高的实验。(部分) 开放性质的设置可以使温度调节困难, 需要考虑。虽然 Langendorff 系统也用于较大的物种9, 但较小的动物主要用于实验性的设置不太复杂, 更大的生物变异性 (g., 转基因小鼠模型) 可以使用。
在本协议的实验设置中, 心内自主神经系统对基本电生理参数、心室心脏交感神经、心外膜传导、环腺苷 (阵营) 动力学的影响是评价。大量的心内神经节, 主要位于心房脂肪垫, 现在众所周知的控制心脏电生理独立于中枢神经控制, 要么保持完好或手动删除与仔细机械夹层。对自主神经系统的药理调节, 要么通过向灌注缓冲器添加药物, 要么在局部通过心房神经节的靶向调节来进行。实验后, 心脏是非常适合的免疫组织化学评估, 因为所有的血细胞已被删除由于连续灌注, 这可以提高染色质量。
所述技术的总体目标是为详细研究自主神经系统对心脏电生理和心脏交感神经的影响提供新的视角。使用这种技术的一个原因是, 在没有中枢神经系统影响的情况下, 可以研究和改变自主神经系统。一个主要的好处是容易的就业的药理实验, 其中潜在的亲或抗心律失常性质的新旧的药物可以测试。此外, 各种心脏疾病的转基因和击倒老鼠模型可以用来研究心律失常、心力衰竭或代谢性疾病的机制。这种方法增强了我们对心房的自主神经系统对心室心脏电生理的影响以及心律失常的诱导的理解。
研究方案
所有涉及动物的程序均由汉堡州、汉堡大学动物保育和使用委员会的地方当局批准。
1. Langendorff 装置的研制
注: 可使用商用 Langendorff 灌注系统。
- 制备改性克雷布斯-Henseleit 溶液 (119 毫米氯化钠、25毫米碳酸氢钠、4.6 毫米氯化钾、1.2 毫米磷酸钾磷酸钙、1.1 毫米硫酸镁、2.5 毫米氯化钙、8.3 毫米葡萄糖和2毫米钠)丙酮酸)。将 95% oxygen/5%carbon 的混合物添加到灌注液中, 以防止钙沉淀。用0.22 µm 的孔隙大小过滤缓冲区。
- 添加一个药理剂到缓冲, 以调查其对心脏电生理和心脏交感神经的影响, 根据需要。
- 启动水浴, 并将灌注液包括 95% oxygen/5%carbon 的混合物。调节水浴的温度, 使灌注液温度直接在套管前37˚C。
- 当达到正确的温度后, 启动辊泵, 并在设备上装入灌注液。
- 在连接心脏之前, 调整泵的速度, 这样在安装到设备上时, 套管内没有气泡被留下。
2. 硬软件准备
- 将数字数据采集系统及其相应的软件连接到 Langendorff 设备, 用于连续记录灌注压力、流速和心率。
- 将常规设置中的目标灌注压力设置为 80 mmHg。
- 开始录制。
- 使用电生理学导管 (材料表) 与铂电极, 电极表面 0.5 x 0.5 毫米, 和电极间距0.5 毫米的数据记录和刺激与指定的数字刺激发电机。
- 将导管放在靠近心脏的部位, 将其放置到设备的附件中。
- 通过从导管中选择2电极来准备刺激, 并使用100毫秒的周期长度。
3. 心脏的准备
- 加入冷 (~ 2-4 ˚C) 灌注缓冲 (10-20 毫升和 40-50 毫升, 因此整个盘子被盖) 对2培养皿 (直径 6 cm 和 10 cm) 和盘与套管并且安置他们在冰直接地其次和在显微镜下。在套管周围准备一个双结。
- 通过使用梅奥剪刀和窄模式钳打开胸腔, 快速切除颈椎脱位后的心脏。然后用伦敦钳夹住隔膜上方的主动脉和上腔静脉, 用斜视剪刀切开与脊柱相近的所有血管和结缔组织。
- 将心肺块转移到第一道菜 (6 厘米直径), 用冰冷的缓冲器填满, 小心地取出肺部, 而不损害心脏, 使用斜视剪刀和伦敦钳。然后将心脏放在显微镜下, 用弹簧剪刀和 SS 钳仔细去除胸腺、食道和气管。
- 用弹簧剪刀在右心房上部切开 1.5-2 毫米的孔, 插入导管。在肺动脉上切开一个洞。然后直接在 supraaortic 分支下切开主动脉, 从主动脉中取出组织, 使结能容易附着。
- 保持心房脂肪垫, 包括主要 atrially 位于 ganglionated 树脂, 周围的左心房完整或完全删除他们仔细解剖。
- 用套管把心脏转到盘子里, 把它放在显微镜下。将主动脉通过套管拉上, 并将准备好的结栓在主动脉周围。确保导管在主动脉中不放置太深, 使主动脉瓣膜和冠状动脉血管游离。
- 将套管快速连接到 Langendorff 装置。请确保套管内没有气泡。
- 将灌注压力转换为 80 mmHg, 允许恒定的压力灌注。
- 将导管小心插入右心房和右心室, 不接触或损害心脏, 用胶带将导管连接到套管。
- 开始刺激与准备的周期长度100毫秒的初始20分钟平衡期。
- 关闭房间, 使温度稳定。
4. 电生理参数和心脏交感神经
- 通过导管的远端或近端电极对心房或心室起搏阈值进行程序化刺激, 以评估电生理参数, 如以下步骤所述。
- 确定窦节点恢复时间为十年代后 S1S1 周期长度为120毫秒、100毫秒和80毫秒的固定速率起搏后的最大返回周期长度。
- 确定文氏点为最长的 S1S1 周期长度 (8 刺激;S1S1: 100 毫秒;2毫秒逐步减少), 损失 11 AV 节点传导。确定房室结节难治期为最长 S1S2 (12 项刺激;S1S1: 120 毫秒, 110 毫秒, 100ms;一个短耦合 extrastimulus 与2毫秒逐步 S1S2 减少) 与丧失 AV 节传导。
- 确定心房和心室难治期为最长 S1S2 (12 刺激;S1S1: 120 毫秒, 110 毫秒, 100ms;一个短耦合 extrastimulus 与2毫秒逐步 S1S2 减少) 与缺席心房或心室反应10,11。
- 执行编程 extrastimulation (S1S1: 120 毫秒, 100 毫秒, 80 毫秒, 其次是3额外节拍; 60-20 ms 以2毫秒逐步减少) 或爆裂起搏协议 (5 s 在 S1S1:50 毫秒以 10 ms 逐步减少) 与兰贝斯惯例符合 evaluate 心室心脏交感神经 10, 11, 12.
5. 心外膜传导测量
注: 记录单极心外膜电图使用128通道, 计算机辅助记录系统, 采样率为25赫的高分辨率映射。使用32多电极阵列 (多边环境协定; 电极间距离: 300 µm; 1.8 x 1.8 毫米)。请注意, 数据是带通滤波的 (50 Hz) 和数字化的12位和信号范围 20 mV。
- 将多边环境协定置于心脏的指定区域, 并将接地添加到心脏的另一部分13,14,15。
- 将心外膜刺激导管靠近多边环境协定, 并开始持续刺激。
- 通过检查信号质量和振幅, 确认电极良好接触后开始记录。
- 利用离线分析方法确定传导方向的波传播速度和色散。
6. Förster 共振能量转移 (烦恼) 的循环腺苷磷酸 (阵营) 成像
注: 对于基于焦虑的测量, 收获心脏从 CAG-Epac1-camps 转基因小鼠16。
- 在显微镜15、17周围使用自构建的成像系统。
- 把显微镜放在心脏前面, 调整它的视力。
- 激发带有光源的野营传感器 [例如, 使用单波长发光二极管 (440 nm)]。使用光束分配器将发射光分成供体和受体通道 (对于青色荧光蛋白/黄色荧光蛋白对, 使用565dcxr 分色镜和 D480/30 和 D535/40 发射过滤器)。
- 通过在会议厅周围放置一个塑料包装, 确保温度稳定。
- 使用一个科学的互补金属氧化物半导体 (sCMOS) 相机拍摄图像。与开源成像软件 (如微管理器) 协调光源和相机图像捕获。
- 要启动图像获取, 请推送多维 Acq。按钮和设置一个时间推移, 每十年代获取一个图像, 与适当的曝光时间, 这取决于荧光信号的强度 (大约100毫秒)。
- 使用以前描述和可用的联机烦恼和烦恼在线 2插件17将图像拆分为两个通道, 选择感兴趣的区域, 并监视比率跟踪。
- 在采集过程中, 根据实验的性质, 灌注了含有不同物质的改性克雷布斯 Henseleit 溶液的心脏。
- 在实验结束时, 通过推送停止按钮并保存图像堆栈来关闭获取。
- 使用专门的分析软件对烦恼数据进行离线分析, 它可以将图像分割为供方和受体通道的两个相同的部分, 并且可以在多个感兴趣的区域进行焦虑分析。
注意: 需要一个专用的插件 (烦恼脱机), 这是在 Sprenger et . 中提供的。17。- 启动软件。通过进入插件菜单, 然后单击事必躬亲, 然后在打开微管理器文件打开分析。
- 运行烦恼脱机插件, 以便将时间间隔分割为 CFP 和 YFP 通道的两个相同的图像。
- 使用手绘选项工具可以标记 YFP 图像中感兴趣的区域。按添加按钮将所选内容添加到多度量值窗口中。
- 在多值窗口中选择感兴趣的区域, 然后按多以获取每个帧和区域的平均灰度值的表。将所有数据复制并粘贴到 Excel 工作表中。
- 单击CFP 图像堆栈。执行与步骤6.10.4 中的 CFP 堆栈相同的操作, 并将平均灰色值粘贴到同一 Excel 工作表中。
- 在接受方通道17中, 为捐赠者的出血通过因子脱机更正原始数据。
- 使用以下公式, 其中 B 为出血系数:
比值 = (YFP x CFP)/CFP - 通过成像心脏仅表达 CFP 并测量 YFP 通道中供体荧光的百分比 (b = YFP/CFP) 确定出血通过因子 b。
- 使用以下公式, 其中 B 为出血系数:
7. Neuromorphology
注: 采用完整的小鼠心脏 immunostainings, 分析心脏自主神经系统。注意, 大部分心内神经节是局部的在心外膜脂肪组织接近肺静脉。
- 使用不同的染色描述丝 (一般神经元结构; 鸡抗 NF-H, 1:3, 000), 酪氨酸羟化酶 (TH, 交感神经结构; 兔α TH, 1:1, 000), 胆碱乙酰转移酶 (聊天, 副交感神经神经元结构;山羊α聊天, 1:50)。
- 在 Langendorff 装置中灌注后, 将10毫升福尔马林中的小鼠心脏固定24小时, 并将其储存在磷酸盐缓冲盐水 (PBS) 中, 4 ˚C。
- 漂白的心脏在凹痕的漂白剂 (4:1: 1 甲醇: 过氧化氢溶液 30% (w/w) 在 H2O: 二甲基亚砜 (亚砜)) 1 星期在4˚C 并且水化他们随后对 pbs 在一系列下降的甲醇在 pbs (100%, 75%, 50%, 25%; 1 H 每个)18。
- 以24井板格式执行以下孵化, 并在4˚C 中进行温和搅拌:
- Permeabilize 的心脏在 1% Triton-X-100/PBS (PBS t) 为 3x 1 小时在室温下阻断他们过夜在阻塞缓冲 [5% 牛血清白蛋白 (BSA)/PBS-T + 0.2% 叠氮化钠]。
- 稀释抗体如下: 山羊α聊天 (1:50), 兔子α TH (1:1, 000), 鸡α丝 (1:3, 000);荧光标签的二级抗体 (1:500; 或根据制造商的指示);生物素化二级抗体的显色标签 (1:200; 或根据制造商的指示)。
- 在4˚C 1 周, 在阻塞缓冲液中将原抗体中的标本孵育。
- 在4天内, 在阻断缓冲器中, 在第二抗体孵化前, 将心脏洗净 3 x 15 分钟。
- 在 PBS 中清洗 3 x 15 分钟的心脏, 并将它们存储在室温下进行荧光染色的安装介质中, 或者根据制造商的说明使用亲和生物素复合检测试剂盒。
- 在一个商业缓冲器中预孵化1小时的心脏, 用于 33 '-diaminobenzidine (民建联), 然后根据制造商的指示, 在包含有缓冲的缓冲器的视觉控制下开发它们。
- 将标本存放在双蒸馏水中。
- 石蜡切片, 脱水和嵌入的心脏石蜡。
- 切割4µm 厚的部分, 并根据实验室的例行程序 deparaffinize。是否和如何进行抗原检索需要建立每个单独的设置, 因为它取决于抗体组合。
- Permeabilize 10 分钟 0.2% Triton-X-100/Tris-buffered 盐水 (tb), 其次是 3 X 5 分钟洗涤在 tb。
- 在室温下, 用 3% BSA/tb 的1小时阻挡它们。
- 一夜之间孵化4˚C [主要抗体: 山羊α聊天 (1:50), 兔子α TH (1:500), 鸡α丝 (1:1, 000)] 或 2 h 在室温下 (荧光标记的二级抗体, 1:500) 在 1% BSA 或 tb 与 3 x 5 分钟洗涤之间的 tb。
- 添加1µg/毫升的 bisbenzimide H33342 三盐酸盐二次抗体溶液或使用不同的核染色方法。
- 将幻灯片安装在安装介质中进行荧光染色。
结果
图 1显示了 Langendorff 设置的映像, 其中包括2个多电极阵列 (多边环境协定)。实验前, 心内导管定位在套管附近, 方便快速方便地插入右心房/右心室, 确保在平衡开始之前有很短的时间。房间的下部可以提高 (请参见图 1中的箭头), 以使会议厅完全闭合并保证稳定的温度。
图 2描述了不同的具有代表性的心脏染色。在图 2A中, 介绍了石蜡切片的苏木精和伊红 (H & E) 染色。在示范性扩大 (图 2B) 中, 一个心房神经节的免疫组化染色显示了主要的副交感神经细胞 (红色, 聊天阳性) 相比, 较少的交感神经细胞 (绿色, TH 阳性)。在图 2CE中, 神经的免疫组化染色 (图 2C, 绿色, 丝) 和交感神经纤维 (图 2D, 红色, TH) 以及两个图像的叠加 (图 2E) 描述了神经纤维如何通过冠状动脉窦向后心室穿过心房。
图 3显示了小鼠心脏连接到 Langendorff 装置的套管上, 在右心房和右心室插入 octapolar 导管, 并将心外膜多电极阵列 (多边环境协定) 放置在左心室 (图 3A)。通过 RV 电极的心室心律失常敏感性测试显示在图 3B中。心脏室性心动过速在部分心房神经支配后的诱导更频繁发生。在放大的多边环境协定 (图 3C) 中, 介绍了电极的示意图布局。重要的是要确保一个稳定的心外膜接触所有电极。在图 3D中, 描述了由多边环境协定记录的经离线分析的心外膜传导。
图 4显示了在整个心脏被 retrogradely 灌注在 Langendorff 装置中的烦恼测量。可以根据需要分析心脏的不同区域 (图 4A)。在这个安装程序中, 可以很容易地使用全球性的和局部的药物应用 (图 4B)。

图 1: Langendorff 设置, 包括多电极阵列 (多边环境协定).octapolar 刺激和记录导管放置在靠近心脏的部位。当心脏连接到仪器后, 房间下部会向上移动 (白色箭头), 从而确保稳定的温度。请单击此处查看此图的较大版本.
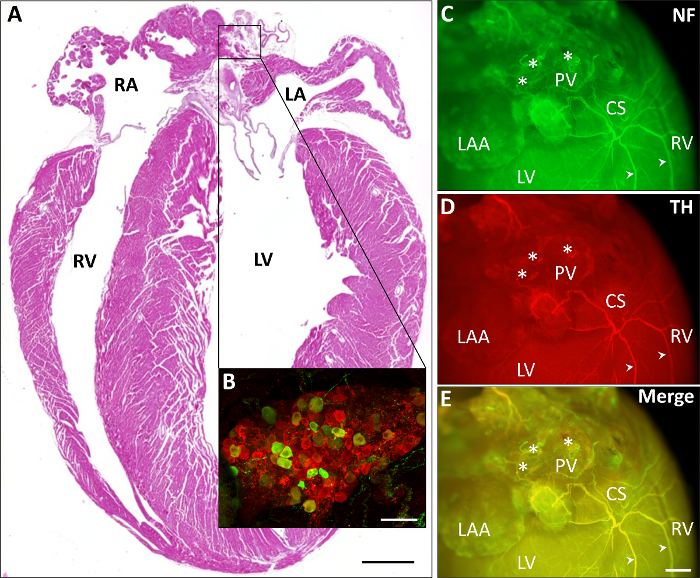
图 2: 心脏整体芒染色描绘自主神经系统的部分. A)描述心脏 H & E 染色石蜡切片 (缩放条1毫米)。B)一个免疫组化染色心房神经节的模范扩大表明, 主要的副交感神经细胞 (红色, 聊天阳性) 相比较少众多的交感神经细胞 (绿色, TH 阳性; 鳞片酒吧75µm)。C E)具有代表性的免疫组化染色 (图2C、绿色、丝、NF) 和交感神经纤维 (图 2D、红色、TH 和它们在图 2E中的叠加) 通过冠状动脉窦 (CS) 穿过心房, 朝向后心室。模范纤维由箭头标记。星号表示心房神经节。鳞片酒吧1毫米 LA, 左心房;LV, 左心室;NF, 丝;PV, 肺静脉;RA, 右心房;RAA, 右心房附属物;RV 右心室请单击此处查看此图的较大版本.
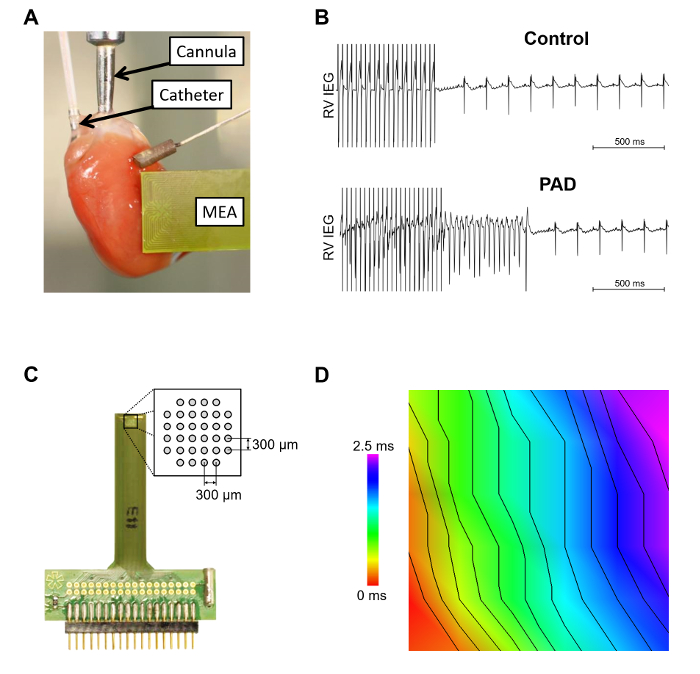
图 3: 使用 Langendorff 设置的内部和心外膜测量.A. 此面板显示了 Langendorff 系统中小鼠心脏的一个例子。在右心房和心室插入心内 octapolar 导管, 并描述一个心外膜多电极阵列。B. 采用无 (控制) 爆裂刺激或诱导自终室性心动过速 [在部分心房神经支配 (垫)] 的情况下进行心律失常敏感性试验。C. 所述的心外膜多边环境图与示意图电极布局的扩大有关。D. 利用自定义软件对波传播速度进行了分析。isochrones 之间的距离是2米/秒.请单击此处查看此图的较大版本.

图 4: 在 Langendorff 设置中烦恼测量.A. differentcAMP 的两个生物传感器荧光通道 [黄色荧光蛋白 (YFP) 和青色荧光蛋白 (CFP)] 在逆行灌注心脏的焦虑测量中被描述。如有需要, 可分析心脏的不同部位 (如: 例如、心房和心室) (刻度条1毫米)。B. 此面板显示一个典型的焦虑实验, 它测量在心房和左心室的药理刺激过程中的阵营水平。首先, 心脏被系统地灌注与 adenylyl 酶激活 NKH477, 佛司可林 analogon, 以增加阵营水平。然后尼古丁被局部地应用和靶向心房神经节, 从而大大降低了营地的水平。请单击此处查看此图的较大版本.
讨论
本论文通过不同的制图和刺激技术, 提出了 Langendorff 的体外心脏灌注系统作为研究心内神经元对心脏电生理和心脏交感神经的影响的工具. 包括心内膜和心外膜的方法。
协议的几个部分对于安装来说是至关重要的。首先, 重要的是使用一种制备技术, 其中心房脂肪垫保持完好或迅速删除, 而不伤害心肌。第二, 适当大小的开放必须削减在右心房, 以方便插入 octapolar 导管进入右心房和右心室。导管应容易滑入右心室而不产生任何压力。在导管连接到套管时, 导管不应深入脑室, 避免心脏损伤。第三, 温度控制是所有 Langendorff 设置的关键部分1,2,5。热室在心律失常测试期间关闭, 确保温度稳定。但对于多边环境协定或烦恼录音, 分庭至少需要部分开放, 以允许测量。无论是记录时间应保持在最低限度, 或其他技术, 以减少温度损失, 如在更长的测量在房间内放置塑料包装, 应进行。第四, 在所有实验中, 应将多边环境协定置于相同的解剖位置。良好的表面接触, 在实时分析中得到大振幅的证实, 可以通过在相对位置上使用两个多边环境协定来实现, 从而产生平衡。第五, 烦恼测量受到运动的影响。为了减少自发性运动, 心脏是在一个稳定的频率由心内导管。为了进一步稳定, 有轻微真空的管子可以稳定顶点。
Langendorff 系统的一个优点是, 心脏可以随后用于免疫组织化学评估的心脏神经系统。连续灌注可去除大多数红细胞, 其自体荧光的高度为19, 提高染色质量。在福尔马林固定后, 心脏可以储存在温度控制 (4 ˚C) 环境中, 磷酸盐缓冲盐水长达一年, 没有明显变化的染色质量。
这个设置的最重要的特点是所有的测量都是在中央神经支配的心脏执行。主要的副交感神经心房内神经节是最后的继电器在心脏20作为交感神经节阻滞位于 intrathoracically 和因此被去除在准备期间。虽然心内神经元没有中央输入, 但已经表明, 他们仍然积极的生理方式, 因为心脏交感神经 photoactivation 增加心率和心脏收缩力21。根据这些发现, 支持心内神经元在中枢失神经心脏的功能重要性, 我们最近展示了它们对心室功能和心脏交感神经15的影响.
这种中枢性失神经设置的一个优点是, 它允许研究员研究不同的心内区域神经网络 (例如, 心房和心室之间的相互作用) 之间的交流15。这些差异可能是有关的心脏移植后患者治疗与选择性窦节点调制器 ivabradine 改善生存, 与治疗与 beta 阻滞剂美托洛尔 (22)。在未来的一步, 直接电刺激副交感神经 (迷走神经) 或交感神经结构 (Ggl. 阻滞23) 将有助于提高我们的知识的相互作用的额外和内心脏自主神经系统。
重要的是要记住, 副交感神经和交感神经纤维大多是共同本地化, 以便目前的治疗, 如导管消融的心房或室性心律失常将不可避免地改变两个结构。在这里描述的设置, 可以研究靶向结构的局部药物修饰 (例如, 对副交感神经神经节的特定刺激)。除了有针对性的修改外, 采用不同药物 (例如, β受体阻滞剂) 的全球灌注是很容易的, 因此可以研究各种药物的潜在致心律失常或抗心律失常性质。使用这种设置, 可以在刺激或抑制心内自主神经系统的不同部位时进行干预和不同的技术测试, 揭示自主神经系统特定部位的影响信息对心功能和心脏交感神经。此外, 小鼠的设置允许研究心脏自主神经系统的疾病, 如心肌梗死, 心力衰竭或糖尿病。
总之, 简单而知名的 Langendorff 体外心脏灌注系统为改变和研究心内神经元对心脏电生理和心脏交感神经的影响提供了灵活的基础.
披露声明
作者没有什么可透露的。
致谢
作者感谢 Hartwig Wieboldt 出色的技术援助, 以及汉堡-离心大学医学中心的 UKE 显微成像设施 (Umif) 提供显微镜和支持。这项研究是由 Förderverein des Universitären Herzzentrums 汉堡 e 和 DZHK (德国心血管研究中心) [FKZ 81Z4710141] 资助的。
材料
| Name | Company | Catalog Number | Comments |
| Sodium chloride | Sigma-Aldrich | S3014 | Modified Krebs-Henleit solution |
| Sodium hydrogencarbonate | Sigma-Aldrich | 401676 | Modified Krebs-Henleit solution |
| Potassium chloride | Sigma-Aldrich | P5405 | Modified Krebs-Henleit solution |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | Modified Krebs-Henleit solution |
| Magnesium sulfate heptahydrate | Sigma-Aldrich | M1880 | Modified Krebs-Henleit solution |
| Calcium chloride dihydrate | Sigma-Aldrich | C7902 | Modified Krebs-Henleit solution |
| Glucose | Sigma-Aldrich | G5767 | Modified Krebs-Henleit solution |
| Sodium pyruvate bioXtra | Sigma-Aldrich | P8574 | Modified Krebs-Henleit solution |
| Carbogen (95% O2 / 5% CO2) | SOL-Group, TMG Technische und Medizinische Gas GmbH, Krefeld, Gersthofen, Germany | Modified Krebs-Henleit solution | |
| Sterile filter steritop-GP 0.22 | EMD Millipore | SCGPT05RE | Modified Krebs-Henleit solution |
| Atropine sulfate | Sigma-Aldrich | A0257 | Neuromodulation |
| Hexamethonium chloride | Sigma-Aldrich | H2138 | Neuromodulation |
| Nicotine free base 98-100% | Sigma-Aldrich | N3876 | Neuromodulation |
| Formalin solution neutral buffered 10% | Sigma-Aldrich | HT501128 | Whole mount staining |
| Tris(hydroxymethyl)aminomethane | Sigma-Aldrich | 252859 | Whole mount staining |
| Methanol | Sigma-Aldrich | 34860 | Whole mount staining |
| Hydrogen peroxide solution 30% (w/w) in H2O | Merck, KGA, Darmstadt, Germany | H1009 | Whole mount staining |
| Dimethyl sulfoxide | Merck, KGA, Darmstadt, Germany | D8418 | Whole mount staining |
| Phosphate-buffered saline tablets | Gibco / Invitrogen | 18912-014 | Whole mount staining |
| Triton-x-100 | Sigma-Aldrich | T8787 | Whole mount staining |
| Albumin bovine fraction V | Biomol, Hamburg, Germany | 11924.03 | Whole mount staining |
| Chicken anti neurofilament | EMD Millipore | AB5539 | Whole mount staining |
| Rabbit anti tyrosine hydroxylase | EMD Millipore | AB152 | Whole mount staining |
| Goat anti choline acetyltransferase | EMD Millipore | AP144P | Whole mount staining |
| Donkey α rabbit IgG Alexa 488 | Thermo Fisher Scientific | A21206 | Whole mount staining |
| Donkey α goat IgG Alexa 568 | Thermo Fisher Scientific | A11057 | Whole mount staining |
| Donkey α chicken IgY Alexa 647 | Merck, KGA, Darmstadt, Germany | AP194SA6 | Whole mount staining |
| Biotin-conjugated donkey α rabbit igG | R&D Systems | AP182B | Whole mount staining |
| Biotin-conjugated donkey α goat igG | R&D Systems | AP192P | Whole mount staining |
| Biotin-conjugated goat α chicken igY | R&D Systems | BAD010 | Whole mount staining |
| Vectashield mounting medium | Vector laboratories, Burlingame, CA, USA | H-1000 | Immunohistochemistry |
| Vectastain ABC kit | Vector laboratories, Burlingame, CA, USA | PK-4000 | Immunohistochemistry |
| Steady DAB/Plus | Abcam plc, Cambridge, UK | ab103723 | Whole mount staining |
| HistoClear | DiaTec, Bamberg, Germany | HS2002 | Immunohistochemistry |
| BisBenzimide H33342 trihydrochloride (Hoechst) | Sigma-Aldrich, St. Louis, MO, USA | B2261 | Immunohistochemistry |
| Vectashield HardSet mounting medium | Vector laboratories, Burlingame, CA, USA | VEC-H-1400 | Immunohistochemistry |
| Perfusion system | HUGO SACHS ELEKTRONIK - HARVARD APPARATUS GmbH, March-Hugstetten, Germany | 73-4343 | Langendorff apparatus |
| Data acquisition system and corresponding software for catheter and physiological parameter | Powerlab 8/30 & Labchart, ADInstruments, Dunedin, New Zealand | PL3508 PowerLab 8/35 | Langendorff setup |
| Octapolar catheter | CIB’ER Mouse, NuMed Inc., Hopkinton, NY, USA | custom | Langendorff setup |
| Stimulus generator | STG4002, Multi Channel Systems, Reutlingen, Germany | STG4002-160µA | Stimulation setup |
| Stimulation software | Multi Channel Systems, Reutlingen, Germany | MC_Stimulus II | Stimulation setup |
| Data acquisition system and corresponding software for epicardial electrograms | ME128-FAI-MPA-System, Multi Channel Systems, Reutlingen, Germany | USB-ME128-System | MEA setup |
| Multi-electrode array | MEA, EcoFlexMEA36, Multi Channel Systems, Reutlingen, Germany | EcoFlexMEA36 | MEA setup |
| Multi-electrode array recording software | Multi Channel Systems, Reutlingen, Germany | MC_Rack | MEA setup |
| Spring scissors | Fine Science Tools GmbH, Heidelberg, Germany | 15003-08 | Heart Preparation |
| Strabismus Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14575-09 | Heart Preparation |
| Mayo Scissors | Fine Science Tools GmbH, Heidelberg, Germany | 14110-15 | Heart Preparation |
| Dumont SS Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11203-25 | Heart Preparation |
| London Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11080-02 | Heart Preparation |
| Narrow Pattern Forceps | Fine Science Tools GmbH, Heidelberg, Germany | 11003-13 | Heart Preparation |
| Plastic Wrap | Parafilm M, Bemis NA, based in Neenah, WI, United States | Consumable Materials | |
| Stereomicroscope | Leica M165FC; Leica Microsystems GmbH, Wetzlar, Germany | FRET | |
| LED | CoolLED, Andover, UK | pE-100 | FRET |
| DualView | Photometrics, Tucson, AZ, USA | DV2-SYS | FRET |
| DualView filter set | Photometrics, Tucson, AZ, USA | 05-EM | FRET |
| optiMOS scientific CMOS camera | Qimaging, Surrey, BC, Canada | 01-OPTIMOS-R-M-16-C | FRET |
| Imaging software | Micro-Manager; Vale Lab, University of California San Francisco, CA, USA | FRET | |
| Analysis Software | Image J software; Public Domain, NIH, USA | FRET | |
参考文献
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research. 41 (6), 613-627 (2000).
- Hearse, D. J., Sutherland, F. J. Experimental models for the study of cardiovascular function and disease. Pharmacological Research. 41 (6), 597-603 (2000).
- Valentin, J. P., Hoffmann, P., De Clerck, F., Hammond, T. G., Hondeghem, L. Review of the predictive value of the Langendorff heart model (Screenit system) in assessing the proarrhythmic potential of drugs. Journal of Pharmacological and Toxicological Methods. 49 (3), 171-181 (2004).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff-still viable in the new millennium. Journal of Pharmacological and Toxicological Methods. 55 (2), 113-126 (2007).
- Langendorff, O. Investigation of the living mammalian heart. Pflügers Archiv. 61, 291-332 (1895).
- Matsumoto-Ida, M., Akao, M., Takeda, T., Kato, M., Kita, T. Real-time 2-photon imaging of mitochondrial function in perfused rat hearts subjected to ischemia/reperfusion. Circulation. 114 (14), 1497-1503 (2006).
- Rassaf, T., Totzeck, M., Hendgen-Cotta, U. B., Shiva, S., Heusch, G., Kelm, M. Circulating nitrite contributes to cardioprotection by remote ischemic preconditioning. Circulation Research. 114 (10), 1601-1610 (2014).
- Schechter, M. A., et al. An isolated working heart system for large animal models. Journal of Visualized Experiments. 88 (88), 51671 (2014).
- Stockigt, F., et al. Total beta-adrenoceptor knockout slows conduction and reduces inducible arrhythmias in the mouse heart. PLoS One. 7 (11), e49203 (2012).
- Berul, C. I. Electrophysiological phenotyping in genetically engineered mice. Physiological Genomics. 13 (3), 207-216 (2003).
- Curtis, M. J., et al. The Lambeth Conventions (II): guidelines for the study of animal and human ventricular and supraventricular arrhythmias. Pharmacology & Therapeutics. 139 (2), 213-248 (2013).
- Schrickel, J. W., et al. Enhanced heterogeneity of myocardial conduction and severe cardiac electrical instability in annexin A7-deficient mice. Cardiovascular Research. 76 (2), 257-268 (2007).
- Rudolph, V., et al. Myeloperoxidase acts as a profibrotic mediator of atrial fibrillation. Nature Medicine. 16 (4), 470-474 (2010).
- Jungen, C., et al. Disruption of cardiac cholinergic neurons enhances susceptibility to ventricular arrhythmias. Nature Communications. 8, 14155 (2017).
- Calebiro, D., et al. Persistent cAMP-signals triggered by internalized G-protein-coupled receptors. PLoS Biology. 7 (8), e1000172 (2009).
- Sprenger, J. U., Perera, R. K., Götz, K. R., Nikolaev, V. O. FRET microscopy for real-time monitoring of signaling events in live cells using unimolecular biosensors. Journal of Visualized Experiments. (66), e4081 (2012).
- Alanentalo, T., et al. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nature Methods. 4 (1), 31-33 (2007).
- Whittington, N. C., Wray, S. Suppression of red blood cell autofluorescence for immunocytochemistry on fixed embryonic mouse tissue. Current Protocols in Neuroscience. 81, 2.28.1-2.28.12 (2017).
- Fukuda, K., Kanazawa, H., Aizawa, Y., Ardell, J. L., Shivkumar, K. Cardiac innervation and sudden cardiac death. Circulation Research. 116 (12), 2005-2019 (2015).
- Wengrowski, A. M., Wang, X., Tapa, S., Posnack, N. G., Mendelowitz, D., Kay, M. W. Optogenetic release of norepinephrine from cardiac sympathetic neurons alters mechanical and electrical function. Cardiovascular Research. 105 (2), 143-150 (2015).
- Rivinius, R., et al. Control of cardiac chronotropic function in patients after heart transplantation: effects of ivabradine and metoprolol succinate on resting heart rate in the denervated heart. Clinical Research in Cardiology. , (2017).
- Ajijola, O. A., et al. Augmentation of cardiac sympathetic tone by percutaneous low-level stellate ganglion stimulation in humans: a feasibility study. Physiological Reports. 3 (3), e12328 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。