Method Article
Строительство тиоэфиры/Винил сульфид-привязанный винтовой пептиды через фото-индуцированной тиоловых СВ/yne Hydrothiolation
В этой статье
Резюме
Мы представляем собой протокол для строительства тиоэфиры/Винил сульфид привязанный винтовой пептиды с помощью фото индуцированной тиоловых СВ/тиоловых yne hydrothiolation.
Аннотация
Здесь мы описываем подробный протокол для подготовки привязал тиоэфиры пептиды, используя на смолы внутримолекулярной/межмолекулярных тиоловых Ен hydrothiolation. Кроме того этот протокол описывает подготовку Винил сульфид привязанный пептиды, используя в решение внутримолекулярной тиоловых yne hydrothiolation между amino acids, которые обладают алкен/алкины боковых цепей и остатков цистеина в я, я + 4 позиции. Линейные пептиды были синтезированы, с использованием стандарта на основе Fmoc пептид Твердофазный синтез (ППУ). Тиоловых Эне hydrothiolation осуществляется с использованием внутримолекулярного Тио-реакций или межмолекулярных Тио Эне реакции, в зависимости от длины пептида. В этом исследовании реакция внутримолекулярной Тио Эне осуществляется в случае коротких пептидов, используя на смолы deprotection групп trityl остатков цистеина, после полный синтез линейных пептид. Смола затем устанавливается с помощью фотоинициатора 4-methoxyacetophenone (карта) и 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone (СПП) УФ-облучения. Реакции межмолекулярной тиоловых Эне осуществляется путем растворения Fmoc-КМС-OH в N, N- диметилформамид (DMF) растворителя. Это затем реагирует с пептида, используя остатки алкен подшипник на смоле. После этого macrolactamization осуществляется с помощью Гексафторофосфат Бензотриазол-1-yl-oxytripyrrolidinophosphonium (PyBop), 1-hydroxybenzotriazole (HoBt) и 4-Methylmorpholine (НММ) как Активация реагентов на смолы. После macrolactamization, продолжал пептидного синтеза с использованием стандартных ППУ. В случае Тио yne hydrothiolation линейной пептид расщепляется из смолы, сушеные и впоследствии распущен в дегазации ДМФ. Это затем облученных, с использованием ультрафиолетового света с фотоинициатора 2,2-диметокси-2-phenylacetophenone (ДМПА). После реакции ДМФ испаряется и сырой осадок осаждается и очищается с помощью высокопроизводительных жидкостной хроматографии (ВЭЖХ). Эти методы могут функционировать для упрощения поколения привязал тиоэфиры циклические пептиды благодаря использованию химии Тио СВ/yne нажмите кнопку, которая обладает превосходной функциональной группы терпимости и хороший урожай. Введение тиоэфиры облигаций в пептиды использует преимущества природы нуклеофильных остатков цистеина и окислительно-инертен по отношению к дисульфидными облигаций.
Введение
Разработка лигандов для модуляции белок белковых взаимодействий (ИЦП) обеспечивает привлекательный подход для современных лекарственных препаратов. Таким образом много усилий было вложено в изучение Роман химических методов, которые могут эффективно модулировать ИЦП1,2,3. ИЦП обычно состоят из мелких, большой или прекращено взаимодействующих поверхностей, и малые молекулы, обычно считаются неподходящими лигандов для модуляции ИЦП4,5. С подходящим подвергаются взаимодействующих площадью поверхности короткие пептиды, которые имитируют структурные особенности белка интерфейсов представляют собой идеальные кандидаты для решения этой проблемы6,7. Однако короткие пептиды, обычно неструктурированные в водном растворе. Это связано с тем, что молекулы воды, которые конкурируют с сетью склеивание внутримолекулярных водородных пептид позвоночника и четко конформации entropically неблагоприятных в воды8. Кроме того пептиды имманентно низкой стабильности и проницаемость свойства ячейки во многом ограничить их использование в биологических приложений9,10. Согласно результатам анализа банка данных (PDB), белка > 50% ИЦП включать короткие α-спирали взаимодействия11. Таким образом различные химические методы были разработаны в отношении стабилизации спирали. К ним относятся дисульфида/тиоэфиры Бонд формирования12,13,14, кольцо закрытие метатеза15, лактамные кольцо формирования16, «щелкните «химия17, добавление perfluoroarenes18,19и винил сульфидные формирования20.
Стабилизированный винтовой пептиды, широко используются для различных внутриклеточных целей, в том числе p53, эстрогеновых рецепторов, РАН, BCL-2 семьи белки и другие21,,2223,24. ALRN-6924, все углеводородов прошит двойной ингибитор пептид MDM2 и MDMX, в настоящее время используется для клинического расследования25. В последние несколько лет наша группа сосредоточила внимание на разработке методов стабилизации Роман пептид с помощью тиоловых Эне тиоловых yne реакции26,,27и28. В общем мы продемонстрировали, что эти фото инициатором реакции эффективны в мягких условиях, когда естественно используется обильные цистеина. Кроме того мы показали, что эти реакции имеют отличные функциональные группы терпимость, био ортогональные и доказали быть применимым для пептидов и белков изменения29. Результате пептиды сульфид привязал тиоэфиры/Винил основном улучшения химического пространства ограничения пептиды, предоставляют центр лабильной модификации на трос и доказано, чтобы быть применимы для использования в многочисленных биологических приложений30 ,,31-32. На сегодняшний день, были описаны только ограниченное доклады относительно тиоловых СВ/тиоловых yne пептид циклизации. В исследовании, опубликованном в Anseth et al. в 2009 году на смолы внутримолекулярной тиоловых реакций для пептида циклизация между активированные алкенов с цистеином был показали33. В 2015 году Чжоу и др. описал двухкомпонентный радикальной начатый тиоловых реакций для пептида, сшивание34 и последующих, последовательные тиоловых yne/Восточный муфта реакции35. Недавно мы описали ряд работы на основе тиоэфиры/Винил сульфид привязал пептиды20,26,27. Этот протокол описывает подробный синтез пептидов сульфид привязал вышеупомянутых тиоэфиры/винил в надежде, что это будет полезно для более широкого исследовательского сообщества.
протокол
1. Оборудование для подготовки
- Для ручной пептидного синтеза аппарата Поместите вакуумный коллектор (Таблица материалов) в эффективной зонта. Следующий место трехходовые запорные краны на вакуумный коллектор и подключить их к линии газом азота или аргона. Крышка все неиспользованные отверстия с помощью резиновых перегородками.
- Подключите смолы заполнены столбцы (0,8 x 4 см, 10 мл водохранилище, смотрите Таблицу материалы) к коллектору, используя трехходовые запорные краны (рис. 1). Использование насоса подключен к вакуумной системы вакуумной фильтрации или резиновую грушу пипеткой путем выдавливания для удаления растворителя в столбцах.
- Использование photoreactor (рис. 2), оснащенных лампами десять 350 Нм (Таблица материалов) для УФ-облучения. Подключите их к танку газ аргон через photoreactor впуска воздуха для обеспечения что photoreactor заполняется газом Аргон до и во время photoreactions.
- Перед включением в УФ-лампе photoreactor, убедитесь, что photoreactor дверь закрыта в случае облучения от ультрафиолета.
2. смола подготовка
Примечание: В общем, строительство пептидных субстратов осуществляется с использованием протоколов на основе Fmoc пептид Твердофазный синтез. Они проводятся с использованием смолы Амида каток, который оставляет C-терминал Амида оставшиеся следующие пептид расщепления. Этот протокол используется во всем документе.
Предупреждение: N, N- диметилформамид (DMF), дихлорметана (DCM), 4-methylmorpholine (НММ) и N, N- diisoproylethylamine (DIPEA) являются токсичными и вредное при вдыхании, при приеме внутрь или контакта с кожей. Диэтиловый эфир легко воспламеняется. Trifluoroacetic кислоты (ТФК) коррозионные. 1,2-ethanedithiol (EDT) весьма зловонный. Таким образом все органических растворителей и химических веществ следует обработаны с соответствующие средства индивидуальной защиты (нитриловые перчатки, лабораторный халат и защитные очки) и обрабатываются внутри химического зонта.
- Рассчитайте количество смолы, необходимо, по следующей формуле:
масштаб (ммоль) / (смола грузоподъемность (ммоль/г) 1000 (мг/г)) = масса смолы (мг)
Например, количество каток Амид MBHA смолы (0.5 ммоль/г) для 25 мкмоль = 0,025 ммоль / (0.5 ммоль/г 1000 мг/г) = 50 мг. Далее весят 50 мг смолы в столбце и установить его на вакуумный коллектор с помощью трехходовые запорные краны. - Добавьте 1-2 мл DCM смолы в столбце (0,8 x 4 см, 10 мл водохранилище). Смола пухнуть, нежно агитируйте его с помощью азота или аргона поток за 10 мин. Далее удалите растворителя, с использованием вакуумной фильтрации.
3. N-терминальный Fmoc Deprotection и мытья
- Подготовка Fmoc N-стержня, deprotecting решение: готовить достаточное количество морфолина 50% (v/v) в DMF в стеклянной бутылке (200 мл).
- Добавить 1-2 мл deprotection раствора смолы, нежно агитировать за 10 мин и затем слейте решения с помощью вакуума. С помощью функции DMF (1-2 мл) и DCM (1-2 мл) в таком порядке, мыть смолы и реакционный сосуд тщательно для в общей сложности 3 x. Далее, повторите процедуры deprotection и вымыть 1 x.
4. Fmoc защищенных аминокислоты муфта
- Использование сцепного устройства аланин остатков в качестве примера, в случае ручной синтез 25 мкмоль шкала, весят Fmoc-Ала-OH (5 экв, 41.4 мг), 2-(6-chloro-1H-benzotriazole-1-yl)-1,1,3,3-tetramethylaminium Гексафторофосфат (HCTU; 4.9 экв, 50,5 мг) в полипропиленовые контейнера и растворить его в DMF (0,5 мл).
- Добавить DIPEA (10 экв, 43,5 мкл) для того, чтобы генерировать 0.25-М активированный раствор амино кислоты (таблица 1). После предварительной активации приблизительно 1 мин добавить решение в смоле, а затем пузырь с N2 для примерно 1-2 ч.
- От этого шага на включения каждой аминокислоты в цепи пептида как последовательность шагов: сначала deprotection N-терминал Fmoc группы, и затем стирки, следуют муфта аминокислоты через активацию с помощью HCTU.
Примечание: Муфта дольше (например., ч. 2) рекомендуется если муфта после труднодоступных препятствуют аминокислотных остатков [например., Fmoc-Чет (tBu) - ой, Fmoc-Cys (Trt) - OH, Fmoc-его (Trt) - ой, Fmoc-Arg (Pbf) - OH]. Алкены/алкины, принимая неестественное аминокислоты используются в 3 эквиваленты вместо 5 и вынуждены реагировать на 3 ч. - С помощью Кайзер или хлоранила тестов, как описано в Арора et al. ходом синтеза пептида 36 эти тесты предоставляют качественные оценки присутствия или отсутствия бесплатные первичные и вторичные амины. Кроме того примерно 2-3 мг пептида можно расщепляется из смолы и проанализированы LC-MS.
5. тиоловых Ен Hydrothiolation и циклизации тиоловых yne
- Постройте тиоэфиры компоновщика через по смолы циклизация (рис. 3).
- Подготовьте примерно 50 мл раствора deprotection Trt (TFA/TIS/DCM 0.03/0.06/1.0). Лечить Cys и mS5-принимая смолы [NH2-R-mS5-A-A-A-Cys (Trt)-R'-смолы, 50 мг] с 1-2 мл раствора deprotection ТРТ в колонке 10-мл. Аккуратно агитируйте решение для 10 мин с использованием N2. Наконец, промойте его с DCM (1-2 мл) для в общей сложности 3 x.
Примечание: MS5 представляет alkylene подшипник строительный блок (см. структура изображена на рис. 6) используется для пептида муфтой и Тио Эне циклизация38. - Повторите процедуру, описанную выше для в общей сложности примерно 6 x, чтобы удалить группу защиты trityl цистеина, до тех пор, пока решение цвет больше не желтый.
- Кипела с N2, мыть R-mS5- A-A-A-Cys(-SH)-R'-смолы [хвоща с бесплатным Тио (-SH)] с DMF (1-2 мл) и DCM (1-2 мл) в указанном порядке. Сжать смолы с использованием метанола (1-2 мл) за 2 мин, а затем удалить растворителя, с помощью фильтрации. Далее последовательно сухой смолой под паром N2 газа приблизительно 5 минут в столбце.
- Подготовьте дегазацию ДМФ заранее, в рот колбу, восходящей газ азот для примерно 1 час через длинные иглы, которая протянулась в растворитель.
- Перевести смолы в 10-мл круглодонные колбу через вес бумаги. Приостановить смолы в 2 мл дегазацию ДМФ, с последующим добавлением фотоинициатора 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone (MMP; 1 экв, 5,6 мг), 4-methoxyacetophenone (карта; 1 экв, 3,8 мг).
- Добавить движение бар (0,3 см) в колбу и крышка колбу с подходящей резиновой заглушкой, а затем вытеснить воздух в колбу с газом азота с использованием масляного насоса.
Примечание: Инертной атмосфере не строго необходим для эффективного Тио Эне фотореакционного на твердой фазы. Однако это очень необходимо для фотореакционного Тио yne в фазе раствора на рисунке 5. В противном случае сера будет окисляются при УФ-облучения. - Установите колбу реакции в photoreactor и перемешайте смолы для 1 h под УФ облучения при комнатной температуре (рис. 2).
Предупреждение: Перед включением photoreactor УФ-лампы, убедитесь, что photoreactor дверь закрыта в случае, если нет вредного излучения от ультрафиолета.
Примечание: Часто выборки реакционной смеси во время photoreactions рекомендуется для новых последовательностей, как прекурсор линейной пептид имеет идентичные молекулярный вес продукта. В общем линейные и циклические пептиды отображения гидрофильность значительно отличаются. Это может быть легко отличить с помощью ВЭЖХ. Кроме того, 5, 5' - dithiobis-(2-nitrobenzoic кислота) (DTNB) реагента могут также использоваться для изучения присутствие свободного тиоловых37. - Перевести смолы из колбы в столбце и удаление растворителя, с использованием вакуумной фильтрации. Вымойте и высушите смолы, как описано в шаге 5.1.3.
- Подготовьте примерно 10 мл коктейль расщепления (TFA/советы/EDT/H2O 94/1/2.5/2.5) в зонта.
- Передавать смолы в 2-мл полипропиленовые контейнер, добавить 1 мл декольте коктейль (TFA/советы/EDT/H2O 94/1/2.5/2.5) к контейнеру и печать контейнер плотно с помощью винтовой крышкой. Затем аккуратно агитируйте контейнера на орбитальный шейкер со скоростью 60 rpm в Зонта на 1,5-2 ч.
Предупреждение: TFA сильнокоррозионные. Носите защитную одежду и работать в эффективной зонта. EDT является весьма зловонные вещества и должны быть обработаны в эффективной зонта. - Удалите TFA коктейль испарение под поток газа N2 в зонта. Далее, осадить остатков, с использованием холодного диэтиловым эфиром (1 мл) для 30 s и изолировать его через центрифугирования в 12000 x g на 2 мин. После центрифугирования аккуратно вылейте компонент эфира. Повторите шаги, осадок и центрифугирования для 2 x. Испарения остатков к сухости.
- Наконец, растворяют остатки в 1 мл H2O/Ацетонитрил (2:1) и очистить, ВЭЖХ, с помощью столбца аналитически C18 (4.6 x 250 мм, расход 1.0 мл/мин). Использование H2O (содержащий 0.1% TFA) и чистой Ацетонитрил как растворители в 2%/min линейный градиент от 20% до 70% Ацетонитрил над 25 мин Monitor ВЭЖХ спектры с использованием УФ 280 Нм и 220 Нм длины волн (таблица 2).
- Подготовьте примерно 50 мл раствора deprotection Trt (TFA/TIS/DCM 0.03/0.06/1.0). Лечить Cys и mS5-принимая смолы [NH2-R-mS5-A-A-A-Cys (Trt)-R'-смолы, 50 мг] с 1-2 мл раствора deprotection ТРТ в колонке 10-мл. Аккуратно агитируйте решение для 10 мин с использованием N2. Наконец, промойте его с DCM (1-2 мл) для в общей сложности 3 x.
- Постройте тиоэфиры компоновщик посредством межмолекулярных Тио-реакций и затем cyclize пептида, macrolactamization (рис. 4).
- Синтезировать alkylene остатков, подшипник линейного пептид H2N-A-A-A-mS5(2-R'')-R'-смолы (50 мг) с помощью стандартных на основе Fmoc пептид Твердофазный синтез (ППУ), как описано в разделе шаги 2-4. Затем вымойте и высушите смолы, как описано в шаге 5.1.3.
- Приостановите смолы в круглодонные колбе 10-мл, содержащих 2 мл дегазацию ДМФ, как описано в шаге 5.1.4.
- Добавьте фотоинициатора ММП и карту (MMP: 1 экв, 5,6 мг; Карта: 1 экв, 3,8 мг), Fmoc-КМС-OH (3 экв, 25.7 мг) и перемешать бар (0,3 см) в колбу. Крышка колбу с помощью подходящего резиновой заглушкой, а затем использовать масляный насос для замены воздуха в колбу с азотом.
- Набор фляга реакции в photoreactor. Мешайте в течение 1-2 h под УФ облучения при комнатной температуре (рис. 2).
- Контролировать реакцию под анализ LC-MS: Клив 2-3 мг смолы, используя декольте коктейль. Затем осадок остатков с холодной диэтиловым эфиром (300 мкл), изолировать остатки центрифугированием и испарения остатков к сухости, как описано в шаге 5.1.11. После этого растворяют остатки в 100 мкл H2O/Ацетонитрил (2:1). Фильтрата пептида решения с помощью 0,22 мкм микропористый фильм и проанализировать его с помощью LC-MS с ионизированной в электроспрей ионизации (ESI), и в положительных режиме.
- Если необходимо, повторите шаги 5.2.2 - 5.2.4 для обеспечения реакции осуществляется до завершения.
- После завершения Фото реакции передача смолы из колбы в столбце и удаление растворителя, с использованием вакуумной фильтрации. Вымойте и высушите смолы, как описано в шаге 5.1.3.
- Добавьте решение ДМФ Гексафторофосфат Бензотриазол-1-yl-oxytripyrrolidinophosphonium (PyBob; 2.4 экв, 31,2 мг), 1-hydroxybenzotriazole (HoBt; 2.4 экв, 8.1 мг) и NMM (4 экв, 11 мкл) смолы в столбце macrolactamization. Пузырь это решение с N2 по 2 ч.
- Кроме того следить за этой муфты реакции с использованием LC-MS, как описано в шаге 5.2.3. При необходимости повторите этот шаг для обеспечения реакции осуществляется до завершения.
- Удлиненное пептид, с использованием стандарта на основе Fmoc ППУ, как описано в шагах 3 и 4.
- После сборки всех аминокислотных остатков расщеплять пептид из смолы, как описано в шагах 5.1.10 и 5.1.11 и очистить его, как описано в шаге 5.1.12.
- Постройте Винил сульфид компоновщика в фазе раствора (рис. 5).
- Синтезировать алкины остатки подшипников линейного пептид с использованием стандарта на основе Fmoc ППУ, как описано в шагах 2-4. Синтезировать алкины, принимая аминокислоты согласно устоявшейся протокол, как описано в предыдущем исследовании20.
- Расщеплять пептид из смолы и ускорять его с помощью холодной диэтиловым эфиром, как описано в шагах 5.1.9 - 5.1.11. После расщепления и осадков смолы собирайте пептид с помощью центрифугирования в 12000 x g на 2 мин.
- Сухие полученный остаток в вакууме. Растворяют остатки в дегазации DMF (50 мл) в 100 мл флакон круглодонные для того, чтобы добраться до конечной концентрации 0,5 мм (основанный на загрузку смолы, 0,025 ммоль (1000 мл/Л / 0.5 ммоль/Л) = 50 мл).
- Добавьте фотоинициатора ДМПА (0,5 экв, 3,2 мг) и затем Дега реакция решение для 10 мин с использованием N2 через длинные иглы, протянул в раствор. Далее облучать образца под УФ света при комнатной температуре на 0,5 - 1 ч без агитации.
- Удаление ДМФ под высоким вакуумом и осадить сырой осадок, добавив диэтиловым эфиром для того чтобы растворить его органических побочных продуктов. Затем изолируйте остатков с помощью центрифугирования в 12000 x g на 2 мин. После центрифугирования аккуратно вылейте компонент эфира. Испарения остатков к сухости. Наконец растворяют остатки в 1 мл раствора H2O/Ацетонитрил (2:1) и очистить его с помощью ВЭЖХ, как описано в шаге 5.1.7.
Результаты
ВЭЖХ и МС спектры пептидов Ac-YmS5AAAC-NH2 и продукта его cyclized Ac - Y-(цикло-1,5)-[mS5AAAC] - NH2 , которые были созданы с использованием на смолы внутримолекулярной тиоловых Эне фотореакционного изображены в Рисунок 6B. циклические пептиды было установлено иметь идентичные молекулярный вес по отношению к линейной прекурсоров. Однако его время удержания ВЭЖХ было отмечено раньше, чем его прекурсоров на тех же условиях разделения будет около 2 мин. Короткие пептиды с различными последовательностями все наблюдались иметь хорошие преобразования, как показано на рисунке 6 c.
Процесс отбора для условий фотореакционного Тио yne изображен Рисунок 7B, и преобразование изомер и соотношение были определены с использованием интеграции реверс фаза ВЭЖХ. Только уровни трассировки пептид 2c наблюдались после УФ-облучения. Это, вероятно, вследствие конформационные предпочтения для треппинга радикальной на N-го thiyl во время Договаривающихся шага к 20-membered макроцикл. Пептиды 1a и 1b были найдены для создания двух изомеров с 8-член Винил сульфид crosslink. Пептиды 2a-A и 2a-B, которые были получены от пептида 1a, выставлены раз собственный удержания, а также различные коэффициенты для различных УФ облучения раз (0 - 30 мин) (рис. 7 c). Эти были назначены как изомеры E/Z силу сигналов Протон двойную связь на 1H ЯМР спектроскопии (рис. 7 d). В случае пептиды 2d-2f Z-изомер найден быть доминирующим продуктом. Это, вероятно, вследствие конформационные предпочтения во время строительства компактной структуры относительно 8-член Винил сульфид crosslink. Как показано на рисунке 7E, согласно спектра круговой дихроизма (CD), пептиды 2a-A/B и 2b-A/B, которые обладают 8-член Винил сульфид crosslink экспонат случайных катушки, а пептид 2d, который обладает 7-член Винил сульфид crosslink экспонатов винтовой конформации. В резюме Z-изомер Винил сульфид облигаций было установлено предпочтительно образовываться и отображается лучше индукции спирали.

Рисунок 1: ручной пептид синтез аппарат для твердой фазы пептидного синтеза. Столбцы были размещены на вакуумный коллектор через запорные краны трехходовые и аппарат был подключен к линии газом азота или аргона для восходящей. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: photoreactor устройство, используемое для photoreactions. Устройство было оснащенных лампами десять 350 Нм (Таблица материалов) для УФ-облучения и баком газа аргона для обеспечения, что photoreactor был заполнен аргоном до и во время photoreactions. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: смола внутримолекулярной тиоловых Эне реакции в случае коротких пептидов. Эта реакция была осуществляется с помощью deprotection на смолы trityl групп остатков цистеина, после полного синтеза линейных пептида и задайте смолы для УФ-облучения, с помощью фотоинициаторы карта и СПП. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: смола реакции межмолекулярной Тио Эне. Эта реакция был проведен путем растворения Fmoc-КМС-OH в DMF растворителя и затем облученного с пептидной алкен подшипник остатков на смолы, а затем macrolactamization с помощью PyBop, HoBt и NMM как Активация реагентов. Затем продолжил пептидного синтеза с использованием стандартного ППУ. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: внутримолекулярной тиоловых yne реакция в фазе раствора. Эта реакция была проведена в фазе раствора после полный синтез линейных пептид, после чего линейной пептид был распущен в дегазации DMF и облученном с помощью УФ-излучения с фотоинициатора ДМПА. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
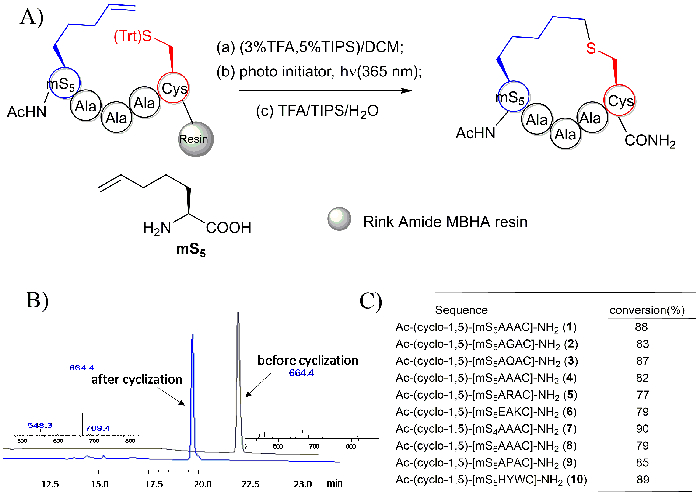
Рисунок 6: тиоэфиры привязал циклические пептиды, создается с помощью реакции на смолы внутримолекулярной тиоловых Эне. А. Эта группа показана схема реакции на смолы внутримолекулярной Тио Эне. mS5: «m» представляет моно замещенных olenic аминокислоты, «S» представляет амино кислоты S настроено, а «5» относится к числу боковой цепи атомов38. Б. этой панели показывает ВЭЖХ и МС спектры пептида Ac-YmS5AAAC-NH2 до и после его циклизации. C. Эта панель показывает преобразование циклические пептиды с различными последовательностями. Эта цифра была изменена с Чжао, B. 28 et al. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
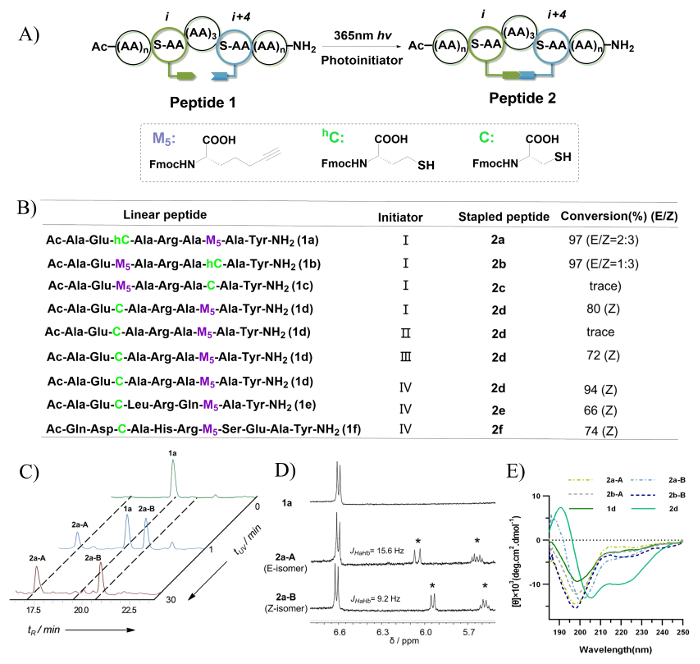
Рисунок 7: Скрепление пептида через фото индуцированной тиоловых yne hydrothiolation. А. это схематическое изображение внутримолекулярной тиоловых yne hydrothiolation. Б. Эта панель показывает пептид последовательности оценивается в этом исследовании. Инициатор: (I) 0,5 экв ДМПА, 1 ч; (II) не инициатор, 1 ч; (III) 0,5 экв ДМПА, 0,5 экв карта, 1 ч; (IV) 0,5 экв ММП, 0,5 ч. C. Эта панель показывает следы ВЭЖХ реакционной смеси 1А пептид с различными УФ облучения раз и контролироваться на 220 Нм. Д. Эта панель показывает 1H ЯМР спектрах 1a, 2a-A, и 2a-B (измеряется в ДМСО d6 в 400 МГц). Звездочки указывают на формирование Винил сульфид двойную связь после УФ-облучения. Е. этой панели отображается круговой дихроизма спектры пептидов с винила сульфид перекрестные ссылки. Эта цифра была изменена от Тянь, ю. и др. 44 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Материалы | МВТ | N(0.5mmol / g смолы × 0. 0 5 g × 5eq.) | М(аминокислоты) (мг) |
| (Да) | (ммоль) | ||
| Fmoc-Gly-OH | 297 | 0.125 | 37,1 |
| Fmoc Ала OH | 331 | 0.125 | 41,4 |
| Fmoc Валь OH | 339 | 0.125 | 42,4 |
| Fmoc леи OH | 353 | 0.125 | 44.1 |
| Fmoc Иль OH | 353 | 0.125 | 44.1 |
| Fmoc-Pro-OH | 337 | 0.125 | 42,1 |
| Fmoc пе OH | 387 | 0.125 | 48,4 |
| Fmoc-Tyr (tBu)-OH | 460 | 0.125 | 57,5 |
| Fmoc ГТО (БП)-OH | 527 | 0.125 | 65,9 |
| Fmoc-Ser (tBu)-OH | 384 | 0.125 | 48 |
| Fmoc-Чет (tBu)-OH | 398 | 0.125 | 49,8 |
| Fmoc-Cys (Trt)-OH | 586 | 0.125 | 73,3 |
| Fmoc встретились OH | 372 | 0.125 | 46,5 |
| Fmoc-Asn (Trt)-OH | 597 | 0.125 | 74,6 |
| Fmoc-Gln (Trt)-OH | 611 | 0.125 | 76,4 |
| Fmoc-Asp (OtBu)-OH | 412 | 0.125 | 51,5 |
| Fmoc-Glu (OtBu)-OH | 426 | 0.125 | 53,3 |
| Fmoc Лис (БП)-OH | 469 | 0.125 | 58,6 |
| Fmoc-Arg (Pbf)-OH | 617 | 0.125 | 77,1 |
| Fmoc его (Trt)-OH | 620 | 0.125 | 77,5 |
| HCTU | 414 | 0.122 | 50,5 |
| DIPEA | 129 | 0.25 | 43.5(ΜL) |
| ДМФ | 0,5 мл | ||
Таблица 1: Количество условий соединения.
| Колонка | Zorbax SB-Aq столбец, 4,6 × 250 мм (размер пор 80 Å, частиц размером 5 мкм) |
| Растворители | A: воды, 0,1% (vol/vol) TFA; B: Ацетонитрил |
| Скорость потока | 1 мл/мин |
| Градиент | B 20 – 70% (vol/vol) свыше 25 мин; 70% - 98% более 5 мин; 98% более 5 мин; |
| Объем впрыска | 30 – 500 МКЛ |
| Длина волны (Нм) | 280 (для Fmoc-, ГТО - или Tyr содержащих пептидов), или 494 (FITC-меченых пептидов) или 220 (для других) |
Таблица 2: Высокая производительность жидкостной хроматографии условий.
Обсуждение
В на смолы внутримолекулярной Тио Эне циклизация, описанные на рис. 3удаление trityl группы остатков цистеина оказалась важным шагом для последующего фотореакционного. Кроме того низкомолекулярных пептидов до и после, что реакция оказалась идентичной как изображены на рисунке 6B. Таким образом использование ВЭЖХ определение или DTNB анализа требуется для того, чтобы контролировать реакцию. В случае реакции межмолекулярной Тио Эне, описанные на рис. 4MS мониторинг является необходимым. В то время как еще один шаг лактамные сцепления был найден для строительства тиоэфиры троса необходимо, мы предлагаем, что этот протокол будет использоваться для длительного пептидов в целях общего повышения эффективности.
Бонд сульфид винил, генерируемые фотореакционного Тио yne не был стабильным в сильно Кислотный раствор TFA, которая используется для расщепления смолы. Таким образом использование фотореакционного Тио yne в стадии решение принимается. Эта реакция была разбавляют до низкой концентрации (0.5 мм) во избежание потенциальных межмолекулярного взаимодействия путем реакций. Не менее важно также Дега растворителя для того, чтобы избежать окисления продукта во время photoreactions. После реакции вакуумного испарения органических растворителей ДМФ следует также тщательно осуществляться во избежание пептид окисления/деградации или механизм амортизации. Реакции циклизации Тио yne, изображенный на рисунке 5 обеспечивает механизм для изменения после пептидного синтеза35.
Хотя реакция внутримолекулярной тиоловых Эне успешно тиоэфиры привязал пептиды с хорошим преобразования, простой тиоэфиры перекрестных ссылок не ограничивают пептидов в желаемой винтовой конформации. Основываясь на этой модификации на троса стратегии, была разработана концепция Спиральность индуцированных пептида в троса хиральный центр, где γ замещенных группы с конфигурацией R на пептида C-терминал был в состоянии побудить пептид винтовой конформацию ( Рисунок 4)39,40. Ограничение, связанное с этим подходом является синтез enantiomerically чистой неестественные аминокислоты с двумя хиральных центров (α (S), γ(R)),41-42.
Это исследование показало, что Тио yne реакцию может сдерживать пептида в винтовой конформации с хорошим преобразования, как показано на рис 7E. С точки зрения строительства винтовой пептиды мы рекомендуем фотореакционного Тио yne для строительства винтовой пептиды. На смолы внутримолекулярной Тио Эне циклизация был продемонстрирован пригодны для строительства коротких тиоэфиры троса пептидов (менее 15) в случае, если долго пептиды слишком гибким, чтобы обеспечить эффективное циклизации. Кроме того на смолой межмолекулярные Тио Эне циклизация рекомендуется для длинные пептид циклизации.
Таким образом мы разработали ряд химических протоколов для строительства тиоэфиры/Винил сульфид привязал пептиды с использованием фотоиндуцированной нажмите Тио СВ/Тио yne химии. Реакция является эффективным, металлический катализатор свободной, удобной для манипуляции и была продемонстрирована обладают превосходной функциональной группы терпимости и био ортогональные. Кроме того этот метод был разработан для того, чтобы стабилизировать другие пептидных вторичных структур, таких как β-заколка43,44. Этот документ показывает, что tether тиоэфиры обеспечивает бесследного изменения сайта. Это во многом расширяет химического пространства после модификации синтез пептида. Кроме того, алифатических тиоэфиры/Винил сульфид привязал пептидов, которые выставлены снижение мембраны токсичность по отношению к углеводородов штапельные пептиды применяются в различных биологических приложений с продемонстрировали хорошую биологическую и Биодоступность-45,46.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы признают финансовой поддержки от естественных наук Китая гранты фонда (№ 21372023, 21778009 и 81701818); Министерство науки и техники Китайской Народной Республики (№ 2015DFA31590); Шэньчжэнь науки и технологии инновации Комитет (No. JCYJ20170412150719814, JCYJ20170412150609690, JCYJ20150403101146313, JCYJ20160301111338144, JCYJ20160331115853521, JSGG20160301095829250 и GJHS20170310093122365); и Китай Докторантура научный фонд (№ 2017 М 610704).
Материалы
| Name | Company | Catalog Number | Comments |
| Rink Amide MBHA resin(0.53 mmol/g) | HECHENG | GRM50407 | |
| Standard Fmoc-protected amino acids | GL Biochem (Shanghai) Ltd. | ||
| N-Methyl-2-pyrrolidinone | Shenzhen endi Biotechnology Co.Ltd. | 3230 | skin harmful |
| N,N-Dimethyl formamide | Energy | B020051 | skin harmful |
| Dichloromethane | Energy | W330229 | skin harmful |
| N,N-Diisoproylethylamine | Aldrich | 9578 | irritant |
| Trifluoroacetic acid | J&K | 101398 | corrosive |
| Triisopropylsilane | J&K | 973821 | |
| 1,2-Ethanedithiol | J&K | 248897 | Stench |
| 2-(6-Chloro-1H-benzotriazole-1-yl)-1,1,3,3-tetramethylaminium hexafluorophosphate | GL Biochem (Shanghai) Ltd. | 851012 | |
| Morpholine | Aldrich | M109062 | irritant |
| Diethyl ether | Aldrich | 673811 | flammable |
| Acetonitrile | Aldrich | 9758 | toxicity |
| Methanol | Aldrich | 9758 | toxicity |
| 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone | Energy | A050035 | |
| 4-methoxyacetophenone | Energy | A050098 | |
| 2,2-dimethoxy-2-phenylacetophenone | Energy | D070132 | |
| 5,5'-Dithiobis-(2-nitrobenzoic acid) | J&K | 281281 | |
| Benzotriazole-1-yl-oxytripyrrolidinophosphonium hexafluorophosphate | Energy | E020172 | |
| 1-Hydroxybenzotriazole | Energy | D050256 | |
| 4-Methylmorpholine | Energy | W320038 | |
| High Performance Liquid Chromatography | SHIMADZU | LC-30AD | |
| Electrospray Ionization Mass | SHIMADZU | LCMS-8030 | |
| Lyophilizer | Labconco | FreeZone | |
| SpeedVac concentration system | Thermo | Savant | |
| vacuum manifold | promega | A7231 | |
| three-way stopcocks | Bio-Rad | 7328107 | |
| poly-prep chromatography columns | Bio-Rad | 7311550 |
Ссылки
- Pelay-Gimeno, M., Glas, A., Koch, O., Grossmann, T. N. Structure-based design of inhibitors of protein-protein interactions: mimicking peptide binding epitopes. Angewandte Chemie International Edition. 54 (31), 8896-8927 (2015).
- Passioura, T., Katoh, T., Goto, Y., Suga, H. Selection-based discovery of druglike macrocyclic peptides. Annual Review of Biochemistry. 83, 727-752 (2014).
- Gonzalez, M. W., Kann, M. G. Protein interactions and disease. PLoS Computational Biology. 8 (12), 1-11 (2012).
- Wilson, A. J. Inhibition of protein-protein interactions using designed molecules. Chemical Society Reviews. 38 (12), 3289-3300 (2009).
- Teresa, A. F. C., Alessio, C. Cyclic and macrocyclic peptides as chemical tools to recognise protein surfaces and probe protein-protein interactions. ChemMedChem. 11 (8), 787-794 (2016).
- Craik, D. J., Fairlie, D. P., Liras, S., Price, D. The future of peptide-based drugs. Chemical Biology & Drug Design. 81 (1), 136-147 (2013).
- Cromm, P. M., Spiegel, J., Grossmann, T. N. Hydrocarbon stapled peptides as modulators of biological function. ACS Chemical Biology. 10 (6), 1362-1375 (2015).
- Zhang, Q. Z., Tian, Y., Lao, Y. Z., Li, Z. G. Peptides-staple method development and its application in cancer therapy. Current Medicinal Chemistry. 21 (21), 2438-2452 (2014).
- Cromm, P. M., Spiegel, J., Grossmann, T. N. Hydrocarbon stapled peptides as modulators of biological function. ACS Chemical Biology. 10 (6), 1362-1375 (2015).
- Wang, D., Liao, W., Arora, P. S. Enhanced metabolic stability and protein-binding properties of artificial alpha helices derived from a hydrogen-bond surrogate: application to Bcl-xL. Angewandte Chemie International Edition. 44 (40), 6525-6529 (2005).
- Bullock, B. N., Jochim, A. L., Arora, P. S. Assessing helical protein interfaces for inhibitor design. Journal of the American Chemical Society. 133, 14220-14223 (2011).
- Jackson, D. Y., King, D. S., Chmielewski, J., Singh, S., Schultz, P. G. General approach to the synthesis of short α-helical peptides. Journal of the American Chemical Society. 113 (24), 9391-9392 (1991).
- Timmerman, P., Beld, J., Puijk, W. C., Meloen, R. H. Rapid and quantitative cyclization of multiple peptide loops onto synthetic scaffolds for structural mimicry of protein surfaces. ChemBioChem. 6 (5), 821-824 (2005).
- Muppidi, A., Wang, Z., Li, X., Chen, J., Lin, Q. Achieving cell penetration with distance-matching cysteine cross-linkers: a facile route to cell-permeable peptide dual inhibitors of Mdm2/Mdmx. Chemical Communications. 47 (33), 9396-9398 (2011).
- Schafmeister, C. E., Po, J., Verdine, G. L. An all-hydrocarbon cross-linking system for enhancing the helicity and metabolic stability of peptides. Journal of the American Chemical Society. 122 (24), 5891-5892 (2000).
- Osapay, G., Taylor, J. W. Multicyclic polypeptide model compounds. 1. synthesis of a tricyclic amphiphilic alpha-helical peptide using an oxime resin, segment-condensation approach. Journal of the American Chemical Society. 112 (16), 6046-6051 (1990).
- Lau, Y. H., Andrade, d. P., Wu, Y., Spring, D. R. Peptide stapling techniques based on different macrocyclisation chemistries. Chemical Society Reviews. 44 (1), 91-102 (2015).
- Spokoyny, A. M., Zou, Y., Ling, J. J., Yu, H., Lin, Y. S., Pentelute, B. L. A perfluoroaryl-cysteine S(N)Ar chemistry approach to unprotected peptide stapling. Journal of the American Chemical Society. 135 (16), 5946-5949 (2013).
- Lautrette, G., Touti, F., Lee, H. G., Dai, P., Pentelute, B. L. Nitrogen arylation for macrocyclization of unprotected peptides. Journal of the American Chemical Society. 138 (27), 8340-8343 (2016).
- Tian, Y., et al. Stapling of unprotected helical peptides via photoinduced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- Chang, Y. S., et al. Stapled α-helical peptide drug development: a potent dual inhibitor of MDM2 and MDMX for p53-dependent cancer therapy. Proceedings of the National Academy of Sciences of the United States of America. 110 (36), 3445-3454 (2013).
- Zhao, H., et al. Crosslinked aspartic acids as helix-nucleating templates. Angewandte Chemie International Edition. 55 (39), 12088-12093 (2016).
- Leshchiner, E. S., et al. Direct inhibition of oncogenic KRAS by hydrocarbon-stapled SOS1 helices. Proceedings of the National Academy of Sciences of the United States of America. 112 (6), 1761-1766 (2015).
- Wang, D., Qin, X., Zhao, H., Li, Z. N-cap helix nucleation: methods and their applications. Science China Chemistry. 60 (6), 689-700 (2017).
- Zorzi, A., Deyle, K., Heinis, C. Cyclic peptide therapeutics: past, present and future. Current Opinion in Chemical Biology. 38, 24-29 (2017).
- Hu, K., et al. An in-tether chiral center modulates the helicity, cell permeability, and target binding affinity of a peptide. Angewandte Chemie International Edition. 55 (28), 8013-8017 (2016).
- Lin, H., Jiang, Y., Zhang, Q., Hu, K., Li, Z. An in-tether sulfilimine chiral center induces helicity in short peptides. Chemical Communications. 52 (68), 10389-10391 (2016).
- Zhao, B., Zhang, Q., Li, Z. Constructing thioether-tethered cyclic peptides via on-resin intra-molecular thiol-ene reaction. Journal of Peptide Science. 22 (8), 540-544 (2016).
- Dondoni, A., Massi, A., Nanni, P., Roda, A. A new ligation strategy for peptide and protein glycosylation: photoinduced thiol-ene coupling. Chemistry. 15 (43), 11444-11449 (2009).
- Hu, K., Sun, C., Li, Z. Reversible and versatile on-tether modification of chiral-center-induced helical peptides. Bioconjugate Chemistry. 28 (7), 2001-2007 (2017).
- Shi, X., Jiang, Y., Yang, D., Zhao, H., Tian, Y., Li, Z. Reversibly switching the conformation of short peptide through in-tether chiral sulfonium auxiliary. Chinese Chemical Letters. , (2017).
- Jiang, Y., et al. Switching substitution groups on the in-tether chiral centre influences backbone peptides' permeability and target binding affinity. Organic & Biomolecular Chemistry. 15 (3), 541-544 (2017).
- Aimetti, A. A., Shoemaker, R. K., Lin, C. C., Anseth, K. S. On-resin peptide macrocyclization using thiol-ene click chemistry. Chemical Communications. 46 (23), 4061-4063 (2010).
- Wang, Y. X., Chou, D. H. C. A thiol-ene coupling approach to native peptide stapling and macrocyclization. Angewandte Chemie International Edition. 54 (37), 10931-10934 (2015).
- Wang, Y., et al. Application of thiol-yne/thiol-ene reactions for peptide and protein macrocyclizations. Chemistry. 23 (29), 7087-7092 (2017).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Ozyurek, M., Baki, S., Gungor, N., Celik, S. E., Guclu, K., Apak, R. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, Q. Z., et al. Chiral sulfoxide-induced single turn peptide α-helicity. Scientific Reports. 6, 38573 (2016).
- Lin, H., et al. An in-tether sulfilimine chiral center induces beta-turn conformation in short peptides. Organic & Biomolecular Chemistry. 14 (42), 9993-9999 (2016).
- Hu, K., Li, W., Yu, M., Sun, C., Li, Z. Investigation of cellular uptakes of the in-tether chiral-center-induced helical pentapeptides. Bioconjugate Chemistry. 27 (12), 2824-2827 (2016).
- Hu, K., et al. A precisely positioned chiral center in an i, i + 7 tether modulates the helicity of the backbone peptide. Chemical Communications. 53 (50), 6728-6731 (2017).
- Li, J., et al. An in-tether chiral center modulates the proapoptotic activity of the KLA peptide. Chemical Communications. 53 (75), 10452-10455 (2017).
- Zhao, B., et al. A thioether-stabilized-D-proline-L-proline-induced β-hairpin peptide of defensin segment increases its anti-Candida albicans ability. ChemBioChem. 17 (15), 1416-1420 (2016).
- Tian, Y., Yang, D., Ye, X., Li, Z. Thioether-derived macrocycle for peptide secondary structure fixation. The Chemical Record. 17 (9), 874-885 (2017).
- Hu, K., Yin, F., Yu, M., Sun, C., Li, J., Liang, Y., Li, W., Xie, M., Lao, Y., Liang, W., Li, Z. G. In-tether chiral center induced helical peptide modulators target p53-MDM2/MDMX and inhibit tumor growth in stem-like cancer cell. Theranostics. 7 (18), 4566-4576 (2017).
- Tian, Y., Jiang, Y., Li, J., Wang, D., Zhao, H., Li, Z. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: a comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены