Method Article
Construcción de Thioether/sulfuro de vinilo-atado Hydrothiolation de péptidos helicoidales mediante foto-inducida tiol-eno/Ino
En este artículo
Resumen
Presentamos un protocolo para la construcción de vinilo thioether sulfuro atado helicoidales péptidos mediante foto-inducida tiol-ene/tiol-Ino hydrothiolation.
Resumen
Aquí, describimos un protocolo detallado para la preparación de péptidos thioether atado con hydrothiolation en resina intramolecular/intermoleculares tiol-ene. Además, este protocolo describe la preparación de péptidos vinilo-sulfuro-atado con hydrothiolation en solución tiol-Ino intramolecular entre residuos de cisteína y producto que poseen cadenas laterales de alkene/alquino en i, i + 4 posiciones. Péptidos lineales fueron sintetizados usando una síntesis de péptidos de fase sólida basado en el Fmoc estándar (SPPS). Tiol-ene hydrothiolation se lleva a cabo mediante una reacción intramolecular de thio-ene o una reacción intermolecular thio-ene, dependiendo de la longitud del péptido. En esta investigación se lleva a cabo una reacción intramolecular de thio-ene en el caso de péptidos más cortos utilizando en resina de desprotección de los grupos del trityl de después de la completa síntesis del péptido lineal de residuos de cisteína. La resina entonces se fija a la irradiación UV con fotoiniciador 4-methoxyacetophenone (mapa) y 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone (MMP). La reacción intermolecular tiol-ene se lleva a cabo por Fmoc-Cys-OH se disuelve en un solvente de N, N- dimetilformamida (DMF). Esto es entonces reaccionó con el péptido utilizando el residuo de alkene-rodamiento en la resina. Después de eso, la macrolactamization se lleva a cabo utilizando hexafluorofosfato de benzotriazol-1-yl-oxytripyrrolidinophosphonium (PyBop), 1-hydroxybenzotriazole (TOHB) y 4-Methylmorpholine (NMM) como reactivos de activación en la resina. Después de la macrolactamization, se continúa la síntesis de péptidos mediante SPPS estándar. En el caso de la hydrothiolation de thio-Ino, el péptido lineal es hendido de la resina, secado y posteriormente se disuelve en DMF desgasificada. Esto entonces se irradia con luz UV de fotoiniciador 2,2-dimetoxi-2-Fenilacetofenona (DMPA). Después de la reacción, DMF se evapora y el residuo crudo se precipita y purificado utilizando cromatografía líquida de alto rendimiento (HPLC). Estos métodos podrían funcionar para simplificar la generación de péptidos cíclicos thioether atado debido al uso de la química click thio-eno/Ino que posee grupo funcional superior tolerancia y buen rendimiento. La introducción de bonos thioether péptidos aprovecha la naturaleza nucleofílica de residuos de cisteína y es redox inertes con respecto a enlaces de disulfuro.
Introducción
El desarrollo de ligandos para modular las interacciones proteína-proteína (IBP) proporciona un enfoque atractivo para el descubrimiento de medicamentos modernos. Así, se ha invertido mucho esfuerzo en estudiar modalidades química novedosas que eficientemente podrían modular los IBP1,2,3. Protones generalmente consisten en superficies de interacción superficiales, grandes o descontinuadas, y pequeñas moléculas típicamente se consideran ligandos inadecuados para la modulación de los IBP4,5. Con una conveniente expuesta interacción superficie, péptidos cortos que mímico las características estructurales de las interfaces de proteínas representan los candidatos ideales para abordar este problema6,7. Sin embargo, los péptidos cortos son típicamente no estructurados en una solución acuosa. Esto es debido a que las moléculas de agua que compiten con la red de enlace de hidrógeno intramolecular del esqueleto peptídico y conformaciones bien definidas son entropically desfavorables en agua8. Además, los péptidos inherentemente baja estabilidad y propiedades de permeabilidad de la célula en gran medida limitan su uso en aplicaciones biológicas9,10. Según el análisis del Banco de datos (PDB) de proteínas, > 50% de los IBP implican interacciones de α-hélice corta11. Así, se han desarrollado diferentes métodos químicos con respecto a la estabilización de la hélice. Éstos incluyen disulfuro/thioether enlace formación12,13,14, ring-closing metathesis15, anillo de lactama formación16, "haga clic en" química17, además de perfluoroarenes18,19y de la formación de sulfuro de vinilo20.
Estabilizado los péptidos helicoidales se utilizan ampliamente para diversos objetivos intracelulares, como p53, estrógeno receptores, Ras, BCL-2 familia las proteínas y otros21,22,23,24. ALRN-6924, un hidrocarburo de todo grapado inhibidor dual de péptido de MDM2 y MDMX, está siendo usado para investigación clínica25. En los últimos años, nuestro grupo se ha centrado en el desarrollo de métodos de estabilización de novedoso péptido con tiol-ene y tiol-Ino reacciones26,27,28. En general, hemos demostrado que estas reacciones iniciadas por foto son eficientes condiciones suaves cuando naturalmente se utiliza abundante cisteína. Además, hemos demostrado que estas reacciones tienen una tolerancia excelente grupo funcional, son bio-orthogonal y ha demostrado para ser aplicable para péptidos y proteínas modificaciones29. Los péptidos resultantes de sulfuro atado thioether vinilo en gran medida mejoran el espacio químico de péptidos de restricción, ofrecen un centro de modificación en tether lábil y ha demostrado para ser aplicable para su uso en numerosas aplicaciones biológicas30 ,31,32. Hasta la fecha, se han descrito solamente limitados informes sobre la ciclación de péptidos tiol-ene/tiol-Ino. En un estudio publicado por Anseth et al. , en 2009, una reacción en resina intramolecular tiol-ene para la ciclación de péptidos entre alquenos activados con cisteína fue demostrado33. En el año 2015, Chou et al. se describe una reacción de dos componentes iniciado radical tiol-ene para péptido grapado34 y una reacción de acoplamiento de eno-Ino/tiol posterior, secuencial35. Recientemente, hemos descrito una serie de trabajos basados en vinilo thioether sulfuro atado péptidos20,26,27. Este protocolo describe una detallada síntesis de los péptidos de sulfuro atado de vinilo thioether mencionados en la esperanza de que sea útil para la comunidad de investigación.
Protocolo
1. preparación de equipo
- Para el aparato de síntesis de péptidos manual, coloque un colector de vacío (Tabla de materiales) en una eficiente campana extractora. A continuación, colocar llaves de tres vías sobre el colector de vacío y conectar a una tubería de gas nitrógeno o argón. Todas las entradas no utilizadas mediante tabiques de goma de la tapa.
- Conectar columnas llenas de resina (0,8 x 4 cm, depósito de 10 mL, ver Tabla de materiales) al colector utilizando las llaves de tres vías (figura 1). Utilice una bomba conectada a un sistema de vacío como filtración de vacío o un bulbo de la pipeta de goma por extrusión para eliminar el solvente en las columnas.
- Uso un photoreactor (figura 2), equipado con diez 350 nm (Tabla de materiales) para la radiación ultravioleta. Conectar a un tanque de gas de argón a través de la entrada de aire de photoreactor para asegurar que el photoreactor se llena de gas argón antes y durante las photoreactions.
- Antes de encender la lámpara Ultravioleta de la photoreactor, asegúrese de que se cierre la puerta de photoreactor en caso de irradiación de la luz UV.
2. preparación de la resina
Nota: en general, la construcción de sustratos de péptido se realiza mediante protocolos de síntesis de péptidos de fase sólida basado en Fmoc. Estas se llevan a cabo utilizando la resina amida de pista que deja un escote de c-terminal amida restante siguiente péptido. Este protocolo se utiliza en todo el documento.
PRECAUCIÓN: N, N- dimetilformamida (DMF), diclorometano (DCM), 4-methylmorpholine (NMM) y N, N- diisoproylethylamine (DIPEA) son tóxicos y nocivos por inhalación, ingestión o contacto con la piel. Éter etílico es altamente inflamable. Ácido trifluoroacético (TFA) es corrosivo. 1, 2-Etanoditiol (EDT) es altamente maloliente. Por lo tanto, todos los disolventes orgánicos y productos químicos deben manejarse con equipo de protección personal (guantes de nitrilo, bata y gafas protectoras) y manejados dentro de una campana de humos químicos.
- Calcular la cantidad de resina necesaria utilizando la siguiente fórmula:
escala (mmol) / (capacidad de carga (mmol/g) 1.000 (mg/g) de la resina) = masa de la resina (mg)
E.g., la cantidad de pista amida MBHA resina (0,5 mmol/g) de 25 μmol = 0,025 mmol / (0,5 mmol/g 1000 mg/g) = 50 mg. A continuación, pesar 50 mg de resina en una columna y establecer en el colector de vacío con llaves de paso de tres vías. - Añadir a la resina en una columna (0,8 x 4 cm, depósito de 10 mL) 1-2 mL de DCM. Para engrosar la resina, frote suavemente con una corriente de nitrógeno o argón durante 10 minutos. A continuación, eliminar el disolvente utilizando filtración de vacío.
3 lavado y desprotección de Fmoc N-terminal
- Preparar el Fmoc N-terminal deprotecting solución: preparar un volumen adecuado (200 mL) de 50% (v/v) morfolina en DMF en un frasco de vidrio.
- Añadir 1-2 mL de la solución de la desprotección a la resina, frote suavemente durante 10 minutos y luego vaciar la solución usando un vacío. Utilizando DMF (1-2 mL) y DCM (1-2 mL) en ese orden, lave la resina y el recipiente de la reacción durante un total de 3 x. A continuación, repita los procedimientos de desprotección y lavado 1 x.
4. protección de Fmoc Aminoácidos acoplamiento
- Usando el acoplamiento de residuos de alanina como por ejemplo, en el caso de una síntesis del manual de 25 μmol-escala, pesan Fmoc-Ala-OH (5 equiv, 41,4 mg) hexafluorofosfato de 2-(6-chloro-1H-benzotriazole-1-yl)-1,1,3,3-tetramethylaminium (HCTU; 4,9 equiv, 50,5 mg) en un contenedor de polipropileno y se disuelve en DMF (0,5 mL).
- Añadir DIPEA (10 equivalente, de 43.5 μl) con el fin de generar un 0.25-M activa solución de aminoácidos (tabla 1). Después de una activación previa de aproximadamente 1 minuto, añadir la solución a la resina, y luego la burbuja con N2 de aproximadamente 1-2 h.
- De este paso, incorporar cada aminoácido en la cadena peptídica como una secuencia de pasos: primero la desprotección del Fmoc-Grupo N-terminal y luego el lavado, seguido por el acoplamiento de los aminoácidos vía activación utilizando HCTU.
Nota: Un acoplamiento tiempo (e.g., 2 h) se recomienda si de acoplamiento después de un residuo de aminoácido sterically obstaculizado [e.g., Fmoc-Thr (tBu) - OH, Fmoc-Cys (Trt) - OH, OH (Trt) - OH, Fmoc-Arg (Pbf) - Fmoc-su]. El alkene/alquino con aminoácidos no naturales se utilizan de 3 equivalentes en vez de 5 y se dejó reaccionar por 3 h. - Supervisar el progreso de la síntesis de péptidos mediante pruebas Kaiser o Cloranilo descrito por Arora et al. 36 estas pruebas proporcionan evaluaciones cualitativas de la presencia o ausencia de aminas primarias y secundarias gratis. Alternativamente, aproximadamente 2-3 mg del péptido puede ser hendida de la resina y analizado por LC-MS.
5. tiol-ene Hydrothiolation y ciclización de tiol-Ino
- Construir el thioether vinculador mediante ciclización en la resina (figura 3).
- Preparar aproximadamente 50 mL de la solución de desprotección de Trt (TFA/TIS/DCM 0.03/0.06/1.0). Tratar la Cys y mS5-resina del cojinete [NH2-R-mS5-A-A-A-Cys (Trt)-R'-resina, 50 mg] con 1-2 mL de la solución de desprotección de Trt en una columna de 10 mL. Frote suavemente la solución por 10 minutos usando N2. Finalmente, la colada con DCM (1-2 mL) para un total de 3 x.
Nota: MS5 representa el bloque de edificio de alquileno-cojinete (véase la estructura representada en la figura 6) utilizado por péptido ciclización de acoplamiento y thio-ene38. - Repita el procedimiento descrito anteriormente para un total de aproximadamente 6 x para quitar el grupo de protección del trityl de cisteína, hasta que el color de la solución ya no es amarillo.
- Burbujas de N2, lave el R-mS5- A-A-A-Cys(-SH)-R'-resina [cisteína con el tio gratis (-SH)] con DMF (1-2 mL) y DCM (1-2 mL) en ese orden. Encogimiento de la resina usando metanol (1-2 mL) por 2 min y luego quitar el disolvente mediante filtración. A continuación, seque secuencialmente la resina en un vapor de gas de2 N durante aproximadamente 5 minutos en la columna.
- Preparar DMF desgasificada previamente, dentro de un matraz de boca, burbujas de nitrógeno durante aproximadamente 1 hora a través de una aguja larga que se extiende en el solvente.
- Transferencia de la resina en un matraz de fondo redondo de 10 mL a través de papel de peso. Suspender la resina en 2 mL de la DMF desgasificada, seguido por la adición del fotoiniciador 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone (MMP; 1 equiv, 5,6 mg), 4-methoxyacetophenone (mapa; 1 equiv, 3,8 mg).
- Añadir un stir bar (0,3 cm) en el matraz, el matraz con un tapón de goma conveniente del casquillo y desplazar el aire en el frasco con gas de nitrógeno utilizando una bomba de aceite.
Nota: La atmósfera inerte no es estrictamente necesaria para la fotoreducción de thio-ene efectivo en una fase sólida. Sin embargo, es muy necesario la fotoreducción de thio-Ino en fase de solución en la figura 5. De lo contrario, sulfuro se oxida durante la irradiación UV. - El matraz de reacción en la photoreactor y remover la resina para 1 h bajo irradiación UV a temperatura ambiente (figura 2).
PRECAUCIÓN: Antes de encender la lámpara Ultravioleta de photoreactor, asegúrese de que se cierre la puerta de photoreactor en caso de irradiación dañina de la luz UV.
Nota: Con frecuencia de muestreo la mezcla de reacción durante los photoreactions recomienda para nuevas secuencias, como el precursor del péptido lineal tiene el idéntico peso molecular del producto. En general, péptidos lineales y cíclicos muestran significativamente diferente hidrofilia. Esto puede distinguirse fácilmente usando HPLC. Por otra parte, el 5, 5' - Ditiobis-(ácido 2-nitrobenzoico) (DTNB) reactivo también podría ser utilizado para estudiar la presencia de tiol libre37. - Transferencia de la resina del frasco en la columna y eliminar el disolvente utilizando filtración de vacío. Lave y seque la resina, tal como se describe en el paso 5.1.3.
- Preparar aproximadamente 10 mL del escote cocktail (TFA/consejos/EDT/H2O 94/1/2.5/2.5) en la campana.
- Transferencia de la resina en un recipiente de polipropileno de 2 mL, añadir 1 mL de escote cocktail (TFA/consejos/EDT/H2O 94/1/2.5/2.5) en el contenedor y cierre el recipiente herméticamente con un tapón de rosca. A continuación, frote suavemente el recipiente en un agitador orbital a una velocidad de 60 rpm en la campana de 1.5-2 h.
PRECAUCIÓN: TFA es altamente corrosivo. Use ropa protectora y trabajo en una eficiente campana extractora. EDT es una sustancia muy maloliente y debe manejarse en una campana de humos eficaz. - Retire el cóctel TFA por evaporación bajo una corriente de gas N2 en la campana. Precipitar a continuación, el residuo usando éter dietílico frío (1 mL) por 30 s y aislamiento que mediante centrifugación a 12.000 x g durante 2 minutos. Después de la centrifugación, suavemente Vierta el componente de éter. Repita los pasos de precipitado y centrifugación para x 2. Evaporar el residuo a sequedad.
- Finalmente, disolver el residuo en 1 mL de H2O/acetonitrilo (2:1) y purificar por HPLC usando una columna analítica de C18 (4.6 x 250 mm, caudal de 1,0 mL/min). Uso H2O (que contiene 0.1% TFA) y acetonitrilo puro como disolventes en un degradado lineal de 2%/min de 20% a 70% acetonitrilo en 25 min espectros de Monitor HPLC con UV 280 nm y 220 nm las longitudes de onda (tabla 2).
- Preparar aproximadamente 50 mL de la solución de desprotección de Trt (TFA/TIS/DCM 0.03/0.06/1.0). Tratar la Cys y mS5-resina del cojinete [NH2-R-mS5-A-A-A-Cys (Trt)-R'-resina, 50 mg] con 1-2 mL de la solución de desprotección de Trt en una columna de 10 mL. Frote suavemente la solución por 10 minutos usando N2. Finalmente, la colada con DCM (1-2 mL) para un total de 3 x.
- Para construir al thioether vinculador por reacción intermolecular thio-ene y luego cyclize el péptido macrolactamization (figura 4).
- Sintetizar el residuo de alquileno teniendo el péptido lineal H2N-A-A-A-mS5(2-R'')-R'-resina (50 mg) con la síntesis de péptidos de fase sólida basado en el Fmoc estándar (SPPS) como se describe en los pasos 2-4. A continuación, lavar y secar la resina como se describe en el paso 5.1.3.
- Suspender la resina en un matraz de fondo redondo de 10 mL que contiene 2 mL de DMF desgasificada como se describe en el paso 5.1.4.
- Añadir el fotoiniciador mapa y MMP (MMP: 1 equiv, 5,6 mg; MAPA: 1 equiv, 3,8 mg), Fmoc-Cys-OH (3 equiv, 25,7 mg) y un revolver bar (0,3 cm) en el matraz. Tapa el matraz con un tapón adecuado y luego usar la bomba de aceite para reemplazar el aire en el frasco con nitrógeno.
- Coloque el matraz de reacción en el photoreactor. Agitar durante 1-2 h bajo irradiación UV a temperatura ambiente (figura 2).
- Controlar la reacción en un análisis por LC-MS: cleave 2-3 mg de la resina con el cóctel de escote. Entonces precipitar el residuo con éter dietílico frío (300 μL), aislar el residuo por centrifugación y evaporar el residuo a sequedad como se describe en el paso 5.1.11. Después de esto, disolver el residuo en 100 μl de H2O/acetonitrilo (2:1). Filtrar la solución de péptido utilizando una película microporosa de 0.22 μm y analizarlos utilizando LC-MS con el compuesto ionizado en la ionización de electrospray (ESI) y operado en modo positivo.
- Si es necesario, repita los pasos 5.2.2 - 5.2.4 para asegurar la reacción se lleva a cabo hasta su conclusión.
- Después de la finalización de la reacción de la foto, transferencia de la resina del frasco en la columna y eliminar el disolvente utilizando filtración de vacío. Lave y seque la resina, tal como se describe en el paso 5.1.3.
- Añadir la solución DMF de hexafluorofosfato de benzotriazol-1-yl-oxytripyrrolidinophosphonium (PyBob; 2,4 equiv, 31,2 mg), 1-hydroxybenzotriazole (TOHB; 2,4 equiv, 8,1 mg) y NMM (4 equiv, 11 μL) a la resina en la columna de la macrolactamization. La burbuja de esta solución con N2 h 2.
- Además, controlar esta reacción de acoplamiento utilizando LC-MS, como se describe en el paso 5.2.3. Si es necesario, repita este paso para asegurar la reacción se lleva a cabo hasta su conclusión.
- Alargar el péptido mediante SPPS Fmoc-base estándar como se describe en los pasos 3 y 4.
- Asamblea de todos los residuos del aminoácido, hienden el péptido de la resina como se describe en los pasos 5.1.10 y 5.1.11 y purifica como se describe en el paso 5.1.12.
- Construcción de vinculador de vinilo sulfuro en fase de solución (figura 5).
- Sintetizar el residuo de alquino cojinete lineal péptido mediante SPPS Fmoc-base estándar como se describe en los pasos 2-4. Sintetizar el alquino con aminoácidos según un protocolo bien establecido como se describe en un estudio anterior de20.
- Hender el péptido de la resina y precipitan con éter dietílico frío como se describe en pasos 5.1.9 - 5.1.11. Después de la hendidura y la precipitación de la resina, recoger el péptido mediante centrifugación a 12.000 x g durante 2 minutos.
- Secar el residuo resultante en el vacío. Disolver el residuo en el DMF desgasificada (50 mL) en un matraz de fondo redondo de 100 mL para alcanzar una concentración final de 0,5 mM (basado en la carga de la resina, 0,025 mmol (1000 mL/L / 0,5 mmol/L) = 50 mL).
- Añadir el fotoiniciador DMPA (0,5 equiv, 3,2 mg) y luego desgasificar la solución de reacción durante 10 minutos usando N2 a través de una aguja larga que se extendía en la solución. A continuación, irradiar la muestra bajo UV luz a temperatura ambiente durante 0.5 - 1 h sin agitación.
- Retire la DMF en un alto vacío y precipitar el crudo residuo mediante la adición de éter dietílico para disolver sus subproductos orgánicos. A continuación, aislar el residuo mediante centrifugación a 12.000 x g durante 2 minutos. Después de la centrifugación, suavemente Vierta el componente de éter. Evaporar el residuo a sequedad. Finalmente, disolver el residuo en 1 mL de H2O/acetonitrilo (2:1) y purificarlo mediante HPLC como se describe en el paso 5.1.7.
Resultados
Los espectros de HPLC y MS del péptido Ac-y más5AAAC-NH2 y su producto ciclizados CA - Y-(cyclo-1,5)-[mS5AAAC] - NH2 que se generaron con la fotoreducción en resina intramolecular tiol-ene se representan en figura 6B. péptido cíclico fue encontrado para tener un peso molecular idéntico con respecto a su precursor lineal. Sin embargo, su tiempo de retención HPLC se observó que aproximadamente 2 minutos antes que el de sus precursores en las mismas condiciones de separación. Péptidos cortos con diferentes secuencias todos observaron para tener una buena conversión, como se muestra en la figura 6.
El proceso de selección para las condiciones de fotoreducción de thio-Ino se muestra en la figura 7B, y la conversión del isómero y el cociente se determinaron mediante la integración de HPLC de fase inversa. Sólo traza los niveles de péptido c 2 fueron observados después de la irradiación UV. Esto es probablemente debido a una preferencia conformacional para una captura de la thiyl radical en la N-terminal durante la etapa de contratación para un macrociclo 20 miembros. Se encontraron péptidos 1a y 1b para generar dos isómeros con una reticulación de sulfuro de vinilo de 8 miembros. Péptidos 2a-A y 2a-B, que se generaron del péptido 1a, mostraron tiempos de retención distintos, así como diversos cocientes de la irradiación UV diferentes tiempos (0 - 30 min) (figura 7). Éstos fueron asignados como los isómeros E/Z debido a las señales del protón enlace doble en la 1H-RMN Espectroscopia (figura 7). En el caso de péptidos 2d-2f, el Z-isómero se encontró que el producto dominante. Esto es probablemente debido a la preferencia conformacional durante la construcción de una estructura compacta en relación con la reticulación de sulfuro de vinilo de 8 miembros. Como se muestra en la figura 7E, según el espectro de dicroísmo circular (CD), péptidos 2a-A/B y 2b-A/B que poseen una vinilo de 8 miembros del sulfuro reticulación exhiben una bobina al azar, mientras que el péptido 2d que cuenta con un vinilo de 7 miembros sulfuro reticulación exhibe un conformación helicoidal. En Resumen, el Z-isómero del enlace de sulfuro del vinilo fue encontrado para ser formado preferencial y una mejor inducción de hélice.

Figura 1: aparato Manual de síntesis de péptidos de síntesis peptídica en fase sólida. Las columnas fueron colocadas en el colector de vacío a través de las llaves de paso de tres vías y el aparato estaba conectado a una línea de gas de nitrógeno o argón para el burbujeo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: el dispositivo de photoreactor utilizado para los photoreactions. El aparato fue equipado con diez 350 nm (Tabla de materiales) para que la irradiación UV y un tanque de gas de argón para asegurarse de que el photoreactor se llenó de gas argón antes y durante las photoreactions. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: reacción intramolecular tiol-ene en el caso de péptidos más cortos en resina. Esta reacción fue llevado a cabo utilizando una desprotección en resina de los grupos del trityl de después de la completa síntesis del péptido lineal de residuos de cisteína y luego poner la resina a la irradiación UV con fotoiniciadores mapa y MMP. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: reacción intermolecular thio-ene en resina. Esta reacción fue llevado a cabo por Fmoc-Cys-OH se disuelve en el disolvente DMF y luego irradiada con el residuo de alkene-cojinete péptido de la resina, seguida de un macrolactamization usando PyBop TOHB y NMM como reactivos de activación. A continuación, la síntesis de péptidos se continuó utilizando un estándar SPPS. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: reacción Intramolecular tiol-Ino en fase de solución. Esta reacción se llevó a cabo en la fase de solución después de la completa síntesis del péptido lineal, después de que el péptido lineal fue disuelto en DMF desgasificada e irradiado usando luz UV con el fotoiniciador DMPA. Haga clic aquí para ver una versión más grande de esta figura.
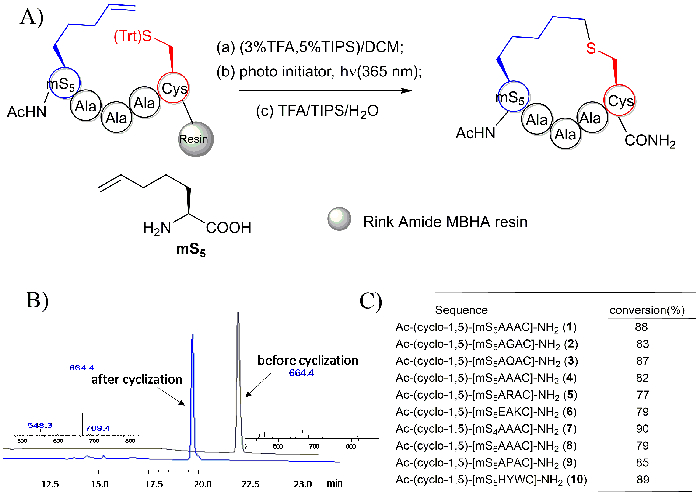
Figura 6: Thioether atado péptidos cíclicos generados utilizando una reacción en resina intramolecular tiol-ene. A. este panel muestra el esquema de la reacción intramolecular de en resina thio-ene. mS5: "m" representa los aminoácidos olenic mono sustituido, "S" representa al aminoácido S configurado y "5" se refiere al número de átomos de cadena lateral38. B. paneles de esta muestra los espectros de HPLC y MS del péptido Ac-y más5AAAC-NH2 antes y después su ciclización. C. este panel muestra la conversión de los péptidos cíclicos con diferentes secuencias. Esta figura ha sido modificada de Zhao, B. et al.28 haga clic aquí para ver una versión más grande de esta figura.
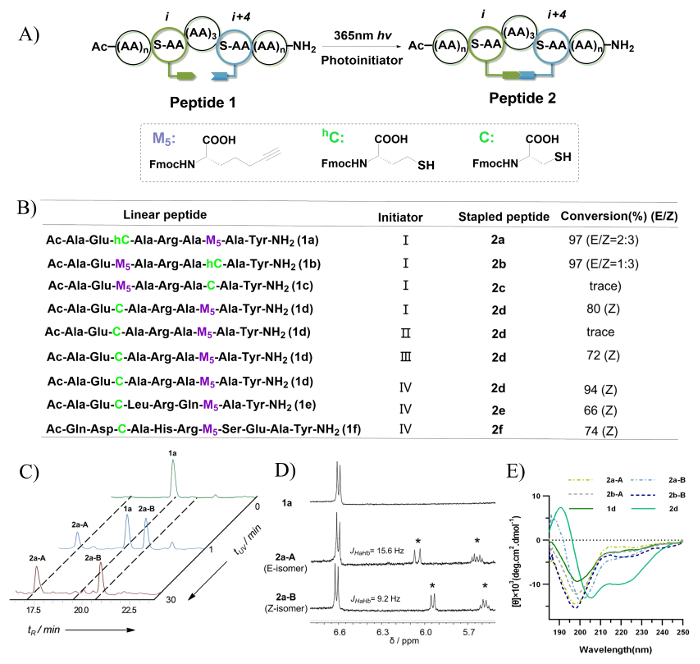
Figura 7: péptido grapado a través de foto-inducida tiol-Ino hydrothiolation. A. esta es una ilustración esquemática de intramolecular tiol-Ino hydrothiolation. B. este panel muestra las secuencias de péptidos evaluadas en este estudio. Iniciador: (I) 0.5 EQ DMPA, 1 h; (II) no iniciador, 1 h; (III) 0,5 EQ DMPA, 0,5 EQ. mapa, 1 h; (IV) 0.5 EQ. MMP, h. 0,5 C. Este panel muestra los rastros HPLC de la mezcla de reacción de 1a de péptidos con diferentes tiempos de irradiación UV y controla a 220 nm. D. este panel muestra el 1espectros de H-NMR de 1a, 2a-A y 2a-B (medido en DMSO-d6 en 400 MHz). Los asteriscos indican la formación de un enlace de vinilo sulfuro doble después de la irradiación UV. E. este panel muestra los espectros de dicroísmo circular de péptidos con enlaces cruzados de sulfuro de vinilo. Esta figura ha sido modificada desde Tian, Y. et al. 44 Haga clic aquí para ver una versión más grande de esta figura.
| Materiales | MW | N(0.5mmol / g resina × 0. 0 5 g × 5eq.) | M(aminoácido) (mg) |
| (Da) | (mmol) | ||
| Fmoc-Gly-OH | 297 | 0,125 | 37.1 |
| Fmoc-Ala-OH | 331 | 0,125 | 41.4 |
| Fmoc-Val-OH | 339 | 0,125 | 42.4 |
| Fmoc-Leu-OH | 353 | 0,125 | 44.1 |
| Fmoc-Ile-OH | 353 | 0,125 | 44.1 |
| Fmoc-Pro-OH | 337 | 0,125 | 42.1 |
| Fmoc-Phe-OH | 387 | 0,125 | 48.4 |
| Fmoc-Tyr (tBu)-OH | 460 | 0,125 | 57,5 |
| Fmoc-Trp (Boc)-OH | 527 | 0,125 | 65.9 |
| Fmoc-Ser (tBu)-OH | 384 | 0,125 | 48 |
| Fmoc-Thr (tBu)-OH | 398 | 0,125 | 49.8 |
| Fmoc-Cys (Trt)-OH | 586 | 0,125 | 73,3 |
| Fmoc-Met-OH | 372 | 0,125 | 46.5 |
| Fmoc-Asn (Trt)-OH | 597 | 0,125 | 74.6 |
| Fmoc-Gln (Trt)-OH | 611 | 0,125 | 76.4 |
| Fmoc-Asp (OtBu)-OH | 412 | 0,125 | 51,5 |
| Fmoc-Glu (OtBu)-OH | 426 | 0,125 | 53.3 |
| Fmoc-Lys (Boc)-OH | 469 | 0,125 | 58.6 |
| Fmoc-Arg (Pbf)-OH | 617 | 0,125 | 77.1 |
| Fmoc-su (Trt)-OH | 620 | 0,125 | 77,5 |
| HCTU | 414 | 0.122 | 50.5 |
| DIPEA | 129 | 0.25 | 43.5(ΜL) |
| DMF | 0, 5 mL | ||
Tabla 1: Las cantidades de las condiciones de acoplamiento.
| Columna | Columna ZORBAX SB-Aq, 4.6 × 250 m m (tamaño de poro 80 Å, partícula tamaño 5 μm) |
| Disolventes | A: agua, 0.1% (vol/vol) TFA; B: acetonitrilo |
| Tasa de flujo | 1 mL/min. |
| Gradiente de | B de 20 – 70% (vol/vol) más de 25 minutos; 70-98% más de 5 min; 98% más de 5min; |
| Volumen de inyección | 30 – 500 ΜL |
| Longitud de onda (nm) | 280 (por Fmoc, Trp o Tyr-que contienen péptidos) o 494 (péptidos marcados con FITC) o 220 (para otros) |
Tabla 2: Condiciones de la cromatografía líquida de alto rendimiento.
Discusión
En la ciclización de la resina en intramolecular thio-ene descrita en la figura 3, la eliminación del grupo trityl de un residuo de cisteína fue encontrada para ser un paso crítico para la fotoreducción posterior. Además, el peso molecular de péptidos antes y tras que la reacción fue encontrada para ser idéntico como representan en la Figura 6B. Por lo tanto, el uso de una identificación de HPLC o un ensayo DTNB es necesaria para el seguimiento de la reacción. En el caso de la reacción intermolecular thio-ene que se describe en la figura 4, MS seguimiento es necesaria. Mientras que un paso más de lactama acoplamiento fue encontrado para ser necesarios para la construcción de un anclaje thioether, sugerimos que este protocolo se utilizará para péptidos largos para alcanzar una eficacia total más alta.
El vínculo de vinilo sulfuro generado por la fotoreducción de thio-Ino no era estable en la solución fuertemente ácida de TFA que se utiliza para el escote de la resina. Por lo tanto, se adoptó el uso de la fotoreducción de thio-Ino en la fase de solución. Esta reacción se diluyó a una concentración baja (0,5 mM) con el fin de evitar potenciales intermoleculares por-reacciones. También es igualmente importante desgasificación el solvente para evitar la oxidación del producto durante los photoreactions. Después de la reacción, vacío evaporación del solvente orgánico que DMF debe también ser cuidadosamente realizado para evitar depreciación de oxidación o degradación o maquinaria de péptido. La reacción de ciclación de thio-Ino representada en la figura 5 proporciona un mecanismo para la síntesis de péptidos posterior modificación35.
Aunque la reacción intramolecular tiol-ene con éxito genera péptidos thioether atado con buena conversión, una reticulación del thioether simple no restringir los péptidos en la conformación helicoidal deseada. Basado en esta estrategia de modificación en el anclaje, un centro quiral en el anclaje inducida por péptido helicidad concepto fue desarrollado, donde lo γ sustituido el grupo con la configuración R en el péptido c-terminal fue capaz de inducir la conformación helicoidal de péptido ( Figura 4)39,40. La limitación asociada a este enfoque es la síntesis del aminoácido natural enantioméricamente puro con dos centros quirales (α (S), γ(R))41,42.
Esta investigación demostró que la reacción de thio-Ino puede restringir el péptido en una conformación helicoidal con buena conversión, como se muestra en la figura 7E. En cuanto a la construcción de péptidos helicoidales, recomendamos fotoreducción de thio-Ino para la construcción de los péptidos helicoidales. La ciclización en resina intramolecular thio-ene fue demostrada para ser convenientes para la construcción de péptidos de anclaje thioether corto (menos de 15) en el caso de péptidos largos son demasiado flexibles para garantizar eficaz ciclización. Además, se recomienda la ciclización en resina intermoleculares thio-ene para ciclación de péptidos largos.
En Resumen, hemos desarrollado una serie de protocolos químicos para la construcción de péptidos de vinilo thioether sulfuro atado mediante fotoinducida thio-ene/tio-Ino haga clic en química. La reacción es eficiente catalizador-libre, conveniente para la manipulación del metal y ha demostrado poseer una tolerancia superior grupo funcional y bio-ortogonales. Además, este método fue desarrollado para estabilizar otras estructuras secundarias de péptidos como la β-horquilla43,44. Este trabajo muestra que el anclaje del thioether proporciona un sitio de modificación sin dejar huellas. Esto amplía en gran medida el espacio químico tras modificación de síntesis de péptidos. Además, los péptidos de alifáticos vinilo thioether sulfuro atado que mostraron una toxicidad de membrana reducida en comparación con los péptidos básicos de hidrocarburos se aplican en diversas aplicaciones biológicas con demostrada bioactividad buena y biodisponibilidad de45,46.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen el apoyo financiero de la Fundación de subvenciones de China de Ciencias naturales (no. 21372023, 21778009 y 81701818); el Ministerio de ciencia y tecnología de la República Popular de China (Nº 2015DFA31590); el Shenzhen Ciencia y tecnología Comité de innovación (no. JCYJ20170412150719814, JCYJ20170412150609690, JCYJ20150403101146313, JCYJ20160301111338144, JCYJ20160331115853521, JSGG20160301095829250 y GJHS20170310093122365); y la Fundación de ciencia Postdoctoral de China (no. 2017 M 610704).
Materiales
| Name | Company | Catalog Number | Comments |
| Rink Amide MBHA resin(0.53 mmol/g) | HECHENG | GRM50407 | |
| Standard Fmoc-protected amino acids | GL Biochem (Shanghai) Ltd. | ||
| N-Methyl-2-pyrrolidinone | Shenzhen endi Biotechnology Co.Ltd. | 3230 | skin harmful |
| N,N-Dimethyl formamide | Energy | B020051 | skin harmful |
| Dichloromethane | Energy | W330229 | skin harmful |
| N,N-Diisoproylethylamine | Aldrich | 9578 | irritant |
| Trifluoroacetic acid | J&K | 101398 | corrosive |
| Triisopropylsilane | J&K | 973821 | |
| 1,2-Ethanedithiol | J&K | 248897 | Stench |
| 2-(6-Chloro-1H-benzotriazole-1-yl)-1,1,3,3-tetramethylaminium hexafluorophosphate | GL Biochem (Shanghai) Ltd. | 851012 | |
| Morpholine | Aldrich | M109062 | irritant |
| Diethyl ether | Aldrich | 673811 | flammable |
| Acetonitrile | Aldrich | 9758 | toxicity |
| Methanol | Aldrich | 9758 | toxicity |
| 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone | Energy | A050035 | |
| 4-methoxyacetophenone | Energy | A050098 | |
| 2,2-dimethoxy-2-phenylacetophenone | Energy | D070132 | |
| 5,5'-Dithiobis-(2-nitrobenzoic acid) | J&K | 281281 | |
| Benzotriazole-1-yl-oxytripyrrolidinophosphonium hexafluorophosphate | Energy | E020172 | |
| 1-Hydroxybenzotriazole | Energy | D050256 | |
| 4-Methylmorpholine | Energy | W320038 | |
| High Performance Liquid Chromatography | SHIMADZU | LC-30AD | |
| Electrospray Ionization Mass | SHIMADZU | LCMS-8030 | |
| Lyophilizer | Labconco | FreeZone | |
| SpeedVac concentration system | Thermo | Savant | |
| vacuum manifold | promega | A7231 | |
| three-way stopcocks | Bio-Rad | 7328107 | |
| poly-prep chromatography columns | Bio-Rad | 7311550 |
Referencias
- Pelay-Gimeno, M., Glas, A., Koch, O., Grossmann, T. N. Structure-based design of inhibitors of protein-protein interactions: mimicking peptide binding epitopes. Angewandte Chemie International Edition. 54 (31), 8896-8927 (2015).
- Passioura, T., Katoh, T., Goto, Y., Suga, H. Selection-based discovery of druglike macrocyclic peptides. Annual Review of Biochemistry. 83, 727-752 (2014).
- Gonzalez, M. W., Kann, M. G. Protein interactions and disease. PLoS Computational Biology. 8 (12), 1-11 (2012).
- Wilson, A. J. Inhibition of protein-protein interactions using designed molecules. Chemical Society Reviews. 38 (12), 3289-3300 (2009).
- Teresa, A. F. C., Alessio, C. Cyclic and macrocyclic peptides as chemical tools to recognise protein surfaces and probe protein-protein interactions. ChemMedChem. 11 (8), 787-794 (2016).
- Craik, D. J., Fairlie, D. P., Liras, S., Price, D. The future of peptide-based drugs. Chemical Biology & Drug Design. 81 (1), 136-147 (2013).
- Cromm, P. M., Spiegel, J., Grossmann, T. N. Hydrocarbon stapled peptides as modulators of biological function. ACS Chemical Biology. 10 (6), 1362-1375 (2015).
- Zhang, Q. Z., Tian, Y., Lao, Y. Z., Li, Z. G. Peptides-staple method development and its application in cancer therapy. Current Medicinal Chemistry. 21 (21), 2438-2452 (2014).
- Cromm, P. M., Spiegel, J., Grossmann, T. N. Hydrocarbon stapled peptides as modulators of biological function. ACS Chemical Biology. 10 (6), 1362-1375 (2015).
- Wang, D., Liao, W., Arora, P. S. Enhanced metabolic stability and protein-binding properties of artificial alpha helices derived from a hydrogen-bond surrogate: application to Bcl-xL. Angewandte Chemie International Edition. 44 (40), 6525-6529 (2005).
- Bullock, B. N., Jochim, A. L., Arora, P. S. Assessing helical protein interfaces for inhibitor design. Journal of the American Chemical Society. 133, 14220-14223 (2011).
- Jackson, D. Y., King, D. S., Chmielewski, J., Singh, S., Schultz, P. G. General approach to the synthesis of short α-helical peptides. Journal of the American Chemical Society. 113 (24), 9391-9392 (1991).
- Timmerman, P., Beld, J., Puijk, W. C., Meloen, R. H. Rapid and quantitative cyclization of multiple peptide loops onto synthetic scaffolds for structural mimicry of protein surfaces. ChemBioChem. 6 (5), 821-824 (2005).
- Muppidi, A., Wang, Z., Li, X., Chen, J., Lin, Q. Achieving cell penetration with distance-matching cysteine cross-linkers: a facile route to cell-permeable peptide dual inhibitors of Mdm2/Mdmx. Chemical Communications. 47 (33), 9396-9398 (2011).
- Schafmeister, C. E., Po, J., Verdine, G. L. An all-hydrocarbon cross-linking system for enhancing the helicity and metabolic stability of peptides. Journal of the American Chemical Society. 122 (24), 5891-5892 (2000).
- Osapay, G., Taylor, J. W. Multicyclic polypeptide model compounds. 1. synthesis of a tricyclic amphiphilic alpha-helical peptide using an oxime resin, segment-condensation approach. Journal of the American Chemical Society. 112 (16), 6046-6051 (1990).
- Lau, Y. H., Andrade, d. P., Wu, Y., Spring, D. R. Peptide stapling techniques based on different macrocyclisation chemistries. Chemical Society Reviews. 44 (1), 91-102 (2015).
- Spokoyny, A. M., Zou, Y., Ling, J. J., Yu, H., Lin, Y. S., Pentelute, B. L. A perfluoroaryl-cysteine S(N)Ar chemistry approach to unprotected peptide stapling. Journal of the American Chemical Society. 135 (16), 5946-5949 (2013).
- Lautrette, G., Touti, F., Lee, H. G., Dai, P., Pentelute, B. L. Nitrogen arylation for macrocyclization of unprotected peptides. Journal of the American Chemical Society. 138 (27), 8340-8343 (2016).
- Tian, Y., et al. Stapling of unprotected helical peptides via photoinduced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- Chang, Y. S., et al. Stapled α-helical peptide drug development: a potent dual inhibitor of MDM2 and MDMX for p53-dependent cancer therapy. Proceedings of the National Academy of Sciences of the United States of America. 110 (36), 3445-3454 (2013).
- Zhao, H., et al. Crosslinked aspartic acids as helix-nucleating templates. Angewandte Chemie International Edition. 55 (39), 12088-12093 (2016).
- Leshchiner, E. S., et al. Direct inhibition of oncogenic KRAS by hydrocarbon-stapled SOS1 helices. Proceedings of the National Academy of Sciences of the United States of America. 112 (6), 1761-1766 (2015).
- Wang, D., Qin, X., Zhao, H., Li, Z. N-cap helix nucleation: methods and their applications. Science China Chemistry. 60 (6), 689-700 (2017).
- Zorzi, A., Deyle, K., Heinis, C. Cyclic peptide therapeutics: past, present and future. Current Opinion in Chemical Biology. 38, 24-29 (2017).
- Hu, K., et al. An in-tether chiral center modulates the helicity, cell permeability, and target binding affinity of a peptide. Angewandte Chemie International Edition. 55 (28), 8013-8017 (2016).
- Lin, H., Jiang, Y., Zhang, Q., Hu, K., Li, Z. An in-tether sulfilimine chiral center induces helicity in short peptides. Chemical Communications. 52 (68), 10389-10391 (2016).
- Zhao, B., Zhang, Q., Li, Z. Constructing thioether-tethered cyclic peptides via on-resin intra-molecular thiol-ene reaction. Journal of Peptide Science. 22 (8), 540-544 (2016).
- Dondoni, A., Massi, A., Nanni, P., Roda, A. A new ligation strategy for peptide and protein glycosylation: photoinduced thiol-ene coupling. Chemistry. 15 (43), 11444-11449 (2009).
- Hu, K., Sun, C., Li, Z. Reversible and versatile on-tether modification of chiral-center-induced helical peptides. Bioconjugate Chemistry. 28 (7), 2001-2007 (2017).
- Shi, X., Jiang, Y., Yang, D., Zhao, H., Tian, Y., Li, Z. Reversibly switching the conformation of short peptide through in-tether chiral sulfonium auxiliary. Chinese Chemical Letters. , (2017).
- Jiang, Y., et al. Switching substitution groups on the in-tether chiral centre influences backbone peptides' permeability and target binding affinity. Organic & Biomolecular Chemistry. 15 (3), 541-544 (2017).
- Aimetti, A. A., Shoemaker, R. K., Lin, C. C., Anseth, K. S. On-resin peptide macrocyclization using thiol-ene click chemistry. Chemical Communications. 46 (23), 4061-4063 (2010).
- Wang, Y. X., Chou, D. H. C. A thiol-ene coupling approach to native peptide stapling and macrocyclization. Angewandte Chemie International Edition. 54 (37), 10931-10934 (2015).
- Wang, Y., et al. Application of thiol-yne/thiol-ene reactions for peptide and protein macrocyclizations. Chemistry. 23 (29), 7087-7092 (2017).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Ozyurek, M., Baki, S., Gungor, N., Celik, S. E., Guclu, K., Apak, R. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, Q. Z., et al. Chiral sulfoxide-induced single turn peptide α-helicity. Scientific Reports. 6, 38573 (2016).
- Lin, H., et al. An in-tether sulfilimine chiral center induces beta-turn conformation in short peptides. Organic & Biomolecular Chemistry. 14 (42), 9993-9999 (2016).
- Hu, K., Li, W., Yu, M., Sun, C., Li, Z. Investigation of cellular uptakes of the in-tether chiral-center-induced helical pentapeptides. Bioconjugate Chemistry. 27 (12), 2824-2827 (2016).
- Hu, K., et al. A precisely positioned chiral center in an i, i + 7 tether modulates the helicity of the backbone peptide. Chemical Communications. 53 (50), 6728-6731 (2017).
- Li, J., et al. An in-tether chiral center modulates the proapoptotic activity of the KLA peptide. Chemical Communications. 53 (75), 10452-10455 (2017).
- Zhao, B., et al. A thioether-stabilized-D-proline-L-proline-induced β-hairpin peptide of defensin segment increases its anti-Candida albicans ability. ChemBioChem. 17 (15), 1416-1420 (2016).
- Tian, Y., Yang, D., Ye, X., Li, Z. Thioether-derived macrocycle for peptide secondary structure fixation. The Chemical Record. 17 (9), 874-885 (2017).
- Hu, K., Yin, F., Yu, M., Sun, C., Li, J., Liang, Y., Li, W., Xie, M., Lao, Y., Liang, W., Li, Z. G. In-tether chiral center induced helical peptide modulators target p53-MDM2/MDMX and inhibit tumor growth in stem-like cancer cell. Theranostics. 7 (18), 4566-4576 (2017).
- Tian, Y., Jiang, Y., Li, J., Wang, D., Zhao, H., Li, Z. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: a comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados