Method Article
Costruzione di peptidi elicoidale Via foto-indotta del tiolo-ene/yne Hydrothiolation Thioether/vinile solfuro-tethered
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Vi presentiamo un protocollo per la costruzione di thioether/vinile peptidi elicoidale solfuro-tethered utilizzando foto-indotta del tiolo-ene/tiolo-yne hydrothiolation.
Abstract
Qui, descriviamo un protocollo dettagliato per la preparazione di peptidi thioether-tethered utilizzando su resina intramolecolare/intermolecolare del tiolo-ene hydrothiolation. Inoltre, questo protocollo descrive la preparazione di peptidi vinile-solfuro-tethered utilizzando in soluzione intramolecolare del tiolo-yne hydrothiolation tra aminoacidi che possiedono catene laterali alchenico/alchini e residui di cisteina a i, i + 4 posizioni. Peptidi lineari sono stati sintetizzati utilizzando una sintesi peptidica in fase solida Fmoc-based standard (SPPS). Tiolo-ene hydrothiolation avviene tramite una reazione intramolecolare thio-ene o una reazione intermolecolare thio-ene, a seconda della lunghezza del peptide. In questa ricerca, una reazione intramolecolare thio-ene avviene nel caso dei peptidi più brevi utilizzando su resina deprotezione dei gruppi trityl di residui di cisteina seguendo la sintesi completa del peptide lineare. La resina viene quindi impostata di irradiazione UV utilizzando fotoiniziatore 4-metossiacetofenone (mappa) e 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone (MMP). La reazione intermolecolare del tiolo-ene è effettuata tramite la dissoluzione di Fmoc-Cys-OH in un solvente di N, N- dimetilformammide (DMF). Questo è poi fatto reagire con il peptide utilizzando il residuo di alchenico-cuscinetto in resina. Dopo di che, la macrolactamization avviene mediante Esafluorofosfato di benzotriazolo-1-yl-oxytripyrrolidinophosphonium (PyBop), 1-parola (HoBt) e 4-metilmorpholin-(NMM) come reagenti di attivazione sulla resina. In seguito il macrolactamization, è continuata la sintesi peptidica utilizzando standard SFF. Nel caso la hydrothiolation thio-yne, il peptide lineare è spaccato dalla resina, essiccato e successivamente disciolto in DMF degassato. Questo poi viene irradiato con luce UV fotoiniziatore 2,2-dimetossi-2-phenylacetophenone (DMPA). A seguito della reazione, DMF è evaporata e il residuo grezzo è precipitato e purificati mediante cromatografia liquida ad alte prestazioni (HPLC). Questi metodi potrebbero funzionare per semplificare la generazione di peptidi ciclici thioether-legato a causa dell'uso della chimica thio-ene/yne clic che possiede tolleranza superiore gruppo funzionale e buona resa. L'introduzione delle obbligazioni thioether peptidi sfrutta la natura nucleofila di residui di cisteina e redox-inerte rispetto i legami bisolfurico.
Introduzione
Lo sviluppo di ligandi per modulare le interazioni proteina-proteina (PPIs) fornisce un approccio attraente per la scoperta di farmaci moderni. Così, una grande quantità di sforzo è stata investita in studiare nuove modalità di chimica che potrebbe efficacemente modulano PPIs1,2,3. PPI consistono generalmente di superfici interagenti poco profonde, grandi e/o fuori produzione, e piccole molecole in genere sono considerati non idonei leganti per la modulazione di PPIs4,5. Con un'adatta interagente superficie esposta, brevi peptidi che imitano le caratteristiche strutturali delle proteine interfacce rappresentano i candidati ideali per affrontare questo problema6,7. Tuttavia, brevi peptidi sono in genere non strutturati in una soluzione acquosa. Questo è dovuto al fatto che le molecole di acqua che sono in concorrenza con la rete di legami idrogeno intramolecolari della spina dorsale del peptide e conformazioni ben definite sono entropically sfavorevoli in acqua8. Inoltre, i peptidi intrinsecamente bassa stabilità e proprietà di permeabilità delle cellule in gran parte limitano il loro uso in applicazioni biologiche9,10. Secondo l'analisi di protein data bank (PDB), > 50% degli IPP coinvolgono breve α-elica interazioni11. Così, sono stati sviluppati diversi metodi chimici per quanto riguarda la stabilizzazione dell'elica. Questi includono disolfuro/thioether bond formazione12,13,14, ciclizzazione metatesi15, lattame anello formazione16, "clic" chimica17, aggiunta di perfluoroarenes18,19e vinile-solfuro formazione20.
Stabilizzato elicoidale peptidi sono ampiamente utilizzati per i vari bersagli intracellulari, tra cui p53, proteine della famiglia di BCL-2 di estrogeno recettori, Ras, e altri21,22,23,24. ALRN-6924, un all-idrocarburo pinzati inibitore doppio del peptide di MDM2 e MDMX, è attualmente utilizzato per indagine clinica25. Negli ultimi anni, il nostro gruppo si è concentrata sullo sviluppo di metodi di stabilizzazione peptide novello utilizzando tiolo-ene e tiolo-yne reazioni26,27,28. In generale, abbiamo dimostrato che queste reazioni foto-avviato sono efficienti in condizioni blande quando naturalmente abbondante cisteina è usata. Inoltre, abbiamo indicato che queste reazioni hanno una tolleranza eccellente gruppo funzionale, sono bio-ortogonali e hanno dimostrate di essere applicabile per le modifiche della proteina e del peptide29. I peptidi di solfuro tethered thioether/vinile risultante in gran parte migliorare lo spazio chimico dei peptidi di vincolo, forniscono un centro di labile il tether modifica e ha dimostrati di essere applicabile per impiego in numerose applicazioni biologiche30 ,31,32. Fin qui, soltanto rapporti limitati sono stati descritti per quanto riguarda la ciclizzazione del tiolo-ene/tiolo-yne peptide. In uno studio pubblicato da Anseth et al. nel 2009, una reazione su resina intramolecolare del tiolo-ene per ciclizzazione del peptide tra alcheni attivati con cisteina è stata dimostrata33. Nel 2015, Chou et al. descritto una reazione del due-componente radicale avviato tiolo-ene per peptide pinzatura34 e una reazione di accoppiamento del tiolo-yne/ene successivi, sequenziale35. Recentemente, abbiamo descritto una serie di lavoro basato su thioether/vinile solfuro tethered peptidi20,26,27. Questo protocollo descrive una sintesi dettagliata dei peptidi solfuro legato suddetto thioether/vinile nella speranza che esso sarà utile per la più ampia comunità di ricerca.
Protocollo
1. preparazione del materiale
- Per l'apparecchio manuale di sintesi del peptide, posizionare un collettore ad aspirazione (Tabella materiali) in una cappa efficiente. Successivamente, inserire rubinetti a tre vie sul collettore sottovuoto e collegarli ad una linea di gas azoto o argon. Chiudere tutti gli ingressi non utilizzati tramite setti in gomma.
- Collegare le colonne piene di resina (0,8 x 4 cm, serbatoio 10 mL, Vedi Tabella materiali) al collettore utilizzando il rubinetto di arresto di tre vie (Figura 1). Utilizzare una pompa collegata ad un sistema di vuoto come filtrazione sotto vuoto o un bulbo di gomma pipetta estrudendo per rimuovere il solvente nelle colonne.
- Uso un photoreactor (Figura 2), dotato di lampade di dieci 350 nm (Tabella materiali) per irradiazione UV. Collegarle ad un serbatoio di gas argon tramite la presa d'aria di photoreactor per garantire che il photoreactor è riempito con gas argon prima e durante i FOTOREAZIONI.
- Prima di accendere la lampada UV della photoreactor, assicurarsi che la porta di photoreactor è chiuso nel caso in cui c'è l'irradiazione della luce UV.
2. resina preparazione
Nota: In generale, la costruzione dei substrati del peptide è effettuata utilizzando protocolli di sintesi peptidica in fase solida Fmoc-basato. Questi sono effettuati utilizzando la resina di ammide di pista che lascia una C-terminale dell'ammide restanti seguenti peptide scissione. Questo protocollo viene utilizzato in tutto il libro.
Attenzione: N, N- dimetilformammide (DMF), diclorometano (DCM), 4-metilmorpholin-(NMM) e la N, N- diisoproylethylamine (DIPEA) sono tossico e nocivo per inalazione, ingestione o contatto con la pelle. Etere dietilico è estremamente infiammabile. Acido trifluoroacetico (TFA) è corrosivo. 1,2-etanditiolo (EDT) sono altamente maleodorante. Di conseguenza, tutti i solventi organici e prodotti chimici dovrebbero essere maneggiati con appropriati dispositivi di protezione individuale (guanti in nitrile, camice e occhiali protettivi) e gestiti all'interno di una cappa chimica.
- Calcolare la quantità di resina necessaria utilizzando la seguente formula:
scala (mmol) / (capacità di carico (mmol/g) 1.000 (mg/g) in resina) = massa di resina (mg)
Ad esempio, la quantità di pista ammide MBHA resina (0,5 mmol/g) per 25 µmol = 0.025 mmol / (0,5 mmol/g 1.000 mg/g) = 50 mg. Successivamente, pesare 50 mg di resina in una colonna e impostarlo sul collettore di aspirazione tramite rubinetti a tre vie. - Aggiungere 1-2 mL di DCM alla resina in una colonna (0,8 x 4 cm, serbatoio 10 mL). Per gonfiare la resina, agitare delicatamente utilizzando un flusso di azoto o argon per 10 min. Successivamente, togliere il solvente mediante filtrazione sotto vuoto.
3. lavaggio e deprotezione Fmoc N-terminale
- Preparare il Fmoc N-terminale comando soluzione: preparare un adeguato volume (200 mL) di 50% (v/v) morpholine in DMF in bottiglia di vetro.
- Aggiungere 1-2 mL di soluzione deprotezione alla resina, agitare delicatamente per 10 minuti e poi scolare la soluzione utilizzando un vuoto. Con DMF (1-2 mL) e DCM (1-2 mL) in quell'ordine, lavare la resina e il recipiente di reazione accuratamente per un totale di 3 volte. Quindi, ripetere le procedure deprotezione e lavare 1 x.
4. Fmoc-protetto amminoacido accoppiamento
- Tramite l'accoppiamento di residui di alanina ad esempio, nel caso di una sintesi manuale 25 µmol-scala, pesare Fmoc-Ala-OH (5 equiv., 41,4 mg), Esafluorofosfato di 2-(6-chloro-1H-benzotriazole-1-yl)-1,1,3,3-tetramethylaminium (HCTU; 4,9 equiv., 50,5 mg) in un contenitore in polipropilene e sciogliere in DMF (0,5 mL).
- Aggiungere DIPEA (10 equiv., µ l 43,5) al fine di generare un 0.25-M attivato soluzione dell'aminoacido (tabella 1). A seguito di pre-un'attivazione approssimativo 1 min, aggiungere la soluzione di resina e quindi di bolla con N2 per circa 1-2 h.
- Da questo punto, incorporare ogni amminoacido nella catena peptidica come una sequenza di passi: prima la deprotezione del N-terminale Fmoc-gruppo e quindi il lavaggio, seguita dall'accoppiamento dell'aminoacido via l'attivazione utilizzando HCTU.
Nota: Un più lungo tempo di accoppiamento (ad es., 2h) è consigliato se giunto a seguito di un residuo dell'amminoacido stericamente [ad es., Fmoc-Thr (tBu) - OH, Fmoc-Cys (Trt) - OH, Fmoc-His (Trt) - OH, Fmoc-Arg (Pbf) - OH]. L'alchenico/alchini cuscinetto amminoacidi non-naturali sono utilizzati in equivalenti di 3 invece di 5 e sono lasciati a reagire per 3 h. - Monitorare l'avanzamento di sintesi del peptide utilizzando test Kaiser o cloranile, come descritto da Arora et al. 36 questi test forniscono una valutazione qualitativa della presenza o assenza di ammine primarie e secondarie gratis. In alternativa, circa 2-3 mg del peptide possono essere spaccati dalla resina e analizzati mediante LC-MS.
5. tiolo-ene Hydrothiolation e del tiolo-yne ciclizzazione
- Costrutto linker tioetere attraverso il resina ciclizzazione (Figura 3).
- Preparare circa 50 mL della soluzione deprotezione Trt (TFA/TIS/DCM 0.03/0.06/1.0). Trattare la Cys - e mS5-cuscinetto resina [NH2-R-mS5-A-A-A-Cys (Trt)-R'-resina, 50mg] con 1-2 mL della soluzione di deprotezione Trt in una colonna di 10 mL. Agitare delicatamente la soluzione per 10 min utilizzando N2. Infine, lavarlo con DCM (1-2 mL) per un totale di 3 volte.
Nota: MS5 rappresenta il blocco di costruzione alchene-cuscinetto (Vedi la struttura raffigurata nella Figura 6) utilizzato per peptide accoppiamento e thio-ene ciclizzazione38. - Ripetere la procedura descritta sopra per un totale di circa 6 x al fine di rimuovere il gruppo di protezione trityl della cisteina, fino a quando il colore della soluzione non è più giallo.
- Gorgogliare con N2, lavare il R-mS5- A-A-A-Cys(-SH)-R'-resina [cisteina con thio gratis (-SH)] con DMF (1-2 mL) e DCM (1-2 mL) in quell'ordine. Compattare la resina con metanolo (1-2 mL) per 2 minuti e poi rimuovere il solvente mediante filtrazione. Successivamente, in sequenza e asciugare la resina sotto un vapore di gas di2 N per circa 5 min nella colonna.
- Preparare in anticipo, DMF degassato all'interno di un fiasco di bocca, di bubbling azoto gassoso per circa 1h attraverso un lungo ago che è stato allungato in solvente.
- Trasferire la resina in un pallone a fondo rotondo 10 mL attraverso carta da pesare. Sospendere la resina in 2 mL del DMF degassato seguito dall'aggiunta del fotoiniziatore 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone (MMP; 1 equiv., 5,6 mg), 4-metossiacetofenone (mappa; 1 equiv., 3,8 mg).
- Aggiungere una mescolare barra (0,3 cm) nel pallone e il pallone con un tappo in gomma adatto di cap, quindi spostare l'aria nel pallone con gas azoto utilizzando una pompa dell'olio.
Nota: L'atmosfera inerte non è strettamente necessario per la fotoreazione efficace thio-ene su fase solida. Tuttavia, è molto necessario per la fotoreazione thio-yne in fase di soluzione nella Figura 5. In caso contrario, lo zolfo si ossida durante l'irradiazione UV. - Impostare il pallone di reazione nella photoreactor e mescolare la resina per 1h sotto irradiazione UV a temperatura ambiente (Figura 2).
Attenzione: Prima di accendere la lampada UV photoreactor, assicurarsi che la porta photoreactor è chiusa in caso di irradiazione è nocivo dalla luce UV.
Nota: Frequentemente la miscela di reazione di campionamento durante i FOTOREAZIONI è consigliabile per le nuove sequenze, come il precursore del peptide lineare ha l'identico peso molecolare del prodotto. In generale, peptidi lineari e ciclici visualizzare significativamente differente idrofilia. Questo potrebbe essere facilmente distinto mediante HPLC. In alternativa, il 5, 5' - ditiobis-(acido 2-nitrobenzoico) reagente (DTNB) potrebbe essere utilizzato anche per studiare la presenza di libero tiolo37. - Trasferire la resina dal pallone nella colonna e rimuovere il solvente mediante filtrazione sotto vuoto. Lavare e asciugare la resina come descritto al punto 5.1.3.
- Preparare circa 10 mL di cocktail la scissione (TFA/suggerimenti/EDT/H2O 94/1/2.5/2.5) nella cappa.
- Trasferire la resina in un contenitore in polipropilene 2 mL, aggiungere 1 mL di cocktail di clivaggio (TFA/suggerimenti/EDT/H2O 94/1/2.5/2.5) al contenitore e sigillare il contenitore ermeticamente con un tappo a vite. Quindi, agitare delicatamente il contenitore in un agitatore orbitale a una velocità di 60 rpm nella cappa per 1,5-2 h.
Attenzione: TFA è altamente corrosivo. Indossare indumenti protettivi e lavorare in una cappa efficiente. EDT è una sostanza altamente maleodorante e deve essere gestito in una cappa efficiente. - Rimuovere il cocktail TFA per evaporazione sotto un flusso di gas N2 nella cappa. Successivamente, precipitare il residuo usando freddo etere dietilico (1 mL) per 30 s e isolate tramite centrifugazione a 12.000 x g per 2 min. Dopo la centrifugazione, delicatamente versare il componente di etere. Ripetere i passaggi precipitato e centrifugazione per 2x. Evaporare il residuo di secchezza.
- Infine, disciogliere il residuo in 1 mL di H2O/acetonitrile (2:1) e purificare da HPLC usando una colonna analitica C18 (4.6 x 250 mm, portata nominale di 1,0 mL/min). Uso H2O (contenente 0,1% TFA) ed acetonitrile puro come solventi in una sfumatura lineare 2%/min dal 20% al 70% acetonitrile sopra 25 min spettri di Monitor HPLC usando UV 280 nm e 220 lunghezze d' (tabella 2) onda nm.
- Preparare circa 50 mL della soluzione deprotezione Trt (TFA/TIS/DCM 0.03/0.06/1.0). Trattare la Cys - e mS5-cuscinetto resina [NH2-R-mS5-A-A-A-Cys (Trt)-R'-resina, 50mg] con 1-2 mL della soluzione di deprotezione Trt in una colonna di 10 mL. Agitare delicatamente la soluzione per 10 min utilizzando N2. Infine, lavarlo con DCM (1-2 mL) per un totale di 3 volte.
- Costruire il linker tioetere attraverso reazione intermolecolare thio-ene e poi cyclize il peptide di macrolactamization (Figura 4).
- Sintetizzare il residuo alchilico recanti il peptide lineare H2N-A-A-A-mS5(2-R ')-R'-resina (50 mg) con una sintesi del peptide di fase solida Fmoc-based standard (SPPS) come descritto nei passaggi 2-4. Successivamente, lavare e asciugare la resina come descritto al punto 5.1.3.
- Sospendere la resina in un pallone a fondo rotondo 10 mL contenente 2 mL del DMF degassato come descritto al punto 5.1.4.
- Aggiungere il fotoiniziatore MMP e mappa (MMP: 1 equiv., 5,6 mg; Mappa: 1 equiv., 3,8 mg), Fmoc-Cys-OH (3 equiv., 25,7 mg) e scalpore barra (0,3 cm) nel pallone. Tappare la beuta con un tappo in gomma adatto e quindi utilizzare la pompa dell'olio per sostituire l'aria nel pallone con azoto.
- Impostare il pallone di reazione nella photoreactor. Mescolare per 1-2 h sotto irradiazione UV a temperatura ambiente (Figura 2).
- Monitorare la reazione sotto un'analisi LC-MS: cleave 2-3 mg della resina con il cocktail di clivaggio. Poi precipitare il residuo con freddo etere dietilico (300 µ l), isolare il residuo mediante centrifugazione ed evaporare i residui di secchezza come descritto nel passaggio 5.1.11. Dopo di che, disciogliere il residuo in 100 µ l di H2O/acetonitrile (2:1). La soluzione di peptide utilizzando una pellicola microporosa da 0,22 µm del filtrato e analizzarlo mediante LC-MS con il composto ionizzato nell'ionizzazione electrospray (ESI) e gestito in modo positivo.
- Se necessario, ripetere i passaggi 5.2.2 - 5.2.4 affinché la reazione avviene al completamento.
- A seguito del completamento della foto-reazione, trasferire la resina dal pallone nella colonna e rimuovere il solvente mediante filtrazione sotto vuoto. Lavare e asciugare la resina come descritto al punto 5.1.3.
- Aggiungere la soluzione DMF di Esafluorofosfato di benzotriazolo-1-yl-oxytripyrrolidinophosphonium (PyBob; 2,4 equiv., 31,2 mg), 1-parola (HoBt; 2,4 equiv., 8,1 mg) e NMM (4 equiv., 11 µ l) per la resina nella colonna per la macrolactamization. Bolla di questa soluzione con N2 per 2 h.
- Inoltre, monitorare la reazione di accoppiamento mediante LC-MS come descritto al punto 5.2.3. Se necessario, ripetere questo passaggio per garantire la reazione avviene al completamento.
- Allungare il peptide utilizzando standard basati su Fmoc SPPS come descritto nei passaggi 3 e 4.
- All'Assemblea di tutti i residui dell'amminoacido, fendere il peptide dalla resina, come descritto nei passaggi 5.1.10 e 5.1.11 e purificarla come descritto nel passaggio 5.1.12.
- Costrutto del linker di solfuro di vinile in fase di soluzione (Figura 5).
- Sintetizzare il residuo di alchini cuscinetto lineare del peptide utilizzando standard basati su Fmoc SPPS come descritto nei passaggi 2-4. Sintetizzare l'alchino cuscinetto dell'amminoacido secondo un protocollo ben stabilito come descritto in un precedente studio20.
- Fendere il peptide dalla resina e precipitare utilizzando etere etilico freddo come descritto nei passaggi 5.1.9 - 5.1.11. Dopo la scissione e la precipitazione della resina, raccogliere il peptide mediante centrifugazione a 12.000 x g per 2 min.
- Asciugare il residuo risultante in un vuoto. Sciogliere il residuo con il DMF degassato (50 mL) in un pallone a fondo rotondo da 100 mL al fine di raggiungere una concentrazione finale di 0.5 mM (basato sul carico di resina, 0.025 mmol (1000 mL/L / 0,5 mmol/L) = 50 mL).
- Aggiungere il fotoiniziatore DMPA (0,5 equiv., 3,2 mg) e poi degassare la soluzione di reazione per 10 min utilizzando N2 attraverso un lungo ago allungato nella soluzione. Successivamente, irradiare il campione sotto UV luce a temperatura ambiente per 0,5 - 1 h senza agitazione.
- Rimuovere il DMF sotto alto vuoto e precipitare il residuo grezzo con l'aggiunta di etere etilico al fine di sciogliere i suoi sottoprodotti organici. Quindi, isolare il residuo mediante centrifugazione a 12.000 x g per 2 min. Dopo la centrifugazione, delicatamente versare il componente di etere. Evaporare il residuo di secchezza. Infine, disciogliere il residuo in 1 mL di H2O/acetonitrile (2:1) e purificarlo mediante HPLC come descritto al punto 5.1.7.
Risultati
Gli spettri di HPLC e MS del peptide Ac-YmS5AAAC-NH2 e il suo prodotto ciclizzata Ac - Y-(cyclo-1,5)-[mS5AAAC] - NH2 che sono stati generati usando la fotoreazione su resina intramolecolare del tiolo-ene sono raffigurati in Figura 6B. il peptide ciclico è stato trovato per avere un peso molecolare identico rispetto al suo precursore lineare. Tuttavia, suo tempo di ritenzione HPLC è stato osservato per essere circa 2 min prima di quello dei suoi precursori alle stesse condizioni di separazione. Brevi peptidi con sequenze diverse sono stati tutti osservati per avere una buona conversione, come illustrato nella Figura 6.
Il processo di screening per le condizioni di fotoreazione thio-yne è raffigurato in figura 7B, e la conversione di isomero e rapporto sono stati determinati utilizzando l'integrazione di HPLC in fase inversa. Solo i livelli di traccia di peptide c 2 sono stati osservati dopo irradiazione UV. Ciò è probabilmente dovuto una preferenza conformazionale per un intrappolamento della thiyl radicale al N-terminale durante la fase di contraente di un macrociclo 20-membered. Entrambi i peptidi 1a e 1b sono stati trovati per generare due isomeri con un vinile di 8 membri solfuro crosslink. Peptidi 2a-A e 2a-B, che sono stati generati da peptide 1a, esposte in tempi di ritenzione distinti, nonché diversi rapporti per irradiazione UV diverso tempi (0 - 30 min) (Figura 7). Questi sono stati assegnati come gli isomeri E/Z a causa di doppio legame protone segnali su 1spettroscopia 1H-NMR (Figura 7). Nel caso di peptidi 2d-2f, il Z-isomero è stato trovato per essere il prodotto dominante. Ciò è probabilmente dovuto la preferenza conformazionale durante la costruzione di una struttura compatta rispetto il crosslink solfuro di vinile di 8 membri. Come raffigurato in Figura 7E, secondo lo spettro di dicroismo circolare (CD), peptidi 2a-A/B e 2b-A/B che possiedono un vinile di 8 membri solfuro crosslink esibiscono una bobina casuale, mentre peptide 2d che possiede un vinile 7 membri solfuro crosslink esibisce un conformazione elicoidale. In sintesi, il Z-isomero del legame di solfuro di vinile è stato trovato per essere formato preferenzialmente e visualizzata un'induzione di elica migliore.

Figura 1: apparecchi di manuale di sintesi del peptide di sintesi del peptide di fase solida. Le colonne erano poste sul collettore di aspirazione attraverso il rubinetto di arresto di tre vie e l'apparecchio è stato collegato a una linea di gas azoto o argon per il gorgogliare. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: il dispositivo di photoreactor utilizzato per i FOTOREAZIONI. Il dispositivo è dotato di lampade dieci 350 nm (Tabella materiali) per irradiazione UV e un serbatoio di gas argon per garantire che il photoreactor è stato riempito con gas argon prima e durante i FOTOREAZIONI. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: reazione intramolecolare del tiolo-ene nel caso dei peptidi più brevi su resina. Questa reazione è stata effettuata utilizzando un su-resina deprotezione dei gruppi trityl di residui di cisteina seguendo la sintesi completa del peptide lineare e quindi impostare la resina per l'irradiazione di ultravioletti usando i fotoiniziatori mappa e MMP. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: su-resina reazione intermolecolare thio-ene. Questa reazione era effettuata tramite la dissoluzione di Fmoc-Cys-OH nel solvente DMF e quindi irradiata con il residuo del peptide alchenico-cuscinetto sulla resina, seguita da un macrolactamization utilizzando PyBop, HoBt e NMM come reagenti di attivazione. Poi è stata continuata la sintesi peptidica utilizzando un SPPS standard. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: reazione intramolecolare del tiolo-yne in fase di soluzione. Questa reazione è stata condotta durante la fase di soluzione successiva la sintesi completa del peptide lineare, dopo di che il peptide lineare è stato dissolto in DMF degassato e irradiati con luce UV il fotoiniziatore DMPA. Clicca qui per visualizzare una versione più grande di questa figura.
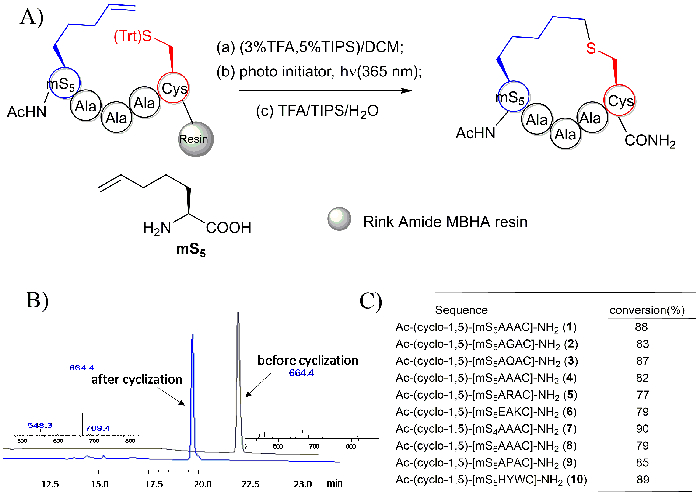
Figura 6: Thioether tethered peptidi ciclici generati utilizzando una reazione su resina intramolecolare del tiolo-ene. A. questo pannello mostra lo schema della reazione su resina intramolecolare thio-ene. mS5: "m" rappresenta gli aminoacidi olenic mono-sostituiti, "S" rappresenta l'aminoacido S configurato e "5" si riferisce al numero di atomi di lato catena38. B. questo pannelli Mostra gli spettri MS e di HPLC del peptide Ac-YmS5AAAC-NH2 prima e dopo la ciclizzazione. C. questo pannello mostra la conversione dei peptidi ciclici con sequenze diverse. Questa figura è stata modificata da Zhao, b. et al.28 Clicca qui per visualizzare una versione più grande di questa figura.
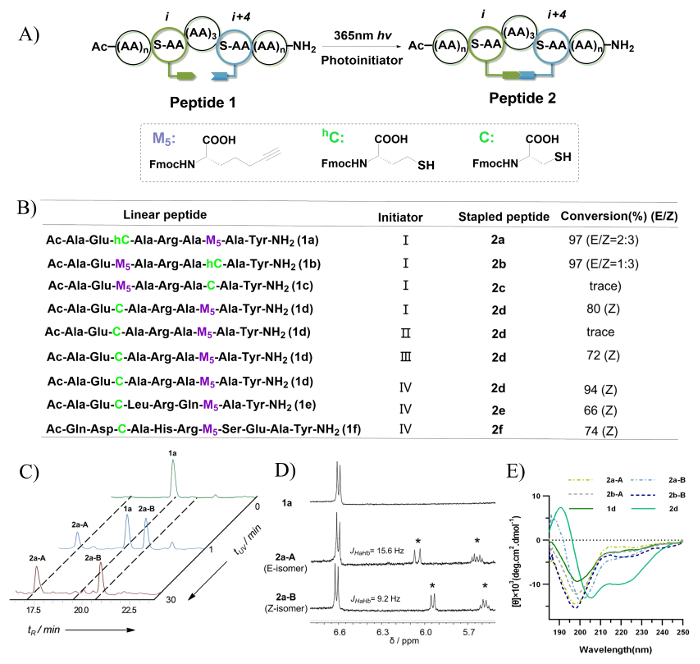
Figura 7: Peptide pinzatura attraverso foto-indotta del tiolo-yne hydrothiolation. A. si tratta di un'illustrazione schematica di intramolecolare del tiolo-yne hydrothiolation. B. questo pannello mostra le sequenze peptidiche valutate in questo studio. Iniziatore: (I) 0,5 EQ. DMPA, 1h; (II) nessun iniziatore, 1h; (III) 0,5 EQ. DMPA, 0,5 EQ. mappa, 1 h; (IV) 0,5 EQ. MMP, 0,5 h. C. Questo pannello mostra le tracce HPLC della miscela di reazione del peptide 1a con differenti tempi di irradiazione UV e monitorati a 220 nm. D. questo pannello mostra il 1H-NMR spettri di 1a, 2a-A e 2a-B (misurata in DMSO-d6 a 400 MHz). Gli asterischi indicano la formazione di un legame doppio di solfuro vinile dopo l'irradiazione UV. E. questo pannello Mostra gli spettri di dicroismo circolare di peptidi con legami incrociati di solfuro di vinile. Questa figura è stata modificata da Tian, Y. et al. 44 Clicca qui per visualizzare una versione più grande di questa figura.
| Materiali | MW | N(0.5mmol / g resina × 0. 0 5 g × 5eq.) | M(amminoacido) (mg) |
| (Da) | (mmol) | ||
| Fmoc-Gly-OH | 297 | 0,125 | 37.1 |
| Fmoc-Ala-OH | 331 | 0,125 | 41,4 |
| Fmoc-Val-OH | 339 | 0,125 | 42,4 |
| Fmoc-Leu-OH | 353 | 0,125 | 44.1 |
| Fmoc-Ile-OH | 353 | 0,125 | 44.1 |
| Fmoc-Pro-OH | 337 | 0,125 | 42.1 |
| Fmoc-Phe-OH | 387 | 0,125 | 48,4 |
| Fmoc-Tyr (tBu)-OH | 460 | 0,125 | 57,5 |
| Fmoc-Trp (Boc)-OH | 527 | 0,125 | 65,9 |
| Fmoc-Ser (tBu)-OH | 384 | 0,125 | 48 |
| Fmoc-Thr (tBu)-OH | 398 | 0,125 | 49,8 |
| Fmoc-Cys (Trt)-OH | 586 | 0,125 | 73,3 |
| Fmoc-incontrato-OH | 372 | 0,125 | 46,5 |
| Fmoc-Asn (Trt)-OH | 597 | 0,125 | 74,6 |
| Fmoc-Gln (Trt)-OH | 611 | 0,125 | 76,4 |
| Fmoc-Asp (OtBu)-OH | 412 | 0,125 | 51,5 |
| Fmoc-Glu (OtBu)-OH | 426 | 0,125 | 53,3 |
| Fmoc-Lys (Boc)-OH | 469 | 0,125 | 58,6 |
| Fmoc-Arg (Pbf)-OH | 617 | 0,125 | 77,1 |
| Fmoc-HSI (Trt)-OH | 620 | 0,125 | 77,5 |
| HCTU | 414 | 0,122 | 50.5 |
| DIPEA | 129 | 0.25 | 43.5(ΜL) |
| DMF | 0,5 mL | ||
Tabella 1: Gli importi delle condizioni di accoppiamento.
| Colonna | Colonna di Zorbax SB-Aq, 4,6 × 250 mm (dimensione dei pori 80 Å, particella dimensione 5 μm) |
| Solventi | R: acqua, 0,1% (vol/vol) TFA; B: acetonitrile |
| Tasso di flusso | 1 mL/min |
| Gradiente | B 20-70% (vol/vol) oltre 25 min; 70% - 98% oltre 5 min; 98% oltre 5min; |
| Volume di iniezione | 30 – 500 ΜL |
| Lunghezza d'onda (nm) | 280 (per peptidi Fmoc-, Trp - o contenenti Tyr), o 494 (FITC-labeled peptidi) o 220 (per gli altri) |
Tabella 2: Condizioni di cromatografia liquida ad alte prestazioni.
Discussione
Nella ciclizzazione intramolecolare su resina thio-ene descritti nella Figura 3, la rimozione del gruppo trityl di un residuo di cisteina è stata trovata per essere un passo fondamentale per la successiva fotoreazione. Inoltre, il peso molecolare del peptide prima di e dopo che la reazione è stata trovata per essere identici come raffigurato in Figura 6B. Pertanto, l'uso di un'identificazione di HPLC o un'analisi DTNB è necessaria al fine di monitorare la reazione. Nel caso la reazione intermolecolare thio-ene designata nella Figura 4, MS monitoraggio è necessaria. Mentre un ulteriore passo di accoppiamento lattame è stato trovato per essere richiesto per la costruzione di una cavezza thioether, suggeriamo questo protocollo verrà utilizzato per i peptidi lunghi al fine di raggiungere un'efficienza totale superiore.
Il legame di solfuro di vinile generato dalla fotoreazione thio-yne non era stabile nella soluzione fortemente acida TFA che viene utilizzata per la scissione di resina. Pertanto, l'uso della fotoreazione thio-yne in fase di soluzione è stata adottata. Questa reazione è stata diluita ad una concentrazione bassa (0,5 mM) al fine di evitare di reazioni intermolecolari potenziali. Inoltre è altrettanto importante degassare il solvente al fine di evitare l'ossidazione del prodotto durante i FOTOREAZIONI. A seguito della reazione, il vuoto evaporazione del solvente organico che DMF dovrebbe anche essere accuratamente effettuato al fine di prevenire l'ammortamento di ossidazione/degradazione o macchine di peptide. La reazione di ciclizzazione di thio-yne descritta nella Figura 5 fornisce un meccanismo per la sintesi del post-peptide modifica35.
Mentre la reazione intramolecolare del tiolo-ene generato thioether tethered peptidi con buona conversione, un collegamento incrociato semplice thioether fallito vincolare i peptidi nella conformazione elicoidale desiderata. Basato su questa strategia il tether modifica, è stato sviluppato un concetto di elicità peptide indotte in tether centro chirale, dove il γ sostituito gruppo con la configurazione R presso il peptide C-terminale è stato in grado di indurre la conformazione elicoidale di peptide ( Figura 4)39,40. La limitazione connessa con questo approccio è la sintesi dell'amminoacido innaturale enantiomericamente puro con due centri chirali (α (S), γ(R))41,42.
Questa ricerca ha dimostrato che la reazione di thio-yne può vincolare il peptide in una conformazione elicoidale con buona conversione, come illustrato nella Figura 7E. In termini di costruzione di peptidi elicoidale, si consiglia di thio-yne fotoreazione per la costruzione di peptidi elicoidale. La ciclizzazione intramolecolare su resina thio-ene è stato dimostrato per essere adatto per la costruzione dei peptidi di tether thioether breve (meno di 15) nel caso in cui lunghi peptidi sono troppo flessibili per garantire efficace ciclizzazione. Inoltre, la ciclizzazione su resina intermolecolari thio-ene è consigliato per ciclizzazione del peptide lungo.
In sintesi, abbiamo sviluppato una serie di protocolli di chimici per la costruzione dei peptidi di solfuro tethered thioether/vinile attraverso l'uso di photoinduced thio-ene/thio-yne clic chimica. La reazione è efficiente, privo di catalizzatore, conveniente per manipolazioni in metallo ed è stata dimostrata per possedere una tolleranza superiore gruppo funzionale e bio-ortogonale. Inoltre, questo metodo è stato sviluppato al fine di stabilizzare altre strutture secondarie del peptide come un β-tornante43,44. Questa carta mostra che il tether thioether fornisce un sito di traceless modification. Questo si espande in gran parte dallo spazio chimico seguito di modifiche apportate di sintesi del peptide. Inoltre, i peptidi di solfuro tethered alifatici thioether/vinile che ha esibito una tossicità ridotta membrana rispetto i peptidi fiocco di idrocarburi vengono applicati in diverse applicazioni biologiche con dimostrata buona bioattività e biodisponibilità di45,46.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori riconoscono sostegno finanziario dalle sovvenzioni Fondazione di Cina in scienze naturali (n. 21372023, 21778009 e 81701818); il Ministero della scienza e della tecnologia della Repubblica popolare cinese (n. 2015DFA31590); La Shenzhen Comitato scientifico e tecnologico dell'innovazione (No. JCYJ20170412150719814, JCYJ20170412150609690, JCYJ20150403101146313, JCYJ20160301111338144, JCYJ20160331115853521, JSGG20160301095829250 e GJHS20170310093122365); e la Cina post-dottorato Science Foundation (n. 2017 M 610704).
Materiali
| Name | Company | Catalog Number | Comments |
| Rink Amide MBHA resin(0.53 mmol/g) | HECHENG | GRM50407 | |
| Standard Fmoc-protected amino acids | GL Biochem (Shanghai) Ltd. | ||
| N-Methyl-2-pyrrolidinone | Shenzhen endi Biotechnology Co.Ltd. | 3230 | skin harmful |
| N,N-Dimethyl formamide | Energy | B020051 | skin harmful |
| Dichloromethane | Energy | W330229 | skin harmful |
| N,N-Diisoproylethylamine | Aldrich | 9578 | irritant |
| Trifluoroacetic acid | J&K | 101398 | corrosive |
| Triisopropylsilane | J&K | 973821 | |
| 1,2-Ethanedithiol | J&K | 248897 | Stench |
| 2-(6-Chloro-1H-benzotriazole-1-yl)-1,1,3,3-tetramethylaminium hexafluorophosphate | GL Biochem (Shanghai) Ltd. | 851012 | |
| Morpholine | Aldrich | M109062 | irritant |
| Diethyl ether | Aldrich | 673811 | flammable |
| Acetonitrile | Aldrich | 9758 | toxicity |
| Methanol | Aldrich | 9758 | toxicity |
| 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone | Energy | A050035 | |
| 4-methoxyacetophenone | Energy | A050098 | |
| 2,2-dimethoxy-2-phenylacetophenone | Energy | D070132 | |
| 5,5'-Dithiobis-(2-nitrobenzoic acid) | J&K | 281281 | |
| Benzotriazole-1-yl-oxytripyrrolidinophosphonium hexafluorophosphate | Energy | E020172 | |
| 1-Hydroxybenzotriazole | Energy | D050256 | |
| 4-Methylmorpholine | Energy | W320038 | |
| High Performance Liquid Chromatography | SHIMADZU | LC-30AD | |
| Electrospray Ionization Mass | SHIMADZU | LCMS-8030 | |
| Lyophilizer | Labconco | FreeZone | |
| SpeedVac concentration system | Thermo | Savant | |
| vacuum manifold | promega | A7231 | |
| three-way stopcocks | Bio-Rad | 7328107 | |
| poly-prep chromatography columns | Bio-Rad | 7311550 |
Riferimenti
- Pelay-Gimeno, M., Glas, A., Koch, O., Grossmann, T. N. Structure-based design of inhibitors of protein-protein interactions: mimicking peptide binding epitopes. Angewandte Chemie International Edition. 54 (31), 8896-8927 (2015).
- Passioura, T., Katoh, T., Goto, Y., Suga, H. Selection-based discovery of druglike macrocyclic peptides. Annual Review of Biochemistry. 83, 727-752 (2014).
- Gonzalez, M. W., Kann, M. G. Protein interactions and disease. PLoS Computational Biology. 8 (12), 1-11 (2012).
- Wilson, A. J. Inhibition of protein-protein interactions using designed molecules. Chemical Society Reviews. 38 (12), 3289-3300 (2009).
- Teresa, A. F. C., Alessio, C. Cyclic and macrocyclic peptides as chemical tools to recognise protein surfaces and probe protein-protein interactions. ChemMedChem. 11 (8), 787-794 (2016).
- Craik, D. J., Fairlie, D. P., Liras, S., Price, D. The future of peptide-based drugs. Chemical Biology & Drug Design. 81 (1), 136-147 (2013).
- Cromm, P. M., Spiegel, J., Grossmann, T. N. Hydrocarbon stapled peptides as modulators of biological function. ACS Chemical Biology. 10 (6), 1362-1375 (2015).
- Zhang, Q. Z., Tian, Y., Lao, Y. Z., Li, Z. G. Peptides-staple method development and its application in cancer therapy. Current Medicinal Chemistry. 21 (21), 2438-2452 (2014).
- Cromm, P. M., Spiegel, J., Grossmann, T. N. Hydrocarbon stapled peptides as modulators of biological function. ACS Chemical Biology. 10 (6), 1362-1375 (2015).
- Wang, D., Liao, W., Arora, P. S. Enhanced metabolic stability and protein-binding properties of artificial alpha helices derived from a hydrogen-bond surrogate: application to Bcl-xL. Angewandte Chemie International Edition. 44 (40), 6525-6529 (2005).
- Bullock, B. N., Jochim, A. L., Arora, P. S. Assessing helical protein interfaces for inhibitor design. Journal of the American Chemical Society. 133, 14220-14223 (2011).
- Jackson, D. Y., King, D. S., Chmielewski, J., Singh, S., Schultz, P. G. General approach to the synthesis of short α-helical peptides. Journal of the American Chemical Society. 113 (24), 9391-9392 (1991).
- Timmerman, P., Beld, J., Puijk, W. C., Meloen, R. H. Rapid and quantitative cyclization of multiple peptide loops onto synthetic scaffolds for structural mimicry of protein surfaces. ChemBioChem. 6 (5), 821-824 (2005).
- Muppidi, A., Wang, Z., Li, X., Chen, J., Lin, Q. Achieving cell penetration with distance-matching cysteine cross-linkers: a facile route to cell-permeable peptide dual inhibitors of Mdm2/Mdmx. Chemical Communications. 47 (33), 9396-9398 (2011).
- Schafmeister, C. E., Po, J., Verdine, G. L. An all-hydrocarbon cross-linking system for enhancing the helicity and metabolic stability of peptides. Journal of the American Chemical Society. 122 (24), 5891-5892 (2000).
- Osapay, G., Taylor, J. W. Multicyclic polypeptide model compounds. 1. synthesis of a tricyclic amphiphilic alpha-helical peptide using an oxime resin, segment-condensation approach. Journal of the American Chemical Society. 112 (16), 6046-6051 (1990).
- Lau, Y. H., Andrade, d. P., Wu, Y., Spring, D. R. Peptide stapling techniques based on different macrocyclisation chemistries. Chemical Society Reviews. 44 (1), 91-102 (2015).
- Spokoyny, A. M., Zou, Y., Ling, J. J., Yu, H., Lin, Y. S., Pentelute, B. L. A perfluoroaryl-cysteine S(N)Ar chemistry approach to unprotected peptide stapling. Journal of the American Chemical Society. 135 (16), 5946-5949 (2013).
- Lautrette, G., Touti, F., Lee, H. G., Dai, P., Pentelute, B. L. Nitrogen arylation for macrocyclization of unprotected peptides. Journal of the American Chemical Society. 138 (27), 8340-8343 (2016).
- Tian, Y., et al. Stapling of unprotected helical peptides via photoinduced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- Chang, Y. S., et al. Stapled α-helical peptide drug development: a potent dual inhibitor of MDM2 and MDMX for p53-dependent cancer therapy. Proceedings of the National Academy of Sciences of the United States of America. 110 (36), 3445-3454 (2013).
- Zhao, H., et al. Crosslinked aspartic acids as helix-nucleating templates. Angewandte Chemie International Edition. 55 (39), 12088-12093 (2016).
- Leshchiner, E. S., et al. Direct inhibition of oncogenic KRAS by hydrocarbon-stapled SOS1 helices. Proceedings of the National Academy of Sciences of the United States of America. 112 (6), 1761-1766 (2015).
- Wang, D., Qin, X., Zhao, H., Li, Z. N-cap helix nucleation: methods and their applications. Science China Chemistry. 60 (6), 689-700 (2017).
- Zorzi, A., Deyle, K., Heinis, C. Cyclic peptide therapeutics: past, present and future. Current Opinion in Chemical Biology. 38, 24-29 (2017).
- Hu, K., et al. An in-tether chiral center modulates the helicity, cell permeability, and target binding affinity of a peptide. Angewandte Chemie International Edition. 55 (28), 8013-8017 (2016).
- Lin, H., Jiang, Y., Zhang, Q., Hu, K., Li, Z. An in-tether sulfilimine chiral center induces helicity in short peptides. Chemical Communications. 52 (68), 10389-10391 (2016).
- Zhao, B., Zhang, Q., Li, Z. Constructing thioether-tethered cyclic peptides via on-resin intra-molecular thiol-ene reaction. Journal of Peptide Science. 22 (8), 540-544 (2016).
- Dondoni, A., Massi, A., Nanni, P., Roda, A. A new ligation strategy for peptide and protein glycosylation: photoinduced thiol-ene coupling. Chemistry. 15 (43), 11444-11449 (2009).
- Hu, K., Sun, C., Li, Z. Reversible and versatile on-tether modification of chiral-center-induced helical peptides. Bioconjugate Chemistry. 28 (7), 2001-2007 (2017).
- Shi, X., Jiang, Y., Yang, D., Zhao, H., Tian, Y., Li, Z. Reversibly switching the conformation of short peptide through in-tether chiral sulfonium auxiliary. Chinese Chemical Letters. , (2017).
- Jiang, Y., et al. Switching substitution groups on the in-tether chiral centre influences backbone peptides' permeability and target binding affinity. Organic & Biomolecular Chemistry. 15 (3), 541-544 (2017).
- Aimetti, A. A., Shoemaker, R. K., Lin, C. C., Anseth, K. S. On-resin peptide macrocyclization using thiol-ene click chemistry. Chemical Communications. 46 (23), 4061-4063 (2010).
- Wang, Y. X., Chou, D. H. C. A thiol-ene coupling approach to native peptide stapling and macrocyclization. Angewandte Chemie International Edition. 54 (37), 10931-10934 (2015).
- Wang, Y., et al. Application of thiol-yne/thiol-ene reactions for peptide and protein macrocyclizations. Chemistry. 23 (29), 7087-7092 (2017).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Ozyurek, M., Baki, S., Gungor, N., Celik, S. E., Guclu, K., Apak, R. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, Q. Z., et al. Chiral sulfoxide-induced single turn peptide α-helicity. Scientific Reports. 6, 38573 (2016).
- Lin, H., et al. An in-tether sulfilimine chiral center induces beta-turn conformation in short peptides. Organic & Biomolecular Chemistry. 14 (42), 9993-9999 (2016).
- Hu, K., Li, W., Yu, M., Sun, C., Li, Z. Investigation of cellular uptakes of the in-tether chiral-center-induced helical pentapeptides. Bioconjugate Chemistry. 27 (12), 2824-2827 (2016).
- Hu, K., et al. A precisely positioned chiral center in an i, i + 7 tether modulates the helicity of the backbone peptide. Chemical Communications. 53 (50), 6728-6731 (2017).
- Li, J., et al. An in-tether chiral center modulates the proapoptotic activity of the KLA peptide. Chemical Communications. 53 (75), 10452-10455 (2017).
- Zhao, B., et al. A thioether-stabilized-D-proline-L-proline-induced β-hairpin peptide of defensin segment increases its anti-Candida albicans ability. ChemBioChem. 17 (15), 1416-1420 (2016).
- Tian, Y., Yang, D., Ye, X., Li, Z. Thioether-derived macrocycle for peptide secondary structure fixation. The Chemical Record. 17 (9), 874-885 (2017).
- Hu, K., Yin, F., Yu, M., Sun, C., Li, J., Liang, Y., Li, W., Xie, M., Lao, Y., Liang, W., Li, Z. G. In-tether chiral center induced helical peptide modulators target p53-MDM2/MDMX and inhibit tumor growth in stem-like cancer cell. Theranostics. 7 (18), 4566-4576 (2017).
- Tian, Y., Jiang, Y., Li, J., Wang, D., Zhao, H., Li, Z. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: a comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon