Method Article
チオエーテル/ビニール硫化テザー ヘリカル ペプチドによる光誘起チオール-エン/イン Hydrothiolation を構築します。
要約
光誘起チオール-エン ・ チオール-イン hydrothiolation を使用して硫化テザー ヘリカル ペプチドによるチオエーテル/ビニールの建設のためプロトコルを提案します。
要約
ここでは、樹脂の分子内・分子間チオール-エン hydrothiolation を用いるスルフィド テザー ペプチドの準備のための詳しいプロトコルについて述べる。さらに、このプロトコルは、私、私 + 4 の位置でアルケン/アルキン側鎖を有する amino acids やシステイン残基間のソリューションで分子内チオール-イン hydrothiolation を使用してビニール硫化テザーのペプチドの製造について説明します。標準 fmoc 保護基固相ペプチド合成法 (SPP) を用いた線形ペプチドを合成しました。チオール-エン hydrothiolation は、分子内のチオ-エン反応やペプチドの長さに応じての分子間チオ-エン反応を使用して実行されます。本研究では線形のペプチッドの完全な合成を次のシステイン残基のトリチル グループの樹脂の脱保護を使用して短いペプチドの場合分子内チオ-エン反応を行った。樹脂は紫外線重合 4 methoxyacetophenone (地図表示) と 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone (MMP) を使用して設定されます。N, N- ジメチルホルムアミド (DMF) 溶媒中で fmoc 保護-システイン-OH を溶解することにより分子のチオール-エン反応を行った。これは、樹脂のアルケン軸受残渣を用いたペプチドと反応しました。その後、macrolactamization は、樹脂の活性化試薬として 4-メチルモルホリン (NMM)、1-1-ヒドロキシベンゾトリアゾール (HoBt) ベンゾトリアゾール-1-イル-oxytripyrrolidinophosphonium ヘキサフルオロリン酸 (PyBop) を使用して実行されます。ペプチド合成を続けて次の macrolactamization、標準 SPP を使用しています。チオ-イン hydrothiolation の場合、線形のペプチドが樹脂から切断が乾燥、脱 DMF で解散。これが、紫外光を用いた光反応開始剤 2, 2-ジメトキシ-2-phenylacetophenone (DMPA) 照射されます。次の反応、DMF が蒸発と原油残渣の沈殿し高速液体クロマトグラフィー (HPLC) を使用して浄化します。これらのメソッドは、優れた官能性良好な収率を所有しているチオ-ene/イン クリック化学の使用によるチオエーテルつないだ環状ペプチドの生成を簡素化する機能でした。チオエーテル結合のペプチドへの導入はシステイン残基の求核性を活用して、ジスルフィド結合を基準にして酸化還元不活性。
概要
タンパク質間相互作用 (Ppi) を調節する配位子の開発は、現代の創の魅力的なアプローチを提供します。したがって、Ppi1,2,3を調節することができる効率的に勉強の新規化学療法に多大な労力を投資されています。Ppi は一般的に浅い、大きい、および/または廃止された相互作用面で構成され、小さな分子は通常 PPIs4、5の変調の不適切な配位子と見なされます。適切な露出相互作用する表面積、短いペプチッドは蛋白質の構造の特徴を模倣するこの問題6,7に対処するための理想的な候補者を表しています。しかし、短いペプチッドは通常水溶液中における構造化ではありません。これは、ペプチッド バックボーンと明確に定義された立体配座の分子内水素結合ネットワークと競合する水の分子は水8のエントロピー有利なためにです。さらに、ペプチドの本質的に低く安定性とセル透磁率特性は主として生物学的応用9,10での使用を制限します。蛋白質のデータ ・ バンク (PDB) の分析によれば > PPIs の 50% を含む短い α ヘリックスの相互作用11。したがって、らせんの安定化に関してさまざまな化学的方法が開発されています。これらは二硫化/チオエーテル結合形成12,13,14閉環メタセシス15ラクタム リング形成16など、「クリックして」化学17、添加perfluoroarenes18,19、そしてビニール硫化層20。
安定したヘリカル ペプチド p53 を含む、さまざまな細胞内対象広く活用されてエストロゲン受容体、Ras、BCL 2 ファミリーのタンパク質、その他21,22,23,24。ALRN-6924 すべて炭化水素 MDM2 および MDMX のペプチド デュアル阻害剤をホチキス止め、臨床調査25現在使用されています。過去数年間で私たちのグループは、チオール-エン ・ チオール-イン反応26,27,28を用いた新規ペプチド安定化方法の開発に集中しています。一般的に、我々 は自然豊かなシステインを使用する場合これらの写真開始反応が温和な条件下で効率的なことを実証しました。さらに、我々 はこれらの反応はバイオ - 直交、ペプチッドおよび蛋白質の修正29に適用する実証されていること、機能グループの優秀な耐性を持っているを示しています。結果チオエーテル/ビニール テザー硫化ペプチド主制約ペプチドの化学の領域を向上させる、不安定なテザーに変更センターを提供して多数のバイオ応用30 の使用のために適当であると証明、31,32。日には、限られたレポートのみをチオール-エン ・ チオール-イン ペプチド環化に関して記載されています。システインと活性アルケン間ペプチド環化の樹脂の分子内チオール-エン反応は年 Ansethらによって 2009 年に公表された研究、実証33です。2015 年に周ら。34と35以降、順次チオール イン/省エネアンバサダー カップリング反応をホチキス止めの 2 成分根本的な開始されるチオール-エン反応を説明しました。最近では、チオエーテル/ビニール テザー硫化ペプチド20,26,27に基づいた作業のシリーズについて説明しました。このプロトコルでは、それがより広い研究コミュニティに役立つことを希望に上記のチオエーテル/ビニール テザー硫化ペプチドの詳細な合成について説明します。
プロトコル
1. 機器の準備
- 手動ペプチド合成装置の効率的なヒューム フードに真空マニホールド (資材表) を配置します。次に、真空マニホールドに三方活栓を置き、窒素またはアルゴン ガス管線に接続します。ゴム隔壁を使用してすべての未使用の入り江をキャップします。
- 三方活栓 (図 1) を使用してマニホールドに樹脂充填柱 (0.8 x 4 cm、10 mL 貯水池は、材料表を参照) を接続します。押し出して真空ろ過やゴムバルブ ピペットとして真空システムに接続されたポンプを使用して、列に溶媒を削除します。
- 使用触媒反応管 (図 2)、UV 照射による 10 350 nm ランプ (資材表) を搭載します。これらの触媒反応管はアルゴン ガス前と光反応の中に満ちていることを確保するため触媒反応管の空気吸入口を経由して、アルゴン ガス タンクに接続します。
- 触媒反応管の UV ランプに切り替える前の UV 光から照射がある場合触媒反応管のドアが閉じていることを確認します。
2. 樹脂の準備
注: 一般に、ペプチッド基板の建設が実施 fmoc 保護基固相ペプチド合成プロトコルを使用しています。これらは C 末端アミド残り次ペプチド切断を残すリンク アミド樹脂を使用して実行されます。このプロトコルは、ホワイト ペーパーで使用されます。
注意: N, N- diisoproylethylamine (DIPEA) 4-メチルモルホリン (NMM)、ジクロロ メタン (DCM) N, N- ジメチルホルムアミド (DMF)、有毒で有害な吸入、摂取、または皮膚接触によって。ジエチル エーテルは非常に可燃性です。トリフルオロ酢酸 (TFA) は、腐食性です。1, 2-エタンジチ (EDT) は高い悪臭です。したがって、すべての有機溶剤や化学物質必要があります適切な個人用保護具 (保護眼鏡、白衣、ニトリル手袋) で処理して化学の発煙のフード内で処理されます。
- 次の式を使用して必要な樹脂の量を計算します。
スケール (モル)/(積載量 (モル/g) 1,000 (mg/g) ガレージ) 樹脂 (mg) の質量を =
など、25 µmol のスケート リンク アミド MBHA 樹脂 (0.5 mmol/g) の量 = 0.025 モル/(0.5 mmol/g 1,000 mg/g) = 50 mg。次に、列の樹脂の 50 mg の重量を量るし、三方活栓を使用して真空マニホールドにそれを設定します。 - (0.8 × 4 cm、10 mL 貯水池) 列でガレージに DCM の 1-2 の mL を追加します。樹脂を膨張するには、10 分の窒素またはアルゴンのストリームを使用した振ちましょう。次に、真空ろ過を使用して溶媒を除去します。
3. N 末端 fmoc 保護および洗濯
- N 末端 fmoc 保護ソリューションを脱保護の準備: ガラスの瓶で DMF に 50% (v/v) モルホリンの十分なボリューム (200 mL) を準備します。
- 樹脂に 1-2 mL の脱保護ソリューションを追加、10 分間振とう、真空を使用してソリューションを排出します。その順序で DMF (1-2 の mL) および DCM (1-2 mL) を使用して、樹脂と 3 倍の合計は徹底的に反応容器を洗います。次に、および洗浄の手順 1 を繰り返します x。
4. fmoc 保護保護アミノ酸の結合
- Fmoc 保護アラ オ (5 当量、41.4 mg) の重量を量る 25 µmol スケールの手動合成の場合、例としてアラニン残基の結合を用いた 2-(6-chloro-1H-benzotriazole-1-yl)-1,1,3,3-tetramethylaminium ヘキサフルオロリン酸 (HCTU; 4.9 当量、50.5 mg) で、ポリプロピレン容器、DMF (0.5 mL) に溶解します。
- 追加 DIPEA (10 当量、43.5 μ l) 0.25 M を生成するためにアクティブにアミノ酸ソリューション (表 1)。おおよそ 1 分前のアクティブ化後、樹脂にソリューションに追加し、N2約 1-2 時間のバブルします。
- このステップからステップのシーケンスとして各アミノ酸ペプチド鎖を組み込む: 最初 N 端末 fmoc 保護グループをクリックし、洗濯、脱保護に HCTU を使用しての活性化を介してアミノ酸のカップリング。
注: 長い結合時間 (e.g。、2 h) お勧め場合次の立体障害のアミノ酸残基結合 [e.g。、fmoc 保護 Thr (tBu) - ああ、fmoc 保護 Cys (Trt) - あ、fmoc 保護彼 (Trt) - ああ、fmoc 保護 Arg (Pbf) - あ]。非天然アミノ酸を含むアルケン/アルキンは 5 ではなく 3 同等で使用され、3 時間反応する残っています。 - アローラet al.による記述でカイザーまたはクロラニルのテストを使用してペプチド合成の進行状況を監視します。36これらのテストは、無料の第一次および二次アミンの定性的な評価の存在の有無を提供します。また、ペプチドの約 2-3 mg は樹脂から切断し、LC-MS による分析できます。
5. チオール-エン Hydrothiolation とチオール-イン環化反応
- 樹脂の環化反応 (図 3) でも、チオエーテル リンカーを構築します。
- Trt 脱保護ソリューション (TFA/TIS/DCM 0.03/0.06/1.0) の約 50 mL を準備します。(システインプロテアーゼ) と mS5の治療-樹脂軸受 [NH2R mS5--A-A-システイン (Trt)-R'-樹脂、50 mg] 10 mL 列の Trt 脱保護ソリューションの 1-2 mL で。N2を使用して 10 分のためのソリューションを軽く振りま します。最後に、DCM の洗浄 (1 -2 mL) 3 倍の合計のため。
注: MS5を表しますアルキレン軸受建物ブロックをペプチド結合とチオ-エンの環化反応のための38の使用 (構造図6 を参照)。 - 約 6 倍の合計はソリューションの色が黄色でなくなるまで、システイン、トリチル保護グループを削除するために上記の手順を繰り返します。
- 2N でバブル洗浄、R mS5---A-Cys(-SH)-R'-樹脂 [無料チオとシステイン (-SH)] DMF (1-2 の mL) とその順序で DCM (1-2 の mL)。2 分のメタノール (1-2 mL) を用いた樹脂を縮小し、その後、濾過を使用して溶媒を除去します。次に、順番に列に約 5 分の N2ガスの蒸気の下で樹脂を乾燥させます。
- 溶媒に伸ばされた長い針を通して約 1 h のバブルの窒素ガスによる脱 DMF を口フラスコ内、事前準備します。
- 重量を量るペーパーを通して 10 mL 丸底フラスコに樹脂を転送します。2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone 光反応開始剤の添加に続いて脱 DMF の 2 mL の樹脂を中断 (MMP; 1 当量、5.6 mg)、4 methoxyacetophenone (地図; 1 当量、3.8 mg)。
- 波紋を追加 (0.3 cm) をフラスコにバーし、適切なゴムのプラグがフラスコのキャップ、油ポンプを使用して窒素ガスでフラスコ内の空気を置換します。
注: 不活性雰囲気は固相に効果的なチオ-エン反応を厳密に必要ありません。ただし、図5 ソリューション フェーズでチオ-イン光反応の非常に必要は。それ以外の場合、硫黄は、UV 照射中に酸化されます。 - 反応フラスコを触媒反応管にセットし、室温 (図 2) で 1 h の紫外光照射下の樹脂を攪拌します。
注意: 触媒反応管紫外線ランプを交換する前に、有害な紫外光照射がある場合触媒反応管のドアが閉じていることを確認します。
メモ: は、線形ペプチド前駆体製品の同一の分子量があり、新しいシーケンスの勧めよく光反応中の反応混合物をサンプリングします。一般に、線形、環状ペプチドは、大幅に異なる親水性を表示します。これが簡単に高速液体クロマトグラフィーを使用して区別します。また、5, 5' - ジチオビス-(2-ニトロ安息香酸) (DTNB) 試薬を使用して無料チオール37の存在を研究することも可能性があります。 - 列にフラスコから樹脂を転送し、吸引ろ過を使用して溶媒を除去します。洗浄し、樹脂の乾燥は 5.1.3 の手順で説明するよう。
- ヒューム フードの谷間カクテル (TFA/ヒント/EDT/H2O 94/1/2.5/2.5) の約 10 mL を準備します。
- 2 mL のポリプロピレン容器に樹脂を転送コンテナーに胸の谷間カクテル (TFA/ヒント/EDT/H2O 94/1/2.5/2.5) の 1 つの mL を追加して、しっかりとスクリュー キャップを使用してコンテナーのシールします。その後、1.5-2 時間の発煙のフード 60 rpm の速度で軌道シェーカーでコンテナーが振ちましょう。
注意: TFA は腐食性の高いです。防護服を着用、効率的なヒューム フードで働きます。EDT は高い悪臭物質で、効率的なドラフトで処理する必要があります。 - N2ガスの流れ発煙のフードの下での蒸発によって TFA カクテルを削除します。次に、30 s と分離の冷たいジエチル エーテル (1 mL) を使用した残渣を沈殿させるそれを 2 分間 12,000 × g で遠心分離を経由。遠心分離、次をエーテル コンポーネントをそっと注ぐ。2 倍の沈殿物および遠心分離の手順を繰り返します。乾燥残渣を蒸発させます。
- 最後に、1 mL H2O/アセトニ トリル (2:1) の残余を分解し、C18 分析カラムを用いた高速液体クロマトグラフィーによる浄化 (4.6 x 250 mm 流量 1.0 mL/分)。使用 H2O (0.1% を含む TFA) と紫外 280 nm と 220 nm 波長 (表 2) を使用して 25 分モニター HPLC スペクトル上 70% アセトニ トリルに 20% から 2%/min の線形グラデーションで溶剤として純粋なアセトニ トリル。
- Trt 脱保護ソリューション (TFA/TIS/DCM 0.03/0.06/1.0) の約 50 mL を準備します。(システインプロテアーゼ) と mS5の治療-樹脂軸受 [NH2R mS5--A-A-システイン (Trt)-R'-樹脂、50 mg] 10 mL 列の Trt 脱保護ソリューションの 1-2 mL で。N2を使用して 10 分のためのソリューションを軽く振りま します。最後に、DCM の洗浄 (1 -2 mL) 3 倍の合計のため。
- Macrolactamization (図 4) によって分子間チオ-エン反応しことを初めて見いだしたペプチドによるチオエーテル リンカーを構築します。
- 線形ペプチド H2N A A A mS5ベアリング アルキレン残渣を合成 (2 R ')-R'-標準 fmoc 保護基固相ペプチド合成 (SPP) を用いた樹脂 (50 mg) に記載手順 2-4。次に、洗浄し、樹脂の乾燥は 5.1.3 の手順で説明するよう。
- 5.1.4 の手順で説明されているように脱 DMF の 2 mL を含む 10 mL 丸底フラスコに樹脂を中断します。
- 光開始剤を追加 MMP とマップ (MMP: 1 当量、5.6 mg;地図: 1 当量、3.8 mg)、fmoc 保護-システイン-ああ (3 当量、25.7 mg) と波紋 (0.3 cm) をフラスコにバーします。適当なゴムのプラグを使用してフラスコのキャップし、フラスコ内の空気を窒素に置き換える油ポンプを使用します。
- 反応フラスコを触媒反応管に設定しました。(図 2) 常温 UV 照射下で 1-2 時間撹拌します。
- LC-MS 分析での反応を監視: 胸の谷間カクテルを用いた樹脂の 2-3 mg を切断します。冷たいジエチル エーテル (300 μ L) の残留物を沈殿、遠心沈降法による、残渣を分離、5.1.11 の手順で説明されているように乾燥残留物を蒸発させます。その後、H2O/アセトニ トリル (2:1) の 100 μ L に溶解します。0.22 μ m の多孔質膜を用いたペプチド ソリューションを濾液し、LC-MS を用いたエレクトロ スプレー イオン化 (ESI) でイオン化し、肯定的なモードで作動させる化合物を分析します。
- 5.2.2 - の手順を繰り返し、必要に応じて完了する反応できるように 5.2.4 が実行されます。
- 写真反応が完了した後、樹脂をカラムにフラスコから転送、吸引ろ過を使用して溶媒を除去します。洗浄し、樹脂の乾燥は 5.1.3 の手順で説明するよう。
- ベンゾトリアゾール-1-イル-oxytripyrrolidinophosphonium ヘキサフルオロリン酸の DMF 溶液を追加 (PyBob; 2.4 当量、31.2 mg)、1-1-ヒドロキシベンゾトリアゾール (HoBt; 2.4 当量、8.1 mg) と NMM (4 当量、11 μ L)、macrolactamization の列のガレージに。N2 2 h のこのソリューションをバブルします。
- さらに、監視手順 5.2.3 LC MS を使用してこのカップリング反応。必要に応じて、繰り返し反応をように、この手順が完了するまで実施します。
- 手順 3 と 4 で説明したように標準 fmoc 保護基 SPP を用いたペプチドは細長い。
- すべてのアミノ酸残基のアセンブリ、5.1.10 と 5.1.11 の手順で説明するように樹脂からペプチドを切断し、5.1.12 の手順で説明するよう、それを浄化します。
- ソリューション フェーズ (図 5) でビニール硫化リンカーを生成します。
- 2-4 の手順で説明したように標準 fmoc 保護基 SPP を使用して線形のペプチドを軸受アルキン残渣を合成します。以前研究20で説明されているように確立されたプロトコルに従ってアミノ酸を軸受アルキンを合成します。
- 切断し、樹脂からペプチドと 5.1.11 5.1.9 - の手順で説明するように冷たいジエチル エーテルを使用してそれを沈殿させます。胸の谷間と樹脂の沈殿物、2 分 12,000 × g で遠心分離を用いたペプチドを収集します。
- 真空の結果として得られる残渣を乾燥させます。0.5 mM の最終的な集中に達するために脱 DMF (50 mL) 100 mL の丸底フラスコの中で溶解 (樹脂、0.025 モルの読み込みに基づいて (1000 mL/L/0.5 mmol/L) = 50 mL)。
- :Dic DMPA (0.5 当量、3.2 mg) を追加し、ソリューションに伸びる長い針を通して N2を使用して 10 分の反応液をし、その後します。次に、0.5 - 1 時間撹拌せず室温での紫外線の下で試料を照射します。
- 高真空下で DMF を削除し、その有機副産物を解消するためにジエチル エーテルを追加することで原油残渣を沈殿させます。その後、2 分間 12,000 × g で遠心分離を用いた残渣を分離します。遠心分離、次をエーテル コンポーネントをそっと注ぐ。乾燥残渣を蒸発させます。最後に、H2O/アセトニ トリル (2:1) 1 mL に溶解し、手順 5.1.7 で HPLC を用いてそれを浄化します。
結果
Ac YmS5AAAC NH2ペプチドとその硬くて製品 Ac - Y-(シクロ-1, 5)-[mS5AAAC] - 高速液体クロマトグラフィーと MS スペクトル樹脂の分子内チオール-エン反応を使用して生成された NH2 図に描かれています。6B. その線形の前駆体を基準にして同じ分子量を持っている環状ペプチドが発見されました。しかし、その HPLC の保持時間は、以前同じ分離条件下でその前駆物質よりも約 2 分に観察されました。さまざまなシーケンスと短いペプチッドすべてみ良いの変換図 6に示すように。
チオ-イン反応条件のためのスクリーニング プロセスは図 7 bで描かれているし、異性体変換と比率を逆相高速液体クロマトグラフィーの統合を使用して求めた。UV 照射ペプチド 2 c のトレース レベルのみが観察されました。これは契約段階 20 員環の大環状にチイルラジカルが発生する N 末端ラジカルのトラップの構造設定可能性があります。8 メンバー ビニール硫化物の架橋結合を持つ 2 つの異性体を生成するペプチドの 1 a と 1 b の両方が見つかりました。ペプチド 1 a から生成されたペプチド 2 a A と、2 a B 展示異なる保持時間として (0 - 30 分) 異なる紫外線の比が異なる (図 7)。これらは、 1H NMR 分光法 (図 7) 二重結合のプロトン シグナル E/Z 異性体として割り当てられました。2f 二次元ペプチド Z 異性体が支配的なプロダクトがあると発見されました。これは 8 メンバー ビニール硫化物の架橋を基準にしてコンパクトな構造の構築時に立体配座の設定可能性があります。図 7 e、円二色性 (CD) のスペクトルによるとに描かれているペプチド 2 a/A、B、2 b-A/B 8 メンバー ビニール硫化物の架橋結合を持つ示すペプチド中のランダム コイル 7 メンバー ビニールを所有している 2d 硫化物の架橋を展示、ヘリカル構造。要約すると、ビニール硫化ボンドの Z 異性体は優先的に形成されることがわかった、良いらせん誘導を表示されます。

図 1: 固相ペプチド合成用手動ペプチド合成装置。列が三方活栓を介して真空マニホールドに置かれ、装置は、バブルの窒素またはアルゴン ガス ラインに接続されていた。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 光反応に使用される触媒反応管デバイス。デバイスは、触媒反応管は前と光反応中にアルゴンガスが満ちていたように紫外線照射とアルゴン ガスタンクの 10 350 nm ランプ (材料表) が装備されていた。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 樹脂の場合短いペプチド分子のチオール-エン反応。この反応は次の線形のペプチッドの完全な合成のシステイン残基のトリチル グループの樹脂の脱保護を使用して遂行し、マップと MMP の光重合開始剤を使用して、紫外線を照射する樹脂を設定します。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 樹脂の分子間チオ エン反応。この反応は、DMF 溶媒中で fmoc 保護-システイン-OH を溶解することにより実施され、活性化試薬として PyBop、HoBt、NMM を使用して macrolactamization に続いて、樹脂アルケン軸受ペプチド残渣を照射し。ペプチド合成を続けたし、標準の SPP を使用しています。この図の拡大版を表示するのにはここをクリックしてください。

図 5: ソリューション相での分子内チオール-イン反応。この反応は次の線形ペプチド、あとで線形のペプチドは脱 DMF に溶解し、:dic DMPA の紫外光照射の完全な合成ソリューション段階で行った。この図の拡大版を表示するのにはここをクリックしてください。
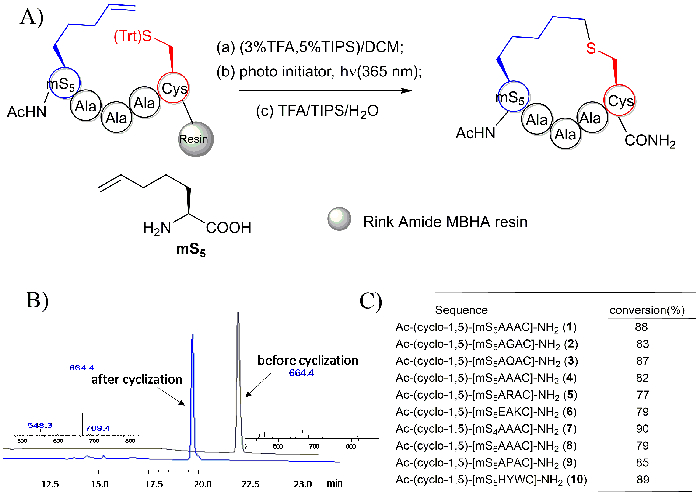
図 6: チオエーテル連結樹脂の分子内チオール-エン反応を使用して生成された環状ペプチド。A. このパネルは樹脂の分子内チオ-エン反応のスキームを示しています。mS5: モノ置換 olenic のアミノ酸を表す"m"、"S"は S 構成アミノ酸を表し、「5」は、側鎖の原子38の数を指します。B。 このパネルはその閉環し、前に Ac YmS5AAAC NH2ペプチドの高速液体クロマトグラフィーと MS スペクトルを示しています。C。 このパネルは、異なるシーケンスの環状ペプチドの変換を示しています。この図は、趙、B.ら28から変更されているこの図の拡大版を表示するのにはここをクリックしてください。
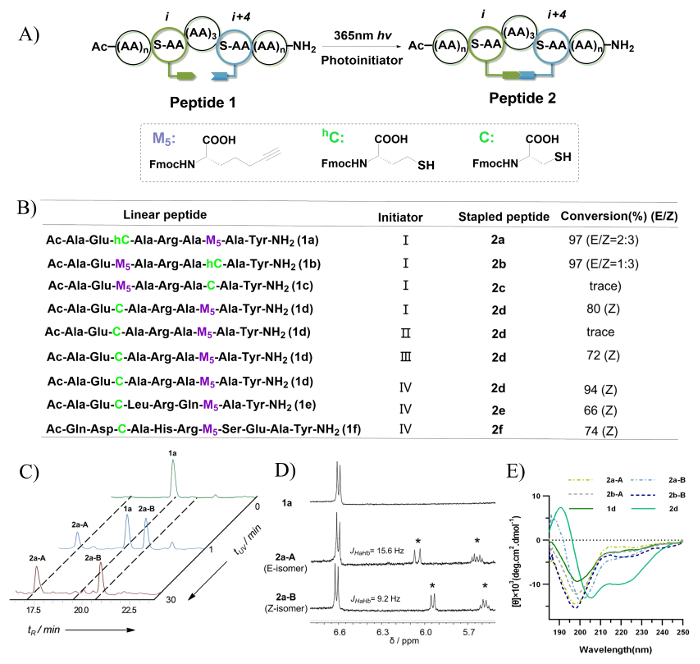
図 7: 光誘起チオール-イン hydrothiolation をホチキス止めペプチド。A. これは分子内のチオール-イン hydrothiolation の模式図。B。 このパネルは今回評価ペプチド配列を示しています。イニシエーター: (I) 0.5 1 h; DMPA の eq(II) のイニシエーター、1 h。(III) 0.5 式 DMPA、0.5 の地図の eq、1 h。(IV) 0.5 の eq MMP、0.5 h. C.このパネルは異なる UV 照射時間ペプチド 1 a の反応混合物の高速液体クロマトグラフィーのトレースを示し、220 で監視 nm。D. このパネル11 a、2 a、および 2 a B (400 MHz で DMSO d6 で測定) の H-NMR スペクトルを示しています。アスタリスクは、UV 照射ビニール硫化二重結合の形成を示します。E。 このパネルはビニール硫化物の架橋結合を有するペプチドの円二色性スペクトルを示しています。この図は、天雄らから変更されています。44この図の拡大版を表示するのにはここをクリックしてください。
| 材料 | MW | N(0.5mmol/g 樹脂 × 0.05 g × 5eq.) | M(アミノ酸) (mg) |
| (ダ) | (モル) | ||
| Fmoc 保護 Gly ああ | 297 | 0.125 | 37.1 |
| Fmoc 保護翼ああ | 331 | 0.125 | 41.4 |
| Fmoc 保護-ヴァル-オハイオ州 | 339 | 0.125 | 42.4 |
| Fmoc 保護ルーああ | 353 | 0.125 | 44.1 |
| Fmoc 保護-イル-オハイオ州 | 353 | 0.125 | 44.1 |
| Fmoc 保護-プロ-オハイオ州 | 337 | 0.125 | 42.1 |
| Fmoc 保護 Phe ああ | 387 | 0.125 | 48.4 |
| Fmoc 保護 Tyr (tBu)-オハイオ州 | 460 | 0.125 | 57.5 |
| Fmoc 保護-Trp (Boc)-オハイオ州 | 527 | 0.125 | 65.9 |
| Fmoc 保護 Ser (tBu)-オハイオ州 | 384 | 0.125 | 48 |
| Fmoc 保護 Thr (tBu)-オハイオ州 | 398 | 0.125 | 49.8 |
| Fmoc 保護 Cys (Trt)-オハイオ州 | 586 | 0.125 | 73.3 |
| Fmoc 保護会ったああ | 372 | 0.125 | 46.5 |
| Fmoc 保護 Asn (Trt)-オハイオ州 | 597 | 0.125 | 74.6 |
| Fmoc 保護 Gln (Trt)-オハイオ州 | 611 | 0.125 | 76.4 |
| Fmoc 保護 Asp (OtBu)-オハイオ州 | 412 | 0.125 | 51.5 |
| Fmoc 保護 Glu (OtBu)-オハイオ州 | 426 | 0.125 | 53.3 |
| Fmoc 保護・ リス (Boc)-オハイオ州 | 469 | 0.125 | 58.6 |
| Fmoc 保護 Arg (Pbf)-オハイオ州 | 617 | 0.125 | 77.1 |
| Fmoc 保護彼 (Trt)-オハイオ州 | 620 | 0.125 | 77.5 |
| HCTU | 414 | 0.122 | 50.5 |
| DIPEA | 129 | 0.25 | 43.5(ΜL) |
| DMF | 0.5 mL | ||
表 1: 結合条件の金額。
| 列 | Zorbax SB Aq 列、4.6 × 250 mm (細孔径 80 Å、粒子サイズ 5 μ m) |
| 溶剤 | A: 水、0.1% (巻/巻) TFA;B: アセトニ トリル |
| 流量 | 1 mL/分 |
| グラデーション | 20-70% (巻/巻) B 25 分以上;70%-98% 以上 5 分;98% 以上 5 分; |
| 注入量 | 30-500 Μ L |
| 波長 (nm) | (その他) 220 または 494 (FITC 標識ペプチド) 280 (fmoc 保護-Trp - や Tyr 含有ペプチドの場合) の |
表 2: 高性能液体クロマトグラフィー条件。
ディスカッション
図 3に記載されている樹脂の分子内チオ ene 環、後続反応の重要な一歩になるトリチル グループのシステイン残基の除去が見つかった。さらに、図 6Bに描かれているは、前にペプチドの分子量と次の反応と同じことが判明しました。したがって、HPLC 識別または DTNB の試金の使用は、反応を監視するために必要です。図 4に記載されている分子間チオ-エン反応、場合 MS の監視が必要です。ラクタム カップリングの更なるステップは、チオエーテル テザーの建設のため必要なことが判明しました、間全体の効率を達成するために、長鎖ペプチドのこのプロトコルが使用されることをお勧めします。
チオ-イン光化学反応によって生成されたビニール硫化ボンドは樹脂胸の谷間に使用される強く酸性 TFA 溶液でした。したがって、ソリューション フェーズでチオ-イン光反応の使用に適用されました。この反応は、潜在的な分子間の反応を避けるために低濃度 (0.5 mM) に希釈。また、光反応中に製品の酸化を避けるために溶媒をガス抜きすることも重要です。次の反応、有機溶剤の DMF の真空蒸着も実施されなければならない慎重にペプチドの酸化・劣化や機械の減価償却を防ぐために。図 5に示すチオ-インの環化反応は、後のペプチド合成修正35メカニズムを提供します。
正常に生成される良好な変換とつながれたチオエーテル ペプチドが分子内のチオール-エン反応、単純なエーテル架橋は目的のヘリカル構造のペプチドに制約に失敗しました。このテザーに変更戦略に基づいて、テザーの不斉誘起ペプチド ヘリシティ概念が開発された、γ 置換ペプチドで R の構成でグループ C ターミナルだったペプチドのヘリカル構造 (を誘導することができます。図 4)39,40。このアプローチに関連付けられている制限は 2 つのキラル中心 (γ(R))41,42α (S) 等と不自然なアミノ酸の不斉合成
この研究は、 7 e を図で表したチオ-イン反応が良い変換を持つヘリカル構造にペプチドを制約することを示した。ヘリカル ペプチドの建設の面では、ヘリカル ペプチドの建設のためのチオ-イン光化学反応をお勧めします。樹脂の分子内チオ ene 環化に備えて長いペプチドは、あまりにも効果的な環化を確保するため柔軟な短いチオエーテル テザー ペプチド (15 以下) の建設に適していることを示した。さらの長いペプチド環化反応は、樹脂の分子間チオ ene 環化の使用をお勧めします。
要約すると、一連の光誘起チオ-ene/チオ-イン クリックケミストリーを使用してチオエーテル/ビニール テザー硫化ペプチドの建設のため化学プロトコルを開発しました。反応は効率、金属触媒フリー、操作、便利な優れた機能グループの許容範囲を所有する実証とバイオ直交されています。さらに、このメソッドは、β ヘアピン43,44など他のペプチドの二次構造を安定させるために開発されました。本稿は、チオエーテル テザーが痕跡を残さない変更サイトを提供することを示しています。これは主ペプチド合成変更を次化学の領域を展開します。さらに、炭化水素の定番ペプチドに対する減らされた膜毒性を展示した脂肪族エーテル/ビニール テザー硫化ペプチドは実証良い生理活性を持つ多様な生物学的応用で適用されますとバイオアベイラビリティ45,46。
開示事項
著者が明らかに何もありません。
謝辞
著者は自然科学中国助成財団 (第 21372023、21778009 および 81701818); からの財政支援を認める科学省と中国 (第 2015DFA31590); 人民共和技術深セン科学技術イノベーション委員会 (第JCYJ20170412150719814、JCYJ20170412150609690、JCYJ20150403101146313、JCYJ20160301111338144、JCYJ20160331115853521、JSGG20160301095829250、および GJHS20170310093122365)。中国ポスドク科学財団 (610704 号 2017 M)。
資料
| Name | Company | Catalog Number | Comments |
| Rink Amide MBHA resin(0.53 mmol/g) | HECHENG | GRM50407 | |
| Standard Fmoc-protected amino acids | GL Biochem (Shanghai) Ltd. | ||
| N-Methyl-2-pyrrolidinone | Shenzhen endi Biotechnology Co.Ltd. | 3230 | skin harmful |
| N,N-Dimethyl formamide | Energy | B020051 | skin harmful |
| Dichloromethane | Energy | W330229 | skin harmful |
| N,N-Diisoproylethylamine | Aldrich | 9578 | irritant |
| Trifluoroacetic acid | J&K | 101398 | corrosive |
| Triisopropylsilane | J&K | 973821 | |
| 1,2-Ethanedithiol | J&K | 248897 | Stench |
| 2-(6-Chloro-1H-benzotriazole-1-yl)-1,1,3,3-tetramethylaminium hexafluorophosphate | GL Biochem (Shanghai) Ltd. | 851012 | |
| Morpholine | Aldrich | M109062 | irritant |
| Diethyl ether | Aldrich | 673811 | flammable |
| Acetonitrile | Aldrich | 9758 | toxicity |
| Methanol | Aldrich | 9758 | toxicity |
| 2-hydroxy-1-[4-(2-hydroxyethoxy)-phenyl]-2-methyl-1-propanone | Energy | A050035 | |
| 4-methoxyacetophenone | Energy | A050098 | |
| 2,2-dimethoxy-2-phenylacetophenone | Energy | D070132 | |
| 5,5'-Dithiobis-(2-nitrobenzoic acid) | J&K | 281281 | |
| Benzotriazole-1-yl-oxytripyrrolidinophosphonium hexafluorophosphate | Energy | E020172 | |
| 1-Hydroxybenzotriazole | Energy | D050256 | |
| 4-Methylmorpholine | Energy | W320038 | |
| High Performance Liquid Chromatography | SHIMADZU | LC-30AD | |
| Electrospray Ionization Mass | SHIMADZU | LCMS-8030 | |
| Lyophilizer | Labconco | FreeZone | |
| SpeedVac concentration system | Thermo | Savant | |
| vacuum manifold | promega | A7231 | |
| three-way stopcocks | Bio-Rad | 7328107 | |
| poly-prep chromatography columns | Bio-Rad | 7311550 |
参考文献
- Pelay-Gimeno, M., Glas, A., Koch, O., Grossmann, T. N. Structure-based design of inhibitors of protein-protein interactions: mimicking peptide binding epitopes. Angewandte Chemie International Edition. 54 (31), 8896-8927 (2015).
- Passioura, T., Katoh, T., Goto, Y., Suga, H. Selection-based discovery of druglike macrocyclic peptides. Annual Review of Biochemistry. 83, 727-752 (2014).
- Gonzalez, M. W., Kann, M. G. Protein interactions and disease. PLoS Computational Biology. 8 (12), 1-11 (2012).
- Wilson, A. J. Inhibition of protein-protein interactions using designed molecules. Chemical Society Reviews. 38 (12), 3289-3300 (2009).
- Teresa, A. F. C., Alessio, C. Cyclic and macrocyclic peptides as chemical tools to recognise protein surfaces and probe protein-protein interactions. ChemMedChem. 11 (8), 787-794 (2016).
- Craik, D. J., Fairlie, D. P., Liras, S., Price, D. The future of peptide-based drugs. Chemical Biology & Drug Design. 81 (1), 136-147 (2013).
- Cromm, P. M., Spiegel, J., Grossmann, T. N. Hydrocarbon stapled peptides as modulators of biological function. ACS Chemical Biology. 10 (6), 1362-1375 (2015).
- Zhang, Q. Z., Tian, Y., Lao, Y. Z., Li, Z. G. Peptides-staple method development and its application in cancer therapy. Current Medicinal Chemistry. 21 (21), 2438-2452 (2014).
- Cromm, P. M., Spiegel, J., Grossmann, T. N. Hydrocarbon stapled peptides as modulators of biological function. ACS Chemical Biology. 10 (6), 1362-1375 (2015).
- Wang, D., Liao, W., Arora, P. S. Enhanced metabolic stability and protein-binding properties of artificial alpha helices derived from a hydrogen-bond surrogate: application to Bcl-xL. Angewandte Chemie International Edition. 44 (40), 6525-6529 (2005).
- Bullock, B. N., Jochim, A. L., Arora, P. S. Assessing helical protein interfaces for inhibitor design. Journal of the American Chemical Society. 133, 14220-14223 (2011).
- Jackson, D. Y., King, D. S., Chmielewski, J., Singh, S., Schultz, P. G. General approach to the synthesis of short α-helical peptides. Journal of the American Chemical Society. 113 (24), 9391-9392 (1991).
- Timmerman, P., Beld, J., Puijk, W. C., Meloen, R. H. Rapid and quantitative cyclization of multiple peptide loops onto synthetic scaffolds for structural mimicry of protein surfaces. ChemBioChem. 6 (5), 821-824 (2005).
- Muppidi, A., Wang, Z., Li, X., Chen, J., Lin, Q. Achieving cell penetration with distance-matching cysteine cross-linkers: a facile route to cell-permeable peptide dual inhibitors of Mdm2/Mdmx. Chemical Communications. 47 (33), 9396-9398 (2011).
- Schafmeister, C. E., Po, J., Verdine, G. L. An all-hydrocarbon cross-linking system for enhancing the helicity and metabolic stability of peptides. Journal of the American Chemical Society. 122 (24), 5891-5892 (2000).
- Osapay, G., Taylor, J. W. Multicyclic polypeptide model compounds. 1. synthesis of a tricyclic amphiphilic alpha-helical peptide using an oxime resin, segment-condensation approach. Journal of the American Chemical Society. 112 (16), 6046-6051 (1990).
- Lau, Y. H., Andrade, d. P., Wu, Y., Spring, D. R. Peptide stapling techniques based on different macrocyclisation chemistries. Chemical Society Reviews. 44 (1), 91-102 (2015).
- Spokoyny, A. M., Zou, Y., Ling, J. J., Yu, H., Lin, Y. S., Pentelute, B. L. A perfluoroaryl-cysteine S(N)Ar chemistry approach to unprotected peptide stapling. Journal of the American Chemical Society. 135 (16), 5946-5949 (2013).
- Lautrette, G., Touti, F., Lee, H. G., Dai, P., Pentelute, B. L. Nitrogen arylation for macrocyclization of unprotected peptides. Journal of the American Chemical Society. 138 (27), 8340-8343 (2016).
- Tian, Y., et al. Stapling of unprotected helical peptides via photoinduced intramolecular thiol-yne hydrothiolation. Chemical Science. 7 (5), 3325-3330 (2016).
- Chang, Y. S., et al. Stapled α-helical peptide drug development: a potent dual inhibitor of MDM2 and MDMX for p53-dependent cancer therapy. Proceedings of the National Academy of Sciences of the United States of America. 110 (36), 3445-3454 (2013).
- Zhao, H., et al. Crosslinked aspartic acids as helix-nucleating templates. Angewandte Chemie International Edition. 55 (39), 12088-12093 (2016).
- Leshchiner, E. S., et al. Direct inhibition of oncogenic KRAS by hydrocarbon-stapled SOS1 helices. Proceedings of the National Academy of Sciences of the United States of America. 112 (6), 1761-1766 (2015).
- Wang, D., Qin, X., Zhao, H., Li, Z. N-cap helix nucleation: methods and their applications. Science China Chemistry. 60 (6), 689-700 (2017).
- Zorzi, A., Deyle, K., Heinis, C. Cyclic peptide therapeutics: past, present and future. Current Opinion in Chemical Biology. 38, 24-29 (2017).
- Hu, K., et al. An in-tether chiral center modulates the helicity, cell permeability, and target binding affinity of a peptide. Angewandte Chemie International Edition. 55 (28), 8013-8017 (2016).
- Lin, H., Jiang, Y., Zhang, Q., Hu, K., Li, Z. An in-tether sulfilimine chiral center induces helicity in short peptides. Chemical Communications. 52 (68), 10389-10391 (2016).
- Zhao, B., Zhang, Q., Li, Z. Constructing thioether-tethered cyclic peptides via on-resin intra-molecular thiol-ene reaction. Journal of Peptide Science. 22 (8), 540-544 (2016).
- Dondoni, A., Massi, A., Nanni, P., Roda, A. A new ligation strategy for peptide and protein glycosylation: photoinduced thiol-ene coupling. Chemistry. 15 (43), 11444-11449 (2009).
- Hu, K., Sun, C., Li, Z. Reversible and versatile on-tether modification of chiral-center-induced helical peptides. Bioconjugate Chemistry. 28 (7), 2001-2007 (2017).
- Shi, X., Jiang, Y., Yang, D., Zhao, H., Tian, Y., Li, Z. Reversibly switching the conformation of short peptide through in-tether chiral sulfonium auxiliary. Chinese Chemical Letters. , (2017).
- Jiang, Y., et al. Switching substitution groups on the in-tether chiral centre influences backbone peptides' permeability and target binding affinity. Organic & Biomolecular Chemistry. 15 (3), 541-544 (2017).
- Aimetti, A. A., Shoemaker, R. K., Lin, C. C., Anseth, K. S. On-resin peptide macrocyclization using thiol-ene click chemistry. Chemical Communications. 46 (23), 4061-4063 (2010).
- Wang, Y. X., Chou, D. H. C. A thiol-ene coupling approach to native peptide stapling and macrocyclization. Angewandte Chemie International Edition. 54 (37), 10931-10934 (2015).
- Wang, Y., et al. Application of thiol-yne/thiol-ene reactions for peptide and protein macrocyclizations. Chemistry. 23 (29), 7087-7092 (2017).
- Patgiri, A., Menzenski, M. Z., Mahon, A. B., Arora, P. S. Solid-phase synthesis of short α-helices stabilized by the hydrogen bond surrogate approach. Nature Protocols. 5 (11), 1857-1865 (2010).
- Ozyurek, M., Baki, S., Gungor, N., Celik, S. E., Guclu, K., Apak, R. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, Q. Z., et al. Chiral sulfoxide-induced single turn peptide α-helicity. Scientific Reports. 6, 38573 (2016).
- Lin, H., et al. An in-tether sulfilimine chiral center induces beta-turn conformation in short peptides. Organic & Biomolecular Chemistry. 14 (42), 9993-9999 (2016).
- Hu, K., Li, W., Yu, M., Sun, C., Li, Z. Investigation of cellular uptakes of the in-tether chiral-center-induced helical pentapeptides. Bioconjugate Chemistry. 27 (12), 2824-2827 (2016).
- Hu, K., et al. A precisely positioned chiral center in an i, i + 7 tether modulates the helicity of the backbone peptide. Chemical Communications. 53 (50), 6728-6731 (2017).
- Li, J., et al. An in-tether chiral center modulates the proapoptotic activity of the KLA peptide. Chemical Communications. 53 (75), 10452-10455 (2017).
- Zhao, B., et al. A thioether-stabilized-D-proline-L-proline-induced β-hairpin peptide of defensin segment increases its anti-Candida albicans ability. ChemBioChem. 17 (15), 1416-1420 (2016).
- Tian, Y., Yang, D., Ye, X., Li, Z. Thioether-derived macrocycle for peptide secondary structure fixation. The Chemical Record. 17 (9), 874-885 (2017).
- Hu, K., Yin, F., Yu, M., Sun, C., Li, J., Liang, Y., Li, W., Xie, M., Lao, Y., Liang, W., Li, Z. G. In-tether chiral center induced helical peptide modulators target p53-MDM2/MDMX and inhibit tumor growth in stem-like cancer cell. Theranostics. 7 (18), 4566-4576 (2017).
- Tian, Y., Jiang, Y., Li, J., Wang, D., Zhao, H., Li, Z. Effect of stapling architecture on physiochemical properties and cell permeability of stapled α-helical peptides: a comparative study. ChemBioChem. 18 (21), 2087-2093 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved