Method Article
Microbiomechanical система для изучения формирования варикозной болезни и восстановления в Центральный нейрон аксоны
В этой статье
Резюме
Этот протокол описывает физиологически актуальной, давлением жидкости подход для быстрого и обратимым индукции варикоз в нейронах.
Аннотация
Аксональное варикоз являются расширенной структуры вдоль валов аксоны с высокой степенью неоднородности. Они присутствуют не только мозги с нейродегенеративных заболеваний или травм, но и в нормальных мозга. Здесь мы описываем микромеханические недавно созданной системы быстро, надежно и обратимо побудить аксональное варикоз, позволяет нам понять механизмы, регулирующие варикозной болезни формирования и состав гетерогенных белков. Эта система представляет собой Роман средство для оценки воздействия сжатия и сдвига стресс на различных внутриклеточных отсеков нейронов, отличается от других в vitro систем, которые в основном сосредоточены на эффект растяжения. Важно отметить, что из-за особенностей нашей системы, мы недавно сделал Роман Открытие показаны, что применение давлением жидкости может быстро и обратимо побудить аксональное варикоз через активацию Переходный рецепторный потенциал канала. Наша биомеханические системы могут быть использованы удобно в сочетании с наркотиками перфузии, живых клеток, кальция изображений и запись зажим патч. Таким образом этот метод может быть принят для изучения mechanosensitive ионные каналы, аксональное транспортного регулирования, динамика аксональное цитоскелета, кальция сигнализации и морфологические изменения связанные с травматического мозговой травмы.
Введение
Формирование варикозной болезни, или припухлость/бисером, вдоль аксонов, является характерной особенностью нейродегенеративные, наблюдается во многих расстройств или травм центральной нервной системы, включая рассеянный склероз, болезнь Альцгеймера, болезнь Паркинсона и травматические мозг травмы1,2. Несмотря на значительные физиологические последствия аксональное варикоз на распространение потенциал действия и синаптической передачи3как создаются варикоз остается неизвестным. Недавно с помощью недавно созданной microbiomechanical пробирного на искусственный Нейроны гиппокампа от грызунов, мы обнаружили, что механические раздражители могут вызвать варикоз в эти нейроны с весьма интригующим возможности. Во-первых, быстрой индукции варикозной болезни (< 10 s) и этот процесс неожиданно обратимым. Во-вторых, инициирования, варикозной болезни зависит от прочности пыхтя давление: чем выше давление, тем быстрее возбуждение. В-третьих инициирования, варикозной болезни зависит от возраста нейронов. Аксоны нейронов младший появляются более отзывчивым к механическим воздействиям, по сравнению с теми из старых нейронов. В-четвертых варикоз форме вдоль аксоны нейронов гиппокампа, а дендриты и первоначальный аксона сегменты этих нейронов отображения без изменений при том же условии уханье. Таким образом наши исследования показали новшеством нейрональных полярности. Эти выводы с системой в vitro физиологически важны. Использование модели в естественных условиях для легкой черепно-мозговой травмы (mTBI), мы показали, что аксональное варикоз разработана в нескольких координационных моды в соматосенсорной коры мышей сразу же после закрытия череп воздействия, в соответствии с нашими в пробирке результаты4. Важно отметить, что наши окрашивание и изображений mTBI мышей обеспечивают только снимок нейрональных морфологических изменений, поскольку в естественных условиях покадровой изображений в ходе механического воздействия нейрональных морфологии является до сих пор не представляется возможным.
Эта жидкость пыхтя система позволила нам не только захватить уникальные особенности, связанные с формированием механические стресс индуцированного варикозной болезни, но и для определения базового механизма. Тестируя различные внеклеточного решения, открывалки разных кандидатов mechanosensitive ионных каналов, и клеточной электрофизиологии и блокаторов, мы определили, что Переходный рецепторный потенциал катионного канала член subfamily V 4 (TRPV4) канал, который является проницаемой для Ca2 + и Na+ и активированную пыхтя отвечает главным образом за выявления первоначальных механического напряжения во время формирования аксональное варикозной болезни4. Это также было подтверждено с подходом нокаут siRNA. Взятые вместе, эта новая система пробирного, который мы разработали с культурой гиппокампа нейрон, является весьма ценной для изучения свойств микромеханические Центральной нейронов, особенно в сочетании с другими методами.
Эта система микромеханические, которую мы создали уникальна и отличается от ранее существующих систем в некоторых основных аспектах. Во-первых в этой системе, нейроны опыт вне плоскости механических напряжений в формах сжатия и сдвига. В ходе механического воздействия нейрональные процессы остаются прикрепленными к coverslip поверхности и не двигаться. Это отличается от других экспериментальных систем, предусматривающих главным образом изгиба и растяжения в плоскости (или напряжения), например, прогиб комплекте аксоны как строки5,6 перемещение или растягивание аксонов, выращенных на micropatterned каналы и растягивающийся мембраны7,8. Кроме того хотя аксональное варикоз может также быть наведено в эти анализы как в нашей системе жидкость пыхтя, процесс в этих параметров занимает гораздо больше времени (от 10 мин до нескольких часов6,,7-8) и появляется необратимый характер. Наконец, наша система, с помощью местных жидкости пыхтя позволяет изучение пространственных особенностей формирования варикозной болезни (например., дендриты, дендритных шипиков, сома, аксональное первоначальный сегментов, аксональное терминалы), кроме его временных характеристик. Используя эту систему, мы обнаружили несколько неожиданных и уникальные особенности формирования аксональное варикозной болезни, особенно быстрое наступление, медленно обратимости и аксон дендритов полярности.
Системы, которые мы обсуждаем в этом документе совместим с много методов молекулярной и клеточной биологии. Например для изучения воздействия механических напряжений на нейрональные морфологии и функции, он может использоваться вместе с coculture миелина, покадровой, Визуализация передачи энергии флуоресцентный резонанс (ЛАДА) и флуоресценции полного внутреннего отражения (TIRF), кальция изображений и патч зажим запись. В этой статье мы сосредоточены на основные компоненты системы. Гиппокампа нейрон культуры, пыхтя жидкости установки, с высоким разрешением покадровой съемки для аксональное транспорта и кальция изображений проиллюстрированы ниже шаг за шагом.
протокол
Все методы, описанные ниже были одобрены институциональный уход животных и использование Комитет (IACUC) из университета штата Огайо.
1. Coverslip подготовка
- Поместите один или несколько ящиков 12 мм или 25 мм coverslips в стеклянный стакан, содержащие 70% азотной кислоты и инкубировать и coverslips при комнатной температуре на ночь.
Примечание: Не мойте coverslips 25 мм в том же стакан как coverslips 12 мм. Это лучше вымыть их отдельно. - Передача всех coverslips в 4 Л стакан, наполненный 2,5 Л ddH2O и встряхнуть стакан, содержащие coverslips за 1 час при 100 об/мин. Использование резиновых полос провести стакан во время встряхивания. Повторите полоскание с свежими 2,5 Л ddH2O четыре раза.
- Coverslips передачи очищены для сухой колба с металлической крышкой. Испечь coverslips в духовке на 225 ° C в течение 6 ч и дать им остыть до комнатной температуры.
Примечание: Coverslip 25 мм подвержен разорвать. Отдельные coverslips один за другим и воздух сухой, а затем запечь их в духовке. - Храните высушенные и очищенные coverslips при комнатной температуре в стерилизованные пластиковые контейнер до использования.
-
Пальто coverslips следующим образом:
- Готовят раствор свежие покрытия в пластиковых пробирок.
- Место каждого coverslip в одну скважину 24-хорошо (или 6-ну) плиты. Место 30 (или 100) мкл раствора покрытие coverslip (Таблица 1) на 12 мм (или 25 мм) coverslip и водоворот. Добавьте 1 мл стерильного фосфат амортизированное saline (PBS, класс культуры ткани) в колодец. Эти пластины можно использовать сразу или хранить при 4 ° C в стерильных PBS на срок до недели.
- На день рассечение удалите PBS. Просушите и поместите пластины под УФ светом (30W) для 2-4 ч.
Примечание: Последний шаг должен быть завершен с УФ-излучением на в ячейку культуры Ламинарный шкаф. Дверь, капот должны быть отменены слегка, чтобы разрешить поток воздуха для сушки coverslips.
2. рассечение, диссоциации и культуры гиппокампа нейронов от беременных мыши/крыса
-
Рассечение и диссоциации гиппокампа нейронов для культуры
- Оттепель решение фермента протеазы (протеазы 23 3 мг/мл в ПВР, Таблица 1) и предварительно теплой обшивка СМИ (Таблица 2) при 37 ° C.
- Вскрыть гиппокампа и промыть с SLDS, согласно методы, описанные в предыдущей публикации14.
Примечание: Четыре гиппокампах обеспечивают достаточное количество клеток для одной 24-ну или один из 6-ну пластины. - Удаление SLDS, добавить 2 мл раствора фермента протеазы и инкубации образца при 37 ° C, 5% CO2 на 15 мин.
- Вымойте гиппокампа эксплантов с 5-10 мл обшивка среднего дважды. Добавьте 5 мл обшивка среднего. Отделить гиппокампа эксплантов в отдельные клетки, создавая небольшой вихрь с помощью пипетки с 1 мл пластикового наконечника. Пипетка вверх и вниз примерно в 40 раз, избегая образования пузырьков кислорода, до тех пор, пока решение становится мутным и не большие куски экспланта остаются.
Примечание: Помните, чтобы оставить некоторые СМИ во время мойки, гиппокампа эксплантов должны оставаться погруженной в среде во время всего процесса. - Центрифуга клетки на 1125 x g на 3 мин удалить супернатант с клетками погруженной в средствах массовой информации. Ресуспензируйте клетки в 145 мл покрытие средств массовой информации. Добавьте 1 мл/колодец суспензию клеток к 24-ну пластины (3 мл/хорошо-6-ну плиты).
Примечание: 145 мл покрытие СМИ используется для производства суспензии клеток, который имеет плотность низкая клеток. Этот объем позволит обшивка клеток в шести 24-ну пластин, восемь 6-ну пластины или различные комбинации 24 - или 6-ну пластины в зависимости от экспериментов проводиться. Каждый хорошо пластины 24-ну будет иметь около 3 х 104 клетки9. - Инкубации клеток в СМИ покрытия при 37 ° C, 5% CO2 на 2-4 ч, затем удалите все покрытие СМИ и заменить его с свежими содержание средств массовой информации.
- После 2 дней (2 дня в пробирке, 2DIV), замените половину средств массовой информации 2 мкм Ara-C (Арабиносилцитозин) растворяют в средствах массовой информации содержание, который подавляет рост фибробластов, эндотелия и глиальных клеток. После разоблачения клетки до Ara-C в течение двух дней, замените свежие содержание СМИ СМИ.
-
Трансфекция для визуализации морфологии клеток
Примечание: Transfect клетки с конструкциями флуоресцентный зеленый флуоресцентный белок (КГВ), желтый флуоресцентный белок (рекламы ЯФП), mCherry и т.д. для освещения морфология отдельных нейронов.- Разбавьте конструкции со склада (1 мкг/мкл) в Opti-MEM СМИ (0,8 мкг конструкции в 50 мкл Opti-MEM СМИ) и вихря. Подготовка 1 конструкции разрежения для каждой скважины.
Примечание: 24-ну плита требует 0,8 мкг конструкции в 50 мкл Opti-MEM средств массовой информации. 6-ну плиты требуется 2,4 мкг конструкции в 150 мкл Opti-MEM СМИ. - Разбавьте липосомы опосредованной трансфекции реагент Opti-MEM СМИ (1,5 мкл Реагента трансфекции в 50 мкл Opti-MEM СМИ) и вихря. Подготовка 1 трансфекции разрежения для каждой скважины.
Примечание: 24-ну плита требует 1,5 мкл Реагента трансфекции в 50 мкл Opti-MEM средств массовой информации. 6-ну плита требует 4.5 мкл Реагента трансфекции в 150 мкл Opti-MEM средств массовой информации. - Приготовить смесь 1:1 (100 мкл) конструкции в Opti-Mem СМИ и трансфекции реагента в СМИ Opti-MEM и вихрь. Инкубируйте смесь при комнатной температуре в течение 20 мин.
Примечание: В колодец, должно быть около 100 мкл раствора, содержащего конструкции, transfection реагента и Opti-MEM СМИ, если с помощью 24-ну плита (300 мкл 6-ну пластины). - Удалить половину средств массовой информации (500 мкл для 24-ну плиты, 1,5 мл для 6-ну плиты) из каждой скважины и передачи этого СМИ в чистой коническую пробирку. Держите эту трубку в инкубаторе. Затем добавьте смесь 100 мкл (шаг 2.2.3) оставшихся средств массовой информации в колодец. Позволяют клеткам для инкубации при 37 ° C для 20-30 мин.
- Во время инкубации (шаг 2.2.4) добавьте один объем свежие содержание средств массовой информации к средствам массовой информации в коническую пробирку (шаг 2.2.4). Поместите смесь в том же инкубатор (37 ° C и 5% CO2).
- После инкубации удалите все средства массовой информации, содержащие трансфекции решение из скважин и заменить его с 1:1 смесь старых и свежих содержание СМИ в коническую пробирку (шаг 2.2.5).
Примечание: В зависимости от размера конструкции, клетки могут начать выражая в течение 12 ч; для больших конструкций 3-4 дней могут быть необходимы, прежде чем будет достигнут пик выражение конструкций.
- Разбавьте конструкции со склада (1 мкг/мкл) в Opti-MEM СМИ (0,8 мкг конструкции в 50 мкл Opti-MEM СМИ) и вихря. Подготовка 1 конструкции разрежения для каждой скважины.
3. Настройка Пыхтящий аппарат пипетки
Примечание: Существует пять основных компонентов этой настройки: стеклянные пипетки, трубы, шприц, микроманипулятор и буфера (Хэнк). Может использоваться любой буфер, который имеет физиологически соответствующих концентрация соли в этой настройке.
- Вытяните боросиликатное пипетку, чтобы иметь вокруг открытия 45-мкм диаметр кончика с помощью съемника микропипеткой и спецификации в таблице 3.
Примечание: Было установлено, что 45 мкм это подходящий размер для диаметра пипетки, открытие в экспериментальных условиях. Незначительные изменения в размер отверстия не должно значительно влиять результаты. Важно отметить, что большие отклонения от этого числа по-прежнему должен работать для индукции варикозной болезни, регулируя высоту шприц, который связан с пипеткой через трубы, но это потребует калибровка величины давления. - Вставьте конец ООН вытащил пипеткой в тонкую резиновую трубку.
Примечание: Трубки стены должна быть тонкой и жесткой, чтобы минимизировать сопротивление жидкости, обеспечение того, что высота шприц прямо пропорциональна давления жидкости, протекающей через дозатор с незначительным сопротивлением. Труб должна быть не больше чем около 0,6 м в длину для дальнейшего минимизировать сопротивление. - Подключите другой конец шланга к пластиковые шприц 10 мл через соединитель с клапаном, поворот состоянии.
Примечание: Пластиковый шприц должна проводиться на постоянной, измеримые высоте для обеспечения точной мерой для предполагаемого давления, вытекающих из пипетки. Высотой 190 мм, была использована, поскольку это обеспечивает минимальное давление, но надежно индуцирует варикоз в аксонов. Другие значения высоты может также использоваться, если давление вызывает клетки оторваться от поверхности coverslip. Рекомендуется использовать те же настройки на протяжении всего эксперимента. - Вставьте дозатор в винт верхней части микроманипулятор провести дозатор на место. Винт метал, плоские превысила винт придает микроманипулятор руку так, что он держит ООН вытащил конца пипетки чуть выше где прилагается резиновой трубки. Пипетка с поверхностью нейрон содержащих coverslips под углом 45°, угол.
Примечание: Микроманипулятор должны быть построены таким образом, чтобы пипеткой может проводиться без сжимает резиновой трубки. Микроманипулятор должны позволить движение пипетку в x, y и z направления точно позиционировать в диапазоне ячеек. Как графический, так и фотографии аппарата приводится ниже (рис. 1). - Включите фильтр флуоресценции, открыть диафрагму и убедитесь, что флуоресцентные пятна можно увидеть сквозь цели. Использование микроманипулятор, переместите пипетку в позицию, линий до кончика с флуоресцентные пятна и опустите пипеткой в позицию чуть выше высота клетки культуры блюдо (35 мм x 10 мм). После того, как он находится в положении, включите пропускаемого света и выключить флуоресценции.
- С помощью пинцета, добавьте один coverslip (с клетками, вверх к пипеткой) от плиты культуры клеток в блюдо культуры клеток, содержащих около 2 мл Хэнка буфера при комнатной температуре.
- Место культуры блюдо, содержащие coverslip на область.
- Используя ручку тонкой фокус и 20 X цели, сосредоточиться на самолете около четырех полных оборотов выше клетки (около 0,4 мм). Используйте микроманипулятор для Расположите наконечник пипетки так, что она направлена и в центре левой части плоскости, как видно через глаз штук.
Примечание: Дендритов, прогнозы, которые должны быть в той же рамке, как они происходят из тела клетки. Чтобы побудить аксональное варикоз, одно должны следовать больше прогнозов из тела клетки медиальной и дистальной аксоны.
4. Калибровка давления пипетки, используя систему растягивающийся мембраны
- Установка Пыхтящий аппарат пипетку с точно такими же параметрами, как описано выше в системы, содержащие microfabricated силиконовая мембрана (500 мкм в диаметре) и толщиной 50 мкм и сосредоточиться Микроскоп на поверхности мембраны.
Примечание: Эта система была разработана для измерения малых давления и объяснение системы была опубликована до10. Это измерение необходимо только сделать один раз для пыхтя эксперименты, если используется параметр точное же пыхтя. - Фокус Микроскоп на массивах Микроточки (4 мкм в диаметре) и 10 мкм друг от друга, как измеряется между центрами. Поверните стопорный клапан и позволяют жидкости из пипетки. Изучите прогиб мембраны в ответ на давление жидкости с помощью конфокального микроскопа.
- Используйте линейной модели, чтобы определить соответствующее давление, связанное с прогиб мембраны.
Примечание: Хотя недавние исследования обнаружили, что отклонение w =-3.143 ± 0,69 мкм было получено для шприца 190 мм в высоту, это производится под давлением 0,25 ± 0,06 nN/мкм2 от текущей установки дозаторов, который находится в пределах физиологических и патологических, хотя шприц высота не является единственным определяющим фактором. Другие факторы влияют на значение точное давление на нейроны, включая пипеткой открытие, позиционирования (расстояние и угол) кончика пипетки относительно клетки и даже гибкость труб4,10.
5. пыхтя побудить варикоз
- Как только пипетки находится в положении, фокус Микроскоп на самолете, который содержит область интереса. Положение клетки и процессов в левой половине области изображений (рассматривается видеосъемки камерой) в рамках Пыхтящий области, в то время как правая половина — за пределами пыхтя области.
Примечание: Из-за обширных нарост аксонов и дендритов нейронов, маловероятно, что все процессы нейрона находятся в пределах области же Пыхтящий. Это фактически одно из преимуществ этой системы, которая позволяет изучение местных эффект отдуваясь. Существует два типа пыхтя, которые могут быть использованы для стимулирования варикоз: длительность пыхтя и пыхтя импульса. -
Пыхтя
- Пыхтя длительность
- Поместите шприц на высоте, 190 мм выше coverslip, содержащие культивировали нейронов4. Начните промежуток времени визуализации области интересов с оптимизированной выдержка, выявление четких нейрональных морфологии. Кадры по меньшей мере 15 с интервалом 2 s (30 всего s) как базовый. Интервал может быть скорректирована на основании эксперимента. В кадре 16, открыть очередь состоянии запорный клапан шприца и позволяют жидкости течь для 75 кадров (150 s). В кадре 75 выключите клапан так, чтобы жидкость поток останавливается. Остановите захват видео.
Примечание: Это должно побуждать аксональное варикоз в нейронах DIV 7-9 в течение 5-10 s, тогда как старые нейроны занять больше времени, чтобы форма варикоз.
- Поместите шприц на высоте, 190 мм выше coverslip, содержащие культивировали нейронов4. Начните промежуток времени визуализации области интересов с оптимизированной выдержка, выявление четких нейрональных морфологии. Кадры по меньшей мере 15 с интервалом 2 s (30 всего s) как базовый. Интервал может быть скорректирована на основании эксперимента. В кадре 16, открыть очередь состоянии запорный клапан шприца и позволяют жидкости течь для 75 кадров (150 s). В кадре 75 выключите клапан так, чтобы жидкость поток останавливается. Остановите захват видео.
- Пыхтя импульса (продолжительность 2 s)
- Поместите шприц на нужной высоте (190 мм). Начать промежуток времени обработки изображений и записи по крайней мере 15 кадров (30 s) с интервалом 2 s. В кадре 16 Откройте клапан шприца и позволяют жидкости для потока, а затем закрыть клапан после 2 s. s ждать 5-20 (в зависимости от частоты для проверки) перед открытием клапана снова. Повторите открытия и закрытия клапана для создания жидкости импульсов и продолжить в течение всего периода 150-300 s. продолжить покадровой изображений для 20 мин для захвата на этапе восстановления.
Примечание: Когда интервал длиннее, чем 10 s, импульсы вызывают резко меньше варикоз. С интервалом 20 s не варикоз может быть вызвана импульсов4. Чтобы получить формирования надежной, последовательной варикозной болезни, рекомендуется шприц высота должна быть около 190 мм. шприц высоты и давления жидкости не должна быть повышена до точки, где клетки начинают отсоединение от поверхности coverslip.
- Поместите шприц на нужной высоте (190 мм). Начать промежуток времени обработки изображений и записи по крайней мере 15 кадров (30 s) с интервалом 2 s. В кадре 16 Откройте клапан шприца и позволяют жидкости для потока, а затем закрыть клапан после 2 s. s ждать 5-20 (в зависимости от частоты для проверки) перед открытием клапана снова. Повторите открытия и закрытия клапана для создания жидкости импульсов и продолжить в течение всего периода 150-300 s. продолжить покадровой изображений для 20 мин для захвата на этапе восстановления.
- До дня использования, очистить set-up (Пипетка, труб и шприца), пропуская о 10 мл 70% этанол через настройки. После этанола мыть, поток 10 мл буфера Хэнка (или желаемого буфера) через настройки системы для использования в этот день премьер. После отделки эксперименты на день, очистить настройки, как описано ранее с этанолом для предотвращения роста загрязнений на ночь.
- Пыхтя длительность
6. дополняя методы
Примечание: Пыхтящий assay может сочетаться с целый ряд различных методов, которые обсуждаются в разделе Введение. Здесь основное внимание уделяется основным методам, которые наиболее часто используются вместе с Пыхтящий assay, включая изображения с высоким разрешением флуоресценции timelapse, кальция изображений и восстановления анализов. Эти вопросы обсуждаются ниже.
-
Проведение с высоким разрешением изображений флуоресцентные промежуток времени, следуя протоколу ниже
- Отслеживать движение дневно тегами белков внутри нейронов с 100 X объектив нефти. Нейроны являются transfected с помощью надлежащего cDNA конструкции. Захват для 150 кадров (всего 300 s) с интервалом в 2 s.
Примечание: Иногда, несколько цвет покадровой изображений выполняется для изображения движения более чем одного белка, дневно тегами одновременно. - Генерировать кимограф, либо через программное обеспечение захвата видео, либо через ImageJ (НИЗ).
Примечание: Скорость и направление движения может быть определен с помощью кимограф. * Обязательно отметить направление soma находится от региона захватываться. Путешествие к soma ретроградным, время поездки от soma кончик аксональное антероградная. - Повторите этот процесс, после Пыхтящий, или кимограф могут быть созданы с помощью захвата изображения во время Пыхтящий assay.
Примечание: Эффекты пыхтя на аксональное транспорта митохондрии и синаптических белков были показаны в последние бумаги4.
- Отслеживать движение дневно тегами белков внутри нейронов с 100 X объектив нефти. Нейроны являются transfected с помощью надлежащего cDNA конструкции. Захват для 150 кадров (всего 300 s) с интервалом в 2 s.
-
Кальция изображений
- Добавить 1 мкл (для 24-ну плиты) или 3 мкл (для 6-ну тарелку) 5 мм Fluo-4 утра в культуре средств массовой информации в одном хорошо и инкубировать при 37 ° C за 30 мин.
- Вымойте клетки дважды с 1 мл Хэнк буфера.
Примечание: Загружен нейроны выделяют зеленой флуоресценцией через набор фильтров FITC. Локусов обозначаются районы, ощутимый кальция в клетке. В сочетании с пыхтя, можно увидеть увеличение интенсивности (повышение уровня внутренней кальция).
-
Варикозная болезнь восстановления
Примечание: Сразу же после Пыхтящий эксперимент, 20 мин восстановления может быть проведен эксперимент.- Захват изображения для 300 кадров (1200 s) с интервалом в 4 s.
Примечание: Клетки transfected с растворимых рекламы ЯФП/mCherry/GFP должен показать умеренный уровень (менее 50%) восстановления к концу сессии изображений. Аксональное восстановления зависит от ряда факторов, таких как стадии развития искусственного нейронов4. Это может также сочетаться с высоким разрешением флуоресцентных изображений и изображений кальция, описанных выше.
- Захват изображения для 300 кадров (1200 s) с интервалом в 4 s.
Результаты
До пыхтя, аксоны обычно показывают мало формирования варикозной болезни. Следующие пыхтя с нашей стандартной давления (190 mmH высота2O), аксоны начинают разрабатывать много бисера как варикоз. Формирование варикоз частично обратима, как показано по регионам аксона, возвращаясь к их предварительно пыхтел состояние после периода восстановления 10 мин (A-BРисунок 2). После длительного периода восстановления (> 20 мин), полностью восстановить некоторые аксоны. Неоптимальный позиционирования Пыхтящий пипеткой, а также точное позиционирование шприца на 190 мм выше этап не может генерировать варикоз быстро. Оптимальные условия должно привести к формированию варикозной болезни в аксоны нейронов (около 7 DIV) молодых в около 5 s4.

Рисунок 1 : Схемы и фотографии пыхтя аппарат. (A) фотографии, показывающие общий Микроскоп set-up. (B) пыхтя аппарат показаны стеклянной пипетки проведенных микроманипулятор и подключен к резиновой трубки. (C) фаза контраст изображения с фокус в плоскости первичного гиппокампа нейронов, показаны тени пипетку в нижней правой. (D) из плоскости клетки сосредоточены на пыхтя наконечник пипетки. (E) схема расстояний и расчетные давления для стимулирования варикоз. Шкалы бар = 50 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
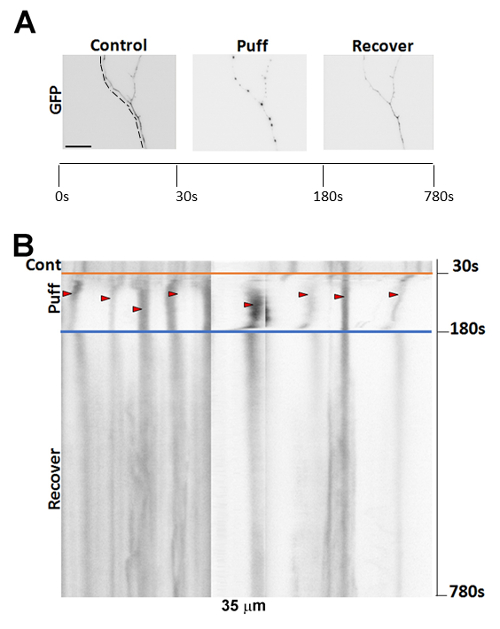
Рисунок 2 : Представитель изображений формирования варикозной болезни после пыхтя. (A) изображения 7DIV, мышь GFP transfected гиппокампа нейронов показаны аксон до и после пыхтя и после периода восстановления 10 мин. (B) кимограф покадровой съемки нейрона в (A). Красные стрелки показывают варикоз, которые сформированы после 150 х 190 mmH2O пыхтя (начало в 30 s). Шкалы бар = 15 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Coverslip раствор для нанесения покрытия | |
| 780 МКЛ | Уксусной acid17 приклад: 50 мкл рабочего раствора уксусной кислоты в 50 мл H2O |
| 200 МКЛ | Поли-D-Лизин (0.5 мг/мл бульона) |
| 20 МКЛ | Крысы хвост коллагена (3 мг/мл бульона) |
| Общий объем определяется на основании количества coverslips быть покрыты. | |
Таблица 1: раствор для нанесения покрытия Coverslip. Предоставляет рецепт для подготовки решение coverslip покрытие, используемое присоединиться культивируемых клеток к coverslips.
| 1 x ломтик рассечение раствора (ПВР), фильтруют, pH = 7,4, хранить при 4 ° C | |
| 1 Л | ddH2O |
| 82 мм | Na2так4 |
| 30 мм | ТАК4 K2 |
| 10 мм | HEPES (свободная кислота) |
| 10 мм | D-глюкоза |
| 5 мм | 2 MgCl |
| 0.00% | Фенол красный (опционально) |
| Покрытие массовой информации (PM, фильтр, хранить при 4 ° C) | |
| 439 мл | МЕМ Эрл соли |
| 50 мл | FBS |
| 11.25 мл | 20% D-глюкозы |
| 5 мл | Пируват натрия (100 мм) |
| 62,5 МКЛ | L-глютамин (200 мм) |
| 5 мл | Пенициллин/стрептомицина (P/S, 100 x) |
| Техническое обслуживание средств массовой информации (мм, фильтр, хранить при 4 ° C) | |
| 484 мл | Neurobasal |
| 10 мл | 50 x дополнение B27 |
| 1,25 мл | L-глютамин (200 мм) |
| 5 мл | 100 x P/S |
| Все решения подвергаются стерилизации с помощью фильтра с порами размером 0,2 мм. | |
Таблица 2: клетки культуры СМИ рецепты. Обеспечивает рецепты для подготовки средств массовой информации, используются в культивирования клеток первичного гиппокампа нейрона.
| Хэнк буфера (фильтр, pH = 7,4, магазин на 4° C | |
| 150 мм | NaCl |
| 4 мм | KCl |
| 1.2 мм | 2 MgCl |
| 1 мм | CaCl2 |
| 10 мг/мл | D-глюкоза |
| 20 мм | HEPES |
Таблица 3: рецепт буфера Хэнка. Предоставляет рецепт для подготовки в буфер, используется в протоколе уханье и во время клеток.
| Пипетка, потянув параметры | |||||
| Жара | Тяга | Скорость | Задержка | Давление | Пандус |
| 501 | 0 | 15 | 1 | 500 | 530 |
Таблица 4: Пипетка, потянув параметры. Предоставляет параметры для быть на пипетку съемник для получения открытие, что составляет около 45 мкм в диаметре.
Обсуждение
Этот assay microbiomechanical процедура прямо вперед. Он будет производить надежные результаты, если все его шаги осуществляются тщательно. Есть несколько ключевых шагов, которые, если выполняется неправильно, будет препятствовать успешной данных коллекции. Важнейшие шаги начинают вверх по течению от фактического применения Пыхтящий стимул. Тщательное вскрытие, выращивание и уход первичный нейрон культуры имеют первостепенное значение. Если культивировали нейроны не являются здоровыми, они не будет реагировать последовательно, так как они могли бы уже были нацелены на стресс. Вниз по течению от культуры, первоначальной настройки и калибровки Пыхтящий аппарата оказывать постоянное давление, что побудит варикоз, но не вызовет отряд клеток с поверхности coverslip, должны быть выполнены с терпением. Точной калибровки настройки может занять 1 ч из-за засорения пипетки, труб или клапан вопросов. Важно обеспечить, чтобы жидкость течет из пипетки с минимальным сопротивлением, прежде чем двигаться вперед с размещение ячейки в блюдо и позиционирования наконечник пипетки. Что касается изменения в настройки, один можно пару Пыхтящий аппарат с перфузии, патч зажима и любой другой Микроскоп основанный инструмент, главным образом зависит от физического пространства, свободного по бокам микроскопа.
Эта система имеет два встроенных ограничений, которые требуют внимания. Настройка последовательно может инициировать формирование реверсивные варикоз в культивированный гиппокампа нейронов через Пыхтящий жидкость в клетки. Однако важно отметить, что значения точное давление на нейронов в пределах того же Пыхтящий поля не идентичны. Давление жидкости, которая влияет на клетки, рассчитывается на основе нагрузки Измерение давления от microfabricated силиконовые мембраны4,10, представляет среднее давление в центре месторождения уханье. Таким образом точные Пыхтящий давление является самым высоким в центре Пыхтящий поля и низкие вокруг края поля. Мы показали, что давление прочность коррелирует с наступлением, размер и количество варикоз индуцированной4. Более высокое давление привело к быстрее начала, больше и более обильные варикоз4. В наших последних исследований мы использовали минимального давления (190 mmHg на кончике Пыхтящий пипетки), который до сих пор надежно может вызвать варикоз в большинстве аксоны4. При этом условии, варикозная болезнь начала для молодых нейронов является обычно около 5 s. Важно отметить, что с точным же пыхтя системы, значение времени начала может меняться, который не только зависит от нейронов типа, возраста и внутриклеточных отсек, но могут также зависеть от позиции нейрон в области уханье. Несмотря на вариации Пыхтящий давления, полученные нейронов эта система анализа по-прежнему предоставляет надежные средства для изучения механического воздействия на центральных нейронов и дает весьма последовательной и воспроизводимые результаты экспериментов.
Второй недостаток системы является ее засорения вопросом. Для достижения физиологически соответствующего давления, открытие пипеток является небольшой, около 45 мкм. Однако небольшое отверстие, как правило, забивают с мусором из пластиковых труб и мусора в наконечник пипетки можно ясно увидеть под микроскопом. Это увеличивает количество времени, prepping установки, в случае забивают пипеткой. Таким образом все решения тщательно фильтруются до помещаются в шприц, труб и пипетки. Это также важно мыть Пыхтящий системы с 70% этанола в начале и в конце дня, после стирки с буфером отфильтрованных Хэнк. Чтобы решить потенциальные проблемы засорения, мы предлагаем пытается тянуть несколько пипеток. Важно, чтобы подтвердить, что решение фактически запыхаться из пипетки посредством визуализации до начала экспериментов. После того, как создана хорошая Пыхтящий система, она обычно может длиться для остальной части дня.
Этот assay биомеханических, в сочетании с нейрон культуры, представляет собой уникальную возможность для изучения mechanosensation Центральный нейрон, подражая физиологические и/или патофизиологические условий. Эта система позволяет нам изучить воздействие сжатия и сдвига на нейронов. В отличие от других систем были использованы для изучения в плоскости растяжения5,6,7. Среднее давление, полученных нейронов в центре Пыхтящий районах составляет 0,25 ± 0,06 nN/мкм2 в нашей системе4. Это давление, оказываемое на клетки сопоставима с упругости Нейроны гиппокампа измерена ранее использование сканирования микроскопии и массовых реология силы, для определения оптически индуцированных деформации13,14, а также давления, используется для изменения роста neurite ведущих края в пробирке, измеряется сканирования силу микроскопии (0.27 ± 0.04 nN/мкм2)16. Это давление не превышает давление, которое может быть порождена естественно мезенхимальных клеток в эмбрион E11, как измеряется с помощью механически конкретных флуоресцентные размера ячейки нефти microdroplets (1.6 ± 0,8 nN/мкм)2,14.
Эта система уже успешно используется в сочетании с кальция изображений, патч зажима, электронный микроскоп и клеточного анализа закрытого череп mTBI мыши модель4. Assay может использоваться также в сочетании с Микроскоп на основе экспериментов, например флуоресценции восстановления после Фотообесцвечивание (FRAP), для изучения белков оборот в пределах варикоз, а так же беспокоить учиться если изменяются белок белковых взаимодействий во время формирования варикозной болезни. По сути, любой метод, который можно сделать с помощью микроскопа и живой клетки изображений настройки может быть сопряжен с Пыхтящий этот assay. Универсальность этого анализа является весьма ценным в изучение молекулярных механизмов, лежащих в основе различных эффектов на нейрональные морфологии и функций микромеханические стресс.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Все эксперименты на животных были проведены национальные институты здравоохранения животных использования руководящим принципам. Эта работа частично поддержали грантов от национальных институтов здравоохранения (R01NS093073 и R21AA024873) C. ГУ.
Материалы
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Warner Instruments | 64-0702 | for 24-well plate |
| 25 mm coverslips | Fisher Scientific | 12-545-102 | for 6-well plate |
| Acetic acid | Fisher Scientific | A38-212 | |
| Poly-D-lysine | Sigma | P6407 | |
| Rat tail collagen | Roche | 11 179 179 001 | |
| 10X PBS | National Diagnostics | CL-253 | |
| Na2SO4 | Fisher Scientific | S373-500 | |
| K2SO4 | Fisher Scientific | P304-500 | |
| HEPES | Fisher Scientific | BP410-500 | |
| D-glucose | Fisher Scientific | D16-500 | |
| MgCl2 | Fisher Scientific | BP214-500 | |
| NaOH | Fisher Scientific | SS255-1 | |
| Protease enzyme | Sigma | P4032 | |
| FBS | Gibco | 26140 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| L-glutamine | Gibco | 25030081 | |
| Penicillin/Streptomycin 100x (P/S) | Gibco | 15140122 | |
| MEM Earle's Salts | Gibco | 11090 | |
| B27 supplement | Gibco | 17504-044 | |
| Neurobasal | Gibco | 21103-049 | |
| Arabinosylcytosine (Ara-C) | Sigma | 147-94-4 | |
| Opti-MEM media | Gibco | 31985-070 | |
| Lipofectamine 2000 | Invitrogen | 1854313 | transfection reagent |
| Borosilicate rods | World Precision Instruments Inc. | PG52151-4 | for puffing pipette |
| rubber tubing | Fisher Scientific | 14-169-1A | |
| 10cc plastic syringe and plunger | Becton Dickinson | ||
| micromanipulator | Sutter Instruments | ||
| NaCl | Fisher Scientific | S640-3 | |
| KCl | Fisher Scientific | BP366-500 | |
| CaCl2 | Fisher Scientific | C70-500 | |
| Cell culture dish (35 mm x 10 mm) | Corning | 3294 | |
| Fluo-4 AM | Molecular Probes | F14201 | for calcium imaging |
| Mito-YFP construct | Takara Bio Inc. | for cell transfection | |
| YFP-N1 construct | Takara Bio Inc. | for cell transfection | |
| Model P-1000 Flaming/Brown Micropipette puller | Sutter Instruments | ||
| Eclipse TE2000-U Mcroscope | Nikon | ||
| Plan Fluor ELWD 20x lens | Nikon | 062933 | objective |
| Apo TIRF 100x/1.49 oil lens | Nikon | MRD01991 | objective |
Ссылки
- Nikić, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 17, 495-499 (2011).
- Yang, J., et al. Regulation of axon degeneration after injury and in development by the endogenous calpain inhibitor calpastatin. Neuron. 80 (5), 1175-1189 (2013).
- Debanne, D. Information processing in the axon. Nat. Rev. Neurosci. 5, 304-316 (2004).
- Gu, Y., Jukkola, P., Wang, Q., Esparza, T., Zhao, Y., Brody, D., Gu, C. Polarity of varicosity initiation in central neuron mechanosensation. J Cell Biol. 216 (7), 2179-2199 (2017).
- Chung, R. S., et al. Mild axonal stretch injury in vitro induces a progressive series of neurofilament alterations ultimately leading to delayed axotomy. J. Neurotrauma. 22 (10), 1081-1091 (2005).
- Staal, J. A., Dickson, T. C., Chung, R. S., Vickers, J. C. Cyclosporin-A treatment attenuates delayed cytoskeletal alterations and secondary axotomy following mild axonal stretch injury. Dev. Neurobiol. 67 (14), 1831-1842 (2007).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Exp. Neurol. 233 (1), 364-372 (2012).
- Donkin, J. J., Vink, R. Mechanisms of cerebral edema in traumatic brain injury: therapeutic developments. Curr Opin Neurol. 23 (3), 293-299 (2010).
- Gardner, A., Jukkola, P., Gu, C. Myelination of rodent hippocampal neurons in culture. Nat Protoc. 7 (10), 1774-1782 (2012).
- Wang, Q., Zhang, X., Zhao, Y. Micromechanical stimulator for localized cell loading: fabrication and strain analysis. J. Micromech. Microeng. 23, 015002(2013).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc. Natl. Acad. Sci. USA. 103 (47), 17759-17764 (2006).
- Elkin, B. S., Azeloglu, E. U., Costa, K. D., Morrison, B. Mechanical heterogeneity of the rat hippocampus measured by atomic force microscope indentation. J. Neurotrauma. 24 (5), 812-822 (2007).
- Franze, K., et al. Neurite branch retraction is caused by a threshold-dependent mechanical impact. Biophys. J. 97 (7), 1883-1890 (2009).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nat. Methods. 11 (2), 183-189 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены