Method Article
Ein Microbiomechanical-System für das Studium Varizen-Bildung und Erholung in zentralen Neuronen Axone
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine physiologisch relevante, unter Druck stehende flüssige Ansatz für schnelle und reversible Induktion von Krampfadern in den Neuronen.
Zusammenfassung
Axonale Krampfadern sind erweiterte Strukturen entlang der Wellen von Axonen mit ein hohes Maß an Heterogenität. Sie sind nicht nur im Gehirn mit neurodegenerativen Erkrankungen oder Verletzungen, sondern auch im normalen Gehirn. Hier beschreiben wir eine neu gegründete mikromechanische System, schnell, zuverlässig und reversibel axonale Krampfadern, induzieren, ermöglicht es uns, die EZB, Varizen-Bildung und heterogenen Proteinzusammensetzung Mechanismen zu verstehen. Dieses System stellt eine neuartige Mittel zur Bewertung der Auswirkungen von Kompression und Shear Stress auf verschiedenen subzelluläre Kompartimente von Neuronen, anders als andere in-vitro- Systeme, die sich hauptsächlich auf die Wirkung von stretching. Vor allem aufgrund der einzigartigen Merkmale unseres Systems haben wir vor kurzem eine neuartige Entdeckung zeigt, dass die Anwendung der unter Druck stehende Flüssigkeit schnell und reversibel axonale Krampfadern durch die Aktivierung eines Transienten Rezeptor potenzielle Kanals hervorrufen kann. Unsere biomechanische System kann bequem in Kombination mit Medikamenten Perfusion, live Cell Imaging, Kalzium Bildgebung und Patch-Clamp-Aufnahme genutzt werden. Daher kann diese Methode für das Studium Mechanosensitive Ionenkanäle, axonalen Transport Verordnung axonalen Zytoskelett Dynamik, Kalzium-Signalisierung und morphologische Veränderungen im Zusammenhang mit traumatischen Hirnverletzungen übernommen werden.
Einleitung
Varizen-Bildung oder Schwellung/Sicke, entlang der Axone, ist ein hervorstechendes Merkmal der Neurodegeneration bei vielen Erkrankungen oder Verletzungen des zentralen Nervensystems, einschließlich multipler Sklerose, Morbus Alzheimer, Morbus Parkinson, beobachtet und traumatischen Gehirn Verletzungen1,2. Trotz der erheblichen physiologischen Auswirkungen der axonalen Krampfadern auf Aktionspotential Ausbreitung und die synaptische Übertragung3wie die Krampfadern entstehen, bleibt unbekannt. Vor kurzem, mit einer neu gegründeten Microbiomechanical-Assay auf kultivierten hippocampal Neuronen von Nagetieren, fanden wir, dass mechanische Reize Krampfadern in diesen Neuronen mit höchst faszinierende Funktionen hervorrufen können. Erstens Varizen Induktion ist schnell (< 10 s) und dieser Prozess kann unerwartet rückgängig gemacht werden. Zweitens, Varizen Einleitung hängt von der Stärke schnaufend Druck: je höher der Druck, desto schneller die Einleitung. Varizen Einleitung hängt Drittens neuronalen Alter. Die Axone der jüngere Neuronen scheinen stärker auf die mechanische Beanspruchung im Vergleich zu älteren Neuronen. Vierter, Krampfadern Form entlang der Axone hippocampal Neuronen, während die Dendriten und erste Axon Segmente dieser Neuronen zeigen keine Veränderung unter den gleichen Bedingungen, puffing. So, unsere Studie ergab ein Novum der neuronale Polarität. Diese Erkenntnisse mit dem in-vitro- System sind physiologisch relevanten. Eine in Vivo Modell zeigten für milde traumatische Hirnverletzungen (mTBI) wir, dass axonale Krampfadern in einer Multi-focal Mode im somatosensorischen Cortex der Mäuse, sofort nach dem Schließen-Totenkopf Aufprall, Einklang mit unserem in-vitro entwickelt- Ergebnisse4. Es ist wichtig zu beachten, dass unsere Färbung und Bildgebung der mTBI Mäuse nur eine Momentaufnahme der neuronalen morphologische Veränderungen, seit Durchführung in Vivo Zeitraffer Bildgebung der neuronale Morphologie während eine mechanische Wirkung ist noch nicht möglich.
Diese Flüssigkeit schnaufend System erlaubt uns nicht nur einzigartige Eigenschaften zu mechanischen Stress-induzierte Varizen-Bildung zu erfassen, sondern auch den zugrunde liegende Mechanismus zu bestimmen. Durch das Testen verschiedener extrazellulären Lösungen, Blocker und Öffner der verschiedenen Kandidaten der Mechanosensitive Ionenkanäle und zelluläre Elektrophysiologie, festgestellt wir, dass die Transienten Rezeptor potenzielle kation Kanal Unterfamilie V Bauteil 4 (TRPV4) Kanal, der ist durchlässig für Ca2 + und Na+ und aktiviert durch schnaufend ist hauptverantwortlich für die erste mechanischen Beanspruchung während der axonalen Varizen Bildung4erkennen. Dies wurde noch mit einem SiRNA ko Ansatz bestätigt. Zusammengenommen, diesem neuen Testsystem, die wir mit hippocampal Neuronen Kultur entwickelt haben, ist sehr wertvoll für die Mikromechanische Eigenschaften des zentralen Neuronen, vor allem in Kombination mit anderen Techniken zu studieren.
Dieses mikromechanische System, die, das wir eingerichtet haben, ist einzigartig und unterscheidet sich von den bereits bestehenden Systemen in einigen wichtigen Aspekten. Zuerst erleben die Neuronen in diesem System Out-of-Plane mechanischen Beanspruchung in den Formen der Kompression und Scheren. Während die mechanischen Auswirkungen neuronale Prozesse bleiben an der Oberfläche Deckglas und bewegen sich nicht. Dies unterscheidet sich von anderen experimentellen Systemen, die vor allem bücken und Strecken in der Ebene beteiligt (oder Spannung), zum Beispiel die Durchbiegung der gebündelte Axone wie Saiten5,6 verschieben oder dehnen Axone auf Micropatterned gewachsen Kanäle und dehnbare Membranen7,8. Darüber hinaus obwohl axonale Krampfadern auch in induziert werden können diese Tests wie in unserem Flüssigkeit schnaufend System, den Prozess in diesen Einstellungen dauert viel länger (ab 10 min bis mehreren Stunden6,7,8) und erscheint irreversible. Zu guter Letzt unser System mit lokalen Fluid schnaufend ermöglicht die Untersuchung der räumlichen Eigenschaften der Varizen-Bildung (zB., Dendriten, dendritische Dornen, Soma, axonalen ersten Segmente axonalen Klemmen), neben seiner zeitlichen Eigenschaften. Mit diesem System haben wir mehrere unerwartete und einzigartige Eigenschaften der axonalen Varizen-Bildung, vor allem schnellen Wirkungseintritt langsam Reversibilität und Axon-Dendrit Polarität entdeckt.
Das System, das wir in diesem Papier zu diskutieren ist kompatibel mit vielen Techniken der molekularen und Zellbiologie. Zum Beispiel zur Untersuchung der Auswirkungen von mechanischem Stress auf neuronale Morphologie und Funktion zusammen mit Myelin Coculture, Time-Lapse Bildgebung des Fluoreszenz Resonanz Energietransfer (FRET) und Totalreflexion Fluoreszenz (TIRF) einsetzbar Calcium Imaging und Patch-Clamp-Aufnahme. In diesem Artikel konzentrieren wir uns auf den Kern-Komponenten des Systems. Hippocampal Neuronen Kultur, die Flüssigkeit schnaufend Setup, hochauflösender Zeitraffer Imaging für axonalen Transport und Kalzium Imaging werden Schritt für Schritt unten illustriert.
Protokoll
Alle nachfolgend beschriebene Methoden wurden von den institutionellen Animal Care und Nutzung Committee (IACUC) von der Ohio State University genehmigt.
(1) Deckglas Vorbereitung
- Legen Sie einen oder mehrere Kisten mit 12 mm oder 25 mm Deckgläsern in ein Becherglas mit 70 % Salpetersäure und inkubieren Sie Deckgläsern bei Raumtemperatur über Nacht.
Hinweis: Waschen Sie die 25 mm Deckgläsern im gleichen Becher als 12 mm Deckgläsern nicht. Es ist besser, sie separat zu waschen. - Übertragen Sie alle Deckgläsern in 4 L Becher gefüllt mit 2,5 L DdH2O und schütteln Sie den Becher mit den Deckgläsern für 1 h bei 100 u/min. Verwenden Sie Gummibänder die Becher beim Schütteln zu halten. Wiederholen Sie das Spülen mit frischen 2,5 L DdH2O viermal.
- Übertragen Sie gereinigte Deckgläsern auf eine trockene Flasche mit einem Metalldeckel. Backen Sie die Deckgläsern in einem Ofen bei 225 ° C für 6 h und auf Raumtemperatur abkühlen lassen.
Hinweis: Die 25 mm-Deckglas ist anfällig für Bruch. Deckgläsern eins nach dem anderen zu trennen und an der Luft trocknen, dann in einem Ofen zu backen. - Lagern Sie die getrocknete und gereinigten Deckgläsern bei Raumtemperatur bis zur Verwendung in einem sterilisierten Plastikbehälter.
-
Bestreichen Sie die Deckgläsern wie folgt:
- Bereiten Sie frische Beschichtungslösung in ein Zentrifugenröhrchen.
- Platzieren Sie jedes Deckglas in einem Brunnen einer 24-Well (oder 6-Well) Platte. Platz 30 (oder 100) µL des Deckglases Beschichtungslösung (Tabelle 1) auf eine 12 mm (oder 25 mm) Deckglas und Wirbel. Fügen Sie 1 mL sterile Phosphat-gepufferte Kochsalzlösung (PBS, Gewebekultur Grade) zum Brunnen. Diese Platten können sofort verwendet oder bei 4 ° C in sterilen PBS für bis zu einer Woche gelagert werden.
- Am Tag der Dissektion entfernen Sie die PBS. An der Luft trocknen Sie und legen Sie die Platten unter UV-Licht (30W) für 2-4 h.
Hinweis: Der letzte Schritt sollte mit UV-Licht auf in eine Zelle Kultur Laminar-Flow Haube abgeschlossen sein. Die Tür der Haube sollte leicht angehoben werden, um Luftstrom zu ermöglichen, für die Trocknung der Deckgläsern.
2. Präparation, Dissoziation und Kultur der Hippocampal Neuronen aus Schwangere Maus/Ratte
-
Dissektion und Dissoziation des hippocampal Neuronen für Kultur
- Protease Enzymlösung (3 mg/mL Protease 23 in SLDS, Tabelle 1) Auftauen und Vorwärmen Beschichtung Medien (Tabelle 2) bei 37 ° C.
- Hippocampus zu sezieren und Spülen mit SLDS, nach den Methoden, die in früheren Publikation14beschrieben.
Hinweis: Vier hippokampi bieten genügend Zellen für einen 24-Brunnen oder eine 6-Well-Platte. - Entfernen Sie SLDS zu, fügen Sie 2 mL Enzymlösung Protease und inkubieren Sie die Probe bei 37 ° C, 5 % CO2 für 15 min.
- Waschen Sie der Hippocampus Explantaten mit 5-10 mL Beschichtung Medium zweimal. Hinzugeben Sie 5 mL Medium Plattieren. Hippocampale Explantaten in Einzelzellen zu distanzieren, erzeugen einen kleinen Wirbel mit einer Pipette mit einer 1-mL-Kunststoff-Spitze. Pipette rauf und runter ca. 40 Mal, vermeiden die Bildung von sauerstoffbläschen, bis die Lösung trüb wird und keine großen Stücke des modellabhängigen bleiben.
Hinweis: Denken Sie daran, einige Medien während Waschungen zu verlassen, der Hippokampus Explantaten während des gesamten Prozesses in das Medium eingetaucht bleiben sollen. - Zentrifugieren Sie die Zellen bei 1.125 x g für 3 min. Entfernen des Überstands mit den Zellen in den Medien überflutet. Aufzuwirbeln Sie die Zellen in 145 mL Plattieren Medien. Fügen Sie 1 mL/Well die Zellsuspension auf einer 24-Well-Platte (3 mL/Brunnen, ein 6-Well-Platte).
Hinweis: 145 mL Plattieren Medien wird verwendet, um eine Zellsuspension zu produzieren, die eine niedrige Zelle Dichte aufweist. Dieser Band ermöglicht die Beschichtung von Zellen in sechs 24-Well-Platten, acht 6-Well-Platten oder verschiedene Kombinationen von 24 oder 6-Well Platten abhängig von den Experimenten durchgeführt werden. Jede Vertiefung des 24-Well-Platte wird etwa 3 x 104 Zellen9haben. - Brüten Sie die Zellen in den Überzug Medien bei 37 ° C, 5 % CO2 für 2-4 h, dann entfernen Sie alle Beschichtung Medien und ersetzen Sie es mit frischen Wartung Medien.
- Nach 2 Tagen (2 Tage in Vitro, 2DIV), ersetzen Sie die Hälfte der Medien mit 2 µM Ara-C (Arabinosylcytosine) aufgelöst in Wartung Medien das Wachstum von Fibroblasten, Endothelzellen und Glia-Zellen hemmt. Ersetzen Sie nach der Freilegung Zellen, Ara-C für zwei Tage die Medien mit frischen Wartung Medien.
-
Transfektion zur Visualisierung der Zellmorphologie
Hinweis: Transfizieren Sie Zellen mit fluoreszierenden Konstrukte des grün fluoreszierenden Proteins (GFP), gelb fluoreszierenden Proteins (YFP), mCherry, etc. , die Morphologie einzelner Neuronen zu beleuchten.- Verdünnen Sie die Konstrukte ab Lager (1 µg/µL) in Opti-MEM Media (0,8 µg des Konstrukts in 50 µL der Opti-MEM Media) und Wirbel. 1 Konstrukt Verdünnung für jedes gut vorbereiten.
Hinweis: Eine 24-Well-Platte erfordert 0,8 µg des Konstrukts in 50 µL der Opti-MEM-Medien. Eine 6-Well-Platte erfordert 2,4 µg des Konstrukts in 150 µL Opti-MEM-Medien. - Verdünnen Sie Liposomen-vermittelte Transfektion Reagenz in Opti-MEM Media (1,5 µL des Transfection Reagens in 50 µL der Opti-MEM Media) und Wirbel. 1 Transfektion Verdünnung für jedes gut vorbereiten.
Hinweis: Eine 24-Well-Platte erfordert 1,5 µL Transfection Reagens in 50 µL der Opti-MEM-Medien. Eine 6-Well-Platte erfordert 4,5 µL Transfection Reagens in 150 µL des Opti-MEM Media. - Bereiten Sie eine 1:1 Mischung (100 µL) des Konstrukts im Opti-Mem Media und Transfection Reagens in Opti-MEM Media und Wirbel. Inkubieren Sie die Mischung bei Raumtemperatur für 20 min.
Hinweis: Pro Bohrloch sollte etwa 100 µL Lösung mit Konstrukt, Transfection Reagens und Opti-MEM Media, wenn mit einer 24-Well-Platte (300 µL für 6-Well-Platte). - Die Hälfte der Medien (500 µL für 24-Well-Platte, 1,5 mL für 6-Well-Platte) aus jedem Brunnen zu entfernen und dieses Medium in einer sauberen konischem Rohr übertragen. Halten Sie diese Röhre im Inkubator. Fügen Sie 100 µL Gemisch (Schritt 2.2.3) die restlichen Medien in den Brunnen. Lassen Sie die Zellen, die bei 37 ° C für 20-30 min inkubieren.
- Während der Inkubation (Schritt 2.2.4) fügen Sie 1 Volumenteil frische Wartung Medien Medien in das konische Rohr (Schritt 2.2.4 hinzu). Legen Sie die Mischung in den selben Inkubator (37 ° C und 5 % CO2).
- Entfernen Sie nach der Inkubation alle Medien, die die Transfektion Lösung aus dem Brunnen zu und ersetzen Sie es mit dem 1:1 Mischung aus alten und frischen Wartung Medien in das konische Rohr (Schritt 2.2.5).
Hinweis: Abhängig von der Größe der Konstrukte können Zellen beginnen mit dem Ausdruck innerhalb von 12 h; für größere Konstrukte können 3-4 Tage erforderlich sein, bevor der Gipfel Ausdruck der Konstrukte erreicht wird.
- Verdünnen Sie die Konstrukte ab Lager (1 µg/µL) in Opti-MEM Media (0,8 µg des Konstrukts in 50 µL der Opti-MEM Media) und Wirbel. 1 Konstrukt Verdünnung für jedes gut vorbereiten.
3. Einrichten der Puffing Pipette Apparat
Hinweis: Es gibt fünf grundlegende Komponenten zu diesem Set-up: die Glaspipette, das Rohr der Spritze, der Mikromanipulator und Puffer (Hank). Puffer, die physiologisch relevante Salzkonzentrationen hat könnte in diesem Set-up verwendet werden.
- Ziehen Sie eine Borosilikat-Pipette, um 45 µm Durchmesser Öffnung Spitze mit einer Mikropipette Puller und die Angaben in Tabelle 3zu haben.
Hinweis: Es wurde festgestellt, dass 45 µm ist eine geeignete Größe für den Durchmesser der Öffnung unter experimentellen Bedingungen Pipette. Geringfügige Abweichungen in der Größe der Öffnung sollte Ergebnisse nicht wesentlich beeinflussen. Es ist wichtig zu beachten, dass größere Abweichungen von dieser Nummer noch arbeiten sollten für Varizen Induktion durch die Höhenverstellung der Spritze, die mit der Pipette über Schläuche verbunden ist, aber dies erfordert eine Rekalibrierung der Druckwert. - Legen Sie die UN zog Ende der Pipette in dünnen Gummischlauch.
Hinweis: Die Schlauch Wand sollte dünn und starre, Flüssigkeitsbeständigkeit, um sicherzustellen, dass die Höhe der Spritze ist direkt proportional zum Druck der Flüssigkeit fließt durch die Pipette mit vernachlässigbaren Widerstand zu minimieren. Der Schlauch sollte nicht mehr als etwa 0,6 m Länge weiter minimieren den Widerstand. - Verbinden Sie das andere Ende des Schlauches auf einen 10-mL-kunststoffspritze über einen Connector mit einem Zug-Lage Ventil.
Hinweis: Die kunststoffspritze muss bei einer Konstanten, messbare Höhe um ein genaues Maß für den angenommenen Druck fließt aus der Pipette zu gewährleisten. Eine Höhe von 190 mm wurde verwendet, da diese sorgt für minimalen Druck sondern zuverlässig Krampfadern in Axone induziert. Anderen Höhenwerte können auch verwendet werden, wenn der Druck dazu führen, die Zellen dass, von dem Deckglas Oberfläche zu lösen. Es wird empfohlen, die gleiche Einstellung während des Experiments zu verwenden. - Legen Sie die Pipette in Schraube oben Mikromanipulator auf die Pipette in Position zu halten. Die Schraube aus Metall, flache gekrönt mit dem Mikromanipulator Arm befestigt, so dass es hält das UN-zog Ende der Pipette oberhalb wo der Gummischlauch befestigt ist. Winkel der Pipette in einem 45°-Winkel mit der Oberfläche der Neuron-haltigen Deckgläsern.
Hinweis: Der Mikromanipulator sollte gebaut werden, so dass die Pipette stattfinden kann, ohne Verengung der Gummischlauch. Der Mikromanipulator darf Bewegung der Pipette in der x-, y- und Z-Richtung, genau innerhalb der Zellbereich zu positionieren. Eine Grafik sowie ein Foto des Geräts erfolgt unter (Abbildung 1). - Schalten Sie ein Fluoreszenz-Filter, öffnen Sie die Blende und sicherzustellen Sie, dass eine fluoreszierende Stelle kommt durch das Ziel gesehen werden kann. Bewegen Sie die Pipette mit dem Mikromanipulator in eine Position, die reiht sich die Spitze mit dem fluoreszierenden Punkt und senken Sie die Pipette in eine Position direkt über die Höhe der Zelle Kulturschale (35 mm x 10 mm). Sobald sie in der Lage ist, das transmittierte Licht schalten Sie ein und schalten Sie Fluoreszenz aus.
- Mit einer Pinzette, einem Deckglas (mit den Zellen nach oben in Richtung der Pipette) aus hinzufügen der Zellplatte Kultur der Zelle Kulturschale mit etwa 2 mL Hanks Puffer bei Raumtemperatur.
- Ort der Kulturschale mit dem Deckglas auf den Anwendungsbereich.
- Mit den feinen fokussierknopf und 20 X Objektiv, konzentrieren Sie sich auf einer Ebene über vier volle Umdrehungen über die Zellen (ca. 0,4 mm). Verwenden Sie der Mikromanipulator, um die PIPETTENSPITZE zu positionieren, so dass es konzentriert und in der Mitte, Links von der Ebene gesehen durch die Okulare.
Hinweis: Dendriten sind Projektionen, die im gleichen Rahmen wie die Zellkörper sein sollten, die, denen Sie stammen. Axonale Krampfadern zu induzieren, sollte man längere Projektionen vom Zellkörper, medialen und distalen Axone folgen.
4. Kalibrierung des Drucks der Pipette eine dehnbare Membran-System nutzen
- Richten Sie der puffing Pipette Apparat mit den exakten gleichen Parametern wie oben beschrieben über ein System mit einer Microfabricated-Silikon-Membran (500 µm im Durchmesser) und 50 µm dick ein und konzentrieren Sie das Mikroskop auf der Oberfläche der Membran zu.
Hinweis: Dieses System wurde entwickelt, um kleine Druckwerte zu messen und eine Erklärung des Systems vor10veröffentlicht wurden. Diese Messung muss nur einmal durchgeführt werden, für Experimente schnaufend, wenn die exaktere gleiche Einstellung der schnaufend verwendet wird. - Konzentrieren Sie das Mikroskop auf die Arrays mikropunkte (4 µm im Durchmesser) und 10 µm auseinander, gemessen zwischen Zentren. Drehen Sie das Absperrventil und Flüssigkeiten Sie fließen aus der Pipette. Die Auslenkung der Membran als Reaktion auf den Flüssigkeitsdruck mit einem konfokalen Mikroskop zu untersuchen.
- Nutzen Sie ein lineares Modell um den entsprechenden Druck verbunden mit Auslenkung der Membran zu bestimmen.
Hinweis: Während einer kürzlich durchgeführten Studie festgestellt, dass eine Durchbiegung w =-3.143 ± 0,69 µm wurde für Spritze Höhe 190 mm erhalten, dies führte zu einen Druck von 0,25 ± 0,06 nN/µm2 aus dem aktuellen Pipette Setup, die innerhalb der physiologischen und pathologischen, allerdings ist die Spritze-Höhe ist nicht der einzige bestimmende Faktor. Andere Faktoren beeinflussen die genaue Druckwert auf die Neuronen, einschließlich Pipette öffnen, Positionierung (Abstand und Winkel) der Pipettenspitze im Vergleich zu den Zellen und auch die Flexibilität der Schlauch4,10.
5. schnaufend um Krampfadern zu induzieren
- Sobald die Pipette in Position ist, konzentrieren Sie sich das Mikroskop auf ein Flugzeug, das eine Zielregion enthält. Positionieren Sie die Zellen und Prozesse in der linken Hälfte des Bildfeld (gesehen von live Aufnahme der Kamera) im Bereich puffing, während die Rechte Hälfte ist außerhalb Bereich schnaufend.
Hinweis: Aufgrund von umfangreichen Auswuchs der Axone und Dendriten der Nervenzellen ist es unwahrscheinlich, dass alle Prozesse eines Neurons im gleichen Bereich und puffing sind. Dies ist tatsächlich ein Vorteil von diesem System, das ermöglicht die Prüfung der die lokale Wirkung der schnaufend. Es gibt zwei Arten von schnaufend, die genutzt werden können, um Krampfadern zu induzieren: lange Dauer schnaufend und Puls schnaufend. -
Schnaufend
- Langer Dauer schnaufend
- Positionieren Sie die Spritze in die Höhe 190 mm über das Deckglas mit kultivierten Neuronen4. Beginnen Sie Time-Lapse Imaging Bereich von Interesse mit einer optimierten Belichtungszeit offenbart klare neuronale Morphologie. Erfassen Sie mindestens 15 Frames in einem 2 s-Intervall (30 s gesamt) als Grundlage. Das Intervall kann anhand des Experiments angepasst werden. Bei Frame 16, öffnen Sie wiederum in der Lage Absperrventil der Spritze und lassen Flüssigkeit für 75 Frames (150 s). Drehen Sie bei Frame 75 das Ventil aus, so dass Flüssigkeit fließen Haltestellen. Videoaufnahme zu stoppen.
Hinweis: Dies sollte axonalen Krampfadern in Neuronen 7-9 DIV innerhalb von 5-10 s, induzieren während ältere Neuronen Form Krampfadern länger dauern.
- Positionieren Sie die Spritze in die Höhe 190 mm über das Deckglas mit kultivierten Neuronen4. Beginnen Sie Time-Lapse Imaging Bereich von Interesse mit einer optimierten Belichtungszeit offenbart klare neuronale Morphologie. Erfassen Sie mindestens 15 Frames in einem 2 s-Intervall (30 s gesamt) als Grundlage. Das Intervall kann anhand des Experiments angepasst werden. Bei Frame 16, öffnen Sie wiederum in der Lage Absperrventil der Spritze und lassen Flüssigkeit für 75 Frames (150 s). Drehen Sie bei Frame 75 das Ventil aus, so dass Flüssigkeit fließen Haltestellen. Videoaufnahme zu stoppen.
- Schnaufend Puls (2 s Dauer)
- Positionieren Sie die Spritze in der richtigen Höhe (190 mm). Time-Lapse Bildgebung beginnen und mindestens 15 Frames zu erfassen (30 s) in einem 2 s-Intervall. Öffnen Sie bei Frame 16 das Ventil der Spritze Flüssigkeit fließen lassen und schließen Sie das Ventil nach 2 S. warten 5-20 s (abhängig von der Frequenz zu prüfenden) vor dem Öffnen des Ventils wieder. Wiederholen Sie öffnen und Schließen des Ventils Fluid Impulse zu schaffen, und fahren Sie für einen Gesamtzeitraum von 150-300 s. weiter Zeitraffer imaging für 20 min, die Erholungsphase zu erfassen.
Hinweis: Wenn das Intervall ist länger als 10 s, die Impulse induzieren drastisch weniger Krampfadern. In einem 20 s-Intervall können keine Krampfadern durch die Impulse-4induziert werden. Um zuverlässige, konsistente Varizen-Bildung zu erhalten, ist es ratsam, die Spritze Höhe sollte ca. 190 mm. Spritze Höhe und Flüssigkeitsdruck sollte nicht erhöht werden, bis zu einem Punkt, wo Zellen beginnen von der Oberfläche Deckglas abnehmen.
- Positionieren Sie die Spritze in der richtigen Höhe (190 mm). Time-Lapse Bildgebung beginnen und mindestens 15 Frames zu erfassen (30 s) in einem 2 s-Intervall. Öffnen Sie bei Frame 16 das Ventil der Spritze Flüssigkeit fließen lassen und schließen Sie das Ventil nach 2 S. warten 5-20 s (abhängig von der Frequenz zu prüfenden) vor dem Öffnen des Ventils wieder. Wiederholen Sie öffnen und Schließen des Ventils Fluid Impulse zu schaffen, und fahren Sie für einen Gesamtzeitraum von 150-300 s. weiter Zeitraffer imaging für 20 min, die Erholungsphase zu erfassen.
- Vor einem Tag voller Einsatz, reinigen die Set-up (Pipette, Schlauch und Spritze) fließt über 10 mL 70 % Ethanol durch das Set-up. Im Anschluss an das Ethanol waschen, 10 mL Hanks Puffer (oder gewünschten Puffer) durch die Einrichtung des Systems für den Einsatz des Tages Prime fließen. Nach der Veredelung Experimente für den Tag, reinigen Sie das Set-up als zuvor beschriebenen mit Ethanol zu verhindern das Wachstum von Schadstoffen über Nacht.
- Langer Dauer schnaufend
(6) Ergänzend zu Methoden
Hinweis: Die puffing Assay kann mit einer Vielzahl von verschiedenen Techniken kombiniert werden, die im Abschnitt Einführung diskutiert werden. Hier ist der Fokus auf den Kern-Techniken, die am häufigsten zusammen mit der puffing Assay, einschließlich hochauflösender Fluoreszenz Timelapse Bildgebung, Kalzium Imaging und Wiederherstellung Assays verwendet werden. Diese werden nachfolgend erläutert.
-
Durchführen Sie hochauflösende fluoreszierende Zeitraffer Bildgebung durch nach dem Protokoll unten
- Verfolgen Sie die Bewegung der eindringmittel getaggt Proteine innerhalb der Neuronen mit 100 X Öl-Objektiv. Neuronen sind mit dem richtigen cDNA-Konstrukt transfiziert. Für 150 Frames erfassen (Gesamt 300 s) mit einem 2 s-Intervall.
Hinweis: Manchmal wird Multiple-Farbe Zeitraffer Bildgebung durchgeführt, um die Bewegung von mehr als einem eindringmittel getaggt Protein gleichzeitig Bild. - Generieren Sie eine Glomeruli durch die Video-Aufnahme-Software oder durch ImageJ (NIH).
Hinweis: Die Geschwindigkeit und die Richtwirkung des Reisens können bestimmt werden mit Hilfe der Glomeruli. * Sicher festzustellen, die Richtung die Soma aus der Region liegt erfasst. Reisen in Richtung der Soma ist rückläufig, während Reisen abseits der Soma in der axonalen Spitze Anterograde. - Wiederholen Sie diesen Prozess nach puffing, oder ein Glomeruli mit der Bilderfassung während des puffing Tests erstellt werden kann.
Hinweis: Die Auswirkungen der schnaufend auf axonalen Transport von Mitochondrien und synaptischen Proteine wurden in einem aktuellen Papier4gezeigt.
- Verfolgen Sie die Bewegung der eindringmittel getaggt Proteine innerhalb der Neuronen mit 100 X Öl-Objektiv. Neuronen sind mit dem richtigen cDNA-Konstrukt transfiziert. Für 150 Frames erfassen (Gesamt 300 s) mit einem 2 s-Intervall.
-
Calcium imaging
- Fügen Sie 1 µL (für ein 24-Well-Platte) oder 3 µL (für eine 6-Well-Platte) von 5 mM Fluo-4 Uhr zur Kultur Medien in einem gut und bei 37 ° C für 30 min inkubieren.
- Waschen Sie die Zellen zweimal mit 1 mL Hank Puffer.
Hinweis: Geladene Neuronen emittieren grün fluoreszieren durch einen FITC-Filter-Set. Loci bezeichnen Regionen spürbar Kalzium in der Zelle. In Kombination mit schnaufend kann eine Zunahme der Intensität (Anstieg der internen Kalziumspiegel) gesehen werden.
-
Varizen-Erholung
Hinweis: Unmittelbar nach einem puffing Experiment kann eine 20 min Erholung Experiment durchgeführt werden.- Aufnahmen für 300 Frames (1.200 s) mit einem 4 s-Intervall.
Hinweis: Eine Zelle mit löslichen YFP/mCherry/GFP transfiziert sollte zeigen mäßigen Lautstärke (weniger als 50 %) der Erholung bis zum Jahresende die imaging-Sitzung. Axonalen Erholung hängt von einer Reihe von Faktoren, wie z. B. vom Entwicklungsstadium der kultivierten Neuronen4. Dies kann auch mit hochauflösenden Fluoreszenz-Bildgebung und Kalzium Imaging oben beschriebenen kombiniert werden.
- Aufnahmen für 300 Frames (1.200 s) mit einem 4 s-Intervall.
Ergebnisse
Vor schnaufend, zeigen Axone normalerweise kleine Varizen-Bildung. Folgenden schnaufend mit unseren Normdruck (190 MmH2O Höhe), die Axone Start viele Perlen-wie Krampfadern entwickeln. Die Bildung von Krampfadern ist teilweise reversibel, dargestellt durch Regionen des Axons Rückkehr in ihre bereits aufgeblasen Zustand nach einer 10 Minuten Erholungszeit (Abbildung 2A-B). Nach längerer Zeit der Erholung (> 20 min), einige Axone vollständig zu erholen. Suboptimale Positionierung der puffing Pipette sowie die genaue Positionierung der Spritze bei 190 mm über der Bühne kann nicht Krampfadern schnell generieren. Optimale Bedingungen sollten Varizen-Bildung in den Axonen von jungen Neuronen (rund 7 DIV) in ca. 5 s4führen.

Abbildung 1 : Schaltplan und Foto von schnaufend Apparat. (A) Fotos, auf denen insgesamt Mikroskop-Set-up. (B) Apparat zeigt die Glaspipette schnaufend von der Mikromanipulator gehalten und mit dem Gummischlauch verbunden. (C) Phase Kontrast Bilder mit Fokus auf Ebene der primären hippocampal Neuronen, die Schatten der Pipette in unten rechts zeigen. (D) aus der Zelle Flugzeug schnaufend PIPETTENSPITZE im Mittelpunkt. (E) schematische Darstellung der Entfernungen und berechnete Druck zur Induktion von Krampfadern. Maßstabsleiste = 50 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
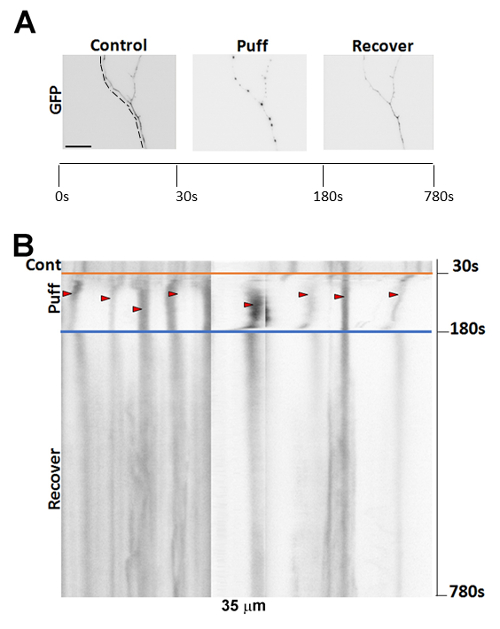
Abbildung 2 : Repräsentative Bilder von Varizen-Bildung nach schnaufend. (A) Darstellung der 7DIV, GFP transfiziert Maus hippocampal Neuronen zeigt einem Axon Pre- und Post-schnaufend sowie nach einer 10 Minuten Erholungszeit. (B) Glomeruli der Zeitraffer Bildgebung Neurons in (A). Rote Pfeile zeigen die Krampfadern, die nach 150 gebildet haben s 190 MmH2O schnaufend (ab 30 s). Maßstabsleiste = 15 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Deckglas Beschichtungslösung | |
| 780 ΜL | Essigsäure acid17 mM Lager: 50 µL Essigsäure in 50 mL H2O |
| 200 ΜL | Poly-D-Lysin (0,5 mg/mL Brühe) |
| 20 ΜL | Ratte Schweif Kollagen (3 mg/mL Brühe) |
| Das Gesamtvolumen wird bestimmt anhand der Anzahl von Deckgläsern, beschichtet werden. | |
Tabelle 1: Deckglas Beschichtungslösung. Liefert das Rezept für die Zubereitung von dem Deckglas Beschichtungslösung verwendet, um kultivierten Zellen zu den Deckgläsern haften.
| 1 X Scheibe Dissektion Lösung (SLDS) gefiltert, pH = 7,4, Shop bei 4 ° C | |
| 1 L | DdH2O |
| 82 mM | Na2SO4 |
| 30 mM | K2SO4 |
| 10 mM | HEPES (freie Säure) |
| 10 mM | D-glucose |
| 5 mM | MgCl2 |
| 0,00 % | Phenol Red (optional) |
| Beschichtung von Medien (PM, filter, Lagerung bei 4 ° C) | |
| 439 mL | MEM Earle Salze |
| 50 mL | FBS |
| 11,25 mL | 20 % D-Glucose |
| 5 mL | Natrium-Pyruvat (100 mM) |
| 62,5 ΜL | L-Glutamin (200 mM) |
| 5 mL | Penicillin/Streptomycin (P/S, 100 X) |
| Wartung-Medien (MM, filter, Lagerung bei 4 ° C) | |
| 484 mL | Neurobasal |
| 10 mL | B27 50 X Ergänzung |
| 1,25 mL | L-Glutamin (200 mM) |
| 5 mL | 100 x P/S |
| Alle Lösungen sind mit einem Filter mit 0,2 mm Porengröße sterilisiert. | |
Tabelle 2: Handy-Nährmedien Rezepte. Bietet Rezepte für die Zubereitung von Medien in der Kultivierung der primären hippocampal Neuron Zellen genutzt.
| Hanks Puffer (Filter, pH = 7,4, bei 4° C | |
| 150 mM | NaCl |
| 4 mM | KCl |
| 1,2 mM | MgCl2 |
| 1 mM | CaCl2 |
| 10 mg/mL | D-glucose |
| 20 mM | HEPES |
Tabelle 3: Hanks Puffer Rezept. Liefert das Rezept für die Zubereitung des Puffers im puffing Protokoll und während live Cell Imaging genutzt.
| Pipette ziehen Parameter | |||||
| Wärme | Ziehen Sie | Geschwindigkeit | Verzögerung | Druck | Rampe |
| 501 | 0 | 15 | 1 | 500 | 530 |
Tabelle 4: Pipette ziehen Parameter. Stellt die Parameter auf die Pipette Puller eingerichtet werden, um eine Öffnung zu erhalten, die rund 45 µm im Durchmesser ist.
Diskussion
Das Verfahren des Microbiomechanical Assays ist geradlinig. Es werden zuverlässige Ergebnisse produzieren, wenn alle seine Schritte sorgfältig durchgeführt werden. Es gibt mehrere wichtige Schritte, die, wenn nicht ordnungsgemäß durchgeführt, erfolgreiche Datenerfassung behindern. Die entscheidenden Schritte beginnen oberhalb der tatsächlichen Anwendung des puffing Stimulus. Sorgfältige Dissektion, Kultivierung und Pflege der primäre Neuron Kultur im Vordergrund stehen. Wenn die kultivierten Neuronen nicht gesund sind, reagiert sie nicht konsequent, da sie bereits für Stress wurde grundiert werden könnte. Stromabwärts von der Kultur, die Ersteinrichtung und Kalibrierung des puffing Apparates zu gleichbleibenden Druck, die Krampfadern zu induzieren, aber wird nicht dazu führen, dass Loslösung der Zellen von der Oberfläche des Deckglases, mit Geduld durchgeführt werden muss. Genaue Kalibrierung des Set-up dauert 1 h aufgrund Pipette verstopfen, Rohr oder Ventil Probleme. Es ist wichtig, um sicherzustellen, dass die Flüssigkeit fließt aus der Pipette mit minimalem Widerstand vor voran mit Platzierung der Zellen in der Schale und Positionierung der Pipettenspitze. Änderungen am Setup angeht, kann ein paar der puffing Apparat mit Perfusion, Patch zu spannen, und ein anderes Mikroskop-basierten Instrument, meist abhängig von den physischen Raum kostenlos auf den Seiten des Mikroskops.
Dieses System hat zwei immanente Grenzen, die Aufmerksamkeit erfordern. Das Setup kann konsequent die Bildung von reversiblen Krampfadern in Axone der kultivierten hippocampal Neuronen durch puffing Flüssigkeit um die Zellen einleiten. Es ist jedoch wichtig zu beachten, dass die genaue Druckwerte auf die Neuronen innerhalb der gleichen puffing Feld nicht identisch sind. Der Flüssigkeitsdruck, der Auswirkungen auf der Zellen, berechnet je nach Last Druckmessung aus Microfabricated Silikon Membran4,10, stellt den durchschnittlichen Druck in der Mitte des Feldes puffing. So ist der genaue puffing Druck am höchsten in der Mitte des Feldes puffing und die niedrigsten um den Rand des Feldes. Wir haben gezeigt, dass der Druck Kraft korreliert mit dem einsetzen, die Größe und die Anzahl der Krampfadern4induziert. Höherer Druck führte zu schneller Beginn, größer, und häufiger Krampfadern4. Unsere jüngsten Studien verwendeten wir einen minimalen Druck (190 MmHg an der Spitze der puffing Pipette), der nach wie vor zuverlässig Krampfadern in den meisten Axone4induzieren kann. Unter dieser Bedingung Varizen auftreten für junge Neuronen ist normalerweise etwa 5 s. Es ist wichtig zu beachten, dass mit der exakt gleichen schnaufend System, der Wert der Beginn-Zeit variieren kann, die nicht nur neuronale Typ, Alter und subzelluläre Fach abhängig, sondern können auch durch die Position des Neurons im Feld puffing beeinflusst werden. Trotz der Variation der puffing Druck von Neuronen empfangen diesem Testsystem noch bietet ein zuverlässiges Mittel für mechanische Einwirkungen auf die zentralen Neuronen zu studieren und sehr konsistent und reproduzierbaren experimentellen Ergebnissen.
Die zweite Einschränkung des Systems ist die Verstopfung Problem. Um physiologisch relevanten Druck zu erreichen, ist die Eröffnung der Pipetten klein, etwa 45 μm. Aber die kleine Öffnung tendenziell mit Schutt aus dem Kunststoffschlauch verstopfen und die Trümmer in der Pipettenspitze ist deutlich unter die Lupe genommen. Dies erhöht die Menge an Zeit, die Vorbereitung der Aufstellung im Falle einer Pipette verstopfen. Alle Lösungen sind daher sorgfältig gefiltert, bevor in der Spritze, Schläuche und Pipette umgesetzt. Es ist auch wichtig, die puffing System mit 70 % Ethanol zu Beginn und Ende des Tages, gefolgt von waschen mit gefilterten Hank Puffer zu waschen. Um das mögliche Verstopfung Problem zu lösen, empfiehlt es sich, mehrere Pipetten zu ziehen versuchen. Es ist wichtig zu bestätigen, dass die Lösung tatsächlich aus der Pipette durch Visualisierung vor Beginn der Experimente aufgeblasen ist. Sobald ein gutes puffing System eingerichtet ist, kann es dauern in der Regel für den Rest des Tages.
Diese biomechanischen Assay, kombiniert mit Neuron Kultur stellt eine einzigartige Gelegenheit für zentrale Neuron Mechanosensation imitiert physiologische und/oder pathophysiologische Bedingungen zu studieren. Dieses System ermöglicht es uns, die Auswirkungen von Kompression und Scheren auf die Nervenzellen zu untersuchen. Im Gegensatz dazu wurden andere Systeme verwendet, um in der Ebene Strecken5,6,7untersuchen. Der durchschnittliche Druck durch die Neuronen in der Mitte der puffing Bereiche eingegangen ist 0,25 ± 0,06 nN/µm2 in unser System4. Dieser Druck auf Zellen ist vergleichbar mit der Elastizitätsmodul der hippocampal Neuronen gemessen unter Verwendung zuvor Scan Kraft-Mikroskopie und Bulk Rheologie, um optisch induzierte Verformung13,14, zu identifizieren sowie Druck verwendet, um das Wachstum von Neuriten Vorderkanten in-vitro- gemessen durch Scannen verändern zwingen Mikroskopie (0,27 ± 0,04 nN/µm2)16. Dieser Druck überschreitet nicht den Druck, der natürlich von mesenchymalen Zellen im Embryo E11 erzeugt werden können, wie mit mechanisch bestimmte fluoreszierende Zelle Größe Öl Microdroplets (1,6 ± 0,8 nN/µm)2,14gemessen.
Dieses System wurde bereits erfolgreich in Kombination mit Kalzium Imaging, Patch spannen, elektronisches Mikroskop und zelluläre Analyse eines geschlossenen Schädel mTBI Maus Modell4eingesetzt. Der Test kann auch in Kombination mit Mikroskop-basierten Experimente wie Fluoreszenz Erholung nach Immunofluoreszenz (FRAP), verwendet werden, Protein Turn-Over in Krampfadern zu untersuchen, als auch ÄRGERN um zu studieren, wenn Protein-Protein-Interaktionen verändert werden bei Varizen-Bildung. Im Prinzip jede Methode, die getan werden kann mit einem Mikroskop und eine live Cell imaging-Setup kann mit dieser puffing Assay kombiniert werden. Die Vielseitigkeit dieser Assay ist sehr wertvoll bei der Untersuchung der molekularen Mechanismen, die verschiedene Effekte auf neuronale Morphologie und Funktionen durch mikromechanische Stress.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Alle Tierversuche wurden in Übereinstimmung mit den nationalen Institute der Gesundheit Tier Verwendung Richtlinien durchgeführt. Diese Arbeit wurde zum Teil durch Zuschüsse aus dem National Institutes of Health (R01NS093073 und R21AA024873), C. Gu unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Warner Instruments | 64-0702 | for 24-well plate |
| 25 mm coverslips | Fisher Scientific | 12-545-102 | for 6-well plate |
| Acetic acid | Fisher Scientific | A38-212 | |
| Poly-D-lysine | Sigma | P6407 | |
| Rat tail collagen | Roche | 11 179 179 001 | |
| 10X PBS | National Diagnostics | CL-253 | |
| Na2SO4 | Fisher Scientific | S373-500 | |
| K2SO4 | Fisher Scientific | P304-500 | |
| HEPES | Fisher Scientific | BP410-500 | |
| D-glucose | Fisher Scientific | D16-500 | |
| MgCl2 | Fisher Scientific | BP214-500 | |
| NaOH | Fisher Scientific | SS255-1 | |
| Protease enzyme | Sigma | P4032 | |
| FBS | Gibco | 26140 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| L-glutamine | Gibco | 25030081 | |
| Penicillin/Streptomycin 100x (P/S) | Gibco | 15140122 | |
| MEM Earle's Salts | Gibco | 11090 | |
| B27 supplement | Gibco | 17504-044 | |
| Neurobasal | Gibco | 21103-049 | |
| Arabinosylcytosine (Ara-C) | Sigma | 147-94-4 | |
| Opti-MEM media | Gibco | 31985-070 | |
| Lipofectamine 2000 | Invitrogen | 1854313 | transfection reagent |
| Borosilicate rods | World Precision Instruments Inc. | PG52151-4 | for puffing pipette |
| rubber tubing | Fisher Scientific | 14-169-1A | |
| 10cc plastic syringe and plunger | Becton Dickinson | ||
| micromanipulator | Sutter Instruments | ||
| NaCl | Fisher Scientific | S640-3 | |
| KCl | Fisher Scientific | BP366-500 | |
| CaCl2 | Fisher Scientific | C70-500 | |
| Cell culture dish (35 mm x 10 mm) | Corning | 3294 | |
| Fluo-4 AM | Molecular Probes | F14201 | for calcium imaging |
| Mito-YFP construct | Takara Bio Inc. | for cell transfection | |
| YFP-N1 construct | Takara Bio Inc. | for cell transfection | |
| Model P-1000 Flaming/Brown Micropipette puller | Sutter Instruments | ||
| Eclipse TE2000-U Mcroscope | Nikon | ||
| Plan Fluor ELWD 20x lens | Nikon | 062933 | objective |
| Apo TIRF 100x/1.49 oil lens | Nikon | MRD01991 | objective |
Referenzen
- Nikić, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 17, 495-499 (2011).
- Yang, J., et al. Regulation of axon degeneration after injury and in development by the endogenous calpain inhibitor calpastatin. Neuron. 80 (5), 1175-1189 (2013).
- Debanne, D. Information processing in the axon. Nat. Rev. Neurosci. 5, 304-316 (2004).
- Gu, Y., Jukkola, P., Wang, Q., Esparza, T., Zhao, Y., Brody, D., Gu, C. Polarity of varicosity initiation in central neuron mechanosensation. J Cell Biol. 216 (7), 2179-2199 (2017).
- Chung, R. S., et al. Mild axonal stretch injury in vitro induces a progressive series of neurofilament alterations ultimately leading to delayed axotomy. J. Neurotrauma. 22 (10), 1081-1091 (2005).
- Staal, J. A., Dickson, T. C., Chung, R. S., Vickers, J. C. Cyclosporin-A treatment attenuates delayed cytoskeletal alterations and secondary axotomy following mild axonal stretch injury. Dev. Neurobiol. 67 (14), 1831-1842 (2007).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Exp. Neurol. 233 (1), 364-372 (2012).
- Donkin, J. J., Vink, R. Mechanisms of cerebral edema in traumatic brain injury: therapeutic developments. Curr Opin Neurol. 23 (3), 293-299 (2010).
- Gardner, A., Jukkola, P., Gu, C. Myelination of rodent hippocampal neurons in culture. Nat Protoc. 7 (10), 1774-1782 (2012).
- Wang, Q., Zhang, X., Zhao, Y. Micromechanical stimulator for localized cell loading: fabrication and strain analysis. J. Micromech. Microeng. 23, 015002 (2013).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc. Natl. Acad. Sci. USA. 103 (47), 17759-17764 (2006).
- Elkin, B. S., Azeloglu, E. U., Costa, K. D., Morrison, B. Mechanical heterogeneity of the rat hippocampus measured by atomic force microscope indentation. J. Neurotrauma. 24 (5), 812-822 (2007).
- Franze, K., et al. Neurite branch retraction is caused by a threshold-dependent mechanical impact. Biophys. J. 97 (7), 1883-1890 (2009).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nat. Methods. 11 (2), 183-189 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten