Method Article
Un sistema di Microbiomechanical per lo studio della formazione del Varicosity e del recupero in centrale del neurone assoni
In questo articolo
Riepilogo
Questo protocollo descrive un approccio fluido pressurizzato, fisiologicamente rilevante per induzione rapida e reversibile di varicosità in neuroni.
Abstract
Varicosities axonal sono allargate strutture lungo i fasci di assoni con un elevato grado di eterogeneità. Sono presenti non solo nei cervelli con malattie neurodegenerative o lesioni, ma anche nel cervello normale. Qui, descriviamo un sistema di nuova costituzione micromeccanici per in modo rapido, affidabile ed reversibilmente indurre varicosities axonal, permettendoci di comprendere i meccanismi che regolano la formazione del varicosity e la proteina eterogenea composizione. Questo sistema rappresenta un mezzo romanzo per valutare gli effetti dello sforzo di compressione e taglio su diversi compartimenti cellulari dei neuroni, diversi da altri sistemi in vitro che si concentrano principalmente sull'effetto di stretching. Cosa importante, a causa delle caratteristiche uniche del nostro sistema, abbiamo recentemente effettuato una scoperta di nuovi risultati che l'applicazione del fluido pressurizzato può indurre rapidamente e reversibilmente varicosities axonal attraverso l'attivazione di un canale potenziale transitorio del ricevitore. Il nostro sistema biomeccanico può essere utilizzato comodamente in combinazione con aspersione di droga, live cell imaging, imaging del calcio e registrazione di patch clamp. Pertanto, questo metodo può essere adottato per lo studio di canali ionici meccanosensibili, regolamento di trasporto assonale, dinamica del citoscheletro assonale, segnalazione calcio e cambiamenti morfologici correlati a traumatico cranico.
Introduzione
Formazione del varicosity, o gonfiore/bordatura, lungo gli assoni, è una caratteristica prominente di neurodegenerazione osservata in molti disturbi o lesioni del sistema nervoso centrale, tra cui la sclerosi multipla, morbo di Alzheimer, morbo di Parkinson e traumatica brain injury1,2. Nonostante gli impatti fisiologici significativi dei varicosities axonal sulla propagazione del potenziale d'azione e trasmissione sinaptica3, come vengono generati i varicosities rimane sconosciuto. Recentemente, usando un'analisi di nuova costituzione microbiomechanical su colture di neuroni ippocampali da roditori, abbiamo trovato che stimoli meccanici possono indurre varicosità in questi neuroni con altamente interessanti caratteristiche. In primo luogo, l'induzione del varicosity è rapida (< 10 s) e questo processo è reversibile in modo imprevisto. In secondo luogo, l'inizio del varicosity dipende dalla forza sbuffando pressione: maggiore è la pressione, più veloce all'avvio. In terzo luogo, l'inizio del varicosity dipende dall'età neuronale. Gli assoni dei neuroni più giovani appaiono più reattivi alle sollecitazioni meccaniche, rispetto a quelle dei neuroni più anziani. In quarto luogo, il modulo di varicosità lungo gli assoni dei neuroni ippocampali, mentre i segmenti di assone iniziale di questi neuroni e dendriti non visualizzare nessun cambiamento nella stessa circostanza puffing. Così, il nostro studio ha rivelato una caratteristica novella di polarità di un neurone. Questi risultati con il sistema in vitro sono fisiologicamente rilevanti. Utilizzando un modello in vivo per trauma cranico lieve (mTBI), abbiamo mostrato che varicosities axonal sviluppato in modo multi-focale nella corteccia somatosensoriale dei topi immediatamente dopo l'impatto di Chiudi-cranio, coerenza con il nostro in vitro Risultati4. È importante notare che la nostra colorazione e imaging dei topi mTBI forniscono solo un'istantanea di un neurone cambiamenti morfologici, da eseguire in vivo imaging time-lapse della morfologia neuronale durante un impatto meccanico è ancora non è fattibile.
Questo sistema fluido-sbuffando ci ha permesso non solo di catturare caratteristiche uniche associate alla formazione di varici indotta da stress meccanico, ma anche per determinare il meccanismo di fondo. Provando diverse soluzioni extracellulare, bloccanti e apribottiglie di diversi candidati di canali ionici mechanosensitive ed elettrofisiologia cellulare, abbiamo identificato che il catione potenziale transitorio del ricevitore canale membro subfamily V 4 (TRPV4) canale che è permeabile per Ca2 + e Na+ e attivato da sbuffando è principalmente responsabile per la rilevazione iniziale stress meccanico durante la formazione di varici axonal4. Questo è stato ulteriormente confermato con un approccio di knockout di siRNA. Presi insieme, questo nuovo sistema di dosaggio che abbiamo sviluppato con la cultura di Neurone ippocampale, è altamente utile per studiare le proprietà di micromeccanica dei neuroni centrali, specialmente in combinazione con altre tecniche.
Questo sistema di micromeccanica che abbiamo stabilito è unico e si differenzia dai sistemi già esistenti in diversi aspetti importanti. In primo luogo, in questo sistema, i neuroni esperienza fuori del piano sollecitazioni meccaniche nelle forme di compressione e taglio. Durante l'impatto meccanico, processi neuronali rimangono attaccati alla superficie del vetrino coprioggetto e non si muovono. Questo è diverso da altri sistemi che si occupa principalmente di flessione e stretching in piano sperimentale (o tensione), per esempio, la deflessione degli assoni in bundle come stringhe5,6 in movimento o stretching assoni coltivati su bioerodibili canali e membrane estensibile7,8. Inoltre, sebbene varicosities axonal possono anche essere indotti questi saggi come nel nostro sistema fluido-sbuffando, il processo in queste impostazioni richiede molto più tempo (da 10 minuti a parecchie ore6,7,8) e viene visualizzato irreversibile. Infine, il nostro sistema utilizzando sbuffando fluido locale consente l'esame delle caratteristiche spaziali della formazione del varicosity (ad es., dendriti, spine dendritiche, soma, axonal segmenti iniziali e terminali axonal), oltre alle sue caratteristiche temporali. Utilizzando questo sistema, abbiamo scoperto diverse caratteristiche inaspettate e unici di formazione del varicosity assonale, particolarmente rapida insorgenza, lenta reversibilità e polarità di assone-dendrite.
Il sistema che discutiamo in questa carta è compatibile con molte tecniche di molecolare e biologia cellulare. Per esempio, per studiare gli effetti dello stress meccanico sulla morfologia neuronale e funzione, può essere utilizzato insieme a coculture di mielina, time-lapse di imaging di fluorescenza di riflessione interna totale (TIRF) e di trasferimento di energia di risonanza fluorescente (FRET) formazione immagine del calcio e registrazione di patch clamp. In questa carta, ci concentriamo sui componenti di base del sistema. Cultura di neuroni ippocampali, il fluido-sbuffando installazione, imaging ad alta risoluzione time-lapse per trasporto assonale e calcio imaging sono illustrate passo passo qui di seguito.
Protocollo
Tutti i metodi descritti di seguito sono stati approvati dal istituzionale Animal Care e uso Committee (IACUC) della Ohio State University.
1. preparazione vetrino coprioggetto
- Inserire una o più caselle di lamelle di 12 mm o 25 mm in un becher di vetro contenente acido nitrico al 70% e incubare i vetrini coprioggetti a temperatura ambiente per una notte.
Nota: Non lavare i coprioggetti 25mm nel becher stesso come le lamelle di 12 mm. Si consiglia di lavarli separatamente. - Trasferire tutti i vetrini coprioggetti in un becher di 4L riempito con 2,5 L di ddH2O e scuotere il becher contenente i coprioggetti per 1 h a 100 giri/min. Utilizzare elastici per tenere il recipiente durante l'agitazione. Ripetere il risciacquo con fresca 2,5 L ddH2O quattro volte.
- Trasferire coprioggetti puliti in un pallone asciutto con un coperchio metallico. Cuocere i coprioggetti in un forno a 225 ° C per 6 h e lasciarli raffreddare a temperatura ambiente.
Nota: Il coprioggetto di 25 mm è incline alla rottura. Separare coprioggetti uno per uno e lasciare asciugare all'aria, quindi cuocere in un forno. - Memorizzare i coprioggetti puliti e secchi a temperatura ambiente in un contenitore di plastica sterile fino all'utilizzo.
-
Rivestire i coprioggetti come segue:
- Preparare la soluzione di rivestimento fresco in una provetta da centrifuga.
- Inserire ogni vetrino coprioggetti in un pozzetto di una piastra a 24 pozzetti (o 6 pozzetti). Mettere 30 (o 100) µ l di soluzione di rivestimento vetrino coprioggetti (tabella 1) su un vetrino coprioggetti 12 mm (o 25 mm) e ricciolo. Aggiungere 1 mL di soluzione fisiologica sterile di tampone fosfato (PBS, grado di coltura del tessuto). Queste piastre possono essere utilizzate immediatamente o conservate a 4 ° C in PBS sterile per fino ad una settimana.
- Il giorno della dissezione, rimuovere il PBS. Asciugare all'aria e posizionare le piastre di luce UV (30W) per 2-4 h.
Nota: L'ultimo passo deve essere completata con la luce UV in cappa a flusso laminare di cultura cellulare. La porta della cappa deve essere alzata leggermente per consentire il flusso d'aria per asciugare i vetrini coprioggetti.
2. dissezione, la dissociazione e la cultura dei neuroni Hippocampal da Mouse/ratto incinto
-
La dissezione e la dissociazione dei neuroni ippocampali per cultura
- Scongelare la soluzione di proteasi enzimi (proteasi 3mg/mL 23 in domini, tabella 1) e pre-riscaldare placcatura media (tabella 2) a 37 ° C.
- Sezionare ippocampo e sciacquare con domini, secondo i metodi descritti nella precedente pubblicazione14.
Nota: Quattro ippocampi forniscono abbastanza cellule per un 24 pozzetti o una piastra a 6 pozzetti. - Rimuovere domini, aggiungere 2 mL di soluzione degli enzimi proteasi e incubare il campione a 37 ° C, 5% CO2 per 15 min.
- Lavare due volte l'espianti di ippocampo con 5-10 mL di terreno di placcatura. Aggiungere 5 mL di mezzo di placcatura. Dissociare hippocampal espianti in singole celle generando un piccolo vortice utilizzando una pipetta con una punta di plastica di 1 mL. Pipettare su e giù circa 40 volte, evitando la formazione di bolle di ossigeno, fino a quando la soluzione diventa torbida e non rimangano grandi pezzi di espianto.
Nota: Ricordarsi di lasciare alcuni media durante i lavaggi, gli espianti hippocampal dovrebbero rimanere sommersi nel medium durante l'intero processo. - Centrifugare le cellule a 1.125 x g per 3 minuti rimuovere il surnatante con le cellule sommerse nei media. Risospendere le cellule in 145 mL di placcatura media. Aggiungere 1 mL/pozzetto della sospensione delle cellule a una piastra a 24 pozzetti (3 mL/pozzetto di una piastra a 6 pozzetti).
Nota: 145 mL di placcatura media viene utilizzato per produrre una sospensione cellulare che ha una densità bassa delle cellule. Questo volume vi permetterà la placcatura delle cellule in piastre da 24 pozzetti sei, otto piastre da 6 pozzetti o varie combinazioni di 24 o 6-pozzetti a seconda gli esperimenti da effettuare. Ciascun pozzetto della piastra 24 pozzetti avrà circa 3 x 104 celle9. - Incubare le cellule nei media placcatura a 37 ° C, 5% CO2 per 2-4 h, quindi rimuovere tutti i supporti di placcatura e sostituirlo con mezzi di manutenzione fresco.
- Dopo 2 giorni (2 giorni in vitro, 2DIV), sostituire la metà dei media con 2 µM Ara-C (arabinosilcitosina) dissolto in mezzi di manutenzione che inibisce la crescita delle fibroblasti, cellule endoteliali e gliali. Dopo aver esposto le cellule di Ara-C per due giorni, è necessario sostituire il supporto con mezzi di manutenzione fresco.
-
Transfezione per la visualizzazione della morfologia delle cellule
Nota: Transfect le cellule con costrutti di fluorescente di proteina fluorescente proteina fluorescente verde (GFP), giallo (YFP), mCherry, ecc per illuminare la morfologia dei singoli neuroni.- Diluire i costrutti a magazzino (1 µ g / µ l) in media Opti-MEM (0,8 µ g del costrutto in 50 µ l di media Opti-MEM) e vortex. Preparare 1 costrutto diluizione per ciascun pozzetto.
Nota: Una piastra a 24 pozzetti richiede 0,8 µ g di costrutto in 50 µ l di media Opti-MEM. Una piastra a 6 pozzetti richiede 2,4 µ g di costrutto nei mezzi di comunicazione di 150 µ l Opti-MEM. - Diluire reagente di transfezione liposoma-mediata in media Opti-MEM (1,5 µ l del reagente di transfezione in 50 µ l di media Opti-MEM) e vortex. Preparare 1 diluizione di transfezione per ciascun pozzetto.
Nota: Una piastra a 24 pozzetti richiede 1,5 µ l di reagente di transfezione in 50 µ l di media Opti-MEM. Una piastra a 6 pozzetti richiede 4,5 µ l di reagente di transfezione in 150 µ l di media Opti-MEM. - Preparare una miscela 1:1 (100 µ l) del costrutto nel reattivo di media e transfezione di Opti-Mem in media Opti-MEM e vortice. Incubare la miscela a temperatura ambiente per 20 min.
Nota: Per pozzetto, ci dovrebbe essere circa 100 µ l di soluzione contenente costrutto, reagente di transfezione e Opti-MEM media se si utilizza una piastra a 24 pozzetti (300 µ l per piastra a 6 pozzetti). - Rimuovere la metà dei media (500 µ l per piastra a 24 pozzetti, 1,5 mL per piastra a 6 pozzetti) da ciascun pozzetto e trasferire questo file multimediali in una provetta pulita. Mantenere questo tubo nell'incubatrice. Quindi aggiungere la miscela di 100 µ l (punto 2.2.3) ai media rimanenti nel pozzo. Permettono alle cellule di incubare a 37 ° C per 20-30 min.
- Durante l'incubazione (punto 2.2.4), aggiungere un volume di mezzi di manutenzione fresco ai media in tubo conico (punto 2.2.4). Mettere il composto in incubatrice stessa (37 ° C e 5% CO2).
- Dopo l'incubazione, rimuovere tutti i supporti contenenti la soluzione di transfezione dai pozzetti e sostituirlo con la miscela di 1:1 di vecchi e mezzi di manutenzione fresco nel tubo conico (passo 2.2.5).
Nota: A seconda delle dimensioni dei costrutti, cellule possono iniziare esprimendo entro 12 h; per i costrutti più grandi, possono essere necessari 3-4 giorni prima che venga raggiunto l'espressione di picco dei costrutti.
- Diluire i costrutti a magazzino (1 µ g / µ l) in media Opti-MEM (0,8 µ g del costrutto in 50 µ l di media Opti-MEM) e vortex. Preparare 1 costrutto diluizione per ciascun pozzetto.
3. configurazione dell'apparato di pipetta Puffing
Nota: Ci sono cinque componenti di base di questo set-up: la pipetta di vetro, la tubazione, la siringa, il micromanipolatore e il buffer (Hank). Qualsiasi buffer che è fisiologicamente rilevanti concentrazioni saline potrebbe essere utilizzato in questo set-up.
- Tirare una pipetta di borosilicato ad avere intorno 45-µm di diametro apertura punta utilizzando un estrattore micropipetta e le specifiche nella tabella 3.
Nota: È stato trovato che 45 µm è un formato adatto per il diametro della pipetta di apertura in condizioni sperimentali. Lievi variazioni delle dimensioni di apertura non influiscono significativamente risultati. È importante notare che più grandi partenze da questo numero dovrebbero funzionare per induzione di varice regolando l'altezza della siringa collegata alla pipetta tramite tubi, ma questo richiederà la ricalibrazione del valore della pressione. - Inserire l'estremità non-tirato della pipetta nella tubazione di gomma sottile.
Nota: La parete della tubazione deve essere sottile e rigido per ridurre al minimo la resistenza del liquido, assicurando che l'altezza della siringa è direttamente proporzionale alla pressione del fluido che scorre attraverso la pipetta con resistenza trascurabile. Il tubo dovrebbe essere non più di circa 0,6 m di lunghezza ulteriormente ridurre al minimo la resistenza. - Collegare l'altra estremità del tubo ad una siringa di plastica 10 mL attraverso un connettore con una valvola in grado di girare.
Nota: La siringa di plastica deve essere tenuto ad un'altezza costante, misurabile per garantire una misura accurata per la presunta pressione che scorre dalla pipetta. Un'altezza di 190 mm è stata utilizzata, poiché questo fornisce una pressione minima ma induce varicosities negli assoni. Altri valori di altezza possono essere utilizzati anche se la pressione indurre le cellule a staccare dalla superficie del vetrino coprioggetti. Si consiglia di utilizzare la stessa impostazione in tutto l'esperimento. - Inserire la pipetta nella parte superiore della vite di micromanipolatore per tenere la pipetta in posizione. Avvitare la vite sormontata da metallo, piatta, collegata al braccio micromanipolatore in modo che essa detiene la fine delle Nazioni Unite-tirata della pipetta appena sopra cui è collegato il tubo di gomma. Angolo della pipetta ad un angolo di 45° con la superficie del neurone-contenente lamelle.
Nota: Il micromanipolatore dovrebbe essere costruito in modo che la pipetta può essere tenuta senza comprimere il tubo di gomma. Il micromanipolatore deve consentire il movimento della pipetta in x, y e z Posizionare con precisione all'interno di gamma delle cellule. Un elemento grafico, nonché una fotografia dell'apparato è fornito qui sotto (Figura 1). - Attivare un filtro di fluorescenza, aprire il diaframma e garantire che uno spot fluorescente può essere visto arrivare attraverso l'obiettivo. Utilizzando il micromanipolatore, spostare la pipetta in posizione che allinea la punta con la macchia fluorescente e abbassa la pipetta in posizione appena sopra l'altezza della piastra di coltura delle cellule (35 x 10 mm). Una volta in posizione, accendere la luce trasmessa e disattivare la fluorescenza.
- Con una pinzetta, aggiungere un vetrino coprioggetti (con le cellule rivolto verso la pipetta) dalla piastra di coltura delle cellule a piastra di coltura cellulare contenente circa 2 mL di tampone di Hank a temperatura ambiente.
- Posizionare la piastra di coltura contenente il coprioggetto sul campo di applicazione.
- Utilizzando la manopola di messa a fuoco micrometrica e 20 X obiettivo, concentrarsi su un aereo circa quattro giri completi sopra le celle (circa 0,4 mm). Utilizzare il micromanipolatore per posizionare la punta della pipetta, affinché essa si concentra e al centro, sul lato sinistro dell'aereo come visto attraverso gli oculari.
Nota: Dendriti sono proiezioni che dovrebbero essere nello stesso frame corpo cellulare da che questi provengono. Per indurre varicosities axonal, uno dovrebbe seguire più proiezioni dal corpo cellulare per assoni mediali e distali.
4. calibrare la pressione della pipetta che utilizzano un sistema a membrana stretch
- L'apparato di pipetta puffing con gli stessi parametri esatti di installazione come descritto in precedenza sopra un sistema contenente una membrana di silicone microfabbricati (500 µm di diametro) e dello spessore di 50 µm e concentrarsi al microscopio sulla superficie della membrana.
Nota: Questo sistema è stato progettato per misurare i valori di pressione piccola e una spiegazione del sistema è stata pubblicata prima delle10. Questa misura deve solo essere fatto una volta per sbuffando esperimenti se viene utilizzata l'impostazione stessa esatta di sbuffando. - Fuoco il microscopio su matrici di micropunti (4 µm di diametro) e 10 µm apart, misurata fra i centri. Girare la valvola di arresto e consentire al fluido di fluire fuori la pipetta. Esaminare la deflessione della membrana in risposta alla pressione del fluido con un microscopio confocale.
- Utilizzare un modello lineare per determinare la pressione corrispondente associata con deflessione della membrana.
Nota: Mentre un recente studio ha scoperto che una deviazione di w =-3.143 ± 0.69 µm è stata ottenuta per 190 mm di altezza di siringa, questo ha prodotto una pressione di 0,25 ± 0,06 nN/µm2 dalla configurazione attuale della pipetta, che è all'interno della gamma fisiologica e patologica, però il altezza della siringa non è il solo determinante. Altri fattori che influenzano il valore di pressione esatta sui neuroni pure, compreso la pipetta di apertura, posizionamento (distanza e angolo) della punta della pipetta rispetto le cellule e anche la flessibilità del tubo4,10.
5. sbuffando per indurre Varicosities
- Una volta la pipetta è in posizione, è possibile concentrare il microscopio su un aereo che contiene una regione di interesse. Posizionare le cellule e i processi nella metà sinistra del campo imaging (visto da acquisizione live della telecamera) all'interno dell'area puffing, mentre la metà destra è di fuori della zona di sbuffando.
Nota: A causa di vasto escrescenza degli assoni e dendriti dei neuroni, è improbabile che tutti i processi di un neurone sono situati nella medesima area puffing. Questo è in realtà uno dei vantaggi di questo sistema, che consente l'esame dell'effetto locale di sbuffando. Ci sono due tipi di sbuffando che possono essere utilizzati per indurre varicosities: lunga durata soffiando e sbuffando impulso. -
Sbuffando
- Sbuffando di lunga durata
- Posizionare la siringa all'altezza, 190 mm sopra il vetrino coprioggetto che contiene neuroni coltivati4. Iniziare time-lapse imaging dell'area di interesse con un tempo di esposizione ottimizzata rivelando morfologia neuronale chiaro. Acquisire almeno 15 fotogrammi a un intervallo di 2 s (30 totale s) come linea di base. L'intervallo può essere aggiustato in base all'esperimento. Al fotogramma 16, aprire la valvola di arresto in grado Disabilita della siringa e consentire al fluido di flusso per 75 fotogrammi (150 s). Al fotogramma 75, spengono la valvola affinché il flusso fluido fermate. Interrompere la cattura video.
Nota: Questo dovrebbe indurre varicosities axonal nei neuroni 7-9 DIV all'interno di 5-10 s, considerando che i neuroni più grandi richiedono più tempo per varicosities forma.
- Posizionare la siringa all'altezza, 190 mm sopra il vetrino coprioggetto che contiene neuroni coltivati4. Iniziare time-lapse imaging dell'area di interesse con un tempo di esposizione ottimizzata rivelando morfologia neuronale chiaro. Acquisire almeno 15 fotogrammi a un intervallo di 2 s (30 totale s) come linea di base. L'intervallo può essere aggiustato in base all'esperimento. Al fotogramma 16, aprire la valvola di arresto in grado Disabilita della siringa e consentire al fluido di flusso per 75 fotogrammi (150 s). Al fotogramma 75, spengono la valvola affinché il flusso fluido fermate. Interrompere la cattura video.
- Sbuffando di impulso (durata 2 s)
- Posizionare la siringa all'altezza corretta (190 mm). Iniziare la formazione immagine time-lapse e catturare almeno 15 fotogrammi (30 s) a un intervallo di 2 s. Al fotogramma 16, aprire la valvola della siringa e consentire al fluido di flusso, quindi chiudere la valvola dopo 2 s. attendere 5-20 s (a seconda della frequenza da testare) prima di aprire la valvola di nuovo. Ripetere l'apertura e la chiusura della valvola per creare impulsi fluidi e continuare per un periodo totale di 150-300 s. continua time-lapse imaging per 20 min per catturare la fase di recupero.
Nota: Quando l'intervallo è più lungo di 10 s, gli impulsi inducono drasticamente meno varicosità. Intervalli di s 20, nessun varicosities può essere indotta da impulsi4. Per ottenere la formazione del varicosity affidabile, coerente, è consigliato l'altezza della siringa deve essere circa 190 mm. altezza di siringa e pressione del fluido non deve essere generata in un punto dove le cellule cominciano lo scollegamento dalla superficie del vetrino coprioggetti.
- Posizionare la siringa all'altezza corretta (190 mm). Iniziare la formazione immagine time-lapse e catturare almeno 15 fotogrammi (30 s) a un intervallo di 2 s. Al fotogramma 16, aprire la valvola della siringa e consentire al fluido di flusso, quindi chiudere la valvola dopo 2 s. attendere 5-20 s (a seconda della frequenza da testare) prima di aprire la valvola di nuovo. Ripetere l'apertura e la chiusura della valvola per creare impulsi fluidi e continuare per un periodo totale di 150-300 s. continua time-lapse imaging per 20 min per catturare la fase di recupero.
- Prima di una giornata di utilizzo, pulire il set-up (pipetta, tubi e siringa) che scorre circa 10 mL 70% etanolo attraverso il set-up. In seguito l'etanolo lavare, 10 mL di buffer di Hank (o buffer desiderato) di flusso attraverso il set-up per innescare il sistema per l'utilizzo di quel giorno. Dopo gli esperimenti di finitura per il giorno, pulire il set-up come precedentemente descritto con etanolo per prevenire la crescita di contaminanti durante la notte.
- Sbuffando di lunga durata
6. complimentarmi con metodi
Nota: Il dosaggio puffing possa essere combinato con una varietà di tecniche diverse che sono discussi nella sezione Introduzione. Qui, il focus è sulle tecniche di base che vengono utilizzate più di frequente con il dosaggio di puffing, compreso formazione immagine di fluorescenza ad alta risoluzione timelapse, calcio imaging e saggi di recupero. Questi sono discussi di seguito.
-
Condotta di imaging ad alta risoluzione di time-lapse fluorescente seguendo il protocollo qui sotto
- Tracciare il movimento delle proteine fluorescente-etichettate all'interno dei neuroni con un 100x obiettivo di olio. I neuroni sono trasfettati con il costrutto di cDNA corretto. Cattura per 150 fotogrammi (Totale 300 s) con un intervallo di 2 s.
Nota: A volte, formazione immagine di time-lapse di multiplo-colore viene eseguita per il movimento di più di una proteina fluorescente-tag di immagine contemporaneamente. - Generare un kymograph attraverso il software di cattura video o attraverso ImageJ (NIH).
Nota: La velocità e la direzionalità del viaggio può essere determinati utilizzando il kymograph. * Essere sicuro notare la direzione il soma si trova dalla regione catturata. Viaggio verso il soma è retrogrado, mentre viaggio lontano da soma fino alla punta di axonal è anterograda. - Ripetere questo processo seguendo puffing, o di un kymograph può essere creato utilizzando la cattura dell'immagine durante il dosaggio puffing.
Nota: Gli effetti di sbuffando il trasporto axonal dei mitocondri e proteine sinaptiche sono stati mostrati in un recente paper4.
- Tracciare il movimento delle proteine fluorescente-etichettate all'interno dei neuroni con un 100x obiettivo di olio. I neuroni sono trasfettati con il costrutto di cDNA corretto. Cattura per 150 fotogrammi (Totale 300 s) con un intervallo di 2 s.
-
Formazione immagine del calcio
- Aggiungere 1 µ l (per una piastra a 24 pozzetti) o 3 µ l (per una piastra a 6 pozzetti) di 5 mM Fluo-4 AM alla cultura media in uno ed incubazione a 37 ° C per 30 min.
- Lavare le cellule due volte con tampone di 1ml Hank.
Nota: Caricati neuroni emettono fluorescenza verde attraverso un set di filtro FITC. Loci denotano regioni di calcio apprezzabile all'interno della cellula. Quando combinato con sbuffando, un aumento nell'intensità (aumento nel livello del calcio interno) può essere visto.
-
Recupero di varici
Nota: Immediatamente dopo un esperimento puffing, un esperimento di recupero di 20 min può essere effettuato.- Catturare immagini per 300 fotogrammi (1.200 s) con un intervallo di 4 s.
Nota: Una cellula trasfettata con solubile YFP/mCherry/GFP dovrebbe mostrare un livello moderato (meno del 50%) di recupero entro la fine della sessione di imaging. Axonal recupero dipende da una serie di fattori, quali lo stadio di sviluppo di neuroni in coltura4. Questo combinabile anche con imaging fluorescente ad alta risoluzione e imaging del calcio sopra descritto.
- Catturare immagini per 300 fotogrammi (1.200 s) con un intervallo di 4 s.
Risultati
Prima sbuffando, assoni normalmente mostrano poca formazione di varici. Seguente sbuffando con la nostra pressione standard (190 mmH2O altezza), l'inizio di assoni di sviluppare molti tallone-come varicosità. La formazione di varicosità è parzialmente reversibile, come mostrato dalle regioni dell'assone tornando al loro stato pre-soffiato in seguito a un periodo di recupero di 10 min (Figura 2A-B). Dopo un periodo di recupero più lungo (> 20 min), alcuni assoni recupero completamente. Posizionamento non ottimale la pipetta puffing nonché accurato posizionamento della siringa a 190 mm sopra il palco non può rapidamente generare varicosità. Condizioni ottimali dovrebbero provocare la formazione di varici negli assoni dei neuroni giovane (circa 7 DIV) in circa 5 s4.

Figura 1 : Disegno schematico e fotografia di sbuffando apparato. (A) fotografie che mostrano di set-up generale di microscopio. (B) sbuffando apparecchio per mostrare la pipetta di vetro tenuto dal micromanipolatore e collegato alla tubazione di gomma. Contrasto di fase (C) immagini con messa a fuoco nel piano dei neuroni hippocampal primari risultati ombra della pipetta nella parte inferiore destra. (D) fuori della cella aereo focalizzata su sbuffando punta della pipetta. (E) schema delle distanze e delle pressioni calcolate per l'induzione di varicosità. Barra della scala = 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.
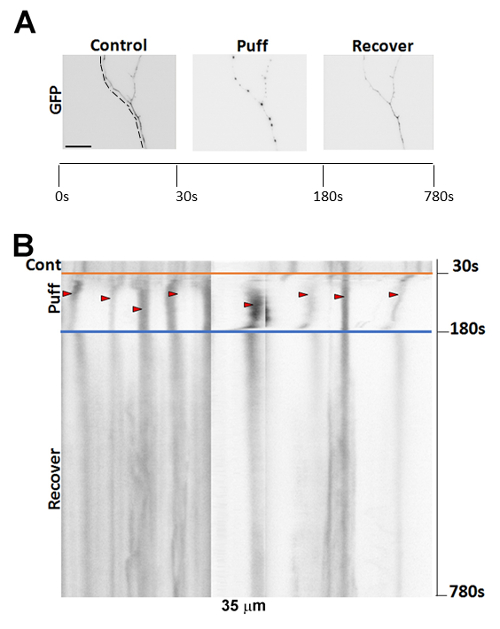
Figura 2 : Immagini rappresentative di formazione di varici segue sbuffando. (A) formazione immagine di 7DIV, neuroni ippocampali di mouse transfettate GFP mostrando un assone pre- e post-sbuffando oltre a seguire un periodo di recupero di 10 min. (B) Kymograph dell'imaging time-lapse del neurone in (A). Le frecce rosse indicano varicosità che si sono formate a seguito di 150 s di 190 mmH2O sbuffando (inizio alle 30 s). Barra della scala = 15 µm. Clicca qui per visualizzare una versione più grande di questa figura.
| Soluzione di rivestimento vetrino coprioggetti | |
| Μ L 780 | Acid17 acetico mM calcio: 50 µ l di acido acetico in 50 mL di H2O |
| 200 Μ l | Poli-D-lisina (0,5 mg/mL di brodo) |
| 20 Μ l | Collagene di coda di ratto (3 mg/mL di brodo) |
| Il volume totale viene determinato in base al numero di vetrini coprioggetto da rivestire. | |
Tabella 1: soluzione di rivestimento vetrino coprioggetti. Fornisce la ricetta per preparare la soluzione di rivestimento vetrino coprioggetti usata per aderire le cellule coltivate a lamelle.
| 1 x fetta dissezione soluzione (SLD), filtrato, pH = 7,4, conservare a 4 ° C | |
| 1 L | ddH2O |
| 82 mM | Na2così4 |
| 30 mM | K2così4 |
| 10 mM | HEPES (acido libero) |
| 10 mM | D-glucosio |
| 5 mM | MgCl2 |
| 0.00% | Rosso fenolo (opzionale) |
| Placcatura Media (PM, filtrare, conservare a 4 ° C) | |
| 439 mL | Sali di MEM Earle |
| 50 mL | FBS |
| 11,25 mL | 20% D-glucosio |
| 5 mL | Piruvato di sodio (100 mM), |
| 62,5 Μ l | L-Glutammina (200 mM) |
| 5 mL | Penicillina/streptomicina (P/S, x 100) |
| Mezzi di manutenzione (MM, filtrare, conservare a 4 ° C) | |
| 484 mL | Neurobasal |
| 10 mL | Supplemento 50 x B27 |
| 1,25 mL | L-Glutammina (200 mM) |
| 5 mL | 100 x P/S |
| Tutte le soluzioni sono sterilizzate con un filtro con pori di 0,2 mm. | |
Tabella 2: Cell ricette di cultura media. Fornisce le ricette per preparare i supporti utilizzati alla coltura delle cellule primarie del neurone hippocampal.
| Buffer di Hank (filtro, pH = 7,4, conservare a 4° C | |
| 150 mM | NaCl |
| 4 mM | KCl |
| 1.2 mM | MgCl2 |
| 1 mM | CaCl2 |
| 10 mg/mL | D-glucosio |
| 20 mM | HEPES |
Tabella 3: ricetta di buffer di Hank. Fornisce la ricetta per preparare il buffer utilizzato nel protocollo puffing e durante la formazione immagine di cellule vive.
| Pipettare tirando i parametri | |||||
| Calore | Tirare | Velocità | Ritardo | Pressione | Rampa |
| 501 | 0 | 15 | 1 | 500 | 530 |
Tabella 4: Pipettare tirando parametri. Fornisce i parametri da impostare sulla levetta della pipetta per ottenere un'apertura che è circa 45 µm di diametro.
Discussione
La procedura di questo test di microbiomechanical è dritto in avanti. Esso produrrà risultati affidabili, se tutti i suoi passaggi sono eseguiti con attenzione. Ci sono diversi passaggi chiave che, se correttamente eseguita, ostacolerà la raccolta dei dati di successo. I passaggi critici cominciano a monte dell'effettiva applicazione dello stimolo puffing. La dissezione attenta, coltura e cura della cultura primaria del neurone sono di primaria importanza. Se i neuroni coltivati non sono sani, non reagiranno in modo coerente, poiché essi potrebbero già state innescate per lo stress. A valle della cultura, la configurazione iniziale e la taratura dell'apparato puffing per fornire una pressione costante, che indurrà varicosities ma non causerà il distacco delle cellule dalla superficie del vetrino coprioggetto, deve essere eseguita con pazienza. Una calibrazione accurata dell'assetto potrebbe richiedere 1 h a causa di problemi di valvola, tubi o pipetta intasamento. È fondamentale per assicurare che il fluido scorre fuori della pipetta con una resistenza minima prima di andare avanti con posizionando le cellule nel piatto e posizionare la punta della pipetta. Per quanto riguardano le modifiche all'assetto, uno può abbinare apparato puffing con aspersione, patch di bloccaggio e qualsiasi altro basati su microscopio strumento, per lo più dipenda sullo spazio fisico libero sui lati del microscopio.
Questo sistema ha due limitazioni intrinseche che richiedono attenzione. Il set-up può costantemente iniziano la formazione di varicosità reversibile in assoni dei neuroni hippocampal coltivati attraverso puffing fluido alle cellule. Tuttavia, è importante notare che i valori di pressione esatta sui neuroni all'interno dello stesso campo puffing non sono identici. La pressione del fluido che urta le cellule, calcolata in base alla misura del carico di pressione da un microfabbricati membrana in silicone4,10, rappresenta la pressione media al centro del campo puffing. Così, l'esatta pressione puffing è il più alto nel centro del campo del puffing e il più basso intorno al bordo del campo. Abbiamo dimostrato che le componenti di forza di pressione con l'insorgenza, la dimensione e il numero di varicosità indotto4. Pressione superiore ha provocato un inizio più veloce, più grande e più abbondante varicosities4. Nei nostri studi recenti, abbiamo usato una pressione minima (190 mmHg sulla punta della pipetta puffing) che possa indurre ancora attendibilmente varicosities nella maggior parte dei assoni4. In questa circostanza, insorgenza di varici per giovani neuroni è normalmente circa 5 s. È importante notare che con l'esatto stesso sbuffando sistema, il valore del tempo di insorgenza può variare, che non solo dipende dal tipo di un neurone, età e compartimento subcellulare, ma può anche essere influenzata dalla posizione del neurone nel campo puffing. Nonostante la variazione di pressione puffing ricevuto dai neuroni, questo sistema di dosaggio ancora fornisce un mezzo affidabile per lo studio di effetti meccanici su neuroni centrali e produce risultati sperimentali altamente coerenti e riproducibili.
La seconda limitazione del sistema è il suo problema di intasamento. Per ottenere la pressione fisiologicamente rilevanti, l'apertura delle pipette è piccolo, circa 45 μm. Tuttavia, la piccola apertura tende ad impastarsi con detriti dalla tubazione di plastica e i detriti nella punta della pipetta possono essere visto chiaramente al microscopio. Questo aumenta la quantità di tempo durante la preparazione il set-up, in caso di uno zoccolo di pipetta. Di conseguenza, tutte le soluzioni sono accuratamente filtrate prima di essere messo nella siringa, tubi e pipetta. Inoltre è importante lavare il sistema puffing con etanolo al 70% all'inizio e alla fine della giornata, seguita da lavaggio con buffer di Hank filtrata. Per risolvere il potenziale problema di intasamento, ti suggeriamo di provare a tirare più pipette. È essenziale per confermare che la soluzione è in realtà soffiata fuori la pipetta attraverso la visualizzazione prima di iniziare gli esperimenti. Una volta stabilito un buon sistema puffing, solitamente può durare per il resto della giornata.
Questa analisi biomeccanica, combinata con la cultura del neurone, presenta un'opportunità unica per lo studio del neurone centrale mechanosensation che imita le condizioni fisiologiche e/o patofisiologiche. Questo sistema permette di esaminare gli effetti di compressione e taglio sui neuroni. Al contrario, altri sistemi sono stati usati per esaminare in piano stretching5,6,7. La pressione media ricevuta dai neuroni nel centro delle zone puffing è 0.25 ± 0,06 nN/µm2 nel nostro sistema4. Questa pressione esercitata sulle cellule è paragonabile al modulo elastico dei neuroni ippocampali come misurato in precedenza utilizzando reologia microscopia e massa scansione di forza, per identificare otticamente indotto deformazione13,14, così come pressioni permette alterare la crescita di neuriti bordi iniziali in vitro, misurata mediante la scansione forza microscopia (0.27 ± 0,04 nN/µm2)16. Questa pressione non superi la pressione che possa essere generata naturalmente dalle cellule mesenchymal in un embrione E11, misurata utilizzando olio di dimensioni delle cellule fluorescenti meccanicamente specifico microgocce (1,6 ± 0,8 nN/µm)2,14.
Questo sistema è già stato utilizzato con successo in combinazione con calcio imaging, patch di bloccaggio, microscopio elettronico e analisi cellulare di un cranio chiuso mTBI mouse modello4. Il dosaggio anche utilizzabile in combinazione con esperimenti basati su microscopio, come recupero di fluorescenza dopo photobleaching (FRAP), per esaminare la proteina turn over all'interno di varicosità, come pure di FRET per studiare se sono alterate interazioni proteina-proteina durante la formazione di varici. In sostanza, qualsiasi metodo che può essere fatto utilizzando un microscopio e una cellula viva, set-up di imaging può essere accoppiato con questo dosaggio puffing. La versatilità di questo test è molto preziosa a studiare i meccanismi molecolari sottostanti vari effetti sulla morfologia neuronale e funzioni dallo sforzo di micromeccanica.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Tutti gli esperimenti sugli animali sono stati condotti in conformità con gli istituti nazionali di salute animale uso orientamenti. Questo lavoro è stato sostenuto in parte dalle concessioni dal National Institutes of Health (R01NS093073 e R21AA024873) a C. Gu.
Materiali
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Warner Instruments | 64-0702 | for 24-well plate |
| 25 mm coverslips | Fisher Scientific | 12-545-102 | for 6-well plate |
| Acetic acid | Fisher Scientific | A38-212 | |
| Poly-D-lysine | Sigma | P6407 | |
| Rat tail collagen | Roche | 11 179 179 001 | |
| 10X PBS | National Diagnostics | CL-253 | |
| Na2SO4 | Fisher Scientific | S373-500 | |
| K2SO4 | Fisher Scientific | P304-500 | |
| HEPES | Fisher Scientific | BP410-500 | |
| D-glucose | Fisher Scientific | D16-500 | |
| MgCl2 | Fisher Scientific | BP214-500 | |
| NaOH | Fisher Scientific | SS255-1 | |
| Protease enzyme | Sigma | P4032 | |
| FBS | Gibco | 26140 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| L-glutamine | Gibco | 25030081 | |
| Penicillin/Streptomycin 100x (P/S) | Gibco | 15140122 | |
| MEM Earle's Salts | Gibco | 11090 | |
| B27 supplement | Gibco | 17504-044 | |
| Neurobasal | Gibco | 21103-049 | |
| Arabinosylcytosine (Ara-C) | Sigma | 147-94-4 | |
| Opti-MEM media | Gibco | 31985-070 | |
| Lipofectamine 2000 | Invitrogen | 1854313 | transfection reagent |
| Borosilicate rods | World Precision Instruments Inc. | PG52151-4 | for puffing pipette |
| rubber tubing | Fisher Scientific | 14-169-1A | |
| 10cc plastic syringe and plunger | Becton Dickinson | ||
| micromanipulator | Sutter Instruments | ||
| NaCl | Fisher Scientific | S640-3 | |
| KCl | Fisher Scientific | BP366-500 | |
| CaCl2 | Fisher Scientific | C70-500 | |
| Cell culture dish (35 mm x 10 mm) | Corning | 3294 | |
| Fluo-4 AM | Molecular Probes | F14201 | for calcium imaging |
| Mito-YFP construct | Takara Bio Inc. | for cell transfection | |
| YFP-N1 construct | Takara Bio Inc. | for cell transfection | |
| Model P-1000 Flaming/Brown Micropipette puller | Sutter Instruments | ||
| Eclipse TE2000-U Mcroscope | Nikon | ||
| Plan Fluor ELWD 20x lens | Nikon | 062933 | objective |
| Apo TIRF 100x/1.49 oil lens | Nikon | MRD01991 | objective |
Riferimenti
- Nikić, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 17, 495-499 (2011).
- Yang, J., et al. Regulation of axon degeneration after injury and in development by the endogenous calpain inhibitor calpastatin. Neuron. 80 (5), 1175-1189 (2013).
- Debanne, D. Information processing in the axon. Nat. Rev. Neurosci. 5, 304-316 (2004).
- Gu, Y., Jukkola, P., Wang, Q., Esparza, T., Zhao, Y., Brody, D., Gu, C. Polarity of varicosity initiation in central neuron mechanosensation. J Cell Biol. 216 (7), 2179-2199 (2017).
- Chung, R. S., et al. Mild axonal stretch injury in vitro induces a progressive series of neurofilament alterations ultimately leading to delayed axotomy. J. Neurotrauma. 22 (10), 1081-1091 (2005).
- Staal, J. A., Dickson, T. C., Chung, R. S., Vickers, J. C. Cyclosporin-A treatment attenuates delayed cytoskeletal alterations and secondary axotomy following mild axonal stretch injury. Dev. Neurobiol. 67 (14), 1831-1842 (2007).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Exp. Neurol. 233 (1), 364-372 (2012).
- Donkin, J. J., Vink, R. Mechanisms of cerebral edema in traumatic brain injury: therapeutic developments. Curr Opin Neurol. 23 (3), 293-299 (2010).
- Gardner, A., Jukkola, P., Gu, C. Myelination of rodent hippocampal neurons in culture. Nat Protoc. 7 (10), 1774-1782 (2012).
- Wang, Q., Zhang, X., Zhao, Y. Micromechanical stimulator for localized cell loading: fabrication and strain analysis. J. Micromech. Microeng. 23, 015002(2013).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc. Natl. Acad. Sci. USA. 103 (47), 17759-17764 (2006).
- Elkin, B. S., Azeloglu, E. U., Costa, K. D., Morrison, B. Mechanical heterogeneity of the rat hippocampus measured by atomic force microscope indentation. J. Neurotrauma. 24 (5), 812-822 (2007).
- Franze, K., et al. Neurite branch retraction is caused by a threshold-dependent mechanical impact. Biophys. J. 97 (7), 1883-1890 (2009).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nat. Methods. 11 (2), 183-189 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon