Method Article
静脈瘤形成と中枢神経の軸索の回復を研究するための Microbiomechanical システム
要約
このプロトコルでは、ニューロンの下肢の急速かつ可逆的誘導の生理学的に関連する、加圧液体のアプローチについて説明します。
要約
軸索の下肢は、不均一性の高度で軸索の軸に沿って拡大構造です。彼らが神経変性疾患や外傷、脳は通常の脳だけではなく存在です。ここでは、我々 静脈瘤形成と異種タンパク質組成を支配するメカニズムを理解すること急速に、確実に、かつ可逆的に軸索の下肢を誘導するために新設された微小力学系をについて説明します。このシステムは、ニューロン、他の培養システム主に及ぼす伸張の影響に焦点を当てる別の細胞内コンパートメントに及ぼす圧縮と剪断応力を評価するための新しい手段を表します。重要なは、我々 のシステムの固有の機能のおかげで我々 は最近、加圧流体のアプリケーション迅速かつ可逆的に誘発することが一時的な受容器の潜在的なチャネルの活性化を介して軸索の下肢を示す新規発見をしました。私たちの生体力学的システムは、薬剤灌流、ライブセル イメージング、カルシウム イメージング、およびパッチ ・ クランプ記録との組み合わせで便利に利用できます。したがって、このメソッドは、機械刺激感受性イオン チャネル、軸索輸送規制、軸索細胞骨格のダイナミクス、カルシウム シグナル伝達、および形態変化関連外傷性脳損傷を研究するため採用することができます。
概要
静脈瘤の形成、または腫れ/ビーズ, 軸索に沿っては多くの障害やパーキンソン病、アルツハイマー病、多発性硬化症を含む中枢神経系の損傷で観察した神経変性疾患の顕著な特徴と外傷性脳損傷1,2。活動電位伝搬とシナプス伝達3軸索下肢の生理学的な影響にもかかわらず、下肢の生成方法は不明のまま。最近、齧歯動物から培養海馬神経細胞の新設 microbiomechanical 試金を使用して、機械的刺激が下肢機能を非常に魅力的なこれらのニューロンを引き起こすことができることがわかった。最初に、静脈瘤の誘導は急速な (< 10 s)、このプロセスは予期せず元に戻せる。第二に、静脈瘤開始が圧力を吹きかける強さ依存: より高い圧力、高速の開始。第三に、静脈瘤の発生は神経年齢に依存します。若いニューロンの軸索はより古いニューロンのそれらと比較して、機械的ストレスに対する応答表示されます。第四に、樹枝状結晶およびこれらのニューロンの軸索の初期セグメント中の海馬ニューロンの軸索に沿って下肢のフォームには、同じたばこを吸う条件変更は表示されません。したがって、我々 の研究は、神経細胞の極性の新規機能を明らかにしました。体外システムこれらの発見は、生理学的に関連しています。軽度外傷性脳損傷 (mTBI)生体内でモデルを使用して、軸索の下肢が閉じる頭蓋骨への影響、私たち体外で一貫した後すぐにマウスの体性感覚野における多焦点方式で開発を示した結果4。私たちの染色・ イメージング mTBI マウスの神経の形態学的変化のスナップ ショットを提供するだけで、体内の実行以来機械的衝撃に神経細胞形態のタイムラプス イメージングはまだ不可能することが重要です。
この液体に吹きかけるシステム機械的応力誘起静脈瘤形成に関連するユニークな機能をキャプチャするのみならず、基になるメカニズムを決定することができました。細胞外のさまざまなソリューション、ブロッカーと機械刺激感受性イオン チャネル、細胞電気生理学の別候補のオープナをテストすることにより一時的な受容器の潜在的な陽イオン チャネル亜科 V メンバー 4 (TRPV4) ことがわかりました吹き込むことによってアクティブ化される Ca2 + +の Na に透過性チャネルは軸索静脈瘤形成4の間に初期の機械的応力を検出を主に担当。これはさらに、siRNA ノックアウト アプローチで確認されました。まとめると、海馬ニューロンの文化を開発したこの新しいアッセイ システム、他の技術との組み合わせでは特に、脳のニューロンのマイクロメカニックスによるプロパティの勉強にとって非常に貴重です。
設けてこのマイクロ システムはユニークないくつかの主要な側面で既存システムとは異なります。まず、このシステムは、ニューロンは圧縮とせん断の形態で面外応力を経験します。機械的衝撃に神経突起 coverslip 表面に接続したまま、移動しないでください。その他実験的曲げ、平面でストレッチを主に含んだシステム (または張力) からこれとは異なり、文字列5,6を移動またはマイクロパターニングゲル上に成長した軸索を伸ばす例えば、バンドルされた軸索の偏向のようなチャンネルと伸縮性膜7,8。また、軸索の下肢に誘起することが流体に吹きかけるシステムでこれらの設定のプロセスのようなこれらの試金が表示されます (数時間6,7,810 分) からのより多くの時間がかかると不可逆的です。最後に、ローカル流体息を切らしを用いてできます静脈瘤形成の空間的特徴の検討 (e.g。、樹状突起スパイン、相馬、軸索の初期セグメント、軸索端末)、時空間特徴のほか。このシステムを使用すると、予期しない、ユニークな機能がいくつか軸索静脈瘤形成、特に急激な発症、低速の可逆性と軸索・樹状突起の極性を発見しました。
本稿で述べるシステムは分子の多くの技術との互換性と、細胞生物学。例えば、機械的ストレスが神経細胞の形態と機能に及ぼす影響を研究するそれと共に使用できますミエリン共、タイムラプス蛍光共鳴エネルギー移動 (FRET) の全内部反射蛍光 (TIRF) イメージングカルシウム イメージング、およびパッチ ・ クランプ記録。本稿で我々 はシステムのコア ・ コンポーネントに焦点を当てます。海馬ニューロンの文化、流体パフィング セットアップ、軸索輸送のための高分解能のタイムラプス イメージングおよびカルシウム イメージングを以下順を追って示します。
プロトコル
以下のすべてのメソッドは、機関動物ケアおよび使用委員会 (IACUC) オハイオ州立大学によって承認されています。
1. Coverslip の準備
- 70% の硝酸を含むガラス ビーカーに 12 mm または 25 mm coverslips の 1 つまたは複数のボックスを置き、一晩常温 coverslips を孵化させなさい。
注: は、12 mm coverslips として同じビーカーに 25 mm coverslips を洗浄しないでください。別にそれらを洗浄することをお勧めします。 - DdH2O の 2.5 L と 4 L ビーカーにすべて coverslips を転送、100 rpm で 1 時間 coverslips を含むビーカーを振る。振動中にビーカーを保持するためにゴムバンドを使用します。4 回新鮮な 2.5 L ddH2O ですすぎを繰り返します。
- 金属カバー付き乾燥フラスコ洗浄 coverslips に転送します。6 h 225 ° C のオーブンで coverslips を焼くし、部屋の温度に冷ます。
注: 25 mm coverslip は破壊しやすいです。Coverslips 1 つずつを分離し、空気が乾燥、オーブンで焼きます。 - 使用状況まで滅菌プラスチック容器に室温で乾燥し、掃除 coverslips を格納します。
-
コート、coverslips のとおり。
- 遠心分離機管の新鮮な塗装ソリューションを準備します。
- 24 ウェル (または 6 ウェル) プレートのウェル 1 個にそれぞれ coverslip を配置します。12 mm (または 25 mm) coverslip と旋回に coverslip コーティング液 (表 1) の 30 (または 100) μ L を配置します。井戸に滅菌リン酸緩衝生理食塩水 (PBS、組織培養グレード) の 1 つの mL を追加します。これらのプレートはすぐに使用または、一週間までの滅菌 PBS で 4 ° C で保存することができます。
- 解剖の日に PBS を削除します。空気乾燥、紫外線 (30 w) 2-4 時間の下でプレートを配置します。
注: 最後のステップは、細胞培養層流フードに紫外線を完了する必要があります。フードのドアは、coverslips を乾燥空気の流れを許可するように少し持ち上げる必要があります。
2. 解離、解離、および妊娠マウス/ラット海馬神経細胞の培養
-
郭清と文化の海馬ニューロンの解離
- プロテアーゼ酵素液 (3 mg/mL プロテアーゼ 23 SLD、表 1) を解凍し、メッキをあらかじめ温める 37 ° C でメディア (表 2)
- 海馬の解剖し、前文書14で説明する方法に従って、SLD とすすいでください。
注: 4 のなった 1 つ 24 ウェルまたは 1 つ 6 ウェル プレートの十分なセルを提供します。 - SLD を削除、プロテアーゼ酵素液 2 mL を追加し、37 ° c で 15 分間 5% CO2サンプルをインキュベートします。
- 2 回を 5-10 mL めっき中の海馬外植体を洗います。播種培地 5 mL を追加します。単一のセルに 1 mL プラスチック先端のピペットを使用して小さな渦を生成することによって海馬外植体を切り離します。酸素気泡の形成を回避するソリューションは曇りになり、植の大部分が残っていないまで約 40 倍のピペットを上下。
注意: 洗浄の間にいくつかのメディアを残して、海馬外植体は全体のプロセス中に培地で水中に残る必要があります。 - 1,125 x g で 3 分間細胞上清にメディアで冠水した削除で細胞を遠心します。メディアをめっきの 145 mL の細胞を再懸濁します。24 ウェル プレート (mL/井戸 6 ウェル プレートに 3) に細胞懸濁液の 1 mL/井戸を追加します。
メモ: メディアをめっきの 145 mL は、低細胞密度を持つ細胞懸濁液を生成する使用されます。このボリュームを 6 24 ウェル プレート、8 6 ウェル プレート、またはさまざまな実験を行うことによって 24-6 ウェル プレートの組み合わせにセルのめっきとなります。24 ウェル プレートの各ウェルでお越しの際にも約 3 × 104セル9。 - 37 ° c、5% CO2 2 4 h 用めっきメディアで細胞をインキュベートし、すべてめっきメディアを取り出し、新鮮な維持媒体に置き換えます。
- 2 日間 (2 日間の in vitro, 2DIV) 後、2 メディアの半分を置き換える μ M Ara C (arabinosylcytosine) 線維芽細胞、内皮細胞およびグリア細胞の増殖を抑制する保守メディアに溶解します。2 日間の Ara c 細胞を公開した後、メディアを新鮮な保守メディアに置き換えます。
-
トランスフェクション細胞形態の可視化
注: Transfect 緑色蛍光タンパク質 (GFP)、黄色い蛍光蛋白質 (YFP を) mCherry、個々 のニューロンの形態を照らすなどの蛍光灯の構造を持つセルです。- Opti メモリ メディア (Opti メモリ メディアの 50 μ L のコンストラクトの 0.8 μ g) と渦に在庫 (1 μ g/μ L) から構造を希釈します。ためにも、各 1 コンストラクト希釈を準備します。
注: 24 ウェル プレートには、Opti メモリ メディアの 50 μ L のコンストラクトの 0.8 μ g が必要です。6 ウェル プレート 2.4 μ g 150 μ L Opti メモリ メディアの構築が必要です。 - Opti メモリ メディア (Opti メモリ メディアの 50 μ L のトランスフェクション試薬の 1.5 μ) と渦にリポソームを介したトランスフェクション試薬を希釈します。ためにも、各 1 トランスフェクション希釈を準備します。
注: 24 ウェル プレートは、Opti メモリ メディアの 50 μ L のトランスフェクション試薬の 1.5 μ L を必要です。6 ウェル プレートは、Opti メモリ メディアの 150 μ L のトランスフェクション試薬の 4.5 μ L 必要です。 - Opti MEM 媒体および渦の Opti メモリ メディア、トランスフェクション試薬の構造の 1:1 混合物 (100 μ L) を準備します。20 分間室温で混合物を孵化させなさい。
注: 好評につき、24 ウェル プレート (6 ウェル プレート 300 μ L) を使用している場合、構築、トランスフェクション試薬と Opti メモリ メディアを含む溶液の約 100 μ L があるはずです。 - 各ウェルからメディア (24 ウェル プレート、1.5 mL 6 ウェル プレートに 500 μ L) の半分を除去し、きれいな円錐管にこのメディアを転送します。このチューブをインキュベーターにおいて。井戸の残りのメディアに 100 μ L の混合物 (ステップ 2.2.3) を追加します。37 ° C、20-30 分インキュベートするセルを許可します。
- (ステップ 2.2.4)、インキュベーション中に円錐管 (ステップ 2.2.4) でメディアに新鮮な維持媒体の 1 つのボリュームを追加します。同じインキュベーター (37 ° C、5% CO2) で混合物を配置します。
- 次の孵化、井戸からトランスフェクション ソリューションを含むすべてのメディアを削除して 1:1 の混合物の古い円錐管 (ステップ 2.2.5) で新鮮な保守メディアに置き換え。
注: 構造のサイズによって始めるかもしれない細胞 12 h の内を表現します。大きい構造の構造発現のピークに達する前に 3-4 日は必要かもしれない。
- Opti メモリ メディア (Opti メモリ メディアの 50 μ L のコンストラクトの 0.8 μ g) と渦に在庫 (1 μ g/μ L) から構造を希釈します。ためにも、各 1 コンストラクト希釈を準備します。
3 たばこを吸うピペット装置の設定
注: このセットアップする 5 つの基本的なコンポーネントがある: ガラス ピペット、チューブ、注射器、マイクロマニピュレーター、およびバッファー (ハンク)。生理的塩濃度を持つバッファーは、このセットアップにされる可能性があります。
- 45 μ m 径の開放端のテーブル 3ピペット引き手および仕様を使用して周りにホウケイ酸ピペットを引き出します。
注: それは発見された 45 μ m は実験条件下で開くピペットの径に最適なサイズ。開口部のサイズのわずかな変化では、結果を大きく影響することはありません。この番号からの大きい出発がチューブを介してピペットにリンクされている注射器の高さを調整することによって静脈瘤誘導機能して必要があることに注意することが重要だが、圧力値の再調整が必要になります。 - 薄いゴム管にピペットの非引っ張られた端を挿入します。
注: 管壁は、薄くて剛性注射器の高さを直接抵抗が極小でピペットを流れる流体の圧力に比例して確保する流体の抵抗を最小限に抑えるためにする必要があります。チューブは、さらに長さ約 0.6 m の抵抗を最小限に抑えるよりももはやする必要があります。 - ターンができるバルブをコネクタを介して 10 mL プラスチック注射器にチューブのもう一方の端を接続します。
注意: プラスチック製の注射器は、ピペットから流れる想定した圧力の正確な測定を確保するための一定した、測定可能な高さで開催される必要があります。高さ 190 mm が利用されたので、これは最小限の圧力を提供しますが、軸索に下肢を確実に誘導します。他の高さの値は、coverslip 表面からデタッチする細胞を引き起こす圧力場合にも使えます。実験全体で同じ設定を使用することをお勧めします。 - 場所でピペットを保持するマイクロマニピュレーターのねじ上にピペットを挿入します。ネジ、金属、フラット トッピング マニピュレーター アームに付属しましたので、ゴム管が接続されている真上ピペットの非引っ張られた終わりを保持します。角のニューロンを含む coverslips 表面と 45 ° の角度でピペット。
注: ピペットはゴム製管を収縮ことがなく開催することができますので、マニピュレーターを構築する必要があります。マニピュレーターは、セルの範囲内に正確に配置するため x、y、および z 方向のピペットの動きを許可しなければなりません。装置の写真と同様に、グラフィックは (図 1) を下記します。 - 蛍光フィルターをオンに、絞りを開く、目的を通って来る蛍光スポットを見ることができることを確認します。マニピュレーターを使用して、蛍光灯のスポットでチップを並べる細胞培養ディッシュ (35 mm × 10 mm) の高さのすぐ上の位置にピペットを低い位置にピペットを移動します。それは、位置、透過光をオンにし、蛍光をオフにします。
- ピンセットを使用して、1 つの coverslip (を持つ追加ピペットに向かって細胞) 細胞培養プレートから約 2 mL の室温でハンクのバッファーを含む細胞培養ディッシュ。
- スコープに coverslip を含む培養皿を配置します。
- ファインフォーカス ノブと 20 × 対物を使用して、平面に焦点をセル (約 0.4 mm) の上約 4 回転。それは焦点を当てているので、センター、目の部分を通して見た飛行機の左側にピペット チップを配置するには、マニピュレーターを使用します。
注: 樹状突起、予測由来細胞体と同じフレームにあるべきです。下肢軸索を誘導して、内側と遠位軸索細胞体から長い突起を従う必要があります一つ。
4. 伸縮性膜を活用したピペットの圧力の校正
- (直径 500 μ m)、厚み 50 μ m 微細シリコン膜を含むシステムを上記のように正確な同じパラメーターでたばこを吸うピペット装置をセットアップおよび膜の表面に顕微鏡の焦点します。
注: このシステムは、小型圧力値を測定する設計されました、システムについての説明は、10前に公開されています。この測定だけ吹かしの正確な同じ設定を使用する場合、実験を膨化に対して一度実行する必要があります。 - センター間測定 (径 4 μ m) と離れて、10 μ m の微細配列の顕微鏡を焦点します。ストップ バルブを切り、液体をピペットの流れ。共焦点顕微鏡を用いた流体の圧力への応答における膜のたわみを確認します。
- 膜の変位に関連付けられている対応する圧力を決定するための線形モデルを利用します。
注: 一方、最近研究を発見した w のたわみ =-3.143 ± 0.69 μ m が得られた注射器高さ 190 mm、この生産圧力 0.25 ± 0.06 μ m2現在のピペットのセットアップは、生理学的および病理学的範囲内だから、注射器の高さが唯一の決定要因ではありません。ピペットを開く、位置決め (距離と角度) のセル、およびチューブ4,10の柔軟性も相対的なピペット チップを含む同様に、ニューロンに正確な圧力値が他の要因に影響します。
5. 下肢を誘導するために息を切らし
- ピペットは、位置、関心領域を含む平面の顕微鏡を焦点します。右半分は外エリアに息を切らしながら、たばこを吸う区域内イメージング分野 (カメラのライブ キャプチャで見られる) の左半分の細胞およびプロセスを配置します。
注意: ニューロンの樹状突起軸索の広汎な副産物、により、ニューロンのすべてのプロセスが同じたばこを吸う区域内にある可能性がありますはできません。これは、実際にたばこを吸うのローカル効果の検討を可能にするこのシステムの利点の 1 つです。下肢を誘導するために利用することができます膨化の 2 つの種類があります: 長い期間息を切らしとパルス。 -
息を切らしてください。
- 長い期間息を切らし
- 高さ 190 mm 培養神経細胞4を含む coverslip 上で注射器を配置します。明確な形態を明らかに最適化された露光時間で関心のある領域のタイムラプス イメージングを開始します。ベースラインとして 2 秒間隔 (30 秒合計) で、少なくとも 15 のフレームをキャプチャします。間隔は実験に基づいて調整することができます。フレーム 16 で注射器のターンができるストップ バルブを開き、液体 75 フレームのための流れを (150 秒)。75 のフレームでバルブをオフに停止の流れ。ビデオのキャプチャを停止します。
注: このする必要がありますを誘発するニューロンの軸索の下肢 7 9 5 10 s 以内 DIV 古いニューロン フォーム下肢に時間がかかるに対し。
- 高さ 190 mm 培養神経細胞4を含む coverslip 上で注射器を配置します。明確な形態を明らかに最適化された露光時間で関心のある領域のタイムラプス イメージングを開始します。ベースラインとして 2 秒間隔 (30 秒合計) で、少なくとも 15 のフレームをキャプチャします。間隔は実験に基づいて調整することができます。フレーム 16 で注射器のターンができるストップ バルブを開き、液体 75 フレームのための流れを (150 秒)。75 のフレームでバルブをオフに停止の流れ。ビデオのキャプチャを停止します。
- 息を切らしパルス (2 時間)
- 適切な高さ (190 mm) 注射器の位置。タイムラプス イメージングを開始し、少なくとも 15 のフレームをキャプチャ (30 s) 2 秒間隔で。フレーム 16 で注射器のバルブを開きし、液体の流れを (テストする頻度) に応じて 2 s. 待機 5 20 秒後再びバルブを開く前にバルブを閉じます。流体パルスを作成し、合計 150-300 s. 回復期をキャプチャするタイムラプス イメージング 20 分継続期間継続する弁の開閉を繰り返します。
注: 間隔は 10 を超える s、パルスが大幅に少ない下肢を誘発します。20 秒間隔で、パルス4下肢が誘導しないことができます。信頼性の高い、一貫性のある静脈瘤形成を得るためには、注射器の高さべき約 190 mm。 注射器の高さとセルが coverslip 表面からデタッチを開始ポイントに液圧を発生させないでくださいお勧めします。
- 適切な高さ (190 mm) 注射器の位置。タイムラプス イメージングを開始し、少なくとも 15 のフレームをキャプチャ (30 s) 2 秒間隔で。フレーム 16 で注射器のバルブを開きし、液体の流れを (テストする頻度) に応じて 2 s. 待機 5 20 秒後再びバルブを開く前にバルブを閉じます。流体パルスを作成し、合計 150-300 s. 回復期をキャプチャするタイムラプス イメージング 20 分継続期間継続する弁の開閉を繰り返します。
- 10 mL の 70% についての流れによってきれいにセットアップ (ピペット、チューブと注射器) 使用の日の前にエタノールをセットアップ。エタノール洗浄、ハンクのバッファー (バッファー) の 10 mL を流れるプライムその日の使用のためのシステムをセットアップします。仕上げの実験日のクリーンアップとしてセットアップ後一晩汚染物質の増大を防止するエタノール前述。
- 長い期間息を切らし
6. ほめる方法
メモ: 噴き出し試金は、さまざまな「はじめに」で説明されているさまざまなテクニックと組み合わせてすることができます。ここでは、一緒にたばこを吸う試金、高解像度蛍光タイムラプス イメージング、カルシウム イメージング、および回復のアッセイを含む最も頻繁に使用されるコア技術にフォーカスがあります。これらを以下に示します。
-
以下のプロトコルに従うことによって高解像度蛍光タイムラプス イメージングを実施します。
- 油レンズ X 100 と神経細胞内蛍光付けられた蛋白質の動きを追跡します。神経細胞が適切な cDNA 構造をトランスフェクトしました。150 フレームのキャプチャ (合計 300 s) 2 秒間隔で。
注: 場合によっては、複数色のタイムラプス イメージングが同時に 1 つ以上のタグ付きの蛍光タンパク質の動きをイメージするされます。 - ビデオ キャプチャ ソフトウェアを介してまたは ImageJ (NIH) によって kymograph を生成します。
注: 速度と旅行の方向性決定できます、kymograph を使用しています。* 確かに、相馬地方のある方向に注意してキャプチャされます。相馬へ旅行は、逆行性軸索の先端に、相馬から旅行は前向性です。 - 繰り返します噴き出し試金の時に画像のキャプチャを使用してたばこを吸う、または kymograph のこのプロセスを作成できます。
注: ミトコンドリアとシナプス蛋白質の軸索輸送の膨化の効果は最近紙4に示した。
- 油レンズ X 100 と神経細胞内蛍光付けられた蛋白質の動きを追跡します。神経細胞が適切な cDNA 構造をトランスフェクトしました。150 フレームのキャプチャ (合計 300 s) 2 秒間隔で。
-
カルシウム イメージング
- 1 μ L (24 ウェル プレート) 用または 5 mm 蛍光 4 (6 ウェル プレート) 用 3 μ L を追加午前文化の 1 つでメディアも 37 ° C、30 分インキュベートします。
- 1 mL ハンクのバッファーで 2 回洗浄を行う。
注意: 読み込まれたニューロン FITC フィルター セットを緑の蛍光を出します。軌跡は、細胞内カルシウムをかなりの領域を示します。たばこを吸うと組み合わせると、強度 (内部のカルシウム レベルの増加) の増加を見ることができます。
-
静脈瘤の回復
注: たばこを吸う実験直後 20 分回収実験実行できます。- 300 フレームの画像をキャプチャ (1,200 s) 4 秒間隔で。
注: 水溶性 YFP/mCherry/GFP 発現細胞は、イメージング セッションの終わりによって回復の中程度のレベル (50% 未満) を表示する必要があります。軸索の回復は4培養神経細胞の発達段階などの要因の数に依存します。これは、高解像度蛍光イメージングと上記カルシウム イメージングを組み合わせることもできます。
- 300 フレームの画像をキャプチャ (1,200 s) 4 秒間隔で。
結果
息を切らし前、軸索は通常小さな静脈瘤形成を示します。次は私たちの標準圧力 (190 mmH2O 高さ)、多くのビーズのような下肢を開発する軸索開始と息を切らし。下肢の形成は、次の 10 分回復期 (図 2A B) 事前息切れの状態を返す軸索の領域で示すように、部分的に可逆です。回復の長い期間後 (> 20 分)、いくつかの軸索は完全に回復します。急速に、190 mm ステージ上で注射器の正確な位置決めと同様にたばこを吸うピペットの最適位置決めも下肢は生成可能性があります。最適な条件は、若いニューロン (約 7 DIV) 約 5 秒4の軸索静脈瘤形成になります。

図 1: 回路図と写真の装置に息を切らしします。(A) 写真顕微鏡ネタケース。(B) が保有するマニピュレーター ガラス ピペットを示す装置を吹きかけるとゴム管に接続されています。(C) 位相コントラスト フォーカスが右下でピペットの影を示す一次海馬ニューロンの平面画像。ピペット チップを膨化に焦点を当てた細胞平面の (D) のうち。(E) 距離と下肢を誘導するための計算された圧力の模式図。スケールバー = 50 μ m.この図の拡大版を表示するのにはここをクリックしてください。
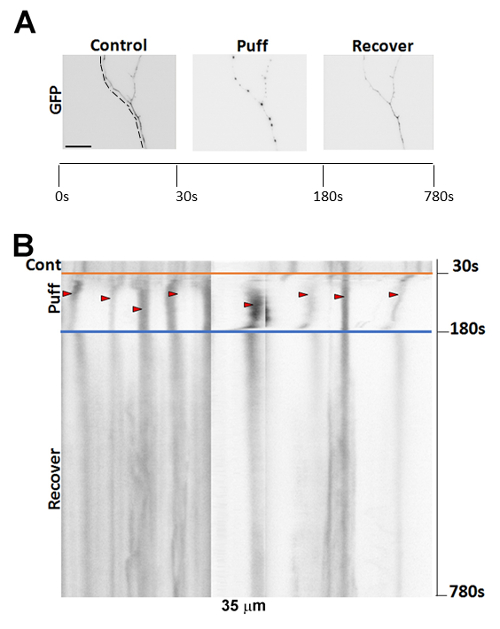
図 2: 次の息を切らし静脈瘤形成の代表的なイメージです。(A) 7DIV、トランスフェクション GFP マウス海馬ニューロン軸索を事前に表示、後 10 分回復期間に続いて、息を切らしてのイメージング。(B) (A) のニューロンのタイムラプス イメージングの Kymograph。赤い矢印は次の 150 を形成している下肢を示す 190 mmH2O を吹かしの s (30 から始まる s)。スケール バー = 15 μ m.この図の拡大版を表示するのにはここをクリックしてください。
| Coverslip コーティング ソリューション | |
| 780 Μ L | 酢酸 acid17 mM 在庫: 50 μ L 酢酸 50 mL の H2O の |
| 200 Μ L | ポリ-D-リジン (0.5 mg/mL 在庫) |
| 20 Μ L | ラット尾コラーゲン (3 mg/mL 在庫) |
| 総容積はコーティングする coverslips の数に基づいて決定されます。 | |
表 1: Coverslip コーティング ソリューションです。Coverslips に対する培養細胞の付着する使用される coverslip コーティング ソリューションを準備するためのレシピを提供します。
| 1 x スライス解離ソリューション (SLD) をフィルター処理、pH 7.4、4 ° C でストアを = | |
| 1 L | ddH2O |
| 82 mM | ナ24 |
| 30 mM | K2その4 |
| 10 mM | HEPES (遊離酸) |
| 10 mM | D-グルコース |
| 5 mM | MgCl2 |
| 0.00% | フェノール レッド (オプション) |
| メディアをめっき (午後、フィルター、4 ° C で保存) | |
| 439 mL | MEM アールの塩 |
| 50 mL | 政府短期証券 |
| 11.25 mL | 20% グルコース |
| 5 mL | ピルビン酸ナトリウム (100 mM) |
| 62.5 Μ L | L-グルタミン (200 mM) |
| 5 mL | ペニシリン/ストレプトマイシン (P/S, 100 x) |
| 保守メディア (MM、フィルター、4 ° C で保存) | |
| 484 mL | Neurobasal |
| 10 mL | B27 50 x サプリメント |
| 1.25 mL | L-グルタミン (200 mM) |
| 5 mL | 100 P/S × |
| すべてのソリューションは、0.2 mm 孔径フィルターを使用して滅菌されています。 | |
表 2: 細胞培養媒体レシピ。プライマリ海馬神経細胞の培養に利用されているメディアを準備するためのレシピを提供します。
| ハンクのバッファー (フィルター、pH 7.4 4 で店を =° C | |
| 150 mM | 塩化ナトリウム |
| 4 mM | KCl |
| 1.2 mM | MgCl2 |
| 1 mM | CaCl2 |
| 10 mg/mL | D-グルコース |
| 20 mM | HEPES |
テーブル 3: ハンクのバッファー調理法。たばこを吸うプロトコルで、住セルイメージ投射の間に利用するバッファーを準備するためのレシピを提供します。
| ピペットのパラメーターを引っ張って | |||||
| 熱 | プル | 速度 | 遅延 | 圧力 | ランプ |
| 501 | 0 | 15 | 1 | 500 | 530 |
表 4: パラメーターを引っ張ってピペットします。直径約 45 μ m にある開口部を取得するピペットの引き手に設定するパラメーターを示します。
ディスカッション
この microbiomechanical のアッセイのプロシージャはまっすぐ進むです。そのすべてのステップは慎重に行われている場合信頼性の高い結果が生成されます。正常なデータ収集の妨げになる場合は、不適切な実行、いくつかの主要な手順があります。重要なステップが始まる上流たばこを吸う刺激の実際に適用しました。細かく、養殖と一次ニューロンの文化のケアが最も重要です。培養神経細胞が健全でない場合彼らが反応しない一貫して、以来、彼ら可能性がありますが既にされて準備万端ストレス。文化、初期セットアップと下肢が誘発される coverslip 表面から細胞の剥離は発生しませんが、根気よく行う必要があります、整合の圧力を提供するためにたばこを吸う装置の校正の下流。セッティングの正確な校正は、ピペットの目詰まり、チューブ、またはバルブの問題のための 1 時間をかかることがあります。皿にセルを配置し、ピペット チップを配置に進む前に最低限の抵抗とピペットから液が流れていることを確認する重要です。設定への変更が懸念している限りでは、血流、パッチク ランプ、その他顕微鏡ベースの計測器、顕微鏡の両側に無料の物理的なスペースに主に依存してたばこを吸う装置一組することができます。
このシステムには、注意が必要な 2 つの本質的な制限があります。設定は一貫してセルに噴き出し流体を介して培養海馬神経細胞の軸索で可逆的な下肢の形成を開始できます。しかし、同じたばこを吸うフィールド内のニューロンに正確な圧力値が同一でないことに注意する重要です。流体の圧力、細胞に影響を与える、微細加工シリコーン膜4,10から圧力負荷測定に基づいて計算、たばこを吸う、フィールドの中央で平均圧力を表します。したがって、正確なたばこを吸う圧力は、たばこを吸うフィールドとフィールドの端のまわりの最低重心で最高です。圧力強度相関発症、サイズ、および下肢の数4を誘発したことを示した.高い圧力はより大きくより速く発症およびより豊富な下肢4で起因しました。私たちの最近の研究では、確実にまだほとんどの軸索4で下肢を引き起こすことができる最小限の圧力 (たばこを吸うピペットの先端で 190 mmHg) を使用しました。この条件の下で若いニューロンの静脈瘤の発症は通常約 5 秒。神経細胞の種類、年齢、および細胞レベル下コンパートメントに依存だけでなく、たばこを吸うフィールド内のニューロンの位置にも左右されますが変化する正確なシステム、息を切らし同じ発症時間の値場合、注意してくださいすることが重要です。ニューロンによって受信されたたばこを吸う圧の変動、にもかかわらず、このアッセイ システムはまだ中枢ニューロンに与える力学的影響を研究するための信頼できる手段を提供します、高い一貫性と再現性の高い実験結果が得られます。
システムの第 2 の制限は、その目詰まりの問題です。生理学的に関連する圧力を達成するためにザ ・ ピペッツの開口部は小さい、45 μ m 周辺です。ただし、プラスチック製のチューブからの残骸を詰まらせる傾向にある小さな開口部、ピペット チップの残骸を顕微鏡下ではっきり見ることができます。これは、ピペットの目詰まりが発生した場合、セットアップを準備中の時間の量を増やします。したがって、すべてのソリューションは、注射器、チューブ、ピペットに置かれる前に慎重にフィルター処理されます。また、先頭とフィルター処理されたハンクのバッファーで洗浄後、一日の終わりに 70% エタノールでたばこを吸うシステムを洗浄することが重要です。潜在的な問題を解決するために複数のピペットをプルしようとしてお勧めします。その解決策は実際に煙を吐いて出て可視化実験を開始する前にピペットを確認が欠かせません。良いたばこを吸うシステムが確立されると、それは通常、その日の残りの部分を持続できます。
ニューロンの文化と組み合わせて、この生体力学的アッセイは、生理学的および病態生理学的条件を模倣した中枢神経形づくりを勉強するためのユニークな機会を提示します。このシステムは圧縮とニューロンのせん断の影響を調べることができます。対照的に、他のシステムの面内ストレッチ5,6,7を検討するため。たばこを吸う区域の中心のニューロンによる受信平均圧力は、私たちのシステム40.25 ± 0.06 nN/μ m2です。細胞のこの圧力は以前利用した走査型力顕微鏡とバルク レオロジー、光誘起変形13,14を識別するために測定される海馬ニューロンの弾性率に匹敵するだけでなく神経突起前縁in vitro でスキャンすることによって測定の成長を変えるため圧力力顕微鏡 (0.27 ± 0.04 μ m2)16。この圧力は、機械的に特定の蛍光細胞サイズリポソーム油微小油滴中 (1.6 ± 0.8 nN/μ m)2,14を用いて測定した E11 胚の間葉系細胞によって自然生成することができます圧力を超えない。
このシステムは既に正常にカルシウム イメージング、パッチク ランプ、電子顕微鏡、閉じた頭蓋骨 mTBI マウス モデル4の細胞解析との組み合わせで使用されています。アッセイは、下肢、内のタンパク質のターン オーバーを調べるだけでなく、勉強蛋白質蛋白質の相互作用を変更する心配する (FRAP) 退色後蛍光回復などの顕微鏡試験と組み合わせても使用ことができます。静脈瘤形成。ことができる任意のメソッド本質的に、このたばこを吸うアッセイ顕微鏡とライブセル イメージング セットアップを使用してペアリングが可能します。このアッセイの多様性あるマイクロメカニックスによるストレスによって神経細胞の形態と機能に関する様々 な効果の基礎となる分子メカニズムの勉強に非常に貴重です。
開示事項
著者が明らかに何もありません。
謝辞
すべての動物実験は、国立機関の健康動物使用のガイドラインに従って実施されています。この作品は、一部に C. 区国立衛生研究所 (R01NS093073 と R21AA024873) からの助成金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Warner Instruments | 64-0702 | for 24-well plate |
| 25 mm coverslips | Fisher Scientific | 12-545-102 | for 6-well plate |
| Acetic acid | Fisher Scientific | A38-212 | |
| Poly-D-lysine | Sigma | P6407 | |
| Rat tail collagen | Roche | 11 179 179 001 | |
| 10X PBS | National Diagnostics | CL-253 | |
| Na2SO4 | Fisher Scientific | S373-500 | |
| K2SO4 | Fisher Scientific | P304-500 | |
| HEPES | Fisher Scientific | BP410-500 | |
| D-glucose | Fisher Scientific | D16-500 | |
| MgCl2 | Fisher Scientific | BP214-500 | |
| NaOH | Fisher Scientific | SS255-1 | |
| Protease enzyme | Sigma | P4032 | |
| FBS | Gibco | 26140 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| L-glutamine | Gibco | 25030081 | |
| Penicillin/Streptomycin 100x (P/S) | Gibco | 15140122 | |
| MEM Earle's Salts | Gibco | 11090 | |
| B27 supplement | Gibco | 17504-044 | |
| Neurobasal | Gibco | 21103-049 | |
| Arabinosylcytosine (Ara-C) | Sigma | 147-94-4 | |
| Opti-MEM media | Gibco | 31985-070 | |
| Lipofectamine 2000 | Invitrogen | 1854313 | transfection reagent |
| Borosilicate rods | World Precision Instruments Inc. | PG52151-4 | for puffing pipette |
| rubber tubing | Fisher Scientific | 14-169-1A | |
| 10cc plastic syringe and plunger | Becton Dickinson | ||
| micromanipulator | Sutter Instruments | ||
| NaCl | Fisher Scientific | S640-3 | |
| KCl | Fisher Scientific | BP366-500 | |
| CaCl2 | Fisher Scientific | C70-500 | |
| Cell culture dish (35 mm x 10 mm) | Corning | 3294 | |
| Fluo-4 AM | Molecular Probes | F14201 | for calcium imaging |
| Mito-YFP construct | Takara Bio Inc. | for cell transfection | |
| YFP-N1 construct | Takara Bio Inc. | for cell transfection | |
| Model P-1000 Flaming/Brown Micropipette puller | Sutter Instruments | ||
| Eclipse TE2000-U Mcroscope | Nikon | ||
| Plan Fluor ELWD 20x lens | Nikon | 062933 | objective |
| Apo TIRF 100x/1.49 oil lens | Nikon | MRD01991 | objective |
参考文献
- Nikić, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 17, 495-499 (2011).
- Yang, J., et al. Regulation of axon degeneration after injury and in development by the endogenous calpain inhibitor calpastatin. Neuron. 80 (5), 1175-1189 (2013).
- Debanne, D. Information processing in the axon. Nat. Rev. Neurosci. 5, 304-316 (2004).
- Gu, Y., Jukkola, P., Wang, Q., Esparza, T., Zhao, Y., Brody, D., Gu, C. Polarity of varicosity initiation in central neuron mechanosensation. J Cell Biol. 216 (7), 2179-2199 (2017).
- Chung, R. S., et al. Mild axonal stretch injury in vitro induces a progressive series of neurofilament alterations ultimately leading to delayed axotomy. J. Neurotrauma. 22 (10), 1081-1091 (2005).
- Staal, J. A., Dickson, T. C., Chung, R. S., Vickers, J. C. Cyclosporin-A treatment attenuates delayed cytoskeletal alterations and secondary axotomy following mild axonal stretch injury. Dev. Neurobiol. 67 (14), 1831-1842 (2007).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Exp. Neurol. 233 (1), 364-372 (2012).
- Donkin, J. J., Vink, R. Mechanisms of cerebral edema in traumatic brain injury: therapeutic developments. Curr Opin Neurol. 23 (3), 293-299 (2010).
- Gardner, A., Jukkola, P., Gu, C. Myelination of rodent hippocampal neurons in culture. Nat Protoc. 7 (10), 1774-1782 (2012).
- Wang, Q., Zhang, X., Zhao, Y. Micromechanical stimulator for localized cell loading: fabrication and strain analysis. J. Micromech. Microeng. 23, 015002(2013).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc. Natl. Acad. Sci. USA. 103 (47), 17759-17764 (2006).
- Elkin, B. S., Azeloglu, E. U., Costa, K. D., Morrison, B. Mechanical heterogeneity of the rat hippocampus measured by atomic force microscope indentation. J. Neurotrauma. 24 (5), 812-822 (2007).
- Franze, K., et al. Neurite branch retraction is caused by a threshold-dependent mechanical impact. Biophys. J. 97 (7), 1883-1890 (2009).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nat. Methods. 11 (2), 183-189 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved