Method Article
Un système de Microbiomechanical pour l’étude de la Formation de varicosité et récupération dans les axones des neurones centraux
Dans cet article
Résumé
Ce protocole décrit une approche fluide pressurisée physiologiquement pertinente pour l’induction rapide et réversible de varicosités dans les neurones.
Résumé
Varicosités axonales sont des structures élargies sur les arbres des axones avec un haut degré d’hétérogénéité. Ils sont présents dans le cerveau avec des blessures ou de maladies neurodégénératives, mais aussi dans le cerveau normal. Nous décrivons ici un système nouvellement créé micromécaniques pour rapide, fiable et réversible induisent des varicosités axonales, ce qui nous permet de comprendre les mécanismes qui régissent la formation varicosité et composition en protéines hétérogènes. Ce système représente un moyen novateur d’évaluer les effets des contraintes de compression et de cisaillement sur les différents compartiments subcellulaires des neurones, différents des autres systèmes in vitro qui portent principalement sur l’effet de l’étirement. Ce qui est important, en raison des particularités de notre système, nous avons récemment fait une découverte montrant que l’application du fluide sous pression peut rapidement et de façon réversible induire axonales varicosités par l’activation d’un canal de potentiel récepteur transitoire. Notre système biomécanique peut être idéalement utilisé en combinaison avec la perfusion de médicaments, l’imagerie de cellules vivantes, imagerie calcique et enregistrement de patch clamp. Par conséquent, cette méthode peut adopter pour l’étude des canaux ioniques mécanosensibles, règlement transport axonal, dynamique du cytosquelette axonal, calcium de signalisation et les changements morphologiques liés à un traumatisme crânien.
Introduction
Varicosité formation, ou gonflement/perler, le long des axones, est une caractéristique importante de la neurodégénérescence observée dans de nombreux troubles ou de lésions du système nerveux central, y compris la sclérose en plaques, maladie d’Alzheimer, de Parkinson et traumatique Brain injury1,2. Malgré les impacts physiologiques importantes de varicosités axonales sur la propagation du potentiel d’action et de la transmission synaptique3, comment naissent les varicosités reste inconnue. Récemment, à un dosage microbiomechanical nouvellement créé sur les neurones hippocampal cultivés contre les rongeurs, nous avons constaté que des stimuli mécaniques peuvent induire des varicosités dans ces neurones avec intriguant très caractéristiques. Tout d’abord, l’induction de la varicosité est rapide (< 10 s) et ce processus est réversible de façon inattendue. Deuxièmement, initiation varicosité dépend de la puissance soufflant la pression : plus la pression, plus vite l’initiation. En troisième lieu, initiation varicosité dépend de l’âge neuronale. Les axones des neurones plus jeunes semblent plus sensibles aux contraintes mécaniques, comparées à celles des neurones plus âgés. Quatrièmement, la forme de varicosités le long des axones des neurones de l’hippocampe, tandis que les dendrites et les segments de l’axone initiale de ces neurones n’afficher aucun changement dans les mêmes conditions de bouffées. Ainsi, notre étude a révélé une nouveauté de la polarité neuronale. Ces résultats avec le système in vitro sont physiologiquement pertinents. À l’aide d’un modèle in vivo pour léger traumatisme crânien léger (TCL), nous a montré que les varicosités axonales élaboré d’une manière multi-focale dans le cortex somatosensoriel des souris immédiatement après le choc de clôture-crâne, conforme à notre in vitro résultats4. Il est important de noter que notre coloration et d’imagerie des souris TCCL fournissent seulement un instantané des changements morphologiques neuronales, depuis l’exécution en vivo imagerie Time-lapse de la morphologie neuronale lors d’un impact mécanique n’est toujours pas réalisable.
Ce système fluide-bouffant nous a permis non seulement de capturer les particularités associées à la formation mécanique varicosité induite par le stress, mais aussi de déterminer le mécanisme sous-jacent. En testant différentes solutions extracellulaires, les bloqueurs et les ouvreurs de différents candidats des canaux ioniques mécanosensibles et de l’électrophysiologie cellulaire, nous avons identifié que le cation potentiel récepteur transitoire canal membre du subfamily V 4 (TRPV4) canal est perméable aux Ca2 + et Na+ et activables par bouffées est principalement responsable de la détection des contraintes mécaniques initiales au cours de la varicosité axonale formation4. Ceci a été confirmé plus loin avec une approche d’élimination directe de siARN. Pris ensemble, ce nouveau système de test, que nous avons mis au point avec la culture de neurones hippocampiques, est très précieux pour l’étude des propriétés de micromécanique des neurones centraux, en particulier en combinaison avec d’autres techniques.
Ce système de micromécanique, que nous avons mis en place est unique et diffère des systèmes déjà existants sous plusieurs aspects importants. Tout d’abord, dans ce système, les neurones expérience hors-plan des contraintes mécaniques dans les formes de compression et de cisaillement. Lors de l’impact mécanique, processus neuronaux restent attachées à la surface de la lamelle couvre-objet et ne bougent pas. Cela diffère des autres systèmes qui occupe principalement la flexion et l’extension dans le plan expérimental (ou tension), par exemple, la déviation des axones groupés comme se déplaçant chaînes5,6 ou l’étirement des axones cultivés sur micromotifs canaux et membranes extensible7,8. En outre, même si les varicosités axonales peuvent également être induites dans ces épreuves comme dans notre système fluide-bouffant, le processus dans ces milieux prend beaucoup plus de temps (à partir de 10 min à plusieurs heures6,7,8) et apparaît irréversibles. Enfin, notre système à l’aide locale fluide soufflant permet l’examen des caractéristiques spatiales de formation varicosité (e.g., dendrites, des épines dendritiques, soma, axonales segments initiaux bornes axonales), outre ses caractéristiques temporelles. Grâce à ce système, nous avons découvert plusieurs fonctionnalités inattendues et uniques de formation de varicosité axonale, surtout un début rapide, lente réversibilité et polarité axon-dendrite.
Le système que nous discutons dans cet article est compatible avec nombreuses techniques de moléculaire et biologie cellulaire. Par exemple, pour étudier les effets du stress mécanique sur la morphologie neuronale et la fonction, il peut être utilisé avec la co-culture de myelin, Time-lapse d’imagerie de fluorescence (FRBR), de la réflexion totale interne et de transfert d’énergie de fluorescence de résonance (FRET) imagerie calcique et enregistrement de patch clamp. Dans cet article, nous nous concentrons sur les composants principaux du système. Culture de neurones hippocampiques, le fluide-bouffées d’installation, une imagerie Time-lapse pour le transport axonal et imagerie calcique sont illustrées étape par étape ci-dessous.
Protocole
Toutes les méthodes décrites ci-dessous ont été approuvés par l’animalier institutionnel et utilisation Comité (IACUC) de l’Université d’Etat de l’Ohio.
1. préparation de la lamelle couvre-objet
- Placez une ou plusieurs cases 12 mm ou 25 mm lamelles dans un bécher de verre contenant de l’acide nitrique 70 % et incuber les lamelles à température ambiante jusqu’au lendemain.
Remarque : Ne pas laver les lamelles de 25 mm dans le bécher de même que les lamelles de 12 mm. Il est préférable de les laver séparément. - Transférer tous les lamelles dans un becher de 4 L rempli de 2.5 L de ddH2O et agiter le bécher contenant les lamelles durant 1 h à 100 tr/min. Utilisez élastiques pour maintenir le bécher au cours de l’agitation. Répéter le rinçage avec frais 2,5 L FD2O quatre fois.
- Lamelles de transfert nettoyé dans un ballon sec avec un couvercle métallique. Faire cuire les lamelles dans un four à 225 ° C pendant 6 h et laissez-les refroidir à température ambiante.
Remarque : La lamelle 25 mm a tendance à casser. Séparer les lamelles une par une et sécher à l’air, puis les faire cuire dans un four. - Rangez les lamelles séchées et nettoyées à la température ambiante dans un récipient en plastique stérilisé jusqu'à son utilisation.
-
Enrober les lamelles comme suit :
- Préparer la solution de revêtement fraîches dans un tube à centrifuger.
- Placez chaque lamelle dans un puits d’une plaque 24 puits (ou 6 puits). Placer 30 (ou 100) µL de solution de revêtement de lamelle (tableau 1) sur une lamelle de 12 mm (ou 25 mm) et un tourbillon. Ajouter 1 mL de sérum physiologique tamponnée au phosphate (PBS, culture de tissus grade) dans le puits. Ces plaques peuvent être utilisées immédiatement ou stockées à 4 ° C dans du PBS stérile pour une semaine.
- Le jour de la dissection, retirez le PBS. Sécher à l’air et placer les plaques sous lumière UV (30W) pour 2-4 h.
Remarque : La dernière étape doit être établie avec la lumière UV sur dans une hotte à flux laminaire culture cellulaire. La porte de la hotte doit être soulevée légèrement pour permettre la circulation d’air pour sécher les lamelles.
2. dissection, Dissociation et la Culture des neurones de l’hippocampe de souris/Rat enceinte
-
Dissection et la dissociation des neurones de l’hippocampe pour la culture
- Décongeler les solution d’enzyme protéase (protéase de 3 mg/mL 23 en SLD, tableau 1) et préchauffer placage médias (tableau 2) à 37 ° C.
- Hippocampe de disséquer et rincer avec SLD, conformément aux méthodes décrites dans la précédente publication14.
Remarque : Quatre hippocampe fournit suffisamment de cellules pour un 24 puits ou une plaque de 6 puits. - Supprimer les SLD, ajouter 2 mL de solution d’enzyme protéase et incuber les échantillons à 37 ° C, 5 % CO2 pendant 15 min.
- Laver les explants d’hippocampe avec 5-10 mL de milieu de placage. Ajouter 5 mL de milieu de placage. Se dissocient des explants hippocampe en cellules individuelles en générant un petit tourbillon à l’aide d’une pipette avec une pointe en plastique de 1 mL. Pipette de haut en bas environ 40 fois, en évitant la formation de bulles d’oxygène, jusqu'à ce que la solution devient trouble et pas de gros morceaux de l’explant demeurent.
Remarque : N’oubliez pas de laisser certains médias au cours de lavages, les explants hippocampe doivent rester immergés dans le milieu pendant tout le processus. - Centrifuger les cellules à 1 125 x g pendant 3 min. Retirer le surnageant avec les cellules immergé dans les médias. Remettre en suspension les cellules dans 145 mL d’électrodéposition de médias. Ajouter 1 mL/puits de la suspension cellulaire à une plaque 24 puits (3 mL/puits d’une plaque 6 puits).
NOTE : 145 mL de médias d’électrodéposition est utilisé pour obtenir une suspension cellulaire qui a une faible densité. Ce volume permettra l’électrodéposition de cellules dans six plaques 24 puits, huit plaques 6 puits ou diverses combinaisons de plaques 24 puits ou 6 selon les expériences effectuées. Chaque puits de la plaque 24 puits aura environ 3 x 104 cellules9. - Incuber les cellules dans les milieux à 37 ° C, 5 % de CO2 pour 2-4 h, puis retirez tous les milieux et remplacez-le par médias de frais d’entretien.
- Après 2 jours (2 jours in vitro, 2DIV), remplacer la moitié des médias avec 2 µM Ara-C (arabinosylcytosine) dissous dans les médias de maintenance qui inhibe la croissance des fibroblastes, des cellules endothéliale et gliales. Après avoir exposé les cellules à l’Ara-C pendant deux jours, remplacez les médias médias de frais d’entretien.
-
Transfection pour la visualisation de la morphologie cellulaire
NOTE : Transfecter les cellules avec des constructions fluorescentes de protéine fluorescente protéine fluorescente verte (GFP), jaune (YFP), mCherry, etc. , pour éclairer la morphologie des neurones individuels.- Diluer les constructions du stock (1 µg/µL) dans les médias de l’Opti-MEM (0,8 µg de l’organisme résultant dans 50 µL de médias Opti-MEM) et vortex. Préparer 1 construction de dilution pour chaque puits.
Remarque : Une plaque 24 puits nécessite 0,8 µg de construction dans 50 µL de médias Opti-MEM. Une plaque 6 puits nécessite 2,4 µg de construction dans les médias de Opti-MEM 150 µL. - Réactif de transfection de liposome-mediated diluées dans médias Opti-MEM (1,5 µL de réactif de transfection dans 50 µL de médias Opti-MEM) et vortex. Préparer 1 dilution de transfection pour chaque puits.
Remarque : Une plaque 24 puits nécessite 1,5 µL de réactif de transfection dans 50 µL de médias Opti-MEM. Une plaque 6 puits nécessite 4,5 µL de réactif de transfection dans 150 µL de médias Opti-MEM. - Préparer un mélange de 1:1 (100 µL) de la construction dans le réactif de médias et de transfection Opti-Mem dans les médias de l’Opti-MEM et vortex. Incuber le mélange à température ambiante pendant 20 min.
Remarque : Chaque puits, il faut environ 100 µL de solution contenant construct, réactif de transfection et Opti-MEM media si vous utilisez une plaque 24 puits (300 µL pour plaque 6 puits). - Retirer la moitié des médias (500 µL pour plaque 24 puits, 1,5 mL pour plaque 6 puits) dans chaque puits et transférer ce média dans un tube conique propre. Gardez ce tube dans l’incubateur. Puis ajouter le mélange de 100 µL (étape 2.2.3) aux autres médias dans le puits. Laissez les cellules à incuber à 37 ° C pendant 20-30 min.
- Pendant l’incubation (étape 2.2.4), ajouter un volume de médias de frais d’entretien aux médias dans le tube à fond conique (étape 2.2.4). Placer le mélange dans le même incubateur (37 ° C et 5 % CO2).
- Après l’incubation, enlever tous les supports contenant la solution de la transfection des puits et remplacez-le par le 1:1 mélange d’ancien et les médias de frais d’entretien dans le tube à fond conique (2.2.5 étape).
Remarque : Selon la taille des constructions, il peuvent que les cellules commencent exprimant dans les 12 h ; pour des constructions plus grandes, 3-4 jours peut être nécessaire avant que l’expression maximale des constructions est atteint.
- Diluer les constructions du stock (1 µg/µL) dans les médias de l’Opti-MEM (0,8 µg de l’organisme résultant dans 50 µL de médias Opti-MEM) et vortex. Préparer 1 construction de dilution pour chaque puits.
3. paramétrage de l’appareil de Pipette bouffées
Remarque : Il y a cinq éléments de base pour ce set-up : la pipette en verre, la tuyauterie, la seringue, le micromanipulateur et la mémoire tampon (Hank). N’importe quel tampon ayant des concentrations de sels physiologiquement pertinentes pourrait être utilisée dans cette configuration.
- Tirez une pipette de borosilicate d’avoir autour de 45 µm-diamètre ouverture pointe utilisant un micropipettes et les spécifications au tableau 3.
Remarque : On a constaté que 45 µm est une taille appropriée pour le diamètre de la pipette d’ouverture dans des conditions expérimentales. Légères variations dans la taille de l’ouverture ne devraient pas affecter sensiblement les résultats. Il est important de noter que les plus grands écarts par rapport à ce nombre devraient encore fonctionne pour l’induction de la varicosité en réglant la hauteur de la seringue qui est liée à la pipette par l’intermédiaire de tubes, mais cela nécessitera un recalibrage de la valeur de la pression. - Insérez l’extrémité non tirée de la pipette dans le tube en caoutchouc mince.
Remarque : La paroi du tube doit être mince et rigide pour minimiser la résistance fluide, en veillant à ce que la hauteur de la seringue est directement proportionnelle à la pression du fluide circulant dans la pipette avec résistance négligeable. Le tube doit être n’est plus que d’environ 0,6 m de longueur pour mieux réduire au minimum la résistance. - Branchez l’autre extrémité du tuyau à une seringue de 10 mL en plastique via un connecteur avec un robinet de tour-able.
Remarque : La seringue en plastique doit être tenue à une hauteur constante et mesurable afin d’assurer une mesure précise de la pression supposée découlant de la pipette. Une hauteur de 190 mm a été utilisée, car cette méthode fournit une pression minimale mais sûrement induit des varicosités dans les axones. Autres valeurs de hauteur peuvent également être utilisés si la pression cause les cellules à se détacher de la surface de la lamelle couvre-objet. Il est recommandé d’utiliser le même paramètre tout au long de l’expérience. - Insérer la pipette dans le haut de la vis de la micromanipulateur pour tenir la pipette en place. Visser la vis nappée métallique, plate, attachée au bras micromanipulateur afin qu’il tient le brin non tiré de la pipette juste au-dessus où le tube de caoutchouc est fixé. Angle de la pipette à un angle de 45° avec la surface des lamelles contenant du neurone.
Remarque : Le micromanipulateur devrait être construit afin que la pipette peut être tenue sans le contraindre le tuyau en caoutchouc. Le micromanipulateur doit accueillir la requête de la pipette dans le x, y et directions z pour le positionner avec précision dans la gamme des cellules. Un graphique, mais aussi une photo de l’appareil est présenté ci-dessous (Figure 1). - Activer un filtre de fluorescence, ouvrir l’ouverture et d’assurer qu'une tache fluorescente peut être vu à travers l’objectif. En utilisant le micromanipulateur, déplacez la pipette dans une position qui est alignée la pointe avec la tache fluorescente et abaissez la pipette dans une position juste au-dessus de la hauteur de l’antenne de culture cellulaire (35 x 10 mm). Une fois en position, allumez la lumière transmise et éteignez de fluorescence.
- Utilisez des pinces, ajouter une lamelle couvre-objet (avec les cellules vers le haut vers la pipette) de la plaque de culture cellulaire à la boîte de Petri de cellule contenant environ 2 mL de tampon de Hank à la température ambiante.
- Placez la boîte de Petri contenant la lamelle à l’étendue.
- À l’aide de la molette de mise au point fine et 20 X, objectif, se concentrer sur un avion environ quatre tours complets au-dessus des cellules (environ 0,4 mm). Utilisez le micromanipulateur pour positionner l’embout de la pipette afin qu’il se concentre et dans le centre, à gauche de l’avion comme on le voit à travers le œil-pièces.
NOTE : Dendrites sont des prévisions qui devraient être dans le même cadre que le corps de la cellule qu’ils proviennent. Pour inciter les varicosités axonales, on doit suivre les projections plus longues du corps cellulaire aux axones médiales et distales.
4. étalonnage de la pression de la Pipette, utilisant un système de membrane extensible
- L’engin de pipette bouffées avec les mêmes paramètres de configuration comme décrit plus haut sur un système contenant une membrane de silicone microfabriques (500 µm de diamètre) et une épaisseur de 50 µm et concentrer le microscope sur la surface de la membrane.
Remarque : Ce système a été conçu pour mesurer les valeurs de pression faible et une explication du système a été publiée avant le10. Cette mesure ne doit être effectué une fois pour souffler des expériences si on utilise le même réglage exact des bouffées. - Concentrer le microscope sur les baies de micropoints (4 µm de diamètre) et 10 µm à part, telle que mesurée entre les centres. Tourner le robinet d’arrêt et laisser le liquide s’écouler de la pipette. Examiner la déformation de la membrane en réponse à la pression du fluide avec un microscope confocal.
- Utiliser un modèle linéaire pour déterminer la pression correspondante associée à la déformation de la membrane.
Remarque : Même si une récente étude qui a révélé une déviation de w =-3.143 ± 0,69 µm ont été utilisées pour 190 mm hauteur de la seringue, cela produit une pression de 0,25 ± 0,06 nN/µm2 à partir de la configuration actuelle de la pipette, qui se situe entre physiologique et pathologique, mais la hauteur de la seringue n’est pas le seul facteur déterminant. Autres facteurs influent sur la valeur de la pression exacte sur les neurones aussi bien, y compris la pipette d’ouverture, positionnement (distance et angle) de l’embout de la pipette par rapport à des cellules et même la flexibilité du tube4,10.
5. soufflant pour induire des varicosités
- Une fois la pipette en position, se concentrent au microscope dans un avion qui contient une zone d’intérêt. Positionnez les cellules et les processus dans la moitié gauche du champ d’imagerie (vu par la capture d’animaux vivants de l’appareil photo) dans la zone de bouffées, tandis que la moitié droite est à l’extérieur de bouffées de zone.
Remarque : En raison de la vaste excroissance des axones et des dendrites des neurones, il est peu probable que tous les processus d’un neurone sont dans la même zone de bouffées. C’est en fait l’un des avantages de ce système, qui permet l’examen de l’effet local du soufflant. Il existe deux types de bouffées qui peuvent être utilisés pour induire des varicosités : bouffées de longue durée et bouffées d’impulsions. -
Soufflant
- Bouffées de longue durée
- Placez la seringue à la hauteur, 190 mm au-dessus de la lamelle couvre-objet contenant des neurones cultivés4. Commencer l’imagerie Time-lapse de la zone d’intérêt avec un temps de pose optimisé révélant la morphologie neuronale clair. Capturer au moins 15 images à un intervalle de s 2 (total de 30 s) comme référence. L’intervalle peut être réglé selon l’expérience. À trame 16, ouvrir la vanne d’arrêt tour-mesure de la seringue et laisser le liquide s’écouler pendant 75 trames (150 s). Membrure 75, fermer la valve afin que le liquide s’écouler s’arrête. Arrêter la capture vidéo.
Remarque : Cela doit induire des varicosités axonales dans les neurones DIV 7-9 dans les 5-10 s, tandis que les neurones plus âgés prennent plus de temps pour les varicosités de forme.
- Placez la seringue à la hauteur, 190 mm au-dessus de la lamelle couvre-objet contenant des neurones cultivés4. Commencer l’imagerie Time-lapse de la zone d’intérêt avec un temps de pose optimisé révélant la morphologie neuronale clair. Capturer au moins 15 images à un intervalle de s 2 (total de 30 s) comme référence. L’intervalle peut être réglé selon l’expérience. À trame 16, ouvrir la vanne d’arrêt tour-mesure de la seringue et laisser le liquide s’écouler pendant 75 trames (150 s). Membrure 75, fermer la valve afin que le liquide s’écouler s’arrête. Arrêter la capture vidéo.
- Impulsion (durée de 2 s) soufflant
- Placer la seringue à la bonne hauteur (190 mm). Commencer l’imagerie Time-lapse et capturer au moins 15 images (30 s) à un intervalle de s 2. À trame 16, ouvrir la vanne de la seringue, puis permettre au liquide de s’écouler avant de fermer le robinet après 2 s. attendre 5-20 s (selon la fréquence à tester) avant d’ouvrir le robinet à nouveau. Répétez l’ouverture et la fermeture de la vanne pour créer des impulsions de fluide et continuer pendant une période totale de 150-300 s. continuer en Time-lapse d’imagerie pendant 20 min pour capturer la phase de récupération.
Remarque : Lorsque l’intervalle est plus long que 10 s, les impulsions provoquent considérablement moins varicosités. À un intervalle de 20 s, aucun varicosités ne peuvent être induites par les impulsions4. Pour obtenir la formation varicosité fiable et cohérente, il est conseillé de la hauteur de la seringue doit être environ 190 mm. hauteur de la seringue et pression du fluide ne devrait pas être invoquée à un point où les cellules commencent à détacher de la surface de la lamelle couvre-objet.
- Placer la seringue à la bonne hauteur (190 mm). Commencer l’imagerie Time-lapse et capturer au moins 15 images (30 s) à un intervalle de s 2. À trame 16, ouvrir la vanne de la seringue, puis permettre au liquide de s’écouler avant de fermer le robinet après 2 s. attendre 5-20 s (selon la fréquence à tester) avant d’ouvrir le robinet à nouveau. Répétez l’ouverture et la fermeture de la vanne pour créer des impulsions de fluide et continuer pendant une période totale de 150-300 s. continuer en Time-lapse d’imagerie pendant 20 min pour capturer la phase de récupération.
- Avant une journée d’utilisation, nettoyez le set-up (pipette, tubes et seringue) en s’écoulant sur 10 mL 70 % éthanol à travers la mise en place. Suite à l’éthanol laver, débit 10 mL de tampon de Hank (ou tampon souhaité) par le biais de la mise en place pour amorcer le système pour une utilisation de la journée. Après des expériences de finitions pour la journée, nettoyer l’installation comme décrit précédemment avec l’éthanol pour prévenir la croissance des contaminants du jour au lendemain.
- Bouffées de longue durée
6. méthodes des compliments
Remarque : Le test de bouffées peut être combiné avec une variété de techniques différentes qui sont discutées dans la section Introduction. Ici, l’accent est sur les techniques de base qui sont plus fréquemment utilisés ainsi que le dosage de bouffées, y compris la fluorescence haute résolution timelapse imagerie, imagerie calcique et des tests de récupération. Elles sont examinées ci-dessous.
-
Réaliser une imagerie de Time-lapse fluorescente en suivant le protocole ci-dessous
- Suivre le mouvement des protéines fluorescent-étiquetées dans les neurones avec un 100 X lentille de pétrole. Les neurones sont transfectées avec la construction de l’ADNc approprié. Capture de 150 cadres (total 300 s) avec un intervalle de s 2.
Remarque : Parfois, les Time-lapse imagerie multiple-couleur est effectué pour le déplacement de plus d’une protéine fluorescent-étiquetée d’images simultanément. - Générer un kymographes par l’intermédiaire de la vidéo logiciel de capture ou par ImageJ (NIH).
Remarque : La vitesse et la directivité du voyage peuvent être déterminées à l’aide de la kymographes. * Être sûr de faire attention au sens du soma se trouve dans la région capturé. Voyage vers le soma est rétrograde, tandis que les voyages loin le soma jusqu'à l’extrémité axonale est antérograde. - Répétez ce processus à la suite de bouffées, ou kymographes peuvent être créé à l’aide de la capture de l’image pendant le test de bouffées.
Remarque : Les effets de souffler sur le transport axonal des mitochondries et des protéines synaptiques apparaissaient dans un récent document4.
- Suivre le mouvement des protéines fluorescent-étiquetées dans les neurones avec un 100 X lentille de pétrole. Les neurones sont transfectées avec la construction de l’ADNc approprié. Capture de 150 cadres (total 300 s) avec un intervalle de s 2.
-
Imagerie calcique
- Ajouter 1 µL (pour une plaque 24 puits) ou 3 µL (pour une plaque de 6 puits) de 5 mM Fluo-4 h à la culture médias dans un puits et incuber à 37 ° C pendant 30 min.
- Laver les cellules deux fois avec un tampon de 1 mL Hank.
NOTE : Chargé de neurones émettent une fluorescence verte grâce à un ensemble de filtre FITC. Locus correspondent aux régions de calcium appréciable au sein de la cellule. Lorsqu’il est combiné avec bouffées, une augmentation de l’intensité (augmentation des taux de calcium interne) sont visibles.
-
Récupération de varicosité
NOTE : Immédiatement après une expérience en haletant, une expérience de récupération 20 min peut être menée.- Capturer des images pour 300 images (1 200 s) avec un intervalle de s 4.
Remarque : Une cellule transfectée avec soluble YFP/mCherry/GFP devrait montrer un niveau modéré (moins de 50 %) de récupération à la fin de la séance d’imagerie. Axonale rétablissement dépend de plusieurs facteurs, tels que le stade de développement des neurones cultivés4. C’est cumulable également avec une imagerie de fluorescence et d’imagerie calcique décrit ci-dessus.
- Capturer des images pour 300 images (1 200 s) avec un intervalle de s 4.
Résultats
Avant de souffler, les axones présentent normalement peu formation varicosité. Suivant soufflant avec notre pression standard (hauteur de2O 190 mmH), le début des axones à développer de nombreuses perles comme varicosités. La formation de varicosités est partiellement réversible, comme illustré par les régions de l’axone, retournant à leur état préalablement gonflé après une période de récupération de 10 min (Figure 2A-B). Après une longue période de récupération (> 20 min), certains axones récupérer complètement. Positionnement suboptimal des bouffées de pipette et le positionnement précis de la seringue à 190 mm au-dessus de la scène ne peut pas générer des varicosités rapidement. Conditions optimales devraient aboutir à la formation de la varicosité dans les axones des neurones jeunes (environ 7 DIV) dans environ 5 s4.

Figure 1 : Schéma et photo de bouffées appareil. (A) photographies montrant la configuration globale de microscope. (B) appareil montrant la pipette en verre tenue par le micromanipulateur et connecté au tuyau en caoutchouc. (C) Phase de contraste des images en mettant l’accent en avion des neurones de l’hippocampe primaires montrant l’ombre de pipette en bas droite. (D) hors de la cellule plan axé sur les bouffées de pipette. (E) schéma des distances et des pressions calculées pour induire des varicosités. Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
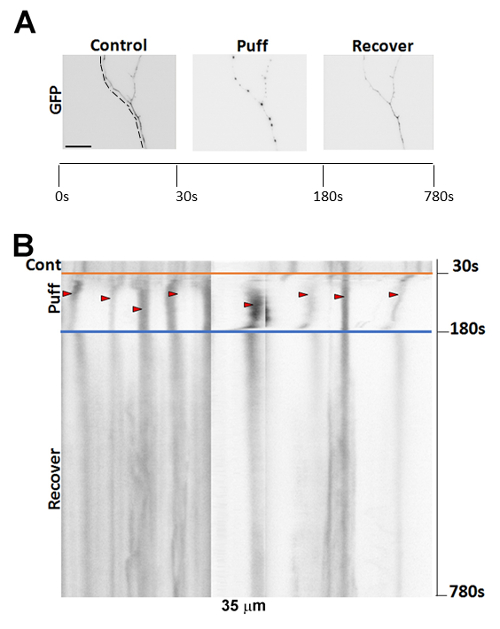
Figure 2 : Des images représentatives de formation varicosité suite soufflant. (A) imagerie de 7DIV, neurones hippocampal de GFP transfectée souris montrant un axone pré et post-souffler ainsi qu’après une période de récupération de 10 min. (B) kymographes d’imagerie Time-lapse du neurone en (A). Flèches rouges indiquent les varicosités qui se sont formées suite 150 s de 190 mmH2O bouffées (commençant à 30 s). Echelle = 15 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Lamelle couvre-objet solution d’enrobage | |
| 780 ΜL | Stock de mM acid17 acétique : 50 µL d’acide acétique dans 50 mL d’H2O |
| 200 ΜL | Poly-D-lysine (0,5 mg/mL de bouillon) |
| 20 ΜL | Collagène de queue de rat (3 mg/mL de bouillon) |
| Le volume total est déterminé en fonction du nombre de lamelles à revêtir. | |
Tableau 1 : solution de revêtement lamelle. Donne la recette pour la préparation de la solution de revêtement de lamelle couvre-objet utilisée pour faire adhérer les cellules cultivées à des lamelles couvre-objet.
| 1 solution x tranche dissection (SLD), filtrée, pH = 7,4, conserver à 4 ° C | |
| 1 L | ddH2O |
| 82 mM | Na2SO4 |
| 30 mM | K2SO4 |
| 10 mM | HEPES (acide libre) |
| 10 mM | D-glucose |
| 5 mM | MgCl2 |
| 0,00 % | Rouge de phénol (facultatif) |
| Médias de placage (PM, filtrer, conserver à 4 ° C) | |
| 439 mL | Sels de MEM Earle |
| 50 mL | FBS |
| 11,25 mL | 20 % D-glucose |
| 5 mL | Pyruvate de sodium (100 mM), |
| 62,5 ΜL | L-glutamine (200 mM) |
| 5 mL | La pénicilline/streptomycine (P/S, 100 x) |
| Médias de maintenance (MM, filtre, conserver à 4 ° C) | |
| 484 mL | Neurobasal |
| 10 mL | Supplément de 50 x B27 |
| 1,25 mL | L-glutamine (200 mM) |
| 5 mL | 100 x P/S |
| Toutes les solutions sont stérilisées à l’aide d’un filtre avec la taille des pores 0,2 mm. | |
Tableau 2 : recettes de milieux de culture de cellules. Fournit les recettes pour la préparation du support utilisé dans la mise en culture de cellules primaires de neurones hippocampiques.
| Tampon de Hank (filtre, pH = 7,4, conserver à 4° C | |
| 150 mM | NaCl |
| 4 mM | KCl |
| 1. 2 mM | MgCl2 |
| 1 mM | CaCl2 |
| 10 mg/mL | D-glucose |
| 20 mM | HEPES |
Tableau 3 : recette de tampon de Hank. Donne la recette pour la préparation de la mémoire tampon utilisée dans le protocole haletant et en imagerie de cellules vivantes.
| Pipetter tirant des paramètres | |||||
| Chaleur | Tirez | Vitesse | Delay | Pression | Rampe |
| 501 | 0 | 15 | 1 | 500 | 530 |
Tableau 4 : Pipetter tirant paramètres. Fournit les paramètres à définir sur l’extracteur de pipette afin d’obtenir une ouverture qui est autour de 45 µm de diamètre.
Discussion
La procédure de ce test de microbiomechanical est simple. Il va produire des résultats fiables, si toutes ses étapes sont réalisées avec soin. Il y a plusieurs étapes clés qui, si mal exécutée, vont entraver la collecte de données réussie. Les étapes critiques commencent en amont de la demande réelle du stimulus bouffée. Dissection minutieuse, culture et soins de la culture de neurones primaires sont primordiaux. Si les neurones en culture ne sont pas en bonne santé, ils ne réagiront pas systématiquement, car ils pourraient avoir déjà été amorcées pour le stress. En aval de la culture, l’installation initiale et l’étalonnage de l’appareil bouffées de fournir une pression constante, ce qui induira des varicosités mais ne causera pas de détachement des cellules de la surface de la lamelle couvre-objet, doit être exécutée avec patience. Un étalonnage précis de l’installation peut prendre 1 h en raison de colmatage de la pipette, une tubulure ou problèmes de vanne. Il est essentiel de veiller à ce que le liquide s’écoule la pipette avec une résistance minimale avant d’aller de l’avant avec la mise en place des cellules dans le plat et positionnement de l’embout de la pipette. Autant que les modifications apportées à la mise en place sont concernées, on peut appairer l’engin bouffées avec perfusion, serrage patch et tout autre axée sur le microscope instrument, pour la plupart dépendent de l’espace physique libre sur les côtés du microscope.
Ce système a deux limites intrinsèques qui ont besoin d’attention. La mise en place peut déclencher systématiquement la formation de varicosités réversibles dans les axones des neurones de l’hippocampe cultivés à travers bouffée fluide aux cellules. Cependant, il est important de noter que les valeurs de pression exacte sur les neurones dans le même champ bouffée ne sont pas identiques. La pression du fluide ayant un effet sur les cellules, calculé sur mesure la pression de la charge d’un microfabriques silicone membrane4,10représente la pression moyenne dans le centre du champ bouffée. Ainsi, la pression exacte bouffée est le plus élevé dans le centre du champ bouffée et le plus bas sur le pourtour du champ. Nous avons montré que les corrélats de la force de pression avec l’apparition, la taille et le nombre de varicosités induit4. Une pression plus élevée a entraîné une installation plus rapide, plus grande et plus abondante varicosités4. Dans nos études récentes, nous avons utilisé une pression minimale (190 mmHg à la pointe de pipette bouffée) qui peut induire encore fiable de varicosités dans la plupart des axones4. Dans ces conditions, apparition de varicosité pour jeunes neurones est normalement d’environ 5 s. Il est important de noter qu’avec exactement le même bouffées de système, la valeur de l’époque d’apparition peut varier, qui non seulement dépend du type de neurones, âge et compartiment subcellulaire, mais peut aussi être influencé par la position du neurone dans le domaine de bouffées. Malgré la variation de pression bouffée reçue par les neurones, ce système de dosage encore offre un moyen fiable pour l’étude des effets mécaniques sur les neurones centraux et donne des résultats expérimentaux très cohérentes et reproductibles.
La deuxième limitation du système est son problème de colmatage. Pour atteindre la pression physiologiquement pertinente, l’ouverture des pipettes est faible, autour de 45 μm. Toutefois, la petite ouverture a tendance à boucher avec des débris de la tubulure en plastique et les débris dans l’embout de la pipette est visible au microscope. Cela augmente la quantité de temps à préparer la mise en place, dans le cas d’une obstruction de la pipette. Par conséquent, toutes les solutions sont soigneusement filtrées avant d’être mis dans la seringue, tubulure et pipette. Il est également important de laver le système bouffée avec éthanol à 70 % au début et fin de la journée, suivie par un lavage avec un tampon de Hank filtrée. Pour résoudre le problème de colmatage éventuel, nous vous suggérons essayant de tirer les pipettes multiples. Il est essentiel de confirmer que la solution est effectivement soufflée hors de la pipette par visualisation avant de commencer les expériences. Dès qu’un bon système de bouffées est établi, il peut habituellement durer pour le reste de la journée.
Ce test biomécanique, combiné avec la culture de neurones, offre une occasion unique pour l’étude de neurone central mécanosensibilité imitant les conditions physiologiques ou physiopathologiques. Ce système nous permet d’examiner les effets de compression et de cisaillement sur les neurones. En revanche, autres systèmes ont été utilisés pour examiner dans le plan étirement5,6,7. La pression moyenne reçue par les neurones dans le Centre des zones bouffées est 0,25 ± 0,06 nN/µm2 dans notre système4. Cette pression exercée sur les cellules est comparable à l’élasticité des neurones de l’hippocampe, telle que mesurée précédemment utilisant balayage force microscopie et vrac rhéologie, afin d’identifier optiquement induite par déformation13,14, ainsi que les pressions utilisées pour modifier la croissance des neurites bords d’attaque in vitro, mesurée par analyse forcent microscopie (0,27 ± 0,04 nN/µm2)16. Cette pression ne dépasse pas la pression qui peut être générée naturellement par les cellules mésenchymateuses dans un embryon de E11, mesurée à l’aide d’huile de taille cellule fluorescente mécaniquement spécifiques gouttelettes (1,6 ± 0,8 nN/µm)2,14.
Ce système a déjà été utilisé avec succès en combinaison avec l’imagerie calcique, patch de serrage, microscope électronique et analyse cellulaire d’un crâne fermé TCCL souris modèle4. Le dosage aussi peut être utilisé en combinaison avec des expériences axées sur le microscope, telles que la récupération de fluorescence après photoblanchiment (FRAP), pour examiner la protéine roulement au sein de varicosités, mais aussi de vous inquiétez pour étudier les cas de modification des interactions protéine-protéine au cours de la formation de la varicosité. Essentiellement, toute méthode qui peut être fait à l’aide d’un microscope et une mise en place de l’imagerie de cellules vivantes peut être couplé avec ce dosage bouffée. La polyvalence de ce test est extrêmement utile pour étudier les mécanismes moléculaires qui sous-tendent les divers effets sur la morphologie neuronale et fonctions par le stress de la micromécanique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Toutes les expériences sur des animaux ont été menées selon le National Institutes of Health Animal usage Guidelines. Ce travail a été soutenu en partie par des subventions du National Institutes of Health (R01NS093073 et R21AA024873) de C. Gu.
matériels
| Name | Company | Catalog Number | Comments |
| 12 mm coverslips | Warner Instruments | 64-0702 | for 24-well plate |
| 25 mm coverslips | Fisher Scientific | 12-545-102 | for 6-well plate |
| Acetic acid | Fisher Scientific | A38-212 | |
| Poly-D-lysine | Sigma | P6407 | |
| Rat tail collagen | Roche | 11 179 179 001 | |
| 10X PBS | National Diagnostics | CL-253 | |
| Na2SO4 | Fisher Scientific | S373-500 | |
| K2SO4 | Fisher Scientific | P304-500 | |
| HEPES | Fisher Scientific | BP410-500 | |
| D-glucose | Fisher Scientific | D16-500 | |
| MgCl2 | Fisher Scientific | BP214-500 | |
| NaOH | Fisher Scientific | SS255-1 | |
| Protease enzyme | Sigma | P4032 | |
| FBS | Gibco | 26140 | |
| Sodium pyruvate | Gibco | 11360-070 | |
| L-glutamine | Gibco | 25030081 | |
| Penicillin/Streptomycin 100x (P/S) | Gibco | 15140122 | |
| MEM Earle's Salts | Gibco | 11090 | |
| B27 supplement | Gibco | 17504-044 | |
| Neurobasal | Gibco | 21103-049 | |
| Arabinosylcytosine (Ara-C) | Sigma | 147-94-4 | |
| Opti-MEM media | Gibco | 31985-070 | |
| Lipofectamine 2000 | Invitrogen | 1854313 | transfection reagent |
| Borosilicate rods | World Precision Instruments Inc. | PG52151-4 | for puffing pipette |
| rubber tubing | Fisher Scientific | 14-169-1A | |
| 10cc plastic syringe and plunger | Becton Dickinson | ||
| micromanipulator | Sutter Instruments | ||
| NaCl | Fisher Scientific | S640-3 | |
| KCl | Fisher Scientific | BP366-500 | |
| CaCl2 | Fisher Scientific | C70-500 | |
| Cell culture dish (35 mm x 10 mm) | Corning | 3294 | |
| Fluo-4 AM | Molecular Probes | F14201 | for calcium imaging |
| Mito-YFP construct | Takara Bio Inc. | for cell transfection | |
| YFP-N1 construct | Takara Bio Inc. | for cell transfection | |
| Model P-1000 Flaming/Brown Micropipette puller | Sutter Instruments | ||
| Eclipse TE2000-U Mcroscope | Nikon | ||
| Plan Fluor ELWD 20x lens | Nikon | 062933 | objective |
| Apo TIRF 100x/1.49 oil lens | Nikon | MRD01991 | objective |
Références
- Nikić, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat. Med. 17, 495-499 (2011).
- Yang, J., et al. Regulation of axon degeneration after injury and in development by the endogenous calpain inhibitor calpastatin. Neuron. 80 (5), 1175-1189 (2013).
- Debanne, D. Information processing in the axon. Nat. Rev. Neurosci. 5, 304-316 (2004).
- Gu, Y., Jukkola, P., Wang, Q., Esparza, T., Zhao, Y., Brody, D., Gu, C. Polarity of varicosity initiation in central neuron mechanosensation. J Cell Biol. 216 (7), 2179-2199 (2017).
- Chung, R. S., et al. Mild axonal stretch injury in vitro induces a progressive series of neurofilament alterations ultimately leading to delayed axotomy. J. Neurotrauma. 22 (10), 1081-1091 (2005).
- Staal, J. A., Dickson, T. C., Chung, R. S., Vickers, J. C. Cyclosporin-A treatment attenuates delayed cytoskeletal alterations and secondary axotomy following mild axonal stretch injury. Dev. Neurobiol. 67 (14), 1831-1842 (2007).
- Tang-Schomer, M. D., Johnson, V. E., Baas, P. W., Stewart, W., Smith, D. H. Partial interruption of axonal transport due to microtubule breakage accounts for the formation of periodic varicosities after traumatic axonal injury. Exp. Neurol. 233 (1), 364-372 (2012).
- Donkin, J. J., Vink, R. Mechanisms of cerebral edema in traumatic brain injury: therapeutic developments. Curr Opin Neurol. 23 (3), 293-299 (2010).
- Gardner, A., Jukkola, P., Gu, C. Myelination of rodent hippocampal neurons in culture. Nat Protoc. 7 (10), 1774-1782 (2012).
- Wang, Q., Zhang, X., Zhao, Y. Micromechanical stimulator for localized cell loading: fabrication and strain analysis. J. Micromech. Microeng. 23, 015002(2013).
- Lu, Y. B., et al. Viscoelastic properties of individual glial cells and neurons in the CNS. Proc. Natl. Acad. Sci. USA. 103 (47), 17759-17764 (2006).
- Elkin, B. S., Azeloglu, E. U., Costa, K. D., Morrison, B. Mechanical heterogeneity of the rat hippocampus measured by atomic force microscope indentation. J. Neurotrauma. 24 (5), 812-822 (2007).
- Franze, K., et al. Neurite branch retraction is caused by a threshold-dependent mechanical impact. Biophys. J. 97 (7), 1883-1890 (2009).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nat. Methods. 11 (2), 183-189 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon