Method Article
Фталевая кислота Эстер связывания ДНК Aptamer выбор, характеристика и применение к электрохимическим Aptasensor
В этой статье
Резюме
Протокол для отбора в пробирке и характеризация конкретных групп фталевой кислоты Эстер связывания ДНК аптамеры представлен. Применение выбранного aptamer в электрохимических aptasensor также входит в стоимость номера.
Аннотация
Фталекислотные эфиры (Паэс) areone основных групп стойких органических загрязнителей. Конкретных групп обнаружения Паес весьма желательно из-за быстрого роста конгенеров. ДНК аптамеры чаще применялись как признание элементов на биосенсор платформах, но выбор аптамеры целей высокой гидрофобностью малые молекулы, такие как Паес, редко сообщается. Эта работа описывает метод, основанный на шарик, предназначенные для выбора конкретной группе аптамеры ДНК для Паес. Амино-группы функционализированных Дибутилфталат (DBP-NH2) как цель якорь был синтезирован и иммобилизованных на эпоксидной активированный агарозы бусы, позволяя отображения группы фталиевый Эстер на поверхности иммобилизации матрицы, и Поэтому выбор конкретной группе связующих. Константы диссоциации aptamer кандидатов определяется количественным полимеризации цепной реакции в сочетании с магнитной сепарации. Относительный близость и избирательности аптамеры для других Паес были определены конкурентоспособные анализов, где aptamer кандидатов были предварительно ограниченной в DBP-NH2 придают магнитные бусы и выпущен в надосадке после инкубации с протестированных Паес или других потенциальных помех веществ. Конкурентоспособных assay был применен потому, что она предоставила снисходительный сродство сравнения среди Паес, которые не функциональными группами для иммобилизации поверхности. Наконец мы продемонстрировали изготовление электрохимическая aptasensor и использовал его сверхчувствительная и селективного выявления бис(2-этилгексил) фталат. Этот протокол обеспечивает понимание aptamer открытие других гидрофобные малых молекул.
Введение
Наряду с быстрого экономического развития ускорение индустриализации и городского строительства, загрязнения окружающей среды является более суровым, чем когда-либо. Типичными загрязнителями окружающей среды включают в себя ионов тяжелых металлов, токсинов, антибиотиков, пестицидов, эндокринные расстройства и стойких органических загрязнителей (СОЗ). Помимо ионов металлов и токсинов, других загрязнителей являются малые молекулы, что довольно часто состоят из различных родственных соединений. Например, наиболее токсичных СОЗ включают полихлорированных дифенилов (ПХД), полициклические ароматические углеводороды (ПАУ), полибромированные дифенил эфиров (ПБДЭ), полихлорированных дибензо p диоксинов (ПХДД), полихлорированных дибензофуран (ПХДФ) и фталиевый кислоты эфиры (Паэс)1,2, которые состоят из многих соединений. Малые молекулы обнаружения главным образом выполнялись хроматография/масс спектрометрии-методы на основе из-за их разнообразие приложений3,4,5,6. Для занятия обнаружений методы, основанные на антитела были недавно развитых7,8,9. Однако так как эти методы являются весьма специфическими для определенных конгенеров, необходимо выполнить несколько тестов. Более серьезным является что роман конгенеров растут так быстро, что их антител не могут быть созданы во времени. Таким образом разработка биосенсоров конкретных групп для контроля общего уровня всех соединений в одном тесте может предоставить бесценную метрики для оценки состояния загрязнения окружающей среды.
Недавно нуклеиновые кислоты аптамеры широко применяется как признание элементов в различных платформах biosensing из-за их возможности признавая широкий спектр задач, от ионов и малых молекул белков и клетки10,11 ,12. Аптамеры определяются через в vitro методом систематической эволюции лигандов, экспоненциальное обогащения (SELEX)13,14. SELEX начинается с случайных синтетических однорядная олигонуклеотида библиотеку, которая содержит приблизительно 1014-1015 последовательности. Размер случайного библиотеки обеспечивает разнообразие структур кандидат РНК и ДНК. Типичный процесс SELEX состоит из нескольких раундов обогащения до тех пор, пока библиотека обогащается в последовательности с высоким сродством и специфичностью к целевому объекту. Затем применяется окончательный обогащенного бассейн, и константы диссоциации (dK) и избирательности против потенциал, мешая веществ определяются различные методы фильтрации привязки, аффинной хроматографии, поверхности плазмон резонанс (СРП), и т.д. 15
Из-за крайне плохой растворимостью в воде и отсутствие функциональными группами для иммобилизации поверхности теоретически трудно aptamer отбора СОЗ. Значительных успехов для SELEX ускорили открытие аптамеры. Однако выбор конкретной группе аптамеры СОЗ пока не сообщалось. Пока только аптамеры PCB-связывания ДНК с высокой точностью для некоторых конгенеров были определены16. Паес используются главным образом в поливинилхлоридных материалов, изменяя Поливиниловый хлорид из жесткого пластика для эластичного пластика, таким образом в качестве пластификатора. Некоторые Паес были определены как эндокринные расстройства, могут нанести серьезный ущерб печень и почки, снижения подвижности мужской спермы и может привести к морфологии аномальной спермы и яичка рака17. Соединение - ни аптамеры PAE-привязки конкретной группе не поступало.
Цель этой работы заключается в том, предоставить представитель протокола для выбора конкретной группе аптамеры ДНК для высокой гидрофобностью малых молекул, таких как Паес, представитель группы СОЗ. Мы также продемонстрировать применение выбранного aptamer для обнаружения загрязнения окружающей среды. Этот протокол обеспечивает руководство и понимание для обнаружения aptamer других гидрофобные малых молекул.
протокол
1. Библиотека и конструкции праймера и синтез
-
Дизайн первоначальной библиотеки и грунтовки.
Библиотека (0бассейн): 5'-TCCCACGCATTCTCCACATC-N40-CCTTTCTGTCCTTCCGTCAC-3'
Вперед грунтовка (ПС): 5'-TCCCACGCATTCTCCACATC-3'
Фосфорилированных обратный грунтовка (PO4- RP): 5'-PO4- GTGACGGAAGGACAGAAAGG-3' - Синтезировать0бассейн, FP и PO4- RP, используя стандартные фосфорамидит химия18,19,20и очистить все ННО, стандартных высокопроизводительных жидкостной хроматографии (ВЭЖХ)21.
- Воссоздания0бассейн, FP и PO4- RP в классе нуклеиназы бесплатная вода в 100 мкм, аликвота и хранить их в -20-80 ° c на срок до одного года.
Примечание: Настоятельно рекомендуется хранить бассейн0, FP и PO4- RP в 10-20 мкл аликвоты, чтобы избежать возможного перекрестного загрязнения.
2. синтезировать целевого объекта привязки и его иммобилизации на эпоксидной активированный агарозы шарик
- Синтезировать аминогруппы функционализированных Дибутилфталат (DBP-NH2) как цель привязки.
Примечание: Экспериментальный детали на синтез и характеристика DBP-NH2 были описаны в литературе22. - Подготовьте якорь целевых акций решения в среде, подходящие для целевого растворимость. Для этого исследования, подготовить 100 мм DBP-NH2 Стоковый раствор в диметилсульфоксида (ДМСО) и хранить решение в 4-20 ° c на срок до одного года.
- Иммобилизации DBP-NH2 на эпоксидной активированный агарозы бусины согласно измененный Протокол от производителя.
- Весят, 0,1 г, Порошок лиофилизированный эпоксидно активированный агарозы бисера и приостановить его в дистиллированной воде. Вымойте среднего за 1 ч с помощью 20 мл дистиллированной воды, добавить в нескольких аликвоты. Мыть в среду с 0,2 М Na2CO3 (рН 12).
Примечание: Средние набухает сразу после добавления воды в нее. - DBP-NH2 (46.7 мг, 0,15 ммоль) Растворите в 500 мкл муфта буферу (0,2 М Na2CO3 ).
- Смешайте сцепления раствора, содержащего лиганда с носителя. Используйте шейкер на 5 об/мин за 48 ч при комнатной температуре.
- Повторите мойки продукта три раза, последовательно с использованием буфера ацетата 0,1 М (0.5 М NaCl, pH 4.5) и 0,2 М карбонат буфера (0.5 М NaCl, рН 12) в каждой стирки. Вымойте и приостановить продукт в воде, чтобы сделать окончательный объем 500 мкл.
- Храните продукт на 4 ° C перед использованием.
- Подтверждение успешной целевой иммобилизации, элементного анализа.
- Весят, 0,1 г, Порошок лиофилизированный эпоксидно активированный агарозы бисера и приостановить его в дистиллированной воде. Вымойте среднего за 1 ч с помощью 20 мл дистиллированной воды, добавить в нескольких аликвоты. Мыть в среду с 0,2 М Na2CO3 (рН 12).
3. SELEX
- Подготовка 500 мл буфера привязки PAE в ультра-чистой воде или нуклеиназы свободный класс с 20 мм Tris· HCl, 100 мм NaCl, 2 мм MgCl2, 5 мм KCl, CaCl 1 мм2, 1% polyoxyethy-lene (20) sorbaitan monolaurate и 0,03% неионные поверхности активного агента (рН 7,9). Фильтр буфер через фильтр нитроцеллюлоза 0,22 мкм стерильным и храните его при температуре выше 20 ° C для месяцев.
Примечание: Очень важно поддерживать хорошее рассеивание статус Паес PAE привязки буфера. Несколько типов поверхностно-активных веществ необходимы для повышения растворимости Паес в водном растворе. Однако количество ПАВ следует к минимуму, чтобы избежать образования мицелл ПАВ, инкапсулирующие PAE молекул. Не ионные, веществом легко осадок при температурах ниже 20 ° C, и поэтому буфер следует хранить при температуре выше 20 ° C. - Развести 10 µL 100 мкм бассейн0(~1.0 нмоль 10 последовательностей15 14-10) в 490 мкл буфера привязки PAE. Тепла аликвоты0 бассейн (5 × 100 мкл) в тонкостенных пробирок в наборе ванна воды на 95 ° C в течение 10 минут место трубы на льду на 5 мин и впоследствии инкубировать трубы для 5 мин при комнатной температуре (~ 25 ° C в этой работе).
- Первый раунд отбора: инкубации пула0 и DBP−NH2−coated среднего.
- Вымойте 200 мкл DBP−NH2−coated среды три раза с 500 мкл буфера привязки PAE. Смесь DBP−NH2−coated среде с бассейном0 и инкубировать смеси при комнатной температуре в течение 1 ч при мягкий встряхивания.
- Отдельные DBP−NH2−coated среднего связаны с аптамеры из несвязанных ННО ультрафильтрации обыкновенного ультрафильтрации трубка с молекулярной отсечения 100 кДа. Вымойте среднего три раза с 500 мкл буфера привязки PAE и центрифуги на 9,168 g × 10 мин при 4 ° C.
- Первый раунд отбора: элюции aptamer из DBP−NH2−coated среды.
- 50 мкл буфера привязки PAE промывают среднего и тепла смеси на 90 ° C для 9 мин под встряхивания.
- Соберите супернатанта, содержащий eluted ННО, ультрафильтрации. Повторите этот процесс элюции три раза для восстановления более связанном ННО.
- Первый раунд отбора: ПЦР
-
Малых масштабах PCR
- Выполнение небольших масштабах ПЦР23 (4 × 20 мкл аликвоты) с помощью ~ 15-30 циклов. Настройка реакции PCR24 следующим образом: 6,5 мкл РНКазы свободной воды, 1 мкл 10 мкм праймера (FP, PO4- RP, 0.01 нмоль), 1.5 мкл этого eluted бассейн из раздела 3.4 (или РНКазы свободной воды как отрицательный контроль) и 10 мкл смешиванием содержащие смесь реакции дНТФ, горячий старт полимеразы и буфер реакции PCR 2 × (20 мм tris· HCl, 100 мм хлористого калия, 3 мм MgCl2, рН 8.3).
- Запуск ПЦР с помощью тепловой циклователь со следующими параметрами: 1 цикл 95 ° c, 1 мин; 30 циклов [95 ° C, 30 s; 56 ° C, 30 s; 72 ° C, 30 s]; 1 цикл 72 ° C, 2 мин и удерживайте при 4 ° C. Когда инструмент работает что 20 sй расширение шаги на 15, 20, 25 и 30 циклов, нажмите клавишу Пауза, откройте крышку инструмента и принять одну трубку из, затем нажмите клавишу Пауза, вновь возобновить ПЦР.
- Подготовка 12% денатурированного геля полиакриламида электрофореза (страница)25,26. Смешайте 4,8 г мочевины, 6 мл ультра-чистой воды, 1 мл 10 × трис/борной кислоты/этилена диамин tetraacetic кислоты (КЭ), 3 мл 40% акриламида, 10 мкл tetramethylethylenediamine (TEMED) и 100 мкл 10% Аммония пероксодисульфат (APS), в этом порядке. Хорошо перемешать и подождать за 1,5-2 ч, чтобы убедиться, что гель полностью твердеет.
- Анализ результатов оптимизации цикла: объединить 1 мкл каждого продукта ПЦР с 5 мкл буфера РНК загрузки (0,4 М формальдегид, 1.25×3-(N-morpholino) propansulfonic кислотой буфера, 0,02% ксилола cyanol FF, 0,02% бромфеноловый синий, 62,5% формамида) и 4 мкл РНКазы свободной воды; Нагрейте смесь на 95 ° C в течение 10 минут и быстро охладить его до 0 ° C на льду; инкубировать в течение 5 мин при комнатной температуре; нагрузка в 5 отдельных скважин 12% денатурированного страницы; Запустите электрофорез системой вертикального электрофореза в буфере TBE 1 × 170 V по 45 мин.
- После электрофореза, пятно гель с 3 мкл 1 × нуклеиновой кислоты геля краситель в 30 мл 1 × кэ буфера для 10 мин и принимать изображение геля.
-
Большой масштаб ПЦР: выберите соответствующее количество циклов производить высокой интенсивности band в правильный размер маркера без нежелательных побочных продуктов. Выполнение крупномасштабных ПЦР (20 × 100 мкл аликвоты), используя условия и соответствующее количество циклов, определяется в разделе 3.5.1.
Примечание: Окончательная сумма одноцепочечной библиотеки, которые могут быть получены пропорциональна общий объем PCR, не концентрация шаблона. Как правило чтобы получить 1 нмоль библиотеки, одноцепочечной пул должен 2 мл ПЦР. ПЦР является очень чувствительны и легко загрязненных вне УНУ. Следует принять меры для уменьшения вероятности заражения, как носить перчатки, использование стерилизованные советы, не плевать в трубах и не открывая крышку ПЦР-пробирку перед центрифугированием.
-
Малых масштабах PCR
- Первый раунд отбора: Очистка продукта PCR высыпанием этанола.
- Объедините две трубы смеси ПЦР в одну трубу (по 200 мкл). Повторите это для всех трубок.
- Добавьте 15 мкл раствора натрия ацетата (3 M, рН 5.2), 4 мкл раствора ДНК/РНК осадков перевозчика и в 2,5 раза объем предварительно охлажденным этанола при-20 ° C в каждую пробирку. Смешайте их равномерно.
Примечание: ДНК/РНК осадков перевозчик широко используется в этанол осадков экспериментов значительно улучшить процент восстановления ДНК/РНК при низких концентрациях. Он не вмешивается в нисходящие приложения, например ПЦР и последовательности. - Центрифуга смеси на 20,627 g × 20 мин при температуре 4 ° C и тщательно удалить супернатант и покинуть Белый преципитат.
- 400 мкл 70% предварительного охлаждения этанола раствор при температуре-20 ° C в каждую пробирку мыть осадков. Центрифуга смеси на 20,627 g × 5 минут при температуре 4 ° C и тщательно удалить супернатант и покинуть Белый преципитат. Повторите шаг мыть еще два раза.
- Открыть крышку трубки; укол уплотнения мембраны; Пусть этанола испарения при 40 ° C на Отопление блока до тех пор, пока Белый преципитат становится прозрачным. Магазин осадок при-20 ° C.
Примечание: Очищенный продукт PCR может храниться при температуре-20 ° C.
- Первый раунд отбора: одноцепочечной ДНК (обогащенный бассейн1) поколения, выполняя λ при exonuclease реакция на дайджест фосфорилированных обратный strand.
-
Малого масштаба λ при exonuclease реакция
- Добавьте 100 мкл РНКазы свободной воды одна трубка, содержащая очищенный продукт PCR раздел 3.6. Вихрь трубка полностью растворить осадок в трубе.
- Подготовить пять пробирок и добавьте 5 мкл раствора выше, 11 мкл РНКазы - свободной воды и 2 мкл 10 × реакции буфера (670 мм глицин Кох, 25 мм MgCl2 , 0,1% (v/v) Тритон X-100 рН 9.4) в каждую пробирку.
- 2 мкл воды или разбавленных λ при exonuclease раствор, содержащий 2 U, 5 U, 8 U и 10 U λ при exonuclease в этих труб, соответственно. Mix решение хорошо, мягко закупорить. 10 × реакции буфер предоставляется вместе с λ exonucleasefrom поставщика.
- Инкубировать трубы для 35 минут при 37 ° C, 15 мин при температуре 80 ° C и провести на 4 ° C.
- Подготовка 12% родной страницы. Смешать 6 мл ультра-чистой воды, 1 мл 10 × КЭ, 3 мл 40% акриламида, 10 мкл TEMED и 100 мкл 10% APS, в этом порядке. Хорошо перемешать и подождать 60-90 мин, чтобы убедиться, что гель полностью твердеет.
- Анализировать результаты реакций, объединяя 5 мкл каждой реакции с 1 мкл загрузки красителя и 4 мкл РНКазы свободной воды, и загрузки этих смесей в 5 отдельных скважин 12% родной страница (150 V за 45 мин).
Примечание: 20 bp двуцепочечной ДНК лестницы также могут быть загружены на геле, но она не может быть необходимым, поскольку отдельных полос продукта PCR и созданный единый мель библиотека Показать на геле.
Примечание: Λ при exonuclease реакции имеет отличные структурные избирательности. Double-stranded продукт PCR (стренги анти чувство помечается фосфатной группы в конце 5') может полностью переваривается в библиотеку одноцепочечной присутствии λ при exonuclease в концентрации довольно широкий диапазон (рис. 4). Минимальная сумма при exonuclease λ, которые вполне могут генерировать одноцепочечной ДНК в небольших масштабах λ при exonuclease реакции также используется для больших масштабах λ при exonuclease реакции. Более высокую концентрацию λ при exonuclease может также использоваться, поскольку λ при exonuclease хорошо работает в диапазоне большой концентрации без потери его структура избирательности и продукта выход. Реакция при exonuclease λ тормозится высокой концентрации соли. Неполное переваривание продукта PCR обычно подразумевает, что существует слишком много соли в продукт PCR. Очистки продуктов ПЦР высыпанием этанола (раздел 3.6) обычно совместим с этим шагом, в то время как продукт PCR, очищенный высыпанием изопропанол довольно часто содержит слишком много соли.
- Больших масштабах λ при exonuclease реакции: Выберите минимальное количество при exonuclease λ, которые вполне могут генерировать одноцепочечной ДНК для больших масштабах λ при exonuclease реакции. Реакция масштабируется пропорционально согласно этому условию. Например: если 2 U является минимальная сумма λ при exonuclease требуется, смешать 38 мкл РНКазы свободной воды, 10 мкл 10 x буфер, 50 мкл ДНК бассейн1 и 2 мкл 10 при exonuclease λ U/мкл.
-
Малого масштаба λ при exonuclease реакция
- Первый раунд отбора: очистки одноцепочечной бассейн1 высыпанием этанола.
- Следуйте инструкциям шаг 3,6.
- Определить концентрацию очищенный бассейн1 УФ поглощения на 260 Нм.
- Воссоздать бассейн 90% очищенного1 в соответствующий объем буфера привязки PAE. Если есть не хватает ДНК, полученной для следующего раунда отбора, повторите разделы 3.5-3.8.2.
Примечание: Объем буфера PAE привязки обычно варьируется от 200 до 500 мкл в зависимости от количества библиотеки и желаемой конечной концентрации библиотеки в следующем раунде SELEX.
- Второй, третьей, четвертой и пятой раундов SELEX.
- Проведение второй, третий, четвертый, и пятый раунды SELEX впоследствии следуя той же процедуре, описанной выше (раздел 3.2-3.8), за исключением того, что библиотека ~ 300 пмоль был вход для увеличения жесткости выбор.
- Для сведения к минимуму неспецифических поглощение ННО на носителе, инкубировать бассейн с неизмененной среднего на роторный шейкер для 30 мин в третьем и Четвёртый раунд отбора до инкубации с среднего −coated2DBP−NH.
Примечание: Процесс SELEX, закончившийся в ходе пятого раунда из-за серьезных crosslink между ННО, свидетельствует большое количество высокой молекулярной массы продукта, который не мигрируют в гель.
4. высокопроизводительного секвенирования
- Подготовьте бассейн4 раздел 3.9.2 для виртуализации, амплификации PCR с совместимыми грунтовки.
- Дизайн и синтезировать индексированных вперед грунт с 6 nt в конце 5′ для облегчения анализа последовательностей.
Индексированные вперед грунтовка (FP-последовательности): 5'-agtacgaTCCCACGCATTCTCCACATC-3' - Настройка реакции 1000 µLPCR следующим образом: 380 мкл РНКазы свободной воды, 50 мкл каждого праймера 10 мкм (FP-последовательности, PO4- RP, 0.5 нмоль), 20 мкл eluted бассейн раздел 3.9.2 и 500 мкл реакционной смеси, содержащие дНТФ смешиванием, горячий старт полимеразы и буфер реакции PCR 2 ×. Алиготе смесь в 10 ПЦР трубы. Используйте те же условия PCR, как описано в подразделе 3.5.1.2.
- Дизайн и синтезировать индексированных вперед грунт с 6 nt в конце 5′ для облегчения анализа последовательностей.
- Очищайте продукт PCR для удовлетворения требований объекта последовательности. Например используйте набор для восстановления страницы гель ДНК согласно инструкциям производителя.
- Отправьте очищенный продукт PCR (~ 2 мкг) для объекта последовательности в морских условиях, требуемые фондом последовательности. Например корабль продукт PCR в пластиковых пробирок с шапки, тщательно запечатанный с льдом для объекта последовательности.
Примечание: Получил результаты, которые занял последовательности согласно копии количество каждой последовательности для оценки обогащения виртуализированного бассейн. Топ последовательности был назван DBP-1 (5'-CTTTCTGTCCTTCCGTCACATCCCACGCATTCTCCACAT-3'). Ее близость и избирательности были измерены следующие протоколом (раздел 5 и 6). Его применение в электрохимических био зондирования впоследствии была продемонстрирована в разделе 7.
5. Kd определение выбранного Aptamer кандидатов с использованием Magnetic Bead-Based количественного PCR (ПЦР)
- Синтезировать DBP-1-ПЦР и грунтовки с помощью стандартных фосфорамидит химии и очистить его от стандартных ВЭЖХ.
Кандидат Aptamer (DBP-1-ПЦР): 5'-ATACCAGCTTATTCAATTCTTTCTGTCCTTCCGTCACATC CCACGCATTCTCCACATAGATAGTAAGTGCAATCT-3'
Вперед грунтовка для ПЦР (FP-ПЦР): 5'-ATACCAGCTTATTCAATT-3'
Обратный грунтовка для ПЦР (RP-ПЦР): 5'-AGATTGCACTTACTATCT-3'
Примечание: Регионы грунтовка протестированных последовательности отличаются от пула0 используется в разделе 3. Цель изменения грунтовка регионов является для тестирования сходство основной последовательности самостоятельно, за исключением регионов грунтовка. - Иммобилизации DBP-NH2 на карбоновые кислоты покрытием магнитные бусы следуя инструкциям производителя.
- Вымойте карбоновые кислоты покрытием магнитные бусы дважды с 25 мм 2-(N-Морфолино) ethanesulfonic кислоты (МОН) (рН 5,0), используя накапаны равным объемом магнитной бусины (100 мкл) из флакона, 10 мин с хорошим смешивания (конец над конец или аналогичные).
- Непосредственно перед применением Подготовьте 50 мг/мл 1-ethyl-3-(3-dimethylaminopropyl) Карбодиимиды гидрохлорид (EDC) раствора с холодной 25 мм MES (рН 5,0).
- Непосредственно перед применением Подготовьте 50 мг/мл раствора N-оксисукцинимидного (NHS) с холодной 25 мм MES (рН 5,0).
- Смешать 100 мкл раствора EDC и 100 мкл раствора NHS промывают бисером и Инкубируйте 30 мин при комнатной температуре с вращением медленный наклон.
- Положите трубку на магнит на 4 мин после инкубации, отбросить супернатанта и мыть бусины дважды с 100 мкл холодной 25 мм MES (рН 5,0).
- Инкубируйте 6 µL 100 мм DBP-NH2 Стоковый раствор и 25 мм MES (рН 5,0, 290 мкл) с активированной бисером под вращение по крайней мере 30 минут при комнатной температуре или 2 ч при температуре 4 ° C, с медленным наклона вращения 5 об/мин.
- Положите трубку на магните для 4 мин после инкубации и удалить супернатант. Вымойте покрытием Бусины 4 раза и Ресуспензируйте бусины с 200 мкл буфера привязки PAE и хранить при 4 ° C до использования.
-
Собирайте кривой титрования для определения Kd.
- Подготовить ряд решений DBP-1 (500 мкл) в различных концентрациях в буфере PAE привязки от 1 м до 300 Нм.
- 10 мкл DBP-NH2-покрытием магнитные шарики, как описано в разделе 5.2.7 для каждого решения DBP-1. Инкубируйте 1 час при комнатной температуре под вращения.
- Место труб на магнит на 4 мин и удалить супернатант. Вымойте Бусины 4 раза с помощью 200 мкл буфера привязки PAE.
- Добавьте 60 мкл буфера PAE привязки к каждой трубе. Инкубируйте трубы на 95 ° C в течение 15 минут собрать супернатанта, содержащий eluted DBP-1, магнитной сепарации. Повторите этот процесс элюции восстановить более связанном DBP-1.
- Разбавить раствор elute 100 раз и принимать 3 мкл для ПЦР в реальном времени. Настройка реакции ПЦР следующим: 3 мкл РНКазы свободной воды, 2 мкл 10 мкм праймера (FP, PO4- RP, 0.01 нмоль), 3 мкл этого eluted и разбавляют DBP-1, и 10 мкл смешиванием реакционной смеси, содержащие дНТФ, полимеразы и 2 x PCR реакции буфера.
- Определить количество DBP-1 в каждой пробе, запустив ПЦР с помощью тепловой циклователь со следующими параметрами: 1 цикл 95 ° c, 30 s; 30 циклов [95 ° C, 30 s; 45 ° C, 30 s; 72 ° C, 30 s]; 1 цикл 72 ° C, 30 s и удерживайте при 4 ° C.
- Участок кривой титрования и определить Kd путем нелинейного монтажа кривой, предполагая соотношение 1:1 привязки27.
6. относительная близость и специфичность тест на конкурентные анализы
- 10 мкл DBP-NH2-покрытием магнитные шарики в DBP-1 решение (500 мкл, 1 мкм). Инкубируйте 1 час при комнатной температуре под вращения. Место труб на магнит на 4 мин и удалить супернатант. Вымойте Бусины 4 раза с помощью 200 мкл буфера привязки PAE и Ресуспензируйте в 10 мкл буфера привязки PAE.
- 10 мкл DBP-NH2-покрытием средних обязан с DBP-1 110 мкл каждого 10 мкм испытания образца (DBP-NH2, DBP, DEHP, бутил бензил phthalate(BBP), ионов тяжелых металлов, и т.д.) Инкубации при комнатной температуре в течение 1 ч. сбор супернатанта, магнитной сепарации.
- Разбавить супернатант 100 раз и принимать 3 мкл для количественной ПЦР. Настройка реакции ПЦР следующим: 3 мкл РНКазы свободной воды, 2 мкл 10 мкм праймера (FP, PO4- RP, 0.01 нмоль), 3 мкл этого eluted и разбавляют DBP-1, и 10 мкл смешиванием реакционной смеси, содержащие дНТФ, полимеразы и 2 x PCR реакции буфера.
- Определить количество DBP-1 в каждой пробе, запустив ПЦР с помощью тепловой циклователь со следующими параметрами: 1 цикл 95 ° c, 30 s; 30 циклов [95 ° C, 30 s; 45 ° C, 30 s; 72 ° C, 30 s]; 1 цикл 72 ° C, 30 s и удерживайте при 4 ° C.
- Вычислить относительную близость путем деления числа выпущенное количество DBP-1 освобожден из бисера в буфере привязки PAE из бисера при наличии образца DBP-1: относительная сродство = N буфер/nобразцабуфера.
7. Изготовление и электрохимические измерения электрохимических биодатчиков ДЭГФ
- Синтезировать последовательности основных thiolated (HS-DBP-1) и сигнальный зонд (DBP-1-C-Fc) с помощью стандартных фосфорамидит химии и очистить его от стандартных ВЭЖХ.
HS-DBP-1: 5' - HS -6(2CH) - CTTTCTGTCCTTCCGTCACATCCCACGCATTCTCCACAT -3 '
DBP-1-C-ФК: 5 '- GATGTGACGGAAGGTTTTTTTT - (2CH)6ФК -3'
Примечание: Рациональный дизайн датчиков зондов был описан в наших предыдущих18,pbulications22. - HS-DBP-1 и DBP-1-C-ФК в воде нуклеиназы свободный класс на 100 мкм, аликвота и хранить их в -20-80 ° c на срок до одного года.
- Польский золотой электрода тщательно к зеркальной поверхности с 1, 0,3 и 0,05 мкм Al2O3 порошка на microcloth 5 минут и sonicate его в ультрачистая вода для 5 минут, чтобы удалить остаточные Al2O3. Затем очистить электрод, электрохимическая полировка с 35 последовательных циклической вольтамперометрии (CV) сканирует от 0,4 до 1,2 V (против Hg-Hg2т4) в 0,5 М H24 так на 100 м/сек.
- Приготовить смесь из 0,5 мкм HS-DBP-1 и 0,5 мкм DBP-1-C-ФК в 100 мкл 10 мм фосфатного буфера, содержащий 1 M NaCl, рН 7,4 (PBS). Нагрейте смесь в тонкостенных пластиковых пробирок в наборе ванна воды на 95 ° C в течение 10 мин и медленно охлаждать смесь до комнатной температуры.
- 1 мкл tris-(2-carboxyethyl)-фосфин гидрохлорид (TCEP, 10 мм, раствор), в смесь. Храните при комнатной температуре в течение 1 ч.
- Погружать чистого золота электрод в приведенные выше решения для 12 h, или на ночь при комнатной температуре.
- Промойте электрод с PBS и погружают электрод в 1 мм [S (2CH)2(OCH2CH2)6OCH3]2 (HS-EG6- OMe) в PBS на 1 ч. промойте электрод, тщательно с использованием PAE Привязка буфера и погружают электрод в PAE привязки буфера.
- В цели свободного буфера привязки PAE примите фонового сканирования квадратные волны вольтамперометрии (SWV).
- Очистить все экспериментальное оборудование: электролизеров, золото рабочих электродом, Платиновый счетчика электрода и насыщенных каломель электрод сравнения (SCE).
- Активировать установленного программного обеспечения; Установите экспериментальные параметры для SWV измерений.
Примечание: Для SWV экспериментов использовались следующие экспериментальные параметры: потенциальный диапазон: от – 0,2 до 0,7 V; амплитуда модуляции: 25 мВ; импульса: 5 мс; Частота сканирования: 50 МВ/s; шаг потенциал: 1 МВ. - Подключите золото стремится потенцио электрода, Платиновый счетчика электрода и SCE и положить эти три электроды в электролитическая ячейка, содержащая PAE привязки буфера.
- Запустите SWV измерения.
Примечание: После начала измерения SWV, SWV кривой будет отображаться на экране компьютера. Сканирование повторяется до тех пор, пока наблюдаются дальнейшие изменения в высоте пик или форму и проверяет, являются постоянным.
- Погружать рабочих электродом в PAE привязки буфер, содержащий определенной концентрации DEHP (например, 10 вечера) за 30 мин при комнатной температуре. Промойте электрод, тщательно с использованием буфера привязки PAE и погружают электрод в PAE привязки буфер с счетчик электрода и SCE. Соберите SWV кривой при том же условии, как описано в разделе 7,8.
- Повторите шаг 7.9, за исключением, что концентрация DEHP (например 100 ПМ, 1 Нм, 10 Нм, 100 Нм, 1 мкм) последовательно была увеличена. Участок кривой титрования.
- Специфичности тестов: Повторите шаги 7.3-7,9, за исключением того, что PAE привязать буфер, содержащий DEHP заменяется PAE привязки буфер, содержащий потенциальные помехи вещество в нужной концентрации.
Результаты
Мы разработан и синтезированных аминогруппы функционализированных Дибутилфталат (DBP-NH2) как цели привязки (Рисунок 1F). Затем мы провели ДНК aptamer выбор Паес, используя DBP-NH2 как объект привязки и после классической целевого метода на основе иммобилизации (рис. 2). В каждом раунде экспериментальный ПЦР проводилось с использованием денатурированного страницы для оптимизации цикла количество PCR (рис. 3). Денатурированного страницы, вместо родной страницы, настоятельно рекомендуется, потому, что мы и другие коллеги обнаружил, что подозреваемых высокомолекулярных побочных продуктов, показан на родной гели на более высокие цифры цикла фактически сшивки комплексы, образованный последовательности правильный размер. Таким образом группа интенсивности денатурированного страницы действительно может отражать количество правильный продукт. Одно поколение мель ДНК является еще одним критическим шагом, и многие методы для этого шага были сообщил28. Метод пищеварение при exonuclease λ является дешевым. Успех поколения одноцепочечной ДНК может проверяться удобно родной страницы, где показан продукт PCR как сингл (первые несколько раундов SELEX) или несколько полос, в то время как только одна полоса отображается после переваривания (рис. 4).
SELEX было остановлено после того, как Пятый раунд отбора из-за значительного количества ДНК накапливаются в верхней части страницы, даже после лечения денатурация (которой ННО нагреваются при 95 ° C для 10 минут в 2 × КЭ содержащие 8.3 M мочевины) , который предложил серьезные сшивки между НОО и также указал, что последовательности обогатились. Таким образом бассейн4 был разослан для высокопроизводительного секвенирования. Высок объём результат показал, что топ 100 наиболее часто встречающихся последовательности были хорошо сохранились и были из одной семьи. Топ последовательности DBP-1 отображается наномолярных сродство (рис. 5) и хорошая группа специфика PAE конгенеров (DBP, BBP, DEHP) (рис. 6) через удобный ПЦР-анализов, как описано в разделе протокол.
DBP-1 был использован для создания на основе перемещения электрохимическая aptasenor прядь соответственно нашей сообщалось ранее работы29. DEHP датчик может чутко и избирательно реагировать DEHP (рис. 7). Общих экологических загрязнителей, таких как ионы тяжелых металлов, антибиотики и малых молекул с аналогичными функциональными группами показали очень слабой реакции на DBP-1.

Рисунок 1: Химические структуры () Паес, (B) BBP, DBP (C), (D) DEHP, (E) 4-OH-DEHP, (F) DBP−NH2. Эта цифра была перепечатана с разрешения Хан ю. и др. 22 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: Группа специфических ДНК aptamer процедуры отбора Паес, используя в качестве целевого объекта привязки DBP-NH2 . Эта цифра была перепечатана с разрешения Хан ю. и др. 22 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: представитель результаты ПЦР цикла оптимизации с помощью денатурированного страницы. Слева направо, представляют собой полосы: 20 bp ДНК лестница стандарт, 15 циклов (шаблон не ДНК), 20 циклов (шаблон не ДНК), 25 циклов (шаблон не ДНК), 30 циклов (шаблон не ДНК), 15 циклов, 20 циклов, 25 циклов и 30 циклов. Оптимальные условия были замечены на 25 циклов, где один продукт группа была на высокой интенсивности без нежелательных побочных продуктов, Кроме того, не было отмечено в соответствующий пустой элемент управления. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: оптимизация λ при exonuclease реакции переваривать фосфорилированных нити, используя родной страницы. Слева направо, представляют собой полосы: 20 bp ДНК лестница стандарт, отрицательный (не при exonuclease λ), 2U, 5U, 8У и 10У. Минимальное количество фермента был отмечен на 2U, где двойной продукт PCR становится одноцепочечной ДНК. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
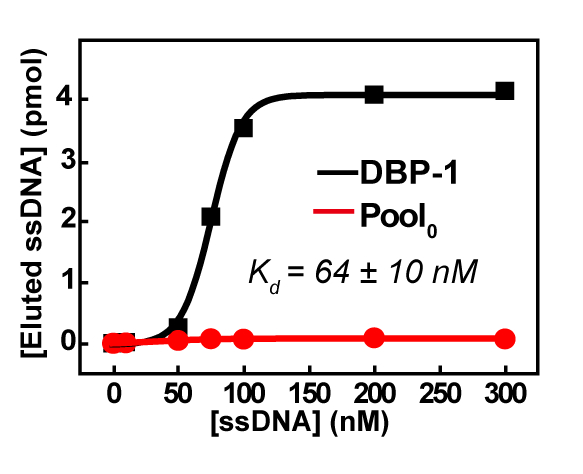
Рисунок 5: близость измерения DBP-1 на основе ПЦР анализов. Ошибка (стандартное отклонение, SD) Kd была рассчитана из трех измерений того же образца. Эта цифра была перепечатана с разрешения Хан ю. и др. 22

Рисунок 6: относительная близость измерения DBP-1 для бесплатно DBP-NH2 (10 мкм), DBP (10 мкм), DEHP (10 мкм), BBP (10 мкм), этилацетат (10 мкм), Бензойная кислота (10 мкм), Фталевая кислота (10 мкм) и других через конкурс assays. Другие: смесь потенциальных помех (глюкоза, канамицин, Ампициллин и этанола) все в 10 мкм. Соотношение (относительная сродство) была рассчитана путем деления числа аптамеры освобожден из бисера при наличии образца на количество аптамеры освобожден из бисера в буфере привязки PAE. Столбцы представляют собой среднее ± SD. ИКБ были рассчитаны из трех отдельных измерений. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 7: Электрохимический биодатчик DEHP сверхчувствительная и ultraselective обнаружения DEHP: механизм (A), SWV кривых (B), калибровочная кривая (C), и избирательности тесты (D). Ошибки (SDs) были рассчитаны из трех отдельных измерений. Эта цифра была перепечатана с разрешения Хан ю. и др. 22 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Одним из выдающихся преимуществ аптамеры является, что они идентифицируются посредством метода в vitro SELEX, в то время как антитела создаются через immunoreactions в естественных условиях . Таким образом аптамеры могут быть выбраны с желаемой цели специфичности в хорошо продуманных экспериментальных условиях, в то время как антитела являются ограниченными в физиологических условиях.
Чтобы облегчить разделение связанных последовательностей от свободной последовательности, несколько измененный SELEX недавно сообщалось, в котором капиллярного электрофореза30, микрофлюидика31, магнитные / акриловые бусины / агарозы бусы14, т. д., заменили фильтры нитроцеллюлозы или столбцы сродство для достижения более эффективного разделения. Среди этих методов, методы, основанные на шарик наиболее широко использовались для отбора aptamer малые молекулы цели благодаря их простой настройки, простота эксплуатации и, будучи поддаются малые молекулы анализы.
Существует две группы методов, которые обычно используются для aptamer выбора целей малых молекул: цель13 и библиотека14 иммобилизации-методы на основе. В бывшей группы методов малые молекулы цели являются иммобилизованных на твердой фазы функционализированных магнитные бусы или бусы агарозы через ковалентная связь реакций. Библиотеки инкубируют с мелкомолекулярных покрытая бисером, и просто выполняя стирки и центрифугирования или магнитной сепарации шаги удаляются те последовательности, которые не связывают или слабо привязку к целевому объекту на твердой фазы. Связанные последовательности впоследствии этого eluted и усиливается ПЦР. Малые молекулы цели должны иметь по крайней мере одной функциональной группы, доступные для сцепления реакции. Для тех, кто не подходит функциональных групп функциональной группы должен включаться в первоначальной цели посредством органического синтеза. Синтез тщательно продуманных целевых может охватывать несколько шагов и иногда также является довольно сложной задачей. Структурные изменения целей может также сильно влияет на сайтов связывания и близость с их аптамеры. Чтобы избежать этих проблем, были разработаны методы иммобилизации на основе библиотеки, где библиотека является гибридизированных к взаимодополняющих ДНК захвата зонды на магнитные бусы, и последовательности привязки упасть бусы после связывания с целями. В этой группе методов цели добавляются в буфере привязки и без функциональных групп требуются. Паес являются производными Эстер фталат кислоты, и типичный PAE состоит из группы кислотного эфира фталат и одного или двух алкильной цепи (рис. 1A-D). Паес имеют не функциональными группами для иммобилизации твердой фазы. Таким образом библиотека на основе иммобилизации методы кажутся более привлекательными для aptamer выбора Паес.
Хорошо контролируемых дисперсии статус имеет решающее значение для обеспечения желаемого обогащение библиотеки через SELEX. Однако Паес крайне гидрофобными и легко образуют агрегаты в водных растворах при концентрации выше, чем несколько мкм, даже при наличии нескольких ПАВ для облегчения дисперсии. Таким образом статус дисперсии Паес сложно контролировать, и было бы трудно выбрать аптамеры, конкретно связанную с отдельных молекул PAE. Для решения проблемы растворимость, были выбраны методы целевого иммобилизации, в котором Паес были иммобилизованных на гидрофильно бусины через ковалентного. Используя эту стратегию иммобилизации, цели должны быть преимущественно присутствует на поверхности шарик в одном государстве молекулярные, вместо агрегатов.
Также весьма важное значение для успешного выбора конкретной группе аптамеры конструкции целевого объекта привязки. Три фактора должны рассматриваться для структурного дизайна. Первым фактором является целью отбора aptamer. Принимая во внимание цель выбора конкретной группе аптамеры важно для выявления общей группы в составе Паес для привязки aptamer и воспрепятствовать остальные части в aptamer привязки. Таким образом функциональной группы следует ввести в терминале боковой цепи. В начале, мы разработан OH-функционализированных DEHP (4-OH−DEHP) (Рисунок 1E) как цель привязки и иммобилизованные на карбоновые кислоты магнитные бусы16. Таким образом алкильной цепи были выставлены на поверхности матрицы. Мы постарались выбрать магнитные бусы с карбоксильных групп как прочную матрицу. Не очевидные сходства улучшение наблюдалось после пяти раундов выделения, и неспецифические поглощения на матрице голые держали сильным.
Таким образом, DBP-NH2 позже был разработан на основе следующей мысли: (1) фталат группа скорее всего взаимодействовать непосредственно с aptamer через стек π-π и Скрепление водопода чем алкильной цепи; (2) ГСЗ опосредованной Карбодиимиды реакция мягкий и имеет очень эффективного сцепления эффективность, поэтому -NH2 введена в конце алкильной цепи DBP; (3) это легко работать с магнитной бусины как раздел твердой фазы, но неспецифической адсорбционной библиотеки является сильным. Хотя потеря агарозы бусины во время разделения является выше, чем магнитные бусы, неспецифической адсорбционной библиотеки гораздо ниже. Таким образом DBP-NH2 была иммобилизованных на эпоксидной активированный агарозы бусы, и группа фталиевый кислотеЭстер был разоблачен на поверхности матрицы.
Выбор выделения буфера имеет важное значение, особенно для целей малые молекулы с разнообразными растворимость. Буфере привязки необходимо тщательно подготовиться избегать агрегации и обеспечить хорошее рассеивание состояние СОЗ во время процесса отбора и квалификации всего aptamer. В нашем исследовании мы обнаружили, что DEHP нельзя растворять в обычных буферов без ПАВ, показаны два отдельных слоев. Слой исчезает после добавления нескольких ПАВ в оптимизированный количество. Четкие решения должны храниться при температуре выше 20 ° C, чтобы сохранить свой статус. Подробная информация приводится в протокол шаг 3.1.
Один важный шаг в процессе SELEX одноцепочечной ДНК поколения от продуктов ПЦР двунитевая. Несколько различных методов в настоящее время были описаны в литературе32,33, включая Асимметричное PCR, λ при exonuclease пищеварение, магнитной сепарации с покрытием стрептавидина бисером и размер разделение денатурации Мочевина Полиакриламид-гель.
Различные методы имеют свои собственные сильные и слабые стороны. В настоящее время наиболее часто используемый метод для генерации ssDNA является магнитная сепарация с покрытием стрептавидина бисером. Выдающиеся преимущества данного метода является его экономить время и простой операцией. Недостатком является его высокая стоимость, по сравнению с другими методами. В отличие от этого метод на основе разделения размер, используя обратный грунты с GC-богатые стволовых – циклической структуры, является одним из дешевых методов, в то время как доходность одноцепочечной ДНК является самым низким среди этих методов32. В этом протоколе мы описали использование λ при exonuclease пищеварения генерировать одноцепочечной ДНК, который является одним из дешевых методов. Мы обнаружили, что доходность одноцепочечной ДНК сопоставима с двумя методами магнитной сепарации и покрытием стрептавидина бусины. Кроме того мы обнаружили, что при exonuclease реакция была тормозится высокой концентрации соли. Неполное переваривание продукта PCR, сообщили в литературе33 , вероятно, из-за слишком много соли существующих в продукт PCR. Кроме того, при exonuclease λ чрезвычайно активные и недорогой (рис. 4).
Характеристика и проверки аптамеры трудоемкой, требует много времени и воплощает основным узким местом в aptamer открытие газопровода33. Большинство методов являются массы чувствительных методов, которые хорошо работают для более крупных партнеров привязки aptamer (> 10 000 Аму), но не достаточно чувствительным, чтобы измерить взаимодействия с низкой молекулярной массой цели (< 1000 Аму)15. Характеристика и проверки аптамеры гидрофобные малых молекул как Паес является еще более трудным. Растворимость в воде их бедных приводит ненасыщенности кривой титрования, которая предотвращает Kdопределение в растворе или обездвиживает аптамеры на поверхности. Таким образом мы определяется sd Kо выявленных аптамеры путем sequencing высокой пропускной способности иммобилизирующие DBP-NH2 на гидрофильные магнитные шарики избежать растворимость. Относительный близость и избирательности аптамеры для других Паес были затем определяется конкурентные анализы, где aptamer кандидатов были предварительно ограниченной в DBP-NH2 придают магнитные бусы и выпущен в надосадке после инкубации с проверенные Паес или других веществ, потенциально помехи. Конкурентоспособных assay был применен потому, что она предоставила снисходительный сродство сравнения среди Паес, которые не функциональными группами для иммобилизации поверхности. Кроме того магнитные на основе бисера флуоресцентные анализов подходят для изучения сходства малые молекулы aptamer взаимодействие34. Однако мы обнаружили, что магнитные бусы иногда вызывают тушения флуоресценции по неизвестным причинам. Таким образом ПЦР-анализов были использованы для измерения сродства.
Один из важнейших техника подсказка для электрохимический биодатчик, описанных в настоящем исследовании является Поверхностная пассивация электрода35. Из-за высокой гидрофобность DEHP она имеет сильную тенденцию быть nonspecifically всасывается на золото электрода, приводит к недостаточности обнаружения. Наиболее часто используется пассивирование поверхности агент, 6-меркапто-1-hexanol (MCH)36,37, не является достаточным для предотвращения неспецифических поглощение DEHP, в то время как мы обнаружили, что HS-(2CH)2-[OCH2CH2 ]6- OCH3 был достаточно эффективным включить чувствительных обнаружение DEHP38.
Эта процедура описывает протокол для выбора конкретной группе ДНК аптамеры высоко гидрофобная малых молекул и применение выбранного aptamer в электрохимический биодатчик. Протокол помогает с выбором других гидрофобные малых молекул и предоставляет информацию о развитии датчик высокой гидрофобностью малых молекул, а также. Процесс отбора aptamer принадлежит к категории целевых методов на основе иммобилизации. Для этого протокола, например необходимость сложного синтеза якорь целей и последствий твердой фазы на aptamer привязки также существуют ограничения этого типа метода. Привлекательные преимущества электрохимических биодатчики, указанных в настоящем Протоколе их простой дизайн и высокую чувствительность. Основным недостатком является их ограниченной точности из-за их чрезвычайно широкий динамический диапазон. Таким образом биосенсоров, описанные здесь являются более подходящими для скрининговых тестов, вместо количественного измерения показателей.
Раскрытие информации
Авторы заявляют не конкурирующие финансового интереса.
Благодарности
Мы признательны за финансовую поддержку от национального фонда естественных наук (21675112), проект ключ плана науки и технологии Пекина образования Комиссии (KZ201710028027) и Яньцзин молодой ученый программа Capital Normal University.
Материалы
| Name | Company | Catalog Number | Comments |
| UV-2550 | Shimadzu,Japan | protocol, section 3.8.2 | |
| DNA Engnine Thermal cycler,PTC0200 | BIO-RAD | section 3.5.1.2 and 3.5.2 | |
| C1000 Touch | BIO-RAD | section 5.3.6 and 6.3 | |
| VMP3 multichannel potentiostat | Bio-Logic Science, Claix, France | section 7.4,7.8 and 7.11 | |
| Epoxy-activated Sepharose 6B | GE Healthcare (Piscataway, NJ, USA) | 10220020 | argarose beads, section 2.3 and 3.3 |
| Dynabeads M-270 carboxylic acid magnetic beads | Invitrogen, USA | 420420 | magnetic beads,section 5.2. and 5.3 |
| Premix Taq Hot Start Version | Takara,Dalian,China | R028A | polymerase, section 3.5.1.1 |
| PARAFILM Sealing Membrane | Bemis, USA | PM-996 | section 3.6.5 |
| Lambda Exonuclease | Invitrogen, USA | EN0561 | section3.7.1.2.The 10 × reaction buffer is provided along with λ exonuclease by the provider. |
| Dr. GenTLE Precipitation Carrier | Takara,Dalian,China | 9094 | section 3.6.2 and 3.8.1 |
| UNIQ-10 PAGE DNA recovery kit | Sangon Biotech (Shanghai) | B511135 | section 4.2 |
| SYBR Gold nucleic acid gel stain | Invitrogen, USA | 1811838 | nucelic acid stain dye, section 3.5.1.5 |
| SYBR Premix Ex Taq II | Takara,Dalian,China | RR820A | polymerase mix contaning polymerase and dNTPs, section 5.3.5 |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | CAS: 1132-61-2 | section 5.2.1 |
| 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride (EDC) | Invitrogen, USA | CAS: 25952-53-8 | section 5.2.2 |
| N-hydroxysuccinimide (NHS) | Sigma-Aldrich | 6066-82-6 | section 5.2.3 |
| mercaptohexanol (MCH) | Sigma-Aldrich | CAS: 1633-78-9 | section 7.7 |
| Gold electrode | Shanghai Chenhua | CHI101 | section 7.4. - 7.11 |
| tris(2-carboxyethyl) phosphine hydrochloride (TCEP) | Sigma-Aldrich | CAS: 51805-45-9 | section 7.5 |
| O-(2-Mercaptoethyl)-O'-methyl-hexa-(ethylene glycol) | Sigma-Aldrich | CAS: 651042-82-9 | section 7.7 |
| diethylhexyl phthalate (DEHP) | National Institute of Metrology, China | CAS: 117-81-7 | section 7.11 |
| Tween 20 | Sigma-Aldrich | CAS: 9005-64-5 | polyoxyethy-lene(20) sorbaitan monolaurate |
| Triton X-100 | Sigma-Aldrich | CAS: 9002-93-1 | non-ionic surface active agent |
| PBS | Sigma-Aldrich | P5368 | 10 mM phosphate buffer containing 1 M NaCl, pH 7.4 |
Ссылки
- Vorkamp, K., Riget, F. F. A review of new and current-use contaminants in the Arctic environment: Evidence of long-range transport and indications of bioaccumulation. Chemosphere. 111, 379-395 (2014).
- Net, S., Sempere, R., Delmont, A., Paluselli, A., Ouddane, B. Occurrence, fate, behavior and ecotoxicological state of phthalates in different environmental matrices. Environ Sci Technol. 49 (7), 4019-4035 (2015).
- Xie, Q. L., Liu, S. H., Fan, Y. Y., Sun, J. Z., Zhang, X. K. Determination of phthalate esters in edible oils by use of QuEChERS coupled with ionic-liquid-based dispersive liquid-liquid microextraction before high-performance liquid chromatography. Anal BioanalChem. 406 (18), 4563-4569 (2014).
- Ierapetritis, I., Lioupis, A., Lampi, E. Determination of phthalates into vegetable oils by isotopic dilution gas chromatography mass spectrometry. Food Anal Methods. 7 (7), 1451-1457 (2014).
- Sun, J. Z., He, H., Liu, S. H. Determination of phthalic acid esters in Chinese white spirit using dispersive liquid-liquid microextraction coupled with sweeping beta-cyclodextrin-modified micellar electrokinetic chromatography. J Sep Sci. 37 (13), 1679-1686 (2014).
- Yilmaz, P. K., Ertas, A., Kolak, U. Simultaneous determination of seven phthalic acid esters in beverages using ultrasound and vortex-assisted dispersive liquid-liquid microextraction followed by high-performance liquid chromatography. J Sep Sci. 37 (16), 2111-2117 (2014).
- Sun, R., Zhuang, H. An ultrasensitive gold nanoparticles improved real-time immuno-PCR assay for detecting diethyl phthalate in foodstuff samples. Anal Biochem. 480, 49-57 (2015).
- Sun, R. Y., Zhuang, H. S. A sensitive heterogeneous biotin-streptavidin enzyme-linked immunosorbent assay for the determination of di-(2-ethylhexyl)phthalate (DEHP) in beverages using a specific polyclonal antibody. Anal Methods. 6 (24), 9807-9815 (2014).
- Zhou, L., Lei, Y., Zhang, D., Ahmed, S., Chen, S. An ultra-sensitive monoclonal antibody-based enzyme-linked immunosobent assay for dibutyl phthalate in human urinary. Sci Total Environ. 541, 570-578 (2016).
- Shen, J., Li, Y., Gu, H., Xia, F., Zuo, X. Recent development of sandwich assay based on the nanobiotechnologies for proteins, nucleic Acids, small Molecules, and ions. Chem Rev. 114 (15), 7631-7677 (2014).
- Yin, X. -B. Functional nucleic acids for electrochemical and electrochemiluminescent sensing applications. TrAC, Trends Anal Chem. 33, 81-94 (2012).
- Nguyen, V. -T., Kwon, Y. S., Gu, M. B. Aptamer-based environmental biosensors for small molecule contaminants. Curr Opin Biotechnol. 45, 15-23 (2017).
- Groher, F., Suess, B. In vitro selection of antibiotic-binding aptamers. Methods. 106, 42-50 (2016).
- Yang, K. -A., Pei, R., Stojanovic, M. N. In vitro selection and amplification protocols for isolation of aptameric sensors for small molecules. Methods. 106, 58-65 (2016).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal. Chim. Acta. 686 (1-2), 9-18 (2011).
- Mehta, J., et al. Selection and characterization of PCB-binding DNA aptamers. Anal Chem. 84 (3), 1669-1676 (2012).
- Matsumoto, M., Hirata-Koizumi, M., Ema, M. Potential adverse effects of phthalic acid esters on human health: A review of recent studies on reproduction. Regul Toxicol Pharm. 50 (1), 37-49 (2008).
- Goodchild, J. Conjugates of oligonucleotides and modified oligonucleotides: a review of their synthesis and properties. Bioconjug Chem. 1 (3), 165-187 (1990).
- Brown, D. M. A brief history of oligonucleotide synthesis. Protocols for Oligonucleotides and Analogs: Synthesis and Properties. , 1-17 (1993).
- Reese, C. B. Oligo-and poly-nucleotides: 50 years of chemical synthesis. Org Biomol Chem. 3 (21), 3851-3868 (2005).
- Sproat, B., Colonna, F., Mullah, B., et al. An efficient method for the isolation and purification of oligoribonucleotides. Nucleos Nucleot Nucl. 14 (1-2), 255-273 (1995).
- Han, Y., et al. Selection of group-specific phthalic acid esters binding DNA aptamers via rationally designed target immobilization and applications for ultrasensitive and highly selective detection of phthalic acid esters. Anal Chem. 89 (10), 5270-5277 (2017).
- Bartlett, J. M. S., Stirling, D. A short history of the polymerase chain reaction. PCR protocols. , 3-6 (2003).
- Saiki, R. K., Scharf, S., Faloona, F., et al. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. Science. 230, 1350-1354 (1985).
- Albright, L. M., Slatko, B. E. Denaturing polyacrylamide gel electrophoresis. Current Protocols in Nucleic Acid Chemistry. , A. 3B 1-A. 3B 5 (2001).
- Summer, H., Grämer, R., Dröge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). JoVE. (32), e1485(2009).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal Chim Acta. 686 (1), 9-18 (2011).
- Sharma, T. K., Bruno, J. G., Dhiman, A. ABCs of DNA aptamer and related assay development. Biotechnol Adv. 35 (2), 275-301 (2017).
- Liu, R., et al. Signaling-probe displacement electrochemical aptamer-based sensor (SD-EAB) for detection of nanomolar kanamycin A. Electrochim Acta. 182, 516-523 (2015).
- Mendonsa, S. D., Bowser, M. T. In vitro evolution of functional DNA using capillary electrophoresis. J Am Chem Soc. 126, 20-21 (2004).
- Lou, X. H., et al. Micromagnetic selection of aptamers in microfluidic channels. Proc Natl Acad Sci USA. 106 (9), 2989-2994 (2009).
- Cho, M., et al. Quantitative selection of DNA aptamers through microfluidic selection and high-throughput sequencing. Proc. Natl. Acad. Sci. U.S.A. 107, 15373-15378 (2010).
- Cho, M., et al. Quantitative selection and parallel characterization of aptamers. Proc Nat Acad Sci USA. 110 (46), 18460-18465 (2013).
- Song, K. -M., et al. Gold nanoparticle-based colorimetric detection of kanamycin using a DNA aptamer. Anal Biochem. 415 (2), 175-181 (2011).
- Yang, Z., Ding, X., Guo, Q., et al. Second generation of signaling-probe displacement electrochemical aptasensor for detection of picomolar ampicillin and sulfadimethoxine. Sens Actuators B. 253 (2017), 1129-1136 (2017).
- Lou, X., Zhao, T., Liu, R., Ma, J., Xiao, Y. Self-assembled DNA monolayer buffered dynamic ranges of mercuric electrochemical sensor. Anal Chem. 85 (15), 7574-7580 (2013).
- Zhao, T., et al. Nanoprobe-enhanced, split aptamer-based electrochemical sandwich assay for ultrasensitive detection of small molecules. Anal Chem. 87 (15), 7712-7719 (2015).
- Lou, X., He, L. A. Surface passivation using oligo(ethylene glycol) in ATRP-assisted DNA detection. Sens Actuators,B. 129 (1), 225-230 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены