Method Article
邻苯二甲酸酯结合 DNA 核酸适体的选择、表征及其在电化学 Aptasensor 中的应用
摘要
本文提出了一种体外的协议, 用于对组特定邻苯二甲酸酯结合 DNA 适配子的筛选和表征。在电化学 aptasensor 中也包括了所选核酸适体的应用。
摘要
邻苯二甲酸酯 (PAEs) areone 主要群体的持久性有机污染物。由于同源性的快速增长, PAEs 的群特异检测非常理想。DNA 适配子已越来越多地应用于生物传感器平台上的识别元素, 但很少报道适配子对高度疏水性的小分子靶点 (如 PAEs) 的选择。这项工作描述了一种基于珠子的方法, 用于选择组特定的 DNA 适配子 PAEs。将氨基甲酸二丁酯 (DBP-NH2) 合成并固定在环氧活化的琼脂糖珠上, 使其在固定基质表面显示邻苯乙酯基团, 并因此选择组特定的粘合剂。通过定量聚合链反应和磁分离, 确定了核酸适体候选者的离解常数。适配子对其他 PAEs 的相对亲和性和选择性由竞争性化验确定, 核酸适体候选者预先限定在 DBP- NH 2 附着的磁性珠子上, 并在孵化时释放到上清被测试的 PAEs 或其他潜在的干扰物质。竞争试验的应用, 因为它提供了一个简便的亲和力比较 PAEs 之间没有功能组的表面固定化。最后, 我们演示了电化学 aptasensor 的制备方法, 并将其应用于邻苯二甲酸二 (2-己酯) 的超灵敏和选择性检测。该协议为核酸适体发现其他疏水小分子提供了见解。
引言
随着经济的快速发展, 工业化的加速, 城市建设的不断加快, 环境污染问题也日益严重。典型的环境污染物包括重金属离子、毒素、抗生素、杀虫剂、内分泌干扰物和持久性有机污染物 (pop)。除了金属离子和毒素, 其他污染物是小分子, 通常由各种同源物组成。例如, 最有毒的持久性有机污染物包括多氯联苯、多环芳烃 (多环芳烃)、多溴联联苯醚 (二苯醚)、聚氯氯苯并 (PCDDs)、多氯氧芴 (呋喃) 和苯二甲酸酸酯 (PAEs)1,2, 它们都由许多同源项组成。小分子检测主要是以色谱/质谱技术为基础进行的, 因为其应用的多样性3,4,5,6。对于现场检测, 最近开发了基于抗体的方法7,8,9。但是, 由于这些方法对某些同类具有高度的特异特性, 因此必须执行多个测试。更严重的是, 新的同源生长得如此之快, 以至于他们的抗体不能及时生成。因此, 在一项试验中, 开发组特定的生物传感器来监测所有同源物的总水平, 可为评估环境污染状况提供一个宝贵的指标。
近年来, 核酸适配子在各种生物传感平台中被广泛应用为识别元素, 因为它们能够识别各种各样的目标, 从离子和小分子到蛋白质和细胞10, 11 ,12。适配子是通过一个体外方法来识别的, 所谓的配位系统进化的指数富集 (SELEX) 13, 14.SELEX 从随机合成单链寡核苷酸库开始, 其中包含大约 1014-1015序列。随机库的大小确保了 RNA 或 DNA 候选结构的多样性。典型的 SELEX 过程包括多轮的浓缩, 直到图书馆丰富的序列, 高度亲和性和特异性的目标。最后的浓缩池然后排序, 离解常数 (Kd) 和选择性反对潜在的干扰物质是由不同的技术, 如过滤器结合, 亲和层析, 表面等离子共振 (SPR),等。15
由于水的溶解度极差, 且缺乏用于表面固定的功能基团, 因此在理论上很难核酸适体选择持久性有机污染物。SELEX 的重大进展加速了适配子的发现。但是, 尚未报告持久性有机污染物的组特定适配子的选择。到目前为止, 只有对某些同类的高特异性的 PCB 结合 DNA 适配子被识别为 16.PAEs 主要应用于聚氯乙烯材料中, 将聚氯乙烯从硬塑料改成弹性塑料, 从而充当增塑剂。一些 PAEs 已被认定为内分泌干扰物质, 可对肝肾功能造成严重损害, 减少男性精子的运动, 并可能导致畸形精子形态和睾丸癌的发生17。未报告复合类或组特定的 PAE 绑定适配子。
这项工作的目标是提供一个代表性的协议, 以选择组特定的 DNA 适配子高疏水性小分子, 如 PAEs, 一个代表性的持久性有机污染物组。我们还演示了选定的核酸适体在环境污染检测中的应用。该协议为核酸适体发现其他疏水小分子提供了指导和见解。
研究方案
1. 图书馆及底漆设计与合成
-
设计初始库和引物。
库 (池0): 5 '-TCCCACGCATTCTCCACATC-N40-CCTTTCTGTCCTTCCGTCAC-3 '
正向底漆 (FP): 5 '-TCCCACGCATTCTCCACATC-3 '
磷酸化反向底漆 (PO4-RP): 5 '-PO4-GTGACGGAAGGACAGAAAGG-3 ' - 综合池0, FP 和 PO4-RP 使用标准的 phosphoramidite 化学18,19,20, 并通过标准的高效液相色谱 (HPLC)21纯化所有的 dna。
- 重建池0、FP 和 PO4-在核酸酶级水中的100µM, 整除, 并将它们存储在-20 或-80 摄氏度, 长达一年。
注意: 强烈建议在10-20 µL 整除数中存储池0、FP 和 PO 4 RP, 以避免可能的交叉污染.
2. 合成环氧活化琼脂糖珠锚靶及其固定化
- 合成氨基甲酸二丁酯 (DBP-NH2) 作为锚定靶。
注意: 在文献22中描述了 DBP-NH2的合成和表征的实验细节。 - 在适合于目标溶解度的介质中准备锚定目标库存解决方案。对于本研究, 在二甲基亚砜 (亚砜) 上准备100毫米的 DBP-NH2库存溶液, 并将溶液贮存在4或-20 摄氏度, 长达一年。
- 固定的 DBP-NH2在环氧树脂活化的琼脂糖珠根据一个修改的协议从制造商。
- 重0.1 克冻干粉的环氧树脂活化琼脂糖珠, 并暂停在蒸馏水。用20毫升蒸馏水在几个整除数中添加1小时洗涤培养基。用0.2 米 Na2CO3 (pH 12) 清洗介质。
注: 介质在加入水后立即膨胀。 - 在500µL 耦合缓冲器 (0.2 M Na2CO3缓冲区) 中溶解 DBP-NH2 (46.7 毫克, 0.15 毫摩尔)。
- 将含有配体的耦合溶液与培养基混合。在室温下使用 5 rpm 的振动筛48小时。
- 重复洗涤产品三次, 依次使用0.1 米醋酸酯缓冲 (0.5 米氯化钠, ph 4.5) 和 0.2 m 碳酸酯缓冲 (0.5 米氯化钠, ph 12) 在每个洗涤周期。在水中洗涤和暂停产品, 使最终的体积为500µL。
- 在使用前将产品存储在4摄氏度。
- 通过元素分析确定目标的成功与否。
- 重0.1 克冻干粉的环氧树脂活化琼脂糖珠, 并暂停在蒸馏水。用20毫升蒸馏水在几个整除数中添加1小时洗涤培养基。用0.2 米 Na2CO3 (pH 12) 清洗介质。
3. SELEX
- 用20毫米 Tris·在超纯水或无核酸酶级水中制备500毫升 PAE 粘结缓冲器HCl, 100 毫米氯化钠, 2 毫米氯化镁2, 5 毫米氯化钾, 1 毫米 CaCl2, 1% polyoxyethy lene (20) sorbaitan 月桂, 0.03% 非离子表面活性剂 (pH 7.9)。通过无菌0.22 µm 硝化棉过滤器过滤缓冲液, 并将其贮存在温度高于20摄氏度的月份。
注意: 在 PAE 绑定缓冲区中保持良好的 PAEs 分散状态至关重要。为了提高 PAEs 在水溶液中的溶解度, 需要多种类型的表面活性剂。然而, 表面活性剂的数量应保持在最低限度, 以避免形成的表面活性剂胶束, 将封装 PAE 分子。非离子型表面活性剂在温度低于20摄氏度时容易沉淀, 因此缓冲液的温度应高于20摄氏度。 - 在 PAE 绑定缓冲区的10µL 中稀释10µL 100 µM 池0(~ 1.0 nmol 14-1015490序列)。加热池0整除数 (5 x 100 µL) 在薄壁离心机管在水浴设置在95°c 为10分钟. 将管子放在冰上5分钟, 然后在室温下孵化管5分钟 (~ 25 °c 在这项工作中)。
- 第一轮选择: 池的孵化0和 DBP−NH2−coated 介质。
- 用500µL 的 PAE 绑定缓冲区洗涤200µL DBP−NH2−coated 中等三倍。将 DBP−NH2−coated 介质与池0混合使用, 并在轻度震动下在室温下孵化混合物1小时。
- 将 DBP−NH2−coated 介质与适配子从未绑定的 dna 中分离, 超滤 usingan 超滤管, 其分子切割为 100 kDa。用500µL 的 PAE 结合缓冲液和离心机在 9,168× g 上清洗介质三次, 在4摄氏度时使用10分钟。
- 第一轮选择: 核酸适体洗脱从DBP−NH2 −coated 介质。
- 将 PAE 绑定缓冲区的50µL 添加到洗涤介质中, 并在震动下将混合物在90摄氏度处加热9分钟。
- 用超滤法收集含有洗脱的上清液。重复这个洗脱过程三次, 以恢复更有约束力的 dna。
- 第一轮选择: PCR
-
小规模 PCR
- 使用 ~ 15-30 个周期执行小规模 PCR23 (4 x 20 µL 整除数)。设置 PCR 反应24 , 如下所示: 6.5 µL RNase 水, 1 µL 10 µM 每个底漆 (FP, PO4-RP, 0.01 nmol 每个), 1.5 µL 洗脱水池从 3.4 (或 RNase 无水作为阴性控制) 和10µL 的预混反应混合物包含dNTPs, 热启动聚合酶, 和 2 x PCR 反应缓冲器 (20 毫米 tris·HCl, 100 毫米氯化钾, 3 毫米氯化镁2, pH 8.3)。
- 使用具有以下设置的热循环仪运行 PCR: 1 周期95°c, 1 分钟;30周期 [95 °c, 三十年代; 56 °c, 三十年代; 72 °c, 三十年代];1周期72°c, 2 分钟和举行在4°c。当仪器在15、20、25和30循环中运行扩展步骤的 20th时, 按下暂停键, 打开仪表盖并取出一根管子, 然后再次按下暂停键恢复 PCR。
- 准备12% 变性聚丙烯酰胺凝胶电泳 (页)25,26。混合4.8 克尿素, 6 毫升超纯水, 1 毫升 10 x 三/硼酸/乙烯二胺四乙酸四酸 (), 3 毫升40% 丙烯酰胺, 10 µL tetramethylethylenediamine (TEMED), 100 µL 10% 硫酸铵 (APS), 按顺序排列。搅拌好, 等待 1.5-2 小时, 以确保凝胶完全固化。
- 分析循环优化的结果: 将每种 PCR 产品的1µL 与5µL 的 RNA 负载缓冲器 (62.5% 甲酰胺、0.4 米甲醛、1.25×3 (n-吗啉代) propansulfonic 酸缓冲器、0.02% 二甲苯蓝 FF、0.02% 溴酚蓝) 和4µL 相结合。无 RNase 水;加热混合物在95°c 10 分钟, 并迅速冷却到0°c 在冰上;室温孵育5分钟;载入12% 变性页的5个独立井;用垂直电泳系统在 1 x 的缓冲液中进行电泳, 170 伏45分钟。
- 电泳后, 用3µL 1×核酸凝胶染色, 在30毫升 1 x 缓冲液中涂上10分钟的凝胶, 并采取凝胶的图像。
-
大型 PCR:选择适当数量的周期以在正确的大小标记上生成最高强度波段, 而不需要副产品。执行大规模 PCR (20 x 100 µL 整除数) 使用的条件和适当数量的周期确定的部分3.5.1。
注: 可获得的单链库的最终数量与 PCR 的总体积成正比, 而不是模板的浓度。通常, 为了获得 1 nmol 的图书馆, 单股池需要2毫升 PCR。PCR 是非常敏感和容易污染的外部 dna。应采取步骤, 以减少污染的机会, 如戴上手套, 使用消毒的小贴士, 不随地吐痰, 而不是在离心前打开 PCR 管的盖子。
-
小规模 PCR
- 第一轮选择: 乙醇沉淀纯化 PCR 产物。
- 将两管 PCR 混合物组合成一管 (每根200µL)。对所有管子重复此操作。
- 添加15µL 乙酸钠 (3 米, pH 5.2) 溶液, 4 µL 的 DNA/RNA 沉淀载体溶液, 2.5 倍的容积, 预冷乙醇在-20 °c 到每管。均匀混合。
注: dna/rna 沉淀载体广泛应用于乙醇沉淀实验, 显著提高低浓度 dna/rna 的回收率。它不会干扰下游应用, 如 PCR 和测序。 - 离心机的混合物在 20627 x 克20分钟在4摄氏度, 并小心地丢弃上清和留下白色沉淀。
- 添加400µL 70% 预冷却乙醇溶液在-20 °c 到每管, 以洗涤降水。离心机的混合物在 20627 x 克5分钟在4摄氏度, 并小心地丢弃上清和留下白色沉淀。重复洗涤步骤两次。
- 打开管盖;刺密封膜;让乙醇在加热块上挥发40摄氏度, 直到白色沉淀变得透明。储存沉淀在-20 摄氏度。
注: 纯化后的 PCR 产物可贮存在摄氏-20 摄氏度。
- 第一轮选择: 单链 DNA 生成 (生成富集池1) 通过执行λ exonuclease 反应消化磷酸化的反向链。
-
小尺度λ exonuclease 反应
- 添加100µL 的 RNase 水到一管含有纯化 PCR 产品从3.6 节。涡流管完全溶解在管内的沉淀。
- 准备五离心管并添加5µL 以上溶液, 11 µL RNase 水, 2 µL 10 x 反应缓冲器 (670 毫米甘氨酸 KOH, 25 毫米氯化镁2 , 0.1% (v/v) 海卫 X-100 pH 9.4) 入每管。
- 添加2µL 水或稀释λ exonuclease 溶液, 其中含有 2 u, 5 u, 8 u 和 10 u λ exonuclease 到这些管, 分别。轻轻吹打, 把溶液搅拌好。10 x 反应缓冲器连同λ exonucleasefrom 提供商。
- 孵化管35分钟在37摄氏度, 15 分钟在80摄氏度, 并保持在4摄氏度。
- 准备12% 本机页。混合6毫升的超纯水, 1 毫升 10 x, 3 毫升40% 丙烯酰胺, 10 µL 的 TEMED, 100 µL 的 10% APS, 按顺序。搅拌好, 等待60-90 分钟, 以确保凝胶完全固化。
- 通过将每个反应的5µL 与1µL 的载染料和4µL 的 RNase 水结合起来分析反应结果, 并将这些混合物装入5个单独的井12% 本机页 (150 V 为45分钟)。
注:20 的 bp 双链 DNA 阶梯也可以装在凝胶上, 但由于 PCR 产物的不同带和在凝胶上产生的单链库显示, 可能没有必要。
注意: λ exonuclease 反应具有优良的结构选择性。双链 PCR 产品 (抗感链标签与磷酸盐组在 5 ' 年底) 可以完全消化成一个单一的库, 在存在λ exonuclease 在相当广泛的浓度范围内 (图 4)。在小尺度λ exonuclease 反应中, 可以完全生成单链 DNA 的λ exonuclease 的最小量也用于大尺度λ exonuclease 反应。还可以使用更高浓度的λ exonuclease, 因为λ exonuclease 在广泛的浓度范围内工作良好, 而不会失去其结构选择性和产品产量。高浓度的盐抑制了λ exonuclease 反应。pcr 产物的不完全消化通常意味着 pcr 产物中存在过多的盐。乙醇沉淀法纯化 pcr 产物 (3.6 节) 通常与此步骤相符合, 而异丙醇沉淀纯化的 pcr 产物往往含有太多的盐。
- 大尺度λ exonuclease 反应:选择可完全生成单链 dna 的λ exonuclease 的最小量, 用于大规模λ exonuclease 反应。反应按这种情况按比例缩放。例如: 如果 2 u 是最低数量的λ exonuclease 需要, 混合38µL 的 Rnase 水, 10 µL 10 x 缓冲, 50 µL DNA 池1和2µL 的 10 U/µL λ exonuclease。
-
小尺度λ exonuclease 反应
- 第一轮选择:通过乙醇沉淀净化单股池1 。
- 按照步骤3.6 的说明进行操作。
- 通过紫外吸收 260 nm 确定纯化池的浓度1 。
- 在适当的 PAE 绑定缓冲区中重建90% 纯化池1 。如果没有足够的 DNA 为下一轮选择, 重复 3.5-3.8. 2 节。
注: PAE 绑定缓冲区的容量通常从200到500µL, 根据库的数量和下一轮 SELEX 的预期最终集中度而定。
- 第二, 第三, 第四, 第五回合的 SELEX。
- 按照上文所述的相同程序进行第二、第三、第四和第五回合的 SELEX (3.2-3.8 节), 但 300 pmol 图书馆的投入增加了选择的严格性。
- 为了尽量减少对培养基的非特异性吸收, 在30分钟的旋转振动筛上用未修改的培养基在 DBP−NH2−coated 培养基上孵化之前, 在第三和第四轮的选择中孵化池。
注: SELEX 过程在第五回合结束, 原因是由于大量的高分子量产品没有迁移到凝胶中, dna 之间存在严重的交联。
4. 高通量测序
- 从切片3.9.2 中准备池4 , 以配合引物进行 PCR 放大。
- 在5′端设计并合成一个 6 nt 的索引正向底漆, 以便于序列分析。
索引正向底漆 (FP 测序): 5 '-agtacgaTCCCACGCATTCTCCACATC-3 ' - 设置1000µLPCR 反应如下: 380 µL 的 RNase 水, 每10µM 底漆的50µL (FP 排序, PO4-RP, 0.5 nmol 每个), 20 µL 洗脱池从部分 3.9.2, 和500µL 的预混反应混合物含有 dNTPs, 热启动聚合酶和 2 x PCR 反应缓冲器。将混合物整除 10 PCR 管。使用相同的 PCR 条件, 如3.5.1.2 节所述。
- 在5′端设计并合成一个 6 nt 的索引正向底漆, 以便于序列分析。
- 纯化 PCR 产品以满足测序设备的要求。例如, 根据制造商的说明使用页面凝胶 DNA 恢复工具包。
- 将纯化的 PCR 产品 (~ 2 µg) 发送到测序设施所需的运输条件下的排序设备。例如, 将 PCR 产品放在离心管中, 用冰包彻底密封在测序装置上。
注: 根据每个序列的拷贝数, 接收到序列排列顺序的结果, 以评估顺序池的富集。顶部序列被命名为 DBP-1 (5 '-CTTTCTGTCCTTCCGTCACATCCCACGCATTCTCCACAT-3 ')。它的亲和力和选择性由下列议定书 (5 和6节) 来衡量。它在电化学生物传感中的应用随后在7节中得到了证明。
5. Kd使用磁珠定量 PCR (qPCR) 测定选定的核酸适体候选者
- 采用标准 phosphoramidite 化学合成 DBP-1-qPCR 和底漆, 并用标准 HPLC 法提纯。
核酸适体候选人 (DBP-1-qPCR): 5 '-ATACCAGCTTATTCAATTCTTTCTGTCCTTCCGTCACATC CCACGCATTCTCCACATAGATAGTAAGTGCAATCT-3 '
qPCR 前底漆 (FP-qPCR): 5 '-ATACCAGCTTATTCAATT-3 '
反向底漆为 qPCR (RP-qPCR): 5 '-AGATTGCACTTACTATCT-3 '
注意: 测试序列的底漆区域不同于3节中使用的池0 。改变底漆区域的目的是单独测试核心序列的亲和性, 不包括底漆区域。 - 固定的 DBP-NH2到羧酸涂层磁性珠后, 制造商的指示。
- 用25毫米 2 (n-吗啉代) 磺酸 (MES) 清洗羧酸涂层磁性珠两次 (pH 5.0), 使用相同体积的磁珠 (100 µL) pipetted 出瓶, 为10分钟与良好的混合 (端结束或类似)。
- 在使用之前, 准备50毫克/毫升 1-乙基 3-(3-dimethylaminopropyl) carbodiimide 盐酸盐 (EDC) 溶液与冷25毫米 MES (pH 值 5.0)。
- 在使用之前, 准备50毫克/毫升的 n-琥珀 (NHS) 溶液与冷25毫米 MES (pH 5.0)。
- 混合100µL 溶液和100µL 的 NHS 溶液与洗涤珠和孵化30分钟的室温下缓慢倾斜旋转。
- 孵化后, 将管放在磁铁上4分钟, 丢弃上清, 用100µL 25 毫米 (pH 5.0) 清洗珠两次。
- 孵化6µL 100 毫米 DBP-NH2股票解决方案和25毫米 MES (pH 5.0, 290 µL) 与活化珠在室温下旋转至少30分钟或2摄氏度, 以慢倾斜旋转在 4 rpm。
- 孵化后把管子放在磁铁上4分钟, 然后丢弃上清。用200µL 的 PAE 装订缓冲器清洗涂覆的珠子4次和并用重悬珠, 并存储在4°c 直到使用。
-
收集滴定曲线以确定Kd。
- 从下午1点到 300 nM, 在 PAE 绑定缓冲区的不同浓度下准备一系列 DBP-1 解决方案 (500 µL)。
- 添加10µL 的 DBP-NH2涂层磁性珠子, 如5.2.7 节中所述的每个 DBP-1 解决方案。在室温下在旋转时孵育1小时。
- 把管子放在磁铁上4分钟, 取出上清。使用200µL 的 PAE 绑定缓冲区来清洗珠子4次。
- 将 PAE 绑定缓冲区的60µL 添加到每个管中。将试管孵化95摄氏度, 15 分钟, 通过磁分离收集含有洗脱 DBP-1 的上清液。重复此洗脱过程以恢复更多绑定的 DBP-1。
- 稀释洗脱溶液100倍, 并采取3µL 实时 qPCR。设置 qPCR 反应如下: 3 µL RNase 水, 2 µL 10 µM 每个底漆 (FP, PO4-RP, 0.01 nmol 每个), 3 µL 洗脱和稀释 DBP-1, 和10µL 的预混反应混合物含有 dNTPs, 聚合酶和 2x PCR 反应缓冲。
- 通过使用具有以下设置的热循环仪运行 qPCR, 确定每个示例中的 DBP-1 数: 1 周期95°c, 三十年代;30周期 [95 °c, 三十年代; 45 °c, 三十年代; 72 °c, 三十年代];1周期72°c, 三十年代和举行在4°c。
- 绘制滴定曲线, 并通过1:1 绑定比27的曲线的非线性拟合确定Kd 。
6. 竞争性化验的相对亲和力和特异性检验
- 将10µL 的 DBP-NH2-涂层磁珠添加到 DBP-1 溶液中 (500 µL, 1 µM)。在室温下在旋转时孵育1小时。把管子放在磁铁上4分钟, 取出上清。用200µL 的 pae 绑定缓冲器将珠子清洗4次, 并将其并用重悬10µL 的 pae 绑定缓冲区中。
- 添加10µL 的 DBP-nh2-涂敷 DBP-1 到110µL 的每10µM 测试样品 (dbp-NH2, DBP, DEHP, 邻苯二甲酸苄酯 (BBP), 重金属离子,等.)室温孵育1小时, 通过磁性分离收集上清液。
- 稀释上清100倍, 并采取3µL qPCR 定量。设置 qPCR 反应如下: 3 µL RNase 水, 2 µL 10 µM 每个底漆 (FP, PO4-RP, 0.01 nmol 每个), 3 µL 洗脱和稀释 DBP-1, 和10µL 的预混反应混合物含有 dNTPs, 聚合酶, 2 x PCR 反应缓冲。
- 通过使用具有以下设置的热循环仪运行 qPCR, 确定每个示例中的 DBP-1 数: 1 周期95°c, 三十年代;30周期 [95 °c, 三十年代; 45 °c, 三十年代; 72 °c, 三十年代];1周期72°c, 三十年代和举行在4°c。
- 通过从 PAE 绑定缓冲区中的珠子中释放的 DBP-1 数除以 DBP-1 中释放的珠子的数量, 计算相对亲和性: 相对亲和性 = n示例/n缓冲区。
7. DEHP 电化学生物传感器的制备及电化学测量
- 采用标准 phosphoramidite 化学合成 thiolated 核序列 (HS-DBP-1) 和信号探针 (DBP-1-C-Fc), 并用标准 HPLC 法对其进行纯化。
HS-DBP-1: 5 '-HS-(CH2)6-CTTTCTGTCCTTCCGTCACATCCCACGCATTCTCCACAT-3 '
DBP-1-C-Fc: 5 '-GATGTGACGGAAGGTTTTTTTT-(CH2)6Fc-3 '
注意: 在我们以前的 pbulications18、22中描述了传感器探头的合理设计。 - 重建 HS-DBP-1 和 DBP-1-C-Fc 在核酸酶免费的等级水在100µM, 整除, 并储存在-20 或-80 摄氏度, 长达一年。
- 用1、0.3 和0.05 µmAl2O3粉在 microcloth 上, 将金电极小心地擦亮至镜面表面, 并将其油脂实验在超纯水中5分钟, 以去除残余 Al 5 O 2.然后用35连续循环伏安 (CV) 扫描从0.4 到 +1.2 V (vs 汞汞的2,4) 在 0.5 M H2, 所以4在 100 mV 中, 用电化学抛光法清洁电极。
- 准备0.5 µM HS-DBP-1 和0.5 µM DBP-1-C-Fc 100 µL 10 毫米磷酸盐缓冲液中含有1米氯化钠, pH 7.4 (PBS) 的混合物。将该混合物在薄壁离心机管内的水浴中设置为95°c 10 分钟, 并将混合物慢慢冷却到室温。
- 在混合物中加入1µL (2-羧乙基)-盐酸膦 (TCEP, 10 毫米, 库存溶液)。保持室温1小时。
- 在上述溶液中浸泡清洁金电极12小时, 或在室温过夜。
- 用 pbs 冲洗电极, 将电极浸入1毫米 [S (CH2)2(秒2CH2)6直径3]2 (HS-如6) 在 pbs 为 1 h. 用 PAE 彻底冲洗电极绑定缓冲区并将电极浸入 PAE 绑定缓冲区中。
- 在无目标的 PAE 绑定缓冲区中, 采取背景方波伏安法 (SWV) 扫描。
- 清洁所有实验设备: 电解电池, 金工作电极, 铂计数器电极, 饱和甘汞参考电极 (SCE)。
- 激活已安装的软件;设置 SWV 测量的实验参数。
注: 以下实验参数用于 SWV 实验: 电位范围: 从-0.2 到 0.7 V;调制振幅:25 mV;脉宽: 5 毫秒;扫描率:50 mV/秒;步进电位: 1 mV。 - 将金工作电极、铂计数器电极和 SCE 连接到恒电位仪, 并将这些三电极放入包含 PAE 绑定缓冲器的电解单元中。
- 运行 SWV 测量。
注意: 一旦 SWV 测量开始, SWV 曲线将显示在计算机的屏幕上。扫描是重复的, 直到扫描是恒定的, 并没有进一步的变化, 峰值高度或形状被观察到。
- 将工作电极浸入包含一定浓度的 DEHP (例如,下午10点) 的 PAE 绑定缓冲区中, 室温为30分钟。使用 pae 绑定缓冲器彻底冲洗电极, 并将该电极浸入 pae 结合缓冲器中, 并与计数器电极和 SCE 一起浸泡。在相同条件下收集 SWV 曲线, 如第7.8 节所述。
- 重复步骤 7.9, 但 DEHP (例如100 pM、1 nm、10 nm、100 nm、1µM) 的浓度依次增加。绘制滴定曲线。
- 特异性测试:重复步骤 7.3-7.9, 但包含 DEHP 的 pae 绑定缓冲区被包含潜在干扰物质的 pae 绑定缓冲区替换为所需的浓度。
结果
我们设计并合成了氨基甲酸二丁酯 (DBP-NH2) 作为定位靶 (图 1F)。然后, 我们进行 DNA 核酸适体选择 PAEs 使用 DBP-NH 2 作为锚定目标和遵循经典的目标固定化的方法(图 2)。在每一个回合中, 使用变性页来优化 pcr 的周期数 (图 3) 进行了先导 pcr。强烈建议变性页面, 而不是本机页, 因为我们和其他同事发现, 在较高的循环数上显示在本机凝胶上的疑似高分子量副产品实际上是交联复合物形成的正确大小的序列。因此, 变性页的频带强度可以真正反映出正确产品的数量。单链 DNA 生成是另一个关键步骤, 并且已报告了此步骤的许多方法28。λ exonuclease 消化法是最便宜的方法。单链 DNA 生成的成功可以方便地检查本机页, 其中 PCR 产品显示为单 (前几轮 SELEX) 或多波段, 而只有一个波段显示后, 消化 (图 4)。
SELEX 在选择的第五轮以后被停止了, 因为大量脱氧核糖核酸积累在页的顶部, 即使在变性治疗以后 (其中脱氧核糖核酸在95°c 被加热10分钟在 2 x TBE–containing 8.3 M 尿素), 表明 dna 之间存在严重的交联, 并表明这些序列是丰富的。因此, 为高通量排序发送了池4 。高通量结果表明, 前100最频繁发生的序列是高度保守的, 是从一个家庭。顶部序列 DBP-1 显示 nanomolar 亲和性 (图 5), 并通过方便的 qPCR 检测 (如 "协议" 部分所述), 对 PAE 同源 (DBP、BBP、DEHP) (图 6) 具有良好的组特异性。
DBP-1 已被用来构造一个基于线位移的电化学 aptasenor 相应的我们以前报告的工作29。DEHP 传感器可以敏感地、有选择地响应 DEHP (图 7)。常见的环境污染物, 如重金属离子、抗生素和具有类似功能基团的小分子, 对 DBP-1 的反应非常微弱。

图 1: (A) PAEs 的化学结构, (B) BBP, (C) DBP, (D) DEHP, (E) 4-OH DEHP, (F) DBP−NH2.此数字已在汉 Y 的许可下转载. et22请单击此处查看此图的较大版本.

图 2: 使用 DBP-NH2作为锚定目标的 PAEs 的组特定 DNA 核酸适体选择过程。此数字已在汉 Y 的许可下转载. et22请单击此处查看此图的较大版本.

图 3: 使用变性页进行 PCR 循环优化的典型结果.从左到右, 车道代表:20 bp DNA 梯子标准, 15 个周期 (没有 dna 模板), 20 个周期 (没有 dna 模板), 25 个周期 (没有 dna 模板), 30 个周期 (没有 dna 模板), 15 个周期, 20 个周期, 25 个周期, 和30个周期。在25个循环中观察到了最佳条件, 单产品带在高强度的情况下没有不需要的副产品, 而且在相应的空白控制中没有观测到带。请单击此处查看此图的较大版本.

图 4: 使用本机页消化磷酸化链的λ exonuclease 反应的优化.从左到右, 车道代表:20 bp DNA 梯子标准, 阴性 (无λ exonuclease), 2U, 5U, 8U 和10U。在 2U, 双 PCR 产物成为单链 dna 时, 观察到酶的最小用量。请单击此处查看此图的较大版本.
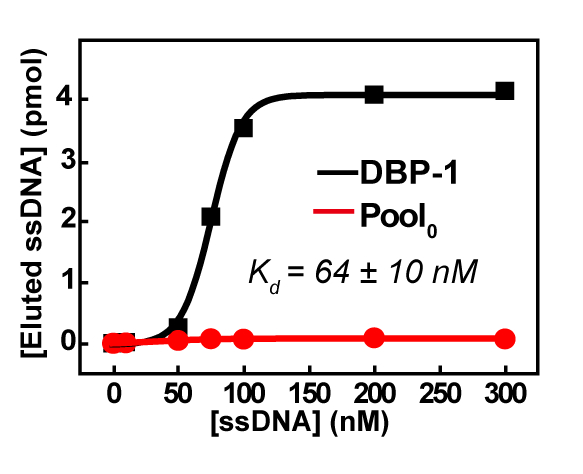
图 5: 基于 qPCR 的检测方法对 DBP-1 的亲和性测量.Kd的错误 (标准偏差, SD) 是从同一样本的三测量中计算出来的。此数字已在汉 Y 的许可下转载. et22

图 6: 自由 DBP-NH2 (10 µM) DBP-1 的相对亲和性测量, DBP (10 µM), DEHP (10 µM), BBP (10 µM), 乙酸乙酯 (10 µM), 苯甲酸 (10 µM), 邻苯二甲酸 (10 µM), 其他通过竞争化验.其他: 潜在干扰 (葡萄糖, 卡那霉素, 氨苄西林, 乙醇) 的混合物在10µM。该比值 (相对亲和性) 是通过在 PAE 绑定缓冲区中从珠子中释放的适配子数除以样品存在时从珠子上释放的适配子的数量来计算的。酒吧代表的是卑鄙的。SDs 是根据三个单独的测量结果计算出来的。请单击此处查看此图的较大版本.

图 7: DEHP 电化学生物传感器用于超灵敏和 ultraselective 检测 DEHP: 机制 (A)、SWV 曲线 (B)、校准曲线 (C) 和选择性试验 (D) 。这些误差 (SDs) 是根据三个单独的测量结果计算出来的。此数字已在汉 Y 的许可下转载. et22请单击此处查看此图的较大版本.
讨论
适配子的一个显著好处是, 它们通过体外方法 SELEX 识别, 而抗体是通过体内免疫生成的. 因此, 在设计良好的实验条件下, 适配子可以选择理想的靶向特异性, 而抗体仅限于生理条件。
为了便于从自由序列分离绑定序列, 最近报告了几种修改后的 SELEX, 其中毛细管电泳30, 微流体 31, 磁性/丙烯酸珠/琼脂糖珠 14, 等, 已更换硝化棉过滤器或亲和柱, 以实现更有效的分离。在这些技术中, 基于珠基的方法在小分子靶的核酸适体选择中得到了广泛的应用, 因为其简单的设置, 操作简单, 易于进行小分子分析。
有两组方法通常用于核酸适体选择小分子目标:目标13 和库14 基于固定化的方法。在前一组的方法中, 小分子靶被固定在固相, 如功能性磁性珠或琼脂糖珠通过共价键耦合反应。图书馆是用小分子包覆的珠子孵化的, 而那些在固体相中不束缚或弱于目标的序列, 只需执行洗涤和离心或磁性分离步骤就可以去除。然后通过 PCR 洗脱和扩增了束缚序列。小分子靶必须至少有一个功能组可用于偶联反应。对于没有合适官能团的人, 必须通过有机合成将功能组纳入原目标。精心设计的目标的综合可能涉及多个步骤, 有时也相当具有挑战性。对目标的结构修改也会对结合点和适配子的亲和性产生强烈影响。为避免这些问题, 本文开发了基于库的固定化方法, 将该库与磁珠上的互补 DNA 捕获探针进行杂交, 并结合靶点将其绑定序列脱落。在这组方法中, 目标被添加到绑定缓冲区中, 并且不需要任何功能组。PAEs 是邻苯二甲酸酯衍生物, 典型的 PAE 由邻苯二甲酸酯组和一或两个烷基链 (图 1A-d) 组成。PAEs 没有功能组可用于固相固定。因此, 基于库的固定化方法对 PAEs 的核酸适体选择显得更具吸引力。
一个良好的控制分散状态是至关重要的, 以确保所期望的丰富的图书馆通过 SELEX。然而, PAEs 是非常疏水性和容易形成聚集在水溶液中浓度高于几个µM, 即使在存在多个表面活性剂, 以促进分散。因此, PAEs 的分散状态是难以控制的, 很难选择适配子, 具体地绑定到单个 PAE 分子。为了解决溶解度问题, 选择了靶固定化方法, 将 PAEs 固定在亲水珠上, 通过共价键合。使用这种固定化的策略, 目标应该是在珠表面上的一个单一的分子状态, 而不是聚合。
锚定靶的结构设计对于成功地选择群特适配子也非常关键。结构设计需要考虑三因素。第一个因素是核酸适体选择的目的。考虑到选择组特定适配子的目的, 必须公开 PAEs 的通用组以核酸适体绑定, 并防止其余部分参与核酸适体绑定。因此, 应在侧链终端上引入功能组。开始时, 我们设计了 OH 功能化的 DEHP (4-OH−DEHP) (图 1E) 作为锚定目标, 并将其固定在羧酸磁珠16上。因此, 烷基链暴露在基体表面。我们试图选择磁性珠子与羧基基团作为固体基质。五轮选择后没有明显的亲和性改善, 裸基质的非特异性吸收保持强烈。
因此, DBP-NH2后来是基于以下思想设计的: (1) 邻苯二甲酸酯组比烷基链更有可能与核酸适体通过π-π栈和氢键相互作用;(2) NHS 介导的 carbodiimide 反应温和, 具有非常有效的耦合效率, 因此, 在 DBP 的烷基链末端引入 NH2 ;(3) 磁珠作为固相分割, 易于操作, 但对库的非特异性吸附较强。虽然在分离过程中, 琼脂糖珠的损失比磁性珠子高, 但对图书馆的非特异性吸附则低得多。因此, DBP-NH2被固定在环氧活化的琼脂糖珠上, 而邻苯二甲酸脂肪酸酯组暴露在基体表面。
选择缓冲器的选择是很重要的, 特别是对于具有不同溶解度的小分子靶点。需要仔细准备绑定缓冲区, 以避免聚合, 并确保持久性有机污染物在整个核酸适体选择和描述过程中的分散状态良好。在我们的研究中, 我们发现 DEHP 不能溶解在常规缓冲器没有表面活性剂, 显示两个不同的层次。在优化数量中添加多个表面活性剂后, 该层消失。明确的解决方案需要存储在温度高于20摄氏度, 以保持其状态。详细信息载于《议定书》步骤3.1。
双链 PCR 产物单链 DNA 的生成是 SELEX 过程中的一个关键步骤。目前在文献32、33中描述了几种不同的方法, 包括不对称 PCR、λ exonuclease 消化、链亲和素涂层珠的磁性分离和变性的粒度分离。尿素聚丙烯酰胺凝胶。
不同的方法有自己的长处和短处。目前, 最常用的 ssDNA 生成方法是用链亲和素包覆的珠子进行磁分离。该方法具有省时、操作简单等优点。缺点是它的高成本与其他方法相比。与此相反, 采用带 GC stem–loop 结构的反向引物进行尺寸分离的方法是最便宜的方法之一, 而单链 DNA 的收率在这些方法中是最低的32。在本协议中, 我们描述了使用λ exonuclease 消化产生单链 DNA, 这是最便宜的方法之一。结果表明, 单链 DNA 的屈服率与磁分离法和链亲和素涂层珠的两种方法相比较。此外, 我们发现, exonuclease 反应是由高浓度的盐抑制。在文献33中报告的 pcr 产物的不完全消化可能是由于 pcr 产物中存在太多的盐。此外, λ exonuclease 非常活跃且价格低廉 (图 4)。
适配子的特性和验证非常费力, 耗时, 并且在核酸适体发现管线33中体现了一个主要的瓶颈。大多数技术都是对较大的核酸适体结合伙伴 (> 1万) 有很好的质量敏感的方法, 但对于测量低分子量目标 (< 1000)15 之间的相互作用不够敏感。像 PAEs 这样的疏水性小分子适配子的特性和验证更加困难。它们的水溶性差导致滴定曲线的不饱和度, 从而防止了K d 在溶液中或力场适配子表面上的测定.因此, 我们通过在亲水性磁珠上固定的 DBP-NH 2 , 通过高吞吐量排序确定了已识别适配子的 K d, 以避免溶解度问题。适配子对其他 PAEs 的相对亲和性和选择性由竞争性化验确定, 核酸适体候选者被预先限定在 DBP- NH 2 附着的磁性珠子上, 并在孵化后释放到上清。与测试的 PAEs 或其他潜在的干扰物质。竞争试验的应用, 因为它提供了一个简便的亲和力比较 PAEs 之间没有功能组的表面固定化。此外, 磁性珠基荧光检测方法适用于小分子核酸适体相互作用的亲和性研究34。然而, 我们发现, 磁珠有时会导致荧光淬火的原因不明。因此, qPCR 测定用于亲和性测量。
本研究描述的电化学生物传感器的一个关键技术提示是电极35的表面钝化。由于 DEHP 的高疏水性, 它有很强的 nonspecifically 吸收到金电极上的倾向, 导致检测失败。最常用的表面钝化剂, 6-巯基-1-hexanol (MCH)36,37, 不足以防止 DEHP 的非特异性吸收, 而我们发现 HS-(CH2)2-[2 CH 2]6-DEHP3的有效性足以启用对38的敏感检测.
本程序描述了一种用于选择高度疏水性小分子的组特定 DNA 适配子的协议, 以及在电化学生物传感器中选择核酸适体的应用。该协议有助于选择其他疏水小分子, 并提供了关于高疏水性小分子的传感器发展的见解。核酸适体选择过程属于目标固定化方法的范畴。此类方法的局限性也存在于此协议中, 例如需要复杂的锚定目标综合, 以及固相对核酸适体结合的影响。本协议所描述的电化学生物传感器具有很大的优越性, 包括其简单的设计和高灵敏度。主要的缺点是它们的精度有限, 因为它们的动态范围非常广泛。因此, 这里描述的生物传感器更适合于筛选试验, 而不是定量测量目标。
披露声明
作者声明没有竞争的财政利益。
致谢
我们感谢国家自然科学基金 (21675112)、北京教育委员会科技计划重点项目 (KZ201710028027) 和首都师范大学燕京青年学者项目的资助。
材料
| Name | Company | Catalog Number | Comments |
| UV-2550 | Shimadzu,Japan | protocol, section 3.8.2 | |
| DNA Engnine Thermal cycler,PTC0200 | BIO-RAD | section 3.5.1.2 and 3.5.2 | |
| C1000 Touch | BIO-RAD | section 5.3.6 and 6.3 | |
| VMP3 multichannel potentiostat | Bio-Logic Science, Claix, France | section 7.4,7.8 and 7.11 | |
| Epoxy-activated Sepharose 6B | GE Healthcare (Piscataway, NJ, USA) | 10220020 | argarose beads, section 2.3 and 3.3 |
| Dynabeads M-270 carboxylic acid magnetic beads | Invitrogen, USA | 420420 | magnetic beads,section 5.2. and 5.3 |
| Premix Taq Hot Start Version | Takara,Dalian,China | R028A | polymerase, section 3.5.1.1 |
| PARAFILM Sealing Membrane | Bemis, USA | PM-996 | section 3.6.5 |
| Lambda Exonuclease | Invitrogen, USA | EN0561 | section3.7.1.2.The 10 × reaction buffer is provided along with λ exonuclease by the provider. |
| Dr. GenTLE Precipitation Carrier | Takara,Dalian,China | 9094 | section 3.6.2 and 3.8.1 |
| UNIQ-10 PAGE DNA recovery kit | Sangon Biotech (Shanghai) | B511135 | section 4.2 |
| SYBR Gold nucleic acid gel stain | Invitrogen, USA | 1811838 | nucelic acid stain dye, section 3.5.1.5 |
| SYBR Premix Ex Taq II | Takara,Dalian,China | RR820A | polymerase mix contaning polymerase and dNTPs, section 5.3.5 |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Sigma-Aldrich | CAS: 1132-61-2 | section 5.2.1 |
| 1-ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride (EDC) | Invitrogen, USA | CAS: 25952-53-8 | section 5.2.2 |
| N-hydroxysuccinimide (NHS) | Sigma-Aldrich | 6066-82-6 | section 5.2.3 |
| mercaptohexanol (MCH) | Sigma-Aldrich | CAS: 1633-78-9 | section 7.7 |
| Gold electrode | Shanghai Chenhua | CHI101 | section 7.4. - 7.11 |
| tris(2-carboxyethyl) phosphine hydrochloride (TCEP) | Sigma-Aldrich | CAS: 51805-45-9 | section 7.5 |
| O-(2-Mercaptoethyl)-O'-methyl-hexa-(ethylene glycol) | Sigma-Aldrich | CAS: 651042-82-9 | section 7.7 |
| diethylhexyl phthalate (DEHP) | National Institute of Metrology, China | CAS: 117-81-7 | section 7.11 |
| Tween 20 | Sigma-Aldrich | CAS: 9005-64-5 | polyoxyethy-lene(20) sorbaitan monolaurate |
| Triton X-100 | Sigma-Aldrich | CAS: 9002-93-1 | non-ionic surface active agent |
| PBS | Sigma-Aldrich | P5368 | 10 mM phosphate buffer containing 1 M NaCl, pH 7.4 |
参考文献
- Vorkamp, K., Riget, F. F. A review of new and current-use contaminants in the Arctic environment: Evidence of long-range transport and indications of bioaccumulation. Chemosphere. 111, 379-395 (2014).
- Net, S., Sempere, R., Delmont, A., Paluselli, A., Ouddane, B. Occurrence, fate, behavior and ecotoxicological state of phthalates in different environmental matrices. Environ Sci Technol. 49 (7), 4019-4035 (2015).
- Xie, Q. L., Liu, S. H., Fan, Y. Y., Sun, J. Z., Zhang, X. K. Determination of phthalate esters in edible oils by use of QuEChERS coupled with ionic-liquid-based dispersive liquid-liquid microextraction before high-performance liquid chromatography. Anal BioanalChem. 406 (18), 4563-4569 (2014).
- Ierapetritis, I., Lioupis, A., Lampi, E. Determination of phthalates into vegetable oils by isotopic dilution gas chromatography mass spectrometry. Food Anal Methods. 7 (7), 1451-1457 (2014).
- Sun, J. Z., He, H., Liu, S. H. Determination of phthalic acid esters in Chinese white spirit using dispersive liquid-liquid microextraction coupled with sweeping beta-cyclodextrin-modified micellar electrokinetic chromatography. J Sep Sci. 37 (13), 1679-1686 (2014).
- Yilmaz, P. K., Ertas, A., Kolak, U. Simultaneous determination of seven phthalic acid esters in beverages using ultrasound and vortex-assisted dispersive liquid-liquid microextraction followed by high-performance liquid chromatography. J Sep Sci. 37 (16), 2111-2117 (2014).
- Sun, R., Zhuang, H. An ultrasensitive gold nanoparticles improved real-time immuno-PCR assay for detecting diethyl phthalate in foodstuff samples. Anal Biochem. 480, 49-57 (2015).
- Sun, R. Y., Zhuang, H. S. A sensitive heterogeneous biotin-streptavidin enzyme-linked immunosorbent assay for the determination of di-(2-ethylhexyl)phthalate (DEHP) in beverages using a specific polyclonal antibody. Anal Methods. 6 (24), 9807-9815 (2014).
- Zhou, L., Lei, Y., Zhang, D., Ahmed, S., Chen, S. An ultra-sensitive monoclonal antibody-based enzyme-linked immunosobent assay for dibutyl phthalate in human urinary. Sci Total Environ. 541, 570-578 (2016).
- Shen, J., Li, Y., Gu, H., Xia, F., Zuo, X. Recent development of sandwich assay based on the nanobiotechnologies for proteins, nucleic Acids, small Molecules, and ions. Chem Rev. 114 (15), 7631-7677 (2014).
- Yin, X. -B. Functional nucleic acids for electrochemical and electrochemiluminescent sensing applications. TrAC, Trends Anal Chem. 33, 81-94 (2012).
- Nguyen, V. -T., Kwon, Y. S., Gu, M. B. Aptamer-based environmental biosensors for small molecule contaminants. Curr Opin Biotechnol. 45, 15-23 (2017).
- Groher, F., Suess, B. In vitro selection of antibiotic-binding aptamers. Methods. 106, 42-50 (2016).
- Yang, K. -A., Pei, R., Stojanovic, M. N. In vitro selection and amplification protocols for isolation of aptameric sensors for small molecules. Methods. 106, 58-65 (2016).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal. Chim. Acta. 686 (1-2), 9-18 (2011).
- Mehta, J., et al. Selection and characterization of PCB-binding DNA aptamers. Anal Chem. 84 (3), 1669-1676 (2012).
- Matsumoto, M., Hirata-Koizumi, M., Ema, M. Potential adverse effects of phthalic acid esters on human health: A review of recent studies on reproduction. Regul Toxicol Pharm. 50 (1), 37-49 (2008).
- Goodchild, J. Conjugates of oligonucleotides and modified oligonucleotides: a review of their synthesis and properties. Bioconjug Chem. 1 (3), 165-187 (1990).
- Brown, D. M. A brief history of oligonucleotide synthesis. Protocols for Oligonucleotides and Analogs: Synthesis and Properties. , 1-17 (1993).
- Reese, C. B. Oligo-and poly-nucleotides: 50 years of chemical synthesis. Org Biomol Chem. 3 (21), 3851-3868 (2005).
- Sproat, B., Colonna, F., Mullah, B., et al. An efficient method for the isolation and purification of oligoribonucleotides. Nucleos Nucleot Nucl. 14 (1-2), 255-273 (1995).
- Han, Y., et al. Selection of group-specific phthalic acid esters binding DNA aptamers via rationally designed target immobilization and applications for ultrasensitive and highly selective detection of phthalic acid esters. Anal Chem. 89 (10), 5270-5277 (2017).
- Bartlett, J. M. S., Stirling, D. A short history of the polymerase chain reaction. PCR protocols. , 3-6 (2003).
- Saiki, R. K., Scharf, S., Faloona, F., et al. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. Science. 230, 1350-1354 (1985).
- Albright, L. M., Slatko, B. E. Denaturing polyacrylamide gel electrophoresis. Current Protocols in Nucleic Acid Chemistry. , A. 3B 1-A. 3B 5 (2001).
- Summer, H., Grämer, R., Dröge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). JoVE. (32), e1485(2009).
- Jing, M., Bowser, M. T. Methods for measuring aptamer-protein equilibria: a review. Anal Chim Acta. 686 (1), 9-18 (2011).
- Sharma, T. K., Bruno, J. G., Dhiman, A. ABCs of DNA aptamer and related assay development. Biotechnol Adv. 35 (2), 275-301 (2017).
- Liu, R., et al. Signaling-probe displacement electrochemical aptamer-based sensor (SD-EAB) for detection of nanomolar kanamycin A. Electrochim Acta. 182, 516-523 (2015).
- Mendonsa, S. D., Bowser, M. T. In vitro evolution of functional DNA using capillary electrophoresis. J Am Chem Soc. 126, 20-21 (2004).
- Lou, X. H., et al. Micromagnetic selection of aptamers in microfluidic channels. Proc Natl Acad Sci USA. 106 (9), 2989-2994 (2009).
- Cho, M., et al. Quantitative selection of DNA aptamers through microfluidic selection and high-throughput sequencing. Proc. Natl. Acad. Sci. U.S.A. 107, 15373-15378 (2010).
- Cho, M., et al. Quantitative selection and parallel characterization of aptamers. Proc Nat Acad Sci USA. 110 (46), 18460-18465 (2013).
- Song, K. -M., et al. Gold nanoparticle-based colorimetric detection of kanamycin using a DNA aptamer. Anal Biochem. 415 (2), 175-181 (2011).
- Yang, Z., Ding, X., Guo, Q., et al. Second generation of signaling-probe displacement electrochemical aptasensor for detection of picomolar ampicillin and sulfadimethoxine. Sens Actuators B. 253 (2017), 1129-1136 (2017).
- Lou, X., Zhao, T., Liu, R., Ma, J., Xiao, Y. Self-assembled DNA monolayer buffered dynamic ranges of mercuric electrochemical sensor. Anal Chem. 85 (15), 7574-7580 (2013).
- Zhao, T., et al. Nanoprobe-enhanced, split aptamer-based electrochemical sandwich assay for ultrasensitive detection of small molecules. Anal Chem. 87 (15), 7712-7719 (2015).
- Lou, X., He, L. A. Surface passivation using oligo(ethylene glycol) in ATRP-assisted DNA detection. Sens Actuators,B. 129 (1), 225-230 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。