Method Article
Рассечение и экспланта культуры мышиных Аллантоис для анализа в пробирке Allantoic вложения
В этой статье
Резюме
Мы описываем в vitro пробирного модель chorioallantoic насадку, первый шаг в формировании плаценты. Протокол показывает вскрытие и экспланта культуры мышиных allantoides на иммобилизованных α4β1 Интегрин. Аллантоис вложений оценивается микроскопически в предопределенное время точках.
Аннотация
Плацента имеет важное значение для роста и развития у млекопитающих эмбрионов. По этой причине многие генетические изменения и вероятно также экологические оскорбления, которые мешают развитию плаценты или функция может привести к ранней потери беременности мышей и людей. Тем не менее хватает простой в vitro анализов для потенциального воздействия на формирование плаценты. Здесь мы сосредоточены на моделирование первый и критический шаг в формирования плаценты, которая состоит из приверженность Аллантоис хориона. Мы описываем метод, чтобы быстро оценить вложение allantoic эксплантов на иммобилизованных α4β1 Интегрин, который служит Хорио подражательный субстрата. Этот подход в vitro позволяет качественной оценки вложения и распространение поведение нескольких Аллантоис эксплантов в точках различных раз подряд. Протокол может использоваться для исследовать эффект целевой мыши мутации, наркотиков или различных экологических факторов, которые были связаны с осложнений беременности или потери плода на Аллантоис вложение ex vivo.
Введение
Плацента является необходимым для эмбрионального роста и развития в условиях матки. Это представляет собой интерфейс для кислорода, метаболит и питательных обмен между обращения матери и плода, а также функции как эндокринной и иммунной орган. Любое эндогенного или экзогенного оскорбление, которое препятствует плацентарный развития может привести к внутриутробного развития, потери плода или осложнений беременности, мышей и людей1. В то время как количество целевых мыши мутаций, которые вызывают аномальные плаценты физиологии продолжает расти2, с 219 генотипов, в настоящее время перечислены на веб-сайте информатики генома мыши (MGI) (http://www.informatics.jax.org/vocab/ mp_ontology / MP:0010038), не многие из этих фенотипы хорошо известны из механистической точки зрения. Наряду с генетическими аномалиями, малые молекулы наркотики, моноклональные антитела, токсинов патогенов, избыток метаболитов или различных экологических агентов могут повлиять на развитие плаценты и функции3,4,5 , 6 , 7. Тем не менее, простые в vitro assays модель важнейшие шаги в развитие плаценты скудны.
Мышиных плацентарной развития начинается в начале midgestation, когда Аллантоис (развития предшественник пуповины) вытекает из заднего конца эмбриона как бутон, который растет в сторону хориона8. Chorioadhesive клетки в наружном слое allantoic бутон посредником вложение и распространение Аллантоис на поверхности хориона (chorioallantoic «фьюжн»). Хорион впоследствии складывается в Вилли, в которые сосудистую Аллантоис растет сформировать лабиринт, внутренний слой плацентарный, где питательные вещества и кислород обмениваются тесно совмещенных материнской крови синусоиды и эмбриональных судов9 ,10.
Приверженность Аллантоис Хорион является первоначальный и критический шаг в формировании лабиринт, и дефекты в этом процессе являются одними из наиболее распространенных причин эмбриональной летальность в midgestation1. Хотя ряд мыши мутантов были описаны chorioallantoic вложений не происходят10, где базы данных MGI в настоящее время перечислены 108 мыши мутантов, которые характеризуются ненормальных chorioallantoic Фьюжн (http:// www.informatics.JAX.org/Vocab/mp_ontology/MP:0002824), межклеточное взаимодействие между адгезии клеток сосудистой молекулы-1 (VCAM-1, выраженные на allantoic мезодермы) и α4β1 Интегрин (выраженный на хорионический мезотелия, который является производные от extraembryonic мезодермы) представляется необходимым для chorioallantoic привязанность и фьюжн11,12,13. Иммуногистохимическое окрашивание всей гора одичал тип эмбрионов показали, что VCAM-1 выражается в дистальной две трети allantoic стеблю на приблизительно эмбриональных день (E) 7,513 (1-4 Сомит этап), и что его выражение остается высоким во время chorioallantoic привязанность и - сплавливание11,12. Провал allantoic привязанность к Хорион обычно обнаруживается гистологический анализ матки почки. Однако размеры Аллантоис физиологически сильно варьирует между ними и даже в пределах пометов же стадии развития14, и Аллантоис можно подключать только к хориона, когда она достигла достаточного размера, чтобы сделать физический контакт. Отражая этот естественной изменчивости, chorioallantoic насадку происходит где-то между ~ E 8.0 и E 9.0 в утробе материи статистически достоверное оценки этого процесса, гистология зависит поэтому анализ большого числа conceptuses для получения достаточно образцов на соответствующей стадии развития.
Здесь мы описываем метод для оценки allantoic вложение ex внутриутробно , в меньшей степени зависит от размера Аллантоис. Мы демонстрируем рассечение зародышей мыши и их allantoides от матки беременных мышей ~ 8 дней, сообщение coitum (dpc; dpc 0.5 обозначает обнаружения Вагинальные вилка), и последующие культуры Аллантоис эксплантах на иммобилизованных α4β1 интегринов. Этот метод позволяет быстрый, функциональной оценки вложения и распространение поведение нескольких Аллантоис эксплантов параллельно и в разное время последовательных точек. Протокол может использоваться экран для воздействия целевых мутации, наркотиков или различных экологических факторов на Аллантоис вложение ex vivo.
протокол
Разведение мыши был одобрен Regierung Унтерфранкен, и все анализы проводились в строгом соответствии с немецкого и Европейского союза применимые законы и правила, касающиеся ухода и использования лабораторных животных.
1. покрытие микротитровальных плиты с α4β1 Интегрин Ex Utero Аллантоис экспланта культуры
- Воссоздать Интегрин лиофилизированные мышиных α4β1 на 200 мкг/мл в стерильных фосфат амортизированное saline (PBS). Разбавляют до конечной концентрации 10 мкг/мл в подогретым (37 ° C) PBS. Пипетка 20 мкл/хорошо Интегрин решения разреженных α4β1 в требуемое количество скважин микротитровальных плиты (1 Аллантоис/хорошо).
Примечание: Избегайте образования пузырьков воздуха когда покрытие скважин микротитровальных пластины. - Инкубируйте микротитровальных пластины для 60 мин при 37 ° C, поместив их в инкубаторе увлажненные культуры ткани.
- Тщательно удалить супернатант с пипеткой. Используйте нежное всасывания и наклона пластины не прикасайтесь к нижней хорошо кончиком пипетки. Промыть скважин дважды, добавляя 50 мкл подогретым (37 ° C) питательной среды например Дульбекко изменение Eagle среднего (DMEM) и удалите средство Стиральная, нежный всасывания.
- Важный шаг: блок бесплатные сайты связывания, добавляя 50 мкл/колодец 0,1% (w/v), бычьим сывороточным альбумином (БСА) / DMEM и проинкубируйте ≥ 30 минут при 37 ° C, поместив микротитровальных пластины в инкубаторе увлажненные культуры ткани.
Примечание: Аллантоис эксплантов можно прикрепить к различным поверхностям присутствии сыворотки. Поэтому важно, чтобы блокировать сайты без конкретной привязки, после покрытия лунки с Интегрин и перед добавлением расчлененных Аллантоис для explant культуры в сыворотке содержащих средний (см. шаг 4.4). - Держите покрытием скважин в решении блокировки при 37 ° C до тех пор, пока в шаге 4.4.
2. матки рассечение от беременной мыши в Dpc 8
Примечание: Уменьшайте ложно положительных беременности вес усиления дискриминации15.
- Пожертвуйте мыши шейки матки дислокации. Продезинфицируйте пальто в брюшной области путем распыления с 70% (v/v) этанола.
Примечание: Надевайте перчатки при обработке мышей. Эвтаназия, шейки матки дислокации без анестетиков предотвращает химическое загрязнение Аллантоис, которая может помешать с вложением Аллантоис. - Откройте брюшной кожи, делая небольшой надрез в средней линии с ножницами. Использование пальцев перчатке провести выше и ниже разрез кожи и потяните кожу друг от друга на грудь и хвост мыши.
- Захватите брюшины с щипцами. С другой стороны V-образный разрез от передней к задней с помощью ножниц и переместить ткани прочь подвергать брюшной полости. Используйте щипцы для толкать кишечника в одну сторону для того, чтобы получить доступ к матке.
- Найдите два рога матки. Держите шейки матки (хвостовой сегмент) с щипцами и вырезать связок с тонкой ножницами. Затем отсоедините оба маточные рожки, разорвав яйцеводов с ножницами.
- Используйте щипцы для передачи матки в стерильные 10 см блюдо, содержащий стерильные, PBS комнатной температуры (RT). Удаление жировой ткани, сосуды и нервы, окружающих маточные рожки с тонкой щипцами или ножницы (рис. 1A).
3. эмбриона рассечение
Примечание: Выполните следующие действия под стереомикроскопом оснащены 8:1 увеличить диапазон.
- Разделяются резки между сайты имплантации эмбрионов с ножницами. Возьмите мышечной матки матка почки с щипцами и тянуть его врозь подвергать decidua (Рисунок 1B).
- С помощью щипцов, передача матки почки в новое блюдо 10 см, содержащие стерильные, RT PBS.
- Исправьте decidua вокруг эмбриона с советами щипцами.
- Сделать надрез на стороне анти mesometrial decidua с тонкой щипцами (рис. 1 c) и удаляйте decidua пинцетом подвергать эмбриона (рис. 1 d).
Примечание: Mesometrial полюса decidua высоко васкуляризированной и может быть шире на своей базе анти mesometrial часть, которая содержит эмбриона и появляется бледнее. - Вскрыть эмбриона с щипцами (Рисунок 1E, F).
- С помощью микро ложки, перенос эмбриона в капли стерильные PBS, содержащихся в стерильных 3,5 см блюдо.
- Переноса эмбриона в свежие капли PBS в том же блюдо 3,5 см, с помощью микро ложки и вскрыть эмбриона из желточного мешка, с помощью щипцов (Рисунок 1 g, H).
- При необходимости, в случае необходимости (например, для генотипирования полимеразной цепной реакции), передачи желточного мешка в стерильную пробирку, аспирационных с ~ 5 мкл PBS в наконечник пипетки большого отверстия 200 мкл. Хранить при температуре от-20 ° C.
Примечание: Материнской ткани (то есть, теменную желточного мешка, включая Райхерт мембраны и ectoplacental конус), которые могут загрязнить желточного мешка подготовка может привести к ошибочной генотипирования результатов. Удаление этих тканей является простым до вскрытия эмбриона из желточного мешка.
4. Аллантоис диссекции и Ex Utero культура на иммобилизованных α4β1 Интегрин
- Вырежьте Аллантоис от своего сайта базальной вставки на задний конец эмбрионов, с помощью тонкой щипцы (рис. 1 H).
- При необходимости при необходимости развития промежуточной, граф Сомит пар эмбриона путем визуального осмотра с помощью микроскопа, оборудованных с фазы контраст Оптика и 5 × 10 × цели.
Примечание: Эмбрион может быть расширен с щипцами для облегчения подсчета Сомит. Chorioallantoic и слияния происходят между E 8.0 и E 9.0 эмбрионов с ≥ 6 Сомит парами. Касаясь начинается в эмбрионов с 6-8 Сомит пар. - Пипетка 40 мкл/колодец DMEM, дополненная плода бычьим сывороточным 10% (v/v), L-глютамин и антибиотиков в требуемое количество предварительно покрытых микротитровальных тарелка скважин (см. раздел 1).
- Собирать плавающей Аллантоис, аспирационных с ~ 5 мкл PBS в больших отверстия наконечник пипетки 200 мкл. Передача 1 Аллантоис/хорошо.
- Инкубировать allantoides, поместив микротитровальных пластины в увлажненные ткани культуры инкубатора (37 ° C, 5% CO2) например, 6, 12 и 24 ч. Во избежание вмешательства с вложением Аллантоис, не перемещайте микротитровальных пластины между этими моментами времени.
- В каждый момент времени, оценка Аллантоис вложений (например, без вложений/плавающей Аллантоис частично или полностью прилагаемый Аллантоис; полностью распространение Аллантоис) с помощью микроскопа с фазы контраст или дифференциальное вмешательства контраст Оптика и или 5 × 10 × цель (рис. 2).
Примечание: Показательные примеры свежевыделенных и полностью придает allantoides показаны на рисунке 2. Ex внутриутробно, дистального наконечника изолированные от мышей C57BL/6J wildtype allantoides придает в течение 4-6 ч (это называется частичной вложения Аллантоис), и полный вложений всей Аллантоис достигается в течение ~ 12 h культуры. 18-24 ч экспланта плоский и себя круглую форму (упоминаемый как полностью распространяться Аллантоис) с CD31-позитивных сосудистого сплетения9,16.
5. подтверждающие окрашивание Explanted Аллантоис для эндотелиальных клеток маркер CD31
- Аспирационная питательной среды полностью распространение эксплантов и исправить ячейки, добавив 40 мкл/колодец параформальдегида 4% (w/v) / PBS.
Примечание: Параформальдегида является токсичным. Надевайте перчатки и защитные очки, чтобы избежать кожу и глаза. - Проинкубируйте втечение 10 мин на RT, а затем удалить супернатант. Мыть три раза путем добавления 40 мкл/колодец PBS и удалите средство Стиральная, нежный всасывания.
- Разрушения клеток и блокировать сайты без конкретной привязки, добавив 40 мкл/хорошо 0,1% (v/v) Тритон X-100/0.1% (w/v) BSA/10% (v/v) нормальной козьего сыворотки в PBS для 30 мин на RT. мыть дважды добавляя 40 мкл/колодец PBS и удалите средство Стиральная, нежный всасывания.
Примечание: Протокол может быть приостановлена на ночь на данный момент. - Запятнать клетки, добавив, что разбавленный 20 мкл/хорошо первичных анти CD31 антител 1:50 в 0,1% (w/v) BSA/PBS на ночь при 4 ° C. Мыть три раза путем добавления 40 мкл/колодец PBS и удалите средство Стиральная, нежный всасывания.
- Выявления привязанных первичных антител, добавив 20 мкл/хорошо дневно меченых вторичных коза антитела анти крыса разбавленных 1: 200 в 0,1% (w/v) BSA/PBS для 1 h на RT. Protect микротитровальных пластины от света с оберткой в алюминиевой фольги или путем размещения в темной камере. Мыть три раза путем добавления 40 мкл/колодец PBS и удалите средство Стиральная, нежный всасывания.
- Внедрять ячейки, добавив 20 мкл/хорошо монтажа среды. Инкубируйте ~ 1 ч на RT до монтажа средних затвердевшим. Магазин микротитровальных пластины на RT или на 4 ° C, защищать от света.
- Изображения сосудистого сплетения Аллантоис эксплантах под микроскопом флуоресценции, оснащен 5 × или 10 × Цель и подходящих флуоресценции фильтры.
Примечание: Представитель изображений CD31-позитивных сосудистого сплетения полностью распространение Аллантоис показаны на рисунке 3. Другие маркеры для сосудистого сплетения, таких как антитела, направленные против Flk-1, Flt, галстук-1 или галстук-2 может использоваться как хорошо16.
Результаты
Этот протокол описывает метод для изоляции и explant мышиных allantoides ex vivoи деталей качественной оценки Аллантоис привязанность к α4β1 Интегрин, критический процесс во время в vivo chorioallantoic фьюжн. Представитель результаты, показанные на рисунке 1A–H демонстрируют последовательные шаги Аллантоис изоляции, начиная от беременной матки. Матери тканей, которые окружают рога матки, например жировой ткани и сосудов (рис. 1A), удаляются, а эмбриона разделяются от эндометрия в поэтапный моды после открытия мышечный слой матки (рис. 1B- E). Впоследствии, будут удалены другие материнской ткани, такие как теменной желточного мешка и ectoplacental конус (Рисунок 1E, F). Рисунок 1 g - H показывает, что метод включает диссекции extraembryonic Аллантоис от желточного мешка, другой extraembryonic и высоко васкуляризированной тканью. Таким образом allantoides, изолированные согласно протоколу основном свободны от загрязнения материнской или (дополнительно) эмбриональных тканях помимо Аллантоис.
Рисунок 2 показывает, что размер и форма allantoides из свеже расчлененных эмбрионов в один один помет может значительно варьироваться14. Allantoides эмбрионов C57BL/6J wildtype, расчлененные на E 8.5 имели удлиненные морфология в 74% случаев (45 61 анализируемого эмбрионов), как показано на рисунке 2 и на рисунке 1 H. Однако в 15% (9/61) эмбрионов, allantoides были заметно меньше и более округлые (см. ссылку14) и 11% (7/61) эмбрионов были еще не сформировался видимый Аллантоис во время вскрытия. Несмотря на разнородных форм и размеров в начальный момент времени Аллантоис explant культуры (рис. 2, панели –h), Аллантоис вложений и полное распространение на иммобилизованных α4β1 Интегрин наблюдалось в течение 12 ч во всех из 54 свежевыделенных allantoides расчлененный из эмбрионов семи пометов. Тем не менее, форм и размеров эксплантов после 12 h культуры были несколько разнородных (рис. 2), отражающий различные allantoic морфологии в начальной точке assay.
На рисунке 3 показана иммуноцитохимическое, пятнать для CD31-позитивных эндотелиальных клеток в полностью прилагаемый allantoides после 24 ч экспланта культуры, которая подтверждает, что эксплантов разработал сосудистого сплетения на этот момент времени, как ожидается9 , 16. такие адэрентных Аллантоис культуры может использоваться для изучения формирования кровеносных сосудов в vitro9. Следовательно эксплантов Аллантоис урожайности представленных методологии, которые могут быть легко культивировали ex vivo, по согласованию с ранее опубликованы экспериментальные исследования9,16.
Протокол устанавливает рамки для оценки на основе микроскопии Аллантоис вложения в заранее заданное время точках, таких как через 12 ч или 24 ч экспланта культуры. Результаты можно оценить на основе качественных (частичная/полная вложение или полное распространение на данный момент – да/нет). Так как же экспланта может неоднократно визуализируется и забил, этот анализ отражает характеристики отдельных Аллантоис explant культур с течением времени. Кроме того, формирование сосудистого сплетения в фиксированной и окрашенных эксплантов могут быть оценены (рис. 3).

Рисунок 1: представитель шаги в Аллантоис диссекции. (A) подробно посмотреть из изолированных рога матки. Бутоны матки, содержащего эмбрионы отмечены звезд; на левой стороне видны жировой ткани и сосудов, вокруг рога матки. (B) вид decidua (эндометрия) после удаления мышечного слоя матки. Весьма васкуляризированной, mesometrial полюс decidua ориентирован слева, анти mesometrial часть (отмечены звездочкой), которая содержит эмбриона ориентирован справа. (C) сторона вид расчлененных анти mesometrial полюс decidua (отмечены звездочкой). Стрелка указывает расположение эмбриона. (D) вид сверху зародыш (стрелка), окруженный париетальной желточного мешка после частичного удаления окружающие decidua. (E, F) Представитель представления последующих шагов в рассечение эмбриона (стрелка). Стрелка указывает желточного мешка. (E) ectoplacental конус (epc) виден справа. (G) частичное вскрытие эмбриона (стрелка) из желточного мешка (стрелок). Аллантоис помечается с красной звездой. (H) изолированные эмбриона (стрелка) с Аллантоис (Красная звезда). Позиция, где Аллантоис будет вырезать из своего сайта базальной вставки на заднем конце эмбриона обозначен красной ломаной линии. Изображения были взяты на стереомикроскопом с диапазоном зум 8:1. Все бары масштаба являются 1 мм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
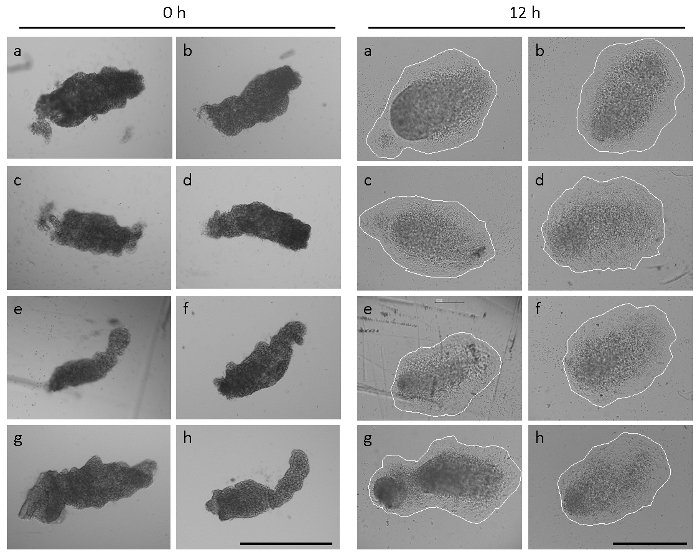
Рисунок 2: разнородных форм и размеров allantoides. Восемь allantoides (–h) были изолированы от эмбрионов один одного помета. Левая панель, allantoides сразу после вскрытия (0 h). Правая панель, же allantoides после 12 h экспланта культуры. Эксплантов прочно прикреплены, и Мезенхимальные клетки распространились. Эксплантов кружил визуализировать экспланта размеров. Изображения были взяты на микроскоп оснащен фазы контраст Оптика и 5 × (Левая панель) или 10 × цель (правая панель). Все бары масштаба являются 500 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: формирование сосудистого сплетения в культурах экспланта Аллантоис. Allantoides были расчленены и описаны на иммобилизованных α4β1 Интегрин как описано в настоящем Протоколе. Эксплантов были культивированный на 24 часа, и эндотелиальных клеток сосудистого сплетения окрашивали с использованием первичных антител анти CD31 и дневно помечены вторичные антитела. Эндотелиальные клетки отображаются зеленым цветом. Верхнее изображение показывает весь сосудистого сплетения в центральной области представитель Аллантоис экспланта. Изображение было взято на микроскопе оснащены флуоресценции Оптика и 5 × цели. Линейки, 500 мкм. Две нижние панели являются выше увеличение изображения другой Аллантоис экспланта расчлененные и культивировали в тех же условиях. Судно как структуры и отдельных эндотелиальные клетки можно увидеть. Изображения были взяты на Конфокальный микроскоп; масштаб баров, 25 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Присутствии сыворотки, которая является богатым источником про клей внеклеточного матрикса молекул, например, фибронектин, Аллантоис эксплантов будет легко прикрепить различные пластика, стекла или фильтр поверхности9,16. Таким образом если цель выполненных assay специально исследовать эффект генетической модификации или любым другим лечением на Аллантоис привязанность к иммобилизованные α4β1, важно для блокирования сайтов связывания неспецифические (например, с бычьим сывороточным альбумин) после покрытия поверхности с Интегрин и до инкубации с сыворотка содержащих средств массовой информации.
Первоначальный приверженность Аллантоис эксплантов иммобилизованные α4β1 Интегрин очень чувствителен к движению, и культура ткани пластины следует поэтому оставить нетронутыми для заранее определенного периода времени (например, за 12 ч) до озвучивание Аллантоис вложение. Обратите внимание, что время, необходимое для стабильной контакта формирования с подложки могут отличаться в зависимости от штамма анализируемого мыши или концентрация Интегрин иммобилизованные α4β1.
Требование межклеточных VCAM-1/α4β1-взаимодействия для успешного chorioallantoic fusion является прочно установившейся11,12,13. Кроме того молекулы внеклеточного матрикса фибронектин, коллагенов и других молекул интереса можно также прикол и используется как «Хорио подражательный» субстратов.
Chorioallantoic вложений зависит от Межклеточные взаимодействия между VCAM-1 и его связывание партнера Интегрин α4β1. В утробе матери, chorioallantoic и последующего слияния может произойти только когда Аллантоис расширила достаточно сделать контакт с хориона. Учитывая физиологические изменчивость Аллантоис размеров на определенной стадии развития, chorioallantoic и слияния занять место где-то между E 8.0 и 9.0 E (диапазон, E 9,25 7,5 E)14,16. Методы для специально исследование переходных процессов Аллантоис привязанность к хорионический пластины в утробе матери в жизни мыши не легко доступны в настоящее время. Скорее анализы основном сосредоточены на трудоемкий определение chorioallantoic fusion по гистологической оценки например, allantoic распространения на поверхности хориона и развитие лабиринт слоя на одном, заранее время пункт11,12,13,16. Этот анализ конечной точки не могут различать дефекты, которые непосредственно обусловлены нарушением вложение Аллантоис хориона и Хорион зависимых эффектов и ограничивается присущих изменчивости в стадии развития эмбриона и allantoic размеры. Как указано в разделе Представитель результаты, физиологической вариабельности Аллантоис размеров может привести к относительной задержки в chorioallantoic fusion в ~ 26% C57BL/6J wildtype эмбрионов. Статистически говоря, почти два из семи беременным мышам таким образом были бы жертву слишком рано (61 эмбрионов из семи пометов, средняя помет размер 8.7), которая преобразует в необходимости существенного разведение избыток крупномасштабных исследований. Интересно, что микрохирургическое эксперименты показали, что Хорион уже компетентным слиться с Аллантоис на стадии 1 пара Сомит, и что Аллантоис exhibits максимальной фьюжн потенциала эмбрионов с 3-5 Сомит пары14. Следовательно chorioadhesive клетки Аллантоис, сформированных и функционально компетентным до фактической chorioallantoic вложения в естественных условиях. Анализ ex utero Аллантоис привязанность к иммобилизованных лигандов, изложенные здесь, поэтому относительно независимо от размера данного Аллантоис. Таким образом одним из преимуществ данного метода является, что он обходит дефекты Аллантоис удлинение и фокусируется на следующем шаге формирования плаценты, т.е., chorioallantois насадку. Этот подход может таким образом использоваться для различения дефекты Аллантоис удлинение и chorioallantois вложения в генетических мыши мутантов.
В отличие от традиционного метода Аллантоис стремление от его точка прикрепления эмбрион, используя рот пипеткой16текущий протокол использует ручной резки подход, и Аллантоис впоследствии обрабатывается с помощью большого отверстия наконечники . Важным преимуществом Аллантоис аспирации является, что этот метод позволяет избежать обработки прямой ткани. Резка и обработка Аллантоис может повредить клетки chorioadhesive оболочка allantoic мезотелия. Тем не менее, резка Аллантоис пинцетом успешно использовался раньше в ex vivo культур pre-placental тканей17, и кинетика allantoic экспланта вложения и морфологии культуры экспланта описан в настоящее исследование похожи на опубликованные данные, основанные на Аллантоис изоляции путем аспирации16. Эти результаты показывают, что chorioadhesive клетки достаточно хорошо сохранились после ручной резки Аллантоис, и что экспланта дифференциация не возмущенных грубо, как указано, формирование CD31-положительных endothelia. Прямая резка Аллантоис также предлагает возможность вскрыть только верхние две трети Аллантоис которые выражают VCAM-113, и он обеспечивает меньше загрязнения с желточного мешка производные клетки, которые могут быть обрезаны далеко от основания Аллантоис после Аллантоис стремление18.
Анализ ex utero allantoic экспланта адгезии к прикол, рекомбинантных α4β1 Интегрин обеспечивает качественное индикация один важный, первоначальный шаг, который требуется для chorioallantoic fusion, т.е., межклеточного взаимодействия между VCAM-1 выразил на Аллантоис, и α4β1 Интегрин локализованных хорионический мезотелия, который является производным от extraembryonic мезодермы. Тем не менее, хотя эти два сцепления молекул распознаются как принцип игроков в chorioallantoic fusion, ~ 50% эмбрионов с гомозиготной нокаут мутации в VCAM-1 или α4 Интегрин проходят chorioallantoic фьюжн в vivo11 ,12,13. Из-за этого неполной пенетрантностью ex vivo метод, описанный в настоящем Протоколе не может быть достаточно, чтобы исключить требование для этих двух сцепления молекул в генетической модели с ошибкой chorioallantoic синтеза.
В физиологических условиях α4β1 интегринов встраиваются в плазматической мембране хорионический трофобласты и включены в сложную сеть структурных и сигнализации белков, которые сотрудничают регулировать ячеек (и клеток матрица) адгезии 19. как большинство редукционистской в vitro подходы, сложность хорионический интерфейс привязки VCAM-1 только моделируется в весьма ограниченной степени Интегрин иммобилизованные α4β1. Помимо потенциального отсутствия других важных структурных или сигнальных входов, производный от нетронутыми хориона в этой системе вполне вероятно, что лишь незначительная часть интегринов, иммобилизованных на грузовик, двумерной поверхности присутствуют в активной, Привязка компетентных, «открыть» конформации.
Представленный метод приближается ранней привязанности и распространение шаг Аллантоис хориона, а также доклад о развитии allantoic сосудистого сплетения в сочетании с анализом судна формировании9. Однако, нынешний подход не модели вторжения Хорион прорастания ангиогенеза, опосредовано allantoic эндотелиальных клеток, и он не отражает ветвления морфогенеза, Хорио, которая является важным процессом для chorioallantoic fusion и последующее развитие плаценты лабиринт10.
С помощью фазового контраста или микроскопия дифференциальной помехи, в сочетании с (полу-) автоматизированных анализа изображений, представленных метод может применяться в крупных экранов для первоначального анализа задерживается или allantoic вложения в пробирке. Помимо анализа мыши мутантов метод может представлять интерес для экрана воздействия наркотиков, патогенов, метаболитов или экологических агентов на allantoic вложения.
В многочисленных мыши мутантов chorioallantoic насадку не происходят, хотя Аллантоис и хориона, как представляется, разработали нормально. Кроме того мутанты, которые обычно показывают chorioallantoic вложение дефекты отображения неполной пенетрантностью1,2,10. Это будет важно расследовать ли эти функционально видимо очень разные гены влияют общие молекулярные пути и/или клеточных процессов. Живой изображений эксплантов Аллантоис, производный от мутантов мышь имеет потенциал для прояснения таких механизмов. Например, клетки в оболочка расчлененных Аллантоис могут быть помечены жизненно Краски люминесцентные, флуоресцентные (например DiI и DiO липофильных карбоцианиновыми Трейсеры16,18) изображение адгезии и распространения событий, или отслеживать ячейки Миграция в реальном времени. Кроме того флуоресцентный репортеров, которые визуализировать белков цитоскелета или адгезии может оказаться информативным.
Недавно был описан ex vivo Сопредседатель культуры системы для предварительных вложений мышиных allantoides и chorions, и этот подход успешно использовался для расследования событий, которые происходят после chorioallantoic вложения, такие как лабиринт слой формирование17. Анализ эффективности вложений Аллантоис на иммобилизованных chorions, изолированных от различных (например, генетически модифицированные) мыши модели может принести новое понимание молекулярных игроков и пути, которые управляют первые шаги в развитии мышиных плаценты.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана Deutsche Forschungsgemeinschaft SFB688 (чтобы а.г.).
Материалы
| Name | Company | Catalog Number | Comments |
| C57BL/6J wildtype mice | The Jackson Laboratory | Stock No: 000664 | |
| 70 % (v/v) Ethanol | VWR International | 930031006 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | Forceps used to open the abdominal cavity. |
| Micro dissecting forceps | Fine Science Tools | 11254-20 | Dumont # 5 medical biology forcepts with fine, sharp tip. |
| Fine scissors | Fine Science Tools | 14094-11 | Straight blades. |
| Spring scissors | Fine Science Tools | 15012-12 | Noyes spring scissors with 14 mm blades for the dissection of uterus buds. |
| Microspoon | Carl Roth | AT18.1 | 5 mm Spoon diameter. |
| Microtiter plates | ibidi | 81501 | We use uncoated, sterile angiogenesis slides (internal volume 50 µL) with a hydrophobic surface that is not tissue-culture treated to reduce non-α4β1-mediated binding to plastic. |
| 10 cm dish | Nunc | 150350 | Sterile tissue culture dishes. |
| 3.5 cm dish | Nunc | 150288 | Sterile tissue culture dishes. |
| Large orifice pipette tips | Biozym | VT0140X | Low binding pipette tips, 200 µL. |
| α4β1 integrin | R&D Systems | 6054-A4 | Murine α4β1 integrin recombinantly expressed and purified from a Chinese hamster ovary cell line. |
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma Aldrich | D8537 | Without Ca2+ and Mg2+. |
| Dulbecco’s Modified Eagle Medium (DMEM) | PAN Biotech | P04-03600 | The formulation contains 4.5 g/L glucose, 110 mg/L sodium pyruvate and 3.7 g/L NaHCO3 but no L-glutamine, which is added separately. |
| Penicillin/Streptomycin | Gibco (ThermoFisher Scientific) | 15140-122 | 100 x (10,000 U/mL Penicillin and 10,000 µg/mL streptomycin) stock solution. Prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| L-Glutamine | PAN Biotech | P04-80100 | 100 x (200 mM) Stock solution. Prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Fetal bovine serum | Biochrom | S 0115 | We use heat-inactivated FBS (heated to 56 °C for 30 min with mixing to inactivate complement). |
| Bovine serum albumin (BSA) | Sigma Aldrich | A7030 | We use protease- and fatty acid-free albumin. Prepare a 0.1 % (w/v) solution in DMEM. Sterile filter the solution through a disposable cell culture filter with a 0.22 µm pore size and low protein-binding membrane, and store aliquots at -20 °C. |
| para-Formaldehyde | Carl Roth | 0335.2 | To make a formaldehyde solution in PBS, weigh para-formaldehyde powder in a ventilated hood, and add it to PBS preheated to ca. 60 °C in a beaker on a stir plate. Add 1 N NaOH dropwise until solution clears. Let solution cool to room temperature, and filter through 0.22 mm filter syringe. Adjust pH with diluted HCl to ca. 6.9, and adjust to final volume with PBS. We aliquot and freeze the solution, but it can also be stored at 4 °C for approximately four weeks. |
| Triton X-100 | Sigma Aldrich | X100 | Use wide-orifice pipette tips to handle undiluted Triton X-100. |
| Normal goat serum | Sigma Aldrich | G9023 | To block non-specific binding of antibodies in immunofluorescence analyses. |
| α-CD31 Antibodies | BD Biosciences | 550274 | Purified rat anti-mouse monoclonal antibodies, clone MEC 13.3. |
| Secondary goat anti-rat antibodies | Thermo Fisher | A-11006 | Goat anti-rat IgG (heavy and light chains), cross-adsorbed, fluorescently labeled with Alexa Fluor 488. Other fluorescent labels are also possible. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | Mounting medium for cytochemistry. MW ~31,000 |
| Labovert | Leitz | Labovert | Inverted phase contrast microscope equipped with a 4 x and 10 x objective for somite pair counting. Other phase contrast microscopes (such as those that are routinely used in tissue culture) are also suitable. |
| M80 | Leica Microsystems | M80 | Stereomicroscope with 8 : 1 zoom range (yielding a magnification between 7.5 x and 60 x) for embryo and allantois dissection. |
| DM4000B | Leica Microsystems | DM4000B | Microscope system for histology with LED illumination. We use HCX PL FLUOTAR 5 x/0.15 and HC PL FLUOTAR 10 x/0.30 objectives. Other microscopes equipped phase contrast and fluorescence optics can be used to score allantois attachment. |
| Digital camera | JVC | KY-F75U | 3-CCD digital capture camera attached to the DM4000B LED microscope. We use Diskus software (Hilgers) to operate both the microscope and the camera. |
| Confocal microscope | Leica Microsystems | SP5 | Confocal microscope for higher-resolution imaging of endothelia in the vascular plexus of allantois explants. Immunofluorescence images were taken with a 40 x objective. |
Ссылки
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nat Rev Genet. 2 (7), 538-548 (2001).
- Segerer, G., et al. An essential developmental function for murine phosphoglycolate phosphatase in safeguarding cell proliferation. Sci Rep. 6, 35160 (2016).
- Kane, S. V., Acquah, L. A. Placental transport of immunoglobulins: a clinical review for gastroenterologists who prescribe therapeutic monoclonal antibodies to women during conception and pregnancy. Am J Gastroenterol. 104 (1), 228-233 (2009).
- Xu, X., Vugmeyster, Y. Challenges and opportunities in absorption, distribution, metabolism, and excretion studies of therapeutic biologics. AAPS J. 14 (4), 781-791 (2012).
- Wesolowski, S. R., Kasmi, K. C., Jonscher, K. R., Friedman, J. E. Developmental origins of NAFLD: a womb with a clue. Nat Rev Gastroenterol Hepatol. 14 (2), 81-96 (2017).
- Racicot, K., Mor, G. Risks associated with viral infections during pregnancy. J Clin Invest. 127 (5), 1591-1599 (2017).
- Grandjean, P., et al. Life-Long Implications of Developmental Exposure to Environmental Stressors: New Perspectives. Endocrinology. 156 (10), 3408-3415 (2015).
- Inman, K. E., Downs, K. M. The murine allantois: emerging paradigms in development of the mammalian umbilical cord and its relation to the fetus. Genesis. 45 (5), 237-258 (2007).
- Arora, R., Papaioannou, V. E. The murine allantois: a model system for the study of blood vessel formation. Blood. 120 (13), 2562-2572 (2012).
- Watson, E. D., Cross, J. C. Development of structures and transport functions in the mouse placenta. Physiology (Bethesda). 20, 180-193 (2005).
- Yang, J. T., Rayburn, H., Hynes, R. O. Cell adhesion events mediated by alpha 4 integrins are essential in placental and cardiac development. Development. 121 (2), 549-560 (1995).
- Gurtner, G. C., et al. Targeted disruption of the murine VCAM1 gene: essential role of VCAM-1 in chorioallantoic fusion and placentation. Genes & development. 9 (1), 1-14 (1995).
- Kwee, L., et al. Defective development of the embryonic and extraembryonic circulatory systems in vascular cell adhesion molecule (VCAM-1) deficient mice. Development. 121 (2), 489-503 (1995).
- Downs, K. M., Gardner, R. L. An investigation into early placental ontogeny: allantoic attachment to the chorion is selective and developmentally regulated. Development. 121 (2), 407-416 (1995).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. J Am Assoc Lab Anim Sci. 54 (4), 368-371 (2015).
- Downs, K. M., Temkin, R., Gifford, S., McHugh, J. Study of the murine allantois by allantoic explants. Dev Biol. 233 (2), 347-364 (2001).
- Hou, W., Sarikaya, D. P., Jerome-Majewska, L. A. Ex vivo culture of pre-placental tissues reveals that the allantois is required for maintained expression of Gcm1 and Tpbpalpha. Placenta. 47, 12-23 (2016).
- Zeigler, B. M., et al. The allantois and chorion, when isolated before circulation or chorio-allantoic fusion, have hematopoietic potential. Development. 133 (21), 4183-4192 (2006).
- Zaidel-Bar, R., Itzkovitz, S., Ma'ayan, A., Iyengar, R., Geiger, B. Functional atlas of the integrin adhesome. Nature cell biology. 9 (8), 858-867 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены