Method Article
Dissecção e cultura de explante de murino alantoide para a análise In Vitro de fixação alantoico
Neste Artigo
Resumo
Descrevemos um ensaio em vitro de fixação corioalantoicas de modelo, o primeiro passo na formação da placenta. O protocolo demonstra a cultura de dissecção e explante de murino allantoides em imobilizado α4β1 integrina. Acessório de alantoide é avaliado microscopicamente em pontos de tempo pré-determinado.
Resumo
A placenta é essencial para o crescimento e o desenvolvimento de embriões de mamíferos. Por este motivo, inúmeras alterações genéticas e insultos ambientais também prováveis que perturbam o desenvolvimento da placenta ou função podem causar perda de gravidez precoce em ratos e seres humanos. No entanto, simples em vitro ensaios para a tela para potenciais efeitos sobre a formação da placenta são escassos. Aqui, focalizamos o primeiro e fundamental passo na formação da placenta, que consiste de penhora do alantoide com o cório de modelagem. Nós descrevemos um método para avaliar rapidamente o acessório de explantes alantoico na imobilizado α4β1 integrina, que serve como substrato cório-mimética. Esta abordagem in vitro permite uma avaliação qualitativa do acessório e espalhando o comportamento de vários explantes alantoide em pontos diferentes vez consecutiva. O protocolo pode ser usado para investigar o efeito de mutações específicas do mouse, drogas ou vários fatores ambientais que têm sido associados a complicações na gravidez ou perda fetal no alantoide acessório ex vivo.
Introdução
A placenta é indispensável para o crescimento embrionário e desenvolvimento no ambiente uterino. Constitui a interface para o oxigênio, metabólito e troca de nutrientes entre a circulação fetal e materna e também funções como órgão endócrino e imunológico. Qualquer insulto endógeno ou exógeno que prejudica o desenvolvimento da placenta pode levar a retardo de crescimento intra-uterino, perda fetal ou complicações na gravidez, tanto em ratos e em seres humanos1. Enquanto o número de mutações específicas do mouse que causam fisiologia placentária anormal continua a aumentar2, com 219 genótipos atualmente listados no site da informática do genoma do rato (MGI) (http://www.informatics.jax.org/vocab/ mp_ontology / MP:0010038), muitos destes fenótipos não são bem compreendidos, do ponto de vista mecanicista. Além de alterações genéticas, drogas pequena molécula, anticorpos monoclonais, toxinas, agentes patogénicos, metabolitos em excesso ou vários agentes ambientais podem afetar desenvolvimento de placenta e função3,4,5 , 6 , 7. ainda, simples em vitro ensaios que passos críticos do modelo em desenvolvimento de placenta são escassos.
Desenvolvimento placentário murino é iniciado no início midgestation, quando o alantoide (o precursor do desenvolvimento do cordão umbilical) emerge da extremidade posterior do embrião como um broto que cresce em direção do córion8. Chorioadhesive células na camada exterior do bud alantoico mediam o apego e a difusão do alantoide na superfície do cório (corioalantoicas "fusão"). O córion dobra-se posteriormente em vilosidades no qual vasculatura do alantoide cresce para formar o labirinto, a camada interna da placenta onde nutrientes e oxigênio são trocados entre o sangue materno intimamente justapostos sinusoides e vasos embrionários9 ,10.
O anexo do alantoide para córion é o passo inicial e fundamental na formação do labirinto, e defeitos neste processo estão entre as causas mais comuns de letalidade embrionária em midgestation1. Embora um número de mutantes de rato tem sido descrito onde corioalantoicas ceda a ocorrer10, e o banco de dados do MGI atualmente lista 108 mutantes de rato que caracterizam-se por fusão corioalantoicas anormal (http:// www.Informatics.Jax.org/Vocab/mp_ontology/MP:0002824), a interação intercelular entre as células vasculares adesão molécula-1 (VCAM-1, expressado na mesoderme alantoico) e α4β1 integrina (expressado no mesotélio gonadotrofina coriônica, que é derivado do mesoderma extraembryonic) parece ser indispensável para a ligação corioalantoicas e fusão11,12,13. Coloração imuno-histoquímica de todo-monte selvagem-tipo embriões tem mostrado que o VCAM-1 é expresso dentro os dois terços distais do caule alantoico no dia aproximadamente embrionário (E) 7,513 (palco do somite 1-4), e que sua expressão permanece elevada durante corioalantoicas anexo e - fusão11,12. Falha de alantoico apego ao córion normalmente é detectada por análise histológica de botões do útero. No entanto, alantoide tamanhos são fisiologicamente altamente variáveis entre e mesmo dentro de ninhadas do mesmo grau de desenvolvimento14, e o alantoide só pode anexar o córion quando atingiu um tamanho suficiente para fazer contato físico. Reflectindo esta variabilidade natural, anexo corioalantoicas ocorre em algum momento entre ~ E 8.0 E 9.0 e no uteroe uma avaliação estatisticamente confiável deste processo pela histologia depende, portanto, a análise de um grande número de conceptuses para obter suficiente amostras na fase do desenvolvimento apropriado.
Aqui, descrevemos um método para avaliar fixação alantoico ex utero que é menos dependente do tamanho do alantoide. Demonstramos a dissecação de embriões do rato e seus allantoides desde o útero de ratos grávidas ~ 8 dias post coitum (dpc; dpc 0.5 designa a detecção de um tampão vaginal), e a cultura subsequente do alantoide explants na α4β1 imobilizado integrinas. Este método permite uma avaliação rápida, funcional de acessório e espalhando o comportamento de vários explantes alantoide em paralelo e em pontos diferentes de tempo sucessivos. O protocolo pode ser usado para tela para efeitos de diversos fatores ambientais, drogas ou mutações específicas no alantoide acessório ex vivo.
Protocolo
Reprodução de rato foi aprovada pelo Regierung Unterfranken, e todas as análises foram realizadas em estrita conformidade com todos os alemão e da União Europeia leis e regulamentos aplicáveis relativos ao uso de animais de laboratório e cuidados.
1. revestimento de microtitulação placas com α4β1 integrina para Ex Utero Allantois explante cultura
- Reconstitua a liofilizado murino α4β1 integrina a 200 µ g/mL em salina tampão fosfato (PBS). Dilua para uma concentração final de 10 µ g/mL em pré-aquecido (37 ° C) PBS. Pipete 20 µ l/poço da solução diluída α4β1 integrina para o número necessário de poços de uma placa de microtitulação (1 alantoide/poço).
Nota: Evite a formação de bolhas de ar quando o revestimento dos poços da placa de microtitulação. - Incube as placas de microtitulação para 60 min a 37 ° C, colocando-os em uma incubadora de cultura de tecidos umidificado.
- Aspire cuidadosamente o sobrenadante com uma pipeta. Usar sucção suave e inclinar a placa para evitar tocar bem fundo com a ponta da pipeta. Lavar os poços duas vezes pela adição de 50 µ l de meio de cultura previamente aquecido (37 ° C) como de Dulbecco modificado águia médio (DMEM) e remover o meio de lavagem por sucção suave.
- Passo fundamental: bloco de ligação grátis sites pela adição de 50 µ l/poço de 0,1% (p/v) albumina de soro bovino (BSA) / DMEM e incube por ≥ 30 min a 37 ° C, colocando as placas de microtitulação numa incubadora umidificado cultura de tecidos.
Nota: Explantes alantoide podem anexar várias superfícies na presença de soro. Portanto, é imperativo para bloquear sites de ligação não-específica, após o revestimento dos poços com integrina e antes de adicionar o alantoide dissecado por explantes cultura no soro contendo médio (consulte a etapa 4.4). - Manter os Poços revestidos na solução de bloqueio a 37 ° C, até que seja necessário na etapa 4.4.
2. o útero dissecação de um rato grávida na Dpc 8
Nota: Reduza taxas de falso-positivo de gravidez, de discriminação de ganho de peso15.
- Sacrifica o mouse por deslocamento cervical. Desinfecte o casaco na região abdominal por pulverização com etanol a 70% (v/v).
Nota: Utilize luvas quando manusear os ratos. Eutanásia por deslocamento cervical sem anestésicos impede a contaminação química do alantoide, que pode interferir com o acessório de alantoide. - Abra a pele abdominal, fazendo uma pequena incisão na linha com uma tesoura. Use os dedos com luvas para manter a pele acima e abaixo da incisão e separar a pele em direção ao peito e a cauda do rato.
- Agarre o peritônio com fórceps. Com a outra mão, faça uma incisão em forma de V de anterior para posterior usando a tesoura e mover o tecido para expor na cavidade abdominal. Use a pinça para empurrar os intestinos de um lado para obter acesso ao útero.
- Localize os dois cornos uterinos. Segure o colo do útero (o segmento caudal) com fórceps e corte os ligamentos com uma tesoura bem. Então retire ambos os cornos uterinos por separando os ovidutos com uma tesoura.
- Usar fórceps para transferir o útero em um prato de 10cm estéril contendo estéril, temperatura (RT) PBS. Remova o tecido adiposo, vasos e nervos que cercam os cornos uterinos com pinça fina e/ou tesoura (figura 1A).
3. embrião dissecação
Nota: Execute as seguintes etapas sob um microscópio estereoscópico equipado com uma gama de zoom de 8:1.
- Separe os embriões por corte entre os locais de implantação com uma tesoura. Segure o revestimento do útero muscular dos brotos útero com pinça e puxá-lo distante para expor a decídua (figura 1B).
- Usando fórceps, transferi os gomos do útero para uma nova placa de 10 cm contendo estéril, RT PBS.
- Corrigi a decidua em torno do embrião com as pontas da pinça.
- Fazer uma incisão no lado anti-mesometrial da decidua com pinça fina (Figura 1) e descascar a decidua com fórceps para expor o embrião (Figura 1).
Nota: O polo mesometrial da decidua é altamente vascularizado e pode ser mais largo na base que a parte de anti-mesometrial, que contém o embrião e aparece mais pálida. - Disse o embrião com pinça (Figura 1E, F).
- Usando uma microcolher, transferi o embrião para uma gota de PBS estéril contido em um prato de estéril de 3,5 cm.
- Transferir o embrião para uma gota fresca de PBS no mesmo prato 3,5 cm usando uma microcolher e dissecar o embrião do saco vitelino usando fórceps (Figura 1, H).
- Opcionalmente, se necessário (por exemplo, para a genotipagem por reação em cadeia da polimerase), transferir o saco vitelino em um tubo estéril aspirando com ~ 5 µ l PBS em uma ponta da pipeta orifício grande 200 µ l. Loja a-20 ° C.
Nota: Tecido materno (ou seja, o saco vitelino parietal, incluindo a membrana do Reichert e o cone de ectoplacental) que possam contaminar a preparação do saco vitelino pode levar a resultados errôneos de genotipagem. Remoção desses tecidos é mais fácil antes a dissecação do embrião do saco vitelino.
4. o alantoide dissecção e cultura Ex Utero no imobilizado α4β1 integrina
- Corte o alantoide do seu local de inserção basal na extremidade posterior do embrião usando pinça fina (Figura 1 H).
- Opcionalmente, se a plataforma do desenvolvimento é necessária, conta os pares somite do embrião por inspeção visual, usando um microscópio equipado com ótica de contraste de fase e um 5 × 10 × objetivo.
Nota: O embrião pode ser estendido com fórceps para facilitar a contagem do somite. Fusão e apego corioalantoicas ocorrem entre E 8.0 e 9.0 E em embriões com pares de 6 somite ≥. Giro começa em embriões com 6-8 pares de somite. - Pipeta de 40 µ l/poço de DMEM suplementado com 10% (v/v) de soro fetal bovino, L-glutamina e antibióticos no número necessário de poços de placa do microtiter pré-revestida (ver seção 1).
- Recolher o alantoide flutuante aspirando com ~ 5 µ l PBS, em um grande orifício de uma ponta de pipeta de 200 µ l. Transferi 1 alantoide/bem.
- Incubar as allantoides colocando as placas de microtitulação numa incubadora de cultura de tecidos umidificado (37 ° C, 5% CO2) para , por exemplo, 6, 12 e 24 h. Para evitar interferência com o acessório de alantoide, não mova as placas de microtitulação entre esses pontos de tempo.
- Em cada ponto do tempo, marcar acessório alantoide (por exemplo, nenhum acessório/flutuante alantoide alantoide parcialmente ou totalmente anexada; totalmente propagação alantoide) usando um microscópio equipado com ótica de contraste contraste ou diferencial do interferência fase e um × 5 ou 10 × objectivo (Figura 2).
Nota: Exemplos representativos de allantoides recém isoladas e totalmente anexadas são mostrados na Figura 2. Ex utero, ponta distal do allantoides isolados de camundongos C57BL/6J de sua anexa dentro de 4-6 h (isto é referido como penhora parcial da alantoide), e acessório completo do alantoide inteira é alcançado dentro de ~ 12 h de cultura. Por 18-24 h, o explante tem aplainado e assumiu uma forma circular (referida para como totalmente espalhar alantoide) com um CD31 positivo do plexo vascular9,16.
5. confirmação dos coloração o alantoide explantado para o CD31 marcador de células endoteliais
- Aspire o meio de cultura de explantes de propagação totalmente e corrigir as células adicionando 40 µ l/poço de 4% (p/v) paraformaldeído/PBS.
Nota: Paraformaldehyde é tóxico. Use luvas e óculos de segurança para evitar o contato de olho e pele. - Incubar durante 10 minutos a RT e, em seguida, aspirar o sobrenadante. Lavar três vezes com a adição de 40 µ l/poço de PBS e remover o meio de lavagem por sucção suave.
- Permeabilize as células e bloquear sites inespecificas adicionando 40 µ l/poço de 0,1% (v/v) de soro de cabra normal BSA/10% Triton X-100/0.1% (w/v) (v/v) em PBS por 30 min em RT. Wash duas vezes adicionando 40 µ l/poço de PBS e remover o meio de lavagem por sucção suave.
Nota: O protocolo pode ser pausado a noite neste ponto. - Mancha de células, adicionando 20 µ l/poço de anticorpos anti-CD31 primário diluído 01:50 em 0,1% (p/v) BSA/PBS durante a noite a 4 ° C. Lavar três vezes com a adição de 40 µ l/poço de PBS e remover o meio de lavagem por sucção suave.
- Detecta anticorpos primários ligados pela adição de 20 µ l/poço de cabra secundário fluorescente etiquetado anticorpos anti-rato diluído 1: 200 em 0,1% (p/v) BSA/PBS por 1h em placas de microtitulação RT. Protect da luz por envolvimento em papel de alumínio ou colocando em uma câmara escura. Lavar três vezes com a adição de 40 µ l/poço de PBS e remover o meio de lavagem por sucção suave.
- Inserir células, adicionando 20 µ l/poço de meio de montagem. Encube por ~ 1h no RT até o meio de montagem tem solidificado. Armazenar placas de microtitulação no RT ou a 4 ° C, protegido da luz.
- Imagem do plexo vascular do alantoide explants sob um microscópio de fluorescência, equipado com um × 5 ou 10 × objetivo e filtros de fluorescência apropriado.
Nota: Imagens representativas do plexo vascular CD31 positivo de uma totalmente propagação alantoide são mostradas na Figura 3. Outros marcadores para o plexo vascular, tais como anticorpos dirigidos contra Flk-1, Flt, gravata-1 ou Tie-2 pode ser usado como bem16.
Resultados
Este protocolo descreve um método para isolar e explantes murino allantoides ex vivoe detalha a avaliação qualitativa do alantoide penhora a α4β1 integrina, um processo crítico durante na vivo corioalantoicas fusão. Os representante resultados mostrados na figura 1A–H demonstram as etapas sucessivas de isolamento alantoide a partir do útero gestante. Tecidos maternos que cercam os cornos uterinos, tais como o tecido adiposo e vasos (figura 1A) são removidos, e os embriões são dissecados de endométrio de forma faseada após a abertura da camada muscular uterina (figura 1B- E). Posteriormente, outros tecidos maternos tais como o saco vitelino parietal e o cone de ectoplacental são removidos (Figura 1E, F). Figura 1 - H mostra que a técnica compreende a dissecção do alantoide extraembryonic longe o saco vitelino, outro tecido extraembryonic e altamente vascularizado. Assim, allantoides isolados de acordo com este protocolo são em grande parte livres de contaminantes tecidos maternos ou embrionários (extra) e não o alantoide.
A Figura 2 demonstra que o tamanho e a forma de allantoides de embriões recém dissecados em uma única ninhada podem variar consideravelmente em14. Allantoides de embriões de sua C57BL/6J dissecados em 8,5 E tinham uma morfologia alongada em 74% dos casos (45 de 61 embriões analisados), como mostrado na Figura 2 e Figura 1 H. No entanto, em 15% (9/61) dos embriões, os allantoides eram consideravelmente menores e mais arredondadas (ver referência14) e 11% (7/61) dos embriões tinha ainda não formada uma alantoide visível no momento da dissecação. Apesar das formas heterogêneas e tamanhos no ponto de partida do tempo do alantoide explant cultura (Figura 2, painéis um–h), acessório alantoide e espalhando completo em imobilizado α4β1 integrina observou-se no prazo de 12 h em todos os das 54 allantoides recém isoladas dissecado de embriões de sete ninhadas. No entanto, as formas e tamanhos dos explantes após 12 h de cultura foram um tanto heterogênea (Figura 2), refletindo as diferentes morfologias alantoico no ponto de partida do ensaio.
A Figura 3 mostra um immunocytochemical coloração para células endoteliais CD31 positivo em allantoides totalmente anexados após 24h de cultura explante, que confirma que os explantes tinham elaborado um plexo vascular por este ponto de tempo, como esperado9 , 16. tais culturas alantoide aderente podem ser usadas para estudar a formação de vasos sanguíneos em vitro9. Portanto, os explantes de alantoide rendimentos apresentada a metodologia que podem ser facilmente cultivadas ex vivo, de acordo com anteriormente publicaram estudos experimentais9,16.
O protocolo define o quadro para a avaliação baseada em microscopia de fixação alantoide nos pontos de tempo predeterminado, tais como após 12h ou 24h de cultura explante. Os resultados podem ser avaliados de forma qualitativa (anexo parcial/completo ou completo se espalhando em um ponto determinado do tempo-Sim/não). Desde que o mesmo explante pode ser visualizado várias vezes e marcou, esta análise reflete que as características do alantoide individual explant culturas ao longo do tempo. Além disso, a formação de um plexo vascular em explantes fixos e manchados pode ser avaliados (Figura 3).

Figura 1: representante passos na dissecação alantoide. (A) detalhe Ver os de um corno uterino isolado. Os botões do útero contendo os embriões são marcados por estrelas; tecido adiposo e vasos que irrigam o corno uterino são vistos no lado esquerdo. (B) vista a decidua (endométrio), após a remoção da camada muscular do útero. O altamente vascularizado, polo mesometrial da decidua é orientado para a esquerda, a parte de anti-mesometrial (marcada com uma estrela) que contém o embrião é orientada para a direita. (C) lado Ver os do polo anti-mesometrial dissecado da decidua (marcado com uma estrela). A seta indica a localização do embrião. (D) vista superior da conceptos (seta) rodeado pelo saco vitelino parietal após remoção parcial da decidua circundante. (E, F) Vistas representativas das etapas subsequentes a dissecação do embrião (seta). A seta indica o saco vitelino. Em (E), o cone de ectoplacental (epc) é visível à direita. (G) dissecação parcial do embrião (seta) do saco vitelino (setas). O alantoide é marcado com uma estrela vermelha. (H) embrião isolado (seta) com alantoide (estrela vermelha). A posição onde o alantoide será cortado do seu local de inserção basal na extremidade posterior do embrião é indicada com uma linha vermelha e quebrada. Imagens foram tiradas em um estereomicroscópio com uma faixa de zoom de 8:1. Todas as barras da escala são 1 mm. clique aqui para ver uma versão maior desta figura.
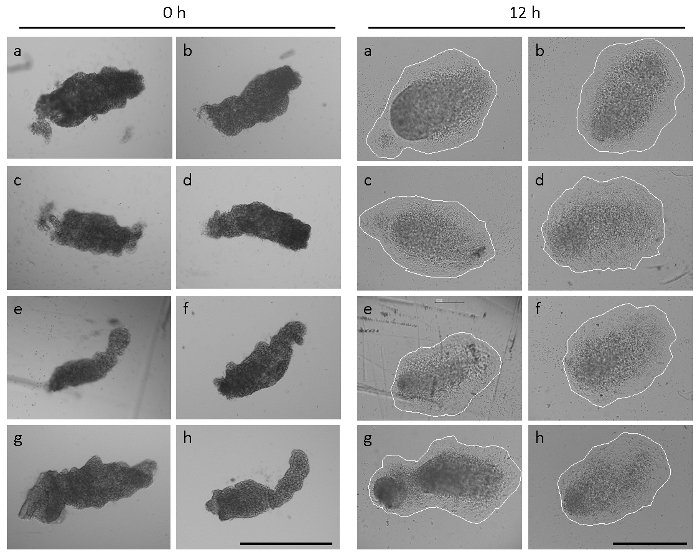
Figura 2: heterogêneas formas e tamanhos de allantoides. Oito allantoides (um–h) foram isoladas a partir de embriões de uma única ninhada. Deixou o painel, allantoides imediatamente após a dissecação (0 h). Painel à direita, as mesmas allantoides após 12 h de cultura explante. Os explantes são firmemente presa, e células mesenquimais se espalharam. Os explantes são circulados para visualizar os tamanhos do explante. Imagens foram tiradas em um microscópio equipado com ótica de contraste de fase e um 5 × (painel esquerdo) ou um objectivo de 10 × (painel direito). Todas as barras de escala são 500 µm. clique aqui para ver uma versão maior desta figura.

Figura 3: formação do plexo Vascular em culturas de explant alantoide. Allantoides foram dissecados e explantados no imobilizado α4β1 integrina conforme descrito no presente protocolo. Explantes foram cultivados por 24 h, e células endoteliais no plexo vascular foram coradas usando anticorpos primários anti-CD31 e fluorescente etiquetado anticorpos secundários. Células endoteliais aparecem em verde. A imagem superior mostra o plexo vascular todo na área central de um explante representante alantoide. A imagem foi tirada em um microscópio equipado com sistema ótico de fluorescência e um objectivo 5 ×. Barra de escala, 500 µm. Os dois painéis inferiores são imagens de alta ampliação de outro alantoide explante dissecados e cultivadas nas mesmas condições. Embarcação-como estruturas e células endoteliais individuais podem ser vistas. Imagens foram tiradas em um microscópio confocal; escala de barras, 25 µm. clique aqui para ver uma versão maior desta figura.
Discussão
Na presença de soro, que é uma fonte rica de moléculas pro-adesivo da matriz extracelular como a fibronectina, explantes alantoide prontamente irão anexar vários plástico, vidro ou superfícies de filtro9,16. Assim, se o objectivo do ensaio realizado é especificamente investigar o efeito de uma modificação genética ou qualquer outro tratamento no acessório alantoide para imobilizado α4β1, é fundamental para bloquear sites de ligação não-específica (por exemplo, com soro bovino albumina) após o revestimento de superfícies com integrina e antes da incubação com soro contendo mídia.
O sistema inicial de explantes alantoide de imobilizado α4β1 integrina é muito sensível ao movimento, e as placas de cultura de tecido devem, portanto, ser deixadas inalteradas durante um período de tempo pré-determinado (por exemplo, para 12h) antes de marcar o alantoide acessório. Observe que o tempo necessário para contato estável formação com o substrato pode variar dependendo da estirpe de rato analisados ou a concentração de imobilizado α4β1 integrina.
A exigência da intercelular VCAM-1/α4β1-interação para fusão corioalantoicas bem sucedido é firmemente estabelecida11,12,13. Além disso, moléculas da matriz extracelular, como fibronectina, colágenos e outras moléculas de interesse podem também ser imobilizadas e usadas como substratos "chorio-mimético".
Anexo corioalantoicas é dependente da interação intercelular entre VCAM-1 e sua vinculação sócio integrina α4β1. No utero, corioalantoicas fixação e fusão posterior só podem ocorrer quando o alantoide alargou-se suficientemente para fazer contato com o córion. Dada a variabilidade fisiológica em tamanhos alantoide em um determinado grau de desenvolvimento, anexo corioalantoicas e fusão ocorrem em algum momento entre E 8.0 e 9.0 E (gama, E 7,5 E 9,25)14,16. Métodos para especificamente estudo o processo transiente de fixação alantoide à placa coriônica no utero no mouse vivos não estão prontamente disponíveis no presente. Ao contrário, análises principalmente concentram-se na determinação da fusão corioalantoicas trabalhosa pela avaliação histológica de , por exemplo, alantoico espalhar sobre a superfície do cório e o desenvolvimento da camada de labirinto em um único, pre-determinada tempo ponto11,12,13,16. Esta análise de ponto de extremidade não pode discriminar entre defeitos que são especificamente devido a penhora prejudicada do alantoide ao córion e efeitos de córion-dependente e é limitado pela variabilidade inerente em estádios de desenvolvimento do embrião e alantoico tamanhos. Conforme discutido em Resultados de representante, a variabilidade fisiológica em tamanhos alantoide pode resultar em um atraso relativo no fusion corioalantoicas em ~ 26% dos embriões de sua C57BL/6J. Estatisticamente falando, quase dois em sete ratos grávidas, portanto, seria sacrificados muito cedo (61 embriões de sete ninhadas, tamanho da ninhada média 8,7), que se traduz a necessidade de uma substancial em excesso para estudos de larga escala de reprodução. Curiosamente, microcirúrgicos experimentos revelaram que o córion já tem competência para fundir-se com o alantoide na 1 fase somite par, e que o alantoide apresenta capacidade máxima de fusão em embriões com 3-5 somite pares14. Assim, chorioadhesive células do alantoide são formado e funcionalmente competente antes do acessório corioalantoicas real em vivo. A análise ex utero de fixação alantoide para ligantes imobilizados, tal como apresentado aqui, é, portanto, relativamente independente de tamanho determinado alantoide. Portanto, uma vantagem deste método é que ignora defeitos em alongamento alantoide e incide sobre o próximo passo na formação da placenta, ou seja, fixação de chorioallantois. Essa abordagem, portanto, pode ser usada para distinguir entre defeitos de alongamento alantoide e acessório chorioallantois em mutantes genéticos do mouse.
Em contraste com o método tradicional de aspiração alantoide de seu ponto de fixação para o embrião usando uma pipeta de boca16, o atual protocolo usa uma abordagem de corte manual, e o alantoide é posteriormente Tratado usando pontas de pipetas de orifício grande . Uma vantagem importante de aspiração alantoide é que este método evita a manipulação direta do tecido. Corte e manipulando o alantoide podem danificar as células chorioadhesive na bainha exterior do mesotélio alantoico. Não obstante, cortando o alantoide com fórceps tem sido utilizado com sucesso antes em ex vivo de culturas de tecidos pre-placental17, e a cinética de explant alantoico acessório e a morfologia das culturas explant descreveram na presente estudo são semelhantes aos dados publicados com base no isolamento alantoide por aspiração16. Estes achados sugerem que células chorioadhesive são suficientemente bem preservadas mediante corte manual do alantoide, e essa diferenciação de explant grosseiramente não é perturbada, conforme indicado pela formação de endothelia CD31 positivo. Direto de corte da alantoide também oferece a possibilidade de dissecar somente a superior dois terços do alantoide que expressam VCAM-113e garante menos contaminação com saco vitelino-derivado de células, que podem ter de ser aparado longe da base da alantoide depois alantoide aspiração18.
A análise ex utero de explant alantoico adesão ao imobilizado, recombinante α4β1 integrina fornece uma leitura qualitativa de um passo importante, inicial que é necessário para a fusão de corioalantoicas, ou seja, a interação intercelular entre VCAM-1 expressa sobre o alantoide, e α4β1 integrina localizadas o mesotélio gonadotrofina coriônica, que é derivado do mesoderma extraembryonic. No entanto, apesar destas moléculas de adesão de dois são reconhecidas como os jogadores de princípio em corioalantoicas fusão, ~ 50% dos embriões com mutações nocaute homozigotos integrina VCAM-1 ou α4 submeter-se fusão corioalantoicas na vivo11 ,12,13. Por causa desta penetrância incompleta, o método ex vivo , descrito no presente protocolo pode não ser suficiente para descartar um requisito para essas moléculas de dois adesão em modelos genéticos com uma falha de fusão corioalantoicas.
Sob condições fisiológicas, α4β1 integrinas são incorporadas na membrana plasmática de gonadotrofina trophoblasts e são incorporadas em uma intrincada rede de proteínas estruturais e sinalização que cooperam para regular a adesão célula-célula (e célula-matriz) 19. modelados com maioria reducionista em vitro abordagens, a complexidade da interface de ligação gonadotrofina VCAM-1 é apenas de forma muito limitada por imobilizado α4β1 integrina. Além da falta de potencial de outros importantes insumos estruturais ou sinalização derivado do córion intacto neste sistema, é provável que apenas uma fração das integrinas que são imobilizadas em uma superfície rígida, duas dimensões estão presentes no ativo, conformação de vinculação-competente, "aberta".
O método apresentado aproxima o apego precoce e espalhando passo do alantoide córion e pode, também, relatório sobre o desenvolvimento do plexo vascular alantoico, quando combinado com a análise do navio formação9. No entanto, a abordagem atual não modelo a invasão do córion por brotação angiogênese mediada por células endoteliais alantoico, nem ele faz refletir morfogênese ramificação pelo córion, que é um processo essencial para corioalantoicas fusão e o desenvolvimento posterior do labirinto da placenta10.
Uso de contraste de fase ou microscopia de interferência diferencial combinado com (semi-) imagem análise automatizada, o método apresentado pode ser aplicado em telas de grandes dimensões para a análise inicial de fixação alantoico atraso ou falha em vitro. Além da análise de mutantes de rato, o método pode ser de interesse para os efeitos das drogas, agentes patogénicos, metabolitos ou agentes ambientais no acessório alantoico de tela.
Em numerosas mutantes de rato, corioalantoicas ceda ocorrer, embora o alantoide e o córion parecem ter desenvolvido normalmente. Além disso, mutantes que mostram defeitos corioalantoicas acessório normalmente exibem penetrância incompleta1,2,10. Será importante investigar se estes genes funcionalmente aparentemente muito diferentes impacto comuns vias moleculares e/ou processos celulares. Imagens ao vivo de explantes alantoide derivadas de mutantes de rato tem o potencial para elucidar tais mecanismos. Por exemplo, as células da bainha exterior do alantoide dissecado poderiam ser rotuladas com corantes fluorescentes vitais (como DiI ou DiO carbocyanine lipofílicos traçadores16,18) a imagem adesão e divulgação de eventos, ou para rastrear celular migração em tempo real. Além disso, repórteres fluorescentes que Visualizar as proteínas do citoesqueleto ou adesão podem provar para ser informativo.
Recentemente, foi descrito um sistema de co-cultura ex vivo para pré-fixação murino allantoides e chorions, e esta abordagem foi usada com sucesso para investigar os eventos que ocorrem após a fixação corioalantoicas, tais como a camada de labirinto formação de17. A análise da eficiência de fixação alantoide no imobilizado chorions isoladas de diferentes (por exemplo, geneticamente modificado) modelos de rato podem produzir novos insights sobre os jogadores moleculares e vias que regem os primeiros passos no desenvolvimento do murino placenta.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado pela Deutsche Forschungsgemeinschaft SFB688 (para A.G.).
Materiais
| Name | Company | Catalog Number | Comments |
| C57BL/6J wildtype mice | The Jackson Laboratory | Stock No: 000664 | |
| 70 % (v/v) Ethanol | VWR International | 930031006 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | Forceps used to open the abdominal cavity. |
| Micro dissecting forceps | Fine Science Tools | 11254-20 | Dumont # 5 medical biology forcepts with fine, sharp tip. |
| Fine scissors | Fine Science Tools | 14094-11 | Straight blades. |
| Spring scissors | Fine Science Tools | 15012-12 | Noyes spring scissors with 14 mm blades for the dissection of uterus buds. |
| Microspoon | Carl Roth | AT18.1 | 5 mm Spoon diameter. |
| Microtiter plates | ibidi | 81501 | We use uncoated, sterile angiogenesis slides (internal volume 50 µL) with a hydrophobic surface that is not tissue-culture treated to reduce non-α4β1-mediated binding to plastic. |
| 10 cm dish | Nunc | 150350 | Sterile tissue culture dishes. |
| 3.5 cm dish | Nunc | 150288 | Sterile tissue culture dishes. |
| Large orifice pipette tips | Biozym | VT0140X | Low binding pipette tips, 200 µL. |
| α4β1 integrin | R&D Systems | 6054-A4 | Murine α4β1 integrin recombinantly expressed and purified from a Chinese hamster ovary cell line. |
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma Aldrich | D8537 | Without Ca2+ and Mg2+. |
| Dulbecco’s Modified Eagle Medium (DMEM) | PAN Biotech | P04-03600 | The formulation contains 4.5 g/L glucose, 110 mg/L sodium pyruvate and 3.7 g/L NaHCO3 but no L-glutamine, which is added separately. |
| Penicillin/Streptomycin | Gibco (ThermoFisher Scientific) | 15140-122 | 100 x (10,000 U/mL Penicillin and 10,000 µg/mL streptomycin) stock solution. Prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| L-Glutamine | PAN Biotech | P04-80100 | 100 x (200 mM) Stock solution. Prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Fetal bovine serum | Biochrom | S 0115 | We use heat-inactivated FBS (heated to 56 °C for 30 min with mixing to inactivate complement). |
| Bovine serum albumin (BSA) | Sigma Aldrich | A7030 | We use protease- and fatty acid-free albumin. Prepare a 0.1 % (w/v) solution in DMEM. Sterile filter the solution through a disposable cell culture filter with a 0.22 µm pore size and low protein-binding membrane, and store aliquots at -20 °C. |
| para-Formaldehyde | Carl Roth | 0335.2 | To make a formaldehyde solution in PBS, weigh para-formaldehyde powder in a ventilated hood, and add it to PBS preheated to ca. 60 °C in a beaker on a stir plate. Add 1 N NaOH dropwise until solution clears. Let solution cool to room temperature, and filter through 0.22 mm filter syringe. Adjust pH with diluted HCl to ca. 6.9, and adjust to final volume with PBS. We aliquot and freeze the solution, but it can also be stored at 4 °C for approximately four weeks. |
| Triton X-100 | Sigma Aldrich | X100 | Use wide-orifice pipette tips to handle undiluted Triton X-100. |
| Normal goat serum | Sigma Aldrich | G9023 | To block non-specific binding of antibodies in immunofluorescence analyses. |
| α-CD31 Antibodies | BD Biosciences | 550274 | Purified rat anti-mouse monoclonal antibodies, clone MEC 13.3. |
| Secondary goat anti-rat antibodies | Thermo Fisher | A-11006 | Goat anti-rat IgG (heavy and light chains), cross-adsorbed, fluorescently labeled with Alexa Fluor 488. Other fluorescent labels are also possible. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | Mounting medium for cytochemistry. MW ~31,000 |
| Labovert | Leitz | Labovert | Inverted phase contrast microscope equipped with a 4 x and 10 x objective for somite pair counting. Other phase contrast microscopes (such as those that are routinely used in tissue culture) are also suitable. |
| M80 | Leica Microsystems | M80 | Stereomicroscope with 8 : 1 zoom range (yielding a magnification between 7.5 x and 60 x) for embryo and allantois dissection. |
| DM4000B | Leica Microsystems | DM4000B | Microscope system for histology with LED illumination. We use HCX PL FLUOTAR 5 x/0.15 and HC PL FLUOTAR 10 x/0.30 objectives. Other microscopes equipped phase contrast and fluorescence optics can be used to score allantois attachment. |
| Digital camera | JVC | KY-F75U | 3-CCD digital capture camera attached to the DM4000B LED microscope. We use Diskus software (Hilgers) to operate both the microscope and the camera. |
| Confocal microscope | Leica Microsystems | SP5 | Confocal microscope for higher-resolution imaging of endothelia in the vascular plexus of allantois explants. Immunofluorescence images were taken with a 40 x objective. |
Referências
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nat Rev Genet. 2 (7), 538-548 (2001).
- Segerer, G., et al. An essential developmental function for murine phosphoglycolate phosphatase in safeguarding cell proliferation. Sci Rep. 6, 35160 (2016).
- Kane, S. V., Acquah, L. A. Placental transport of immunoglobulins: a clinical review for gastroenterologists who prescribe therapeutic monoclonal antibodies to women during conception and pregnancy. Am J Gastroenterol. 104 (1), 228-233 (2009).
- Xu, X., Vugmeyster, Y. Challenges and opportunities in absorption, distribution, metabolism, and excretion studies of therapeutic biologics. AAPS J. 14 (4), 781-791 (2012).
- Wesolowski, S. R., Kasmi, K. C., Jonscher, K. R., Friedman, J. E. Developmental origins of NAFLD: a womb with a clue. Nat Rev Gastroenterol Hepatol. 14 (2), 81-96 (2017).
- Racicot, K., Mor, G. Risks associated with viral infections during pregnancy. J Clin Invest. 127 (5), 1591-1599 (2017).
- Grandjean, P., et al. Life-Long Implications of Developmental Exposure to Environmental Stressors: New Perspectives. Endocrinology. 156 (10), 3408-3415 (2015).
- Inman, K. E., Downs, K. M. The murine allantois: emerging paradigms in development of the mammalian umbilical cord and its relation to the fetus. Genesis. 45 (5), 237-258 (2007).
- Arora, R., Papaioannou, V. E. The murine allantois: a model system for the study of blood vessel formation. Blood. 120 (13), 2562-2572 (2012).
- Watson, E. D., Cross, J. C. Development of structures and transport functions in the mouse placenta. Physiology (Bethesda). 20, 180-193 (2005).
- Yang, J. T., Rayburn, H., Hynes, R. O. Cell adhesion events mediated by alpha 4 integrins are essential in placental and cardiac development. Development. 121 (2), 549-560 (1995).
- Gurtner, G. C., et al. Targeted disruption of the murine VCAM1 gene: essential role of VCAM-1 in chorioallantoic fusion and placentation. Genes & development. 9 (1), 1-14 (1995).
- Kwee, L., et al. Defective development of the embryonic and extraembryonic circulatory systems in vascular cell adhesion molecule (VCAM-1) deficient mice. Development. 121 (2), 489-503 (1995).
- Downs, K. M., Gardner, R. L. An investigation into early placental ontogeny: allantoic attachment to the chorion is selective and developmentally regulated. Development. 121 (2), 407-416 (1995).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. J Am Assoc Lab Anim Sci. 54 (4), 368-371 (2015).
- Downs, K. M., Temkin, R., Gifford, S., McHugh, J. Study of the murine allantois by allantoic explants. Dev Biol. 233 (2), 347-364 (2001).
- Hou, W., Sarikaya, D. P., Jerome-Majewska, L. A. Ex vivo culture of pre-placental tissues reveals that the allantois is required for maintained expression of Gcm1 and Tpbpalpha. Placenta. 47, 12-23 (2016).
- Zeigler, B. M., et al. The allantois and chorion, when isolated before circulation or chorio-allantoic fusion, have hematopoietic potential. Development. 133 (21), 4183-4192 (2006).
- Zaidel-Bar, R., Itzkovitz, S., Ma'ayan, A., Iyengar, R., Geiger, B. Functional atlas of the integrin adhesome. Nature cell biology. 9 (8), 858-867 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados