Method Article
Dissection et la Culture Explant allantoïde murin pour l’analyse In Vitro de l’attachement allantoïdien
Dans cet article
Résumé
Nous décrivons un dosage in vitro à l’attachement de Chorio-modèle, la première étape dans la formation du placenta. Le protocole montre la culture dissection et explant de murins allantoides sur l’intégrine α4β1 immobilisée. Fixation de l’allantoïde est évaluée au microscope à des moments prédéterminés.
Résumé
Le placenta est essentiel pour la croissance et le développement de l’embryon de mammifère. Pour cette raison, nombreuses altérations génétiques et probables insultes aussi environnementales qui perturbent le développement du placenta ou une fonction peuvent causer perte de grossesse précoce chez les souris et les humains. Néanmoins, on manque de simple in vitro tests pour dépister les effets potentiels sur la formation du placenta. Ici, nous nous concentrons sur la modélisation de la première étape critique dans la formation de placenta, qui consiste en la fixation de l’allantoïde sur le chorion. Les auteurs décrivent une méthode pour évaluer rapidement l’attachement des explants allantoïdien sur l’intégrine α4β1 immobilisé, qui sert de substrat chorio-mimétique. Cette approche in vitro permet une évaluation qualitative de l’attachement et la diffusion de comportement d’explants d’allantoïde multiples à différents moments consécutifs. Le protocole peut être utilisé pour étudier l’effet de mutations ciblées de souris, de drogues ou divers facteurs environnementaux qui ont été liés aux complications de la grossesse ou la perte fœtale sur allantoïde fixation ex vivo.
Introduction
Le placenta est indispensable pour la croissance embryonnaire et développement au sein de l’utérus. Elle constitue l’interface pour l’oxygène, métabolite et échange de nutriments entre la circulation fœtale et maternelle, ainsi que des fonctions comme un organe endocrine et immunologique. Toute insulte endogène ou exogène qui entrave le développement placentaire peut entraîner un retard de croissance intra-utérin, la perte fœtale ou complications de la grossesse, tant chez les souris et les humains1. Alors que le nombre de mutations de souris ciblées qui causent anormale physiologie placentaire continue d’augmenter de2, avec 219 génotypes qui figurent actuellement sur le site Web de génome de souris informatique (MGI) (http://www.informatics.jax.org/vocab/ mp_ontology / MP:0010038), bon nombre de ces phénotypes ne sont pas bien compris d’un point de vue mécaniste. En plus des altérations génétiques, médicaments à petites molécules, anticorps monoclonaux, toxines, agents pathogènes, les métabolites excès ou divers agents environnementaux peuvent affecter développement placentaire et fonction3,4,5 , 6 , 7. encore, simple in vitro tests que les étapes critiques de modèle dans le développement du placenta sont rares.
Murine développement placentaire est initié début mi-gestation, lorsque l’allantoïde (le précurseur du développement du cordon ombilical) émerge de l’extrémité postérieure de l’embryon comme un bourgeon qui se développe vers le chorion8. Chorioadhesive cellules de la couche externe de le œuf liquide allantoïdien médient l’attachement et la propagation de l’allantoïde sur la surface du chorion (Chorio-« fusion »). Le chorion se plie par la suite dans les villosités dans lequel le système vasculaire de l’allantoïde se développe pour former le labyrinthe, la couche interne de placentaire où les nutriments et l’oxygène sont échangés entre les sinusoïdes de sang maternel étroitement juxtaposées et vaisseaux embryonnaires9 ,,10.
La fixation de l’allantoïde sur le chorion est l’étape initiale et critique dans la formation du labyrinthe, et défauts de ce processus sont parmi les causes les plus fréquentes de létalité embryonnaire en milieu1. Bien qu’un certain nombre de souris mutantes ont été décrits où Chorio-accessoire ne parvient pas à se produire10, et la base de données MGI répertorie actuellement 108 souris mutantes qui sont caractérisées par des anomalies Chorio-fusion (http:// www.Informatics.JAX.org/Vocab/mp_ontology/MP:0002824), l’interaction intercellulaire entre la molécule d’adhésion cellulaire vasculaire-1 (VCAM-1, exprimé sur le mésoderme allantoïdien) et l’intégrine α4β1 (exprimées sur le mésothélium chorionique, qui est dérivé du mésoderme extra-embryonnaire) semble indispensable pour Chorio-attachement et fusion11,12,13. Marquage immunohistochimique des embryons de type sauvage entier-montent a montré que la VCAM-1 est exprimé dans les deux-tiers distal du pédoncule allantoïdien au jour environ embryonnaire (E) 7,513 (stade de segments de 1-4), et que son expression reste élevée au cours de la Chorio-attachement et - fusion11,12. Échec de fixation allantoïdienne au chorion est généralement détecté par l’analyse histologique des bourgeons de l’utérus. Toutefois, allantoïde tailles sont physiologiquement très variables entre les deux et même au sein des portées du même stade de développement14et l’allantoïde pouvez uniquement attacher au chorion lorsqu’il a atteint une taille suffisante pour établir le contact physique. Reflétant cette variabilité naturelle, Chorio-fixation a lieu quelque temps entre ~ E 8.0 et 9.0 E le dans l’utéruset à une évaluation statistiquement fiable de ce processus par l’histologie est donc tributaire de l’analyse d’un grand nombre de foetus à obtenir suffisamment d’échantillons au stade du développement approprié.
Nous décrivons ici une méthode pour évaluer des attachement allantoïdien ex utero qui est moins tributaire de la taille de l’allantoïde. Nous démontrons la dissection des embryons de souris et leurs allantoides de l’utérus de souris enceintes ~ 8 jours post coitum (dpc ; dpc 0,5 désigne la détection d’un bouchon vaginal), et la culture subséquente de l’allantoïde explants sur α4β1 immobilisé intégrines. Cette méthode permet une évaluation rapide et fonctionnelle de l’attachement et la diffusion de comportement d’explants d’allantoïde multiples en parallèle et à différents moments successifs. Le protocole peut être utilisé pour dépister les effets des mutations ciblées, de drogues ou de différents facteurs environnementaux sur l’allantoïde fixation ex vivo.
Protocole
Élevage de souris a été approuvé par le Regierung Unterfranken, et toutes les analyses ont été réalisées en stricte conformité avec tous les allemands et l’Union européenne aux lois et règlements concernant le soin et l’utilisation des animaux de laboratoire.
1. revêtement de microplaques plaques avec l’intégrine α4β1 pour Ex Utero allantoïde Explant Culture
- Reconstituer l’intégrine α4β1 murin lyophilisée stérile solution saline tamponnée au phosphate (PBS) 200 µg/ml. Diluer à une concentration finale de 10 µg/mL dans le milieu (37 ° C) PBS. Pipeter 20 µL/puits de la solution de l’intégrine α4β1 dilué dans le nombre requis de puits d’une microplaque (1 allantoïde/puits).
NOTE : Éviter la formation de bulles d’air lorsque le revêtement du puits de la plaque de microtitration. - Incuber les plaques de microtitration pendant 60 min à 37 ° C en les plaçant dans un incubateur de culture de tissu humidifié.
- Soigneusement aspirer le surnageant avec une pipette. Utilisation légère succion et l’inclinaison de la plaque pour éviter de toucher le fond bien avec la pipette. Laver les puits deux fois en ajoutant 50 µL de milieu de culture pré chauffé (37 ° C) comme de Dulbecco modifié Eagle (DMEM) et enlever le support de lavage par aspiration douce.
- Étape cruciale : bloc gratuit des sites de liaison en ajoutant 50 µL/puits de 0,1 % (p/v) d’albumine sérique bovine (BSA) / DMEM et incuber pendant ≥ 30 min à 37 ° C en plaçant des plaques de microtitration dans un incubateur de culture de tissu humidifié.
NOTE : Les explants allantoïde peuvent fixer sur des surfaces diverses en présence de sérum. Il est donc impératif de bloquer les sites de fixation non spécifique, après avoir enduit les puits avec l’intégrine et avant d’ajouter l’allantoïde disséqué pour explant culture en sérum contenant moyen (voir étape 4.4). - Gardez de la microplaque à la solution de saturation à 37 ° C jusqu'à ce que nécessaire à l’étape 4.4.
2. utérus Dissection d’une souris enceinte au Dpc 8
Remarque : Réduire les taux de grossesse de faux-positifs de poids gain discrimination15.
- Sacrifier la souris par dislocation cervicale. Désinfecter le manteau dans la région abdominale en les vaporisant avec l’éthanol à 70 % (v/v).
NOTE : Porter des gants lorsque vous manipulez des souris. L’euthanasie par dislocation cervicale sans anesthésiques empêche la contamination chimique de l’allantoïde, qui peut-être interférer avec l’attachement de l’allantoïde. - Ouvrir la peau abdominale en faisant une petite incision à la ligne médiane avec des ciseaux. Utiliser les doigts gantés de tenir la peau au-dessus et au-dessous de l’incision et écartez la peau vers la poitrine et la queue de la souris.
- Saisir le péritoine avec une pince. Avec l’autre main, faire une incision en forme de V de la partie antérieure vers postérieur à l’aide de ciseaux et déplacer le tissu loin d’exposer la cavité abdominale. Utilisez la pince pour pousser les intestins d’un côté pour accéder à l’utérus.
- Localisez les deux cornes utérines. Tenir le col de l’utérus (le segment caudal) avec une pince et couper les ligaments avec des ciseaux. Puis détacher les deux cornes utérines en sectionnant les oviductes avec des ciseaux.
- Utilisez des pinces pour transférer l’utérus dans un stérile 10 cm plat contenant stérile, PBS de température ambiante (RT). Retirez le tissu adipeux, vaisseaux et nerfs qui entourent les cornes utérines avec pince fine et/ou des ciseaux (Figure 1 a).
3. Dissection de l’embryon
Remarque : Effectuez les opérations suivantes sous un stéréomicroscope équipé d’une plage de zoom 8:1.
- Séparer les embryons en coupant entre les sites d’implantation avec des ciseaux. Saisir la musculaire muqueuse utérine des utérus bourgeons avec une pince et tirer à part pour exposer la caduque (Figure 1 b).
- À l’aide de pinces, transférer les bourgeons de l’utérus dans une autre boite de 10 cm contenant stérile, RT PBS.
- Difficulté la caduque autour de l’embryon avec le bout des pinces.
- Faire une incision sur le côté de l’anti-mesometrial de la caduque avec une pince fine (Figure 1) et la caduque, décollez avec une pince pour exposer l’embryon (Figure 1).
Remarque : Le pôle mesometrial de la caduque est fortement vascularisé et peut être plus large à sa base que la partie anti-mesometrial, qui contient l’embryon et apparaît plus pâles. - Disséquer l’embryon avec une pince (Figure 1E, F).
- À l’aide d’une micro-cuillère, transférer l’embryon dans une goutte de solution de PBS stérile contenue dans un récipient stérile de 3,5 cm.
- Transférer l’embryon dans une nouvelle goutte de PBS dans le même plat de 3,5 cm à l’aide d’une micro-cuillère et disséquer l’embryon du sac vitellin à l’aide de pinces (Figure 1, H).
- Éventuellement, si nécessaire (par exemple, pour le génotypage par polymerase chain reaction), transférer le sac vitellin dans un tube stérile en aspirant avec ~ 5 µL PBS dans un grand orifice 200 µL de pipette. Conserver à-20 ° C.
Remarque : Des tissus maternels (c.-à-d., le sac vitellin pariétal comme membrane de Reichert et le cône ectoplacental) susceptibles de contaminer la préparation du sac vitellin peuvent conduire à des résultats erronés de génotypage. Suppression de ces tissus est plus facile avant la dissection de l’embryon du sac vitellin.
4. allantoïde Dissection et Culture Ex Utero sur l’intégrine α4β1 immobilisé
- L’allantoïde, coupez son site basale d’insertion à l’extrémité postérieure de l’embryon à l’aide de pinces fines (Figure 1 H).
- Éventuellement, s’il faut du développement mise en scène, compter les paires de segments de l’embryon par inspection visuelle à l’aide d’un microscope équipé d’optique de contraste de phase et un 5 x et objectif × 10.
Remarque : L’embryon peut être étendu avec une pince pour faciliter le dénombrement du somite. Fusion et Chorio-accessoire se produisent entre E 8.0 et 9.0 E chez les embryons avec paires ≥ 6 somite. Virage commence dans des embryons avec 6-8 paires de segments. - Pipette 40 µL/puits de DMEM additionné de sérum de veau fœtal 10 % (v/v), L-glutamine et des antibiotiques dans le nombre requis de micropuits de plaque revêtus (voir Section 1).
- Recueillir l’allantoïde flottant en aspirant avec ~ 5 µL PBS dans un grand orifice d’une pointe de pipette de 200 µL. Transférer 1 allantoïde/puits.
- Incuber les allantoides en plaçant des plaques de microtitration dans un incubateur de culture de tissu humidifié (37 ° C, 5 % de CO2) pour par exemple, 6, 12 et 24 h. Afin d’éviter toute interférence avec l’attachement de l’allantoïde, ne déplacez pas les plaques de microtitration entre ces points dans le temps.
- À chaque moment, marquer l’attachement allantoïde (p. ex., aucun attachement/flottant allantoïde allantoïde partiellement ou totalement attachée ; entièrement propagation allantoïde) à l’aide d’un microscope équipé avec phase contraste ou différentiel interférences contraste une optique et un 5 × ou × 10 objectif (Figure 2).
NOTE : Des exemples représentatifs d’allantoides fraîchement isolées et complètement attachées sont illustrés Figure 2. Ex utero, l’extrémité distale du allantoides isolés de souris C57BL/6J de type sauvage s’attache au sein de 4 à 6 h (Ceci est dénommé fixation partielle de l’allantoïde) et fixation complète de l’allantoïde entière est obtenue dans les ~ 12 h de culture. De 18 à 24 heures, l’explant a aplati et a assumé une forme circulaire (appelée pour aussi pleinement répandre allantoïde) CD31 séropositifs au plexus vasculaire9,16.
5. confirmation de coloration de l’allantoïde explanté pour le CD31 de marqueur de cellules endothéliales
- Aspirer le milieu de culture d’explants de propagation complètement et fixer les cellules en ajoutant 40 µL/puits de 4 % (p/v) paraformaldéhyde/PBS.
NOTE : Paraformaldéhyde est toxique. Porter des gants et des lunettes de sécurité pour éviter la peau et contact avec les yeux. - Incuber pendant 10 min à la droite, puis aspirer le surnageant. Laver trois fois en ajoutant 40 µL/puits de PBS et enlever le support de lavage par aspiration douce.
- Permeabilize des cellules et bloquer les sites de fixation non spécifique en ajoutant 40 µL/puits de 0,1 % (v/v) de sérum de chèvre normal de Triton X-100/0.1% (p/v) BSA/10% (v/v) dans du PBS pendant 30 min à RT. Wash deux fois en ajoutant 40 µL/puits de PBS et enlever le support de lavage par aspiration douce.
Remarque : Le protocole peut être suspendu pendant la nuit à ce stade. - Colorer les cellules en ajoutant 20 µL/puits des anticorps anti-CD31 primaire dilué 01:50 dans 0,1 % (p/v) BSA/PBS pendant la nuit à 4 ° C. Laver trois fois en ajoutant 40 µL/puits de PBS et enlever le support de lavage par aspiration douce.
- Détecter les anticorps primaires en ajoutant 20 µL/puits de chèvre secondaire fluorescent marqué des anticorps anti-rat dilué 1 : 200 à 0,1 % (p/v) : BSA/PBS pendant 1 h à RT. Protect microplaques de la lumière par les envelopper dans du papier d’aluminium, soit en plaçant dans une chambre noire. Laver trois fois en ajoutant 40 µL/puits de PBS et enlever le support de lavage par aspiration douce.
- Intégrer des cellules en ajoutant 20 µL/puits de milieu de montage. Incuber pendant ~ 1 h à RT jusqu'à ce que le milieu de montage se solidifie. Stocker les microplaques à RT ou à 4 ° C, abri de la lumière.
- Image du plexus vasculaire de l’allantoïde des explants sous un microscope à fluorescence équipé a × 5 ou 10 × objectif et filtres de fluorescence approprié.
NOTE : Images représentatives du plexus vasculaire CD31-positif d’une allantoïde entièrement propagation sont indiquées à la Figure 3. Autres marqueurs pour le plexus vasculaire, tels que des anticorps dirigés contre Flk-1, Flt, Tie-1 ou Tie-2 peut servir bien16.
Résultats
Ce protocole décrit une méthode pour isoler et explantation murin allantoides ex vivoet détaille l’évaluation qualitative de l’allantoïde pièce jointe à l’intégrine α4β1, un processus critique pendant en vivo Chorio-fusion. Les résultats représentatifs, illustrés à la Figure 1 a–H montrent les étapes successives d’isolement allantoïde à partir de l’utérus gravide. Des tissus maternels qui entourent les cornes utérines, tels que le tissu adipeux et les vaisseaux (Figure 1 a) sont supprimés, et les embryons sont disséqués de l’endomètre de façon progressive après ouverture vers le haut de la couche musculaire utérine (Figure 1 b- E). Par la suite, les autres tissus maternels tels que le sac vitellin pariétal et le cône d’ectoplacental sont supprimées (Figure 1E, F). Figure 1 - H montre que la technique compose de la dissection de l’allantoïde extra-embryonnaires loin le sac vitellin, un autre tissus extra-embryonnaires et très vascularisée. Allantoides isolés selon le présent protocole sont donc, en grande partie libres de contamination des tissus maternels ou embryonnaires (en sus) autre que de l’allantoïde.
La figure 2 montre que la taille et la forme des allantoides d’embryons fraîchement disséqués dans une portée unique peuvent varier considérablement14. Allantoides d’embryons de type sauvage de C57BL/6J disséqués à 8,5 E avaient une morphologie allongée dans 74 % des cas (45 des 61 embryons analysées), comme illustré dans la Figure 2 et Figure 1 H. Cependant, dans 15 % (9/61) des embryons, les allantoides étaient nettement plus petits et plus arrondie (voir référence14) et 11 % (7/61) des embryons n'avait pas encore formé une allantoïde visible au moment de la dissection. Malgré les formes hétérogènes et la taille au départ temps d’allantoïde explantation culture (Figure 2, panneaux une–h), fixation de l’allantoïde et épandage complet sur l’intégrine α4β1 immobilisé a été observée dans les 12 h en tout de le 54 allantoides fraîchement isolées disséqué des embryons de sept portées. Néanmoins, les formes et les tailles des explants après 12 h de culture ont été quelque peu hétérogène (Figure 2), reflétant les différentes morphologies allantoïdien au point de départ de l’essai.
La figure 3 montre un immunocytochimique de coloration pour les cellules endothéliales CD31-positif d’allantoides pleinement attachées après 24 h de culture des explants, qui confirme que les explants avaient élaboré un plexus vasculaire par ce point dans le temps comme prévu9 , 16. ces cultures allantoïde adhérente peuvent être utilisés pour étudier la formation de vaisseaux sanguins dans vitro9. Par conséquent, explants allantoïde méthodologie présentée des rendements qui peuvent être facilement cultivées ex vivo, en accord avec précédemment publié études expérimentales9,16.
Le protocole définit le cadre pour l’évaluation de l’attachement de l’allantoïde microscopie à des moments prédéterminés, comme après 12 h ou 24 h de culture d’explants. Les résultats peuvent être évaluées de façon qualitative (fixation partielle/complète ou propagation complète à un moment donné – oui/non). Puisque l’explant même peut être visualisé à plusieurs reprises et a marqué, cette analyse reflète que les caractéristiques de chaque allantoïde explant cultures au fil du temps. En outre, la formation d’un plexus vasculaire des explants de fixe et colorées peut être évalués (Figure 3).

Figure 1 : représentant les étapes de la dissection de l’allantoïde. (A) détail Découvre d’une corne utérine isolée. Bourgeons d’utérus contenant les embryons sont marquées par des étoiles ; le tissu adipeux et les vaisseaux qui entourent la corne utérine sont vus sur le côté gauche. (B) vue de la caduque (l’endomètre) après l’enlèvement de la couche musculaire de l’utérus. Le très vascularisée, mesometrial pôle de la caduque est orientée vers la gauche, la partie anti-mesometrial (marquée d’une étoile) qui contient l’embryon est orientée vers la droite. (C) côté Découvre du pôle disséqués anti-mesometrial de la caduque (marqué d’une étoile). La flèche indique l’emplacement de l’embryon. Vue de dessus (D) du produit de conception (flèche) entouré par le sac vitellin pariétal après élimination partielle de la caduque environnante. (E, F) Vue représentante les étapes suivantes de la dissection de l’embryon (flèche). La flèche indique le sac vitellin. (E), le cône d’ectoplacental (CBE) est visible sur la droite. (G) la dissection partielle de l’embryon (flèche) de la vésicule vitelline (pointes de flèche). L’allantoïde est marqué avec une étoile rouge. (H) embryon isolés (flèche) avec l’allantoïde (étoile rouge). La position où l’allantoïde sera coupée de son chantier d’insertion basale à l’extrémité postérieure de l’embryon est indiquée par une ligne rouge discontinue. Des images ont été prises sur un stéréomicroscope avec une plage de zoom 8:1. Toutes les barres d’échelle sont mm 1. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
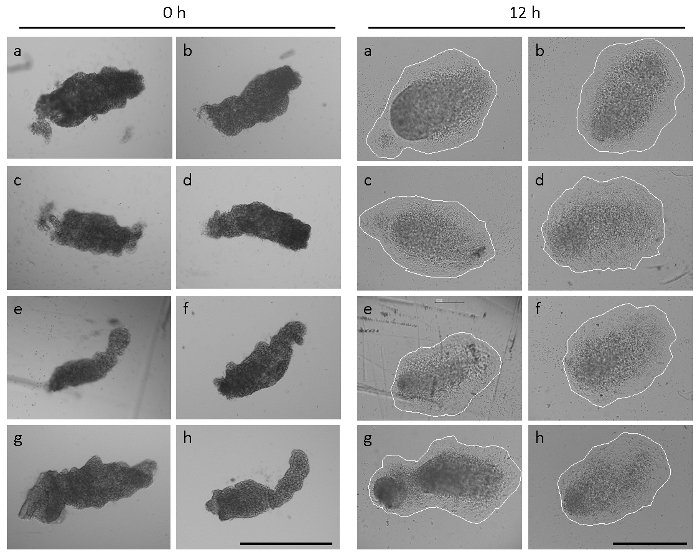
Figure 2 : formes hétérogènes et tailles d’allantoides. Huit allantoides (un–h) ont été isolés des embryons d’une portée unique. Panneau latéral gauche, allantoides immédiatement après dissection (0 h). Panneau de droite, l’allantoides mêmes après 12 h de culture d’explants. Les explants sont solidement fixées, et cellules mésenchymateuses ont semé. Les explants sont entourées pour visualiser la taille de l’explant. Des images ont été prises sur un microscope équipé d’optique de contraste de phase et un 5 × (panneau de gauche) ou un objectif de 10 × (panneau de droite). Toutes les barres d’échelle sont 500 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : formation de plexus vasculaire dans des cultures d’explants allantoïde. Allantoides ont été disséqués et cultivés sur l’intégrine α4β1 immobilisée comme décrit dans le présent protocole. Des explants ont été cultivés pendant 24 h, et les cellules endothéliales dans le plexus vasculaire ont été colorées en utilisant des anticorps primaire anti-CD31 et fluorescent étiquetée anticorps secondaires. Les cellules endothéliales apparaîtront en vert. L’image du dessus montre le plexus vasculaire ensemble dans la zone centrale d’un explant allantoïde représentatif. L’image a été prise sur un microscope équipé d’optique de fluorescence et un objectif de 5 ×. Echelle, 500 µm. Les deux panneaux inférieurs sont des images de grossissement supérieure d’un autre allantoïde explant disséqué et cultivées dans les mêmes conditions. Structures ressemblant à des navires et des cellules endothéliales individuelles sont visibles. Des images ont été prises sur un microscope confocal ; barres, 25 µm. l’échelle s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
En présence de sérum, qui est une source riche en molécules de la matrice extracellulaire Pro-adhésif telles que la fibronectine, allantoïde explants s’attacheront facilement à divers plastique, verre ou filtre surfaces9,16. Ainsi, si l’objectif de l’essai effectué est d’étudier plus précisément l’effet d’une modification génétique ou tout autre traitement sur l’attachement allantoïde à immobilisé α4β1, il est essentiel de bloquer des sites de fixation non spécifique (par exemple, avec du sérum de boeuf l’albumine) après avoir enduit les surfaces avec intégrine et avant incubation avec sérum contenant médias.
L’attachement initial des explants allantoïde à l’intégrine α4β1 immobilisé est très sensible au mouvement, et les plaques de culture de tissus par conséquent devraient être laissées intactes pour une période de temps prédéterminée (p. ex., pendant 12 h) avant de marquer l’allantoïde système de fixation. Notez que le temps requis pour contact stable formation avec le substrat peut varier selon la souche de souris analysées ou la concentration de l’intégrine α4β1 immobilisée.
L’exigence de l’intercellulaire VCAM-1/α4β1-interaction pour fusion Chorio-réussie est solidement établi11,12,13. En outre, molécules de la matrice extracellulaire telles que la fibronectine, de collagènes et d’autres molécules d’intérêt peuvent être également immobilisés et utilisés comme substrats « chorio-mimétique ».
Chorio-fixation dépend de l’interaction intercellulaire entre VCAM-1 et sa liaison partenaire intégrine α4β1. In utero, Chorio-attachement et fusion subséquente ne peuvent se produire lorsque l’allantoïde a suffisamment étendu pour faire contact avec le chorion. Compte tenu de la variabilité physiologique en tailles allantoïde à un stade de développement particulier, Chorio-attachement et la fusion ont lieu entre E 8.0 et 9.0 E (plage, E 7,5-E 9.25)14,16. Méthodes spécifiquement étude le procédé transitoire d’attachement allantoïde au chorionique plaque in utero chez la souris vivantes ne sont pas facilement disponibles à présent. Plutôt, les analyses sont principalement axés sur la détermination laborieuse de Chorio-fusion par évaluation histologique de p. ex., allantoïdien s’étalant sur la surface du chorion et le développement de la couche de labyrinthe à un seul, déterminé à l’avance point de temps11,12,13,16. L’analyse de ce point de terminaison ne peut pas distinguer les défauts qui sont précisément en raison de l’attachement avec facultés affaiblies de l’allantoïde au chorion et effets dépendants de chorion et sont limitée par la variabilité inhérente des stades du développement embryonnaire et allantoïdien tailles. Tel que discuté dans les Résultats de représentant, la variabilité physiologique allantoïde taille peut entraîner un retard relatif de Chorio-fusion en ~ 26 % des embryons de type sauvage C57BL/6J. Statistiquement parlant, presque deux dans sept des souris enceintes auraient donc été sacrifiés trop tôt (61 embryons provenant de sept portées, taille de la portée moyenne 8,7), qui se traduit par la nécessité d’un important excès d’études à grande échelle de reproduction. Fait intéressant, les expériences microchirurgicales ont révélé que le chorion est déjà compétent pour fusionner avec l’allantoïde au stade de la paire 1 somite, et que l’allantoïde présente une capacité de fusion maximale chez les embryons avec 3-5 somite paires14. Les cellules chorioadhesive de l’allantoïde sont donc formés et fonctionnellement compétent avant le réel attachement Chorio- in vivo. L’analyse ex utero d’attachement allantoïde aux ligands immobilisés, tel que présenté ici, est donc relativement indépendante d’une taille donnée allantoïde. Par conséquent, l’un des avantages de cette méthode sont qu’il ignore les vices de l’élongation allantoïde et met l’accent sur la prochaine étape dans la formation du placenta, c.-à-d., attachement de l’allantoîde. Cette approche peut donc servir à distinguer les défauts dans l’élongation de l’allantoïde et attachement allantoîde en génétique de souris mutantes.
Contrairement à la méthode traditionnelle d’aspiration allantoïde de son point de fixation de l’embryon à l’aide d’une pipette de bouche16, le protocole actuel utilise une approche de découpe manuelle et l’allantoïde est géré ensuite à l’aide de pointes de pipette grand orifice . Un avantage important de l’aspiration de l’allantoïde est que cette méthode évite la manipulation directe de tissu. Coupe et manipuler l’allantoïde peuvent endommager les cellules de chorioadhesive de la gaine externe du mésothélium allantoïdien. Néanmoins, coupant l’allantoïde avec une pince a été utilisé avec succès avant dans ex vivo des cultures de tissus pre-placental17et la cinétique de l’explant allantoïdien attachement et la morphologie des cultures explant décrits dans le présente étude sont semblables aux données publiées, basées sur l’isolement de l’allantoïde par aspiration16. Ces résultats suggèrent que des cellules chorioadhesive sont suffisamment bien préservés à la découpe manuelle de l’allantoïde, et cette différenciation explant n’est pas gravement perturbée, comme indiqué par la formation d’endothelia CD31-positif. Direct de découpage de l’allantoïde aussi offre la possibilité de disséquer seulement les deux tiers supérieurs de l’allantoïde qui expriment la VCAM-1,13, et il assure moins de contamination avec des cellules dérivées de sac vitellin, qui pourraient devoir être coupé de la base de la allantoïde après allantoïde aspiration18.
L’analyse ex utero d’adhérence explant allantoïdien immobiliser, l’intégrine α4β1 recombinant fournit une lecture qualitative d’un pas important, initial requis pour Chorio-fusion, c'est-à-dire, l’interaction intercellulaire entre VCAM-1 exprimé sur l’allantoïde et l’intégrine α4β1 localisé le mésothélium chorionique, qui est dérivé du mésoderme extra-embryonnaire. Néanmoins, bien que ces molécules de deux adhésion sont reconnus comme des acteurs de principe de fusion Chorio-, ~ 50 % des embryons avec des mutations homozygotes knockout intégrine VCAM-1 ou α4 subissent Chorio-fusion en vivo11 ,12,13. En raison de cette pénétrance incomplète, l’ex vivo la méthode décrite dans le présent protocole ne peut-être pas suffisante pour écarter une exigence pour ces molécules de deux adhésion modèles génétiques souffrant d’une insuffisance de la Chorio-fusion.
Dans des conditions physiologiques, les intégrines α4β1 sont incorporées dans la membrane plasmique des trophoblastes chorioniques et sont intégrés dans un réseau complexe de protéines structurales et signalisation qui coopèrent pour réglementer l’adhérence cellule-cellule (et cellule-matrice) 19. comme avec la plupart réductionniste in vitro des approches, la complexité de l’interface de liaison chorionique VCAM-1 est uniquement modélisée dans une mesure très limitée par intégrine α4β1 immobilisée. En plus de l’éventuel manque d’autres importants intrants structurels ou signalisation dérivé du chorion intact dans ce système, il est probable que seulement une fraction des intégrines qui sont immobilisées sur une surface rigide, deux dimensions sont présentes dans les actifs, conformation de liaison compétent, « ouverte ».
La méthode présentée rapproche de l’attachement précoce et la diffusion de l’étape de l’allantoïde pour le chorion et pouvez également rapport sur le développement du plexus vasculaire allantoïdien lorsqu’il est combiné avec l’analyse du navire formation9. Toutefois, l’approche actuelle ne modélise pas l’invasion du chorion par germination angiogenèse médiée par les cellules endothéliales allantoïdien, et ne réflètent pas ramifiée morphogénèse par le chorion, qui est un processus essentiel pour Chorio-fusion et le développement ultérieur du labyrinthe placentaire10.
En utilisant le contraste de phase ou microscope interférentiel différentiel associé (semi-) automatiques analyse d’image, la méthode présentée pourrait être appliquée dans les écrans de plus grande envergure pour l’analyse initiale de retard ou échec de fixation allantoïdien in vitro. Outre l’analyse des souris mutantes, la méthode peut être d’intérêt pour les effets de drogues, des pathogènes, des métabolites ou des agents environnementaux sur liquide allantoïdienne fixation de l’écran.
De nombreuses souris mutantes, Chorio-accessoire ne parvient pas à se produire, même si l’allantoïde et le chorion semblent avoir développé normalement. En outre, mutants qui présente des défauts de fixation Chorio-généralement affichent une pénétrance incomplète1,2,10. Il sera important d’examiner si ces gènes fonctionnellement apparemment très différentes des répercussions des voies moléculaires communs et/ou processus cellulaires. L’imagerie direct des explants allantoïde provenant de souris mutantes a le potentiel pour élucider ces mécanismes. Par exemple, les cellules de la gaine externe de l’allantoïde disséqué pourraient être étiquetés avec les colorants fluorescents vitales (comme DiI ou DiO carbocyanine lipophiles traceurs16,18) à image adhérence et la propagation des événements, ou pour suivre des cellules migration en temps réel. En outre, reporters fluorescents que visualiser les protéines du cytosquelette ou adhérence peuvent s’avérer instructif.
Récemment, un système de co-culture ex vivo pour fixation préalable allantoides murins et chorions a été décrite, et cette approche a été utilisée avec succès pour enquêter sur les événements qui se produisent après Chorio-fixation, tels que la couche de labyrinthe formation17. L’analyse de l’efficacité d’attachement allantoïde sur immobilisé chorions isolées de divers (p. ex., organismes génétiquement modifiés) modèles de souris peuvent donner de nouvelles perspectives sur les acteurs moléculaires et les voies qui régissent les étapes précoces dans le développement de la murine placenta.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Deutsche Forschungsgemeinschaft SFB688 (à A.G.).
matériels
| Name | Company | Catalog Number | Comments |
| C57BL/6J wildtype mice | The Jackson Laboratory | Stock No: 000664 | |
| 70 % (v/v) Ethanol | VWR International | 930031006 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | Forceps used to open the abdominal cavity. |
| Micro dissecting forceps | Fine Science Tools | 11254-20 | Dumont # 5 medical biology forcepts with fine, sharp tip. |
| Fine scissors | Fine Science Tools | 14094-11 | Straight blades. |
| Spring scissors | Fine Science Tools | 15012-12 | Noyes spring scissors with 14 mm blades for the dissection of uterus buds. |
| Microspoon | Carl Roth | AT18.1 | 5 mm Spoon diameter. |
| Microtiter plates | ibidi | 81501 | We use uncoated, sterile angiogenesis slides (internal volume 50 µL) with a hydrophobic surface that is not tissue-culture treated to reduce non-α4β1-mediated binding to plastic. |
| 10 cm dish | Nunc | 150350 | Sterile tissue culture dishes. |
| 3.5 cm dish | Nunc | 150288 | Sterile tissue culture dishes. |
| Large orifice pipette tips | Biozym | VT0140X | Low binding pipette tips, 200 µL. |
| α4β1 integrin | R&D Systems | 6054-A4 | Murine α4β1 integrin recombinantly expressed and purified from a Chinese hamster ovary cell line. |
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma Aldrich | D8537 | Without Ca2+ and Mg2+. |
| Dulbecco’s Modified Eagle Medium (DMEM) | PAN Biotech | P04-03600 | The formulation contains 4.5 g/L glucose, 110 mg/L sodium pyruvate and 3.7 g/L NaHCO3 but no L-glutamine, which is added separately. |
| Penicillin/Streptomycin | Gibco (ThermoFisher Scientific) | 15140-122 | 100 x (10,000 U/mL Penicillin and 10,000 µg/mL streptomycin) stock solution. Prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| L-Glutamine | PAN Biotech | P04-80100 | 100 x (200 mM) Stock solution. Prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Fetal bovine serum | Biochrom | S 0115 | We use heat-inactivated FBS (heated to 56 °C for 30 min with mixing to inactivate complement). |
| Bovine serum albumin (BSA) | Sigma Aldrich | A7030 | We use protease- and fatty acid-free albumin. Prepare a 0.1 % (w/v) solution in DMEM. Sterile filter the solution through a disposable cell culture filter with a 0.22 µm pore size and low protein-binding membrane, and store aliquots at -20 °C. |
| para-Formaldehyde | Carl Roth | 0335.2 | To make a formaldehyde solution in PBS, weigh para-formaldehyde powder in a ventilated hood, and add it to PBS preheated to ca. 60 °C in a beaker on a stir plate. Add 1 N NaOH dropwise until solution clears. Let solution cool to room temperature, and filter through 0.22 mm filter syringe. Adjust pH with diluted HCl to ca. 6.9, and adjust to final volume with PBS. We aliquot and freeze the solution, but it can also be stored at 4 °C for approximately four weeks. |
| Triton X-100 | Sigma Aldrich | X100 | Use wide-orifice pipette tips to handle undiluted Triton X-100. |
| Normal goat serum | Sigma Aldrich | G9023 | To block non-specific binding of antibodies in immunofluorescence analyses. |
| α-CD31 Antibodies | BD Biosciences | 550274 | Purified rat anti-mouse monoclonal antibodies, clone MEC 13.3. |
| Secondary goat anti-rat antibodies | Thermo Fisher | A-11006 | Goat anti-rat IgG (heavy and light chains), cross-adsorbed, fluorescently labeled with Alexa Fluor 488. Other fluorescent labels are also possible. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | Mounting medium for cytochemistry. MW ~31,000 |
| Labovert | Leitz | Labovert | Inverted phase contrast microscope equipped with a 4 x and 10 x objective for somite pair counting. Other phase contrast microscopes (such as those that are routinely used in tissue culture) are also suitable. |
| M80 | Leica Microsystems | M80 | Stereomicroscope with 8 : 1 zoom range (yielding a magnification between 7.5 x and 60 x) for embryo and allantois dissection. |
| DM4000B | Leica Microsystems | DM4000B | Microscope system for histology with LED illumination. We use HCX PL FLUOTAR 5 x/0.15 and HC PL FLUOTAR 10 x/0.30 objectives. Other microscopes equipped phase contrast and fluorescence optics can be used to score allantois attachment. |
| Digital camera | JVC | KY-F75U | 3-CCD digital capture camera attached to the DM4000B LED microscope. We use Diskus software (Hilgers) to operate both the microscope and the camera. |
| Confocal microscope | Leica Microsystems | SP5 | Confocal microscope for higher-resolution imaging of endothelia in the vascular plexus of allantois explants. Immunofluorescence images were taken with a 40 x objective. |
Références
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nat Rev Genet. 2 (7), 538-548 (2001).
- Segerer, G., et al. An essential developmental function for murine phosphoglycolate phosphatase in safeguarding cell proliferation. Sci Rep. 6, 35160 (2016).
- Kane, S. V., Acquah, L. A. Placental transport of immunoglobulins: a clinical review for gastroenterologists who prescribe therapeutic monoclonal antibodies to women during conception and pregnancy. Am J Gastroenterol. 104 (1), 228-233 (2009).
- Xu, X., Vugmeyster, Y. Challenges and opportunities in absorption, distribution, metabolism, and excretion studies of therapeutic biologics. AAPS J. 14 (4), 781-791 (2012).
- Wesolowski, S. R., Kasmi, K. C., Jonscher, K. R., Friedman, J. E. Developmental origins of NAFLD: a womb with a clue. Nat Rev Gastroenterol Hepatol. 14 (2), 81-96 (2017).
- Racicot, K., Mor, G. Risks associated with viral infections during pregnancy. J Clin Invest. 127 (5), 1591-1599 (2017).
- Grandjean, P., et al. Life-Long Implications of Developmental Exposure to Environmental Stressors: New Perspectives. Endocrinology. 156 (10), 3408-3415 (2015).
- Inman, K. E., Downs, K. M. The murine allantois: emerging paradigms in development of the mammalian umbilical cord and its relation to the fetus. Genesis. 45 (5), 237-258 (2007).
- Arora, R., Papaioannou, V. E. The murine allantois: a model system for the study of blood vessel formation. Blood. 120 (13), 2562-2572 (2012).
- Watson, E. D., Cross, J. C. Development of structures and transport functions in the mouse placenta. Physiology (Bethesda). 20, 180-193 (2005).
- Yang, J. T., Rayburn, H., Hynes, R. O. Cell adhesion events mediated by alpha 4 integrins are essential in placental and cardiac development. Development. 121 (2), 549-560 (1995).
- Gurtner, G. C., et al. Targeted disruption of the murine VCAM1 gene: essential role of VCAM-1 in chorioallantoic fusion and placentation. Genes & development. 9 (1), 1-14 (1995).
- Kwee, L., et al. Defective development of the embryonic and extraembryonic circulatory systems in vascular cell adhesion molecule (VCAM-1) deficient mice. Development. 121 (2), 489-503 (1995).
- Downs, K. M., Gardner, R. L. An investigation into early placental ontogeny: allantoic attachment to the chorion is selective and developmentally regulated. Development. 121 (2), 407-416 (1995).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. J Am Assoc Lab Anim Sci. 54 (4), 368-371 (2015).
- Downs, K. M., Temkin, R., Gifford, S., McHugh, J. Study of the murine allantois by allantoic explants. Dev Biol. 233 (2), 347-364 (2001).
- Hou, W., Sarikaya, D. P., Jerome-Majewska, L. A. Ex vivo culture of pre-placental tissues reveals that the allantois is required for maintained expression of Gcm1 and Tpbpalpha. Placenta. 47, 12-23 (2016).
- Zeigler, B. M., et al. The allantois and chorion, when isolated before circulation or chorio-allantoic fusion, have hematopoietic potential. Development. 133 (21), 4183-4192 (2006).
- Zaidel-Bar, R., Itzkovitz, S., Ma'ayan, A., Iyengar, R., Geiger, B. Functional atlas of the integrin adhesome. Nature cell biology. 9 (8), 858-867 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon