Method Article
Dissektion und modellabhängigen Kultur der murinen Allantois zur In-vitro- Analyse der Viruswenig Anlage
In diesem Artikel
Zusammenfassung
Wir beschreiben einen in-vitro- Test auf Modell chorioallantoic Anlage, der erste Schritt bei der Bildung der Plazenta. Das Protokoll zeigt die Dissektion und modellabhängigen Kultur der murinen Allantoides auf immobilisierte α4β1 Integrin. Allantois Anlage wird mikroskopisch zu vorher festgelegten Zeitpunkten ausgewertet.
Zusammenfassung
Die Plazenta ist essentiell für das Wachstum und die Entwicklung von Säugetier-Embryonen. Aus diesem Grund können zahlreiche genetische Veränderungen und wahrscheinlich auch ökologische Beleidigungen, die Plazenta-Entwicklung oder Funktion stören frühen Schwangerschaft bei Mäusen und Menschen verloren gehen. Dennoch fehlen einfache in-vitro- Assays für mögliche Auswirkungen auf die Bildung der Plazenta auf den Bildschirm. Hier konzentrieren wir uns auf die Modellierung der ersten und entscheidenden Schritt in Plazenta-Formation, bestehend aus der Befestigung des die Allantois an der Chorion. Wir beschreiben eine Methode, um schnell die Befestigung der Viruswenig Explantaten an immobilisierte α4β1 Integrin, bewerten die als Chorio-mimetischen Substrat dient. Dieser in-vitro- Ansatz ermöglicht eine qualitative Bewertung der Anlage und Verhalten von mehreren Allantois Explantaten zu verschiedenen aufeinander folgenden Zeitpunkten zu verbreiten. Das Protokoll kann verwendet werden, untersuchen die Wirkung von gezielten Maus Mutationen, Drogen oder verschiedene Umweltfaktoren, die zu Komplikationen während der Schwangerschaft oder fetale Verlust aus der Allantois Anlage ex Vivoverknüpft wurden.
Einleitung
Die Plazenta ist unverzichtbar für embryonale Wachstum und Entwicklung in der Gebärmutter. Es bildet die Schnittstelle für Sauerstoff, Metaboliten und Nährstoffaustausch zwischen fetalen und mütterlichen Kreislauf, und auch Funktionen als endokrine und immunologische Organ. Jede endogene oder exogene Beleidigung, die plazentaren Entwicklung beeinträchtigt führen zu intrauterine Wachstumsverzögerung, fetale Verlust oder Komplikationen während der Schwangerschaft, bei Mäusen und Menschen1. Während die Zahl der gezielten Maus Mutationen, abnorme plazentar Physiologie verursachen, weiter erhöht2, 219 Genotypen, die derzeit auf der Website der Maus Genom Informatik (MGI) aufgeführt (http://www.informatics.jax.org/vocab/ Mp_ontology / MP:0010038), viele von diesen Phänotypen sind nicht gut verstanden, aus einem mechanistischen Sicht. Neben der genetischen Veränderungen, niedermolekulare Medikamente, monoklonale Antikörper, Toxine beeinträchtigen Krankheitserreger, überschüssige Stoffwechselprodukte oder verschiedene Umweltfaktoren Plazenta-Entwicklung und Funktion3,4,5 , 6 , 7. doch einfach in-vitro- Tests, dass Modell wichtige Schritte in der Entwicklung der Plazenta knapp sind.
Murine plazentar Entwicklung im frühen Midgestation beginnt, wenn die Allantois (developmental Vorläufer der Nabelschnur) vom hinteren Ende des Embryos als eine Knospe entsteht, die in Richtung der Chorion8wächst. Chorioadhesive Zellen in der äußeren Schicht der Viruswenig Knospe vermitteln die Befestigung und Verbreitung der Allantois auf der Oberfläche des Chorion (chorioallantoic "Fusion"). Das Chorion faltet sich anschließend in Zotten in die das Gefäßsystem der Allantois wächst, das Labyrinth, die innere Schicht der Plazenta zu bilden, wo Nährstoffe und Sauerstoff zwischen eng nebeneinander angeordnete mütterlichen Blut Sinusoide und embryonale Gefäße9 ausgetauscht werden ,10.
Die Befestigung der Allantois an das Chorion ist der erste und entscheidende Schritt in Labyrinth Bildung und Mängel in diesem Prozess gehören zu den häufigsten Ursachen von embryonalen Tödlichkeit in midgestation1. Obwohl eine Reihe von Maus-Mutanten beschrieben worden, denen chorioallantoic Anlage scheitert10auftreten, und die MGI-Datenbank listet derzeit 108 Maus-Mutanten, die durch abnorme chorioallantoic Fusion (http:// gekennzeichnet sind Www.Informatics.Jax.org/Vocab/mp_ontology/MP:0002824), die interzelluläre Interaktion zwischen die vaskuläre Zelle Adhäsion Molekül-1 (VCAM-1, drückte auf den Viruswenig Mesoderm) und α4β1 Integrin (ausgedrückt auf die Chorion Mesothelium, die abgeleitet von extraembryonic Mesoderm) scheint für chorioallantoic Anlage und Fusion11,12,13unverzichtbar sein. Immunhistochemische Färbung des gesamten-Mount Wildtyp Embryonen hat gezeigt, dass VCAM-1 innerhalb der distale zwei Drittel der Viruswenig Stiel etwa embryonale Tag (E) 7,5 ausgedrückt wird13 (1-4 Somiten Bühne) und seinen Ausdruck bleibt hoch während chorioallantoic Anlage und -Fusion11,12. Ausfall der Viruswenig Bindung an das Chorion ist in der Regel durch histologische Analysen der Gebärmutter Knospen erkannt. Jedoch Allantois Größen sind physiologisch sehr variabel zwischen und sogar innerhalb Würfe von der gleichen Entwicklungsstufe14, und die Allantois kann nur an die Chorion anfügen, wenn sie eine ausreichende Größe, körperlichen Kontakt zu machen erreicht hat. Reflektieren diese natürliche Variabilität, chorioallantoic Anlage findet irgendwann zwischen ~ E 8.0 und 9.0 E in der Gebärmutterund eine statistisch zuverlässige Beurteilung dieses Verfahrens durch Histologie ist also abhängig von der Analyse einer großen Anzahl von Conceptuses, genügend Exemplare in den entsprechenden Entwicklungsstadium zu erhalten.
Hier beschreiben wir eine Methode zur Bestimmung Viruswenig Anlage ex Utero , die Allantois Größe weniger abhängig ist. Wir demonstrieren das Sezieren von Mäuseembryonen und ihre Allantoides aus Uteri von schwangeren Mäusen ~ 8 Tage post Coitum (Dpc; Dpc 0,5 bezeichnet die Erkennung von einem vaginalen Stecker), und die nachfolgende Kultur der Allantois explants auf immobilisierte α4β1 Integrine. Diese Methode ermöglicht eine schnelle, funktionale Bewertung der Anlage und Verhalten von mehreren Allantois Explantaten parallel und zu verschiedenen aufeinander folgenden Zeitpunkten zu verbreiten. Das Protokoll kann verwendet werden zum Bildschirm für die Auswirkungen von gezielter Mutationen, Drogen oder verschiedene Umweltfaktoren auf Allantois Anlage ex Vivo.
Protokoll
Maus-Zucht von der Regierung Unterfranken genehmigt wurde, und alle Analysen wurden unter strikter Einhaltung aller deutschen und Europäischen Union geltenden Gesetzen und Vorschriften rund um Pflege und Verwendung von Labortieren durchgeführt.
(1) Beschichtung der Mikrotiter-Platten mit α4β1 Integrin für Ex Utero Allantois Explant Kultur
- Bereiten Sie die lyophilisierten murinen α4β1 Integrin bei 200 µg/mL in sterilen Phosphat-gepufferte Kochsalzlösung (PBS). Um eine Endkonzentration von 10 µg/mL im vorgewärmten (37 ° C) PBS verdünnen. Pipette 20 µL/Well der verdünnten α4β1 Integrin-Lösung in die erforderliche Anzahl von Brunnen von einer Mikrotiterplatte (1 Allantois/Na).
Hinweis: Vermeiden Sie die Bildung von Luftblasen, wenn die Vertiefungen der Mikrotiterplatte Beschichtung. - Inkubieren Sie die Mikrotiter-Platten für 60 min bei 37 ° C werden, indem sie in einem befeuchteten Gewebekultur Inkubator.
- Aspirieren Sie sorgfältig den Überstand mit einer Pipette. Verwenden Sie sanfte Saugwirkung und Neigung der Platte zu vermeiden, berühren die Näpfchenboden mit der Pipettenspitze. Waschen Sie Brunnen zweimal durch Zugabe von 50 µL vorgewärmten (37 ° C) Kulturmedium wie Dulbeccos geändert Eagle Medium (DMEM), und entfernen Sie das Waschmedium durch sanfte Saugwirkung.
- Entscheidender Schritt: Block frei Bindungsstellen durch Zugabe von 50 µL/Well von 0,1 % (w/V) Rinderserumalbumin (BSA) / DMEM und ≥ 30 min bei 37 ° C inkubieren, indem man die Mikrotiter-Platten in einem Inkubator befeuchtete Gewebekultur.
Hinweis: Allantois Explantaten können verschiedene Oberflächen in Anwesenheit von Serum zuordnen. Es ist daher unerlässlich, unspezifischen Bindungsstellen blockieren, nach der Beschichtung die Brunnen mit Integrin und vor dem Hinzufügen der seziert Allantois für explant Kultur im Serum-haltigen Medium (siehe Punkt 4.4). - Halten Sie die beschichteten Vertiefungen in der blockierenden Lösung bei 37 ° C bis in Schritt 4.4 benötigt.
(2) Gebärmutter Dissektion von schwangere Maus bei Dpc 8
Hinweis: Einkochen Sie falsch-Positive Schwangerschaftsrate Gewicht Gewinn Diskriminierung15.
- Die Maus durch zervikale Dislokation zu opfern. Desinfizieren Sie das Fell im Bauchbereich durch Besprühen mit 70 % (V/V) Ethanol.
Hinweis: Tragen Sie Handschuhe beim Umgang mit Mäusen. Euthanasie durch zervikale Dislokation ohne Betäubung verhindert chemische Verschmutzung der Allantois, die Allantois Anlage stören kann. - Öffnen Sie die Bauchhaut, indem man einen kleinen Schnitt an der Mittellinie mit einer Schere. Verwenden Sie behandschuhte Fingern, um die Haut oberhalb und unterhalb der Schnitt zu halten, und ziehen Sie die Haut auseinander in Richtung Brust und Ende der Maus.
- Greifen Sie das Bauchfell mit Zange. Mit der anderen Hand einen v-förmigen Einschnitt von anterior in Richtung Posterior mit einer Schere und bewegen Sie das Gewebe entfernt, um die Bauchhöhle aussetzen. Verwenden Sie die Zange um den Darm zur Seite schieben, um Zugriff auf die Gebärmutter.
- Suchen Sie die uterine zwei Hörner. Halten Sie den Gebärmutterhals (kaudalen Segment) mit Zange und schneiden Sie die Bänder mit einer feinen Schere. Lösen Sie dann beide uterinen Hörner durch Durchtrennung der Eileiter mit einer Schere.
- Verwenden Sie Zange, die Gebärmutter in eine sterile 10 cm Schüssel mit sterilen, übertragen Raumtemperatur (RT) PBS. Entfernen Sie Fettgewebe, Gefäße und Nerven rund um die Gebärmutter Hörner mit feinen Pinzette/Schere (Abbildung 1A) oder.
(3) Embryo Dissektion
Hinweis: Führen Sie folgende Schritte unter einem Stereomikroskop mit einem 8:1 Zoombereich ausgestattet.
- Trennen Sie die Embryonen durch Schneiden zwischen der Implantation Websites mit einer Schere. Greifen Sie die muskuläre Gebärmutterschleimhaut der Gebärmutter Knospen mit Zange und ziehen sie auseinander um die Dezidua (Abbildung 1 b) verfügbar zu machen.
- Mit Pinzette, übertragen Sie die Gebärmutter Knospen in eine neue 10 cm Schale mit sterilen, RT PBS.
- Befestigen Sie die Dezidua um den Embryo mit den Spitzen der Zange.
- Machen Sie einen Einschnitt auf der Anti-Mesometrial der Decidua mit feinen Pinzette (Abbildung 1), und ziehen Sie der Decidua mit Zange um den Embryo (Abbildung 1) verfügbar zu machen ab.
Hinweis: Der Mesometrial Pol von der Decidua ist stark durchblutet und kann an der Basis breiter als der Anti-Mesometrial Teil, der enthält des Embryos und blasser erscheint. - Zerlegen Sie den Embryo mit Zange (Abb. 1E, F).
- Mit einem Mikro-Löffel, transfer des Embryos zu einem Tropfen von sterilen PBS in einer sterilen 3,5 cm Schüssel enthalten.
- Transfer des Embryos zu einem frischen Tropfen von PBS in der gleichen 3,5 cm Schüssel mit einem Mikro-Löffel und sezieren die Embryos aus dem Dottersack mit Pinzette (Abbildung 1, H).
- Optional, bei Bedarf (z.B.für die Genotypisierung durch Polymerase-Kettenreaktion) übertragen der Dottersack in ein steriles Röhrchen durch Absaugen mit ~ 5 µL PBS in einer großen Öffnung 200 µL Pipettenspitze. Shop bei-20 ° C.
Hinweis: Mütterlichen Gewebe (d.h. der parietalen Dottersack einschließlich Reicherts Membran und die Ectoplacental Kegel), die die Dottersack Zubereitung verunreinigen kann kann zu fehlerhaften Genotypisierung Ergebnissen führen. Entfernung von diesen Geweben ist am einfachsten vor dem Embryo Dissektion aus dem Dottersack.
4. Allantois Dissektion und Ex Utero Kultur auf immobilisierte α4β1 Integrin
- Schneiden Sie die Allantois aus der basalen Insertionsstelle am hinteren Ende des Embryos mit feinen Pinzette (Abbildung 1 H).
- Optional, wenn Entwicklungsstörungen Inszenierung erforderlich ist, zählen Sie die Somiten Paare des Embryos durch Sichtkontrolle unter Verwendung eines Mikroskops mit Phase Kontrast-Optik und eine 5 × 10 × Ziel ausgestattet.
Hinweis: Der Embryo kann mit der Pinzette Somiten zählen zu erleichtern erweitert werden. Chorioallantoic Anlage und Fusion auftreten zwischen E 8.0 und 9.0 E in Embryonen mit ≥ 6 Somiten Paaren. Drehen beginnt beim Embryo mit 6-8 Somiten Paaren. - Pipette 40 µL/Well des DMEM mit 10 % (V/V) fötalen Rinderserum, L-Glutamin und Antibiotika in der erforderlichen Anzahl von vorbeschichteten Mikrotiter Platte Brunnen (siehe Abschnitt 1) ergänzt.
- Sammeln Sie die schwimmenden Allantois durch Absaugen mit ~ 5 µL PBS in einer großen Öffnung von einer Pipettenspitze 200 µL. 1 Allantois/gut zu übertragen.
- Inkubieren Sie die Allantoides indem man die Mikrotiter-Platten in einem befeuchteten Gewebekultur-Inkubator (37 ° C, 5 % CO2) für z.B.6, 12 und 24 h. Zur Vermeidung von Interferenzen mit Allantois Anlage bewegen Sie Mikrotiter-Platten zwischen diesen Zeitpunkten nicht.
- Zu jedem Zeitpunkt der Gäste Allantois Anlage (z.B., keine Anlage/floating Allantois teilweise oder vollständig angehängte Allantois; voll Ausbreitung Allantois) unter Verwendung eines Mikroskops mit Phase Kontrast oder Differential Interferenz-Kontrast-Optik ausgestattet und ein 5 × oder 10 × Ziel (Abbildung 2).
Hinweis: Repräsentative Beispiele für frisch isolierte und vollständig angehängte Allantoides sind in Abbildung 2gezeigt. Ex Utero, misst der distalen Spitze Allantoides vom Wildtyp C57BL/6J Mäusen isoliert innerhalb von 4-6 Stunden (Dies wird bezeichnet als partielle Befestigung der Allantois) und vollständige Befestigung des gesamten Allantois erfolgt innerhalb von ~ 12 h von Kultur. Von 18-24 Uhr hat der modellabhängigen abgeflacht und übernahm eine Kreisform (voll Allantois Spread bezeichnet) mit einem CD31-positiven vaskulären Plexus9,16.
5. Bestätigung Färbung der explantierten Allantois für die Endothelzellen Markers CD31
- Aspirieren Sie das Kulturmedium voll Ausbreitung Explantaten und beheben Sie die Zellen durch Zugabe von 40 µL/Well von 4 % (w/V) Paraformaldehyd/PBS zu.
Hinweis: Paraformaldehyd ist giftig. Tragen Sie Handschuhe und Schutzbrille zu Haut- und Augenkontakt vermeiden. - 10 min bei RT inkubieren Sie, dann aspirieren Sie überstand. Waschen Sie dreimal durch Zugabe von 40 µL/Well des PBS, und entfernen Sie das Waschmedium durch sanfte Saugwirkung.
- Permeabilize der Zellen und unspezifischen Bindungsstellen durch Zugabe von 40 µL/Well von 0,1 % (V/V) Triton X-100/0.1% (w/V) BSA/10% (V/V) normalem Ziegenserum mit PBS-Puffer für 30 min bei RT. Wash zweimal durch Zugabe von 40 µL/Well des PBS zu blockieren und entfernen das Waschmedium durch sanfte Saugwirkung.
Hinweis: Das Protokoll kann über Nacht an dieser Stelle angehalten werden. - Beflecken Sie Zellen durch Zugabe von 20 µL/Well des primären Anti-CD31 Antikörper 01:50 in 0,1 % (w/V) BSA/PBS verdünnt über Nacht bei 4 ° C. Waschen Sie dreimal durch Zugabe von 40 µL/Well des PBS, und entfernen Sie das Waschmedium durch sanfte Saugwirkung.
- Gebundenen primären Antikörper durch Zugabe von 20 µL/Well Eindringmittel beschriftet sekundäre Ziege Antikörper Anti-Ratte verdünnt 1: 200 in 0,1 % (w/V) BSA/PBS für 1 h bei RT. Protect Mikrotiter-Platten aus Licht indem einwickeln in Alufolie oder in einer dunklen Kammer zu erkennen. Waschen Sie dreimal durch Zugabe von 40 µL/Well des PBS, und entfernen Sie das Waschmedium durch sanfte Saugwirkung.
- Betten Sie Zellen durch Zugabe von 20 µL/Well Eindeckmedium ein. Inkubieren ~ 1 h bei RT bis das Eindeckmittel erstarrt ist. Bewahren Sie Mikrotiter-Platten bei RT oder bei 4 ° C, vor Licht geschützt auf.
- Bild der vaskulären Plexus der Allantois explants unter dem Fluoreszenzmikroskop mit einer 5 × oder 10 × Ziel und geeignete Fluoreszenz-Filter ausgestattet.
Hinweis: Repräsentative Bilder der CD31-positiven vaskulären Plexus der voll Ausbreitung Allantois sind in Abbildung 3gezeigt. Andere Marker für den vaskulären Plexus, z. B. Antikörper gegen Flk-1, Flt, Tie-1 oder Tie-2 kann als gut16verwendet werden.
Ergebnisse
Dieses Protokoll beschreibt eine Methode zum isolieren und explant murinen Allantoides ex Vivound details die qualitative Bewertung der Allantois Bindung an α4β1 Integrin, ein kritischer Prozess bei der in Vivo chorioallantoic Fusion. Die repräsentativen Ergebnisse in Abbildung 1A–H zeigen die aufeinander folgenden Schritte der Allantois Isolation der schwangeren Gebärmutter ab. Mütterlichen Gewebe, die die Gebärmutter Hörner, wie Fettgewebe und Schiffe (Abbildung 1A) umgeben werden entfernt, und Embryonen sind von der Gebärmutterschleimhaut in einer schrittweisen Mode nach Öffnung der Gebärmutter-Muskelschicht (Abbildung 1 b- seziert E). Anschließend werden andere mütterlichen Gewebe wie der parietalen Dottersack und der Ectoplacental Kegel entfernt (Abbildung 1E, F). Abbildung 1 - H zeigt, dass die Technik das Sezieren von den extraembryonic Allantois Weg von dem Dottersack, ein weiterer extraembryonic und stark vaskularisierte Gewebe umfasst. Allantoides isoliert nach diesem Protokoll sind weitgehend frei von kontaminierenden mütterlichen oder (extra) embryonalen Gewebe als die Allantois.
Abbildung 2 zeigt, dass die Größe und Form der Allantoides aus frisch seziert Embryonen in einem einzigen Wurf14erheblich variieren können. Allantoides C57BL/6J Wildtyp Embryonen bei E 8.5 seziert hatte eine längliche Morphologie in 74 % der Fälle (45 von 61 untersuchten Embryonen), wie in Abbildung 2 und Abbildung 1 Hgezeigt. 15 % (9/61) der Embryonen, die Allantoides waren deutlich kleiner und mehr gerundet (siehe Referenz14) und 11 % (7/61) des Embryos nicht noch bildeten eine sichtbare Allantois bei der Präparation. Trotz der heterogenen Formen und Größen ab Zeitpunkt der Allantois explant Kultur (Abbildung 2, Platten ein–h), Allantois Anlage und vollständige Verbreitung auf immobilisierte α4β1 Integrin beobachtet wurde, innerhalb von 12 h in allen von den 54 frisch isolierte Allantoides seziert von Embryonen von sieben Würfe. Dennoch waren die Formen und Größen der Explantate nach 12 h Kultur etwas heterogene (Abbildung 2), reflektiert die verschiedenen Viruswenig Morphologien am Startpunkt des Assays.
Abbildung 3 zeigt eine Immunocytochemical Färbung für CD31-positiven Endothelzellen in vollständig angehängte Allantoides nach 24 h Explant Kultur, die bestätigt, dass die Explantaten vaskulären Plexus von diesem Zeitpunkt, als erwarteten9 ausgearbeitet hatte , 16. so anhaftende Allantois-Kulturen können verwendet werden, um Blutgefäß Bildung in-vitro-9zu studieren. Daher veröffentlicht die vorgestellte Methodik Erträge Allantois Explantaten, die sich leicht kultivierten ex Vivo, in Absprache mit zuvor lassen experimentelle Studien9,16.
Das Protokoll legt den Rahmen für die Mikroskopie-Beurteilung der Allantois Anlage zu vorgegebenen Zeitpunkten, wie z. B. nach 12 h oder 24 h Explant Kultur. Die Ergebnisse können auf qualitative Weise (partielle/vollständige Anlage oder voll zu verbreiten, zu einem bestimmten Zeitpunkt – ja/nein) ausgewertet werden. Da die gleichen Explant wiederholt visualisiert und erzielt werden kann, spiegelt diese Analyse, dass die Merkmale der einzelnen Allantois explant Kulturen im Laufe der Zeit. Darüber hinaus kann die Bildung von vaskulären Plexus in festen und gefärbten Explantaten sein (Abbildung 3) bewertet.

Abbildung 1: Vertreter Schritte in Allantois Dissektion. (A) Detailansicht einer isolierten uterine Horn. Gebärmutter Knospen, die Embryonen enthalten sind durch Sterne gekennzeichnet; Fettgewebe und Schiffe rund um die Gebärmutter Horn werden auf der linken Seite gesehen. (B) Ansicht von der Dezidua (Endometrium) nach Entfernung der Muskelschicht der Gebärmutter. Die stark vaskularisierte Mesometrial Pol von der Decidua orientiert sich an der linken Seite, das Anti-Mesometrial Teil (mit einem Stern gekennzeichnet), die den Embryo enthält orientiert sich an der rechten Seite. (C) Seitenansicht des Pfostens seziert Anti-Mesometrial von der Dezidua (mit einem Stern gekennzeichnet). Der Pfeil zeigt die Lage des Embryos. (D) Draufsicht des Conceptus (Pfeil) umgeben von den parietalen Dottersack nach Teilentfernung des umliegenden Decidua. (E, F) Repräsentative Ansichten von weiteren Schritten in die Dissektion des Embryos (Pfeil). Die Pfeilspitze zeigt dem Dottersack. (E) ist der Ectoplacental Kegel (Epc) auf der rechten Seite sichtbar. (G) teilweise Dissektion des Embryos (Pfeil) aus dem Dottersack (Pfeilspitzen). Die Allantois ist mit einem roten Stern gekennzeichnet. (H) isolierte Embryo (Pfeil) mit Allantois (roter Stern). Die Position, wo die Allantois am hinteren Ende des Embryos aus der basalen Insertionsstelle geschnitten wird, ist mit einer roten gestrichelten Linie angezeigt. Bilder wurden auf einem Stereomikroskop mit einem Zoombereich von 8:1. Alle Maßstabsleisten sind 1 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
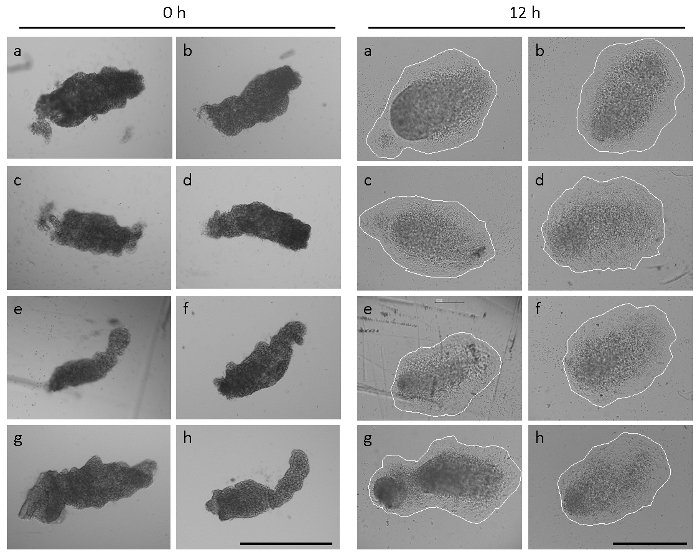
Abbildung 2: heterogene Formen und Größen der Allantoides. Acht Allantoides (ein–h) wurden isoliert von Embryonen von einem einzigen Wurf. Links Panel, Allantoides unmittelbar nach Dissektion (0 h). Rechten Seite, die gleiche Allantoides nach 12 h Explant Kultur. Der Explantate sind fest angebracht und mesenchymale Zellen verbreitet haben. Der Explantate sind eingekreist um Explant Größen zu visualisieren. Bilder wurden auf einem Mikroskop mit Phase Kontrast-Optik und eine 5 × (linken) oder ein 10 × Ziel (Rechts) ausgestattet. Alle Maßstabsleisten sind 500 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: vaskulären Plexus Bildung in Allantois Explant Kulturen. Allantoides wurden seziert und explantiert auf immobilisierte α4β1 Integrin wie in diesem Protokoll beschrieben. Explantate wurden für 24 Stunden kultiviert, und Endothelzellen in der vaskulären Plexus waren voller Flecken, mit Anti-CD31 Primärantikörper und Gewebekulturen Sekundärantikörper beschriftet. Endotheliale Zellen werden in grün angezeigt. Das obere Bild zeigt die gesamte vaskulären Plexus im zentralen Bereich von einer repräsentativen Allantois Explant. Das Bild wurde am Mikroskop ausgestattet mit Fluoreszenz-Optik und ein 5 × Ziel aufgenommen. Maßstabsleiste, 500 µm. Die zwei unteren Platten sind Bilder mit höherer Vergrößerung von einem anderen Allantois Explant seziert und unter den gleichen Bedingungen kultiviert. Schiff-wie Strukturen und einzelnen Endothelzellen zu sehen. Bilder wurden auf einem confocal Mikroskop; Skalieren Sie Bars, 25 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
In Anwesenheit von Serum, das ist eine reiche Quelle von pro-Kleber extrazelluläre Matrix Moleküle wie Fibronektin, werden Allantois Explantaten leicht verschiedenen Kunststoff, Glas oder Filter Oberflächen9,16beimessen. Deshalb wenn der durchgeführten Test speziell die Auswirkung einer genetischen Veränderung zu untersuchen soll oder eine andere Behandlung auf Allantois Bindung an α4β1 immobilisiert, kritische, unspezifischen Bindungsstellen (z. B.mit Rinderserum blockieren Albumin) nach der Beschichtung der Oberflächen mit Integrin und vor der Inkubation mit Serum-haltigen Medien.
Die erste Befestigung des Allantois Explantaten an immobilisierte α4β1 Integrin reagiert sehr empfindlich auf Bewegung und Gewebekultur Platten sollte daher bleiben ungestört einen vorher festgelegten Zeitraum (z.B.für 12 h) vor scoring allantois Anlage. Beachten Sie, dass der Zeitaufwand für stabile Kontakt je nach der analysierten Maus-Stamm oder die Konzentration der immobilisierten α4β1 Integrin Bildung mit dem Substrat variieren.
Die Anforderung der interzellulären VCAM-1/α4β1-Interaktion für erfolgreiche chorioallantoic Fusion ist fest etablierten11,12,13. Darüber hinaus können extrazelluläre Matrix Moleküle wie Fibronektin, kollagene und andere Moleküle des Interesses auch immobilisiert und als "Chorio-mimetischen" Substrate verwendet.
Chorioallantoic Anlage ist abhängig von der interzellulären Interaktion zwischen VCAM-1 und seine verbindliche Partner Integrin α4β1. In Utero, chorioallantoic Anlage und anschließende Fusion können nur auftreten, wenn die Allantois hinreichend ausgedehnt hat, machen Kontakt mit dem Chorion. Da die physiologische Variabilität in Allantois Größen in einem bestimmten Entwicklungsstadium, chorioallantoic Anlage und Fusion findet irgendwann zwischen E 8.0 und 9.0 E (Bereich E 7,5-E 9,25)14,16. Methoden, um speziell der transiente Prozess der Allantois Bindung an das Chorion Platte in Utero in lebenden Maus sind nicht leicht zugänglich in der Studie präsentieren. Vielmehr Analysen sind meist auf die aufwändige Ermittlung der chorioallantoic Fusion durch histologische Beurteilung z. B.konzentriert, Viruswenig Verbreitung auf der Oberfläche das Chorion und die Entwicklung der Labyrinth-Schicht an einer einzigen vorbestimmt Zeit Punkt11,12,13,16. Dieser Endpunktanalyse kann nicht unterscheiden zwischen Mängel, die speziell aufgrund eingeschränkter Befestigung von der Allantois Chorion und Chorion-abhängige Effekte und ist begrenzt durch die inhärente Variabilität im Embryo Entwicklungsstadien und Viruswenig Größen. Wie unter Vertreter Ergebnissebesprochen, die physiologische Variabilität in Allantois Größen unter Umständen eine relative Verzögerung chorioallantoic Fusion in ~ 26 % der C57BL/6J Wildtyp Embryonen. Statistisch gesehen, hätte fast zwei von sieben schwangeren Mäusen geopferten zu früh (61 Embryonen aus sieben Würfen, durchschnittlichen Wurfgröße 8,7), daher die übersetzt in die Notwendigkeit einer erheblichen Zucht überschüssige für größere Studien. Interessanterweise haben mikrochirurgische Experimente ergaben, dass die Chorion bereits zu verschmelzen mit der Allantois zum Zeitpunkt 1 Somiten paar zuständig ist und die Allantois maximale Fusion Kapazität bei Embryonen mit 3-5 Somiten Paare14Exponate. Daher sind Chorioadhesive Zellen der Allantois geformt und funktionell zuständigen vor die eigentliche chorioallantoic Anlage in Vivo. Die ex Utero -Analyse der Allantois Bindung an immobilisierten Liganden, ist wie hier dargestellt daher relativ unabhängig von einer bestimmten Allantois Größe. Ein Vorteil dieser Methode ist daher, dass es Mängel in Allantois Dehnung umgeht, und konzentriert sich auf den nächsten Schritt in der Plazenta Bildung, d. h., Chorioallantois Anlage. Dieser Ansatz kann somit verwendet werden, Mängel in Allantois Dehnung und Chorioallantois Anlage in genetischen Maus-Mutanten zu unterscheiden.
Im Gegensatz zu der traditionellen Methode der Allantois Aspiration von seinen Befestigungspunkt für den Embryo mit einem Mund Pipette16das aktuelle Protokoll verwendet einen manuellen Schneiden-Ansatz und die Allantois erfolgt anschließend mit großer Öffnung Pipettenspitzen . Ein wichtiger Vorteil der Allantois Bestreben ist, dass diese Methode direkte Gewebe Handhabung vermeidet. Schneiden und bearbeiten die Allantois beschädigen die Chorioadhesive Zellen in den Außenmantel aus Viruswenig Mesothel. Trotzdem schneiden die Allantois mit Zange bereits erfolgreich verwendet wurde in ex Vivo Kulturen von pre-placental Gewebe17und die Kinetik der Viruswenig Explant Anlage und die Morphologie der modellabhängigen Kulturen beschrieben der vorliegenden Studie sind vergleichbar mit veröffentlichten Daten basierend auf Allantois Isolierung von Aspiration16. Diese Ergebnisse legen nahe, dass Chorioadhesive Zellen sind ausreichend gut auf manuellen Schneiden von der Allantois erhalten, und dass Explant Differenzierung nicht grob gestört ist, wie durch die Bildung von CD31-Positive Gefäßendothelien. Direktes schneiden auch von der Allantois bietet die Möglichkeit, nur die oberen zwei Drittel der Allantois sezieren, die VCAM-113ausdrücken, und es sorgt für weniger Kontamination mit Dottersack-abgeleitete Zellen, die möglicherweise von der Basis der getrimmt werden müssen die Allantois nach Allantois streben18.
Ex Utero Analyse der Viruswenig Explant Adhäsion immobilisiert, rekombinante α4β1 Integrin liefert eine qualitative Auslesen der eine wichtige, erste Schritt, der für chorioallantoic Fusion, d.h., die interzelluläre Wechselwirkungen erforderlich ist zwischen VCAM-1 ausgedrückt auf die Allantois und α4β1 Integrin lokalisiert das Chorion Mesothel, die extraembryonic Mesoderm abgeleitet ist. Dennoch, obwohl diese beiden Adhäsionsmoleküle als Prinzip Spieler chorioallantoic Fusion anerkannt sind ~ 50 % der Embryonen mit homozygoter Ko-Mutationen im VCAM-1 oder α4-Integrin chorioallantoic Fusion in Vivo11 unterziehen ,12,13. Wegen dieser unvollständiger Penetranz möglicherweise in diesem Protokoll beschriebene ex-Vivo -Verfahren nicht ausreichen, um eine Anforderung für diese zwei Adhäsionsmoleküle in genetische Modelle mit einem Ausfall der chorioallantoic Fusion auszuschließen.
Unter physiologischen Bedingungen α4β1 Integrine in der Plasmamembran von Chorion Trophoblasten eingebettet sind, und fließen in ein komplexes Netzwerk von Struktur- und Signalisierung Proteine, die zusammenarbeiten, um die Zell-Zell (und Zelle-Matrix) Haftung zu regulieren 19. wie mit den meisten reduktionistischen in-vitro- Ansätze, die Komplexität der Chorion VCAM-1 verbindliche Schnittstelle nur in sehr begrenztem Umfang immobilisierten α4β1 Integrin modelliert wird. Neben der möglichen Mangel an andere wichtige strukturelle oder Signalisierung Impulse abgeleitet aus der intakten Chorion in diesem System ist es wahrscheinlich, dass nur ein Bruchteil der Integrine, die auf eine starre, zweidimensionale Oberfläche immobilisiert sind vorhanden in den aktiven sind, Bindung-kompetente, "offene" Konformation.
Die vorgestellte Methode nähert sich der frühen Bindung und Verbreitung der Schritt von der Allantois, das Chorion, und kann auch Bericht über die Entwicklung der Viruswenig vaskulären Plexus in Kombination mit der Analyse des Schiffes Bildung9. Jedoch das derzeitige Konzept die Invasion der Chorion nicht modellieren, indem Angiogenese vermittelt durch Viruswenig Endothelzellen sprießen, noch spiegelt es verzweigte Morphogenese von Chorion, das ist ein wesentlicher Prozess für chorioallantoic Fusion und die weitere Entwicklung der Plazenta Labyrinth10.
Mit Phasenkontrast oder differential Interferenz Mikroskopie in Kombination mit (halb-) automatisierte Bildanalyse, die vorgestellte Methode angewandt werden, bei größeren Bildschirmen für die erste Analyse der verspätete oder fehlerhafte Viruswenig Anlage in Vitro. Neben der Analyse der Maus-Mutanten kann die Methode für die Auswirkungen von Drogen, Krankheitserreger, Metaboliten oder Umweltfaktoren auf Viruswenig Anlage Bildschirm von Interesse sein.
In zahlreichen Maus-Mutanten schlägt chorioallantoic Anlage auftreten, obwohl der Allantois und der Chorion scheinen normal entwickelt haben. Darüber hinaus zeigen Mutanten, die in der Regel chorioallantoic Anlage Mängel zeigen unvollständiger Penetranz1,2,10. Es werden wichtig zu untersuchen, ob diese funktional anscheinend sehr unterschiedliche Gene gemeinsame molekulare Signalwege und/oder zelluläre Prozesse auswirken. Live Darstellung der Allantois Explantaten abgeleitet von Maus-Mutanten hat das Potenzial, diese Mechanismen aufzuklären. Z. B. Zellen in den Außenmantel aus seziert Allantois mit vital fluoreszierende Farbstoffe (z. B. DiI oder DiO lipophilen Carbocyanine Tracer16,18) Bild gekennzeichnet werden könnte Adhäsion und Veranstaltungen, zu verbreiten oder Handy verfolgen Migration in Echtzeit. Darüber hinaus könnte fluoreszierende Reporter, die das Zellskelett oder Adhäsion Proteine visualisieren informativ sein.
Vor kurzem, eine ex-Vivo Kokulturen-System für Pre-Anlage murinen Allantoides und Chorions ist beschrieben worden, und dieser Ansatz wurde erfolgreich verwendet, um Ereignisse zu untersuchen, die nach chorioallantoic Anlage, z. B. Labyrinth Schicht auftreten Bildung17. Die Analyse der Allantois Anlage Effizienz auf immobilisierte Chorions aus verschiedenen (z.B.gentechnisch veränderte) isoliert Mausmodellen können liefern neue Erkenntnisse über die molekularen Spieler und Wege, die ersten Schritte in der Entwicklung von Regeln die murine Plazenta.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde durch die Deutsche Forschungsgemeinschaft SFB688 (, A.G.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| C57BL/6J wildtype mice | The Jackson Laboratory | Stock No: 000664 | |
| 70 % (v/v) Ethanol | VWR International | 930031006 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | Forceps used to open the abdominal cavity. |
| Micro dissecting forceps | Fine Science Tools | 11254-20 | Dumont # 5 medical biology forcepts with fine, sharp tip. |
| Fine scissors | Fine Science Tools | 14094-11 | Straight blades. |
| Spring scissors | Fine Science Tools | 15012-12 | Noyes spring scissors with 14 mm blades for the dissection of uterus buds. |
| Microspoon | Carl Roth | AT18.1 | 5 mm Spoon diameter. |
| Microtiter plates | ibidi | 81501 | We use uncoated, sterile angiogenesis slides (internal volume 50 µL) with a hydrophobic surface that is not tissue-culture treated to reduce non-α4β1-mediated binding to plastic. |
| 10 cm dish | Nunc | 150350 | Sterile tissue culture dishes. |
| 3.5 cm dish | Nunc | 150288 | Sterile tissue culture dishes. |
| Large orifice pipette tips | Biozym | VT0140X | Low binding pipette tips, 200 µL. |
| α4β1 integrin | R&D Systems | 6054-A4 | Murine α4β1 integrin recombinantly expressed and purified from a Chinese hamster ovary cell line. |
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma Aldrich | D8537 | Without Ca2+ and Mg2+. |
| Dulbecco’s Modified Eagle Medium (DMEM) | PAN Biotech | P04-03600 | The formulation contains 4.5 g/L glucose, 110 mg/L sodium pyruvate and 3.7 g/L NaHCO3 but no L-glutamine, which is added separately. |
| Penicillin/Streptomycin | Gibco (ThermoFisher Scientific) | 15140-122 | 100 x (10,000 U/mL Penicillin and 10,000 µg/mL streptomycin) stock solution. Prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| L-Glutamine | PAN Biotech | P04-80100 | 100 x (200 mM) Stock solution. Prepare and store aliquots at -20 °C to avoid freeze/thaw. |
| Fetal bovine serum | Biochrom | S 0115 | We use heat-inactivated FBS (heated to 56 °C for 30 min with mixing to inactivate complement). |
| Bovine serum albumin (BSA) | Sigma Aldrich | A7030 | We use protease- and fatty acid-free albumin. Prepare a 0.1 % (w/v) solution in DMEM. Sterile filter the solution through a disposable cell culture filter with a 0.22 µm pore size and low protein-binding membrane, and store aliquots at -20 °C. |
| para-Formaldehyde | Carl Roth | 0335.2 | To make a formaldehyde solution in PBS, weigh para-formaldehyde powder in a ventilated hood, and add it to PBS preheated to ca. 60 °C in a beaker on a stir plate. Add 1 N NaOH dropwise until solution clears. Let solution cool to room temperature, and filter through 0.22 mm filter syringe. Adjust pH with diluted HCl to ca. 6.9, and adjust to final volume with PBS. We aliquot and freeze the solution, but it can also be stored at 4 °C for approximately four weeks. |
| Triton X-100 | Sigma Aldrich | X100 | Use wide-orifice pipette tips to handle undiluted Triton X-100. |
| Normal goat serum | Sigma Aldrich | G9023 | To block non-specific binding of antibodies in immunofluorescence analyses. |
| α-CD31 Antibodies | BD Biosciences | 550274 | Purified rat anti-mouse monoclonal antibodies, clone MEC 13.3. |
| Secondary goat anti-rat antibodies | Thermo Fisher | A-11006 | Goat anti-rat IgG (heavy and light chains), cross-adsorbed, fluorescently labeled with Alexa Fluor 488. Other fluorescent labels are also possible. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | Mounting medium for cytochemistry. MW ~31,000 |
| Labovert | Leitz | Labovert | Inverted phase contrast microscope equipped with a 4 x and 10 x objective for somite pair counting. Other phase contrast microscopes (such as those that are routinely used in tissue culture) are also suitable. |
| M80 | Leica Microsystems | M80 | Stereomicroscope with 8 : 1 zoom range (yielding a magnification between 7.5 x and 60 x) for embryo and allantois dissection. |
| DM4000B | Leica Microsystems | DM4000B | Microscope system for histology with LED illumination. We use HCX PL FLUOTAR 5 x/0.15 and HC PL FLUOTAR 10 x/0.30 objectives. Other microscopes equipped phase contrast and fluorescence optics can be used to score allantois attachment. |
| Digital camera | JVC | KY-F75U | 3-CCD digital capture camera attached to the DM4000B LED microscope. We use Diskus software (Hilgers) to operate both the microscope and the camera. |
| Confocal microscope | Leica Microsystems | SP5 | Confocal microscope for higher-resolution imaging of endothelia in the vascular plexus of allantois explants. Immunofluorescence images were taken with a 40 x objective. |
Referenzen
- Rossant, J., Cross, J. C. Placental development: lessons from mouse mutants. Nat Rev Genet. 2 (7), 538-548 (2001).
- Segerer, G., et al. An essential developmental function for murine phosphoglycolate phosphatase in safeguarding cell proliferation. Sci Rep. 6, 35160 (2016).
- Kane, S. V., Acquah, L. A. Placental transport of immunoglobulins: a clinical review for gastroenterologists who prescribe therapeutic monoclonal antibodies to women during conception and pregnancy. Am J Gastroenterol. 104 (1), 228-233 (2009).
- Xu, X., Vugmeyster, Y. Challenges and opportunities in absorption, distribution, metabolism, and excretion studies of therapeutic biologics. AAPS J. 14 (4), 781-791 (2012).
- Wesolowski, S. R., Kasmi, K. C., Jonscher, K. R., Friedman, J. E. Developmental origins of NAFLD: a womb with a clue. Nat Rev Gastroenterol Hepatol. 14 (2), 81-96 (2017).
- Racicot, K., Mor, G. Risks associated with viral infections during pregnancy. J Clin Invest. 127 (5), 1591-1599 (2017).
- Grandjean, P., et al. Life-Long Implications of Developmental Exposure to Environmental Stressors: New Perspectives. Endocrinology. 156 (10), 3408-3415 (2015).
- Inman, K. E., Downs, K. M. The murine allantois: emerging paradigms in development of the mammalian umbilical cord and its relation to the fetus. Genesis. 45 (5), 237-258 (2007).
- Arora, R., Papaioannou, V. E. The murine allantois: a model system for the study of blood vessel formation. Blood. 120 (13), 2562-2572 (2012).
- Watson, E. D., Cross, J. C. Development of structures and transport functions in the mouse placenta. Physiology (Bethesda). 20, 180-193 (2005).
- Yang, J. T., Rayburn, H., Hynes, R. O. Cell adhesion events mediated by alpha 4 integrins are essential in placental and cardiac development. Development. 121 (2), 549-560 (1995).
- Gurtner, G. C., et al. Targeted disruption of the murine VCAM1 gene: essential role of VCAM-1 in chorioallantoic fusion and placentation. Genes & development. 9 (1), 1-14 (1995).
- Kwee, L., et al. Defective development of the embryonic and extraembryonic circulatory systems in vascular cell adhesion molecule (VCAM-1) deficient mice. Development. 121 (2), 489-503 (1995).
- Downs, K. M., Gardner, R. L. An investigation into early placental ontogeny: allantoic attachment to the chorion is selective and developmentally regulated. Development. 121 (2), 407-416 (1995).
- Heyne, G. W., et al. A simple and reliable method for early pregnancy detection in inbred mice. J Am Assoc Lab Anim Sci. 54 (4), 368-371 (2015).
- Downs, K. M., Temkin, R., Gifford, S., McHugh, J. Study of the murine allantois by allantoic explants. Dev Biol. 233 (2), 347-364 (2001).
- Hou, W., Sarikaya, D. P., Jerome-Majewska, L. A. Ex vivo culture of pre-placental tissues reveals that the allantois is required for maintained expression of Gcm1 and Tpbpalpha. Placenta. 47, 12-23 (2016).
- Zeigler, B. M., et al. The allantois and chorion, when isolated before circulation or chorio-allantoic fusion, have hematopoietic potential. Development. 133 (21), 4183-4192 (2006).
- Zaidel-Bar, R., Itzkovitz, S., Ma'ayan, A., Iyengar, R., Geiger, B. Functional atlas of the integrin adhesome. Nature cell biology. 9 (8), 858-867 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten