Method Article
Автоматизированный анализ хемосенсорного предпочтения на основе нематод
В этой статье
Резюме
Мы представляем установку регистрации записи и протокол, который позволяет автоматизировать анализ нематод, предпочтение Caenorhabditis elegans для растворимых соединений в популяционном анализе. В этой статье описывается построение камеры поведения, протокола поведенческого анализа и использования программного обеспечения для анализа видео.
Аннотация
Нематода, компактная нервная система Caenorhabditis elegans , состоящая всего из 302 нейронов, лежит в основе разнообразного репертуара поведения. Для облегчения диссекции нейронных схем, лежащих в основе этих поведений, необходимо разработать надежные и воспроизводимые поведенческие анализы. Предыдущие исследования поведения C. elegans использовали вариации «теста на падение», «анализ хемотаксиса» и «анализ на удерживание» для исследования реакции C. elegans на растворимые соединения. Способ, описанный в этой статье, направлен на объединение дополнительных преимуществ трех вышеупомянутых анализов. Вкратце, маленький круг в середине каждой аналитической пластины делится на четыре квадранта с поочередно расположенными контрольными и экспериментальными решениями. После добавления червей аналитические пластины загружают в поведенческую камеру, где камеры микроскопа записывают встречи червей с обработанными областями. Затем автоматизированный видеоанализ выполняетсяИ генерируется значение индекса предпочтения (PI) для каждого видео. Возможности сбора видео и автоматического анализа этого метода минимизируют участие экспериментатора и любые связанные с ним ошибки. Кроме того, минимальное количество экспериментального соединения используется для каждого анализа, а установка с несколькими камерами поведенческой камеры увеличивает экспериментальную пропускную способность. Этот метод особенно полезен для проведения поведенческих экранов генетических мутантов и новых химических соединений. Однако этот метод не подходит для изучения навигации по градиенту стимула из-за непосредственной близости областей управления и экспериментального решения. Он также не должен использоваться, когда доступно лишь небольшое количество червей. Несмотря на то, что он подходит для анализа ответов только на растворимые соединения в его нынешней форме, этот метод можно легко модифицировать с учетом мультимодального сенсорного взаимодействия и оптико-генетических исследований. Этот метод также может быть адаптирован для анализа хемосенсорных реакций других видов нематод.
Введение
Кормящие животные должны интегрировать материалы из нескольких сенсорных модальностей и выбирать соответствующие стратегии поведения, чтобы успешно ориентироваться в своей среде. Понимание того, как внешние сенсорные входы принимаются и трансдуцируются в нейронную информацию для направления выбора действия, является центральной целью в области нейробиологии. Генетически поддающаяся нематодам C. elegans - привлекательный модельный организм, в котором изучаются нейронные механизмы, лежащие в основе сенсорной биологии и мультимодальной интеграции. Хотя C. elegans имеет только 302 нейрона, он может обнаруживать и различать широкий спектр экологических стимулов, включая растворимые соединения, летучие одоранты и температуру окружающей среды 1 , 2 , 3 , 4 , 5 , 6 , 7 .Нематод C. elegans в значительной степени полагается на свой хемосенсорный аппарат, чтобы локализовать источники пищи и предупреждать себя о потенциальных угрозах. Таким образом, поведенческие анализы, предназначенные для скрининга ответов дикого типа и мутантного C. elegans на химические раздражители, играют решающую роль в анализе генетических, клеточных и нервных механизмов, связанных с замечательными сенсорными способностями C. elegans .
Для анализа реакции на растворимые соединения были описаны три типа анализов - тест на падение, анализ хемотаксиса и анализ на удерживание. В тесте на каплю небольшая капля соединения помещается в хвост движущегося червя, и решение червя перевернуть или продвинуться вперед, когда жидкость достигнет передней сенсорной аппаратуры, оценивается 4 . Тест на падение требует небольшой экспериментальной подготовки и полезен, когда размер образцов червей мал, как в случае с лазерными червями. Однако, поскольку только один червьМогут быть проанализированы одновременно, и экспериментатор должен присутствовать на протяжении всего анализа, тест на падение может занять много времени. Тест на падение также уязвим для изменений в доставке капель между каждым червем в образце, что может влиять на общие результаты анализа. Другим ограничением теста на падение является то, что его можно использовать только для анализа реакции червя на аверсивные соединения, поскольку невозможно отличить привлекательный или нейтральный эффект соединения от движения вперед червя.
Анализ хемотаксиса на растворимые соединения обычно включает разделение пластины агара на четыре квадранта, при этом экспериментальный раствор смешивают с агаром из двух противоположных квадрантов, а контрольный раствор смешивают в двух других квадрантах 8 , 9 . В начале анализа в центре пластины помещается капля буфера с червями, а количество червей в Каждый квадрант оценивается в разные моменты времени. Анализ хемотаксиса обеспечивает большую статистическую мощность по сравнению с тестом на падение, поскольку большое количество червей тестируется в каждом анализе. Однако одним ограничением этого метода является то, что для приготовления пластинок для анализа хемотаксиса требуются большие количества экспериментального соединения. Это затруднит проведение крупномасштабных экранов поведения, если для получения интересующего соединения требуется сложный процесс очистки с ограниченными выходами, как в случае сигнальных молекул аскаросидов 10 . Кроме того, ручной подсчет червей во всем анализе подвержен ошибкам, и возмущение пластин во время процесса подсчета может повлиять на результаты.
В отличие от двух вышеупомянутых методов анализ удерживания использует машинное зрение, которое минимизирует ошибку во время процесса подсчета очков и уменьшает интерференцию экспериментатора во время анализа > 11. Компьютеризированный анализ видеозаписей поведения червя также может потенциально выявлять более тонкую поведенческую динамику, которая будет пропущена, когда подсчет очков будет выполняться только в несколько отдельных временных периодов. В анализе удержания на противоположных сторонах небольшого кругового бактериального пищевого патча добавляются пятна двух растворов с последующим размещением небольшого количества червей в середине пищевого пятна. Затем поведение червей записывается, анализируется и значение индекса предпочтения рассчитывается на основе общего количества пикселей червя в каждой области решения. Хотя наличие привлекательного паттерна для пищи позволяет использовать меньшие популяции червей в каждом анализе, ранее было показано, что пища проявляет склонность избегать поведения к растворимым репеллентам 12 . Кроме того, черви проявляют светоподобный отклик на коротковолновый свет и использование источников света микроскопа, излучающих белый свет при установке записи по поведению, может повлиять на поведениеS = "xref"> 13.
Цель метода, обсуждаемого в этой статье, - записать и проанализировать предпочтение C. elegans для растворимых соединений с использованием популяционного анализа. С этой целью текущий метод интегрирует и улучшает аспекты из всех трех ранее обсуждавшихся методов. Это позволяет тестировать большие популяции червей, и для каждого анализа требуется только небольшое количество экспериментального раствора. Кроме того, анализ проводится в специально построенной закрытой поведенческой камере с инфракрасной светодиодной подсветкой для минимизации влияния коротковолнового света на поведение. Каждая камера также может быть оснащена несколькими камерами микроскопа, что увеличивает экспериментальную пропускную способность без ущерба для пространства для стенда. Наконец, программное обеспечение для анализа видео выводит значение индекса предпочтения для каждого видео, а также график сопровождающего червя, чтобы визуализировать динамику популяционного поведения с течением времени. Настройка камеры иПротокол ssay может быть дополнительно модифицирован для изучения мультимодальных реакций поведения, таких как влияние одорантов или температуры на хемосенсорное поведение.
В этой статье описывается конструкция камеры поведения и протокола анализа. Он также демонстрирует полезность этого метода при анализе реакции червей дикого типа и хемосенсорных дефектных мутантов на известный растворимый репеллент, ионы меди 4 . Наконец, подробный анализ процесса видеоанализа с использованием предоставленного программного обеспечения.
протокол
1. Собрание поведенческой палаты
ПРИМЕЧАНИЕ. Кабина поведения состоит из приблизительно кубической рамы из экструдированных алюминиевых стержней, покрытых непрозрачными тканевыми покрытиями, с прозрачным акриловым днищем и опорами камеры. Соединения между прессованными алюминиевыми брусками, образующими поведенческую камеру, все перпендикулярны и закреплены с помощью «L» -образных угловых кронштейнов (шириной 1 дюйм с 1-дюймовыми ножками), которые фиксируют одну угловую стойку к каждому стержню с помощью винтов и вставки Т-гайки. Каждое соединение закреплено либо одним, либо двумя угловыми скобками, как описано ниже. Тканевые покрытия над камерой прикрепляются к алюминиевым каркасам с одинаковыми винтами и вставными Т-образными гайками, но через прокладки в углах ткани. Винты правильно вставлены в потайную сторону вставных Т-образных гаек, а не в сторону с выступающей губой. При креплении крепежного элемента винта / T-гайки к алюминиевому стержню сдвиньте Т-образную гайку в каналНа соответствующей поверхности стержня с головкой винта, торчащей из паза.
- Подготовьте тканевые покрытия.
- Используйте ножницы, чтобы вырезать пять кусков непрозрачной полиэфирной ткани для покрытия верхней и четырех сторон камеры.
- Вырезать один квадрат 14 x 14 дюймов 2 листа ткани для верхней части камеры. Вырезать четыре прямоугольных 11 x 14 дюймов 2 листа ткани для сторон камеры.
- Установите прокладки в углах листов ткани.
- Отметьте контрольную линию на 0,5 дюйма от каждого края всех пяти листов из полиэфирной ткани, используя карандаш и линейку.
- Для четырех прямоугольных листов используйте плоскогубцы для втулки, чтобы вставить втулки с центрированием, где линии карандаша пересекаются в каждом углу (то есть 4 прокладки на лист).
- Для квадратного листа вставьте два прокладки вдоль каждого края с каждой втулкой, центрированной на линии карандаша, и расположите на расстоянии 1,5 дюйма от конца каждого изЧетыре линии карандаша (т. Е. Всего 8 проводов, два возле каждого угла).
- Вставьте винт в каждое отверстие для втулки и свободно приложите к каждой из них гайку.
- Используйте ножницы, чтобы вырезать пять кусков непрозрачной полиэфирной ткани для покрытия верхней и четырех сторон камеры.
- Изготовить стойки крепления камеры.
- Используйте ленточную пилу или ее эквивалент, чтобы вырезать один алюминиевый экструзионный стержень длиной 2 дюйма для каждой камеры, гарантируя, что отрезанный конец стержня перпендикулярен к длине стержня, чтобы облегчить последующую сборку.
- Используйте сверлильный пресс с сверлом диаметром 0,25 дюйма, чтобы просверлить отверстие через центральные перемычки каждой панели крепления камеры, на 0,75 дюйма от одного конца, чтобы отверстие было перпендикулярно верхней и нижней граням и проходило через осевую линию штанги , При желании просверлите отверстие с помощью ручного электрического сверла с сверлом диаметром 0,25 дюйма, но убедитесь, что отверстие перпендикулярно верхней и нижней частям стержня.
- Подготовьте все угловые скобки.
- Вставьте винт через отверстие вКаждая ножка углового кронштейна, вставляя винт со стороны внутреннего угла. Навинтите на каждый винт T-образную гайку.
- Подготовьте узел крепления камеры ( рисунок 1B , уровень 2).
ПРИМЕЧАНИЕ. Монтажный узел камеры представляет собой «H» -образный узел, который поддерживает три кобуры камеры.- Прикрепите стержни крепления камеры к центральной панели крепления камеры.
- Выложите три монтажные панели камеры, изготовленные на шаге 1.2, с просверленными отверстиями, ориентированными вертикально. Сдвиньте два угловых кронштейна на боковые стороны каждого крепежного стержня на крайнее расстояние от просверленного отверстия.
- Расположите угловые кронштейны с ногами кронштейнов заподлицо с концом стержня и затяните винты, чтобы зафиксировать их на месте. Это формирует форму «Т» с просверленным отверстием в нижней части «Т».
- Положите алюминиевую экструзию толщиной 1 фута на рабочую поверхность. Сдвиньте T-образные гайки одной панели крепления камерыMbly (с предыдущего шага) на одну сторону 1-футового бара. Центрируйте монтажный стержень вдоль длины 1 фута и затяните винты, чтобы зафиксировать их. Сдвиньте два других крепежных стержня на противоположную сторону 1-футовой стойки.
- Расположите два стержня на одинаковом расстоянии от середины 1-футового бара, а их внутренние угловые кронштейны расположены примерно на 2,5 дюйма друг от друга. Скользящие угловые кронштейны по бокам 1-футового стержня, по два на каждом конце стержня. Расположите угловые кронштейны с опорами кронштейнов заподлицо с концами стержня и затяните винты, чтобы зафиксировать их на месте.
- Прикрепите концевые стержни к центральной панели.
- Слейте две алюминиевые профили толщиной 1 фута на T-образные гайки на каждом конце сборки с предыдущего шага, образуя форму «H». Центрируйте каждую концевую планку на центральной панели и закрепите, затянув четыре винта.
- Сместите четыре угловых кронштейна на верхнюю часть двух концевых стержней, добавленных на предыдущем шаге, по одному на каждом концеКаждого бара. Расположите угловые кронштейны с опорами кронштейнов заподлицо с концами стержней и затяните винты, чтобы зафиксировать их на месте.
- Прикрепите стойки и кобуры к корпусу камеры.
- Для каждой из трех подставок для микроскопа снимите чехол камеры, ослабив винт с накатанной головкой и соскользнув с подставки.
- Для каждой стойки крепления камеры (теперь прикрепленной к центральной панели «H») поместите одну шайбу на винт с круглой головкой, проденьте винт вверх через просверленное отверстие в панели крепления камеры и поместите еще одну шайбу вниз по винту , Проденьте резьбовое отверстие стержня стойки камеры вниз на винт, надежно затянув его на панели крепления камеры.
- Повторите шаги 14.3.2 для других двух монтажных балок камеры.
- Сдвиньте кобуру камеры на каждую подставку для подставки камеры с более широким отверстием, ориентированным на панель крепления камеры и винт. Временно закрепите кобуру на стенде камеры rС помощью винта с накатанной головкой.
ПРИМЕЧАНИЕ. Конечное рабочее положение будет установлено в разделе 2.
- Прикрепите стержни крепления камеры к центральной панели крепления камеры.
- Соберите каркас камеры поведения ( рис. 1A ).
ПРИМЕЧАНИЕ. Для облегчения конструкции соберите каркас вверх дном, начиная с «верхней» рамы камеры на рабочей поверхности ( рис. 1В , слой 1) и работая вверх к «ногам» рамы ( рис. 1В , слой 3).- Чтобы собрать верхний слой поведенческой камеры, прикрепите четыре алюминиевых стержня из 1 фута к квадратному полиэфирному листу ( рис. 1В , слой 1).
- Сдвиньте один стержень на две Т-образные гайки вдоль каждого края листа ткани, центрируя планку вдоль ширины ткани. Затяните крепежные элементы для закрепления листа ткани в каждом баре.
- Распространите квадратный лист из полиэстера на рабочей поверхности wiГо четырех прикрепленных алюминиевых стержней сверху. Сместите восемь угловых кронштейнов на верхние поверхности четырех алюминиевых стержней, по одному на каждом конце каждого стержня. Расположите угловые кронштейны на стержнях с вертикальными ножками кронштейнов заподлицо с концами стержней. Закрепите, затянув винты в Т-образных гайках.
- В свою очередь, на каждом углу, выдвиньте дополнительную 1-футовую алюминиевую экструзию вертикально, выталкивая экструзию через Т-образные гайки на двух угловых кронштейнах.
- Закрепите вертикальный стержень на горизонтальных стержнях, затянув крепежные детали, тем самым соединяя два соседних горизонтальных стержня.
ПРИМЕЧАНИЕ. После завершения восемь экструзий (четыре горизонтальных и четыре вертикальных) образуют квадратное кольцо на столе с четырьмя стойками, торчащими вверх ( рис. 1В , слой 1). - Сдвиньте свободные Т-образные гайки крепления держателя камеры с «H» из раздела 1.4 вниз в стойки рамы с предыдущего шага. Пусть "H & #34; Проскользните полностью вниз, чтобы отдохнуть сверху угловых кронштейнов в каждом углу рамки. Закрепите узел крепления камеры на месте, затянув четыре крепежных винта.
- Соберите нижний слой камеры, используя последние четыре 1-дюймовых экструдированных алюминиевых стержня ( рис. 1B , слой 3).
- Сместите один угловой кронштейн на каждый конец каждого 1-футового стержня, поместите угловые кронштейны с ножками кронштейнов заподлицо с концами стержня и затяните винты, чтобы зафиксировать их на месте.
- Сдвиньте решетки вниз между стойками рамы с помощью свободных Т-образных гаек в каналах стойки. Расположите стержни так, чтобы верхние края их угловых кронштейнов были на 1 дюйм ниже открытого конца стойки и зафиксированы на месте, затянув винты углового кронштейна.
- Чтобы собрать верхний слой поведенческой камеры, прикрепите четыре алюминиевых стержня из 1 фута к квадратному полиэфирному листу ( рис. 1В , слой 1).
- Сдвиньте Т-образные гайки четырех прямоугольных листов из полиэфира вниз в каналы на вертикальных полосах экструзии, чтобы закрыть стороны чашкиR и затяните крепежные детали для закрепления на месте.
- Выберите одну сторону, чтобы быть дверью для доступа к внутренней части камеры, и вытащите два винта и Т-образные гайки в нижнем слое камеры.
ПРИМЕЧАНИЕ. Когда рамка повернута вертикально, нижняя часть этой крышки будет висеть снизу внизу и может быть поднята для доступа к внутренней части камеры. - Поместите пластиковую крышку на верхний конец каждого углового элемента, чтобы служить в качестве футов для завершенной рамки. Поверните рамку вправо. Вставьте два держателя панели на каждую сторону внутри базового слоя рамки и закрутите, чтобы зафиксировать их на месте ( рисунок 1B , слой 3). Поместите 12 x 12 дюймов 2 куска прозрачного акрила поверх держателей панели, чтобы обеспечить стадию для аналитических пластин ( рисунок 1B , слой 3).
2. Позиционирование камеры и сцены
- Загрузите и установите программное обеспечение для сбора видеоизображения на микроскоп на компьютерС веб-сайта производителя.
- Сместите камеру микроскопа в каждую из трех камерных кобурок с оптикой камеры, направленной вниз на акриловую сцену и подсветку. Подключите камеры к USB-портам компьютера. Поместите инфракрасную панель подсветки под рамкой, центрируясь под сценой. Включите панель подсветки.
- Распечатайте прилагаемые шаблоны размещения решений и шаблонов выравнивания на прозрачных листах (см. Дополнительный файл ).
ПРИМЕЧАНИЕ. На шаблоне размещения решения круг плиты периметра имеет диаметр 3,8 см, а внутренняя область интереса - 0,9 см в диаметре. - Вырежьте вдоль линий сетки, чтобы получить прямоугольные элементы прозрачности, охватывающие круглые шаблоны.
- Запустите программное обеспечение для получения видеоролика и щелкните нумерованные миниатюры в верхней части окна, чтобы просмотреть каналы камер.
- Отрегулируйте ориентацию микроскопа и увеличьте его.
- Поместите шаблон выравнивания пластины под объектив камеры микроскопа ( рисунок 2B ).
- Измените рабочее расстояние вертикально, сдвинув кобуру камеры вдоль штанги стойки камеры и отрегулируйте увеличение камеры, повернув шкалу увеличения камеры, до тех пор, пока маркеры номера шаблона не будут четко видны по краям поля зрения камеры.
- Наденьте шаблон выравнивания пластины на акриловую сцену.
- Поместите образец пластины червяков на шаблон выравнивания пластины под камерой микроскопа и дополнительно уточните увеличение и рабочее расстояние до тех пор, пока не будет достигнут резкий образ червей, сохраняя при этом число маркеров в поле зрения.
- Повторите шаги 2.6.1-2.6.4 для двух других микроскопов.
3. Рост и синхронизация нематод
- За четыре дня до экспериментов семена двадцать четыре 60 ммПласты агара роста нематод (NGM) с 50 мкл OP50 Escherichia coli в бульоне Luria-Bertani (LB) (см. Раздел 5 для рецепта).
ПРИМЕЧАНИЕ. Каждая 60-миллиметровая пластина будет обеспечивать достаточное количество червей для одной аналитической пластины. Рекомендуется получить шесть повторов на лечение или генотип. - Оставьте посевные плиты высохнуть вертикально с крышками, на ночь при комнатной температуре.
- На следующий день перенесите пятнадцать сытых гермафродитов на каждую посеянную тарелку и дайте червям откладывать яйца в течение шести часов. Это даст> 360 яиц на тарелку.
- Через 6 часов удалите черви из посевных пластин и дайте потомству три дня взрослым при 20 ° C.
4. Хемосенсорный анализ предпочтений
- За день до эксперимента подготовьте 35 мм планшеты для анализа агара NGM.
- Подготовьте 250 мл агара NGM (см. Раздел 5 для рецепта).
- Организовать двадцать восемь пустых 35-миллиметровых пластин в стопках пяти или менее на плоском surface. Заполните каждую аналитическую пластинку 5 мл агара NGM. Оставьте аналитические планшеты для сушки в вертикальном положении с крышками на ночь при комнатной температуре.
ПРИМЕЧАНИЕ. Как правило, подготавливайте одну дополнительную аналитическую пластину для каждой обработки или генотипа для анализа в случае непредвиденных обстоятельств.
- В день эксперимента включите подсветку, загрузите компьютер и запустите программное обеспечение для захвата видеокамеры микроскопа.
- Подключите камеру микроскопа к компьютеру и настройте параметры видеозаписи.
- Нажмите на миниатюру нумерованной камеры в верхней части окна программного обеспечения, чтобы просмотреть живую ленту камеры.
- Выдвиньте меню «Формат видео» в верхнем левом углу камеры и выберите «MJPG 1280 x 1024». Выдвиньте меню «Папка» рядом с меню «Формат видео» и выберите папку для сохранения видеофайлов.
- Нажмите на значок «Автоэкспозиция» в верхнем правом углуПитание камеры и выключение автоэкспозиции. Нажмите на значок «СИД» сразу справа от значка «Автоматическая экспозиция», чтобы выключить встроенные светодиоды камеры микроскопа. Нажмите на соседний значок «Настройки»: выберите «Монохромный», увеличьте «Контрастность» и настройте «Яркость», пока черви не будут отличаться от фона.
- Получите калибровочные видео.
- Выровняйте шаблон размещения решения поверх шаблона выравнивания тарелки ( рисунок 2A ). Нажмите на значок «Время-потерянное видео» в левой части канала камеры и введите «5» для продолжительности и «1» для интервала для записи видео с 5 с в 1 кадр / с. Нажмите «Старт», чтобы начать запись видео.
- Повторите шаги в 4.3 и 4.4 для двух других микроскопов.
- Удалите шаблон размещения раствора из камеры.
- Промывайте червя три раза буфером для удаления пищи.
- Используйте 5 мл стеклянной пипетки, чтобы добавить 1,2 мл буфера NGM на пластину синхронизированных червей и осторожно перемешать пластину, чтобы вытеснить червей в буфер. Пипеткой буфера из пластины и дозирования червей в буфер в чистую микроцентрифужную пробирку.
ПРИМЕЧАНИЕ. Черви чувствительны к отклонениям от их концентрации соли в агаровом растворе 14 . Чтобы свести к минимуму изменения концентрации соли агара после размещения червя, рекомендуется использовать буфер NGM для процесса стирки (см. Раздел 5 для рецепта). Не используйте пластиковые пипетки для удаления червяков из пластин, так как черви будут прилипать к бокам. Подготовьте эквивалентное количество трубок, так как количество анализируемых пластин должно запускаться одновременно. - Пусть три трубки стоят 1-2 минуты, чтобы черви могли оседать на дно. Используйте наконечник из пластиковой пипетки, чтобы удалить как можно больше промывочного буфера из трубок, не нарушая осадок агрегатаЧервей в нижней части трубок. Заполните пробирки 1 мл чистого буфера NGM каждый.
- Повторите шаг 4.7.2 один раз.
- Используйте 5 мл стеклянной пипетки, чтобы добавить 1,2 мл буфера NGM на пластину синхронизированных червей и осторожно перемешать пластину, чтобы вытеснить червей в буфер. Пипеткой буфера из пластины и дозирования червей в буфер в чистую микроцентрифужную пробирку.
- Добавьте 10 мМ буферные растворы CuCl 2 и M13 для анализа пластин (см. Раздел 5 для рецептов).
- Наденьте шаблон размещения раствора на вершине рассекающего микроскопа.
- Поместите полосу двусторонней ленты с обеих сторон шаблона выравнивания пластины. Убедитесь, что лента перекрывается с кругом периметра пластины, но не закрывает область записи, представляющую интерес, в центре шаблона.
- Выровняйте периметр измерительной пластины с кружком на шаблоне выравнивания тарелки и нажимайте до тех пор, пока шаблон не прилипает к нижней части пластины. Выровняйте маркеры номерных знаков шаблона анализа с помощью шаблонов шаблонов размещения раствора на рассекающем микроскопе.
- Используйте пипетку P2 и пластиковый наконечник, чтобы поместить 1 мкл буфера M13 в квадрантах 1 и 4 ( Рисунок 2A). Используйте новый наконечник для размещения 1 мкл раствора 10 мМ CuCl 2 в квадрантах 2 и 3 ( рисунок 2A ).
- Повторите шаги 4.8.2-4.8.4 для двух других аналитических пластин.
- После того, как капли раствора полностью всасываются в агар, используйте стеклянную пипетку Пастера для переноса промытых червей из каждой микроцентрифужной трубки в соответствующую аналитическую пластину.
- Поместите каплю червей каждый на область выше и ниже области, обработанной кругом. Сложите ткань четыре раза и используйте тупую кромку для поглощения избыточного промывочного буфера на всех пластинах для анализа.
- Немедленно расположите три пластины для анализа под камерами микроскопа в поведенческой камере, выровняв числа в углах шаблона. Подождите 2-3 минуты, чтобы черви могли акклиматизироваться на планшетах.
ПРИМЕЧАНИЕ. Перед началом видеозаписи убедитесь, что дверная заслонка поведенческой камеры закрыта на следующем шаге. - Щелкните по значку записи «Время-потерянное видео» в левой части канала камеры и введите «10 минут» для продолжительности и «1» для интервала для записи 10-минутного видео с 1 кадром в секунду. Нажмите «Старт», чтобы начать видеозапись. После того, как видеозаписи были записаны и сохранены, удалите аналитические пластины из камеры.
- Повторите шаги 4.7-4.12 для следующего раунда аналитических пластин. Приобретите по крайней мере шесть реплик или два раунда записи для каждой обработки или генотипа.
5. Подготовка реагента
- Подготовьте агар и буфер NGM.
- В стеклянной бутылке объемом 1 л добавляют 1,5 г хлорида натрия, 8,5 г агара и 1,25 г пептона. Добавить 500 мл дистиллированной воды и мешалку в бутылку. Автоклавная бутылка с содержимым.
- Поместите бутылку на мешалку и включите функцию перемешивания.
- Добавить в порядке с использованием стерильной техники: 0,5 мл 5 мг / мл холестерина, 0,5 мл 1 М кальцияХлорид, 0,5 мл 1 М сульфата магния и 12,5 мл 1 М фосфата калия.
- Повторите шаги с 5.1.1 по 5.1.2, чтобы сделать буфер NGM, но не оставляйте агар и пептон на шаге 5.1.1.
- Подготовьте бульон LB.
- В стеклянной бутылке объемом 1 л добавляют 5 г триптона, 2,5 г дрожжевого экстракта, 2,5 г хлорида натрия, 500 мл дистиллированной воды и 0,5 мл 1 н. Гидроксида натрия. Автоклавная бутылка с содержимым.
- Подготовьте буфер M13.
- В стеклянной бутылке объемом 1 л добавляют 1,817 г Триса, 2,922 г хлорида натрия, 0,373 г хлорида калия и 500 мл дистиллированной воды. Автоклав бутылки с содержимым.
- Подготовьте раствор хлорида меди (CuCl 2 ).
- Выделяют 0,144 г CuCl 2 . Добавляют раствор в 10 мл буфера M13 в 15-мл пластиковой трубке для получения 100 мМ раствора CuCl 2 . Инвертируйте пластиковую трубку до тех пор, пока все растворенные вещества не исчезнутlved.
- Используйте фильтр-шприц и 0,2 мкм мембранный фильтр для очистки 100 мМ раствора CuCl 2 в чистой пластиковой трубке емкостью 15 мл.
- Чтобы получить раствор 10 мМ CuCl 2 , добавьте 900 мкл буфера M13 и 100 мкл 100 мМ исходного раствора CuCl 2 в микроцентрифужную пробирку. Инвертируйте микроцентрифужную пробирку, чтобы хорошо перемешать.
6. Видеоанализ
- Загрузите Python 3 (https://www.python.org/downloads/) и библиотеку программного обеспечения OpenCV (http://opencv.org/downloads.html).
- Загрузите три сценария Python для анализа (https://github.com/WormLabCaltech/ResidentWorm).
ПРИМЕЧАНИЕ. Перед продолжением убедитесь, что все используемые видео файлы находятся в формате mp4. - Чтобы просмотреть описания функций и параметров, введите «help (введите имя функции)» в консоли и нажмите «Ввод». Например, введите «help (calibration)» и нажмите enter.
- Выполнить функцию калибровкиС входными параметрами для определения интересующих видео областей (ROI).
- Введите имя файла калибровочного видео, сделанного в разделе 4, для переменной «mp4filename». Включать кавычки при вводе имени файла.
- Начните с значений 600 и 360 для переменных «Q * x» и «Q * y». * Введите квадрантные номера с 1 по 4. Начните со значения 310 для переменной «rad». Отрегулируйте значения переменных до тех пор, пока маски ROI не будут совпадать с контурами квадранта в шаблоне.
- Запишите общее количество пикселей в каждом ROI, которое будет напечатано в консоли после выполнения этой функции. Введите это значение для параметра «ROI_size» в функции preference_index.
- Выполните функцию threshold_constant, чтобы определить соответствующую пороговую константу. Отрегулируйте значение «постоянное» до тех пор, пока черви (белые) не будут видны четко, и в фоновом режиме минимальный шум соли и перца (черный).
- Выполните функцию preference_index, чтобы создать таблицу данных csv, индекс предпочтений видео и соответствующий участок размещения червя.
- Используйте значения «Q * x», «Q * y», «rad», «ROI_size» и «constant», определенные на шагах 6.4 и 6.5, в качестве входных параметров для функции preference_index.
ПРИМЕЧАНИЕ. Для каждого видеофрагмента функция preference_index подсчитывает количество пикселов червя в каждом ROI и вычисляет процент пикселов червя из общего количества пикселей ROI. Затем функция генерирует значение индекса предпочтения для каждого видеокадра, используя формулу:
ПРИМЕЧАНИЕ. После того, как программа проанализировала все кадры в видео, для видео генерируется среднее значение индекса предпочтения. График заполнения червя с индексом предпочтений видео, напечатанным вверху, а также csv datasheet, содержащимПиксель червя, процентные значения загрузки червя и индекс предпочтений для каждого видеокадра будут сохранены в указанную папку после завершения работы программы.
- Используйте значения «Q * x», «Q * y», «rad», «ROI_size» и «constant», определенные на шагах 6.4 и 6.5, в качестве входных параметров для функции preference_index.
Результаты
На рис. 3А показаны значения индекса предпочтений, полученные для разных генотипов и пар обработки. Значение индекса предпочтения 1 указывает на сильное притяжение к решению, помещенному в экспериментальный ROI, в то время как значение индекса предпочтения -1 указывает на сильное отталкивание. Индекс предпочтения 0,02 был получен, когда буферный раствор M13 помещался как в контрольный, так и в экспериментальный ROI, демонстрируя отсутствие пространственного смещения в сторону ROI. Черви N2 сильно избегали ионов меди, что приводило к индексу предпочтений -0,67, что подтверждает предыдущие выводы о том, что ионы меди являются сильным репеллентом ( дополнительный фильм 1 ) 4 . Мутантов osm-3 , которые не имеют надлежащего образования дистальных сегментов сенсорных ресничек, показали значительно меньшее избегание ионов меди (PI = -0,19) 15 . Ocr-2 мутантов, которые являются Fect во многих опосредованных ASH ноцицептивных ответах, включая предотвращение меди, также демонстрируют значительно уменьшенное избегание и даже некоторое умеренное притяжение к ионам меди (PI = 0,19) ( дополнительный фильм 2 ) 16 .
На рисунке 3В показаны типичные графики заполнения червя, которые указывают на плотность червей в контроле по сравнению с экспериментальными коэффициентами рентабельности с течением времени в каждом видео. Чем темнее цвет области печати, тем больше количество червяков в ROI. Участок занятости для червей N2, обработанных буфером M13, показывает, что количество червей в обоих ROI остается одинаковым во всем анализе. Однако график заполнения для червей N2, обработанных ионами меди, указывает на то, что черви сильно и последовательно избегают экспериментальной ROI на протяжении всего анализа.
Gimg "src =" / files / ftp_upload / 55963 / 55963fig1.jpg "/>
Рисунок 1: Фото и схематическое представление дизайна камеры поведения. ( A ) Вид спереди установки поведенческой камеры (слева) и соответствующее схематическое изображение камеры (справа). Непрозрачные полиэфирные листы закрывают камеру на всех поверхностях, кроме нижней поверхности, которая пропускает свет через инфракрасную панель подсветки. Числа 1, 2 и 3 соответствуют слоям экструзии в (B). ( B ) Схема вид сверху слоев экструзии, содержащих каркас поведенческой камеры. Это включает в себя верхний слой (1), средний монтажный слой (2) крепления камеры и слой нижней ступени (3). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Шаблоны размещения решений и шаблонов выравнивания. ( A ) Шаблон размещения решения имеет четыре квадранта и маркеры выравнивания. Контрольный раствор помещается в верхний левый и нижний правый квадранты, тогда как экспериментальное решение помещается в верхние правые и нижние левые квадранты. ( B ) Шаблон выравнивания тарелки имеет только маркеры выравнивания номера, чтобы минимизировать окклюзию червей в поле зрения во время видеозаписи и анализа. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
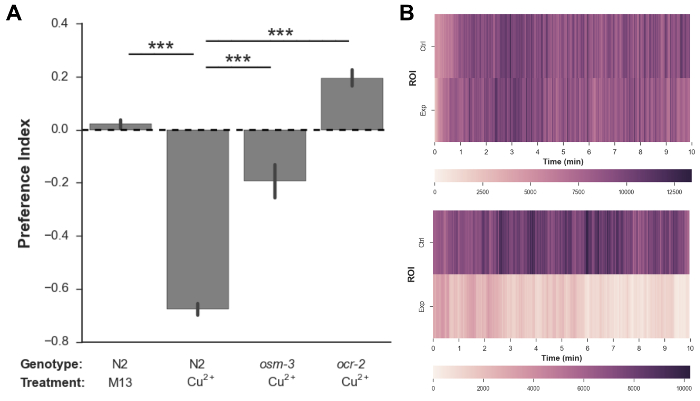
Рисунок 3: Пример данных, собранных с использованием этого анализа. ( A ) значения индекса предпочтения (PI) для N2 дикого типа и мутантного C. elegans М> в ответ на буфер М13 и 10 мМ CuCl 2 . Черви N2 не показали предпочтения между контрольными и экспериментальными ROI, когда управляющий раствор M13 был помещен в оба ROI, но сильно избегал экспериментального ROI, когда в него были помещены ионы меди (PI = 0,02 и -0,67 соответственно). Мутанты osm-3 (p802) и ocr-2 (ak47) показали значительно меньшее избегание ионов меди по сравнению с N2 (PI = -0,1 и 0,2 соответственно). N = 6 анализов для каждого спаривания генотипа,> 360 червей на анализ, полосы ошибок указывают ± 1 SEM, *** p <0,001, односторонний ANOVA, за которым следует пост-часовой тест Tukey Honestly существенной разницы (HSD). ( B ) Типичные графики заполнения червя для червей N2 с буфером M13 в обоих ROI (верхних) и N2-червях с буфером M13 в контрольном ROI и ионах меди в экспериментальном ROI (внизу). Цветовая шкала ниже каждого графика занятости представляет количество пикселей червя.Pload / 55963 / 55963fig3large.jpg "target =" _ blank "> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный фильм 1: Поведенческий ответ червей N2 на 10 мМ медного хлорида. Черви притягиваются к контрольным квадрантам буфером M13 (верхний левый и правый правый), но сильно избегают квадрантов, содержащих ионы меди, растворенные в буфере M13 (верхний правый и нижний левый). Видео записывалось со скоростью 1 кадр в секунду и ускорялось 15 раз. Нажмите здесь, чтобы скачать этот файл.
Дополнительный фильм 2: Поведенческий ответ ocr-2 (ak47) Черви до 10 мМ Медный хлорид. Черви перемещаются примерно в равной степени как в квадрантах управления с буфером M13 (верхний левый и правый правый), так и в квадрантС ионами меди, растворенными в буфере M13 (верхний правый и нижний левый) на протяжении всей продолжительности записи. Мутанты проявляют небольшое предпочтение квадрантам, содержащим ионы меди в начале записи. Видео записывалось со скоростью 1 кадр в секунду и ускорялось 15 раз. Нажмите здесь, чтобы скачать этот файл.
Дополнительные файлы: размещение решений и шаблоны выравнивания тарелок. Нажмите здесь, чтобы скачать этот файл.
Обсуждение
Критическим шагом в протоколе является обеспечение того, чтобы аналитические пластины имели согласованный уровень сухости в разные экспериментальные дни. Различные уровни сухости приведут к разной скорости диффузии раствора в агар и, следовательно, к изменениям поведенческого результата. Таким образом, аналитические пластины всегда должны быть свежими во второй половине дня перед экспериментами. Количество протестированных червей на анализ также должно регулироваться для удобства сравнения между обработками. Для справки, червь дикого типа откладывает 4-10 яиц / ч в среднем, давая> 360 червей на анализ, если соблюдается протокол синхронизации червя выше. 17 . Если определенные мутантные штаммы являются дефектными для яиц, подберите больше взрослых взрослых червей для укладки яиц, чтобы достичь целевого количества потомства. Другим важным шагом в протоколе является осторожное обращение с червями во время процесса стирки и размещения червя. Черви чувствительны к механическим раздражителям, которые вызывают реакции стресса, такие как S и торможение яйцекладки 18 . Кроме того, необходимо тщательно определить ROI и определить оптимальное значение порога для конкретных условий освещения, прежде чем приступать к анализу видео. Также рекомендуется повторять процесс калибровки и порогового значения, если длительный период времени истек с момента последнего эксперимента.
Ограничение этого метода заключается в том, что оно не подходит для анализа небольших популяций червя. Однако, если соответствующие меры контроля для определения влияния присутствия пищи на сенсорное поведение выполняются, то использование этой пищи для ограничения пространственного разведочного местоположения червей, как и в анализе удержания, также возможно с этой установкой. Кроме того, этот метод не предназначен для изучения навигации по градиенту стимулов из-за непосредственной близости и небольших количеств используемых контрольных и экспериментальных растворов.
E_content "> В будущем в эту систему можно интегрировать программное обеспечение для программирования, обеспечивающее отслеживание нескольких червей и извлечение одной червя, в эту систему 19 , 20. Запись тонких параметров поведения поведения одного червя, таких как скорости разворота и амплитуда изгибов тела, обеспечит Более детальную картину хемосенсорного поведения отдельного червя в контексте популяционного анализа. Анализ также может быть изменен для изучения привыкания путем сверления отверстий через ROI с использованием игл шприца с соответствующим размером калибра и заполнения отверстий агаром, наполненным С экспериментальным соединением или контрольным буфером, что обеспечит более постоянную поверхностную концентрацию соединения в течение более длительного периода времени записи, что необходимо во время изучения привыкания. Другим потенциальным применением этого метода является проведение сравнительных исследований поведения различных видов нематод. Кроме того, камера поведенияМогут быть модифицированы различными способами для изучения поведенческих реакций на мультимодальные стимулы. Для оптогенетических применений высокоинтенсивные светодиодные матрицы могут быть прикреплены рядом с держателем камеры для избирательной активации интересующих нас нейронов во время анализа. Нагревательные элементы, системы охлаждения и температурные датчики также могут быть добавлены в установку для изучения влияния температуры на сенсорное поведение. Кроме того, в кабине могут быть установлены системы доставки запаха, чтобы исследовать взаимодействия между аторсенсорными и хемосенсорными модальностями.Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Некоторые штаммы были предоставлены Центром генетических исследований Caenorhabditis (CGC), который финансируется NIH Office Research Infrastructure Program (P40 OD010440). Эта работа поддерживается Медицинским институтом Говарда Хьюза, с которым PWS является исследователем.
Материалы
| Name | Company | Catalog Number | Comments |
| Aluminum T-slotted framing extrusions | McMaster-Carr | 47065T101 | Single profile, 1" size, solid |
| Brackets | McMaster-Carr | 47065T236 | 1" long for 1" high single profile extrusions |
| Compact end-feed fasteners | McMaster-Carr | 47065T139 | 1" (single), pack of 4 |
| Twist-in solid panel holders | McMaster-Carr | 47065T251 | For 1" high extrusion |
| Plastic end caps | McMaster-Carr | 47065T91 | For 1" high extrusion |
| Optically clear cast acrylic sheet | McMaster-Carr | 8560K211 | 3/16" thick, 12" x 12" |
| Vinyl-coated polyester fabric | McMaster-Carr | 88505K57 | 0.027" thick, 61" width, black |
| Brass grommets | McMaster-Carr | 9604K22 | Trade size 0, 0.545" outer diameter |
| Steel washers | McMaster-Carr | 90107A029 | 1/4" screw size |
| Rounded head screws | McMaster-Carr | 90272A546 | 1/4" - 20 thread size, 1 - 1/2" long |
| Standard operating backlight | Smart Vision Lights | See local vendor | 8" x 8", infrared 850 nm |
| IVP-C1 Variable Control Pot | Smart Vision Lights | See local vendor | |
| T1 Power Supply | Smart Vision Lights | See local vendor | |
| Dino lite Pro AM4113T | Dino-Lite Digital Microscope | See local vendor | |
| MS09B microscope stand | Dino-Lite Digital Microscope | See local vendor |
Ссылки
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philos Trans R Soc Lond B Biol Sci. 314, 1-340 (1986).
- Bargmann, C. I., Horvitz, H. R. Chemosensory neurons with overlapping functions direct chemotaxis to multiple chemicals in C. elegans. Neuron. 7 (5), 729-742 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Hilliard, M. A., Bargmann, C. I., Bazzicalupo, P. C. elegans responds to chemical repellents by integrating sensory inputs from the head and the tail. Curr Biol. 12 (9), 730-734 (2002).
- Hilliard, M. A., Bergamasco, C., Arbucci, S., Plasterk, R. H., Bazzicalupo, P. Worms taste bitter: ASH neurons, QUI-1, GPA-3 and ODR-3 mediate quinine avoidance in Caenorhabditis elegans. EMBO J. 23 (5), 1101-1111 (2004).
- Zariwala, H. A., Miller, A. C., Faumont, S., Lockery, S. R. Step response analysis of thermotaxis in Caenorhabditis elegans. J Neurosci. 23 (10), 4369-4377 (2003).
- Ward, S. Chemotaxis by the nematode Caenorhabditis elegans: identification of attractants and analysis of the response by use of mutants. Proc Natl Acad Sci U S A. 70 (3), 817-821 (1973).
- Wicks, S. R., de Vries, C. J., van Luenen, H. G., Plasterk, R. H. CHE-3, a cytosolic dynein heavy chain, is required for sensory cilia structure and function in Caenorhabditis elegans. Dev Biol. 221 (2), 295-307 (2000).
- Jansen, G., Weinkove, D., Plasterk, R. H. A. The G-protein subunit gpc-1 of the nematode C. elegans is involved in taste adaptation. EMBO J. 21 (5), 986-994 (2002).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Ezcurra, M., Tanizawa, Y., Swoboda, P., Schafer, W. R. Food sensitizes C. elegans avoidance behaviours through acute dopamine signalling. EMBO J. 30 (6), 1110-1122 (2011).
- Ward, A., Liu, J., Feng, Z., Xu, X. Z. S. Light-sensitive neurons and channels mediate phototaxis in C. elegans. Nat Neurosci. 11 (8), 916-922 (2008).
- Kunitomo, H., et al. Concentration memory-dependent synaptic plasticity of a taste circuit regulates salt concentration chemotaxis in Caenorhabditis elegans. Nat Commun. 4, 2210 (2013).
- Snow, J. J., et al. Two anterograde intraflagellar transport motors cooperate to build sensory cilia on C. elegans neurons. Nat Cell Biol. 6 (11), 1109-1113 (2004).
- Tobin, D. M., et al. Combinatorial expression of TRPV channel proteins defines their sensory functions and subcellular localization in C. elegans neurons. Neuron. 35 (2), 307-318 (2002).
- Waggoner, L. E., Zhou, G. T., Schafer, R. W., Schafer, W. R. Control of alternative behavioral states by serotonin in Caenorhabditis elegans. Neuron. 21 (1), 203-214 (1998).
- Sawin, E. R. . Genetic and cellular analysis of modulated behaviors in Caenorhabditis elegans. , (1996).
- Ramot, D., Johnson, B. E., Berry, T. L., Carnell, L., Goodman, M. B. The parallel worm tracker: A platform for measuring average speed and drug-induced paralysis in nematodes. PLoS One. 3 (5), e2208 (2008).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nat Methods. 8 (7), 592-598 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены