Method Article
Automatisierte Analyse eines Nematoden-Populations-basierten Chemosensorischen Präferenzassays
In diesem Artikel
Zusammenfassung
Wir stellen ein Verhaltensaufzeichnungs-Setup und -Protokoll vor, das eine automatisierte Analyse des Nematoden ermöglicht, Caenorhabditis elegans 'Präferenz für lösliche Verbindungen in einem Populations-basierten Assay. Dieser Artikel beschreibt den Aufbau einer Verhaltenskammer, das Verhaltenstestprotokoll und die Analyse der Videoanalyse.
Zusammenfassung
Die Nematode, Caenorhabditis elegans 'kompaktes Nervensystem von nur 302 Neuronen unterliegt einem vielfältigen Repertoire von Verhaltensweisen. Um die Sezierung der neuronalen Schaltkreise zu erleichtern, die diesen Verhaltensweisen zugrunde liegen, ist die Entwicklung von robusten und reproduzierbaren Verhaltensassays notwendig. Vorherige C. elegans Verhaltensstudien haben Variationen eines "Falltests", eines "Chemotaxisassays" und eines "Retentionstests" verwendet, um die Reaktion von C. elegans auf lösliche Verbindungen zu untersuchen. Die in diesem Artikel beschriebene Methode versucht, die komplementären Stärken der drei vorgenannten Assays zu kombinieren. Kurz gesagt, ein kleiner Kreis in der Mitte jeder Testplatte wird in vier Quadranten unterteilt, wobei die Kontroll- und experimentellen Lösungen abwechselnd platziert sind. Nach dem Hinzufügen der Würmer werden die Testplatten in eine Verhaltenskammer geladen, in der Mikroskopkameras die Wurmbegegnungen mit den behandelten Bereichen aufzeichnen. Automatisierte Videoanalyse wird dann durchgeführtEs wird ein Präferenzindex (PI) -Wert für jedes Video erzeugt. Die Videoerfassung und die automatisierten Analysemerkmale dieser Methode minimieren die Beteiligung des Experimentators und die damit verbundenen Fehler. Weiterhin werden pro Assay winzige Mengen der experimentellen Verbindung verwendet und die Multikamera-Einstellung der Verhaltenskammer erhöht den experimentellen Durchsatz. Diese Methode eignet sich besonders für die Durchführung von Verhaltensbildschirmen von genetischen Mutanten und neuartigen chemischen Verbindungen. Diese Methode eignet sich jedoch nicht für das Studium der Stimulus-Gradienten-Navigation aufgrund der engen Nähe der Kontroll- und Versuchslösungsregionen. Es sollte auch nicht verwendet werden, wenn nur eine kleine Population von Würmern zur Verfügung steht. Obwohl es geeignet ist, Reaktionen nur auf lösliche Verbindungen in ihrer gegenwärtigen Form zu untersuchen, kann dieses Verfahren leicht modifiziert werden, um multimodale sensorische Wechselwirkung und optogenetische Studien anzupassen. Dieses Verfahren kann auch angepasst werden, um die chemosensorischen Reaktionen anderer Nematodenarten zu untersuchen.
Einleitung
Das Füttern von Tieren muss Eingaben aus mehreren sensorischen Modalitäten integrieren und geeignete Verhaltensstrategien auswählen, um ihre Umgebung erfolgreich zu navigieren. Verständnis, wie externe sensorische Eingaben empfangen und in neuronale Informationen umgesetzt werden, um die Aktionsauswahl zu leiten, ist ein zentrales Ziel im Bereich der Neurobiologie. Der genetisch tragbare Nematoden, C. elegans , ist ein attraktiver Modellorganismus, in dem die neuronalen Mechanismen der sensorischen Biologie und der multimodalen Integration untersucht werden können. Obwohl C. elegans nur 302 Neuronen hat, kann er zwischen einer Vielzahl von Umweltreizen einschließlich löslicher Verbindungen, flüchtiger Geruchsstoffe und Umgebungstemperatur 1 , 2 , 3 , 4 , 5 , 6 , 7 erkennen und unterscheiden . DasNematode C. elegans stützt sich stark auf seinen chemosensorischen Apparat, um Nahrungsmittelquellen zu lokalisieren und sich auf potenzielle Bedrohungen aufmerksam zu machen. So spielen Verhaltensassays, die entworfen sind, um die Reaktionen von Wildtyp- und Mutanten C. elegans auf chemische Reize zu untersuchen, eine entscheidende Rolle bei der Sezierung der genetischen, zellulären und neuronalen Mechanismen, die den bemerkenswerten sensorischen Fähigkeiten von C. elegans zugrunde liegen.
Um die Reaktion auf lösliche Verbindungen zu untersuchen, wurden drei Arten von Assays beschrieben - der Falltest, der Chemotaxisassay und der Retentionsassay. In dem Falltest wird ein kleiner Tropfen der Verbindung am Schwanz eines beweglichen Schneckers platziert und die Entscheidung des Wurms, sich umzukehren oder vorwärts zu bewegen, sobald die Flüssigkeit den vorderen sensorischen Apparat erreicht hat, wird erzielt 4 . Der Drop-Test erfordert wenig experimentelle Vorbereitung und ist nützlich, wenn die Stichprobengröße der Würmer klein ist, wie bei lasergestützten Würmern. Doch als nur ein wurmKann zu einem Zeitpunkt getestet werden und der Experimentator muss während der gesamten Dauer des Assays vorhanden sein, der Drop-Test kann zeitaufwendig sein. Der Falltest ist auch anfällig für Variationen in der Tropfenabgabe zwischen jedem Wurm innerhalb einer Probe, die die Gesamtergebnisse des Assays beeinflussen können. Eine weitere Einschränkung des Falltests ist, dass es nur verwendet werden kann, um die Reaktion des Wurms auf aversive Verbindungen zu untersuchen, da es nicht möglich ist, zwischen einer attraktiven oder neutralen Wirkung der Verbindung aus der Vorwärtsbewegung des Wurms zu unterscheiden.
Der Chemotaxis-Assay für lösliche Verbindungen beinhaltet im allgemeinen das Aufteilen einer Agarplatte in vier Quadranten, wobei die experimentelle Lösung in den Agar von zwei gegenüberliegenden Quadranten gemischt und die Kontrolllösung in die beiden anderen Quadranten 8 , 9 gemischt wird. Zu Beginn des Assays wird ein Tropfen Puffer, der Würmer enthält, in der Mitte der Platte platziert und die Anzahl der Würmer in Jeder Quadrant wird zu verschiedenen Zeitpunkten bewertet. Der Chemotaxis-Assay bietet eine größere statistische Leistung im Vergleich zum Falltest, da eine große Anzahl von Würmern in jedem Assay getestet wird. Eine Einschränkung dieses Verfahrens besteht jedoch darin, daß die Herstellung der Chemotaxis-Testplatten große Mengen der experimentellen Verbindung erfordert. Dies wird es schwierig machen, großräumige Verhaltensbildschirme durchzuführen, wenn ein komplizierter Reinigungsprozess mit begrenzten Ausbeuten erforderlich ist, um die interessierende Verbindung zu erhalten, wie im Fall der Ascarosid-Signalmoleküle 10 . Darüber hinaus ist das manuelle Zählen von Würmern während des gesamten Assays fehleranfällig und die Störung der Platten während des Zählvorgangs könnte die Ergebnisse beeinflussen.
Im Gegensatz zu den beiden vorgenannten Verfahren verwendet der Retentionsassay eine Machine Vision, die den Fehler während des Scoring-Prozesses minimiert und die Interferenz des Experimentators während des Assays reduziert > 11 Die computergesteuerte Analyse von Videoaufnahmen des Wurmverhaltens kann auch potenziell subtilere Verhaltensdynamiken aufdecken, die beim Scoring nur bei wenigen diskreten Zeitpunkten verpasst werden. In dem Retentionstest werden zwei Lösungspunkte auf gegenüberliegenden Seiten eines kleinen kreisförmigen bakteriellen Nahrungsmittelflecks hinzugefügt, gefolgt von der Platzierung einer kleinen Anzahl von Würmern in der Mitte des Nahrungsmittelflecks. Das Verhalten der Würmer wird dann aufgezeichnet, analysiert und ein Präferenzindexwert wird basierend auf der Gesamtzahl der Wurmpixel in jedem Lösungsbereich berechnet. Obwohl die Anwesenheit eines attraktiven Nahrungsmittelflecks ermöglicht, dass kleinere Populationen von Würmern in jedem Assay verwendet werden, wurde bisher gezeigt, dass das Vermeidungsverhalten für lösliche Repellanten 12 sensibilisiert wurde. Darüber hinaus zeigen Würmer eine photophobe Antwort auf kurzwelliges Licht und die Verwendung von Mikroskop-Lichtquellen, die weißes Licht in der Verhaltensaufzeichnung einrichten, können das Verhalten beeinflussenS = "xref"> 13
Der Zweck der in diesem Artikel diskutierten Methode ist die Aufzeichnung und Analyse von C. elegans ' Präferenz für lösliche Verbindungen unter Verwendung eines Populations-basierten Assays. Zu diesem Zweck integriert und verbessert das aktuelle Verfahren Aspekte aus allen drei der zuvor diskutierten Methoden. Es ermöglicht große Populationen von Würmern getestet werden und erfordert nur geringe Mengen der experimentellen Lösung in jedem Assay verwendet werden. Darüber hinaus wird der Assay innerhalb einer kundenspezifischen umschlossenen Verhaltenskammer mit Infrarot-LED-Hintergrundbeleuchtung durchgeführt, um die Auswirkungen von kurzwelligem Licht auf das Verhalten zu minimieren. Jede Kammer kann auch mit mehreren Mikroskopkameras ausgerüstet werden, was den experimentellen Durchsatz erhöht, ohne den Bankraum zu beeinträchtigen. Schließlich gibt die Videoanalyse-Software den Präferenzindexwert für jedes Video sowie einen begleitenden Wurmbelegungsplan aus, um die Dynamik der Populationsverhalten im Laufe der Zeit zu visualisieren. Der Kammeraufbau und aSsay-Protokoll kann weiter modifiziert werden, um multimodale Verhaltensreaktionen wie die Wirkung von Geruchsstoffen oder Temperaturen auf chemosensorische Verhaltensweisen zu untersuchen.
Dieser Artikel beschreibt die Konstruktion der Verhaltenskammer und des Testprotokolls. Es zeigt auch die Nützlichkeit dieses Verfahrens bei der Untersuchung der Reaktion von Wildtyp-Würmern und chemosensorischen defekten Mutanten auf die bekannten löslichen Repellanten, Kupferionen 4 . Schließlich ist der Videoanalyseprozess mit der mitgelieferten Software detailliert.
Protokoll
1. Verhalten Kammermontage
HINWEIS: Die Verhaltenskammer besteht aus einem etwa würfelförmigen Rahmen aus extrudierten Aluminiumstäben, mit opaken Stoffbezügen bedeckt, mit einem klaren Acrylboden und Kameraträgern. Die Fugen zwischen den extrudierten Aluminiumstäben, die die Verhaltenskammer bilden, sind alle senkrecht und werden mit "L" -förmigen Eckklammern (1 Zoll breit mit 1-Zoll-Beinen) befestigt, die ein Eckbügel-Bein an jeder Stange mit Schrauben und Einrasten befestigen T-Nüsse Jedes Gelenk ist mit einem oder zwei Eckklammern wie unten beschrieben befestigt. Die Stoffabdeckungen über der Kammer werden an den Aluminium-Rahmenstangen mit den gleichen Schrauben und Einschub-T-Muttern, aber durch Durchführungen in den Ecken des Gewebes befestigt. Schrauben werden ordnungsgemäß in die Senkseite der Einschub-T-Muttern eingesetzt, nicht in die Seite mit der vorspringenden Lippe. Beim Anbringen einer Schraube / T-Mutter Befestigungsanordnung an einem Aluminiumstab schieben Sie die T-Mutter in den KanalAuf dem passenden Gesicht der Stange, wobei der Kopf der Schraube aus dem Schlitz herausragt.
- Stoffbezüge vorbereiten
- Verwenden Sie eine Schere, um fünf Stücke des opaken Polyestergewebes zu schneiden, um die oberen und vier Seiten der Kammer zu bedecken.
- Schneiden Sie ein Quadrat 14 x 14 Zoll 2 Blatt Stoff für die Oberseite der Kammer. Schneiden Sie vier rechteckige 11 x 14 Zoll 2 Blatt Stoff für die Seiten der Kammer.
- Installieren Sie die Ösen an den Ecken der Stoffblätter.
- Markieren Sie eine Referenzlinie 0,5 Zoll von jeder Kante aller fünf Polyester-Stoffblätter mit einem Bleistift und Straightge.
- Für die vier rechteckigen Blätter verwenden Sie die Trommelzangen, um die Ösen einzusetzen, die zentriert sind, wo sich die Bleistiftlinien an jeder Ecke schneiden (dh 4 Ösen pro Blatt).
- Für die quadratische Platte, legen Sie zwei Ösen entlang jeder Kante mit jeder Tülle zentriert auf der Bleistiftlinie und positioniert 1,5-Zoll von dem Ende von jedem vonDie vier Bleistiftlinien (das heißt, 8 Tüllen insgesamt, zwei in der Nähe jeder Ecke).
- Setzen Sie eine Schraube in jede Durchführungsbohrung ein und lösen Sie jeweils eine T-Mutter.
- Verwenden Sie eine Schere, um fünf Stücke des opaken Polyestergewebes zu schneiden, um die oberen und vier Seiten der Kammer zu bedecken.
- Kamerahalterung herstellen
- Verwenden Sie eine Bandsäge oder gleichwertig, um ein 2 Zoll langes Stück Aluminium-Extrusionsstange für jede Kamera zu schneiden, um sicherzustellen, dass das geschnittene Ende der Stange senkrecht zur Stablänge ist, um spätere Montage zu erleichtern.
- Verwenden Sie eine Bohrmaschine mit einem Bohrer von 0,25 Zoll Durchmesser, um ein Loch durch die Mittelbahnen jeder Kamerahalterungsstange zu bohren, 0,75 Zoll von einem Ende, so dass das Loch senkrecht zu den oberen und unteren Flächen ist und durch die Mittellinie der Stange geht . Optional bohren Sie das Loch mit einem handgehaltenen Elektrobohrer mit einem 0,25-Zoll-Bohrer, aber stellen Sie sicher, dass das Loch senkrecht zu den oberen und unteren Flächen der Stange ist.
- Bereiten Sie alle Eckklammern vor.
- Setzen Sie eine Schraube durch das Loch einJeder Eckhalter Bein, Einsetzen der Schraube von der Innenwinkel Seite. Ziehen Sie eine T-Mutter auf jede Schraube.
- Bereiten Sie die Kamerahalterung vor ( Abbildung 1B , Schicht 2).
HINWEIS: Die Kamerahalterung ist eine "H" -förmige Baugruppe, die die drei Kamerahalter unterstützt.- Befestigen Sie die Kamerahalterung an der Mittelstange der Kamerahalterung.
- Legen Sie die drei in Schritt 1.2 gefertigten Kamerahalterungsstäbe mit den vertikal gebohrten Bohrungen aus. Schieben Sie zwei Eckklammern auf die Seiten jeder Montagestange am Ende am weitesten von der Bohrung.
- Positionieren Sie die Eckwinkel mit den Beinen der Klammern bündig mit dem Ende der Stange und ziehen Sie die Schrauben an, um sie zu befestigen. Dies bildet eine "T" -Form mit dem Bohrloch an der Unterseite des "T".
- Legen Sie eine 1-Fuß-Aluminium-Extrusion auf die Arbeitsfläche. Schieben Sie die T-Muttern einer Kamerahalterung aufMbly (aus dem vorherigen Schritt) auf eine Seite der 1-Fuß-Bar. Zentrieren Sie die Montagestange entlang der Länge der 1 Fußstange und ziehen Sie die Schrauben fest, um sie zu sichern. Schieben Sie die beiden anderen Montagestangen auf die gegenüberliegende Seite der 1 Fußstange.
- Positionieren Sie die beiden Stäbe gleich weit von der Mitte der 1-Fuß-Stange, mit ihren inneren Eckklammern ca. 2,5 cm auseinander. Slip Eckklammern auf die Seiten der 1-Fuß-Bar, zwei an jedem Ende der Bar. Positionieren Sie die Eckklammern mit den Beinen der Klammern bündig mit den Enden der Stange und ziehen Sie die Schrauben fest, um sie zu befestigen.
- Befestigen Sie die Endstäbe an der Mittelleiste.
- Schieben Sie zwei 1-Fuß-Aluminium-Strangpressprofile auf die T-Muttern an jedem Ende der Baugruppe aus dem vorherigen Schritt, die eine "H" -Form bilden. Zentrieren Sie jede Endstange auf der Mittelstange und sichern Sie sie, indem Sie die vier Schrauben festziehen.
- Slip vier Eckklammern auf die Oberseite der beiden Endstäbe hinzugefügt in der vorherigen Schritt, eine an jedem EndeVon jedem bar Positionieren Sie die Eckwinkel mit den Beinen der Klammern, die mit den Enden der Stangen bündig sind, und ziehen Sie die Schrauben fest, um sie zu befestigen.
- Befestigen Sie Kameraständer und Holster an der Kamerahalterung.
- Für jedes der drei Mikroskop-Kamerastände, entfernen Sie das Kamerahalter, indem Sie die Rändelschraube lösen und den Standstab abschieben.
- Für jede Kamerahalterung (jetzt gesichert an der Mittelstange des "H"), legen Sie eine Unterlegscheibe auf eine Rundkopfschraube, schieben Sie die Schraube durch das Bohrloch in der Kamerahalterung und legen Sie eine andere Unterlegscheibe über die Schraube . Fädeln Sie die Gewindebohrung der Kameraständerstange auf die Schraube und ziehen Sie sie fest gegen die Kamerahalterung.
- Wiederholen Sie die Schritte 14.3.2 für die beiden anderen Kamerahalterung.
- Schieben Sie ein Kamerahalter auf jede Kameraständerstange, wobei die breitere Öffnung zur Kamerahalterung und Schraube ausgerichtet ist. Halten Sie das Holster vorübergehend am Kamerastand rOd mit der Holster-Rändelschraube.
HINWEIS: Die endgültige Betriebsposition wird in Abschnitt 2 eingestellt.
- Befestigen Sie die Kamerahalterung an der Mittelstange der Kamerahalterung.
- Montieren Sie den Verhaltenskammerrahmen ( Abbildung 1A ).
HINWEIS: Um die Konstruktion zu erleichtern, montieren Sie den Rahmen mit der Oberseite des Kammerrahmens auf der Arbeitsfläche ( Abbildung 1B , Schicht 1) und arbeiten nach oben zu den "Füßen" des Rahmens ( Abbildung 1B , Schicht 3).- Um die obere Schicht der Verhaltenskammer zusammenzubauen, befestigen Sie vier 1-Fuß extrudierte Aluminiumstäbe an der quadratischen Polyesterfolie ( Abbildung 1B , Schicht 1).
- Schieben Sie einen Stab auf die beiden T-Muttern entlang jeder Kante des Stoffblattes, zentrieren Sie die Stange entlang der Stoffbreite. Ziehen Sie die Befestigungselemente fest, um das Gewebeblatt an jedem Stab zu sichern.
- Verbreiten Sie die quadratische Polyesterfolie auf der Arbeitsfläche wiTh die vier angebrachten Aluminiumstangen oben. Schieben Sie acht Eckklammern auf die Oberseiten der vier Aluminiumstäbe, eine an jedem Ende jeder Stange. Positionieren Sie die Eckwinkel an den Stäben, wobei die vertikalen Beine der Klammern mit den Enden der Stangen bündig sind. Sicherung durch Anziehen der Schrauben in die T-Muttern.
- Im Gegenzug an jeder Ecke, stehen eine zusätzliche 1-Fuß-Aluminium-Extrusion aufrecht, rutschen die Extrusion über die T-Nüsse an den beiden Eckwinkel Beine.
- Sichern Sie den aufrechten Stab an den horizontalen Stangen, indem Sie die Befestigungselemente festziehen und damit die beiden benachbarten horizontalen Stangen verbinden.
HINWEIS: Nach Fertigstellung bilden die acht Extrusionen (vier horizontale und vier vertikale) einen quadratischen Ring auf dem Tisch, wobei vier Pfosten nach oben haften ( Abbildung 1B , Schicht 1). - Schieben Sie die losen T-Muttern der "H" -förmigen Kamerahalterung von Abschnitt 1.4 in die Ständer des Rahmens aus dem vorherigen Schritt. Lassen Sie die "H & #34; Rutscht den ganzen Weg hinunter, um oben auf den Eckklammern an jeder Ecke des Rahmens zu ruhen. Sichern Sie die Kamerahalterung, indem Sie die vier Eckbügelschrauben festziehen.
- Montieren Sie die untere Schicht der Kammer mit den letzten vier 1 Fuß extrudierten Aluminiumstäben ( Abbildung 1B , Schicht 3).
- Schieben Sie eine Eckhalterung auf jedes Ende jeder 1-Fuß-Stange, positionieren Sie die Eckklammern mit den Beinen der Bügel bündig mit den Enden der Stange und ziehen Sie die Schrauben an, um sie zu befestigen.
- Schieben Sie die Stäbe zwischen die Rahmenständer mit den losen T-Nüssen in den Ständerkanälen. Positionieren Sie die Stäbe so, dass die oberen Kanten ihrer Eckklammern 1 Zoll unter dem offenen Ende der Ständer sind und sichern Sie sie, indem Sie die Eckbügelschrauben festziehen.
- Um die obere Schicht der Verhaltenskammer zusammenzubauen, befestigen Sie vier 1-Fuß extrudierte Aluminiumstäbe an der quadratischen Polyesterfolie ( Abbildung 1B , Schicht 1).
- Schieben Sie die T-Muttern der vier rechteckigen Polyesterfolien in die Kanäle auf den aufrechten Extrusionsstäben, um die Seiten der Chambe zu bedeckenR und ziehen Sie die Befestigungselemente fest, um sie zu sichern.
- Wählen Sie eine Seite, um eine Tür zu sein, um auf das Innere der Kammer zuzugreifen, und entfernen Sie die beiden Schrauben und T-Muttern an der unteren Schicht der Kammer.
HINWEIS: Wenn der Rahmen aufrecht steht, wird die Unterseite dieser Abdeckung lose an der Unterseite hängen und kann angehoben werden, um auf das Innere der Kammer zuzugreifen. - Legen Sie eine Plastikkappe auf das obere Ende jedes Eckelements, um als Füße für den fertigen Rahmen zu dienen. Drehen Sie den Rahmen rechts-nach oben. Setzen Sie zwei Tafelhalter pro Seite in die Grundschicht des Rahmens ein und verdrehen Sie, um sie zu befestigen ( Abbildung 1B , Schicht 3). Legen Sie ein 12 x 12 Zoll 2 Stück klare Acryl auf die Plattenhalter, um eine Bühne für Testplatten zu liefern ( Abbildung 1B , Schicht 3).
2. Kamera- und Bühnenschablonenpositionierung
- Laden und installieren Sie die Mikroskop-Kamera-Video-Erfassungssoftware auf den ComputerVon der Website des Herstellers.
- Schieben Sie eine Mikroskop-Kamera in jeden der drei Kamera-Holster mit der Kamera-Optik nach unten auf die Acryl-Bühne und Hintergrundbeleuchtung. Verbinden Sie die Kameras mit den USB-Ports des Computers. Positionieren Sie die Infrarot-LED-Hintergrundbeleuchtung unter dem Rahmen, zentriert unter der Bühne. Stecken Sie die Hintergrundbeleuchtung ein, um das Gerät einzuschalten.
- Drucken Sie die bereitgestellten Lösungs-Platzierungs- und Plattenausrichtungsvorlagen auf Transparentfolien (siehe Ergänzende Datei ).
HINWEIS: Auf der Lösungsplatzierungsschablone hat der Plattenumfangskreis 3,8 cm im Durchmesser und der innere Bereich des Interessionskreises ist 0,9 cm im Durchmesser. - Schneiden Sie die Gitterlinien entlang, um rechteckige Transparenzstücke zu erhalten, die die kreisförmigen Vorlagen umschließen.
- Starten Sie die Video-Erfassungssoftware und klicken Sie auf die nummerierten Thumbnails am oberen Rand des Fensters, um die Feeds der Kameras anzuzeigen.
- Anpassung der Mikroskop-Kamera Ausrichtung und Vergrößerung.
- Positionieren Sie eine Plattenausrichtungsschablone unter einem Mikroskop-Objektiv ( Abbildung 2B ).
- Ändern Sie den Arbeitsabstand, indem Sie das Kamerahalterung entlang der Kameraständerstange vertikal schieben und die Vergrößerung der Kamera einstellen, indem Sie das Vergrößerungsrad der Kamera drehen, bis die Nummernmarkierungen der Schablone an den Rändern des Sichtfeldes der Kamera deutlich sichtbar sind.
- Tondieren Sie die Plattenausrichtungsschablone auf die Acrylstufe.
- Legen Sie eine Probenplatte von Würmern auf die Plattenausrichtungsschablone unter der Mikroskopkamera und verfeinern Sie die Vergrößerung und den Arbeitsabstand, bis ein scharfes Bild der Würmer erreicht ist, während die Nummernmarkierungen im Sichtfeld weiterhin beibehalten werden.
- Wiederholen Sie die Schritte 2.6.1-2.6.4 für die beiden anderen Mikroskopkameras.
3. Nematodenwachstum und Synchronisation
- Vier Tage vor den Experimenten, Saatgut vierundzwanzig 60 mmNematode Growth Media (NGM) Agarplatten mit 50 μl OP50 Escherichia coli in Luria-Bertani (LB) Brühe (siehe Abschnitt 5 für Rezept).
HINWEIS: Jede 60-mm-Platte liefert genügend Würmer für eine Testplatte. Erwerb von sechs Replikaten pro Behandlung oder Genotyp wird empfohlen. - Lassen Sie die gezogenen Teller aufrecht mit Deckel auf, über Nacht bei Raumtemperatur trocknen.
- Am nächsten Tag übertragen Sie fünfzehn gut gefütterte Gravid-Hermaphroditen auf jede Samenplatte und erlauben den Würmern, Eier für sechs Stunden zu legen. Dies ergibt> 360 Eier pro Teller.
- Nach 6 h, entfernen Sie die Würmer aus den Samenplatten und lassen Sie die Nachkommen für drei Tage in Erwachsene bei 20 ° C wachsen.
4. Chemosensorischer Präferenzassay
- Am Tag vor dem Experiment werden 35 mm NGM-Agar-Testplatten hergestellt.
- 250 ml NGM-Agar vorbereiten (siehe Abschnitt 5 für Rezept).
- Vereinbaren Sie achtundzwanzig leere 35-mm-Platten in Stapeln von fünf oder weniger auf einer Wohnung suRief Füllen Sie jede Testplatte mit 5 ml NGM-Agar. Lassen Sie die Assay-Platten aufrecht mit Deckel auf, über Nacht bei Raumtemperatur trocknen.
ANMERKUNG: Als Faustregel gilt eine zusätzliche Testplatte für jede zu behandelnde Behandlung oder Genotyp im Falle von Eventualitäten.
- Am Tag des Experiments, schalten Sie die Hintergrundbeleuchtung, booten Sie den Computer, und starten Sie die Mikroskop-Kamera Video-Capture-Software.
- Schließen Sie eine Mikroskopkamera an den Computer an und stellen Sie die Videoaufzeichnungseinstellungen ein.
- Klicken Sie auf die nummerierte Kamera-Miniaturansicht am oberen Rand des Software-Fensters, um das Live-Feed der Kamera anzuzeigen.
- Ziehen Sie das 'Video Format' Menü in der oberen linken Ecke des Kameraeinzugs und wählen Sie 'MJPG 1280 x 1024'. Ziehen Sie das 'Ordner' Menü neben dem Menü 'Video Format' und wählen Sie einen Ordner, in dem die Videodateien gespeichert werden sollen.
- Klicken Sie auf das Symbol 'Auto Belichtung' oben rechtsDen Kamera-Feed und schalte die automatische Belichtung aus. Klicken Sie auf das Symbol 'LED' rechts neben dem 'Auto Exposure' Symbol, um die eingebauten Mikroskop-LEDs zu deaktivieren. Klicken Sie auf das nebenstehende Symbol 'Einstellungen': Wählen Sie 'Monochrom', maximieren Sie 'Kontrast' und stellen Sie 'Helligkeit' ein, bis die Würmer vom Hintergrund getrennt sind.
- Erfassen von Kalibrierungsvideos.
- Richten Sie eine Lösungs-Platzierungsvorlage auf eine Bühnenplatten-Ausrichtungsschablone aus ( Abbildung 2A ). Klicken Sie auf das 'Time-Lapsed Video' Aufnahmesymbol auf der linken Seite des Kamera-Feeds und geben Sie '5' s für Dauer und '1' s für Intervall, um ein 5 s Video auf 1 Frame / s aufzunehmen. Klicken Sie auf 'Start', um die Videoaufnahme zu starten.
- Wiederholen Sie die Schritte in 4.3 und 4.4 für die beiden anderen Mikroskopkameras.
- Entfernen Sie die Lösungsvorlage aus der Kammer.
- Würmer dreimal mit Waschpuffer waschen, um das Essen zu entfernen.
- Verwenden Sie eine 5-ml-Glaspipette, um 1,2 ml NGM-Puffer auf eine Platte von synchronisierten Schnecken zu geben und die Platte vorsichtig zu bewegen, um die Würmer in den Puffer zu verschieben. Pipettieren Sie den Puffer von der Platte und geben Sie Würmer in Puffer in ein sauberes Mikrozentrifugenröhrchen.
HINWEIS: Würmer sind empfindlich gegenüber Abweichungen von ihrer kultivierenden Agarsalzkonzentration 14 . Zur Minimierung von Änderungen der Agar-Salz-Konzentration nach der Wurm-Platzierung wird mit NGM-Puffer für den Waschprozess empfohlen (siehe Abschnitt 5 für Rezept). Verwenden Sie keine Plastikpipetten, um die Schnecken von den Platten zu entfernen, da die Würmer an den Seiten haften. Bereiten Sie eine äquivalente Anzahl von Rohren vor, da die Anzahl der Testplatten gleichzeitig ausgeführt wird. - Lassen Sie die drei Röhrchen für 1-2 min stehen, damit sich die Würmer nach unten absetzen können. Verwenden Sie eine Plastikpipettenspitze, um so viel Waschpuffer aus den Röhrchen wie möglich zu entfernen, ohne das Pellet der Aggregat zu störenEd Würmer an der Unterseite der Rohre. Nachfüllen der Röhrchen mit je 1 ml sauberem NGM-Puffer.
- Wiederholen Sie Schritt 4.7.2 einmal.
- Verwenden Sie eine 5-ml-Glaspipette, um 1,2 ml NGM-Puffer auf eine Platte von synchronisierten Schnecken zu geben und die Platte vorsichtig zu bewegen, um die Würmer in den Puffer zu verschieben. Pipettieren Sie den Puffer von der Platte und geben Sie Würmer in Puffer in ein sauberes Mikrozentrifugenröhrchen.
- Füge 10 mM CuCl 2 - und M13-Pufferlösungen zu Testplatten hinzu (siehe Abschnitt 5 für Rezepte).
- Tape eine Lösung-Platzierung Vorlage auf der Bühne des Sezier-Mikroskops.
- Legen Sie einen Streifen doppelseitigen Klebebandes auf beiden Seiten einer Plattenausrichtungsschablone. Stellen Sie sicher, dass das Band mit dem Plattenumfangskreis überlappt, aber nicht den Aufzeichnungsbereich von Interesse in der Mitte der Schablone verschließt.
- Richten Sie den Umfang der Testplatte mit dem Kreis auf der Plattenausrichtungsschablone aus und drücken Sie nach unten, bis die Schablone an der Unterseite der Platte haftet. Richten Sie die Testschablonen-Nummernmarkierungen mit den Lösungs-Platzierungs-Schablonenmarkierungen auf dem Sektionsmikroskop aus.
- Verwenden Sie eine P2-Pipette und eine Plastikspitze, um 1 μl des M13-Puffers jeweils in den Quadranten 1 und 4 ( Abbildung 2A). Verwenden Sie eine neue Spitze, um 1 μl 10 mM CuCl 2 -Lösung jeweils in den Quadranten 2 und 3 zu platzieren ( Abbildung 2A ).
- Wiederholen Sie die Schritte 4.8.2-4.8.4 für die beiden anderen Testplatten.
- Sobald die Lösungsabfälle vollständig in den Agar absorbiert worden sind, verwenden Sie eine Glaspasteurpipette, um gewaschene Würmer von jedem Mikrozentrifugenröhrchen auf die entsprechende Testplatte zu übertragen.
- Legen Sie einen Tropfen Würmer jeweils auf den Bereich oberhalb und unterhalb der kreisförmigen behandelten Region. Falten Sie ein Gewebe viermal und verwenden Sie die stumpfe Kante, um überschüssigen Waschpuffer auf allen Testplatten zu absorbieren.
- So ordnen Sie die drei Testplatten unter den Mikroskopkameras in der Verhaltenskammer ordnungsgemäß an, indem Sie die Zahlen an den Schablonenecken ausrichten. Warten Sie 2-3 Minuten, damit die Würmer sich an die Testplatten anpassen können.
HINWEIS: Vergewissern Sie sich, dass die Klappentürklappe vor dem Beginn der Videoaufnahme im nächsten Schritt geschlossen ist. - Klicken Sie auf das 'Time-Lapsed Video' Aufnahmesymbol auf der linken Seite des Kamera-Feeds und geben Sie "10" min für die Dauer und '1' s für das Intervall ein, um ein 10-minütiges Video mit 1 Bild pro Sekunde aufzunehmen. Klicken Sie auf 'Start', um die Videoaufnahme zu starten. Nachdem die Videos aufgenommen und gespeichert wurden, entfernen Sie die Testplatten aus der Kammer.
- Wiederholen Sie die Schritte 4.7-4.12 für die nächste Runde der Testplatten. Erwerben Sie mindestens sechs Wiederholungen oder zwei Runden der Aufnahme für jede Behandlung oder Genotyp.
5. Reagenzvorbereitung
- NGM-Agar und Puffer vorbereiten
- In einer 1 l Glasflasche werden 1,5 g Natriumchlorid, 8,5 g Agar und 1,25 g Pepton zugegeben. Füge 500 ml destilliertes Wasser und einen Rührstab zur Flasche hinzu. Autoklavenflasche mit Inhalt.
- Legen Sie die Flasche auf eine Rührplatte und schalten Sie die Rührfunktion ein.
- In der Reihenfolge mit steriler Technik: 0,5 ml 5 mg / ml Cholesterin, 0,5 ml 1 M CalciumChlorid, 0,5 ml 1 M Magnesiumsulfat und 12,5 ml 1 M Kaliumphosphat gegeben.
- Wiederholen Sie die Schritte 5.1.1 bis 5.1.2, um NGM-Puffer zu machen, aber lassen Sie Agar und Pepton in Schritt 5.1.1 aus.
- LB-Brühe vorbereiten
- In einer 1 l Glasflasche werden 5 g Trypton, 2,5 g Hefeextrakt, 2,5 g Natriumchlorid, 500 ml destilliertes Wasser und 0,5 ml 1 N Natriumhydroxid zugegeben. Autoklavenflasche mit Inhalt.
- M13-Puffer vorbereiten
- In einer 1 l Glasflasche werden 1,817 g Tris, 2,922 g Natriumchlorid, 0,373 g Kaliumchlorid und 500 ml destilliertes Wasser zugegeben. Autoklav die Flasche mit Inhalt.
- Kochchlorid (CuCl 2 ) -Lösung zubereiten.
- 0,134 g CuCl 2 abwiegen. Hinzufügen gelöster Stoff zu 10 ml M13 - Puffer in einem 15-ml - Kunststoffrohr 100 mM CuCl 2 - Stammlösung zu machen. Umkehren Sie den Plastikschlauch, bis der gesamte gelöste Stoff disso istLved
- Verwenden Sie eine Spritze und 0,2 μm Membranfilter, um die 100 mM CuCl 2 -Lösung in ein sauberes 15 ml Plastikrohr zu filtrieren.
- Um 10 mM CuCl 2 -Lösung zu bilden, werden 900 & mgr; l M13-Puffer und 100 & mgr; l 100 mM CuCl 2 -Trägerlösung zu einem Mikrozentrifugenröhrchen gegeben. Das Mikrozentrifugenröhrchen umkehren, um gut zu mischen.
6. Videoanalyse
- Download Python 3 (https://www.python.org/downloads/) und die OpenCV Softwarebibliothek (http://opencv.org/downloads.html).
- Laden Sie die drei Python-Skripte zur Analyse herunter (https://github.com/WormLabCaltech/ResidentWorm).
HINWEIS: Stellen Sie sicher, dass alle Videodateien, die verwendet werden sollen, im mp4-Format sind, bevor Sie fortfahren. - Um die Funktion und die Parameterbeschreibungen anzuzeigen, geben Sie 'help (enter function name)' in die Konsole ein und drücken Sie Enter. Geben Sie beispielsweise 'help (calibration)' ein und drücken Sie Enter.
- Führen Sie die Kalibrierfunktion ausMit Eingabeparametern, um die Videoregionen von Interesse (ROI) zu definieren.
- Geben Sie den Dateinamen des in Abschnitt 4 aufgenommenen Kalibriervideos für die Variable 'mp4filename' ein. Geben Sie Anführungszeichen bei der Eingabe des Dateinamens ein.
- Beginnen Sie mit den Werten 600 und 360 für die Variablen 'Q * x' und 'Q * y'. * Geben Sie die Quadrantennummern 1 bis 4 ein. Beginnen Sie mit dem Wert 310 für die Variable 'rad'. Passen Sie die Variablenwerte an, bis die ROI-Masken mit den Quadranten-Konturen auf der Vorlage übereinstimmen.
- Notieren Sie die Gesamtzahl der Pixel in jedem ROI, die bei der Ausführung dieser Funktion in der Konsole gedruckt wird. Geben Sie diesen Wert für den Parameter 'ROI_size' in die Funktion preference_index ein.
- Führen Sie die Variable threshold_constant aus, um die entsprechende Schwellenwertkonstante zu bestimmen. Den "konstanten" Wert anpassen, bis die Würmer (weiß) deutlich zu sehen sind und im Hintergrund minimales Salz-und-Pfeffer-Rauschen (schwarz).
- Führen Sie die Funktion preference_index aus, um ein csv-Datenblatt zu erzeugen, den Präferenzindex des Videos und den dazugehörigen Wurmbelegungsplan.
- Verwenden Sie aus den Schritten 6.4 und 6.5 als Eingabeparameter für die Funktion preference_index die Werte 'Q * x', 'Q * y', 'rad', 'ROI_size' und 'constant'.
HINWEIS: Für jeden Videorahmen zählt die Funktion preference_index die Anzahl der Wurmpixel in jedem ROI und berechnet den Prozentsatz der Wurmpixel aus der Gesamtzahl der ROI-Pixel. Die Funktion erzeugt dann einen Präferenzindexwert für jeden Videorahmen mit der Formel:
HINWEIS: Sobald das Programm alle Frames im Video analysiert hat, wird für das Video ein durchschnittlicher Präferenzindexwert erzeugt. Ein Wurmbelegungsplot mit dem Präferenzindex des Videos, der oben gedruckt wurde, sowie ein csv-Datenblatt mitWurmpixel, prozentuale Wurmbelegungswerte und der Präferenzindex für jeden Videorahmen werden nach dem Ende des Programms in den dafür vorgesehenen Ordner gespeichert.
- Verwenden Sie aus den Schritten 6.4 und 6.5 als Eingabeparameter für die Funktion preference_index die Werte 'Q * x', 'Q * y', 'rad', 'ROI_size' und 'constant'.
Ergebnisse
Fig. 3A zeigt die Präferenzindexwerte, die für verschiedene Genotyp- und Behandlungspaarungen erhalten wurden. Ein Präferenzindexwert von 1 zeigt eine starke Anziehung der in dem experimentellen ROI platzierten Lösung an, während ein Präferenzindexwert von -1 eine starke Abstoßung anzeigt. Ein Präferenzindex von 0,02 wurde erhalten, wenn die M13-Pufferlösung sowohl in der Kontroll- als auch in den experimentellen ROIs platziert wurde, was zeigt, dass es keine räumliche Vorspannung gegenüber entweder ROI gibt. N2-Würmer vermieden stark die Kupferionen, was zu einem Präferenzindex von -0,67 führt, was frühere Befunde bestätigt, dass Kupferionen ein starker Repellant sind ( Ergänzungsfilm 1 ) 4 . Osm-3- Mutanten, denen die korrekte Bildung der distalen Segmente der sensorischen Zilien fehlt, zeigte eine signifikant verminderte Vermeidung von Kupferionen (PI = -0,19) 15 . Ocr-2- Mutanten, die de sind Fective in vielen ASH-vermittelten nozizeptiven Reaktionen einschließlich Kupfervermeidung, zeigen auch deutlich verminderte Vermeidung und sogar einige leichte Anziehung zu Kupferionen (PI = 0,19) ( Ergänzungsfilm 2 ) 16 .
Fig. 3B zeigt repräsentative Wurmbelegungsdiagramme, die die Dichte der Würmer in der Steuerung gegenüber den experimentellen ROIs im Laufe der Zeit in jedem Video anzeigen. Je dunkler die Farbe des Plotbereichs ist, desto größer ist die Anzahl der Wurmpixel im ROI. Die Belegungsdarstellung für N2-Würmer, die mit der M13-Puffersteuerung behandelt wurden, zeigt, dass die Anzahl der Würmer in beiden ROIs während des gesamten Assays ähnlich bleibt. Allerdings zeigt die Belegungsdarstellung für N2-Würmer, die mit Kupferionen behandelt wurden, an, dass die Würmer den experimentellen ROI während des gesamten Assays stark und konsequent vermeiden.
Gimg "src =" / files / ftp_upload / 55963 / 55963fig1.jpg "/>
Abbildung 1: Foto- und Schematische Darstellung des Verhaltenskammer-Designs. ( A ) Vorderansicht des Verhaltenskammeraufbaus (links) und entsprechende schematische Darstellung des Kammerrahmens (rechts). Opake Polyesterfolien umschließen die Kammer auf allen Flächen mit Ausnahme der Bodenfläche, die Licht durch die Infrarot-Hintergrundbeleuchtung ermöglicht. Die Zahlen 1, 2 und 3 entsprechen den Extrusionsschichten in (B). ( B ) Schema der Draufsicht auf Extrusionsschichten, die den Verhaltenskammerrahmen umfassen. Dies schließt die obere Schicht (1), die mittlere Kamerahalterungs-Montageschicht (2) und die untere Stufenschicht (3) ein. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2: Lösung-Platzierung und Plate-alignment-Vorlagen. ( A ) Die Lösung-Platzierungs-Vorlage hat vier Quadranten und Zahl-Ausrichtungsmarkierungen. Die Kontrolllösung wird in den oberen linken und unteren rechten Quadranten platziert, während die experimentelle Lösung in den oberen rechten und unteren linken Quadranten platziert wird. ( B ) Die Plattenausrichtungsschablone hat nur Nummernausrichtungsmarkierungen, um die Okklusion der Würmer im Sichtfeld während der Videoaufzeichnung und -analyse zu minimieren. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
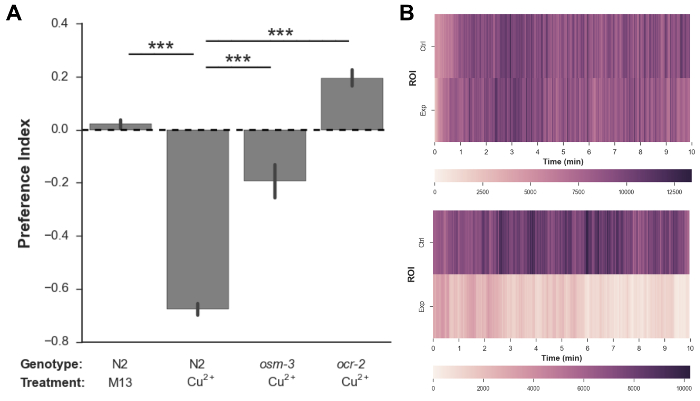
Abbildung 3: Beispieldaten, die mit diesem Assay gesammelt wurden. ( A ) Präferenzindex (PI) -Werte für Wildtyp-N2 und Mutanten C. elegans M> als Reaktion auf M13-Puffer und 10 mM CuCl 2 . N2-Würmer zeigten keine Präferenz zwischen Kontroll- und experimentellen ROIs, wenn die M13-Kontrolllösung in beide ROIs platziert wurde, aber der experimentelle ROI stark vermieden wurde, wenn Kupferionen in sie gelegt wurden (PI = 0,02 bzw. -0,67). Osm-3 (p802) -Mutanten und ocr-2 (ak47) -Mutanten zeigten eine signifikant verminderte Vermeidung von Kupferionen im Vergleich zu N2 (PI = -0,1 bzw. 0,2). N = 6 Assays für jede Genotyp-Behandlungspaarung,> 360 Würmer pro Assay, Fehlerbalken zeigen ± 1 SEM, *** p <0,001, Einweg-ANOVA, gefolgt von post-hoc Tukey Ehrlich signifikanten (HSD) Test. ( B ) Repräsentative Wurmbelegungsplots für N2-Würmer mit M13-Puffer in beiden ROIs (Top) und N2-Würmern mit M13-Puffer im Kontroll-ROI und Kupfer-Ionen im experimentellen ROI (unten). Die Farbskala unterhalb jedes Belegungsplots repräsentiert die Anzahl der Wurmpixel.Pload / 55963 / 55963fig3large.jpg "target =" _ blank "> Bitte hier klicken um eine größere Version dieser Figur zu sehen.
Ergänzungsfilm 1: Verhaltensreaktion von N2-Würmern auf 10 mM Kupferchlorid. Würmer werden von den Kontrollquadranten mit M13-Puffer (oben links und unten rechts) angezogen, aber vermeiden die Quadranten, die Kupferionen enthalten, die in M13-Puffer (oben rechts und unten links) aufgelöst sind. Video wurde bei 1 Frame pro Sekunde aufgezeichnet und 15x beschleunigt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsfilm 2: Verhaltensreaktion von ocr-2 (ak47) Würmer bis 10 mM Kupferchlorid . Die Würmer wandern in gleichem Maße in den Kontrollquadranten mit M13-Puffer (oben links und unten rechts) und dem QuadrantenS enthaltende Kupferionen, die in M13-Puffer (oben rechts und unten links) während der Aufzeichnungsdauer aufgelöst wurden. Die Mutanten zeigen eine leichte Präferenz für die Quadranten, die Kupferionen zu Beginn der Aufzeichnung enthalten. Video wurde bei 1 Frame pro Sekunde aufgezeichnet und 15x beschleunigt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei: Solution-Placement und Plate-alignment Vorlagen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Ein kritischer Schritt in dem Protokoll ist sicherzustellen, dass die Testplatten eine konsistente Trockenheit über verschiedene experimentelle Tage haben. Unterschiedliche Trockenheitsniveaus führen zu unterschiedlichen Diffusionsraten der Lösung in den Agar und damit zu Variationen des Verhaltens. So sollten die Testplatten immer am Nachmittag vor den Experimenten frisch gemacht werden. Die Anzahl der getesteten Würmer pro Assay sollte auch für einen leichten Vergleich zwischen Behandlungen geregelt werden. Als Referenz, ein Wildtyp-Wurm legt 4-10 Eier / h im Durchschnitt ergibt> 360 Würmer pro Assay, wenn das Wurm-Synchronisationsprotokoll oben folgt 17 . Wenn bestimmte Mutanten-Stämme Ei-Verlegung defekt sind, wählen Sie mehr gravid Erwachsene Würmer für Ei-Verlegung, um die Ziel-Zahl der Nachkommen zu erreichen. Ein weiterer wichtiger Schritt im Protokoll ist es, die Würmer sanft während des Waschprozesses und der Wurmplatzierung zu behandeln. Würmer sind empfindlich gegenüber mechanischen Reizen, die Stressreaktionen wie S Umkehrungen und Eiablage Inhibition 18 . Weiterhin sollte darauf geachtet werden, den ROI genau zu definieren und den optimalen Schwellenwertkonstantenwert für bestimmte Lichtverhältnisse zu bestimmen, bevor die Videoanalyse durchgeführt wird. Es wird auch empfohlen, dass die Kalibrier- und Schwellwertprozesse wiederholt werden, wenn eine lange Zeitspanne seit dem letzten Versuch verstrichen ist.
Eine Beschränkung dieser Methode ist, dass es nicht geeignet ist, kleine Wurmpopulationen zu untersuchen. Wenn jedoch die geeigneten Kontrollen zur Bestimmung des Einflusses des Vorhandenseins von Nahrungsmitteln auf das sensorische Verhalten durchgeführt werden, dann ist die Verwendung von Nahrungsmitteln, um die räumliche Erkundungsstelle der Würmer zu beschränken, wie bei dem Retentionsassay, auch bei dieser Einrichtung möglich. Darüber hinaus ist diese Methode nicht für das Studium der Stimulus-Gradienten-Navigation aufgrund der engen Nähe und geringe Mengen der Kontrolle und experimentelle Lösung Tropfen verwendet.
E_content "> In der Zukunft kann die Programmiersoftware, die eine Mehrfach-Wurmverfolgung und eine Single-Wurm-Merkmalsextraktion ermöglicht, in dieses System integriert werden. 19 , 20. Die Aufzeichnung von subtilen Verhaltensparametern des einzelnen Wurmverhaltens wie Umkehrgeschwindigkeiten und Amplituden von Körperbiegungen wird gegeben Ein detaillierteres Bild des chemosensorischen Verhaltens eines einzelnen Wurms im Kontext eines Populations-basierten Assays. Der Assay kann auch modifiziert werden, um die Gewöhnung zu untersuchen, indem er Löcher durch den ROI mit Spritzen-Nadeln mit der entsprechenden Maßgrße bohrt und die Löcher mit Agar infundiert füllt Mit der experimentellen Verbindung oder Kontrollpuffer, was eine gleichmäßigere Oberflächenkonzentration der Verbindung über einen längeren Zeitraum der Aufzeichnungszeit sicherstellt, wie es bei Gewöhnungstests erforderlich ist. Eine weitere mögliche Anwendung dieser Methode besteht darin, vergleichende Verhaltensstudien über verschiedene Nematodenarten durchzuführen. Darüber hinaus ist die VerhaltenskammerKann auf vielfältige Weise modifiziert werden, um Verhaltensreaktionen auf multimodale Reize zu untersuchen. Für optogenetische Anwendungen können neben der Kamerahalterung hochintensive LED-Arrays angebracht werden, um während des Assays selektiv Neurone zu aktivieren. Heizelemente, Kühlsysteme und Temperatursensoren können auch dem Setup hinzugefügt werden, um die Auswirkungen der Temperatur auf sensorische Verhaltensweisen zu untersuchen. Darüber hinaus können Geruchsabgabesysteme innerhalb der Kammer installiert werden, um Wechselwirkungen zwischen geruchs- und chemosensorischen Modalitäten zu untersuchen.Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Einige Stämme wurden von der Caenorhabditis Genetics Center (CGC), die von NIH Office of Research Infrastructure Programme (P40 OD010440) finanziert wird, zur Verfügung gestellt. Diese Arbeit wird vom Howard Hughes Medical Institute unterstützt, mit dem PWS ein Ermittler ist.
Materialien
| Name | Company | Catalog Number | Comments |
| Aluminum T-slotted framing extrusions | McMaster-Carr | 47065T101 | Single profile, 1" size, solid |
| Brackets | McMaster-Carr | 47065T236 | 1" long for 1" high single profile extrusions |
| Compact end-feed fasteners | McMaster-Carr | 47065T139 | 1" (single), pack of 4 |
| Twist-in solid panel holders | McMaster-Carr | 47065T251 | For 1" high extrusion |
| Plastic end caps | McMaster-Carr | 47065T91 | For 1" high extrusion |
| Optically clear cast acrylic sheet | McMaster-Carr | 8560K211 | 3/16" thick, 12" x 12" |
| Vinyl-coated polyester fabric | McMaster-Carr | 88505K57 | 0.027" thick, 61" width, black |
| Brass grommets | McMaster-Carr | 9604K22 | Trade size 0, 0.545" outer diameter |
| Steel washers | McMaster-Carr | 90107A029 | 1/4" screw size |
| Rounded head screws | McMaster-Carr | 90272A546 | 1/4" - 20 thread size, 1 - 1/2" long |
| Standard operating backlight | Smart Vision Lights | See local vendor | 8" x 8", infrared 850 nm |
| IVP-C1 Variable Control Pot | Smart Vision Lights | See local vendor | |
| T1 Power Supply | Smart Vision Lights | See local vendor | |
| Dino lite Pro AM4113T | Dino-Lite Digital Microscope | See local vendor | |
| MS09B microscope stand | Dino-Lite Digital Microscope | See local vendor |
Referenzen
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philos Trans R Soc Lond B Biol Sci. 314, 1-340 (1986).
- Bargmann, C. I., Horvitz, H. R. Chemosensory neurons with overlapping functions direct chemotaxis to multiple chemicals in C. elegans. Neuron. 7 (5), 729-742 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Hilliard, M. A., Bargmann, C. I., Bazzicalupo, P. C. elegans responds to chemical repellents by integrating sensory inputs from the head and the tail. Curr Biol. 12 (9), 730-734 (2002).
- Hilliard, M. A., Bergamasco, C., Arbucci, S., Plasterk, R. H., Bazzicalupo, P. Worms taste bitter: ASH neurons, QUI-1, GPA-3 and ODR-3 mediate quinine avoidance in Caenorhabditis elegans. EMBO J. 23 (5), 1101-1111 (2004).
- Zariwala, H. A., Miller, A. C., Faumont, S., Lockery, S. R. Step response analysis of thermotaxis in Caenorhabditis elegans. J Neurosci. 23 (10), 4369-4377 (2003).
- Ward, S. Chemotaxis by the nematode Caenorhabditis elegans: identification of attractants and analysis of the response by use of mutants. Proc Natl Acad Sci U S A. 70 (3), 817-821 (1973).
- Wicks, S. R., de Vries, C. J., van Luenen, H. G., Plasterk, R. H. CHE-3, a cytosolic dynein heavy chain, is required for sensory cilia structure and function in Caenorhabditis elegans. Dev Biol. 221 (2), 295-307 (2000).
- Jansen, G., Weinkove, D., Plasterk, R. H. A. The G-protein subunit gpc-1 of the nematode C. elegans is involved in taste adaptation. EMBO J. 21 (5), 986-994 (2002).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Choe, A., et al. Ascaroside signaling is widely conserved among nematodes. Curr Biol. 22 (9), 772-780 (2012).
- Ezcurra, M., Tanizawa, Y., Swoboda, P., Schafer, W. R. Food sensitizes C. elegans avoidance behaviours through acute dopamine signalling. EMBO J. 30 (6), 1110-1122 (2011).
- Ward, A., Liu, J., Feng, Z., Xu, X. Z. S. Light-sensitive neurons and channels mediate phototaxis in C. elegans. Nat Neurosci. 11 (8), 916-922 (2008).
- Kunitomo, H., et al. Concentration memory-dependent synaptic plasticity of a taste circuit regulates salt concentration chemotaxis in Caenorhabditis elegans. Nat Commun. 4, 2210(2013).
- Snow, J. J., et al. Two anterograde intraflagellar transport motors cooperate to build sensory cilia on C. elegans neurons. Nat Cell Biol. 6 (11), 1109-1113 (2004).
- Tobin, D. M., et al. Combinatorial expression of TRPV channel proteins defines their sensory functions and subcellular localization in C. elegans neurons. Neuron. 35 (2), 307-318 (2002).
- Waggoner, L. E., Zhou, G. T., Schafer, R. W., Schafer, W. R. Control of alternative behavioral states by serotonin in Caenorhabditis elegans. Neuron. 21 (1), 203-214 (1998).
- Sawin, E. R. Genetic and cellular analysis of modulated behaviors in Caenorhabditis elegans. , M.I.T. Cambridge, MA. (1996).
- Ramot, D., Johnson, B. E., Berry, T. L., Carnell, L., Goodman, M. B. The parallel worm tracker: A platform for measuring average speed and drug-induced paralysis in nematodes. PLoS One. 3 (5), e2208(2008).
- Swierczek, N. A., Giles, A. C., Rankin, C. H., Kerr, R. A. High-throughput behavioral analysis in C. elegans. Nat Methods. 8 (7), 592-598 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten