Method Article
Оценка процедуры выполнения пробуждения цистометрии в мышиной модели
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом исследовании описываются хирургические процедуры и экспериментальные методы для проведения активной цистометрии у свободно движущейся мыши. Кроме того, он предоставляет экспериментальные данные, подтверждающие его оптимизацию и стандартизацию.
Аннотация
Цистометрия с активным заполнением была использована в течение длительного времени для оценки функции мочевого пузыря у свободно перемещающихся мышей, однако конкретные методы, используемые в разных лабораториях, различаются. Цель этого исследования состояла в том, чтобы описать микрохирургическую процедуру, используемую для имплантации внутрипузырной трубки, и экспериментальную методику для регистрации давления мочевого пузыря в бодрствующей свободно движущейся мыши. Кроме того, экспериментальные данные представлены, чтобы показать, как хирургия, а также тип и размер трубки влияют на функцию нижних мочевых путей и чувствительность к записи. Влияние диаметра трубы на запись давления оценивали как в полиэтиленовых, так и в полиуретановых трубах с различными внутренними диаметрами. Впоследствии лучшая пробирка из обоих материалов была хирургически имплантирована в купол мочевого пузыря самцов мышей C57BL / 6. Частота двенадцатичасовой ночной мочеиспускания регистрировалась у здоровых, интактных животных и животных через 2, 3, 5 и 7 дней после операции. При уборке, пузыри wОценивались по признакам набухания с использованием валового наблюдения и впоследствии обрабатывались для патологического анализа. Наибольшая набухаемость мочевого пузыря наблюдалась на 2-й и 3-й день, что коррелировало с данными по поведенческому мочеиспусканию, показывающими значительную нарушения функции мочевого пузыря. К 5 дню гистология мочевого пузыря и частота мочеиспускания нормализовались. Основываясь на литературе и доказательствах, полученных в наших исследованиях, мы предлагаем следующие шаги для регистрации in vivo внутрипузырного давления и объема мочеиспускания у бодрствующей мыши: 1) выполнить операцию с использованием операционного микроскопа и микрохирургических инструментов; 2) использовать полиэтилен-10 Чтобы уменьшить артефакты движения, и 3) выполнить цистометрию на 5-й день после операции, когда разбухание пузыря разрешится.
Введение
Заполнение цистометрии (ФК) является диагностическим методом, который включает в себя размещение катетера в мочевом пузыре для регистрации давления во время медленной наполнения мочевого пузыря. Впервые введенный в 1927 году в качестве клинического диагностического метода для оценки функции нижних мочевых путей, он по-прежнему широко используется. 1 В исследованиях применение ФК может быть использовано для проверки функции мочевого пузыря у здоровых и больных животных моделей и для изучения эффектов фармакологических агентов. Грызунные животные модели обычно используются для исследования функции нижних мочевых путей. 2 В этой группе млекопитающих FC был впервые разработан для использования на крысах. 3 Здесь методика имплантации трубки в мочевой пузырь и выполнения ФК была хорошо описана и использована многими исследователями с приемлемым уровнем воспроизводимости. 4 Наличие трансгенных и выбитых штаммов делает мышей ценным видом для многочисленных исследовательских областей,Включая область дисфункции нижних мочевых путей. Методика, используемая для проведения мышиной цистометрии, значительно варьирует между лабораториями, что затрудняет сравнение результатов. 5
По сравнению с образцами ex vivo ФК сохраняет анатомию нижних мочевых путей, что позволяет координировать функцию между мочевым пузырем и его выходом во время фазы хранения и опорожнения цикла мочеиспускания. Предыдущие исследования показывают, что многочисленные, часто используемые анестетики подавляют сокращение мочеиспускания. Агенты, которые сохраняют сокращение гладкой мускулатуры мочевого пузыря (уретан, α-хлоралоза, кетамин и ксилазин), позволяя животному micturate, все еще значительно уменьшают функциональную емкость мочевого пузыря и подавляют нейротрансмиссию. 6 , 7 , 8 , 9 Хотя технически более сложная задача, ФК выполняется в awЖивотные, находящиеся в движении, сохраняют функциональную целостность рефлекса мочеиспускания.
На функции нижних мочевых путей влияют несколько факторов, включая послеоперационное опухание стенки мочевого пузыря, стресс из-за боли и дискомфорта и влияние окружающей среды. Используя хирургическую технику, которая минимизирует повреждение ткани во время имплантации трубки и методов регистрации, которые уменьшают движение трубки, одновременно позволяя животному свободно перемещаться, необходимы для получения точных и воспроизводимых записей.
Если выполнено адекватно, in vivo FC в свободно движущихся животных может предоставить данные, которые надежно отражают физиологическую функцию мочевого пузыря. 10 FC в свободно движущихся животных могут предоставить данные по следующим параметрам; Базальное или базовое давление: Минимальное давление между двумя мочеиспусканиями. Давление перетекания: среднее давление между двумя мочеиспусканиями. Пороговое давление: внутрипузырное давление immНепосредственно перед мочеиспусканием. Максимальное давление: Максимальное давление в мочевом пузыре во время цикла мочеиспускания. Спонтанная активность (или среднее колебательное давление): давление перетирания минус базальное давление. Невобождающиеся сокращения: увеличение внутрипузырного давления во время фазы заполнения, не связанное с выделением жидкости. Соответствие мочевого пузыря: емкость мочевого пузыря делится на пороговое давление минус базальное давление. Частота мочеиспускания: количество мочеиспусканий в единицу времени. Интервал между переменами: период между двумя максимальными давлениями опорожнения. Объем мочевого пузыря: Объем инфузии делится на количество мочеиспусканий. Ранее было опубликовано подробное описание этих параметров и стандартизированная терминология. 11
ФК может быть выполнена с использованием метода внутрипузырной инфузии с непрерывным или однократным циклом. Непрерывная цистометрия позволяет регистрировать несколько циклов мочеиспускания и выбирать репрезентативные данные на основеНа воспроизводимость. Его точность измерения емкости мочевого пузыря ограничена из-за неизвестного остаточного объема. Кроме того, сложно собирать маленькие свободные объемы (которые основаны на деформации и полу варьируют от 30 до 184 мкл) у свободно передвигающихся мышей. Использование этого метода для регистрации объема мочеиспускания является менее точным по сравнению с анестезированным препаратом, но оно превосходит его в том, что оно позволяет избежать подавляющих эффектов анестетиков на функцию мочевого пузыря. Для оценки емкости мочевого пузыря следует использовать одноциклическую цистометрию. В этом методе мочевой пузырь опорожняется путем аспирации до инфузии, а емкость рассчитывается как функция скорости инфузии, умноженной на время до максимального давления.
Хотя была опубликована методика проведения цистометрии у мелких грызунов, она описала операцию, выполненную на крысе, и рекомендовала провести цистометрию мыши под анестезией уретаном. 10 Цель этого сообщения - tO описать как микрохирургические методы, используемые для имплантации внутрипузырной трубки в купол мочевого пузыря, так и экспериментальную установку, используемую для регистрации функции нижних мочевых путей, in vivo , при непрерывном заполнении мочевого пузыря и мочеиспускании в бодрствующей свободно движущейся мыши. Кроме того, были проведены эксперименты по определению длины, диаметра и материала труб, а также методологии проведения in vivo FC, влияющих на запись. Этот экспериментальный протокол суммирует ранее опубликованные методы и предлагает ряд модификаций, основанных на экспериментальных результатах.
протокол
Животные были размещены в Учреждении по уходу за животными Вермонтского университета в соответствии с установленными правилами. Все опыты на животных проводились в соответствии с руководством Национального института здравоохранения по уходу и использованию лабораторных животных.
1. Внутрипузырная имплантация трубки
- Подготовка труб и инструментов для хирургической процедуры
- Отрежьте 7-сантиметровый кусок трубки РЕ10, чтобы сделать катетер для имплантации.
- Создайте факел на одном конце трубы PE10, медленно продвигая конец к открытому пламени.
ПРИМЕЧАНИЕ: Быстро вытащите трубку, как только вспышка развивается. - Нанесите три капли универсального горячего клея, используя низкотемпературную установку на пистолет для клея, на 4,5, 5 и 5,5 см от расширяющегося конца снаружи трубки PE10. Это поможет закрепить трубу у спины животного. ( Рисунок 1 )
- Стерилизовать трубку, замачивая ее в 70%Этанола и затем промывают его стерильным 0,9% NaCl перед использованием. Оставьте заполненную трубу во избежание попадания пузырьков воздуха в систему.
- Создайте пробку 30 калибра, чтобы запечатать конец катетера PE10, отделив иглу 30 калибра от ступицы, вручную управляя проксимальным концом из стороны в сторону. Нанесите каплю горячего клея до конца. Убедитесь, что уплотнение является водонепроницаемым. ( Рисунок 2 )
- Используйте следующие микрохирургические инструменты: две пары изогнутых микрошагов Dumont # 7, две пары изогнутых микрошагов Dumont # 5, иглу 21 G, тончайший прямой гемостат, микроножницы, малые рассекающие ножницы и держатель микроигл.
- Перед началом процедуры стерилизовать все инструменты.
- Приготовление животного
- После обезболивания животного сначала сбривают нижнюю половину живота, затем поворачивают животное, склонное к бритью, и очищают область на верхней части спины 70% -ным спиртом, за которым следует бетадин, Применить ветеринарную мазь для глаз, чтобы предотвратить сухость. Затем используйте пару прямых тупых ножниц и пару изогнутых микроскопов Dumont # 7, чтобы сделать разрез кожи между лопатками длиной 1,5 см и поместить животное на спину поверх грелки (37 ° C), покрытой стерильными драпировками.
- Наконец, очистите живот спиртом и бетадином.
- Хирургическая процедура
ПРИМЕЧАНИЕ. Выполняйте все хирургические процедуры под операционным микроскопом с увеличением от 3,15 до 20 раз. После помещения животного на стерильные шторы, наденьте стерильные перчатки. Продолжайте использовать стерильные процедуры на протяжении всей операции.- Поместите животное в индукционную коробку и обезболивайте, используя 2% ингаляционного изофлурана с носителем кислорода (1 л / мин). Поддерживайте анестезию в течение всей процедуры, помещая головку животного в носовой конус и используя 2% ингаляционного изофлурана с носителем кислорода (1 л / мин). Начинайте операцию после получения негативаАтивный ответ от теста на носки.
- Используйте пару прямых, тупых ножниц и пару микрофонов прикуса Dumont # 7, чтобы сделать снизу на 1,5 см срединный разрез брюшной полости через кожу. Впоследствии, создайте соответствующий разрез через фасцию вдоль линии alba и мышцы, чтобы выставить купол и верхнюю половину мочевого пузыря. Избегайте травм мочевого пузыря, применяя направленное вверх сцепление с каждым слоем ткани, используя пару микрофонов с дугообразными микрофонами Dumont # 7. Держите брюшную внутренность от высыхания, добавляя капли теплого физиологического раствора.
- Поверните животное на бок, чтобы получить доступ к разрезу на затылке. Надавите узким кровоостанавливающим подкожно, хотя разрез. Подкожный канал должен начинаться на спине и продолжаться вдоль стороны.
- Как только наконечник инструмента достигнет дна грудной клетки, поверните наконечник к средней линии и внутри живота (при прокалывании мышц брюшной стенки будет небольшой поп), Продолжайте продвигать гемостат до тех пор, пока кончик не откроется при брюшном разрезе под мышечным слоем. ( Рисунок 3 )
- Возьмитесь за «нерасширенный» конец трубки с помощью гемостата и медленно втягивайте инструмент, вытягивая конец трубки через разрез на задней части шеи. Отрегулируйте расширяющийся конец трубки так, чтобы он лежал прямо над куполом мочевого пузыря.
- Сделайте свободную нить из мононити 6-0 (неабсорбируемую) и поместите ее поверх купола пузыря. Этот галстук будет использован позже для закрепления трубки в мочевом пузыре.
- Поместите небольшой рулон безворсовой ткани в живот и позади мочевого пузыря, чтобы помочь стабилизировать и поднять его.
- Подготовьте к вставке расширяющийся конец катетера PE10 в мочевой пузырь.
- В недоминирующей руке держите купол мочевого пузыря дугообразными микрошариками Dumont # 7 и держите это сцепление до тех пор, пока катетер не будет помещен в мочевой пузырь.
- Используйте иглу 21-го калибра tO сделать цистотомию на вершине купола. Аккуратно исследуйте цистотомию с помощью закрытой пары микровыступов # 5, чтобы убедиться, что катетер легко проходит через отверстие.
- Держа купол камеры в недоминирующей руке, поместите расширяющийся конец катетера PE10 в мочевой пузырь (подтолкните вспышку вниз к шейке мочевого пузыря, чтобы она не выскользнула во время фиксации).
- Свяжите 6-0 моноволоконный шов вокруг купола мочевого пузыря и трубки с галстуком, расположенным впереди трубки. Обязательно завяжите шов как можно выше на мочевом пузыре, чтобы избежать искусственного уменьшения емкости мочевого пузыря. ( Рисунок 4 )
- Альтернативно, закрепите катетер, используя шовный нить кошелька следующим образом. Сделайте свободный шов на кошельке на куполе мочевого пузыря с использованием мононити 6-0. Выполните шаги 1.3.8.1 - 1.3.8.3, чтобы выполнить цистотомию и вставить катетер. Закрепите трубку, завязав нить кошелька. ( Рисунок 5 )
- Протестируйте проходимость и герметичность трубки в мочевом пузыре, прикрепив к дальнему концу трубки шприц с инсулином объемом 0,5 мл с иглой 30-го калибра. Медленно заполните мочевой пузырь 0,1-0,2 мл 0,9% NaCl до тех пор, пока капля не появится в отверстии уретры, затем опорожните мочевой пузырь путем аспирации. Важно, чтобы мочевой пузырь мог быть заполнен и опорожнен.
- Если на куполе не образуются утечки, подтяните мочевой пузырь с помощью пары изогнутых микрошагов и осторожно потяните за шланг трубки, пока вспышка не будет опираться на внутреннюю часть купола камеры.
- Перед закрытием удалите небольшой рулон ткани и убедитесь, что мочевой пузырь находится в нормальном положении.
- Закройте брюшную стенку в два слоя (мышцы и кожа) с помощью 6-0 ходового шва. Предпочтительно аппроксимировать мышцу прямой мышцы живота путем наложения швов только на края передней брюшной фасции (передняя стенка прямой кишки).
- Чтобы закрепить трубу у животных назад, осторожно roЖивотное на живот. Вставьте подкожную часть металлического анкера в межкапиллярный разрез. ( Рис. 12 ) Используйте шов 6-0 для закрепления трубки и анкеровки, обведя их вертикальным швом матраца.
- Убедитесь, что пузырек клея остается выше и ниже кожи, чтобы предотвратить вытягивание трубки. Отрежьте трубку примерно на 2 см выше кожи.
- Аккуратно вставьте вилку 30-калибра (шаг 1.1.5) в конец трубки, чтобы предотвратить утечку мочи.
- Внесите 0,5 мл 0,9% NaCl подкожно для гидратации. Дайте послеоперационную анальгезию сразу после операции и поддерживайте ее в течение 48 часов.
- Поместите животное обратно в клетку, расположенную под инфракрасной лампой. Поддерживайте постоянное наблюдение до тех пор, пока животное не будет свободно передвигаться по клетке.
- Контролируйте животное ежедневно и дайте ему восстановиться в течение 5 дней перед записью.
2. Просыпающаяся кистаЗапись ометрия
- Подготовка программы регистрации, датчика давления и инфузионного насоса.
- Перед обезболиванием животного подключите инфузионный насос, датчик давления и поводок 22 G с помощью трубки PE50. ( Рисунок 6 )
- Откройте программу записи (см. Таблицу материалов для примера) на компьютере для калибровки давления в системе и подготовки к записи. Обязательно используйте те же настройки во время калибровки и записи.
- Заполните шприц объемом 20 мл 10 - 15 мл комнатной температуры 0.9% NaCl и загрузите в инфузионный насос. Запрограммируйте насос для инфузии со скоростью 0,6 мл / ч.
- Закрепите преобразователь давления на той же высоте, что и мочевой пузырь животного или дно камеры для записи.
- Присоедините вертлюг 22 калибра к концу датчика давления (PE50 - трубка - датчик давления для поворота)
ПРИМЕЧАНИЕ. Шарнир используется для предотвращения закручивания или изгиба трубкиЖивотное движется. - Продвиньте шприцевой насос для промывки 0.9% NaCl через систему. Перед калибровкой обязательно удалите все пузырьки воздуха.
- Когда программа записи запущена, используйте линейку для калибровки давления (см / Н 2 O). Медленно перемещайте конец троса PE50 с 0 до 30 см. При необходимости отрегулируйте нуль.
ПРИМЕЧАНИЕ: метка 0 см должна быть на той же высоте, что и пол записывающего каркаса и датчика давления.
- Приостановите поворот на 22 калибра над центром кассеты для записи. Убедитесь, что дно клетки позволяет моче попадать на собирающее устройство весов, расположенных под клеткой. Отрегулируйте высоту троса, чтобы мышка могла свободно передвигаться по клетке, не напрягая и не растягивая трубку. ( Рисунок 7 )
- По завершении проверьте, чтобы система и внешняя труба PE50 были заполнены 0.9% NaCl, и все пузырьки воздуха были удалены.
- приготовительныйЗапись животного для записи
- Обезболить животное 2% вдыхаемым изофлураном и поместить его на живот. Снимите пробку с 30 калибрами и вставьте трубку РЕ10 (катетер для мочевого пузыря) в конец троса PE50. Используйте горячий клей для образования водонепроницаемого уплотнения.
- Выключите анестезию и поместите животное в клетку для записи с параллельным проводом, что позволит мочи попасть прямо на сборное устройство, размещенное поверх аналитического баланса. ( Рисунок 7 )
- Запустите запись, как только животное окажется в клетке, но не начинайте настаивать. Контролируйте животное, пока оно полностью не восстановится после анестезии. Когда давление в мочевом пузыре стабилизируется, начните вводить 0,9% NaCl со скоростью 0,6 мл / ч.
ПРИМЕЧАНИЕ. Запишите в программу записи все изменения. Важно иметь отчет о том, когда начинается инфузия, прекращается или возникают нарушения. - Проверьте систему на наличие утечек и убедитесь, что животное легкоК пище и воде.
- Продолжайте запись в тихом помещении до тех пор, пока не будут получены три воспроизводимых цикла мочеиспускания.
ПРИМЕЧАНИЕ: Животное должно быть полностью спокойным во время записи. Предпочтительно использовать дистанционный видеомониторинг для наблюдения за поведением.
Результаты
Не было существенной разницы между материалами труб и диаметрами в консистенции повышения давления и падения в системе при окклюзии трубки. Послеоперационная внутрипузырная имплантация стенки мочевого пузыря была существенной как для полиэтиленовых (PE), так и для полиуретановых (PU) материалов. На 2-й день развилась тяжелая подслизистая опухоль. Он занимал половину поперечного сечения мочевого пузыря, что приводило к непроходимости просвета. На 5 день отек полностью разрешился, в результате чего подслизистые области проникли в воспалительные клетки, которые частично проникали в мышечную систему. На 7-й день воспалительная инфильтрация была значительно снижена, и гистология стенки мочевого пузыря вернулась к норме ( рис. 8 ). Наибольшая степень разбухания ткани, наблюдавшаяся на 2-й и 3-й день, коррелировала с данными по поведенческому мочеиспусканию, показывающими значительное нарушение функции мочевого пузыря ( рисунок 9 ). Частота опорожнения, нормированная po 5-й день операции.
Внутриплечевое давление в свободно движущейся мыши (с минимальными артефактами движения) характеризуется базовым давлением 10-15 см Н 2 О, которое может оставаться неизменным или постепенно увеличиваться не более чем на 10 см Н 2 О в течение цикла заполнения , Затем внезапное, пульсирующее повышение давления и затем падение во время мочеиспускания ( рис. 10 и 11 ).

Рисунок 1: Трубка PE10 для имплантации в мочевой пузырь. ( A ) 7 см кусок трубки РЕ10 с каплями горячего клея на 4,5, 5 и 5,5 см от расширяющегося конца. ( B и C ) Детальная картина, показывающая расширяющийся конец трубки (используется для закрепления трубки в мочевом пузыре).Es / ftp_upload / 55588 / 55588fig1large.jpg "target =" _ blank "> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Штекер для внешней части трубки PE10 для мочевого пузыря. Вилка изготовлена из иглы 30 G и горячего клея. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Ход трубки мочевого пузыря. Схематический чертеж, иллюстрирующий размещение трубки через брюшную полость и ее подкожный путь к затылку шеи. Нажмите здесь, чтобы посмотреть большеВерсии этого рисунка.
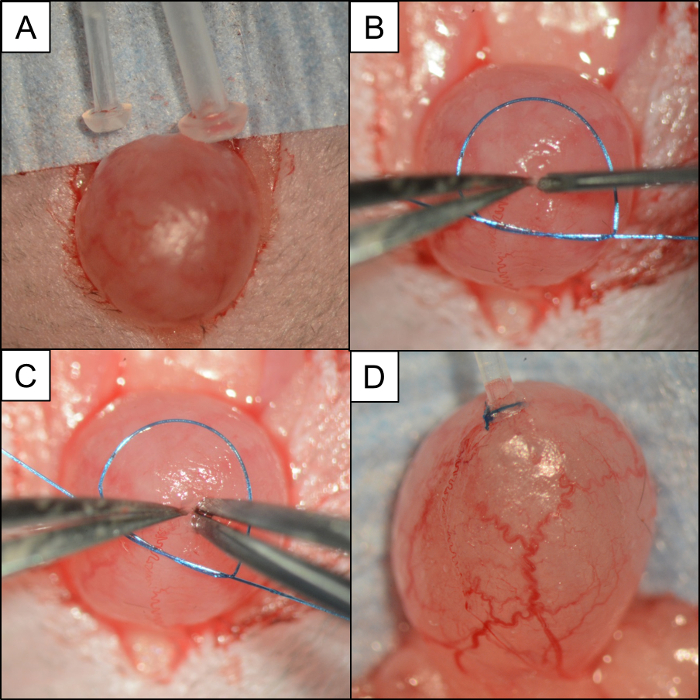
Рисунок 4: Сравнение мочевого пузыря / тюбинга и этапы, используемые для вставки и фиксации трубки с использованием шовной нити из моноволокон. Интраоперационные фотографии с изображением: ( A ) Изображение, сравнивающее PE50 и PE10 с мочевым пузырем мыши. ( B ) Небольшая петля из мононити 6-0, размещенная вокруг мочевого пузыря. Пара микроприцепов № 5 застегивает купол мочевого пузыря, в то время как иглы 21 G используются для проведения цистотомии. ( C ) Не выпуская купол мочевого пузыря, пара микроопераций # 5 в противоположной руке исследует отверстие перед вставкой катетера PE10. ( D ) катетер PE10, закрепленный в куполе мочевого пузыря с 6-0 моноволоконным швом. Пожалуйста, нажмите здесьДля просмотра увеличенной версии этого рисунка.

Рисунок 5: Шовный шнур кошелька может использоваться в качестве альтернативного метода крепления трубки в мочевом пузыре. ( A ) Шовный шнур кошелька в куполе мочевого пузыря. ( B ) Труба PE10, вставленная через центр кошелька. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Экспериментальная установка. Шприц, содержащий 0,9% NaCl в инфузионном насосе, последовательно соединенный с датчиком давления и внутрипузырным катетером. Экран компьютера в правом нижнем углу показывает три воспроизводимых mictЦиклы мочеиспускания. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7: Настройка экспериментальной записи. ( A ) 22 G, подвешенным над клеткой для записи и балансом. ( B ) Фотография, показывающая всю длину внешней части инфузионной трубки с поворотным устройством 22 G и тросом PE50. ( C ) Шарнир 22 G с пружинной оболочкой, покрывающей трубы из PE50. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8: Гистологическая оценка ReОтклика стенки мочевого пузыря на имплантированную трубку PE10. Поперечные сечения мочевого пузыря, окрашенные гематоксилином и эозином (H & E) до, 2, 3, 5 и 7 дней после операции. На послеоперационный день 5-й день опухоль мочевого пузыря была разрешена. Пожалуйста , нажмите здесь, чтобы посмотреть увеличенную версию этого рисунка.

Рисунок 9: Функциональная оценка мочевого пузыря с использованием анализа пятнистости. Мочевые пятна на фильтровальной бумаге с УФ-светом, документирующие характерный рисунок мочеиспускания на 0-й день (до имплантации трубки), 2, 3, 4, 5 и 7 имплантата после внутрипузырного введения. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 10: Цистометрограмма. Репрезентативный след внутрипузырного давления мочевого пузыря в бодрствующей свободно движущейся мыши. Трассировка с 3 воспроизводимыми циклами мочеиспускания. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 11: Фаза мочеиспускания. Трассировка, изображающая фазу мочеиспускания с высокочастотными колебаниями во время начального увеличения давления, пикового давления и быстрого падения давления к базовой линии. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 12: Закрепление троса. ( A ) Якорь, используемый для закрепления катетера PE10 у животного и предотвращения забивания трубки в мочевой пузырь. Диск прикреплен к пружинной оболочке. ( B ) Внутренний PE10 катетер подключен к внешней трубке PE50. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
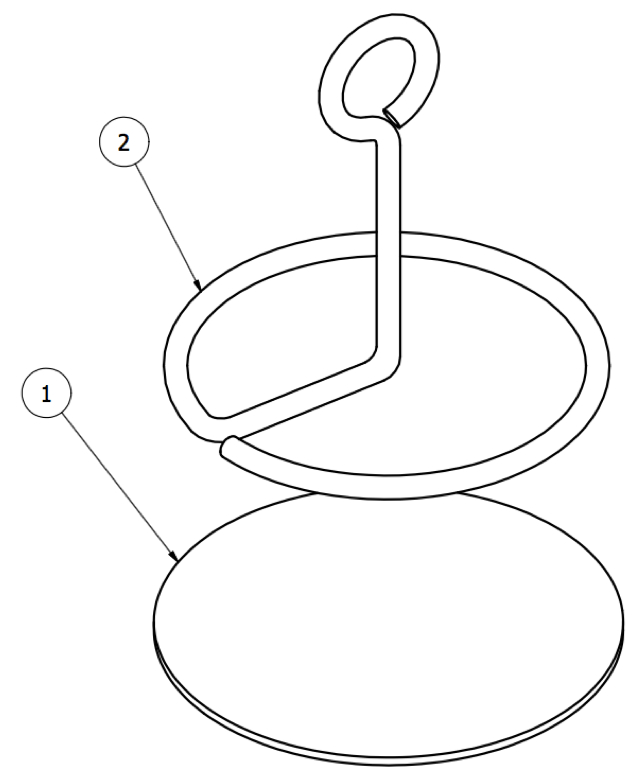
Рисунок 13: Шарнирное соединение. Подкожная часть анкера, состоящая из ( 1 ) диска из ткани и ( 2 ) металлической петли.
Обсуждение
Оптимальный материал и размер внутрипузырной трубки
Для определения влияния диаметра трубки на запись давления мы тестировали различные микрожидкостные трубки; PE50 (0,58 мм ID), полиуретан PU027 (0,4 мм ID), PE25 (0,46 мм ID) и PE10 (0,28 мм ID). Для каждой трубки регистрировали давление с помощью инфузионного насоса, работающего со скоростью 1 мл / ч, при быстром перемещении трубки по вертикали от 0 до 30 см. Первоначальные эксперименты in vivo были направлены на использование труб РЕ50, но они не увенчались успехом из-за размера трубки по сравнению с мышами ( рис. 4А ). Хотя это подтверждает вывод Смита и Кучела, которые полагают, что использование трубки РЕ50 для пробуждения цистометрии у мышей создает артефакты, что затрудняет интерпретацию данных12, важно отметить, что другие успешно использовали трубки РЕ50 в обоих случаях без сна , Бодрствующая сдержанность и анестезированная цистометрия мыши. 9 , 13 , 14 По сравнению с PE50, PE10 является более гибким, что уменьшает натяжение трубки, воздействующее на мочевой пузырь при движении мыши, уменьшая артефакты движения. Важно, чтобы секция PE10 была как можно короче (≤ 7 см). Более длинная трубка PE10 приводит к большей вероятности того, что показания давления будут увлажнены. Несмотря на теоретическое преимущество использования более мягкого, более био-инертного материала, такого как PU, для внутрипузырной имплантации для уменьшения воспалительной реакции, это не привело к существенной разнице в послеоперационном опухании мочевого пузыря. Кроме того, испытания, в которых использовались более мягкие трубки из полиуретана, были связаны с перекручиванием и закупоркой.
Воздействие операции на сократимость стенки мочевого пузыря и набухание
До настоящего времени данные о функции мочевого пузыря и опухании стенки мочевого пузыря, после имплантации внутрипузырной трубки, были доступны только для крыс. Согласно предыдущимМочеиспускание, объем мочеиспускания был ниже, а частота мочеиспускания была выше в послеоперационные дни 1 - 3. 15 Было также показано, что изменения функции мочевого пузыря у крысы были связаны с сильным набуханием мочевого пузыря, при этом отек начинал ослабевать после 3 дней. 16 Чтобы лучше понять изменения функции мочевого пузыря, набухание стенки мочевого пузыря и сроки восстановления самцов мышей C57BL / 6, которые происходят от имплантации трубки PE10, 12-часовую поведенческую частоту мочеиспускания оценивали, используя метод записи в фильтровальную бумагу , После последней записи мышей анестезировали, и мочевой пузырь грубо оценивали, собирали, фиксировали и оценивали гистологически. После 1-го и 2-го послеоперационного периода частота мочеиспускания снижалась, а пятнистость повышалась, затем наблюдалось увеличение мочеиспускания к 3-му дню. Поведение при мочеиспускании нормализовалось к 5-му дню. Валовая оценка мочевого пузыря при уборке и последующем окрашивании H & E выявила наибольшее количествоСубуротелиального набухания на послеоперационном дне 2 и 3, при этом пузырьки становятся похожими на контрольные пузыри на 5 и 7 день после имплантации трубки.
Подобно клиническим уродинамическим исследованиям, большинство лабораторий использовали комнатную температуру 0.9% NaCl. 11 Скорость инфузии в предыдущих исследованиях значительно варьирует от 10 мкл / мин до 100 мкл / мин. 17 , 18 Исследование, в котором сравнивали влияние различных уровней инфузии на функцию мочевого пузыря у мышей, не проводилось, однако данные, полученные в более крупных исследованиях на животных, рекомендовали использовать более медленные скорости наполнения. Из-за небольшого объема мышечного пузыря, перистальтические насосы не подходят, и необходим насос для непрерывного вливания.
Наиболее точные и удобные FC-записи сбалансируют хорошую прозрачность изменений давления при ограниченных артефактах. Результаты, полученные с использованиемКороткий отрезок трубки PE10, соединенный непосредственно с PE50, обеспечил точное измерение давления в мочевом пузыре мыши. Колебания давления, вызванные движением животных, могут быть ограничены закреплением трубки на коже в точке ее выхода на затылке ( рис. 12 и 13 ). Это может быть достигнуто с использованием пузырьков клея и специального анкера, состоящего из подкладки, покрытой металлической тканью, а внешняя деталь, прикрепленная к металлической пружине, закрывающей трубу. Дополнительные способы предотвращения натягивания трубки на мочевой пузырь включают создание изогнутой подкожной дорожки для внутренней части трубки РЕ10, которая обеспечивает провисание в трубке и использование поворота и троса, которые предотвращают скручивание и изгиб. Основываясь на литературе и доказательствах, полученных в результате этих исследований, рекомендуется выполнить следующие шаги, чтобы обеспечить наиболее воспроизводимый и физиологически точный метод in vivoЗапись внутрипузырного давления в мышь. Используйте операционный микроскоп и микрохирургические инструменты для имплантации катетера в купол мочевого пузыря. Позвольте 5-дневный восстановительный период между операцией и записью. Акклиматизируйте животное в той же клетке, в котором будет производиться запись, и обеспечьте свободный доступ к пище и воде. Проведите эксперимент в спокойной обстановке с минимальным контактом с человеком, в идеале используйте дистанционный видеомониторинг, чтобы наблюдать за поведением животного.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This study was funded by the Department of Surgery University of Vermont, Danish Council for Independent Research, and by the Odense University Hospital.
Материалы
| Name | Company | Catalog Number | Comments |
| Polyethylene (PE) 10 tubing | Instech | BTPE-10 | Fits 30G connectors/plugs |
| Polyethylene (PE) 50 tubing | Instech | BTPE-50 | Fits 22G connectors/plugs |
| 22 G single channel stainless steel swivel | Instech | 375/22 | |
| High Carbon Steel Utility Extension Spring (9/64" OD) | Grainger | 1NAH1 | Protects PE50 tubing - Cut to length |
| 22 G connector | Instech | SP22/12 | |
| Yutaoz Professional Hot Melt Adhesive Glue Gun | Yutaoz | Use low temperature setting (100 °C) - Any hot melt glue gun with an adjustable temperature range will work | |
| Surebonder DT-2010 all purpose glue stick | Surebonder | Any all purpose hot glue will work | |
| Dumont #5 curved microforceps | World Precision Instruments | 500232 | |
| Dumont #7 curved microforceps | World Precision Instruments | 14188 | |
| Mini dissecting scissors - straight | World Precision Instruments | 503240 | |
| Micro mosquito forceps (12.5 cm) | World Precision Instruments | 500451 | |
| Dissecting scissors - straight | World Precision Instruments | 14393 | |
| Castroviejo Needle Holder | World Precision Instruments | 503258 | |
| Isoflurane, USP | Phoenix | 2%, 1 L/min flow rate | |
| Buprenorphine | 0.05 mg/kg | ||
| 0.9% Sodium Chloride Irrigation, USP | Baxter | ||
| 6-0 Ethilon black monofilament, non-absorbable suture | Ethicon | Bladder tie | |
| 6-0 Vicryl violet braided, absorbable suture | Ethicon | Muscle suture, running | |
| 6-0 Prolene blue monofilament, non-absorbable suture | Ethicon | Skin suture, vertical mattress, buried interrupted | |
| KD Legato 210 infuse/withdraw pump | KD Scientific | 1.5 mL/hr | |
| Disposable pressure transducer | Digitimer | NL108T2 | |
| Pressure Amplifier | Digitimer | NL108A | |
| Power1401-3 data acquisition interface | Digitimer | ||
| Spike2 | Cambridge Electronic Design Limited | PC pressure recording software | |
| Leica MZ6 surgical operating microscope (3.2 - 20X) | Leica Microsystems | Magnification |
Ссылки
- Perez, L. M., Webster, G. D. The History of Urodynamics. Neurourol Urodyn. 11 (1), 1-21 (1992).
- Fry, C. H., et al. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol Urodyn. 29 (4), 603-608 (2010).
- Maggi, C. A., Santicioli, P., Meli, A. The nonstop transvesical cystometrogram in urethane-anesthetized rats: a simple procedure for quantitative studies on the various phases of urinary bladder voiding cycle. J Pharmacol Methods. 15 (2), 157-167 (1986).
- Malmgren, A., et al. Cystometrical evaluation of bladder instability in rats with infravesical outflow obstruction. J Urol. 137 (6), 1291-1294 (1987).
- Pandita, R. K., Fujiwara, M., Alm, P., Andersson, K. E. Cystometric evaluation of bladder function in non-anesthetized mice with and without bladder outlet obstruction. J Urol. 164 (4), 1385-1389 (2000).
- Chang, H. Y., Havton, L. A. Differential effects of urethane and isoflurane on external urethral sphincter electromyography and cystometry in rats. Am J Physiol Renal Physiol. 295 (4), F1248-F1253 (2008).
- Matsuura, S., Downie, J. W. Effect of anesthetics on reflex micturition in the chronic cannula-implanted rat. Neurourol Urodyn. 19 (1), 87-99 (2000).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Peripheral Nerve Transplantation Combined with Acidic Fibroblast Growth Factor and Chondroitinase Induces Regeneration and Improves Urinary Function in Complete Spinal Cord Transected Adult Mice. PLoS One. 10 (10), e0139335(2015).
- Kadekawa, K., et al. Characterization of bladder and external urethral activity in mice with or without spinal cord injury--a comparison study with rats. Am J Physiol Regul Integr Comp Physiol. 310 (8), R752-R758 (2016).
- Uvin, P., et al. The use of cystometry in small rodents: a study of bladder chemosensation. J Vis Exp. (66), (2012).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol Urodyn. 30 (5), 636-646 (2011).
- Smith, P. P., Kuchel, G. A. Continuous uroflow cystometry in the urethane-anesthetized mouse. Neurourol Urodyn. 29 (7), 1344-1349 (2010).
- Aizawa, N., Homma, Y., Igawa, Y. Influence of High Fat Diet Feeding for 20 Weeks on Lower Urinary Tract Function in Mice. Low Urin Tract Symptoms. 5 (2), 101-108 (2013).
- Bjorling, D. E., et al. Evaluation of voiding assays in mice: impact of genetic strains and sex. Am J Physiol Renal Physiol. 308 (12), F1369-F1378 (2015).
- Morikawa, K., et al. Effects of various drugs on bladder function in conscious rats. Jpn J Pharmacol. 50 (4), 369-376 (1989).
- Yaksh, T. L., Durant, P. A., Brent, C. R. Micturition in rats: a chronic model for study of bladder function and effect of anesthetics. Am J Physiol. 251 (6 Pt 2), R1177-R1185 (1986).
- Cornelissen, L. L., Misajet, B., Brooks, D. P., Hicks, A. Influence of genetic background and gender on bladder function in the mouse. Auton Neurosci. 140 (1-2), 53-58 (2008).
- Lemack, G. E., Zimmern, P. E., Vazquez, D., Connell, J. D., Lin, V. K. Altered response to partial bladder outlet obstruction in mice lacking inducible nitric oxide synthase. J Urol. 163 (6), 1981-1987 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены