Method Article
评估在鼠标模型中执行唤醒膀胱测压的过程
* 这些作者具有相同的贡献
摘要
本研究描述了在自由移动的小鼠中进行清醒膀胱测压术的外科手术和实验技术。此外,它还提供实验证据来支持其优化和标准化。
摘要
唤醒灌注膀胱测量法已经被用于评估自由移动小鼠的膀胱功能,但是实际使用的具体方法有所不同。这项研究的目的是描述用于植入膀胱内管的显微外科手术和用于在清醒,自由移动的小鼠中记录膀胱压力的实验技术。此外,还提供了实验数据,以显示手术以及管道类型和尺寸如何影响下尿路功能和记录敏感性。在具有不同内径的聚乙烯和聚氨酯管中评估管直径对压力记录的影响。随后,将来自两种材料的最佳试管手术植入雄性C57BL / 6小鼠膀胱的圆顶。手术后2,3,5和7天在健康,完整的动物和动物中记录了12小时,隔夜排尿次数。在收获时,气囊w用大量观察评估肿胀征象,随后进行病理分析。在第2天和第3天观察到膀胱肿胀最大程度,与行为排尿数据相关,显示膀胱功能受损明显。到第5天,膀胱组织学和排尿频率正常化。根据我们研究提供的文献和证据,我们提出了在醒来的小鼠体内记录膀胱内压和空洞体积的以下步骤:1)使用手术显微镜和显微外科手术进行手术,2)使用聚乙烯-10管道以最小化运动伪影,以及3)在膀胱肿胀消退后,在术后第5天进行膀胱测压。
引言
填充性膀胱测量术(FC)是一种诊断方法,其涉及将膀胱放置在膀胱中以在缓慢的膀胱充盈期间记录压力。首先在1927年作为评估下尿路功能的临床诊断方法,它一直被广泛使用。 1在研究应用中,FC可用于测试健康和患病动物模型中的膀胱功能,并研究药理作用的影响。啮齿类动物模型通常用于调查下尿路功能。 2在这组哺乳动物中,FC首先开发用于大鼠。 3在这里,将管子植入膀胱并执行FC的方法已被许多研究人员充分描述和使用,具有可接受的重现性水平。转基因和敲除菌株的可用性使得小鼠成为许多研究领域的宝贵物种,包括下尿路功能障碍的领域。用于执行小鼠膀胱测压术的方法在实验室之间变化明显,使得难以比较结果。 五
与离体模型相比,FC保留了下尿路解剖学,允许评估排尿周期的储存和排尿期间膀胱及其出口之间的协调作用。以前的研究表明,许多常用的麻醉药抑制排尿收缩。维持膀胱平滑肌收缩的药物(氨基甲酸酯,α-氯醛酸,氯胺酮和赛拉嗪),允许动物排尿,仍然显着降低功能性膀胱容量并抑制神经传递。 6,7,8,9虽然在技术上更具挑战性,FC在aw中表现出色ake行动动物保留排尿反射的功能完整性。
下尿路功能受多种因素的影响,包括手术后膀胱壁肿胀,由于疼痛和不适引起的压力,以及环境影响。使用在管植入期间最小化组织损伤的手术技术和减少管运动的记录方法,同时允许动物自由行走,对于获得准确和可再现的记录是必需的。
如果充分进行,在体内 FC在自由移动的动物中可以提供可靠地反映生理性膀胱功能的数据。自由移动动物中的10个 FC可以提供以下参数的数据;基础或基线压力:两次排尿之间的最小压力。间歇压力:两次排尿之间的平均压力。阈值压力:膀胱内压排尿之前。最大压力:排尿期间膀胱压力最大。自发活动(或平均间歇性振荡压力):排气压力减去基础压力。无空洞的收缩:在充盈阶段增加膀胱内压,与流体释放无关。膀胱依从性:膀胱容量除阈值压力减去基础压力。排尿频率:每单位时间的排尿次数。间隔间隔:两个最大排尿压力之间的周期。膀胱容量:输注量除以排尿次数。以前已经公布了这些参数和标准化术语的详细描述。 11
FC可以使用连续或单循环膀胱输液法进行。连续膀胱测量允许记录多个排尿周期并选择代表性的数据重现性。由于未知剩余体积,其测量膀胱容量的准确性受到限制。此外,在自由行走的小鼠中收集小的空隙体积(其基于应变和性别在30和184μL之间变化)是具有挑战性的。使用这种方法记录空洞体积与麻醉制剂相比不太准确,但是优于其避免麻醉剂对膀胱功能的抑制作用。单循环膀胱测量应用于评估膀胱容量。在这种方法中,膀胱在输注之前通过抽吸排空,并且根据输注速率乘以时间到最大压力的函数计算容量。
虽然已经出版了在小型啮齿动物中进行膀胱测压的技术,但它描述了在大鼠中进行的手术,并建议在氨基甲酸乙酯麻醉下进行小鼠膀胱测压。这个沟通的目标是to描述了用于将膀胱管植入膀胱圆顶的显微手术技术和用于在清醒的自由移动的小鼠中连续膀胱充盈和排尿期间在体内记录下尿路功能的实验装置。此外,进行实验以解决管长度,直径和材料以及在体内 FC中执行的方法是否影响记录。该实验方案总结了以前发表的技术,并提出了一些基于实验结果的修改。
研究方案
根据机构指导,动物被安置在佛蒙特州动物保护基金会大学。所有的动物实验都是按照国家卫生研究院的指南进行的,用于护理和使用实验动物。
膀胱内管植入
- 准备外科手术的管道和器械
- 切割一个7厘米的PE10管,使导管植入。
- 通过缓慢地将端部朝着明亮的火焰推进,在PE10管的一端形成一个耀斑。
注意:一旦发生耀斑,就可以快速取出管子。 - 使用三滴通用热胶,使用胶枪上的低热量设置,距离PE10管外侧的喇叭口的距离为4.5,5和5.5厘米。这些将有助于将管固定在动物的背部。 ( 图1 )
- 通过将管浸泡在70%乙醇,然后在使用前用无菌的0.9%NaCl冲洗。放置管子以避免引入气泡进入系统。
- 通过将近端侧面手动操作,通过将30号针头与轮毂分开来创建一个30号插头,以密封PE10导管的末端。最后涂一滴热胶。确保密封件是防水的。 ( 图2 )
- 使用以下显微外科手术仪器:两对Dumont#7弯曲微型压力机,两对Dumont#5弯曲微型压力机,21 G针头,超细直线止血钳,微型剪刀,小型解剖剪刀和微型针架。
- 在开始手术之前对所有仪器进行灭菌。
- 动物的准备
- 麻醉动物后,首先刮下腹部的下半部分,然后转动动物,剃须后用70%酒精擦拭上面的区域,然后用betadine。应用兽医软膏给眼睛防止干燥。接下来,使用一对直的,钝的剪刀和一对Dumont#7弯曲的微型力量,在肩胛骨之间做一个1.5厘米长的皮肤切口,并将动物仰卧位置在覆盖无菌窗帘的加热垫(37°C)的顶部。
- 最后,用酒精和betadine清洁腹部。
- 外科手术
注意:在放大范围为3.15X至20X的手术显微镜下执行所有外科手术。将动物放在无菌蓬茸上后,戴上无菌手套。在整个手术过程中继续使用无菌手术。- 将动物置于感应盒中,并使用2%吸入的异氟烷与氧气载体麻醉(1升/分钟)。通过将动物的头部放置在鼻锥中并使用2%的吸入异氟烷与氧气载体(1升/分钟),在整个过程中保持麻醉。在收到一个负号后开始手术来自脚尖测试的反应。
- 使用一对直的,钝的剪刀和一对Dumont#7弯曲的微型力量,通过皮肤做一个1.5厘米的中线腹部切口。随后,通过沿着线和肌肉的筋膜创建匹配的切口,以暴露膀胱的穹顶和上半部。通过使用一对Dumont#7弯曲的微型力量向每个组织层施加向上的牵引力来避免对膀胱造成伤害。通过加入一滴温暖的生理盐水使腹部内脏免受干燥。
- 将动物旋转到侧面,以进入颈部颈部的切口。通过切口皮下移动一个狭窄的止血钳。皮下通道应从背部开始,并沿着侧面继续。
- 一旦仪器的尖端到达肋骨的底部,将尖端朝向中线和腹部内侧(当刺穿腹壁肌肉时会有轻微的弹出)。继续推进止血剂,直到尖端暴露在肌肉层下的腹部切口处。 ( 图3 )
- 用止血钳握住管道的"未扩张"端,并缓慢缩回工具,通过颈部后部的切口将管的一端拉出。调整管道的扩口端,使其直接位于膀胱圆顶上方。
- 制作6-0单丝缝合线(不可吸收)的松紧带,并将其放置在膀胱圆顶顶部。这种领带将在以后用于将管固定在膀胱中。
- 在腹部和膀胱后面放置一小片无绒的组织,以帮助稳定和提升膀胱。
- 准备将PE10导管的扩口端插入膀胱。
- 在非优势的手中,用Dumont#7弯曲的微型压力容器保持膀胱的圆顶,并保持该把手,直到导管置于膀胱中。
- 使用21号针to在圆顶的顶点进行膀胱切开术。轻轻地用闭合的#5弯曲微型力量探测膀胱切开术,以确保导管能够容易地穿过孔。
- 同时将膀胱圆顶保持在非优势手中,将PE10导管的扩口端放入膀胱(将耀斑向下推到膀胱颈,使其在固定时不会滑出)。
- 将6-0单丝缝合在膀胱和管道的圆顶周围,并将扎带放置在管道的前面。确保将缝合线尽可能高的绑在膀胱上,以避免人为地减少膀胱容量。 ( 图4 )
- 或者,如下使用钱包串缝线固定导管。使用6-0单丝在膀胱圆顶上做一个松散的钱包缝合线。按照步骤1.3.8.1 - 1.3.8.3进行膀胱切开术并插入导管。通过捆扎钱包缝合线来固定管子。 ( 图5 )
- 通过将带有30号针的0.5mL胰岛素注射器连接到管的远端来测试膀胱中管的通畅和密封。用0.1-0.2mL的0.9%NaCl慢慢填充膀胱,直到尿道口出现下降,然后抽吸排空膀胱。重要的是膀胱可以充满和排空。
- 如果在圆顶没有发生泄漏,用一对弯曲的微型支架支撑膀胱,并轻轻地拉动管道,直到火炬靠在膀胱圆顶内部。
- 关闭前,取出小卷纸,确保膀胱处于正常位置。
- 关闭腹壁两层(肌肉和皮肤)与6-0运行缝合线。通过仅缝合前腹肌筋膜(直肌鞘前壁)的边缘,最好近似腹直肌。
- 为了将动物的管子固定回来,轻轻地滚动把动物放在腹部上。将金属锚固体的皮下部分插入肩胛下切口。 ( 图12 )使用6-0缝合线通过用垂直床垫缝合环来固定管子和锚固件。
- 确保胶水泡沫保持在皮肤上方和下方,以防止管子拉出。将管切开皮肤上方约2厘米。
- 轻轻地将30号插头(步骤1.1.5)插入管的末端,以防止尿液泄漏。
- 皮下注射0.5 mL 0.9%NaCl进行水合。手术后立即给予术后镇痛,并维持48 h。
- 将动物放回其位于红外灯下方的笼中。保持持续观察,直到动物自由移动。
- 每天监测动物,并允许它在记录前恢复5天。
清醒囊肿ometry录音
- 记录程序,压力传感器和输液泵的准备。
- 在麻醉动物之前,使用PE50管连接输液泵,压力传感器和22 G旋转器。 ( 图6 )
- 在计算机上打开录制程序(参见材料表),以校准系统压力并准备录制。确保在校准和录制过程中使用相同的设置。
- 向20 mL注射器中注入10 - 15 mL室温0.9%NaCl并装入输液泵。将泵编程以0.6 mL / h的速度注入。
- 将压力传感器固定在与动物的膀胱或记录笼底部相同的高度。
- 将22号转子连接到压力传感器的末端(PE50 - 管道 - 压力传感器旋转)
注意:旋转头用于防止管子扭曲或扭曲动物的动作。 - 推进注射泵通过系统冲洗0.9%的NaCl。校准前请确保清除所有气泡。
- 记录程序运行时,使用标尺校准压力(cm / H 2 O)。将PE50系绳的末端从0缓慢移动到30厘米。如果需要,调整零。
注意:0厘米标记应与记录笼和压力传感器的地板处于相同的高度。
- 将22号转子悬挂在记录笼的中心上方。确保笼底允许尿液落到定位在笼子下方的天平的收集装置上。调整系绳的高度,以便鼠标可以自由移动,不要紧张或拉伸管道。 ( 图7 )
- 完成后,检查以确保系统和外部PE50管道充满0.9%NaCl,所有气泡都已被去除。
- 预备动物进行记录
- 用2%吸入异氟烷麻醉动物,并将其放在腹部。取下30号插头,将PE10管(膀胱导管)滑入PE50系绳的末端。使用热胶水形成防水密封。
- 关闭麻醉,并将动物放置在带有平行线的地板的记录笼中,这样可以使尿液直接落在放置在分析天平顶部的收集装置上。 ( 图7 )
- 一旦动物在笼子里,开始记录,但不要开始注入。监测动物,直到麻醉完全恢复。一旦膀胱压力稳定,开始以0.6mL / h的速率注入0.9%的NaCl。
注意:当进行任何更改时,请在录制程序中进行注释。输入开始,停止或发生不规则的记录是很重要的。 - 检查系统是否有泄漏,并确保动物容易食物和水。
- 继续录音在一个安静的房间,直到获得三个可再现的排尿循环。
注意:在整个录制过程中,动物应完全不受干扰。最好使用远程视频监控来观察行为。
结果
在管堵塞期间,管材料与直径之间的压力上升和系统内的压力一致性没有显着差异。膀胱管内植入的膀胱壁肿胀对于聚乙烯(PE)和聚氨酯(PU)材料都是显着的。在第2天,严重粘膜下肿胀。它占据膀胱横截面的一半,导致管腔阻塞。在第5天,水肿完全解决,使黏膜下层区域渗入部分侵入肌层的炎症细胞。在第7天,炎症浸润显着减少,膀胱壁组织学恢复正常( 图8 )。在第2天和第3天观察到的最大程度的组织溶胀与显示膀胱功能受损显着的行为排尿数据相关( 图9 )。空载频率由po标准化手术第5天。
清醒的自由移动的鼠标(具有最小的运动伪影)的内部压力的特征在于10-15cm H 2 O的基线压力,其可以在填充循环期间保持不变或逐渐增加不超过10cm 2 H 2 O ,然后是突然的脉动压力增加,然后在排尿期间下降( 图10和11 )。

图1: 用于植入膀胱膀胱的PE10管。 ( A )一个7厘米的PE10管,一束热胶,距离喇叭形的端部有4.5,5和5.5厘米。 ( B和C )详细图片显示管的扩口端(用于固定膀胱中的管)。es / ftp_upload / 55588 / 55588fig1large.jpg"target ="_ blank">请点击此处查看此图的较大版本。

图2:PE10膀胱管外部插头。插头由30 G针和热胶制成。 请点击此处查看此图的较大版本。

图3:膀胱管路径。示意图线图说明了通过腹部及其皮下路线向管颈颈部放置的管路。 请点击这里查看大图版本的这个数字。
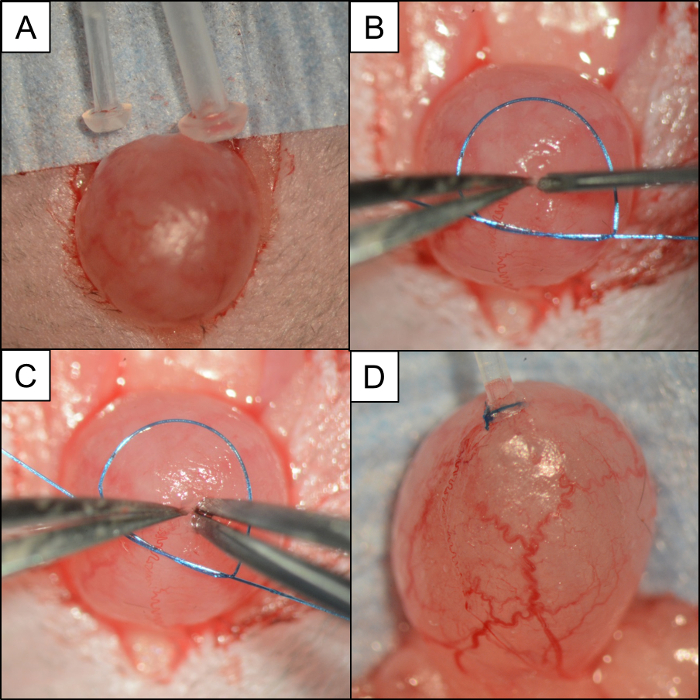
图4:用于使用失去单丝缝合线插入和固定管的膀胱/管道比较和步骤。手术照片描述: ( A )比较PE50和PE10与小鼠膀胱的比较。 ( B )围绕膀胱放置一条6-0单丝缝合线的小环。一对#5微型镊子夹住膀胱的圆顶,而使用21 G针进行膀胱切开术。 ( C )在不释放膀胱的圆顶的情况下,在插入PE10导管之前,相对手中的一对#5微型力量测量孔。 ( D )PE10导管固定在6-0单丝缝合的膀胱圆顶。 请点击这里以查看该图的较大版本。

图5:钱包串缝线可用作在膀胱中固定管子的替代方法。 ( A )在膀胱圆顶中的钱包缝合线。 ( B )穿过钱包中心的PE10管。 请点击此处查看此图的较大版本。

图6: 实验设置。注射器中含有0.9%NaCl的注射器与压力传感器和膀胱内导管串联连接。右下角的电脑屏幕显示三个可重复的mict尿循环请点击此处查看此图的较大版本。

图7:实验记录设置。 ( A )22 G旋转悬挂在录音笼和平衡上。 ( B )使用22 G旋转器和PE50系绳显示输注管的外部部分的整个长度的照片。 ( C )22 G旋转,弹簧护套覆盖PE50管。 请点击此处查看此图的较大版本。

图8:Re的组织学评价尿膀胱壁对植入PE10管的反应。手术前,第2,3,5和7天,用苏木精和曙红(H&E)染色的膀胱截面。术后第5天膀胱壁肿胀消退。 请点击此处查看此图的较大版本。

图9:使用空斑测定的功能性膀胱评估。使用紫外光观察的滤纸上的尿点在第0天(管植入前),第2,3,4,5和7个膀胱内植入后记录代表性排尿模式。 请点击此处查看此图的较大版本。

图10:囊肿图。代表性的膀胱膀胱压力迹象在清醒,自由移动的鼠标。痕迹显示3个可再现的排尿周期。 请点击此处查看此图的较大版本。

图11:排尿期。痕迹描述了在初始压力升高,峰值压力和快速压降到基线时,高频振荡的排尿阶段。 请点击此处查看此图的较大版本。

图12:固定系绳。 ( A )用于固定动物中的PE10导管的锚杆,并防止管子在膀胱上打浆。盘连接到弹簧护套。 ( B )内部PE10导管连接到外部PE50管。 请点击此处查看此图的较大版本。
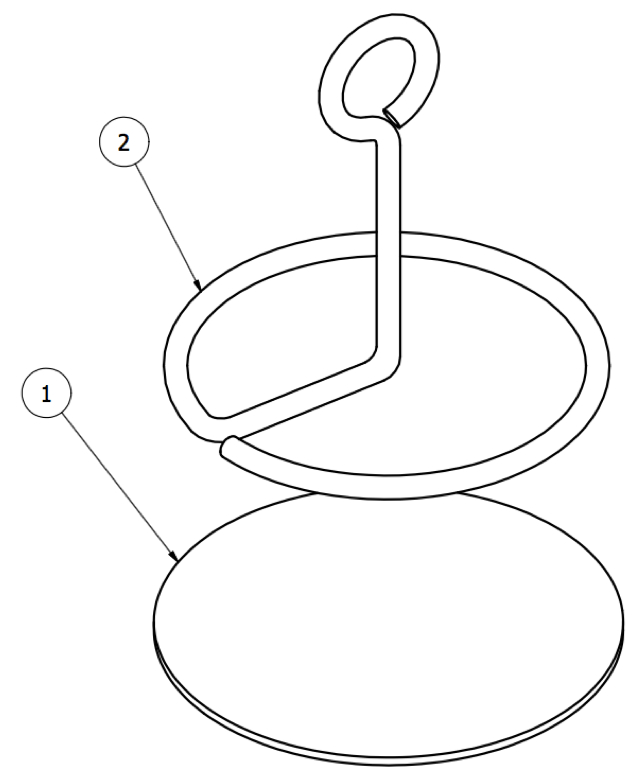
图13:旋转锚。锚固体的皮下部分由( 1 )由织物制成的盘和( 2 )金属环组成。
讨论
最佳材料和大小的膀胱内管
为了确定管径对压力记录的影响,我们测试了不同的微流体管; PE50(0.58mm ID),聚氨酯PU027(0.4mm ID),PE25(0.46mm ID)和PE10(0.28mm ID)。对于每个管,记录输注泵的压力为1mL / h,同时将管垂直地从0延伸至30cm。初始体内实验尝试使用PE50管,但是由于与小鼠膀胱相比,管的尺寸不成功( 图4A )。虽然这支持了Smith和Kuchel的发现,他们建议在小鼠中使用PE50管道进行清醒的膀胱测压,但会产生伪像,这使得难以解释数据, 12重要的是要注意,其他人已经成功地使用了PE50管, ,清醒约束,麻醉鼠标膀胱测压法。 9 , 13,14与PE50相比,PE10更灵活,可以减少管道随着鼠标移动而施加在膀胱上的张力,从而减少运动伪影。重要的是PE10的截面尽可能短(≤7cm)。较长的PE10管导致压力读数将被抑制的可能性更大。尽管使用更柔软,更生物惰性的材料如PU用于膀胱内植入以减少炎症反应具有理论上的优势,但并未导致术后膀胱肿胀的显着差异。此外,使用较软的PU管的试验与扭结和堵塞有关。
手术对膀胱壁收缩和肿胀的影响
到目前为止,膀胱功能和膀胱壁肿胀,植入后膀胱管的数据仅适用于大鼠。根据以前的小便,排尿量较低,术后1〜3天排尿频率较高。15也显示大鼠膀胱功能改变与膀胱严重肿胀有关,3级后水肿开始下降天。 16为了更好地了解从注入PE10管发生的男性C57BL / 6小鼠的膀胱功能变化,膀胱壁肿胀和修复时间线,使用滤纸记录方法评估12小时行为排尿频率。在最后一次记录之后,将小鼠麻醉,并对组织学评估,收获,固定和评估膀胱。手术后第1天和第2天,排尿频率下降,斑点增加,第3天排空增加。第5天归一化排空行为。收获后和随后的H&E染色显示最大量在手术后第2天和第3天的神经性上皮肿胀,囊管在管植入后第5和7天变得类似于对照囊。
类似于临床尿动力学研究,大多数实验室使用室温0.9%NaCl。 11以前研究中的输注速率从10μL/ min到100μL/ min显着不等。比较不同输注速率对小鼠膀胱功能的影响的研究尚未完成,但是在较大型动物研究中获得的数据表明,应使用较慢的灌注率。由于小鼠膀胱体积小,所以蠕动泵不合适,需要连续机构输液泵。
最准确和可用的FC记录通过有限的伪影平衡压力变化的良好透射率。使用的结果直接连接到PE50的短段PE10管可以准确测量小鼠膀胱的压力。动物运动导致的压力波动可以通过在颈部颈部退出的位置将管固定在皮肤上来限制( 图12和13 )。这可以通过使用胶水气泡和由皮下放置的金属织物覆盖的板组成的特殊锚固件以及附接到覆盖管的金属弹簧的外部件来实现。用于防止管子拉动膀胱的其它方法包括为PE10管的内部部分创建弯曲的皮下轨道,其在管中提供松弛,并且使用防止扭曲和扭结的旋转和系绳。基于这些研究提供的文献和证据,推荐以下步骤为体内提供最可重复和生理学上准确的方法记录小鼠的膀胱内压力。使用手术显微镜和显微手术工具将导管植入膀胱的圆顶。允许手术和记录之间的5天恢复期。适应同一个笼子里的动物进行录音,并提供食物和水的自由。在一个安静的环境中进行实验,人际接触最少,理想情况下,使用远程视频监控来观察动物的行为。
披露声明
The authors have nothing to disclose.
致谢
This study was funded by the Department of Surgery University of Vermont, Danish Council for Independent Research, and by the Odense University Hospital.
材料
| Name | Company | Catalog Number | Comments |
| Polyethylene (PE) 10 tubing | Instech | BTPE-10 | Fits 30G connectors/plugs |
| Polyethylene (PE) 50 tubing | Instech | BTPE-50 | Fits 22G connectors/plugs |
| 22 G single channel stainless steel swivel | Instech | 375/22 | |
| High Carbon Steel Utility Extension Spring (9/64" OD) | Grainger | 1NAH1 | Protects PE50 tubing - Cut to length |
| 22 G connector | Instech | SP22/12 | |
| Yutaoz Professional Hot Melt Adhesive Glue Gun | Yutaoz | Use low temperature setting (100 °C) - Any hot melt glue gun with an adjustable temperature range will work | |
| Surebonder DT-2010 all purpose glue stick | Surebonder | Any all purpose hot glue will work | |
| Dumont #5 curved microforceps | World Precision Instruments | 500232 | |
| Dumont #7 curved microforceps | World Precision Instruments | 14188 | |
| Mini dissecting scissors - straight | World Precision Instruments | 503240 | |
| Micro mosquito forceps (12.5 cm) | World Precision Instruments | 500451 | |
| Dissecting scissors - straight | World Precision Instruments | 14393 | |
| Castroviejo Needle Holder | World Precision Instruments | 503258 | |
| Isoflurane, USP | Phoenix | 2%, 1 L/min flow rate | |
| Buprenorphine | 0.05 mg/kg | ||
| 0.9% Sodium Chloride Irrigation, USP | Baxter | ||
| 6-0 Ethilon black monofilament, non-absorbable suture | Ethicon | Bladder tie | |
| 6-0 Vicryl violet braided, absorbable suture | Ethicon | Muscle suture, running | |
| 6-0 Prolene blue monofilament, non-absorbable suture | Ethicon | Skin suture, vertical mattress, buried interrupted | |
| KD Legato 210 infuse/withdraw pump | KD Scientific | 1.5 mL/hr | |
| Disposable pressure transducer | Digitimer | NL108T2 | |
| Pressure Amplifier | Digitimer | NL108A | |
| Power1401-3 data acquisition interface | Digitimer | ||
| Spike2 | Cambridge Electronic Design Limited | PC pressure recording software | |
| Leica MZ6 surgical operating microscope (3.2 - 20X) | Leica Microsystems | Magnification |
参考文献
- Perez, L. M., Webster, G. D. The History of Urodynamics. Neurourol Urodyn. 11 (1), 1-21 (1992).
- Fry, C. H., et al. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol Urodyn. 29 (4), 603-608 (2010).
- Maggi, C. A., Santicioli, P., Meli, A. The nonstop transvesical cystometrogram in urethane-anesthetized rats: a simple procedure for quantitative studies on the various phases of urinary bladder voiding cycle. J Pharmacol Methods. 15 (2), 157-167 (1986).
- Malmgren, A., et al. Cystometrical evaluation of bladder instability in rats with infravesical outflow obstruction. J Urol. 137 (6), 1291-1294 (1987).
- Pandita, R. K., Fujiwara, M., Alm, P., Andersson, K. E. Cystometric evaluation of bladder function in non-anesthetized mice with and without bladder outlet obstruction. J Urol. 164 (4), 1385-1389 (2000).
- Chang, H. Y., Havton, L. A. Differential effects of urethane and isoflurane on external urethral sphincter electromyography and cystometry in rats. Am J Physiol Renal Physiol. 295 (4), F1248-F1253 (2008).
- Matsuura, S., Downie, J. W. Effect of anesthetics on reflex micturition in the chronic cannula-implanted rat. Neurourol Urodyn. 19 (1), 87-99 (2000).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Peripheral Nerve Transplantation Combined with Acidic Fibroblast Growth Factor and Chondroitinase Induces Regeneration and Improves Urinary Function in Complete Spinal Cord Transected Adult Mice. PLoS One. 10 (10), e0139335(2015).
- Kadekawa, K., et al. Characterization of bladder and external urethral activity in mice with or without spinal cord injury--a comparison study with rats. Am J Physiol Regul Integr Comp Physiol. 310 (8), R752-R758 (2016).
- Uvin, P., et al. The use of cystometry in small rodents: a study of bladder chemosensation. J Vis Exp. (66), (2012).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol Urodyn. 30 (5), 636-646 (2011).
- Smith, P. P., Kuchel, G. A. Continuous uroflow cystometry in the urethane-anesthetized mouse. Neurourol Urodyn. 29 (7), 1344-1349 (2010).
- Aizawa, N., Homma, Y., Igawa, Y. Influence of High Fat Diet Feeding for 20 Weeks on Lower Urinary Tract Function in Mice. Low Urin Tract Symptoms. 5 (2), 101-108 (2013).
- Bjorling, D. E., et al. Evaluation of voiding assays in mice: impact of genetic strains and sex. Am J Physiol Renal Physiol. 308 (12), F1369-F1378 (2015).
- Morikawa, K., et al. Effects of various drugs on bladder function in conscious rats. Jpn J Pharmacol. 50 (4), 369-376 (1989).
- Yaksh, T. L., Durant, P. A., Brent, C. R. Micturition in rats: a chronic model for study of bladder function and effect of anesthetics. Am J Physiol. 251 (6 Pt 2), R1177-R1185 (1986).
- Cornelissen, L. L., Misajet, B., Brooks, D. P., Hicks, A. Influence of genetic background and gender on bladder function in the mouse. Auton Neurosci. 140 (1-2), 53-58 (2008).
- Lemack, G. E., Zimmern, P. E., Vazquez, D., Connell, J. D., Lin, V. K. Altered response to partial bladder outlet obstruction in mice lacking inducible nitric oxide synthase. J Urol. 163 (6), 1981-1987 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。