Method Article
マウスモデルにおける覚醒時膀胱内圧測定の実施手順の評価
* これらの著者は同等に貢献しました
要約
本研究では、自由に動くマウスで覚醒膀胱内圧測定を行うための手術手順と実験技術について述べる。さらに、最適化と標準化をサポートする実験的証拠を提供します。
要約
覚醒充填膀胱内圧測定は、自由に動くマウスの膀胱機能を評価するために長い間使用されてきたが、使用される具体的な方法は実験室によって異なる。この研究の目的は、膀胱内チューブを埋め込むために使用される顕微手術手順と、覚醒し、自由に動くマウスに膀胱圧を記録するための実験技術を記述することであった。さらに、手術データ、管の種類およびサイズが下部尿路機能および記録感度にどのように影響するかを示すための実験データを提示する。圧力記録に対するチューブ直径の影響は、異なる内径を有するポリエチレンおよびポリウレタンチューブの両方で評価された。続いて、両方の材料から得られた最も優れたチューブを、雄のC57BL / 6マウスの膀胱のドームに外科的に移植した。手術後2、3、5、および7日目に、健康で無傷の動物および動物に、12時間の一晩排尿頻度を記録した。収穫時に、膀胱肉眼観察を用いて腫脹の徴候を評価し、続いて病理学的分析のために処理した。 2および3日目に膀胱腫脹の最大限度が観察され、有意に膀胱機能障害を示す行動排尿データと相関した。 5日目までに、膀胱組織学および排尿頻度が正常化した。我々の研究で得られた文献と証拠に基づき、我々は、覚醒マウスの膀胱内圧および空隙体積のインビボ記録のための以下のステップを提案する:1)手術顕微鏡および顕微手術ツールを用いて手術を行う、2)ポリエチレン-10 3)膀胱膨潤が解消した術後5日目に膀胱内圧測定を行う。
概要
充填膀胱内圧測定法(FC)は、膀胱充填が遅い間に圧力を記録するためにカテーテルを膀胱内に配置することを含む診断方法である。下部尿路機能を評価するための臨床診断法として1927年に初めて導入されたが、現在でも広く使用されている。研究アプリケーションでは、FCを使用して、健常な動物モデルおよび罹患動物モデルの膀胱機能を試験し、薬理学的作用物質の効果を研究することができる。げっ歯類動物モデルは、下部尿路機能を調査するために一般的に使用される。 2この哺乳動物群では、FCはラットでの使用のために最初に開発された。 3ここで、チューブを膀胱に埋め込み、FCを行う方法は、許容可能なレベルの再現性を有する多くの研究者によってよく記述され、使用されている。 4トランスジェニックおよびノックアウト株の利用可能性は、マウスを数多くの研究分野にとって貴重な種にし、下部尿路機能不全の分野を含む。マウス膀胱内圧測定を実施するために使用される方法論は、実験室間でかなり異なるため、結果を比較することが困難である。 5
エキソビボモデルと比較して、FCは下部尿路の解剖学的構造を保存し、排尿サイクルの貯蔵および排尿段階の間に膀胱とその出口との協調機能を評価することができる。以前の研究は、多くの一般的に使用される麻酔薬が排尿収縮を抑制することを示しています。膀胱平滑筋収縮(ウレタン、α-クロラロース、ケタミン、キシラジン)を維持し、動物を麻酔させる薬剤は、機能性膀胱容量を有意に低下させ、神経伝達を抑制する。 6、7、8、9技術的に難しいが、FCはaw動物を徘徊することは、排尿反射の機能的完全性を保存する。
下部尿路機能は、術後膀胱壁の腫脹、痛みおよび不快感によるストレス、および環境への影響を含む複数の要因によって影響される。管移植中の組織損傷を最小限に抑える外科技術と、管運動を減少させ、動物を自由に歩行させる記録方法を使用することは、正確で再現性のある記録を得る上で不可欠である。
適切に実施される場合、in vivo 自由に動く動物のFCは、生理学的膀胱機能を確実に反映するデータを提供することができる。 10自由に動く動物のFCは、以下のパラメータに関するデータを提供することができます。基礎またはベースライン圧力:2回の排尿間の最低圧力。相互排尿圧:2回の排尿間の平均圧力。閾値圧力:膀胱内圧imm排尿前に瀉血する。最大圧力:排尿サイクル中の最大膀胱圧。自発的活動(または平均交互咬合圧):交絡圧 - 基底圧。非空隙収縮:液体の放出に関連しない充填段階中の膀胱内圧の上昇。膀胱遵守:膀胱容量を閾値圧力 - 基底圧で割った値。排尿頻度:単位時間当たりの排尿回数。インターミッション間隔:2つの最大ボイド圧力の間の期間。膀胱容量:注入量を排尿回数で割った値。これらのパラメータおよび標準化された用語の詳細な説明はこれまでに公開されています。 11
FCは、連続または単サイクルの膀胱内注入法を用いて行うことができる。連続的な膀胱内圧測定により、複数回の排尿サイクルを記録し、再現性について。膀胱容量の測定精度は、残量が不明であるため制限されます。さらに、自由に移動するマウスでは、小さな空隙量(ひずみと性別に基づいて30〜184μL)を収集することは困難です。この方法を用いて空隙体積を記録することは、麻酔された製剤と比較してあまり正確ではないが、膀胱機能に対する麻酔薬の抑制効果を回避する点で優れている。膀胱容量を評価するには、単一サイクル膀胱内圧測定法を用いるべきである。この方法では、膀胱は、注入前に吸引によって空にされ、容量は、注入速度に時間から最大圧力までの関数として計算される。
小型げっ歯類で膀胱内圧測定を行う技術は公開されているが、ラットで行われた手術を記載し、マウス膀胱内圧測定をウレタン麻酔下で行うべきであると勧告した。 10このコミュニケーションの目標はtですo膀胱のドームに膀胱内チューブを埋め込むために使用される顕微手術技術と、膀胱の詰まった状態および覚醒している自由に動くマウスにおける排尿の持続中に、下部尿路機能をインビボで記録するために用いられる実験装置の両方を記載する。さらに、チューブ内の長さ、直径および材料ならびにインビボ FCを実施する方法が記録にどのように影響を及ぼすかについての実験が行われた。この実験プロトコルは、以前に公開された技術を要約し、実験結果に基づいて多くの変更を提案する。
プロトコル
動物は、施設ガイドラインに従って、バーモント大学動物飼育施設に収容された。すべての動物実験は、実験動物のケアおよび使用のためのNational Institutes of Healthガイドに従って実施した。
1.膀胱内チューブインプラント
- 外科処置のための管および器具の準備
- 移植のためにカテーテルを作るためにPE10チュービングの7cmピースを切断します。
- 端を開いたフレームに向かってゆっくりと前進させてPE10チューブの一端にフレアを作ります。
注:フレアが発生するとすぐに素早くチューブを引き抜きます。 - PE10チューブの外側のフレア端から4.5,5,5 cmのグルーガンの低熱量設定を使用して、汎用のホットグルーを3滴塗布します。これらは、動物の背中のチューブを固定するのに役立ちます。 ( 図1 )
- チューブを70%浸漬して滅菌する。その後、使用前に滅菌0.9%NaClで洗い流してください。システムに気泡が入るのを避けるため、チューブを満たしたままにしておきます。
- 手で近位端を左右に操作して30ゲージの針をハブから分離することにより、PE10カテーテルの端をシールするために30ゲージのプラグを作成します。最後に熱い糊を塗ってください。シールは水密であることを確認してください。 ( 図2 )
- 2対のデュモン#7湾曲マイクロフォース、2対のデュモン#5湾曲マイクロフォース、21G針、極細ストレート止血鉗子、マイクロハサミ、小型解剖用ハサミ、およびマイクロニードルホルダーを使用する。
- 処置を開始する前に、すべての器具を滅菌する。
- 動物の調製
- 動物を麻酔した後、まず腹部の下半分を剃り、次に動物に腹を立て、70%アルコールでベタディーン。乾燥を防ぐために、眼に獣医用軟膏を塗布する。次に、真っ直ぐな鈍いはさみとDumont#7湾曲マイクロフォースのペアを使用して、肩甲骨の間に1.5cmの長さの皮膚切開を作り、滅菌ドレープで覆われた加熱パッド(37℃)の上に動物を仰向けに置く。
- 最後に、腹部をアルコールとベタジンで洗浄します。
- 外科処置
注:手術用顕微鏡下で、3.15倍から20倍までの倍率ですべての外科手術を行います。滅菌ドレープに動物を置いた後、滅菌手袋を着用する。手術中は滅菌手順を続けます。- 動物を誘導箱に入れ、酸素キャリア(1L /分)を有する2%吸入イソフルランを用いて麻酔する。ノーズコーンに動物の頭を置き、酸素キャリア(1L /分)を含む2%吸入イソフルランを使用することにより、手順全体を通して麻酔を維持する。ネガを受けた後に手術を開始するトウピンチ試験からの応答。
- 真っ直ぐな鈍いはさみとDumont#7湾曲したマイクロフォースのペアを使用して、1.5cm下、中線の腹部を皮膚を通して切開する。その後、線虫と筋肉に沿って筋膜を通し、ドームと膀胱の上半分を露出させるために一致する切開を作成します。 1対のDumont#7湾曲マイクロフォースを使用して、各組織層に上向きの牽引力を加えることによって、膀胱を傷つけることは避けてください。暖かい生理食塩水を滴下して腹部内臓を乾燥させないようにしてください。
- 動物をその側に回転させて、首の首の切開部にアクセスします。切開部を通って皮下に狭い止血材を押す。皮下のチャンネルは、背中から開始し、横に沿って続行する必要があります。
- 器具の先端が胸郭の底に達すると、先端を正中線および腹部の内側に向けて回す(腹壁筋肉を突き刺すときにわずかなポップが生じる)。先端が筋層の下の腹部切開部に露出するまで、止血剤を前進させ続ける。 ( 図3 )
- 止血剤でチューブの "非膨張"端をつかんで、ゆっくりとツールを引き、チューブの端を首の後ろの切開部から引き出します。チューブのフレア端を膀胱のドームの真上に位置するように調整します。
- 6-0モノフィラメント縫合(非吸収性)のゆるいネクタイを作成し、膀胱ドームの上に置きます。このネクタイは後で膀胱内のチューブを固定するために使用されます。
- 腹部と膀胱の裏に糸くずのない小さな組織を置き、安定して持ち上げるのを助けます。
- PE10カテーテルのフレア端を膀胱に挿入する準備をする。
- 非支配的な手で、Dumont#7湾曲マイクロフォースで膀胱のドームを保持し、カテーテルが膀胱内に置かれるまでこのグリップを維持する。
- 21ゲージの針を使用するoドームの頂点に膀胱切開術を施す。カテーテルが容易に穴を通過できるように、#5湾曲したマイクロフォースの閉じた一対で、膀胱切開術を静かにプローブする。
- まだ支配的でない手に膀胱ドームを保持したまま、PE10カテーテルのフレア端を膀胱に入れます(フレアを膀胱頚部に押し込み、膀胱頸部に固定して滑り落ちないようにします)。
- 6-0モノフィラメント縫合糸を膀胱とチューブのドームの周りに結び、チューブをチューブの前に置きます。人工的に膀胱容量を減らすことを避けるために、可能な限り膀胱上の縫合糸を確実に結ぶようにしてください。 ( 図4 )
- あるいは、以下のようにして巾着縫合糸を用いてカテーテルを固定する。 6-0モノフィラメントを使用して、膀胱のドームにゆるい巾着縫合糸を作る。膀胱切開術を実施し、カテーテルを挿入するために、1.3.8.1〜1.3.8.3のステップに従う。巾着縫合糸を縛ってチューブを固定します。 ( 図5 )
- チューブの遠位端に30ゲージの針を備えた0.5mLインスリンシリンジを取り付けることによって、膀胱内のチューブの開存性および密閉を試験する。尿道口に滴が現れるまでゆっくりと0.9〜2%のNaCl 0.1〜0.2 mLを膀胱に満たし、膀胱を吸引で空にします。膀胱を満たして空にすることができることが重要です。
- ドームに漏れがない場合は、一対の湾曲したマイクロフォースで膀胱を支え、フレアが膀胱ドームの内側に当たるまで静かにチューブを引っ張ります。
- 閉める前に、小さなロールの組織を取り出し、膀胱が正常な位置にあることを確認します。
- 6-0の縫合糸を用いて2つの層(筋肉および皮膚)の腹壁を閉じる。前腹部筋膜(腹膜鞘の前壁)の縁のみを縫合して腹直筋を近似することが好ましい。
- 動物にチューブを固定するには、静かにro動物を腹部に移す。金属アンカーの皮下部分を肩甲間切開部に挿入する。 ( 図12 )チューブとアンカーを垂直マットレス縫合で包囲して固定するには、6-0縫合糸を使用します。
- チューブが引き抜かれるのを防ぐため、泡が皮膚の上下に残っていることを確認してください。チューブを皮膚の約2cm上に切断します。
- チューブの端に30ゲージのプラグ(ステップ1.1.5)をゆっくり挿入して、尿が漏れないようにします。
- 0.5mLの0.9%NaClを皮下に注入して水和させる。手術直後に術後鎮痛を与え、48時間維持する。
- 動物を赤外線ランプの下にあるケージに戻します。動物がケージの周りを自由に動くまで一定の観察を維持する。
- 動物を毎日モニターし、記録する前に5日間回復させる。
2.アウェイクシストometryレコーディング
- 記録プログラム、圧力変換器、および注入ポンプの準備。
- 動物を麻酔する前に、PE50チューブを使用して輸液ポンプ、圧力トランスデューサ、および22Gスイベルを接続します。 ( 図6 )
- コンピューター上で録音プログラム(例の表を参照)を開いて、システムの圧力を校正し、録音の準備をします。校正と録音中に同じ設定を使用してください。
- 20mLシリンジに10〜15mLの室温0.9%NaClを満たし、輸液ポンプにロードする。ポンプを0.6 mL / hの速度で注入するようにプログラムします。
- 圧力変換器を動物の膀胱または記録ケージの底と同じ高さに固定する。
- 22ゲージのスイベルを圧力トランスデューサの端に取り付けます(PE50 - チューブ - 圧力トランスデューサをスイベルに接続)
注:スイベルは、チューブがねじれたりねじれたりしないようにするために使用されます。動物は動く。 - シリンジポンプを進め、0.9%NaClを系内に流します。キャリブレーションを行う前に、気泡をすべて除去してください。
- 記録プログラムが実行されている状態で、ルーラーを使用して圧力(cm / H 2 O)を較正します。ゆっくりとPE50テザーの端を0〜30cmの範囲で動かします。必要に応じてゼロを調整します。
注:0 cmのマークは、録音ケージと圧力変換器の床と同じ高さにする必要があります。
- 録音ケージの中央の上に22ゲージのスイベルをサスペンドします。ケージの底には、ケージの下にある天びんの収集装置に尿が落ちるようにしてください。テザーの高さを調節して、マウスがケージの周りを自由に動かせるようにします。 ( 図7 )
- 完了したら、システムと外部PE50チューブが0.9%NaClで満たされ、すべての気泡が除去されていることを確認してください。
- 準備記録のための動物の植え付け
- 2%吸入イソフルランで動物を麻酔し、その腹部に置きます。 30ゲージのプラグを取り外し、PE10テザーの端にPE10チューブ(膀胱カテーテル)をスライドさせます。ホットグルーを使用して防水シールを形成してください。
- 麻酔をオフにして、パラレルワイヤーの床で動物を記録ケージに入れます。尿が分析天秤の上に置かれた収集装置に直接落ちるようになります。 ( 図7 )
- 動物がケージに入ったら記録を開始するが、注入を開始しない。麻酔から完全に回復するまで動物を監視する。膀胱圧が安定したら、0.9%NaClを0.6mL / hの速度で注入し始める。
注記:変更が加えられたときに、録画プログラムにメモを書き留めます。注入の開始、停止、または不規則性がいつ発生するかの記録を持つことが重要です。 - システムに漏れがないかどうかチェックし、動物が容易に漏れることを確認します食物と水に
- 3回の再現性のある排尿サイクルが得られるまで、静かな部屋で記録を続ける。
注記:動物は記録を通して完全に妨げられてはいけません。好ましくは、挙動を観察するために遠隔ビデオ監視を使用することが好ましい。
結果
管閉塞の間のシステム内の圧力の上昇および下降の一貫性における管材料および直径の間に有意差はなかった。ポリエチレン(PE)およびポリウレタン(PU)材料の両方において、膀胱壁の腫脹後の膀胱内チューブの移植が有意であった。 2日目に、重度の粘膜下腫脹が発症した。それは膀胱の断面の半分を占め、内腔の閉塞を引き起こした。 5日目に浮腫は完全に消散し、粘膜下領域に筋肉を部分的に侵入させる炎症細胞が浸潤したままになった。 7日目に、炎症性浸潤が有意に減少し、膀胱壁組織学は正常に戻った( 図8 )。 2日目および3日目に観察された組織腫脹の最大程度は、有意に障害された膀胱機能を示す行動排尿データと相関した( 図9 )。 poで正規化された無効周波数手術中5日目。
(最小の運動アーチファクトを有する)覚醒している自由に動くマウスの膀胱内圧は、10〜15cmH 2 Oのベースライン圧力によって特徴づけられ、充填サイクル中に10cm H 2 O以上変化しないかまたは徐々に増加する急激な脈動的な圧力上昇が起こり、次に排尿中に低下する( 図10および11 )。

図1: 膀胱への植え込みのためのPE10チューブ ( A )フレア端から4.5,5および5.5cmのホットグルーを滴下した7cmピースのPE10チューブ。 ( BおよびC )チューブのフレア端部を示す詳細図(チューブを膀胱に固定するために使用される)。es / ftp_upload / 55588 / 55588fig1large.jpg "target =" _ blank ">この図の拡大版を表示するには、ここをクリックしてください。

図2:PE10ブラダーチューブの外部部分のプラグ。プラグは30G針とホットグルーから作られています。 この図の拡大版を見るには、ここをクリックしてください。

図3:膀胱管のコース。腹部を通る配管の配置および首の首に向かってのその皮下経路を示す概略線図。 もっと見るにはここをクリックしてくださいこの図のバージョン。
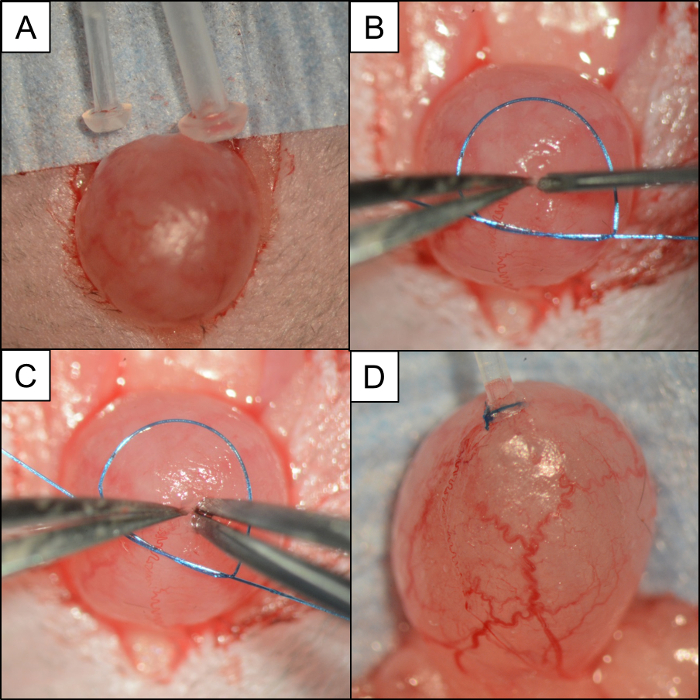
図4:膀胱/チューブの比較および喪失モノフィラメント縫合糸を使用してチューブを挿入して固定するために使用されるステップ。術中の写真: ( A )PE50とPE10をマウスの膀胱と比較した画像。 ( B )膀胱周囲に配置された6-0モノフィラメント縫合糸の小さなループ。 1対の#5マイクロフォースプルが膀胱のドームを留め、21G針を使用して膀胱切開術を行う。 ( C )膀胱のドームを解放しないで、反対側の手の#5マイクロフォースのペアがPE10カテーテルを挿入する前に穴をプローブする。 ( D )6-0モノフィラメント縫合で膀胱のドーム内に固定されたPE10カテーテル。 ここをクリックしてくださいこの図のより大きなバージョンを表示します。

図5:巾着縫合糸は、膀胱内の管を固定するための代替方法として使用することができる。 ( A )膀胱のドーム内の巾着縫合糸。 ( B )PE10チューブが財布の紐の中心を通って挿入されている。 この図の拡大版を見るには、ここをクリックしてください。

図6: 実験的セットアップ。圧力変換器および膀胱内カテーテルに直列に接続された注入ポンプ内に0.9%NaClを含むシリンジ。右下のコンピュータ画面には、3つの再現可能なmict願う。 この図の拡大版を見るには、ここをクリックしてください。

図7:実験録音設定 ( A )22Gスイベルは、録音ケージと天びんに吊り下げられています。 ( B )22GスイベルとPE50テザーを備えた輸液チューブの外側部分の全長を示す写真。 ( C )PE50チュービングを覆うスプリングシース付きの22Gスイベル。 この図の拡大版を見るには、ここをクリックしてください。

図8:Reの組織学的評価移植されたPE10チューブへの膀胱壁のスポンサー。手術の前、2、3、5および7日目にヘマトキシリンおよびエオシン(H&E)で染色された膀胱の横断面。術後5日目に膀胱壁の腫脹が解消した。この図の拡大版を見るには、ここをクリックしてください。

図9:ボイドスポットアッセイを用いた機能性膀胱評価。 0日(チューブインプラント前)、膀胱内チューブインプラント後2,3,4,5および7日に代表的な排尿パターンを記録したUV光で見た濾紙上の尿スポット。 この図の拡大版を見るには、ここをクリックしてください。

図10:膀胱内圧計。覚醒し、自由に動くマウスにおける膀胱内圧の代表的な痕跡。 3回の再現性のある排尿サイクルを示すトレース。 この図の拡大版を見るには、ここをクリックしてください。

図11:排尿相。初期の圧力上昇、ピーク圧力、およびベースラインまでの急速な圧力低下の間に高周波振動を伴う排尿相を示すトレース。 この図の拡大版を見るには、ここをクリックしてください。

図12:テザーの固定。 ( A )PE10カテーテルを動物に固定し、チューブが膀胱上で動かないようにするためのアンカー。ディスクはスプリングシースに取り付けられています。 ( B )外部PE50管に接続された内部PE10カテーテル。 この図の拡大版を見るには、ここをクリックしてください。
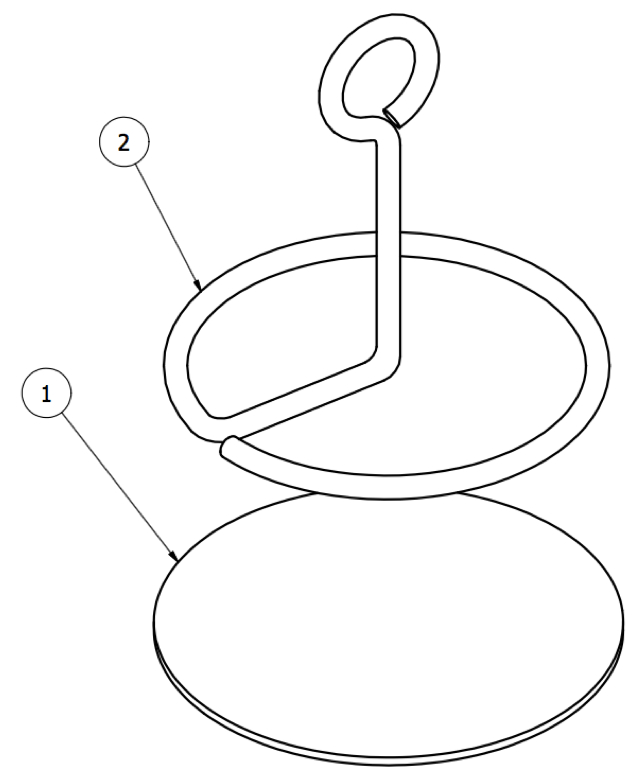
図13:スイベルアンカー。アンカーの皮下部分は、( 1 )布製のディスクと( 2 )金属ループからなる。
ディスカッション
膀胱内チューブの最適な材料およびサイズ
チュービングの直径が圧力記録に及ぼす影響を決定するために、我々は異なるマイクロ流体チューブを試験した。 PE50(0.58mm ID)、ポリウレタンPU027(0.4mm ID)、PE25(0.46mm ID)、およびPE10(0.28mm ID)。各チューブについて、チューブを0〜30cmの範囲で垂直方向に急速に動かしながら、1mL /時で注入ポンプを作動させて圧力を記録した。最初のin vivo実験ではPE50チュービングを使用しようとしましたが、マウスの膀胱と比較してチュービングのサイズが不十分でした( 図4A )。これは、マウスの覚醒膀胱内圧測定のためにPE50チュービングを使用すると、アーチファクトが生じ、データの解釈が困難になることを示唆しているSmithとKuchelによる発見を支持するが、 12覚醒の非拘束、覚醒拘束、および麻酔したマウス膀胱内圧測定。 図9 において、PE10はPE50と比較してより柔軟性があり、マウスが移動する際にチューブが膀胱に加える張力の量を減らし、動きアーチファクトを低減します。 PE10のセクションはできるだけ短く(7cm以下)することが重要です。長いPE10チューブは、圧力の読みが弱くなる可能性が高くなります。炎症反応を減少させるために膀胱内植込みにPUのようなより柔らかくより生物学的に不活性な材料を使用することに理論的利点があるが、術後膀胱の腫脹に有意差は生じなかった。さらに、より柔らかいPUチュービングを使用した試験は、よじれおよび詰まりに関連していた。
手術が膀胱壁の収縮および腫脹に及ぼす影響
今まで、膀胱機能および膀胱壁腫脹(膀胱内チューブの移植後)に関するデータは、ラットにのみ利用可能であった。以前の術後1〜3日で排尿回数が少なく、排尿頻度が高かった。ラットの膀胱機能の変化は膀胱の重度の腫脹に関連しており、3日後には水腫が治り始めることが示された日々。 16 PE10チューブの移植から生じる雄のC57BL / 6マウスの膀胱機能、膀胱壁の腫脹、および修復のタイムラインの変化をよりよく理解するために、濾紙記録法を用いて12時間の行動排尿回数を評価した。最後の記録の後、マウスを麻酔し、膀胱を肉眼で評価し、収穫し、固定し、組織学的に評価した。術後1日目および2日目に排尿回数が減少し、スポッティングが増加し、3日目まで排尿が増加した。5日目までに排尿行動が正常化した。収穫時およびH&E染色後の膀胱の総評価では、術後2日目および3日目に尿路下腫脹が生じ、膀胱は管移植後5日目および7日目に対照膀胱に類似するようになった。
臨床的な尿力学試験と同様に、大部分の実験室では室温0.9%のNaClを使用していました。以前の研究での注入速度は、10μL/分から100μL/分まで大きく変化する。マウスの膀胱機能に対する異なる注入速度の効果を比較した研究は行われていないが、より大きな動物試験で得られたデータは、より遅い充填率を用いるべきであると推奨した。マウス膀胱の容積が小さいため、蠕動ポンプは適切ではなく、連続的な機構注入ポンプが必要である。
最も正確で有用なFC記録は、限られたアーチファクトを伴う圧力変化の良好な透過率のバランスをとる。使用して得られた結果PE50に直接接続されたPE10チューブの短いセグメントは、マウス膀胱の正確な圧力測定を提供した。動物の動きによって引き起こされる圧力変動は、チューブが頚部の首筋を出る箇所で皮膚に固定することによって制限され得る( 図12および図13 )。これは、接着剤の気泡と、皮下に配置された金属製の布で覆われたプレートと、管を覆う金属ばねに取り付けられた外部の部分とからなる特別なアンカーを用いて達成することができる。チューブが膀胱を引っ張らないようにするための追加の方法としては、PE10チューブの内部に湾曲した皮下のトラックを作り、チューブに弛緩をもたらし、ねじれやよじれを防止するスイベルとテザーを使用する。これらの研究によって提供された文献および証拠に基づいて、インビボで最も再現可能で生理学的に正確な方法を提供するために、以下のステップが推奨されるマウスの膀胱内圧の記録。手術用顕微鏡と顕微手術用具を使用して、カテーテルを膀胱のドーム内に埋め込む。手術と記録の間に5日間の回復期間を置く。記録が実行され、食物と水に自由にアクセスできるように、同じケージ内の動物を順応させる。人間の接触を最小限に抑えて静かな環境で実験を行い、理想的には動物の行動を観察するために遠隔ビデオモニタリングを使用する。
開示事項
The authors have nothing to disclose.
謝辞
This study was funded by the Department of Surgery University of Vermont, Danish Council for Independent Research, and by the Odense University Hospital.
資料
| Name | Company | Catalog Number | Comments |
| Polyethylene (PE) 10 tubing | Instech | BTPE-10 | Fits 30G connectors/plugs |
| Polyethylene (PE) 50 tubing | Instech | BTPE-50 | Fits 22G connectors/plugs |
| 22 G single channel stainless steel swivel | Instech | 375/22 | |
| High Carbon Steel Utility Extension Spring (9/64" OD) | Grainger | 1NAH1 | Protects PE50 tubing - Cut to length |
| 22 G connector | Instech | SP22/12 | |
| Yutaoz Professional Hot Melt Adhesive Glue Gun | Yutaoz | Use low temperature setting (100 °C) - Any hot melt glue gun with an adjustable temperature range will work | |
| Surebonder DT-2010 all purpose glue stick | Surebonder | Any all purpose hot glue will work | |
| Dumont #5 curved microforceps | World Precision Instruments | 500232 | |
| Dumont #7 curved microforceps | World Precision Instruments | 14188 | |
| Mini dissecting scissors - straight | World Precision Instruments | 503240 | |
| Micro mosquito forceps (12.5 cm) | World Precision Instruments | 500451 | |
| Dissecting scissors - straight | World Precision Instruments | 14393 | |
| Castroviejo Needle Holder | World Precision Instruments | 503258 | |
| Isoflurane, USP | Phoenix | 2%, 1 L/min flow rate | |
| Buprenorphine | 0.05 mg/kg | ||
| 0.9% Sodium Chloride Irrigation, USP | Baxter | ||
| 6-0 Ethilon black monofilament, non-absorbable suture | Ethicon | Bladder tie | |
| 6-0 Vicryl violet braided, absorbable suture | Ethicon | Muscle suture, running | |
| 6-0 Prolene blue monofilament, non-absorbable suture | Ethicon | Skin suture, vertical mattress, buried interrupted | |
| KD Legato 210 infuse/withdraw pump | KD Scientific | 1.5 mL/hr | |
| Disposable pressure transducer | Digitimer | NL108T2 | |
| Pressure Amplifier | Digitimer | NL108A | |
| Power1401-3 data acquisition interface | Digitimer | ||
| Spike2 | Cambridge Electronic Design Limited | PC pressure recording software | |
| Leica MZ6 surgical operating microscope (3.2 - 20X) | Leica Microsystems | Magnification |
参考文献
- Perez, L. M., Webster, G. D. The History of Urodynamics. Neurourol Urodyn. 11 (1), 1-21 (1992).
- Fry, C. H., et al. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol Urodyn. 29 (4), 603-608 (2010).
- Maggi, C. A., Santicioli, P., Meli, A. The nonstop transvesical cystometrogram in urethane-anesthetized rats: a simple procedure for quantitative studies on the various phases of urinary bladder voiding cycle. J Pharmacol Methods. 15 (2), 157-167 (1986).
- Malmgren, A., et al. Cystometrical evaluation of bladder instability in rats with infravesical outflow obstruction. J Urol. 137 (6), 1291-1294 (1987).
- Pandita, R. K., Fujiwara, M., Alm, P., Andersson, K. E. Cystometric evaluation of bladder function in non-anesthetized mice with and without bladder outlet obstruction. J Urol. 164 (4), 1385-1389 (2000).
- Chang, H. Y., Havton, L. A. Differential effects of urethane and isoflurane on external urethral sphincter electromyography and cystometry in rats. Am J Physiol Renal Physiol. 295 (4), F1248-F1253 (2008).
- Matsuura, S., Downie, J. W. Effect of anesthetics on reflex micturition in the chronic cannula-implanted rat. Neurourol Urodyn. 19 (1), 87-99 (2000).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Peripheral Nerve Transplantation Combined with Acidic Fibroblast Growth Factor and Chondroitinase Induces Regeneration and Improves Urinary Function in Complete Spinal Cord Transected Adult Mice. PLoS One. 10 (10), e0139335(2015).
- Kadekawa, K., et al. Characterization of bladder and external urethral activity in mice with or without spinal cord injury--a comparison study with rats. Am J Physiol Regul Integr Comp Physiol. 310 (8), R752-R758 (2016).
- Uvin, P., et al. The use of cystometry in small rodents: a study of bladder chemosensation. J Vis Exp. (66), (2012).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol Urodyn. 30 (5), 636-646 (2011).
- Smith, P. P., Kuchel, G. A. Continuous uroflow cystometry in the urethane-anesthetized mouse. Neurourol Urodyn. 29 (7), 1344-1349 (2010).
- Aizawa, N., Homma, Y., Igawa, Y. Influence of High Fat Diet Feeding for 20 Weeks on Lower Urinary Tract Function in Mice. Low Urin Tract Symptoms. 5 (2), 101-108 (2013).
- Bjorling, D. E., et al. Evaluation of voiding assays in mice: impact of genetic strains and sex. Am J Physiol Renal Physiol. 308 (12), F1369-F1378 (2015).
- Morikawa, K., et al. Effects of various drugs on bladder function in conscious rats. Jpn J Pharmacol. 50 (4), 369-376 (1989).
- Yaksh, T. L., Durant, P. A., Brent, C. R. Micturition in rats: a chronic model for study of bladder function and effect of anesthetics. Am J Physiol. 251 (6 Pt 2), R1177-R1185 (1986).
- Cornelissen, L. L., Misajet, B., Brooks, D. P., Hicks, A. Influence of genetic background and gender on bladder function in the mouse. Auton Neurosci. 140 (1-2), 53-58 (2008).
- Lemack, G. E., Zimmern, P. E., Vazquez, D., Connell, J. D., Lin, V. K. Altered response to partial bladder outlet obstruction in mice lacking inducible nitric oxide synthase. J Urol. 163 (6), 1981-1987 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved