Method Article
Evaluación del procedimiento para realizar cistometría despierta en un modelo de ratón
* Estos autores han contribuido por igual
En este artículo
Resumen
Este estudio describe los procedimientos quirúrgicos y técnicas experimentales para realizar cistometría despierta en un ratón que se mueve libremente. Además, proporciona evidencia experimental para apoyar su optimización y estandarización.
Resumen
La cistometría de llenado despierto se ha utilizado durante mucho tiempo para evaluar la función de la vejiga en ratones que se mueven libremente, sin embargo, los métodos específicos utilizados varían entre los laboratorios. El objetivo de este estudio fue describir el procedimiento microquirúrgico utilizado para implantar un tubo intravesical y la técnica experimental para registrar la presión de la vejiga urinaria en un ratón despierto y de movimiento libre. Además, los datos experimentales se presentan para mostrar cómo la cirugía, así como el tipo de tubo y el tamaño, afectan la función del tracto urinario inferior y la sensibilidad de grabación. El efecto del diámetro del tubo sobre el registro de presión se evaluó tanto en tubos de polietileno como de poliuretano con diferentes diámetros internos. Posteriormente, el tubo de mejor rendimiento de ambos materiales se implantó quirúrgicamente en la cúpula de la vejiga urinaria de ratones C57BL / 6 macho. Se registró una frecuencia de micturación de doce horas durante toda la noche en animales sanos e intactos 2, 3, 5 y 7 días después de la cirugía. En la cosecha, vejigas wSe evaluaron los signos de hinchamiento utilizando la observación bruta y se procesaron posteriormente para el análisis patológico. La mayor extensión de hinchazón de la vejiga se observó en los días 2 y 3, que se correlacionó con los datos de micción conductual que muestran una función vesical significativamente deteriorada. Al día 5, la histología de la vejiga y la frecuencia de micción se habían normalizado. Basado en la literatura y la evidencia proporcionada por nuestros estudios, proponemos los siguientes pasos para el registro in vivo de la presión intravesical y el volumen de vacío en un ratón despierto: 1) Realizar la cirugía con un microscopio operativo y herramientas microquirúrgicas, 2) Utilizar polietileno-10 Tubería para minimizar los artefactos de movimiento, y 3) realizar cistometría en el día 5 postoperatorio, cuando se disuelve la hinchazón de la vejiga.
Introducción
La cistometría de llenado (FC) es un método de diagnóstico que consiste en colocar un catéter en la vejiga urinaria para registrar la presión durante el llenado lento de la vejiga. Introducido por primera vez en 1927 como un método de diagnóstico clínico para evaluar la función del tracto urinario inferior, se ha mantenido ampliamente utilizado. 1 En aplicaciones de investigación, el FC puede usarse para probar la función de la vejiga en modelos animales sanos y enfermos y para estudiar los efectos de los agentes farmacológicos. Modelos animales de roedores se utilizan comúnmente para investigar la función del tracto urinario inferior. 2 En este grupo de mamíferos, FC se desarrolló por primera vez para su uso en ratas. 3 Aquí, la metodología para implantar un tubo en la vejiga urinaria y realizar CF ha sido bien descrita y utilizada por muchos investigadores con un nivel aceptable de reproducibilidad. La disponibilidad de cepas transgénicas y knock out hace de los ratones una especie valiosa para numerosas áreas de investigación,Incluyendo el campo de la disfunción del tracto urinario inferior. La metodología utilizada para realizar la cistometría del ratón varía apreciablemente entre los laboratorios, lo que dificulta la comparación de los resultados. 5
En comparación con los modelos ex vivo , FC preserva la anatomía del tracto urinario inferior, permitiendo evaluar la función coordinada entre la vejiga y su salida durante las fases de almacenamiento y micción del ciclo miccional. La investigación anterior demuestra que los anestésicos numerosos, de uso general suprimen la contracción de la micción. Los agentes que preservan la contracción del músculo liso de la vejiga urinaria (uretano, α-cloralosa, ketamina y xilazina), permitiendo al animal miccionarte, todavía reducen significativamente la capacidad funcional de la vejiga y suprimen la neurotransmisión. 6 , 7 , 8 , 9 Aunque técnicamente más desafiante, el FC realizado en awLos animales ambulantes preservan la integridad funcional del reflejo de la micción.
La función del tracto urinario inferior está influenciada por múltiples factores, incluyendo el hinchamiento post-operatorio de la pared de la vejiga, el estrés debido al dolor y la incomodidad, y las influencias ambientales. El uso de una técnica quirúrgica que minimiza el daño tisular durante la implantación del tubo y los métodos de registro que reducen el movimiento del tubo, mientras que simultáneamente permite que el animal se mueva libremente, son esenciales para obtener grabaciones precisas y reproducibles.
Si se realiza adecuadamente, in vivo FC en animales que se mueven libremente puede proporcionar datos que reflejen fiablemente la función fisiológica de la vejiga. 10 FC en animales en movimiento libre puede proporcionar datos sobre los siguientes parámetros; Presión basal o basal: Presión mínima entre dos micciones. Presión de la intermitencia: Presión media entre dos micciones. Presión umbral: Presión intravesical immAntes de la micción. Presión máxima: Presión máxima de la vejiga durante un ciclo de micción. Actividad espontánea (o media oscilatoria de la intermitución): Presión de la interfunción menos presión basal. Contracciones no votivas: Aumento de la presión intravesical durante la fase de llenado, no asociado con la liberación de líquido. Cumplimiento de la vejiga: Capacidad de la vejiga dividida por la presión umbral menos la presión basal. Frecuencia de micción: Número de micciones por unidad de tiempo. Intervalo de intermitencia: Período entre dos presiones de vacío máximas. Capacidad de la vejiga: Volumen infundido dividido por el número de micciones. Se ha publicado previamente una descripción detallada de estos parámetros y una terminología estandarizada. 11
FC se puede realizar utilizando un método de infusión intravesical de ciclo único o continuo. La cistometría continua permite registrar múltiples ciclos de micción y seleccionar datos representativos basados enSobre la reproducibilidad. Su precisión en la medición de la capacidad de la vejiga está limitada debido al volumen residual desconocido. Además, es difícil recolectar pequeños volúmenes anidados (que basados en la tensión y el sexo varían entre 30 y 184 μL) en ratones que se desplazan libremente. El uso de este método para registrar el volumen anulado es menos preciso en comparación con una preparación anestesiada, pero es superior en cuanto que evita los efectos supresores de los anestésicos sobre la función de la vejiga. Se debe usar cistometría de ciclo único para evaluar la capacidad de la vejiga. En este método, la vejiga se vacía por aspiración antes de la infusión y la capacidad se calcula como una función de la velocidad de infusión multiplicada por el tiempo hasta la presión máxima.
Aunque se ha publicado la técnica de realizar cistometría en roedores pequeños, describió la cirugía realizada en una rata y recomendó que la cistometría del ratón se realizara bajo anestesia con uretano. 10 El objetivo de esta comunicación esO describir las técnicas microquirúrgicas utilizadas para implantar un tubo intravesical en la cúpula de la vejiga urinaria y la configuración experimental utilizada para registrar la función del tracto urinario inferior, in vivo , durante el llenado continuo de la vejiga y la micción en un ratón despierto que se mueve libremente. Además, se realizaron experimentos para determinar cómo la longitud, el diámetro y el material de los tubos, así como la metodología para realizar FC in vivo , afectan a la grabación. Este protocolo experimental resume técnicas previamente publicadas y propone una serie de modificaciones basadas en resultados experimentales.
Protocolo
Los animales fueron alojados en la Universidad de Vermont Animal Care Facility de acuerdo con las directrices institucionales. Todos los experimentos con animales se realizaron de acuerdo con la guía de los Institutos Nacionales de Salud para el cuidado y uso de animales de laboratorio.
1. Implante de tubo intravesical
- Preparación de tubos e instrumentos para el procedimiento quirúrgico
- Corte una pieza de 7 cm de tubo PE10 para hacer el catéter para la implantación.
- Crear una llamarada en un extremo del tubo PE10 por avanzar lentamente el extremo hacia una llama abierta.
NOTA: Retire rápidamente el tubo tan pronto como se desarrolle la llamarada. - Aplique tres gotas de pegamento caliente para todos los fines, usando el ajuste de calor bajo en una pistola de pegamento, a 4,5, 5 y 5,5 cm del extremo ensanchado en el exterior del tubo PE10. Esto ayudará a asegurar el tubo en la espalda del animal. ( Figura 1 )
- Esterilizar la tubería remojándola en 70%Etanol y luego enjuagar con NaCl estéril al 0,9% antes de su uso. Deje el tubo lleno para evitar la introducción de burbujas de aire en el sistema.
- Crear un enchufe de calibre 30 para sellar el extremo del catéter PE10 separando una aguja de calibre 30 del cubo manualmente manipulando el extremo proximal de lado a lado. Aplique una gota de pegamento caliente al final. Asegúrese de que el sello esté hermético. ( Figura 2 )
- Utilice los siguientes instrumentos microquirúrgicos: Dos pares de microforceps curvos de Dumont # 7, dos pares de microforceps curvos Dumont # 5, una aguja 21 G, hemostato recto ultrafino, micro tijeras, pequeñas tijeras de disección y un porta agujas micro.
- Esterilizar todos los instrumentos antes de comenzar el procedimiento.
- Preparación del animal
- Después de anestesiar al animal, afeitarse primero la parte inferior del abdomen, luego girar el animal hacia afuera y afeitarse y limpiar el área en la parte superior de la espalda con alcohol al 70% seguido de betadina. Aplique el ungüento del veterinario a los ojos para prevenir sequedad. A continuación, utilice un par de tijeras rectas y romas y un par de microforzadas curvas de Dumont # 7 para realizar una incisión cutánea de 1,5 cm de longitud entre las escápulas y colocar el animal en decúbito supino sobre una almohadilla térmica (37 ° C) cubierta con cortinas estériles.
- Finalmente, limpie el abdomen con alcohol y betadine.
- Procedimiento quirúrgico
NOTA: Realizar todos los procedimientos quirúrgicos bajo un microscopio de operación con una ampliación que varía de 3.15X a 20X. Después de colocar el animal en las cortinas estériles, ponerse guantes estériles. Continúe usando procedimientos estériles durante toda la cirugía.- Colocar el animal en una caja de inducción y anestesiar usando isoflurano inhalado al 2% con un portador de oxígeno (1 L / min). Mantenga la anestesia durante todo el procedimiento colocando la cabeza del animal en un cono de la nariz y usando isoflurano inhalado al 2% con un portador de oxígeno (1 L / min). Comience la cirugía después de recibir un negativoDe la prueba de pinzamiento de la punta.
- Use un par de tijeras rectas y romas y un par de microforzadas curvas de Dumont # 7 para hacer una incisión abdominal de 1,5 cm más bajo, a través de la piel. Posteriormente, crear una incisión a juego a través de la fascia a lo largo de la línea alba y el músculo para exponer la cúpula y la mitad superior de la vejiga urinaria. Evite herir la vejiga aplicando tracción hacia arriba a cada capa de tejido usando un par de microforzadas curvas Dumont # 7. Mantenga las vísceras abdominales de la desecación añadiendo gotas de solución salina fisiológica tibia.
- Gire el animal sobre su lado para acceder a la incisión en la nuca. Empuje un hemostato estrecho por vía subcutánea a través de la incisión. El canal subcutáneo debe comenzar en la parte posterior, y continuar a lo largo del lado.
- Una vez que la punta del instrumento llegue al fondo de la caja torácica, gire la punta hacia la línea media y el interior del abdomen (habrá un leve estallido al perforar los músculos de la pared abdominal). Continúe avanzando el hemostato hasta que la punta se expone en la incisión abdominal debajo de la capa muscular. ( Figura 3 )
- Sujete el extremo "no acampanado" del tubo con el hemostato y retraiga lentamente la herramienta, sacando el extremo del tubo a través de la incisión en la parte posterior del cuello. Ajuste el extremo ensanchado de la tubería de manera que quede directamente por encima de la cúpula de la vejiga.
- Hacer un lazo suelto de 6-0 sutura de monofilamento (no absorbible) y colocarlo en la parte superior de la cúpula de la vejiga. Esta corbata se utilizará más tarde para asegurar el tubo en la vejiga.
- Coloque un pequeño rollo de tejido sin pelusa en el abdomen y detrás de la vejiga para ayudar a estabilizarlo y elevarlo.
- Prepárese para insertar el extremo ensanchado del catéter PE10 en la vejiga.
- En la mano no dominante, sostenga la cúpula de la vejiga con Dumont # 7 curvo microforceps y mantener este agarre hasta que el catéter se coloca en la vejiga.
- Utilice una aguja de calibre 21O hacer una cistotomía en el ápice de la cúpula. Suavemente sonda la cistotomía con un par cerrado de # 5 curvo microforceps para asegurarse de que el catéter puede pasar fácilmente a través del agujero.
- Mientras todavía sostiene la cúpula de la vejiga en la mano no dominante, coloque el extremo ensanchado del catéter PE10 en la vejiga (empuje la llamarada hacia abajo hasta el cuello de la vejiga para que no se resbale mientras se asegura).
- Ate la sutura monofilamento 6-0 alrededor de la cúpula de la vejiga y el tubo con la corbata situada antes de la tubería. Asegúrese de atar la sutura tan alto en la vejiga como sea posible para evitar reducir artificialmente la capacidad de la vejiga. ( Figura 4 )
- Alternativamente, asegure el catéter usando una sutura de cadena de monedero como sigue. Hacer una sutura suelta cadena de bolsa en la cúpula de la vejiga utilizando monofilamento 6-0. Siga los pasos 1.3.8.1 - 1.3.8.3 para realizar la cistotomía e insertar el catéter. Asegure el tubo atando la sutura de la correa del bolso. ( Figura 5 )
- Prueba de la permeabilidad y sellado del tubo en la vejiga mediante la fijación de una jeringa de 0,5 ml de insulina con una aguja de calibre 30 hasta el extremo distal del tubo. Llenen lentamente la vejiga con 0,1 - 0,2 ml de NaCl al 0,9% hasta que aparezca una gota en el orificio uretral, luego vacíe la vejiga por aspiración. Es importante que la vejiga se pueda llenar y vaciar.
- Si no se producen fugas en la cúpula, abrazadera de la vejiga con un par de microfuerzas curvadas y tire suavemente de la tubería hasta que la llamarada se apoye contra el interior de la cúpula de la vejiga.
- Antes de cerrar, retire el pequeño rollo de tejido y asegúrese de que la vejiga esté en su posición normal.
- Cierre la pared abdominal en dos capas (músculo y piel) con sutura 6-0. Es preferible aproximar el músculo recto abdominal suturando sólo los bordes de la fascia abdominal anterior (pared anterior de la vaina del recto).
- Para asegurar el tubo en los animales,El animal sobre su abdomen. Inserte la porción subcutánea del anclaje metálico en la incisión interescapular. ( Figura 12 ) Utilice una sutura de 6-0 para asegurar el tubo y el anclaje, rodeándolos con una sutura de colchón vertical.
- Asegúrese de que una burbuja de pegamento permanezca por encima y por debajo de la piel para evitar que el tubo se retire. Corte el tubo aproximadamente 2 cm por encima de la piel.
- Inserte suavemente el tapón de calibre 30 (paso 1.1.5) en el extremo del tubo para evitar que la orina salga.
- Inyectar 0,5 ml de NaCl al 0,9% por vía subcutánea para hidratación. Administre analgesia postoperatoria inmediatamente después de la cirugía y mantenga durante 48 h.
- Coloque el animal de nuevo en su jaula situada debajo de una lámpara infrarroja. Mantenga una observación constante hasta que el animal se mueva libremente alrededor de la jaula.
- Vigilar el animal diariamente y permitir que se recupere durante 5 días antes de la grabación.
2. Cisto despiertoOmetry Grabación
- Preparación del programa de grabación, transductor de presión y bomba de infusión.
- Antes de anestesiar al animal, conecte la bomba de infusión, el transductor de presión y el giro 22 G con tubo PE50. ( Figura 6 )
- Abra el programa de grabación (ver tabla de materiales para un ejemplo), en un ordenador para calibrar la presión del sistema y preparar la grabación. Asegúrese de utilizar los mismos ajustes durante la calibración y la grabación.
- Llenar una jeringa de 20 ml con 10 - 15 ml de NaCl al 0,9% a temperatura ambiente y cargar en la bomba de infusión. Programe la bomba para infundir a una velocidad de 0,6 ml / h.
- Asegure el transductor de presión a la misma altura que la vejiga del animal o la parte inferior de la caja de registro.
- Sujete el eslabón giratorio de calibre 22 al extremo del transductor de presión (PE50 - tubo - transductor de presión para girar)
NOTA: El eslabón giratorio se utiliza para evitar que el tubo se tuerza oS el animal se mueve. - Avance la bomba de la jeringa para limpiar el NaCl al 0.9% a través del sistema. Asegúrese de retirar todas las burbujas de aire antes de calibrar.
- Con el programa de grabación en ejecución, utilice una regla para calibrar la presión (cm / H 2 O). Mueva lentamente el extremo de la abrazadera PE50 de 0 a 30 cm. Ajuste el cero si es necesario.
NOTA: La marca de 0 cm debe estar a la misma altura que el piso de la caja de registro y el transductor de presión.
- Suspender el giro de calibre 22 por encima del centro de la caja de registro. Asegúrese de que el fondo de la jaula permita que la orina caiga sobre el dispositivo colector de la balanza situada debajo de la jaula. Ajuste la altura de la atadura para que el ratón pueda moverse libremente alrededor de la jaula sin forzar o estirar la tubería. ( Figura 7 )
- Cuando termine, compruebe que el sistema y el tubo PE50 externo estén llenos de NaCl al 0,9% y que se hayan eliminado todas las burbujas de aire.
- DeberesAción del animal para su registro
- Anestesiar al animal con isoflurano inhalado al 2% y colocarlo sobre su abdomen. Retire el tapón de calibre 30 y deslice el tubo PE10 (catéter de la vejiga) en el extremo de la abrazadera PE50. Utilice pegamento caliente para formar un sello hermético.
- Apague la anestesia y coloque el animal en la caja de registro con un piso de alambre paralelo, lo que permitirá que la orina caiga directamente sobre un dispositivo colector colocado encima de una balanza analítica. ( Figura 7 )
- Comience la grabación una vez que el animal está en la jaula, pero no comience a infundir. Monitoree al animal hasta que se recupere completamente de la anestesia. Una vez que la presión de la vejiga se estabilice, empiece a infundir NaCl al 0,9% a una velocidad de 0,6 ml / h.
NOTA: Anote una nota en el programa de grabación cuando se realicen cambios. Es importante tener un registro de cuándo comienza la infusión, se producen paradas o irregularidades. - Revise el sistema para ver si hay fugas y asegúrese de que el animal tenga accAlimentos y agua.
- Continúe la grabación en una habitación tranquila hasta que se obtengan tres ciclos de micción reproducibles.
NOTA: El animal debe permanecer completamente inalterado durante toda la grabación. De preferencia, utilice la monitorización remota de vídeo para observar el comportamiento.
Resultados
No hubo diferencias significativas entre los materiales de la tubería y los diámetros en la consistencia de la subida y caída de la presión dentro del sistema durante la oclusión del tubo. El aumento de la pared de la vejiga después de la implantación del tubo intravesical fue significativo tanto para los materiales de polietileno (PE) como para los materiales de poliuretano (PU). El día 2, se desarrolló una hinchazón submucosa severa. Se ocupó de la mitad de la sección transversal de la vejiga, lo que conduce a la obstrucción de la luz. El día 5, el edema se resolvió por completo, dejando las áreas submucosas infiltradas con células inflamatorias que invadieron parcialmente la muscular. El día 7, la infiltración inflamatoria se redujo significativamente y la histología de la pared vesical volvió a la normalidad ( Figura 8 ). La mayor extensión de la hinchazón de los tejidos observada en el día 2 y el día 3 se correlacionó con los datos de micción conductual que mostraban una función vesical significativamente deteriorada ( Figura 9 ). Frecuencia de micción normalizada por po Día de st-operative 5.
La presión intravesical en un ratón despierto que se mueve libremente (con artefactos de movimiento mínimos) se caracteriza por una presión de línea de base de 10-15 cm H 2 O, que puede permanecer sin cambios o aumentar gradualmente en no más de 10 cm H 2 O durante el ciclo de llenado , Seguido por un aumento repentino, pulsátil de la presión y luego gota durante el vaciado ( Figuras 10 y 11 ).

Figura 1: Tubo PE10 para su implantación en la vejiga urinaria. ( A ) Una pieza de 7 cm de tubo PE10 con gotas de pegamento caliente a 4,5, 5 y 5,5 cm del extremo ensanchado. ( B y C ) Un cuadro detallado que muestra el extremo ensanchado del tubo (utilizado para asegurar el tubo en la vejiga).Es / ftp_upload / 55588 / 55588fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Enchufe para la porción externa de la tubería de vejiga PE10. El enchufe se hace de una aguja de 30 G y del pegamento caliente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Curso de la tubería de la vejiga. Dibujo lineal esquemático que ilustra la colocación del tubo a través del abdomen y su vía subcutánea hacia la nuca. Haga clic aquí para ver unaVersión de esta figura.
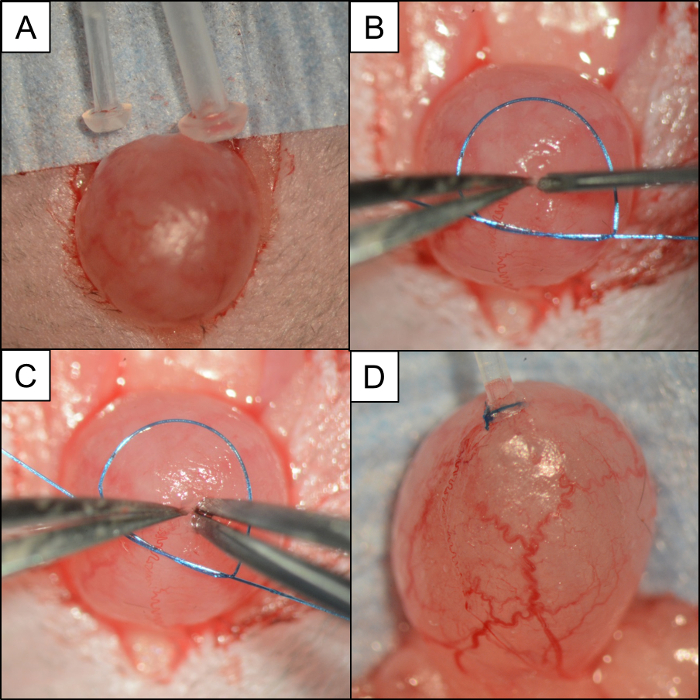
Figura 4: Comparación de la vejiga / tubo y los pasos utilizados para insertar y asegurar el tubo con una sutura monofilamento de pérdida. Fotografías intraoperatorias que representan: ( A ) Imagen que compara PE50 y PE10 con una vejiga urinaria de ratón. ( B ) Un pequeño lazo de sutura de monofilamento 6-0 colocado alrededor de la vejiga. Un par de # 5 microforceps abrocha la cúpula de la vejiga mientras que una aguja de 21 G se utiliza para hacer la cistotomía. ( C ) Sin liberar la cúpula de la vejiga, un par de micro-fuerzas # 5 en la mano opuesta prueba el agujero antes de insertar el catéter PE10. ( D ) Cateter PE10 asegurado en la cúpula de la vejiga con sutura monofilamento 6-0. Haga clic aquíPara ver una versión más grande de esta figura.

Figura 5: Una sutura de cuerda de bolsa se puede utilizar como un método alternativo para asegurar el tubo en la vejiga. ( A ) Sutura de la correa del bolso en la cúpula de la vejiga. ( B ) tubo PE10 insertado a través de un centro de la cadena de bolsa. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Configuración experimental. Jeringa que contiene 0,9% de NaCl en la bomba de infusión conectada en serie al transductor de presión y al catéter intravesical. La pantalla de la computadora en la parte inferior derecha muestra tres mict reproducibleLos ciclos de nutrición. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Configuración de la grabación experimental. ( A ) 22 G giratorio suspendido sobre una jaula de grabación y el equilibrio. ( B ) Fotografía que muestra toda la longitud de la porción externa del tubo de infusión con un eslabón giratorio de 22 G y una sujeción PE50. ( C ) Un giro de 22 G con una vaina de resorte que cubre el tubo PE50. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Evaluación Histológica del ReRespuesta de la pared urinaria de la vejiga a un tubo implantado PE10. Secciones transversales de la vejiga urinaria teñidas con hematoxilina y eosina (H & E) antes, 2, 3, 5 y 7 días después de la cirugía. La hinchazón de la pared de la vejiga se resuelve en el día 5 postoperatorio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Evaluación funcional de la vejiga utilizando el ensayo de anulación de vaciamiento. Manchas de orina en papel de filtro visto con luz UV documentando el patrón de micción representativo en el día 0 (antes del implante de tubo), 2, 3, 4, 5 y 7 después del implante de tubo intravesical. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Cistometrograma. Traza representativa de la presión intravesical de la vejiga en un ratón despierto, que se mueve libremente. Traza mostrando 3 ciclos de micción reproducibles. Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Fase de micción. Traza representando la fase de micción con oscilaciones de alta frecuencia durante el aumento inicial de presión, presión máxima y una caída de presión rápida a la línea de base. Haga clic aquí para ver una versión más grande de esta figura.

Figura 12: Anclaje del anclaje. ( A ) Ancla utilizada para fijar el catéter PE10 en el animal e impedir que el tubo empuje la vejiga. El disco está unido a la vaina del muelle. ( B ) Cateter interno PE10 conectado a la tubería PE50 externa. Haga clic aquí para ver una versión más grande de esta figura.
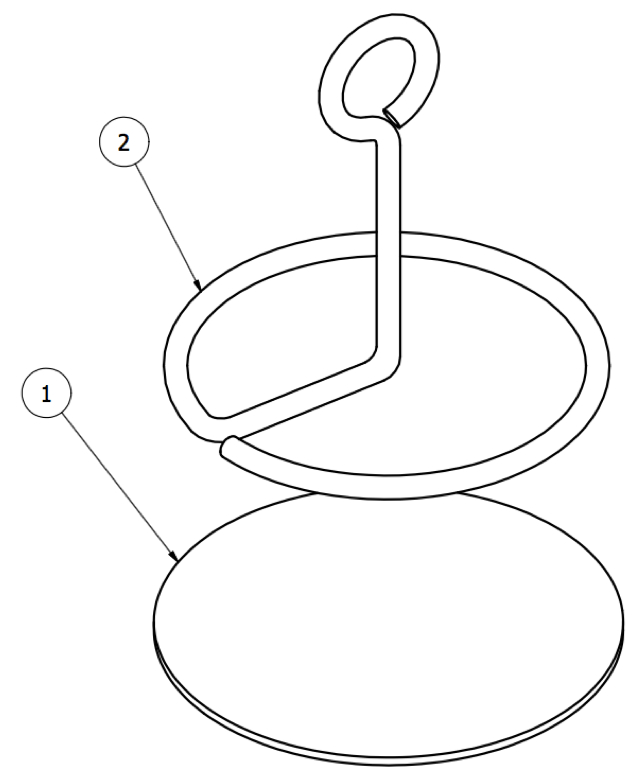
Figura 13: Anclaje giratorio. Porción subcutánea del ancla consistente en ( 1 ) un disco hecho de tela y ( 2 ) un bucle de metal.
Discusión
Material óptimo y tamaño de la tubería intravesical
Para determinar el efecto del diámetro del tubo en las grabaciones de presión, hemos probado diferentes tubos microfluídicos; PE50 (0,58 mm ID), poliuretano PU027 (0,4 mm ID), PE25 (0,46 mm ID) y PE10 (0,28 mm ID). Para cada tubo, se registró presión con la bomba de infusión funcionando a 1 ml / h, mientras que se desplazaba rápidamente el tubo verticalmente de 0 a 30 cm. Los ensayos iniciales in vivo intentaron usar la tubería PE50, pero no tuvieron éxito debido al tamaño del tubo comparado con la vejiga del ratón ( Figura 4A ). Aunque esto apoya el hallazgo de Smith y Kuchel, quienes sugieren que el uso de tubos PE50 para la cistometría despierta en un ratón crea artefactos, lo que dificulta la interpretación de los datos12, es importante notar que otros han usado con éxito la tubería PE50 tanto en no despierto , Cistometría de ratones retenida y anestesiada. 9 ,
Efectos de la cirugía sobre la contractilidad e inflamación de la pared de la vejiga
Hasta ahora, los datos sobre la función de la vejiga y la hinchazón de la pared de la vejiga, después del implante de un tubo intravesical, sólo estaban disponibles para las ratas. De acuerdo con anteriores sTudies, el volumen de la micción fue menor y la frecuencia de la micción fue mayor en los días postoperatorios 1 - 3. 15 También se demostró que las alteraciones en la función vesical de una rata se asociaron con hinchazón severa de la vejiga, días. 16 Para obtener una mejor comprensión del cambio en la función de la vejiga urinaria, hinchazón de la pared de la vejiga, y la reparación del tiempo de los ratones machos, C57BL / 6, que se producen a partir de la implantación de tubería PE10, . Después de la última grabación, el ratón fue anestesiado y la vejiga fue evaluada, recogida, fijada y evaluada histológicamente. En los días 1 y 2 postoperatorios, disminuyó la frecuencia de micción y aumentó el manchado, seguido de un aumento de la micción al día 3. Comportamiento de micción normalizado en el día 5. La evaluación macroscópica de las vejigas en la cosecha y después de la tinción con H & E reveló la mayor cantidadDe hinchamiento suburothelial en los días postoperatorios 2 y 3, con las vejigas que se asemejan a las vejigas de control en los días 5 y 7 después del implante de tubo.
Al igual que en los estudios urodinámicos clínicos, la mayoría de los laboratorios usaron NaCl al 0,9% a temperatura ambiente. La tasa de infusión en estudios previos varía significativamente de 10 μL / min a 100 μL / min. 17 , 18 No se ha realizado un estudio comparando los efectos de diferentes tasas de infusión en la función de la vejiga en un ratón, sin embargo, los datos obtenidos en estudios con animales de mayor tamaño recomendaron que se usen tasas de llenado más lentas. Debido al pequeño volumen de la vejiga del ratón, las bombas peristálticas no son apropiadas y se necesita una bomba de infusión de mecanismo continuo.
Las grabaciones FC más precisas y utilizables equilibran la buena transmitancia de los cambios en la presión con artefactos limitados. Los resultados obtenidosUn segmento corto de tubo PE10 conectado directamente a PE50 proporcionó una medición precisa de la presión en la vejiga urinaria del ratón. Las fluctuaciones de presión causadas por el movimiento del animal pueden ser limitadas fijando el tubo a la piel en el punto donde sale en la nuca ( Figuras 12 y 13 ). Esto podría conseguirse con el uso de burbujas de cola y un anclaje especial que consta de una placa cubierta de tela metálica colocada subcutáneamente, y la pieza externa, que está unida al resorte metálico que cubre el tubo. Otros métodos para evitar que el tubo tire de la vejiga incluyen la creación de una pista subcutánea curvada para la parte interna de la tubería PE10, que proporciona holgura en el tubo y utilizando un eslabón giratorio y un tirante, que impiden la torsión y la torcedura. Basándose en la literatura y la evidencia proporcionada por estos estudios, se recomiendan los siguientes pasos para proporcionar el método más reproducible y fisiológicamente exacto para in vivoRegistro de la presión intravesical en un ratón. Utilice un microscopio de funcionamiento y herramientas microquirúrgicas para implantar el catéter en la cúpula de la vejiga urinaria. Permita un período de recuperación de 5 días entre la cirugía y la grabación. Aclimate al animal en la misma jaula en que se realizará la grabación y proporcione acceso gratuito a alimentos y agua. Realice el experimento en un ambiente tranquilo con un mínimo contacto humano, idealmente utilice el monitoreo de video remoto para observar el comportamiento del animal.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This study was funded by the Department of Surgery University of Vermont, Danish Council for Independent Research, and by the Odense University Hospital.
Materiales
| Name | Company | Catalog Number | Comments |
| Polyethylene (PE) 10 tubing | Instech | BTPE-10 | Fits 30G connectors/plugs |
| Polyethylene (PE) 50 tubing | Instech | BTPE-50 | Fits 22G connectors/plugs |
| 22 G single channel stainless steel swivel | Instech | 375/22 | |
| High Carbon Steel Utility Extension Spring (9/64" OD) | Grainger | 1NAH1 | Protects PE50 tubing - Cut to length |
| 22 G connector | Instech | SP22/12 | |
| Yutaoz Professional Hot Melt Adhesive Glue Gun | Yutaoz | Use low temperature setting (100 °C) - Any hot melt glue gun with an adjustable temperature range will work | |
| Surebonder DT-2010 all purpose glue stick | Surebonder | Any all purpose hot glue will work | |
| Dumont #5 curved microforceps | World Precision Instruments | 500232 | |
| Dumont #7 curved microforceps | World Precision Instruments | 14188 | |
| Mini dissecting scissors - straight | World Precision Instruments | 503240 | |
| Micro mosquito forceps (12.5 cm) | World Precision Instruments | 500451 | |
| Dissecting scissors - straight | World Precision Instruments | 14393 | |
| Castroviejo Needle Holder | World Precision Instruments | 503258 | |
| Isoflurane, USP | Phoenix | 2%, 1 L/min flow rate | |
| Buprenorphine | 0.05 mg/kg | ||
| 0.9% Sodium Chloride Irrigation, USP | Baxter | ||
| 6-0 Ethilon black monofilament, non-absorbable suture | Ethicon | Bladder tie | |
| 6-0 Vicryl violet braided, absorbable suture | Ethicon | Muscle suture, running | |
| 6-0 Prolene blue monofilament, non-absorbable suture | Ethicon | Skin suture, vertical mattress, buried interrupted | |
| KD Legato 210 infuse/withdraw pump | KD Scientific | 1.5 mL/hr | |
| Disposable pressure transducer | Digitimer | NL108T2 | |
| Pressure Amplifier | Digitimer | NL108A | |
| Power1401-3 data acquisition interface | Digitimer | ||
| Spike2 | Cambridge Electronic Design Limited | PC pressure recording software | |
| Leica MZ6 surgical operating microscope (3.2 - 20X) | Leica Microsystems | Magnification |
Referencias
- Perez, L. M., Webster, G. D. The History of Urodynamics. Neurourol Urodyn. 11 (1), 1-21 (1992).
- Fry, C. H., et al. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol Urodyn. 29 (4), 603-608 (2010).
- Maggi, C. A., Santicioli, P., Meli, A. The nonstop transvesical cystometrogram in urethane-anesthetized rats: a simple procedure for quantitative studies on the various phases of urinary bladder voiding cycle. J Pharmacol Methods. 15 (2), 157-167 (1986).
- Malmgren, A., et al. Cystometrical evaluation of bladder instability in rats with infravesical outflow obstruction. J Urol. 137 (6), 1291-1294 (1987).
- Pandita, R. K., Fujiwara, M., Alm, P., Andersson, K. E. Cystometric evaluation of bladder function in non-anesthetized mice with and without bladder outlet obstruction. J Urol. 164 (4), 1385-1389 (2000).
- Chang, H. Y., Havton, L. A. Differential effects of urethane and isoflurane on external urethral sphincter electromyography and cystometry in rats. Am J Physiol Renal Physiol. 295 (4), F1248-F1253 (2008).
- Matsuura, S., Downie, J. W. Effect of anesthetics on reflex micturition in the chronic cannula-implanted rat. Neurourol Urodyn. 19 (1), 87-99 (2000).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Peripheral Nerve Transplantation Combined with Acidic Fibroblast Growth Factor and Chondroitinase Induces Regeneration and Improves Urinary Function in Complete Spinal Cord Transected Adult Mice. PLoS One. 10 (10), e0139335(2015).
- Kadekawa, K., et al. Characterization of bladder and external urethral activity in mice with or without spinal cord injury--a comparison study with rats. Am J Physiol Regul Integr Comp Physiol. 310 (8), R752-R758 (2016).
- Uvin, P., et al. The use of cystometry in small rodents: a study of bladder chemosensation. J Vis Exp. (66), (2012).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol Urodyn. 30 (5), 636-646 (2011).
- Smith, P. P., Kuchel, G. A. Continuous uroflow cystometry in the urethane-anesthetized mouse. Neurourol Urodyn. 29 (7), 1344-1349 (2010).
- Aizawa, N., Homma, Y., Igawa, Y. Influence of High Fat Diet Feeding for 20 Weeks on Lower Urinary Tract Function in Mice. Low Urin Tract Symptoms. 5 (2), 101-108 (2013).
- Bjorling, D. E., et al. Evaluation of voiding assays in mice: impact of genetic strains and sex. Am J Physiol Renal Physiol. 308 (12), F1369-F1378 (2015).
- Morikawa, K., et al. Effects of various drugs on bladder function in conscious rats. Jpn J Pharmacol. 50 (4), 369-376 (1989).
- Yaksh, T. L., Durant, P. A., Brent, C. R. Micturition in rats: a chronic model for study of bladder function and effect of anesthetics. Am J Physiol. 251 (6 Pt 2), R1177-R1185 (1986).
- Cornelissen, L. L., Misajet, B., Brooks, D. P., Hicks, A. Influence of genetic background and gender on bladder function in the mouse. Auton Neurosci. 140 (1-2), 53-58 (2008).
- Lemack, G. E., Zimmern, P. E., Vazquez, D., Connell, J. D., Lin, V. K. Altered response to partial bladder outlet obstruction in mice lacking inducible nitric oxide synthase. J Urol. 163 (6), 1981-1987 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados