Method Article
Auswertung der Prozedur für die Durchführung einer wachen Zystometrie in einem Mausmodell
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Studie beschreibt die chirurgischen Eingriffe und experimentellen Techniken zur Durchführung einer wachen Zystometrie in einer frei bewegenden Maus. Darüber hinaus bietet es experimentelle Beweise für seine Optimierung und Standardisierung zu unterstützen.
Zusammenfassung
Awake Füllung Zystometrie wurde für eine lange Zeit verwendet, um Blase Funktion in frei bewegenden Mäusen zu bewerten, aber die spezifischen Methoden verwendet, variieren zwischen Laboratorien. Das Ziel dieser Studie war es, das mikrochirurgische Verfahren zu beschreiben, das verwendet wurde, um ein intravesikales Röhrchen zu implantieren, und die experimentelle Technik zum Aufzeichnen des Harnblasendrucks in einer wachen, frei beweglichen Maus. Darüber hinaus werden experimentelle Daten dargestellt, um zu zeigen, wie Chirurgie, sowie Schlauch-Typ und Größe, beeinflussen niedrigere Harnwege Funktion und Aufzeichnung Empfindlichkeit. Die Wirkung des Rohrdurchmessers auf die Druckaufzeichnung wurde sowohl in Polyethylen- als auch in Polyurethan-Schläuchen mit unterschiedlichen Innendurchmessern bewertet. Anschließend wurde das bestmögliche Rohr aus beiden Materialien chirurgisch in die Kuppel der Harnblase von männlichen C57BL / 6-Mäusen implantiert. Zwölfstündige, über Nacht Miktionsfrequenz wurde bei gesunden, intakten Tieren und Tieren 2, 3, 5 und 7 Tage nach der Operation aufgezeichnet. Bei der Ernte, Blasen wVeregen auf Anzeichen von Quellung mit grober Beobachtung und wurden anschließend für pathologische Analyse verarbeitet. Das grösste Ausmaß der Blasenschwellung wurde am Tag 2 und 3 beobachtet, was mit den Verhaltensstörungsdaten korrelierte, die eine signifikant beeinträchtigte Blasenfunktion zeigten. Am Tag 5 hatte sich die Blasenhistologie und die Hohlraumfrequenz normalisiert. Basierend auf der Literatur und den Beweisen, die von unseren Studien zur Verfügung gestellt werden, schlagen wir die folgenden Schritte für die in vivo Aufzeichnung von intravesikalen Druck und void Volumen in einer wachen Maus: 1) Durchführung der Operation mit einem Operationsmikroskop und mikrochirurgische Werkzeuge, 2) Verwenden Sie Polyethylen-10 Schlauch, um Bewegungsartefakte zu minimieren, und 3) Zystometrie am postoperativen Tag 5 durchführen, wenn die Blasenschwellung auflöst.
Einleitung
Die Füllung der Zystometrie (FC) ist eine diagnostische Methode, bei der ein Katheter in die Harnblase gelegt wird, um den Druck während der langsamen Blasenfüllung aufzuzeichnen. Zuerst eingeführt 1927 als klinische Diagnostik Methode zur Bewertung der unteren Harnwege Funktion, ist es weit verbreitet geblieben. 1 In Forschungsanwendungen kann FC verwendet werden, um die Blasenfunktion bei gesunden und kranken Tiermodellen zu testen und die Wirkungen von pharmakologischen Wirkstoffen zu untersuchen. Nagetier-Tier-Modelle werden häufig verwendet, um niedrigere Harnwege-Funktion zu untersuchen. 2 In dieser Gruppe von Säugetieren wurde FC zuerst für den Einsatz bei Ratten entwickelt. 3 Hier wurde die Methodik zur Implantation eines Röhrchens in die Harnblase und zur Durchführung von FC gut beschrieben und von vielen Forschern mit einer akzeptablen Reproduzierbarkeit verwendet. 4 Die Verfügbarkeit von transgenen und knockenden Stämmen macht Mäuse zu einer wertvollen Spezies für zahlreiche Forschungsgebiete,Einschließlich des Feldes der unteren Harnwege Dysfunktion. Die Methodik, die für die Durchführung der Maus-Zystometrie verwendet wird, variiert zwischen den Laboratorien erheblich, was es schwierig macht, die Ergebnisse zu vergleichen. 5
Im Vergleich zu Ex-vivo- Modellen bewahrt FC eine niedere Harnwege-Anatomie, so dass die koordinierte Funktion zwischen der Blase und ihrem Auslass während der Lagerung und der Leerlaufphasen des zu beurteilenden Miktionszyklus ermöglicht wird. Bisherige Untersuchungen zeigen, dass zahlreiche, häufig verwendete Anästhetika die Miktionskontraktion unterdrücken. Agenten, die die Harnblase glatte Muskelkontraktion (Urethan, α-Chloralose, Ketamin und Xylazin) bewahren, die es dem Tier erlauben, zu mischen, die funktionelle Blasenkapazität noch signifikant zu reduzieren und die Neurotransmission zu unterdrücken. 6 , 7 , 8 , 9 Obwohl technisch anspruchsvoller, hat FC in awAke ambulating Tiere bewahrt die funktionale Integrität des Miktionsreflexes.
Niedrige Harnwege-Funktion wird durch mehrere Faktoren beeinflusst, einschließlich postoperative Blasenwand Schwellung, Stress durch Schmerzen und Unannehmlichkeiten und Umwelteinflüsse. Mit einer chirurgischen Technik, die Gewebeschäden während der Röhrenimplantation minimiert und Aufzeichnungsverfahren, die die Röhrenbewegung reduzieren, während sie gleichzeitig dem Tier erlauben, sich frei zu bewegen, sind für die Erzielung genauer und reproduzierbarer Aufnahmen unerlässlich.
Wenn sie in vivo adäquat durchgeführt werden FC in frei bewegten Tieren können Daten liefern, die die physiologische Blasenfunktion zuverlässig widerspiegeln. 10 FC in frei bewegten Tieren können Daten über die folgenden Parameter liefern; Basal- oder Baseline-Druck: Minimaler Druck zwischen zwei Miktionen. Zwischendruck: mittlerer Druck zwischen zwei Miktionen. Schwellwert: Intravesikaler DruckVor der Miktion. Maximaler Druck: Maximaler Blasendruck während eines Miktionszyklus. Spontane Aktivität (oder mittlerer Intermicturition Oszillationsdruck): Intermicturition Druck minus Basaldruck. Nicht-voiding Kontraktionen: Erhöhung des intravesikalen Drucks während der Füllphase, nicht mit der Freisetzung von Flüssigkeit verbunden. Blasenkapazität: Blasenkapazität geteilt durch Schwellendruck minus Basaldruck. Miktionsfrequenz: Anzahl der Miktionen pro Zeiteinheit. Intermicturitionsintervall: Zeitraum zwischen zwei maximalen Leerendrücken. Blasenkapazität: Infundiertes Volumen geteilt durch die Anzahl der Miktion. Eine detaillierte Beschreibung dieser Parameter und standardisierter Terminologie wurde zuvor veröffentlicht. 11
FC kann mit einem kontinuierlichen oder einstufigen intravesikalen Infusionsverfahren durchgeführt werden. Kontinuierliche Zystometrie ermöglicht die Aufzeichnung von mehreren Miktionszyklen und die Auswahl von repräsentativen Daten basiertAuf Reproduzierbarkeit Die Genauigkeit bei der Messung der Blasenkapazität ist aufgrund des unbekannten Restvolumens begrenzt. Darüber hinaus ist es schwierig, kleine, voidvolumige Volumina (die auf Stress und Geschlecht variieren, zwischen 30 und 184 μl) in frei ambulierenden Mäusen zu sammeln. Mit dieser Methode zur Aufzeichnung von void Volumen ist weniger genau im Vergleich zu einer anästhesierten Vorbereitung, aber es ist überlegen, dass es die unterdrückenden Auswirkungen der Anästhetika auf die Blasenfunktion vermeidet. Eine Einzelzyklus-Zystometrie sollte zur Beurteilung der Blasenkapazität verwendet werden. Bei dieser Methode wird die Blase vor der Infusion durch Absaugen entleert und die Kapazität wird als Funktion der Infusionsrate multipliziert mit der Zeit bis zum maximalen Druck berechnet.
Obwohl die Technik der Durchführung von Zystometrie bei kleinen Nagetieren veröffentlicht wurde, beschrieb sie die Operation bei einer Ratte durchgeführt und empfahl, dass die Maus-Zystometrie unter Urethan-Anästhesie durchgeführt werden sollte. 10 Das Ziel dieser Kommunikation ist tO beschreiben sowohl die mikrochirurgischen Techniken, die verwendet werden, um eine intravesikale Röhre in die Kuppel der Harnblase zu importieren, und die experimentelle Aufstellung, die verwendet wird, um eine untere Harnwegefunktion aufzuzeichnen, in vivo während der kontinuierlichen Blasenfüllung und Miktion in einer wachen, frei beweglichen Maus. Darüber hinaus wurden Experimente durchgeführt, um zu adressieren, wie Schlauchlänge, -durchmesser und -material sowie die Methode zur Durchführung von in vivo FC die Aufzeichnung beeinflussen. Dieses experimentelle Protokoll fasst bisher veröffentlichte Techniken zusammen und schlägt eine Reihe von Modifikationen vor, die auf experimentellen Ergebnissen basieren.
Protokoll
Tiere wurden in der Universität von Vermont Tierpflege-Einrichtung nach institutionellen Richtlinien untergebracht. Alle Tierversuche wurden in Übereinstimmung mit den National Institutes of Health Guide für die Pflege und Verwendung von Labortieren durchgeführt.
1. Intravesikale Röhrenimplantation
- Vorbereitung von Schläuchen und Instrumenten für den chirurgischen Eingriff
- Schneiden Sie ein 7-cm-Stück PE10-Schlauch, um den Katheter für die Implantation zu machen.
- Erstellen Sie eine Fackel an einem Ende des PE10-Rohres, indem Sie langsam das Ende zu einer offenen Flamme vorschieben.
HINWEIS: Die Röhre schnell abziehen, sobald sich die Fackel entwickelt. - Tragen Sie drei Tropfen Allzweck-Heißleim unter Verwendung der niedrigen Hitzeeinstellung auf einer Leimpistole bei 4,5, 5 und 5,5 cm vom aufgeweiteten Ende auf der Außenseite des PE10-Rohres auf. Diese helfen, die Tube am Rücken des Tieres zu sichern. ( Abbildung 1 )
- Sterilisieren Sie den Schlauch, indem Sie ihn in 70%Ethanol und spülen Sie es dann vor der Verwendung mit sterilem 0,9% NaCl ein. Lassen Sie das Rohr gefüllt, um zu vermeiden, dass Luftblasen in das System eingeführt werden.
- Erstellen Sie einen 30-Gauge-Stecker, um das Ende des PE10-Katheters abzudichten, indem Sie eine 30-Gauge-Nadel von der Nabe trennen, indem Sie das proximale Ende von Seite zu Seite manuell manipulieren. Wenden Sie einen Tropfen Heißkleber bis zum Ende an. Achten Sie darauf, dass die Dichtung wasserdicht ist. ( Abbildung 2 )
- Verwenden Sie die folgenden mikrochirurgischen Instrumente: Zwei Paare von Dumont # 7 gebogenen Mikrozangen, zwei Paare von Dumont # 5 gebogenen Mikrozangen, eine 21 G Nadel, ultrafeine gerade Hämostat, Mikroschere, kleine Sezierschere und ein Mikronadelhalter.
- Sterilisieren Sie alle Instrumente, bevor Sie den Vorgang starten.
- Vorbereitung des Tieres
- Nach der Betäubung des Tieres, rasieren Sie die untere Hälfte des Bauches zuerst, dann drehen Sie das Tier anfällig und rasieren und reinigen Sie das Gebiet auf dem oberen Rücken mit 70% Alkohol gefolgt von Betadin. Tragen Sie Tierarzneimittel auf die Augen, um Trockenheit zu verhindern. Als nächstes verwenden Sie ein Paar gerader, stumpfer Schere und ein Paar Dumont # 7 gekrümmte Mikrozangen, um einen 1,5 cm langen Hautschnitt zwischen den Schulterblättern zu machen und das Tier auf einem Heizkissen (37 ° C) mit sterilen Vorhängen zu versehen.
- Schließlich reinige den Bauch mit Alkohol und Betadin.
- Chirurgische Prozedur
HINWEIS: Führen Sie alle chirurgischen Eingriffe unter einem Operationsmikroskop mit einer Vergrößerung von 3,15X bis 20X durch. Nach dem Platzieren des Tieres auf die sterilen Vorhänge, setzen Sie auf sterile Handschuhe. Weiter mit sterilen Prozeduren während der gesamten Operation.- Legen Sie das Tier in eine Induktionsbox und betäubt mit 2% inhaliertem Isofluran mit einem Sauerstoffträger (1 l / min). Pflegen Sie die Anästhesie während des gesamten Verfahrens, indem Sie den Kopf des Tieres in einen Nasenkonus stellen und 2% inhaliertes Isofluran mit einem Sauerstoffträger (1 l / min) verwenden. Beginne die Chirurgie nach dem Erhalt einer negAtive Antwort vom Zehen-Prise-Test
- Verwenden Sie ein Paar gerader, stumpfer Schere und ein Paar Dumont # 7 gekrümmte Mikrozangen, um eine 1,5 cm tiefe, mittlere Abdominal-Inzision durch die Haut zu machen. Anschließend erstellen Sie einen passenden Schnitt durch die Faszie entlang der linea alba und Muskel, um die Kuppel und die obere Hälfte der Harnblase zu entlarven. Vermeiden Sie es, die Blase zu verletzen, indem Sie eine Aufwärtstraktion auf jede Gewebeschicht mit einem Paar Dumont # 7 gebogenen Mikrozangen anwenden. Halten Sie die Bauch-Eingeweide vor dem Austrocknen durch Zugabe von Tropfen warmer physiologischer Kochsalzlösung.
- Drehen Sie das Tier auf die Seite, um auf den Einschnitt auf den Nacken zuzugreifen. Schieben Sie einen schmalen Hämostat subkutan, obwohl der Schnitt. Der subkutane Kanal sollte auf der Rückseite beginnen und weiter entlang der Seite.
- Sobald die Spitze des Instruments den Boden des Brustkorbes erreicht, drehen Sie die Spitze in Richtung der Mittellinie und im Inneren des Bauches (es wird ein leichter Pop beim Durchstechen der Bauchwandmuskulatur). Setzen Sie fort, den Hämostat vorzurücken, bis die Spitze am Bauchschnitt unter der Muskelschicht ausgesetzt ist. ( Abbildung 3 )
- Fassen Sie das "non-flared" Ende des Schlauches mit dem Hämostat an und ziehen Sie das Werkzeug langsam zurück und ziehen Sie das Ende des Schlauches über den Einschnitt an der Rückseite des Halses heraus. Stellen Sie das aufgeweitete Ende des Schlauches so ein, dass er direkt über der Kuppel der Blase liegt.
- Machen Sie eine lose Krawatte von 6-0 Monofilament Naht (nicht resorbierbar) und legen Sie es auf die Blase Kuppel. Diese Krawatte wird später verwendet, um die Röhre in der Blase zu sichern.
- Lege eine kleine Rolle mit fusselfreiem Gewebe in den Bauch und hinter die Blase, um sie zu stabilisieren und zu heben.
- Vorbereiten, das aufgeweitete Ende des PE10-Katheters in die Blase einzusetzen.
- In der nicht dominanten Hand halten Sie die Kuppel der Blase mit Dumont # 7 gebogenen Mikrozangen und halten Sie diesen Griff, bis der Katheter in die Blase gelegt wird.
- Verwenden Sie eine 21-gauge-Nadel tO mache eine Zystotomie in der Spitze der Kuppel. Vorsichtig die Zystotomie mit einem geschlossenen Paar von # 5 gebogenen Mikrozangen, um sicherzustellen, dass der Katheter kann leicht durch das Loch passieren.
- Während du noch die Blase Kuppel in der nicht dominanten Hand hältst, platziere das aufgeweitete Ende des PE10 Katheters in die Blase (drücke die Fackel bis zum Blasenhals, so dass es nicht ausrutscht, während es sichert).
- Binden Sie die 6-0 Monofilament Naht um die Kuppel der Blase und Schlauch mit der Krawatte anterior an der Schläuche platziert. Achten Sie darauf, die Naht so hoch oben auf die Blase wie möglich zu binden, um künstlich zu reduzieren Blase Kapazität. ( Fig. 4 )
- Alternativ, sichern Sie den Katheter mit einem Geldbeutel String Naht wie folgt. Machen Sie eine lose Geldbörse String Naht auf der Kuppel der Blase mit 6-0 Monofilament. Befolgen Sie die Schritte 1.3.8.1 - 1.3.8.3, um die Zystotomie durchzuführen und den Katheter einzuführen. Sichern Sie die Tube, indem Sie die Geldbörse Naht fügen. ( Abbildung 5 )
- Testen Sie die Durchgängigkeit und Abdichtung des Röhrchens in der Blase, indem Sie eine 0,5 ml Insulinspritze mit einer 30-Gauge-Nadel an das distale Ende des Röhrchens anschließen. Langsam die Blase mit 0,1 - 0,2 ml 0,9% NaCl füllen, bis ein Tropfen an der Harnröhrenöffnung auftritt und dann die Blase durch Absaugen entleert. Es ist wichtig, dass die Blase sowohl gefüllt als auch entleert werden kann.
- Wenn keine Lecks an der Kuppel auftreten, klemmen Sie die Blase mit einem Paar gebogenen Mikrozangen und ziehen Sie vorsichtig an den Schlauch, bis die Fackel auf der Innenseite der Blase Kuppel ruht.
- Vor dem Schließen entfernen Sie die kleine Rolle des Gewebes und stellen Sie sicher, dass die Blase in ihrer normalen Position ist.
- Schließen Sie die Bauchwand in zwei Schichten (Muskel und Haut) mit 6-0 laufenden Naht. Es ist vorzuziehen, den M. rectus abdominis zu approximieren, indem man nur die Ränder der vorderen Bauchfaszie (vordere Wand der Rectushülle) näht.
- Um die Schläuche an den Tieren zurück zu sichern, sanft roTiere das Tier auf den Bauch. Setzen Sie den subkutanen Teil des Metallankers in den interskapulären Einschnitt ein. (Abbildung 12 ) Verwenden Sie eine 6-0 Naht, um das Rohr und den Anker zu sichern, indem Sie sie mit einer vertikalen Matratzennaht umschließen.
- Vergewissern Sie sich, dass eine Leimblase über und unter der Haut bleibt, um zu verhindern, dass der Schlauch herauszieht. Schneide das Rohr ca. 2 cm über die Haut.
- Schieben Sie den 30-Gauge-Stecker (Schritt 1.1.5) vorsichtig in das Ende des Röhrchens ein, um zu verhindern, dass der Urin austritt.
- Injizieren Sie 0,5 ml 0,9% NaCl subkutan zur Hydratation. Geben Sie postoperative Analgesie sofort nach der Operation und pflegen für 48 h.
- Legen Sie das Tier wieder in den Käfig, der sich unter einer Infrarotlampe befindet. Halten Sie eine ständige Beobachtung, bis sich das Tier um den Käfig frei bewegt.
- Überwachen Sie das Tier täglich und lassen Sie es für 5 Tage vor der Aufnahme zu erholen.
2. wache zysteOmetry Aufzeichnung
- Vorbereitung des Aufzeichnungsprogramms, Druckaufnehmer und Infusionspumpe.
- Vor der Betäubung des Tieres die Infusionspumpe, den Druckaufnehmer und die 22 G-Schwenkung mit PE50-Schläuchen verbinden. ( Fig. 6 )
- Öffnen Sie das Aufnahmeprogramm (siehe Tabelle der Materialien für ein Beispiel), auf einem Computer, um den Systemdruck zu kalibrieren und für die Aufzeichnung vorzubereiten. Achten Sie darauf, die gleichen Einstellungen während der Kalibrierung und Aufnahme zu verwenden.
- Füllen Sie eine 20 ml Spritze mit 10 - 15 ml Raumtemperatur 0,9% NaCl und laden Sie sie in die Infusionspumpe. Programmieren Sie die Pumpe mit einer Geschwindigkeit von 0,6 mL / h.
- Sichern Sie den Druckaufnehmer auf der gleichen Höhe wie die Blase des Tieres oder die Unterseite des Aufzeichnungskäfigs.
- Befestigen Sie das 22-gauge-Drehgelenk am Ende des Druckaufnehmers (PE50 - Schlauch - Druckaufnehmer zum Schwenken)
HINWEIS: Das Drehgelenk wird verwendet, um zu verhindern, dass sich das Rohr verdreht oder knicktDas Tier bewegt sich. - Führen Sie die Spritzenpumpe vor, um 0,9% NaCl durch das System zu spülen. Achten Sie darauf, alle Luftblasen vor dem Kalibrieren zu entfernen.
- Wenn das Aufzeichnungsprogramm läuft, verwenden Sie ein Lineal, um den Druck (cm / H 2 O) zu kalibrieren. Langsam das Ende des PE50-Halters von 0 auf 30 cm bewegen. Bei Bedarf die Null einstellen.
HINWEIS: Die 0-cm-Marke sollte auf der gleichen Höhe sein wie der Boden des Aufzeichnungskäfigs und des Druckaufnehmers.
- Das 22-gauge-Drehgelenk über der Mitte des Aufzeichnungskäfigs anheben. Vergewissern Sie sich, dass der Käfigboden den Urin auf die Auffangvorrichtung der unterhalb des Käfigs liegenden Waage fallen lässt. Stellen Sie die Höhe des Halteseils so ein, dass sich die Maus frei um den Käfig bewegen kann, ohne den Schlauch zu spannen oder zu dehnen. ( Fig. 7 )
- Wenn Sie fertig sind, überprüfen Sie, ob das System und der externe PE50-Schlauch voll 0,9% NaCl sind und alle Luftblasen entfernt wurden.
- VorbereitungAration des tieres zur aufzeichnung
- Anästhesieren Sie das Tier mit 2% inhaliertem Isofluran und legen Sie es auf den Bauch. Entfernen Sie den 30-Gauge-Stecker und schieben Sie den PE10-Schlauch (Blasenkatheter) in das Ende des PE50-Halters. Verwenden Sie Heißkleber, um eine wasserdichte Abdichtung zu bilden.
- Schalten Sie die Anästhesie aus und legen Sie das Tier in den Aufzeichnungskäfig mit einem Parallel-Draht-Boden, wodurch der Urin direkt auf eine Sammelvorrichtung fallen kann, die auf eine analytische Waage gelegt wird. ( Fig. 7 )
- Starten Sie die Aufnahme, sobald das Tier im Käfig ist, aber fangen Sie nicht an zu infundieren. Überwachen Sie das Tier, bis es sich vollständig von der Anästhesie erholt. Sobald sich der Blasendruck stabilisiert, beginnen Sie, 0,9% NaCl mit einer Geschwindigkeit von 0,6 ml / h zu infundieren.
HINWEIS: Machen Sie eine Notiz im Aufnahmeprogramm, wenn Änderungen vorgenommen werden. Es ist wichtig, eine Aufzeichnung zu haben, wenn Infusion beginnt, Stopps oder Unregelmäßigkeiten auftreten. - Überprüfen Sie das System auf Lecks und stellen Sie sicher, dass das Tier einfach istEss zu essen und wasser
- Setzen Sie die Aufzeichnung in einem ruhigen Raum fort, bis drei reproduzierbare Miktionszyklen erhalten werden.
HINWEIS: Das Tier sollte während der gesamten Aufnahme völlig ungestört sein. Vorzugsweise verwenden Sie die Fernüberwachung, um das Verhalten zu beobachten.
Ergebnisse
Es gab keinen signifikanten Unterschied zwischen den Schlauchmaterialien und den Durchmessern in der Konsistenz des Druckanstiegs und fiel in das System während der Schlauchverschlußung. Blasenwand-Schwellpfosten Intravesikale Röhrenimplantation war sowohl für Polyethylen (PE) als auch Polyurethan (PU) Materialien von Bedeutung. Am 2. Tag entwickelte sich eine schwere submuköse Schwellung. Es besetzte die Hälfte des Querschnitts der Blase, was zu einer Behinderung des Lumens führte. Am Tag 5 löste sich das Ödem vollständig, so dass die submukösen Gebiete mit entzündlichen Zellen infiltriert wurden, die teilweise in die Muskulatur eindrangen. Am 7. Tag wurde die entzündliche Infiltration signifikant reduziert und die Blasenwandhistologie wieder normal (Abbildung 8 ). Das größte Ausmaß der Gewebsschwellung, die am Tag 2 und Tag 3 beobachtet wurde, korrelierte mit den Verhaltensstörungsdaten, die eine signifikant beeinträchtigte Blasenfunktion zeigten (Abbildung 9 ). Leerfrequenz, die durch po St-operative Tag 5.
Der intravesikale Druck in einer wachen, frei beweglichen Maus (mit minimalen Bewegungsartefakten) zeichnet sich durch einen Grundliniendruck von 10-15 cm H 2 O aus, der während des Füllzyklus unverändert oder allmählich um nicht mehr als 10 cm H 2 O ansteigen kann , Gefolgt von einem plötzlichen, pulsierenden Druckanstieg und dann bei der Entleerung ( Abb. 10 und 11 ).

Abbildung 1: PE10 Schlauch für die Implantation in die Harnblase. ( A ) Ein 7 cm großes Stück PE10-Schlauch mit Tropfen Heißleim bei 4,5, 5 und 5,5 cm vom aufgeweiteten Ende. ( B und C ) Ein detailliertes Bild, das das aufgeweitete Ende des Röhrchens zeigt (verwendet, um das Rohr in der Blase zu sichern).Es / ftp_upload / 55588 / 55588fig1large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2: Stecker für den externen Teil des PE10 Blasenschlauches. Der Stecker ist aus einem 30 G Nadel und Heißkleber gefertigt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3: Kurs des Blasenschlauches. Schematische Linienzeichnung, die die Platzierung des Schlauches durch den Bauch und seinen subkutanen Weg zum Nacken veranschaulicht. Bitte klicken Sie hier um eine größere zu sehenVersion dieser Figur.
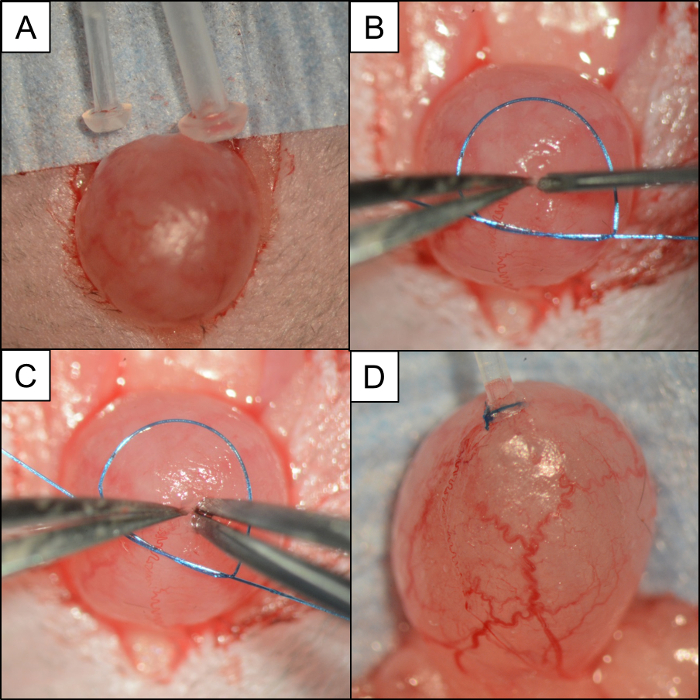
Abbildung 4: Blasen- / Schlauchvergleich und Schritte zum Einsetzen und Sichern des Röhrchens mit einer Lose Monofilament Naht. Intraoperative Fotos, die: ( A ) Bild, das PE50 und PE10 mit einer Maus-Harnblase vergleicht. ( B ) Eine kleine Schleife von 6-0 Monofilament Naht platziert um die Blase. Ein Paar von # 5 Mikrozangen packt die Kuppel der Blase, während eine 21 G Nadel verwendet wird, um die Zystotomie zu machen. ( C ) Ohne Freigabe der Kuppel der Blase prüft ein Paar von # 5 Mikrozangen in der gegenüberliegenden Hand das Loch vor dem Einsetzen des PE10 Katheters. ( D ) PE10 Katheter in der Kuppel der Blase mit 6-0 Monofilament Naht gesichert. Klicken Sie bitte hierUm eine größere Version dieser Figur zu sehen.

Abbildung 5: Eine Geldbörse String Naht kann als alternative Methode zur Sicherung der Tube in der Blase verwendet werden. ( A ) Geldbörse Naht in der Kuppel der Blase. ( B ) PE10-Schlauch, der durch eine Mitte der Geldbörse eingeführt wird. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 6: Versuchsaufbau. Spritze mit 0,9% NaCl in der Infusionspumpe, die in Reihe mit dem Druckwandler und dem intravesikalen Katheter verbunden ist. Der Computerbildschirm rechts unten zeigt drei reproduzierbare mictDringlichkeitszyklen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 7: Experimentelle Aufzeichnung. ( A ) 22 G schwenken über einen Aufzeichnungskäfig und Balance. ( B ) Photographie, die die gesamte Länge des äußeren Teils des Infusionsschlauches mit einem 22 G-Schwenk- und einem PE50-Haltegurt zeigt. ( C ) A 22 G schwenkbar mit einer Federummantelung PE50 Schlauch. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 8: Histologische Evaluation der ReAntwort der Harnblasenwand auf eine implantierte PE10 Röhre. Querschnitte der Harnblase mit Hämatoxylin und Eosin (H & E) vor, 2, 3, 5 und 7 Tage nach der Operation gefärbt. Blase Wand Schwellung auf postoperativen Tag 5. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 9: Funktionelle Blasenauswertung mit Voiding Spot Assay. Urinflecken auf Filterpapier, die mit UV-Licht betrachtet werden, dokumentieren das repräsentative Miktionsmuster am Tag 0 (vor dem Röhrenimplantat), 2, 3, 4, 5 und 7 post-intravesikalen Röhrenimplantat. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 10: Zystometrogramm Repräsentative Spur von intravesikalen Blasendruck in einer wachen, frei bewegenden Maus. Trace zeigt 3 reproduzierbare Miktionszyklen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 11: Miktionsphase. Spur, die die Miktionsphase mit Hochfrequenzschwingungen bei der anfänglichen Druckerhöhung, dem Spitzendruck und einem schnellen Druckabfall zur Grundlinie darstellt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 12: Verankerung des Tetters. ( A ) Anker verwendet, um den PE10 Katheter im Tier zu sichern und zu verhindern, dass der Schlauch auf die Blase zieht. Die Scheibe ist an der Federhülse befestigt. ( B ) Interner PE10-Katheter an den externen PE50-Schlauch angeschlossen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
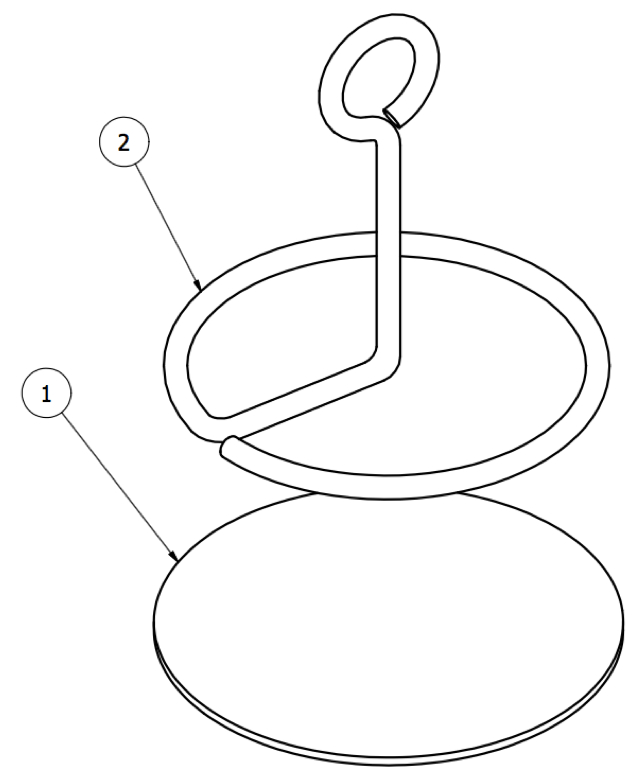
Abbildung 13: Schwenkanker. Subkutaner Teil des Ankers, bestehend aus ( 1 ) einer Scheibe aus Gewebe und ( 2 ) einer Metallschlaufe.
Diskussion
Optimales Material und Größe der intravesikalen Schläuche
Um den Effekt zu bestimmen, der Schlauchdurchmesser auf Druckaufzeichnungen hat, haben wir verschiedene mikrofluidische Rohre getestet; PE50 (0,58 mm ID), Polyurethan PU027 (0,4 mm ID), PE25 (0,46 mm ID) und PE10 (0,28 mm ID). Für jede Röhre wurde der Druck mit der Infusionspumpe aufgezeichnet, die mit 1 mL / h betrieben wurde, während das Röhrchen rasch von 0 auf 30 cm bewegt wurde. Initiale In-vivo-Experimente versuchten, PE50-Röhrchen zu verwenden, waren aber aufgrund der Größe der Röhrchen im Vergleich zur Mausblase nicht erfolgreich (Abbildung 4A ). Während dies unterstützt die Feststellung von Smith und Kuchel, die darauf hindeuten, dass die Verwendung von PE50-Schlauch für wache Zystometrie in einer Maus Artefakte erzeugt, macht es schwierig, die Daten zu interpretieren, 12 ist es wichtig zu beachten, dass andere erfolgreich PE50-Schlauch in beiden wach nicht hemmt , Wach zurückhaltend und anästhesierte Mauszystometrie. 9 ,
Auswirkungen der Operation auf Blasenwand Kontraktilität und Schwellung
Bisher waren Daten über Blasenfunktion und Blasenwandschwellung, Nachimplantat eines Intravesikaltubus, nur für Ratten verfügbar. Nach vorheriger sTäuschungen, Miktionsvolumen war niedriger und die Miktionsfrequenz war an den postoperativen Tagen 1 - 3 15 höher. 15 Es wurde auch gezeigt, dass Veränderungen der Blasenfunktion einer Ratte mit einer schweren Schwellung der Blase einhergingen, wobei das Ödem nach 3 zu sinken begann Tage. Um ein besseres Verständnis der Veränderung der Harnblasenfunktion, der Blasenwandschwellung und der Reparaturzeitlinie der männlichen C57BL / 6-Mäuse, die aus dem Implantieren von PE10-Röhrchen resultieren, zu erhalten, wurde die 12-Stunden-Verhaltens-Hohlraumfrequenz mit dem Filterpapier-Aufzeichnungsverfahren bewertet . Nach der letzten Aufnahme wurde die Maus betäubt und die Blase wurde grob beurteilt, geerntet, fixiert und histologisch ausgewertet. Bei der postoperativen Tag 1 und 2 wurde die Hohlraumverminderung verringert und die Spotting erhöht, gefolgt von einer Zunahme der Ablehnung am Tag 3. Das Verhalten, das bis zum Tag 5 normalisiert wurde. Die Bruttobewertung der Blasen bei der Ernte und die nachfolgende H & E-Färbung ergab die größte MengeDer suburothelialen Schwellung am postoperativen Tag 2 und 3, wobei die Blasen den Kontrollblasen am Tag 5 und 7 nach dem Röhrenimplantat ähnlich werden.
Ähnlich wie bei klinisch-urodynamischen Studien nutzten die meisten Laboratorien Raumtemperatur 0,9% NaCl. 11 Die Infusionsrate in früheren Studien variiert deutlich von 10 μl / min bis 100 μl / min. 17 , 18 Eine Studie, in der die Auswirkungen verschiedener Infusionsraten auf die Blasenfunktion in einer Maus verglichen wurden, wurde jedoch nicht durchgeführt. Die Daten, die in größeren Tierversuchen erhalten wurden, empfahlen jedoch, dass langsamere Abfüllraten verwendet werden sollten. Aufgrund des geringen Volumens der Mausblase sind Peristaltikpumpen nicht geeignet und es ist eine kontinuierliche Mechanismus-Infusionspumpe erforderlich.
Die genauesten und nutzbaren FC-Aufzeichnungen setzten eine gute Durchlässigkeit von Druckänderungen mit begrenzten Artefakten aus. Die erhaltenen Ergebnisse wurden verwendetEin kurzes Segment von PE10-Schlauch, das direkt mit PE50 verbunden ist, stellte eine genaue Messung des Drucks in der Maus-Harnblase zur Verfügung. Druckschwankungen, die durch die Tierbewegung verursacht werden, können durch Verankerung des Röhrchens an der Haut an der Stelle begrenzt werden, an der es am Nacken austritt ( Abb. 12 und 13 ). Dies könnte mit der Verwendung von Leimblasen und einem speziellen Anker erreicht werden, der aus einer subkutan platzierten Metallgewebe besteht und das äußere Stück, das an der Metallröhre befestigt ist, die das Rohr bedeckt. Zusätzliche Verfahren zum Verhindern, dass das Rohr auf die Blase zerlegt wird, besteht darin, eine gekrümmte subkutane Spur für den inneren Teil des PE10-Schlauches zu schaffen, der einen Schlauch in dem Rohr bereitstellt und ein Schwenk- und Halteglied verwendet, was ein Verdrehen und Knicken verhindert. Basierend auf der Literatur und den Beweisen, die durch diese Studien bereitgestellt werden, werden die folgenden Schritte empfohlen, um die am meisten reproduzierbare und physiologisch genaue Methode für in vivo bereitzustellenAufzeichnung des intravesikalen Drucks in einer Maus. Verwenden Sie ein Operationsmikroskop und mikrochirurgische Werkzeuge, um den Katheter in die Kuppel der Harnblase zu implantieren. Erlaube eine 5-tägige Erholungsphase zwischen Chirurgie und Aufnahme. Akklimatisiere das Tier im selben Käfig, dass die Aufnahme durchgeführt wird und freien Zugang zu Nahrung und Wasser bietet. Führen Sie das Experiment in einer ruhigen Umgebung mit minimalem menschlichen Kontakt, idealerweise Remote-Monitoring verwenden, um das Verhalten des Tieres zu beobachten.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This study was funded by the Department of Surgery University of Vermont, Danish Council for Independent Research, and by the Odense University Hospital.
Materialien
| Name | Company | Catalog Number | Comments |
| Polyethylene (PE) 10 tubing | Instech | BTPE-10 | Fits 30G connectors/plugs |
| Polyethylene (PE) 50 tubing | Instech | BTPE-50 | Fits 22G connectors/plugs |
| 22 G single channel stainless steel swivel | Instech | 375/22 | |
| High Carbon Steel Utility Extension Spring (9/64" OD) | Grainger | 1NAH1 | Protects PE50 tubing - Cut to length |
| 22 G connector | Instech | SP22/12 | |
| Yutaoz Professional Hot Melt Adhesive Glue Gun | Yutaoz | Use low temperature setting (100 °C) - Any hot melt glue gun with an adjustable temperature range will work | |
| Surebonder DT-2010 all purpose glue stick | Surebonder | Any all purpose hot glue will work | |
| Dumont #5 curved microforceps | World Precision Instruments | 500232 | |
| Dumont #7 curved microforceps | World Precision Instruments | 14188 | |
| Mini dissecting scissors - straight | World Precision Instruments | 503240 | |
| Micro mosquito forceps (12.5 cm) | World Precision Instruments | 500451 | |
| Dissecting scissors - straight | World Precision Instruments | 14393 | |
| Castroviejo Needle Holder | World Precision Instruments | 503258 | |
| Isoflurane, USP | Phoenix | 2%, 1 L/min flow rate | |
| Buprenorphine | 0.05 mg/kg | ||
| 0.9% Sodium Chloride Irrigation, USP | Baxter | ||
| 6-0 Ethilon black monofilament, non-absorbable suture | Ethicon | Bladder tie | |
| 6-0 Vicryl violet braided, absorbable suture | Ethicon | Muscle suture, running | |
| 6-0 Prolene blue monofilament, non-absorbable suture | Ethicon | Skin suture, vertical mattress, buried interrupted | |
| KD Legato 210 infuse/withdraw pump | KD Scientific | 1.5 mL/hr | |
| Disposable pressure transducer | Digitimer | NL108T2 | |
| Pressure Amplifier | Digitimer | NL108A | |
| Power1401-3 data acquisition interface | Digitimer | ||
| Spike2 | Cambridge Electronic Design Limited | PC pressure recording software | |
| Leica MZ6 surgical operating microscope (3.2 - 20X) | Leica Microsystems | Magnification |
Referenzen
- Perez, L. M., Webster, G. D. The History of Urodynamics. Neurourol Urodyn. 11 (1), 1-21 (1992).
- Fry, C. H., et al. Animal models and their use in understanding lower urinary tract dysfunction. Neurourol Urodyn. 29 (4), 603-608 (2010).
- Maggi, C. A., Santicioli, P., Meli, A. The nonstop transvesical cystometrogram in urethane-anesthetized rats: a simple procedure for quantitative studies on the various phases of urinary bladder voiding cycle. J Pharmacol Methods. 15 (2), 157-167 (1986).
- Malmgren, A., et al. Cystometrical evaluation of bladder instability in rats with infravesical outflow obstruction. J Urol. 137 (6), 1291-1294 (1987).
- Pandita, R. K., Fujiwara, M., Alm, P., Andersson, K. E. Cystometric evaluation of bladder function in non-anesthetized mice with and without bladder outlet obstruction. J Urol. 164 (4), 1385-1389 (2000).
- Chang, H. Y., Havton, L. A. Differential effects of urethane and isoflurane on external urethral sphincter electromyography and cystometry in rats. Am J Physiol Renal Physiol. 295 (4), F1248-F1253 (2008).
- Matsuura, S., Downie, J. W. Effect of anesthetics on reflex micturition in the chronic cannula-implanted rat. Neurourol Urodyn. 19 (1), 87-99 (2000).
- DePaul, M. A., Lin, C. Y., Silver, J., Lee, Y. S. Peripheral Nerve Transplantation Combined with Acidic Fibroblast Growth Factor and Chondroitinase Induces Regeneration and Improves Urinary Function in Complete Spinal Cord Transected Adult Mice. PLoS One. 10 (10), e0139335(2015).
- Kadekawa, K., et al. Characterization of bladder and external urethral activity in mice with or without spinal cord injury--a comparison study with rats. Am J Physiol Regul Integr Comp Physiol. 310 (8), R752-R758 (2016).
- Uvin, P., et al. The use of cystometry in small rodents: a study of bladder chemosensation. J Vis Exp. (66), (2012).
- Andersson, K. E., Soler, R., Fullhase, C. Rodent models for urodynamic investigation. Neurourol Urodyn. 30 (5), 636-646 (2011).
- Smith, P. P., Kuchel, G. A. Continuous uroflow cystometry in the urethane-anesthetized mouse. Neurourol Urodyn. 29 (7), 1344-1349 (2010).
- Aizawa, N., Homma, Y., Igawa, Y. Influence of High Fat Diet Feeding for 20 Weeks on Lower Urinary Tract Function in Mice. Low Urin Tract Symptoms. 5 (2), 101-108 (2013).
- Bjorling, D. E., et al. Evaluation of voiding assays in mice: impact of genetic strains and sex. Am J Physiol Renal Physiol. 308 (12), F1369-F1378 (2015).
- Morikawa, K., et al. Effects of various drugs on bladder function in conscious rats. Jpn J Pharmacol. 50 (4), 369-376 (1989).
- Yaksh, T. L., Durant, P. A., Brent, C. R. Micturition in rats: a chronic model for study of bladder function and effect of anesthetics. Am J Physiol. 251 (6 Pt 2), R1177-R1185 (1986).
- Cornelissen, L. L., Misajet, B., Brooks, D. P., Hicks, A. Influence of genetic background and gender on bladder function in the mouse. Auton Neurosci. 140 (1-2), 53-58 (2008).
- Lemack, G. E., Zimmern, P. E., Vazquez, D., Connell, J. D., Lin, V. K. Altered response to partial bladder outlet obstruction in mice lacking inducible nitric oxide synthase. J Urol. 163 (6), 1981-1987 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten