Method Article
Подмороженная трансплантация островков в эпидидимальной жировой клетке диабетических мышей
В этой статье
Резюме
Этот протокол демонстрирует изоляцию мышиного островка и посев на дезаклеарном эшафоте. Осадки, поддерживаемые эшафотом, трансплантировали в эпидидимальную жировую площадку стрептозотоцина (STZ) -индуцированных диабетических мышей. Островки выживали на участке трансплантации и меняли гипергликемическое состояние.
Аннотация
Было доказано, что трансплантация островков эффективна при лечении диабета 1 типа. Тем не менее, нынешняя стратегия внутрипеченочной трансплантации может иметь острую реакцию цельной крови и приводить к плохому приживлению островков. Здесь мы сообщаем о надежном протоколе для трансплантации островков на внепеченочном участке трансплантации - эпидидимальной жировой подушке (EFP) - в модели диабетической мыши. Описан протокол для выделения и очистки островков с высоким выходом от мышей C57BL / 6J, а также метод трансплантации, выполняемый посевными островками на дезаклеарный каркас (DCS) и имплантация их на сайт EFP у сингенных мышей C57BL / 6J, которые были диабетическими Стрептозотоцином. Трансплантат DCS, содержащий 500 островков, перевернул гипергликемическое состояние в течение 10 дней, в то время как свободные островки без DCS требовали не менее 30 дней. Нормогликемия поддерживалась на срок до 3 месяцев, пока не был эксплантирован трансплантат. В заключение DCS усилило приживление островков в tОн внепеченочный сайт EFP, который можно легко получить и может обеспечить воспроизводимую и полезную платформу для исследования материалов лесов, а также другие параметры трансплантации, необходимые для успешного приживления островков.
Введение
Сахарный диабет 1 типа (T1D) является аутоиммунным эндокринным расстройством, в котором островковые клетки удаляются иммунной системой, что делает пациентов зависимыми от инъекции экзогенного инсулина на всю жизнь. Протокол Эдмонтона представляет собой веху в клинических исследованиях трансплантации островков; Островки вводили через портальную вену и трансплантировали на внутрипеченочном участке 1 . Однако два основных препятствия - неадекватные источники островков-доноров и плохое приживление островков - препятствуют широкому успеху трансплантации островков 2 . Как правило, островки необходимо собирать у трех доноров трупы, чтобы отменить гипергликемическое состояние одного пациента; Это связано с низким выходом процедур изоляции островков и потерями островков после трансплантации. В частности, хотя островки после трансплантации были омыты богатой кислородом кровью, прямой контакт с кровью часто вызывал мгновенную опосредованную кровью инфаркта(IBMIR), что может вызвать острую потерю островков. В долгосрочной перспективе считается, что постепенная потеря островков у пациентов объясняла снижение показателей реверсии диабета в клинических группах, которые могли достичь 90% в первый год и снизились до 30% и 10% на 2 и 5 Лет после трансплантации, соответственно 3 .
Трансплантация островков на внепеченочных участках была привлекательной стратегией для уменьшения прямого контакта островков с кровью, ограничивая трансплантацию до более определяемых мест по сравнению с внутрипеченочной инфузией. В последние годы исследования были проведены в капсулах для почек, глазных мышцах, мышцах, жировых клетках и подкожных клетках, что свидетельствует о том, что островки на этих участках способны выжить и функционировать для восстановления нормогликемии 4 . Кроме того, островки на этих участках извлекаются, что позволяет проводить биопсию или даже для дальнейших процедур замены. ВнепеченочныеПоэтому он демонстрирует большой потенциал для клинической трансплантации 5 .
Исследования на основе биоматериалов интенсивно изучались для трансплантации клеток и тканевой инженерии. Трехмерные (3D) леса обычно содержат пористые структуры и могут служить в качестве клеточных шаблонов для создания пространственной структуры / организации клеток или в качестве резервуаров для обеспечения контролируемого высвобождения биоактивных сигналов. Леса также были изготовлены из полимерных материалов, таких как поли (гликолид-L-лактид) 6 , поли (диметилсилоксана) 7 и термопластичный поли (уретан) 8 , в трансплантационные островки в EFP. Было обнаружено, что по сравнению с прямой трансплантацией островков было обнаружено, что использование подмостей уменьшает потери островков, предотвращая утечку островков во внутрибрюшинную полость 9 , 10 , обеспечивая механическую защиту и модулюЛокализуя местную воспалительную реакцию. Таким образом, строительные леса могут быть разработаны для содействия приживлению островков на участках трансплантации 7 .
В этом исследовании мы намерены продемонстрировать парадигму трансплантации островков в EFP, проводимую в моделях мышей с использованием DCS. Леса, полученные из внеклеточных матриц, в последние годы вызвали большой интерес благодаря превосходной биосовместимости и более естественным пористым структурам по сравнению с синтетическими продуктами. Здесь мы описываем надежный протокол изоляции для получения островков поджелудочной железы с высоким выходом у мышей C57BL / 6J. DCS, обработанные из бычьего перикарда, затем засевали островками, и трансплантаты были трансплантированы в EFP в сингенных диабетических моделях. Нормогликемия у мышей была достигнута в течение 10 дней и поддерживалась до 100 дней до удаления трансплантатов.
протокол
Все эксперименты были одобрены Комитетом по институциональному уходу и использованию животных в Пекине (IACUC, IACUC no COE-LuoY-1).
1. Изоляция островков
- Подготовка реагентов и оборудования.
- Восстановить порошок коллагеназы P (2 ед. / Мг) в HBSS для приготовления раствора 5 мг / мл и фильтровать его через фильтр 0,22 мкм для удаления бактерий. Подготовьте 0,6 мл-аликвотные растворы коллагеназы Р в 15-мл конических пробирках и храните при -20 ° C.
ПРИМЕЧАНИЕ. Во время использования каждую аликвоту разбавляют HBSS с получением 6 мл рабочих растворов с конечными концентрациями 0,5 мг / мл или 1 ед. / Мл (достаточно для лечения 3 мышей). Рабочий раствор хранится на льду для немедленного использования в течение 1 часа. Рабочее решение не должно быть восстановлено или повторно заморожено для дополнительного использования. - Подготовьте раствор нейтрализации путем добавления FBS (2,5%) и P / S (1%) в HBSS; Держите раствор на льду. Подготовьте 60 мл нейтрализующего раствора для обработкиT 6 мышей.
- Для культуральной среды островка добавляют D-глюкозу (7 мМ), FBS (10%) и P / S (1%) в среду RPMI 1640.
- Автоклав хирургических инструментов при 115 ° C в течение 30 минут и 15 фунтов на квадратный дюйм давления.
- Восстановить порошок коллагеназы P (2 ед. / Мг) в HBSS для приготовления раствора 5 мг / мл и фильтровать его через фильтр 0,22 мкм для удаления бактерий. Подготовьте 0,6 мл-аликвотные растворы коллагеназы Р в 15-мл конических пробирках и храните при -20 ° C.
- Инфляция поджелудочной железы.
- Подготовьте 12 мл рабочего раствора коллагеназы, как указано на шаге 1.1.1, для 6 мышей (12 недель). Заполните 10 мл шприца 9 мл рабочего раствора и соедините шприц с внутривенной иглой 27 G. Храните шприц на льду и используйте раствор в течение 1 часа.
- Усыплять мышцы шейным дислокацией. Поместите мышь в лежачее положение на бумажном полотенце, хвост указывает на оператора. Распылите все тело 70% этанолом, сделав его полностью влажным.
- Сделайте V-разрез, начиная с области гениталий и распространяясь на диафрагму, используя ножницы для вскрытия и щипцы. Сложите кожу над сундуком, чтобы полностью открыть брюшную полость.
- ПереехатьКишечника с правой стороны мыши и выставить поджелудочную железу и общий желчный проток. Прихватите двенадцатиперстной кишку осторожно с помощью щипцов и потяните ее до тех пор, пока желчный канал не станет тугим ( рис. 1А- 1 и А-2 ).
- Найти портал вены и желчных протоков, ведущих в печень. Закрепите портальную вену и желчный канал микроскопическим гемостатическим зажимом.
ПРИМЕЧАНИЕ. Зажим предотвращает чрезмерное кровотечение и попадание коллагеназы в печень. - Пока держите кисть с помощью щипцов, найдите расположение ампулы, соединяющей желчный проток и двенадцатиперстную кишку. Вставьте 27G внутривенную иглу в общий желчный проток через ампулу ( рис. 1B -1 и B-2 ).
- Внесите около 200 мкл рабочего раствора коллагеназы, чтобы проверить, полностью ли канюлирование проходит через желчный канал. Если раствор коллагеназы начинает заполнять канал ( Рисунок 1C- 1 и C2 ), игла находится в просвете канала; Зажмите сегмент канала, содержащий иглу, используя гемостатический зажим артерии и распределите оставшуюся часть 2 мл раствора с медленной и постоянной скоростью в течение 1 мин ( рис. 2А- 1 , А-2 и В-1 ).
ПРИМЕЧАНИЕ. Если ткань, окружающая канал, начинает раздуваться ( рис. 2B -2 ), игла пробивается сквозь стенку желчного протока, что делает необходимым переместить иглу и снова попытаться выполнить канюлирование желчного протока. Аналогично, если двенадцатиперстная кишка начинает накачиваться ( рис. 2C- 1 и C-2 ), необходимо отрегулировать гемостатический зажим артерии, и желчный канал повторно канюлировать. Когда раствор коллагеназы заполняет поджелудочную железу, ткань около двенадцатиперстной кишки сначала раздувается, а затем регистрируетсяN около хвоста поджелудочной железы. Перфузия хвоста поджелудочной железы (селезеночная лопасть) важна для максимизации выхода островков. - После полной инфляции поджелудочной железы ( рис. 2С- 1 ) подтолкните кишечник к левой стороне мыши и удалите поджелудочную железу, начиная с нисходящей ободочной кишки. Используйте щипцы, чтобы поднять кишку и отделить ее от поджелудочной железы с помощью другой пары щипцов. Продолжайте снимать поджелудочную железу, пока она не будет прикреплена к верхней части желудка. Наконец, поднимите поджелудочную железу из брюшной полости и освободите ее от остальной селезенки.
ПРИМЕЧАНИЕ. Все разделение следует выполнять быстро, так как расщепление продолжается во время процесса удаления. - Поместите поджелудочную железу в пустую 15-мл коническую трубку и оставьте на льду. Повторите описанную выше процедуру для оставшихся мышей. Все поджелудочную железу следует дополнительно обработать в течение 1 часа, быстро следуя шагу 1.3, чтобы предотвратить чрезмерное переваривание коллагеназой P.

Рисунок 1: Фотографии, показывающие канюлю желчного протока и перфузию поджелудочной железы с помощью растворов коллагеназы. ( A1 ) Вытягивание двенадцатиперстной кишки до тех пор, пока желчный проток не станет напряженным. (Ампула: треугольная, молочная область на поверхности двенадцатиперстной кишки, желчный проток: пуховидная молочная структура на поверхности). ( B1 ) Вставка иглы в желчный проток из ампулы. ( C1 ) Надувание поджелудочной железы инъекцией фермента. ( A2, B2 и C2 ) Мультяшные изображения процедур, показанных в A1, B1 и C1, соответственно. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
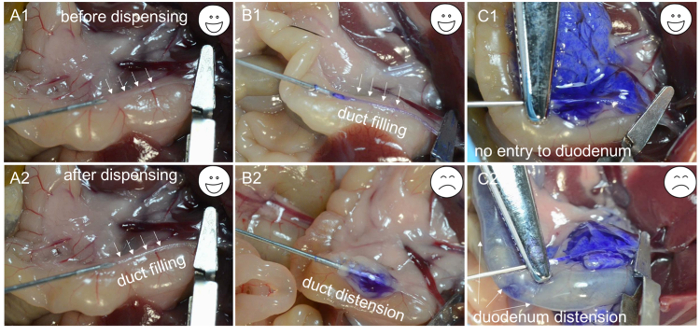
Рисунок 2: Устранение неполадок для канюлирования. ( A1 ) Кончик иглы вставлен в просвет желчного протока. ( A2 ) Канал, заполненный ферментными растворами. ( B1 ) Игла вставлена в просвет желчного протока, а канал заполнен синим красителем. ( B2 ) Из-за неправильной канюлирования игла находится под желчным протоком, и после раздачи синего красителя наблюдается только накачанная капсула. ( C1 ) Успешная канюляция подтверждается растяжением поджелудочной железы. ( C2 ) Из-за неправильного зажима синий краска входит в двенадцатиперстную кишку и вызывает вздутие. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- <Сильный> Пищеварение и очистка островков.
- Инкубируйте конические пробирки, содержащие перфузированную поджелудочную железу при 37 ° С в течение 17 мин.
ПРИМЕЧАНИЕ. Время инкубации может варьироваться в зависимости от возраста и видов животных. - Прекратите расщепление, добавив 7 мл нейтрализующего раствора и положив трубки на лед.
- Диссоцианируйте ткань, энергично встряхивая пробирки ( например, 20 раз за 10 с) до получения мелких частиц ткани.
ПРИМЕЧАНИЕ. Выход островки будет низким, если поджелудочная железа полностью не будет диссоциировать. - Отфильтруйте расщепленные образцы тканей с помощью проволочной сетки толщиной 0,5 мм, чтобы удалить любые непереваренные кусочки ткани. Соберите суспензии островков в новой конической трубке 50 мл.
- Центрифугируйте пробирки в течение 3 минут при 230 xg и 4 ° C и аккуратно вылейте надосадочную жидкость, не нарушая тканевые гранулы.
- Ресуспендируют гранулы от 3 мышей в 4 мл градиента плотности полисухарозы, слегка встряхивая или pIpetting подвеска вверх и вниз несколько раз. Медленно пипетируйте 4 мл HBSS по бокам трубки до верхней части растворов полисухарозы.
ПРИМЕЧАНИЕ. Два решения должны быть хорошо разделены слоями с четким интерфейсом.
ПРИМЕЧАНИЕ. Добавление HBSS должно выполняться с осторожностью, не нарушая градиент плотности полисухарозы на дне. - Центрифугируйте суспензию в течение 20 минут при 900 xg и 4 ° C, выбирая очень медленную скорость ускорения. Завершите центрифугирование без тормоза.
ПРИМЕЧАНИЕ. Это шаг для очистки островков от экзокринных клеток, причем большинство островков мигрируют к границе между слоями полисахарозы и HBSS и большинством экзокринных клеток, оседающих на дне. - Удалите весь раствор супернатантов с 8 мл, используя пипетку с большим объемом 15 мл. Проходите решения через инвертированный фильтр на 70 мкм.
ПРИМЕЧАНИЕ. Островки будут дополнительно очищены и сохранены фильтром, в то время как экзокринные клеткиБудет проходить через фильтр.
Осторожно: градиент плотности полисускорса токсичен клетками; Фильтрация поможет островкам избавиться от полисухарозы. - Внесите 2 мл раствора для нейтрализации холодной воды в 35-миллиметровую чашку Петри. Инвертируйте сетчатый фильтр прямо вверх, опустите поверхность, удерживая островки в растворе, и осторожно встряхните, чтобы освободить островки.
- С помощью пипетки размером 20 мкл с белым наконечником вытащите островки под микроскоп.
ПРИМЕЧАНИЕ. Островки представляют собой желтоватые, компактные клеточные агрегаты ( рис. 3А ), в то время как загрязняющая экзокринная ткань или клетки имеют черноватую и рыхлую структуру под рассекающим микроскопом. - Поместите около 200 островков в 35-миллиметровую чашку с 2 мл культуральной среды и инкубируйте при 37 ° С в инкубаторе, снабженном 5% СО 2 в течение 12 часов.
ПРИМЕЧАНИЕ. Обычно 150-300 островков можно собирать у одной 12-недельной мыши C57BL / 6J. Острова склонны к образованию агрегатов во время культуры,И большие островки (> 300 мкм) восприимчивы к центральному некрозу ( рис. 1В , вставка). Встряхните суспензию, чтобы равномерно распределить островки в блюде и уменьшить скопление.
- Инкубируйте конические пробирки, содержащие перфузированную поджелудочную железу при 37 ° С в течение 17 мин.
2. Культура островков на Лесах
ПРИМЕЧАНИЕ. DCS имеет пористость около 79%, толщину около 0,6 мм и размер пор от 12 до 300 мкм.
- Вырежьте леса в 7-миллиметровые диски, смочите их в 70% этаноле и промойте их HBSS. Поместите строительные леса в 24-луночные вставки для культуры тканей.
ПРИМЕЧАНИЕ. Когда свежие островки восстанавливаются после ночной культуры, островки кажутся яркими и плотными, с гладкими границами ( рисунок 3B ). - Переверните блюдо и соберите островки из центра блюда, используя пипетку 20 мкл с белым кончиком. Перенесите островки на леса (250 островков / леса) с помощью пипетки и добавьте 2 мл культуральной среды кКолодец. Культура островков за 12 ч до трансплантации.
3. Трансплантация островков на сайте EFP
- Индуцирование диабета у реципиентных мышей.
- Поместите мышей C57BL / 6J (более 10 недель) в свежую клетку с водой, но без пищи. Быстро мышей в течение 10 ч перед индукцией диабета.
- Подготовьте буферные растворы с рН 4,2-4,5 путем смешивания 0,1 М лимонной кислоты с 0,1 М цитратом натрия. Растворить STZ (10 мг / мл) в свежеприготовленном буфере и стерилизовать раствор, пропуская его через фильтр 0,22 мкм.
ПРИМЕЧАНИЕ: STZ чувствительна к свету и теряет активность в течение 10 мин; Всегда готовите свежие STZ-раствор прямо перед инъекцией. - Инъецируйте каждую мышь внутрибрюшинно STZ в дозе 140-150 мг / кг для каждой мыши C57BL / 6J.
ПРИМЕЧАНИЕ. Доза варьируется в зависимости от возраста и видов животных. Рекомендуется проводить мелкомасштабную оптимизацию дозы teДля данного вида перед началом формального эксперимента. - Соберите кровь хвостовой вены и контролируйте уровень глюкозы в крови с помощью глюкометра в день 2, 3 и 4 после инъекции STZ.
ПРИМЕЧАНИЕ. Когда животные подвергаются гипергликемическому (уровень глюкозы в крови натощак> 16,7 мМ) в течение двух последовательных дней, они готовы к трансплантации островков.
- Трансплантация островков на сайт EFP.
- Анестезируйте мышей с пентобарбиталом, поставленным внутрибрюшинно (50 мг / кг). Поместите мышь в лежачее положение на бумажном полотенце, хвост указывает на оператора. Широко брить живот, чтобы удалить мех вокруг участка разреза. Наденьте ленту на четыре конечности и полностью протирайте кожу чередующимся спиртом, а салфетки йодофора перемещаются круговым способом для стерилизации участка разреза. Нанесите мышь стерильной драпировкой, разрешая доступ только к области разреза. Сделайте разрез на 7 мм через перитонеальную стенкуСредней линии, близкой к области гениталий.
ПРИМЕЧАНИЕ. Все инструменты, используемые во время операции, включая перчатки, должны быть стерильными. - Аккуратно возьмите и удалите EFP из брюшной полости с помощью щипцов. Распределите EFP на смоченной стерильной марле. Поместите эшафот, содержащий островки, в EFP и сложите EFP, чтобы обернуть трансплантат. Обеспечьте прямой контакт между островками и EFP, зашив EFP с помощью абсорбируемых швов 6-0. Смочите поверхность EFP стерильным физиологическим раствором, используя пропитанный ватный тампон, чтобы предотвратить высыхание EFP.
- Осторожно поместите EFP обратно в брюшную полость. Закройте разрез, зашив перитонеальную стенку и закрепив дермальный слой раневыми зажимами.
- Внедрить бупренорфин (0,1 мг / кг) подкожно в качестве анальгетика.
- Внесите 1 мл физиологического раствора подкожно, чтобы предотвратить обезвоживание.
- Поместите мышь в клетку на нагревательной подушке, пока мышь не восстановится от анестезии.
- Проверьте уровень глюкозы, не находящийся натощакЧерез два дня, собирая кровь из хвостовой вены. Если вы извлекаете трансплантат, повторите описанные выше процедуры трансплантации, аккуратно вытащите EFP, используйте шов 3-0 для лигирования конца жировой прокладки, прилегающей к эпидидимису, закрывайте кровеносные сосуды, эксплантируйте трансплантат EFP и сохраните его для гистологии ,
ПРИМЕЧАНИЕ. Объяснение островков должно снова вызвать гипергликемию реципиента мышей в течение 3 дней, подтверждая функцию трансплантата.
- Анестезируйте мышей с пентобарбиталом, поставленным внутрибрюшинно (50 мг / кг). Поместите мышь в лежачее положение на бумажном полотенце, хвост указывает на оператора. Широко брить живот, чтобы удалить мех вокруг участка разреза. Наденьте ленту на четыре конечности и полностью протирайте кожу чередующимся спиртом, а салфетки йодофора перемещаются круговым способом для стерилизации участка разреза. Нанесите мышь стерильной драпировкой, разрешая доступ только к области разреза. Сделайте разрез на 7 мм через перитонеальную стенкуСредней линии, близкой к области гениталий.
Результаты
Наш метод зажима, выполненный с использованием микроскопического гемостатического зажима, прост и экономичен по времени по сравнению с методом лигирования швов. Прошло около 4 часов, чтобы выделить и очистить около 1200 островков от 6 мышей. Недавно выделенные островки обычно имели грубую периферию под оптическим микроскопом ( рис. 3А ). Как только островки восстановились из процесса изоляции, они выглядели яркими и плотными и приобрели гладкую поверхность. Однако стрессовая изоляция все еще может вызвать гибель клеток, что приводит к падению клеток с островковых поверхностей, а нездоровые островки часто содержат темный некротический сердечник ( рис. 3B ). Мы измерили диаметры 945 островков от 5 мышей; Рассчитанный средний диаметр островков составлял 130,42 ± 41,75 мкм ( фиг. 3С ).
Чтобы избежать иммунитета реципиента Мы проводили сингенную трансплантацию у мышей C57BL / 6J. Как правило, 500 островков, нагруженных DCS, трансплантировали на сайт EFP и отменяли гипергликемию в течение 10 дней по сравнению с 30 днями, наблюдаемыми в группе свободных островков. Нормогликемия поддерживалась в течение примерно 100 дней, пока не было извлечено графтов ( рисунок 3D ). Загруженные островки были равномерно распределены по DCS и покрыты EFP. Оставшееся на носилках DCS можно также легко манипулировать с помощью щипцов ( рис. 3Е и 3F ). Гистологическое исследование показало, что равномерно распределенные островки были реваскуляризированы и окружены тканями EFP и DCS после трансплантации в течение 60 дней ( рисунок 3G ). Иммунное окрашивание инсулина также подтвердило успешное приживление островков ( рисунок 3Н ).
Xfigimg "src =" / files / ftp_upload / 54995 / 54995fig3.jpg "/>
Рисунок 3: Трансплантация островков, поддерживаемых эшафотами, на сайт EFP. ( A ) Репрезентативная картина свежих островков, изолированных от мышей. ( B ) Островки культивируют в течение 12 ч, при этом мертвые клетки отрываются от поверхности островка. Вставка: нездоровые островки имеют темное, некротическое ядро. ( C ) Распределение по размеру 945 островков от 5 мышей. ( D ) Уровень глюкозы в крови натощак у диабетических мышей, трансплантированных островками, снабженными DCS и свободными островками. Черная стрелка указывает, что трансплантат был извлечен в этот момент времени. ( E ) Фотография, показывающая перенос загруженных островками эшафотов на поверхность ткани EFP с распространением. ( F ) Репрезентативное фазовое контрастное изображение загруженного островка DCS. Вставка: оптическое изображение DCS, удерживаемого щипцами. ( G ) Репрезентативный гистологический H & E-образПересаженные островки, окруженные DCS и EFP, через 60 дней. ( H ) Иммуноокрашивание островков, поддерживаемых DCS, эксплантируемых через 60 дней. Шкала шкалы = 150 мкм (A, B), 100 мкм (F), 500 мкм (G) и 25 мкм (H). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Перфузия поджелудочной железы и время переваривания являются двумя ключевыми параметрами, которые влияют на выход и качество остэка. Moskalewski впервые сообщило об использовании сырой смеси коллагеназы для переваривания поджелудочной железы поджелудочной железы морской свинки 11 . Lacy et al. Сообщил о введении ферментов в систему каналов, чтобы перфузировать поджелудочную железу, что значительно увеличило выход островков 12 . Перфузия в протоках фермента позволяет максимально подвергать ферментам площадь поверхности поджелудочной железы, что приводит к более гомогенному расщеплению и большему высвобождению интактных островков по сравнению с перевариванием измельченной поджелудочной железы 13 . По нашему опыту, успешная канюлирование желчного протока и перфузия всей поджелудочной железы были предпосылками для получения высоких островков. Это связано с тем, что хвост поджелудочной железы (селезеночный лепесток) фактически содержит большую часть островков по сравнению с поджелудочной тканью, близкой к двенадцатиперстной кишке. Существует два способа канюлирования В желчном протоке, о котором сообщается в литературе: i) вставка иглы близко к месту печенки, блокируя проникновение фермента в двенадцатиперстную кишку 13 , 14 и ii) вставляя иглу близко к двенадцатиперстной кишке, блокируя проникновение фермента в Печень 15 . Здесь мы использовали последний метод, который не требует изгиба иглы или перемещения мыши. Хорошо обученный исследователь может выполнять канюлю 10 мышей в течение 40 минут, следуя нашему протоколу. Время переваривания поджелудочной железы зависит от возраста и видов мышей. Передозировка поджелудочной железы продуцирует небольшие островки, а подкожные поджелудочной железы имеют ацинарные клетки, прикрепленные к островкам. Поэтому важно оптимизировать время переваривания для получения высоких урожаев здоровых островков.
STZ представляет собой антибиотическое соединение, которое специфически разрушает бета-клетки и индуцирует диабет у мышей в течение 3 днейSs = "xref"> 16. Дозировка варьируется в зависимости от конкретного штамма и возраста мыши и должна определяться предварительными экспериментами. Насколько нам известно, мыши C57BL / 6J требуют более низкой дозы STZ, чем мышей Balb / C. Передозировка STZ вызовет тяжелую гипергликемию и приведет к гибели животных в течение недели, в то время как неадекватная доза STZ снижает уровень заболеваемости диабетом.
EFP - сильно васкуляризированные ткани и доступны для хирургии с помощью минимально инвазивных процедур. Трансплантация островков в EFP, как правило, более легкая и более безопасная по сравнению с капсулой в почках, еще один часто сообщаемый сайт для трансплантации островков в моделях мыши. В частности, почка является важным органом и чувствительна к обработке; Трансплантация островков может потерпеть неудачу или животные не могут выжить в хирургии 4 . EFP у мышей также похожи на мешочек сальса у людей. Исследование трансплантации в EFP может не только способствоватьПонимание предпосылки тканевой среды для выживания / функционирования островков, а также заложить основу для разработки клинических процедур трансплантации 17 .
DCS, используемый в этом исследовании, был получен из бычьего перикарда и в основном был сделан из коллагена. Децеллюлярные материалы могут не проявлять иммуногенность и могут вызывать только легкие воспалительные реакции in vivo 18 . Когда островки были посеяны в порах DCS, эшафот предлагал механическую защиту и предотвращал слияние островков, что могло привести к некрозу островков. Каркас DCS, содержащий островки, можно обрабатывать непосредственно с помощью щипцов, что позволяет легко переносить трансплантат. Встраивание лесов в EFP также уменьшало утечку островков в брюшину, в отличие от свободных островков, пересаженных без помоста 8 . Следовательно, DCS обеспечивает distincT для трансплантации островков.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Вэй Чжан из Guanhao Biotech за предоставление декоративных лесов. Мы благодарим Сяо-хон Пэн за полезные обсуждения. Это исследование было финансово поддержано Национальным фондом естественных наук Китая (проект №31322021).
Материалы
| Name | Company | Catalog Number | Comments |
| Dissecting scissor | Ningbo Medical | ||
| Forceps | Ningbo Medical | ||
| 0.5 mm diameter wire mesh | Ningbo Medical | ||
| 70 μm cell strainer | Falcon | 352350 | |
| Artery hemostatic clamp | Ningbo Medical | ||
| Microscopic hemostatic clamp | Ningbo Medical | ||
| Hemostatic forceps | Ningbo Medical | ||
| Absorbable 6-0 PGLA sutures | JINHUAN | With needle | |
| Wound clip | Ningbo Medical | ||
| Cotton swab | Ningbo Medical | ||
| Gauze | Ningbo Medical | ||
| Sterile drapes | Ningbo Medical | ||
| 10mL syringe | JINGHUAN | ||
| 1 mL syringe | JINGHUAN | ||
| 27G intravenous needle | JINGHUAN | 0.45x15 RWSB | |
| 1.5 mL Eppendorf tube | Axygen | ||
| 15mL conical tube | Corning | 430791 | |
| 50mL conical tube | Corning | 430829 | |
| 35mm Non-treated Peri-dishes | Corning | 430588 | |
| Transwell | Corning | 3422 | |
| 0.22 μm filter | Pall | PN4612 | |
| 10 mL serological pipet | Corning | 4488 | |
| Pipet filler S1 | Thermo Scientific | 9501 | |
| Pipette (2-20μL) | Axygen | AP-20 | AXYPETTM |
| Dissecting microscope | Olympus | SZ61 | |
| Centrifuge | Eppendorf | 5810R | |
| Hank’s balanced salt solution | Gibco | C14175500CP | |
| Collagenase P | Roche | COLLP-RO | |
| Histopaque 1077 | Sigma | 10771 | |
| RPMI 1640 | Gibco | 11879-20 | |
| FBS | Gibco | 16000-044 | |
| D-glucose | Gibco | A24940-01 | |
| Glucose meter | Roche | ACCU-CHEK | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Streptozotocin | Sigma | V900890 | VetecTM |
| Chloral hydrate | J&K | C0073 | |
| Sodium citrate | Sigma | 71497 | |
| Citric acid | Sigma | C2404 | |
| Iodophors | Ningbo Medical | ||
| C57BL/6J, 10-12 weeks old | VitalRiver | Beijing, China | |
| Decellularized scaffold | Guanhao Biotec | 131102 | Guangzhou, China |
Ссылки
- Shapiro, A. M., et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 343, 230-238 (2000).
- Shapiro, A. M. J., et al. International Trial of the Edmonton Protocol for Islet Transplantation. N Engl J Med. 355, 1318-1330 (2006).
- Ryan, E. A., et al. Five-year follow-up after clinical islet transplantation. Diabetes. 54, 2060-2069 (2005).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95, 1449-1461 (2008).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotechnol. 35 (1), (2017).
- Dufour, J. M., et al. Development of an ectopic site for islet transplantation, using biodegradable scaffolds. Tissue Eng. 11, 1323-1331 (2005).
- Weaver, J. D., et al. Controlled Release of Dexamethasone from Organosilicone Constructs for Local Modulation of Inflammation in Islet Transplantation. Tissue Eng Part A. 21, 2250-2261 (2015).
- Wang, K., et al. From Micro to Macro: The Hierarchical Design in a Micropatterned Scaffold for Cell Assembling and Transplantation. Adv Mater. 29, (2017).
- Blomeier, H., et al. Polymer Scaffolds as Synthetic Microenvironments for Extrahepatic Islet Transplantation. Transplantation. 82, 452-459 (2006).
- Gibly, R. F., et al. Extrahepatic islet transplantation with microporous polymer scaffolds in syngeneic mouse and allogeneic porcine models. Biomaterials. 32, 9677-9684 (2011).
- Moskalewski, S. Isolation and Culture of the Islets of Langerhans of the Guinea Pig. Gen Comp Endocrinol. 5, 342-353 (1965).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16, 35-39 (1967).
- Zmuda, E. J., Powell, C. A., Hai, T. A Method for Murine Islet Isolation and Subcapsular Kidney Transplantation. J Vis Exp. (50), (2011).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4, 1649-1652 (2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse Islet of Langerhans Isolation using a Combination of Purified Collagenase and Neutral Protease. J Vis Exp. (67), (2012).
- Sakata, N., Yoshimatsu, G., Tsuchiya, H., Egawa, S., Unno, M. Animal models of diabetes mellitus for islet transplantation. Exp Diabetes Res. , 256707(2012).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotech. 35, 8-8 (2017).
- Londono, R., Badylak, S. F. Biologic scaffolds for regenerative medicine: mechanisms of in vivo remodeling. Ann Biomed Eng. 43, 577-592 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены