Method Article
Transplante de islotes en el cojín de grasa epididimal de ratones diabéticos
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo demuestra el aislamiento de los islotes murinos y la siembra en un andamio decelularizado. Los islotes soportados por el andamio fueron trasplantados en la almohadilla de grasa epididimal de ratones diabéticos inducidos por estreptozotocina (STZ). Los islotes sobrevivieron en el sitio del trasplante e invirtieron la condición hiperglucémica.
Resumen
El trasplante de islotes ha demostrado clínicamente ser eficaz en el tratamiento de la diabetes tipo 1. Sin embargo, la actual estrategia de trasplante intrahepático puede incurrir en reacciones agudas de sangre entera y resultar en inseminación de islotes pobres. En este trabajo se presenta un protocolo robusto para el trasplante de islotes en el sitio de trasplante extrahepático -la almohadilla de grasa epididimal (EFP) - en un modelo de ratón diabético. Se describe un protocolo para aislar y purificar islotes con altos rendimientos de ratones C57BL / 6J, así como un método de trasplante realizado mediante la siembra de islotes sobre un andamio decelularizado (DCS) y su implantación en el sitio EFP en ratones C57BL / 6J singénicos rendidos diabéticos Por la estreptozotocina. El injerto DCS que contenía 500 islotes invirtió la condición hiperglucémica en 10 días, mientras que los islotes libres sin DCS requirieron al menos 30 días. La normoglucemia se mantuvo hasta 3 meses hasta que se explantó el injerto. En conclusión, DCS mejoró el injerto de islotes en tEl sitio extrahepático de la EFP, que podría ser fácilmente recuperado y podría proporcionar una plataforma reproducible y útil para investigar los materiales del andamio, así como otros parámetros de trasplante requeridos para un inseminación exitosa de islotes.
Introducción
La diabetes mellitus tipo 1 (T1D) es un trastorno endocrino autoinmune en el que las células de los islotes son ablacionadas por el sistema inmunitario, haciendo que los pacientes dependan de la inyección de insulina exógena durante toda su vida. El protocolo de Edmonton representa un hito en los estudios clínicos del trasplante de islotes; Los islotes fueron infundidos a través de la vena porta y trasplantados en el sitio intrahepático [ 1] . Sin embargo, dos obstáculos principales-fuentes inadecuadas de islotes donantes y insectos de islotes pobres-impiden el gran éxito del trasplante de islotes 2 . Por lo general, los islotes necesitan ser recogidos de tres donantes cadáveres para revertir la condición hiperglucémica de un paciente; Esto se debe al bajo rendimiento de los procedimientos de aislamiento de islotes ya la pérdida de islotes tras el trasplante. En particular, aunque los islotes posteriores al trasplante se bañaban en sangre rica en oxígeno, el contacto directo con la sangre evocaba a menudo la inflamación mediada por la sangre instantánea(IBMIR), que podría causar la pérdida aguda de los islotes. A largo plazo, se piensa que la pérdida gradual de islotes en los pacientes explicó la caída de las tasas de reversión de la diabetes en los grupos clínicos, que podría llegar al 90% en el primer año y disminuir a 30% y 10% a 2 y 5 Años después del trasplante, respectivamente 3 .
El trasplante de islote en los sitios extrahepáticos ha sido una estrategia atractiva para reducir el contacto directo de los islotes con la sangre mientras se confina los trasplantes a lugares más definibles en comparación con la infusión intrahepática. Se han realizado estudios en la cápsula renal, ojos, músculos, almohadillas de grasa y espacios subcutáneos en los últimos años, mostrando que los islotes en estos sitios son capaces de sobrevivir y funcionan para restaurar la normoglucemia 4 . Además, los islotes en estos sitios son recuperables, lo que hace posible la biopsia o incluso para procedimientos de reemplazo adicionales. ExtrahepáticoItes por lo tanto, muestran un gran potencial para el trasplante clínico [ 5] .
Los andamios basados en biomateriales han sido intensamente investigados para el trasplante de células y la ingeniería de tejidos. Los andamios tridimensionales (3D) generalmente contienen estructuras porosas y pueden servir como plantillas celulares para generar estructura espacial / organización de células o como reservorios para proporcionar la liberación controlada de señales bioactivas. Los andamios también se han fabricado a partir de materiales poliméricos, tales como poli (glicolida-L-lactida) 6 , poli (dimetilsiloxano) 7 y poli (uretano) termoplástico 8 , para transplantar islotes en la EFP. En comparación con el trasplante directo de islotes, se encontró que el uso de andamios reduce la pérdida de islotes al prevenir la fuga de islotes en la cavidad intraperitoneal 9 , 10 , proporcionando protección mecánica y moduLa reacción inflamatoria local. Los andamios pueden así desarrollarse para promover el injerto de islotes en los sitios de trasplante 7 .
En este estudio, pretendemos demostrar un paradigma de trasplante de islotes en la EFP, llevado a cabo en modelos de ratones utilizando un DCS. Los andamios derivados de matrices extracelulares han atraído gran interés en los últimos años debido a la biocompatibilidad superior ya estructuras naturales porosas más comparadas con productos sintéticos. Aquí, describimos un robusto protocolo de aislamiento para obtener los islotes pancreáticos con altos rendimientos de ratones C57BL / 6J. Los DCSs procesados a partir del pericardio bovino fueron entonces sembrados con islotes, y los injertos fueron trasplantados a la EFP en modelos diabéticos singénicos. La normoglucemia en ratones se logró en 10 días y se mantuvo hasta 100 días, hasta la eliminación de los injertos.
Protocolo
Todos los experimentos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Pekín (IACUC, IACUC no COE-LuoY-1).
1. Aislamiento de islotes
- Preparación de reactivos y equipos.
- Reconstituir colagenasa P en polvo (2 U / mg) en HBSS para hacer una solución de 5 mg / mL y filtrar a través de un filtro de 0,22 μm para eliminar las bacterias. Preparar soluciones alícuotas de 0,6 ml de colagenasa P en tubos cónicos de 15 ml y almacenar a -20 ° C.
NOTA: Durante el uso, cada alícuota se diluye con HBSS para dar soluciones de trabajo de 6 ml con concentraciones finales de 0,5 mg / ml, o 1 U / ml (suficiente para tratar 3 ratones). La solución de trabajo se mantiene en hielo para su uso inmediato en 1 h. La solución de trabajo no se debe restaurar o volver a congelar para uso adicional. - Preparar la solución de neutralización añadiendo FBS (2,5%) y P / S (1%) en HBSS; Mantener la solución sobre hielo. Preparar 60 ml de solución de neutralización a treaT 6.
- Para el medio de cultivo de islotes, añadir D-glucosa (7 mM), FBS (10%) y P / S (1%) a medio RPMI 1640.
- Autoclave los instrumentos quirúrgicos a 115 ° C durante 30 min y 15 psi de presión.
- Reconstituir colagenasa P en polvo (2 U / mg) en HBSS para hacer una solución de 5 mg / mL y filtrar a través de un filtro de 0,22 μm para eliminar las bacterias. Preparar soluciones alícuotas de 0,6 ml de colagenasa P en tubos cónicos de 15 ml y almacenar a -20 ° C.
- Inflación del páncreas.
- Preparar 12 ml de solución de trabajo de colagenasa, como se especifica en el paso 1.1.1, para 6 ratones (12 semanas de edad). Llene la jeringa de 10 ml con 9 ml de solución de trabajo y conecte la jeringa a la aguja intravenosa de 27 G. Guarde la jeringa en hielo y utilice la solución en 1 h.
- Eutanasia del ratón por dislocación cervical. Coloque el ratón en posición supina sobre una toalla de papel, con la cola apuntando hacia el operador. Rocíe el cuerpo entero con etanol al 70%, haciéndolo completamente mojado.
- Haga una incisión en V, comenzando desde el área genital y extendiéndose hasta el diafragma, usando tijeras de disección y fórceps. Doble la piel sobre el pecho para revelar completamente la cavidad abdominal.
- MovimientoEl intestino al lado derecho del ratón y exponer el páncreas y el conducto biliar común. Coge el duodeno cuidadosamente con pinzas y tire de él hasta que el conducto biliar esté tenso ( Figura 1A -1 y A-2 ).
- Encuentre la vena porta y el conducto biliar que conduce al hígado. Sujete la vena porta y el conducto biliar con una pinza hemostática microscópica.
NOTA: La sujeción previene el sangrado excesivo y la entrada de la colagenasa en el hígado. - Mientras todavía mantiene el intestino con la pinza, encontrar la ubicación de la ampolla que conecta el conducto biliar y el duodeno. Insertar la aguja intravenosa 27G en el conducto biliar común a través de la ampolla ( Figura 1B -1 y B-2 ).
- Dispensar unos 200 μl de colagenasa solución de trabajo para comprobar si la canulación es todo el camino a través del conducto biliar. Si la solución de colagenasa comienza a llenar el conducto ( 1 y C2 ), la aguja está en el lumen del conducto; Sujetar el segmento del conducto que contiene la aguja usando una pinza hemostática de la arteria y dispensar el resto de los 2 ml de solución a una velocidad lenta y constante dentro de 1 minuto ( Figura 2A -1 , A-2 y B-1 ).
NOTA: Si el tejido que rodea el conducto comienza a inflar ( Figura 2B- 2 ), la aguja ha atravesado la pared del conducto biliar, haciendo necesario volver a colocar la aguja e intentar volver a canular el conducto biliar. De manera similar, si el duodeno comienza a inflar ( Figura 2C -1 y C-2 ), la pinza hemostática de la arteria necesita ser ajustada y el conducto biliar puede volver a canularse. A medida que la solución de colagenasa llena el páncreas, el tejido cerca del duodeno se infla primero, seguido por el regioN cerca de la cola pancreática. La perfusión de la cola pancreática (el lóbulo esplénico) es importante para maximizar el rendimiento del islote. - Después del inflado completo del páncreas ( Figura 2C -1 ), empuje el intestino hacia el lado izquierdo del ratón y retire el páncreas comenzando en el colon descendente. Use la pinza para levantar el intestino y separarla del páncreas con otro par de pinzas. Continúe quitando el páncreas hasta que no quede suelto de la parte superior del estómago. Finalmente, levante el páncreas fuera del abdomen y corte libre del bazo restante.
NOTA: La separación completa debe realizarse rápidamente, ya que la digestión continúa durante el proceso de extracción. - Coloque el páncreas en un tubo cónico vacío de 15 mL y déjelo sobre hielo. Repita el procedimiento anterior para los ratones restantes. Todos los páncreas deben procesarse en 1 h siguiendo el paso 1.3 para evitar la sobre-digestión de la colagenasa P.

Figura 1: Fotografías que muestran la canulación del conducto biliar y la perfusión del páncreas con soluciones de colagenasa. ( A1 ) Tirar del duodeno hasta que el conducto biliar esté tenso. (Ampolla: el área triangular, lechosa en la superficie del duodeno, conducto biliar: la estructura lechosa similar a la cuerda en la superficie). ( B1 ) Inserción de la aguja en el conducto biliar de la ampolla. ( C1 ) Inflación del páncreas con la inyección de enzima. ( A2, B2 y C2 ) Imágenes de dibujos animados de los procedimientos mostrados en A1, B1 y C1, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.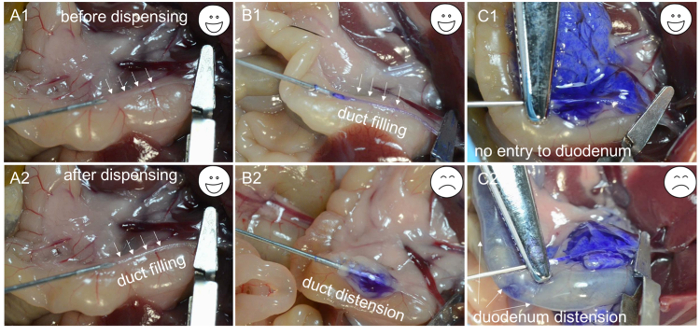
Figura 2: Solución de problemas para la canulación. ( A1 ) La punta de la aguja se inserta en el lumen del conducto biliar. ( A2 ) El conducto se llena de soluciones enzimáticas. ( B1 ) La aguja se inserta en el lumen del conducto biliar y el conducto se llena con un colorante azul. ( B2 ) Debido a una canulación inapropiada, la aguja se encuentra por debajo del conducto biliar y sólo se observa una cápsula inflada después de dispensar el colorante azul. ( C1 ) Una canulación exitosa se evidencia por la distensión del páncreas. ( C2 ) Debido al pinzamiento inapropiado, el colorante azul entra en el duodeno y causa distensión. Haga clic aquí para ver una versión más grande de esta figura.- Digestión y purificación de islotes.
- Incubar los tubos cónicos que contienen el páncreas perfundido a 37 ° C durante 17 min.
NOTA: El tiempo de incubación puede variar con la edad y las especies del animal. - Terminar la digestión añadiendo 7 ml de solución de neutralización y poner los tubos en hielo.
- Disociar el tejido agitando vigorosamente los tubos ( por ejemplo, 20 veces en 10 s) hasta que se obtienen partículas finas de tejido.
NOTA: El rendimiento del islote será bajo si el páncreas no se disocia completamente. - Filtrar las muestras de tejido digerido a través de malla de alambre de 0,5 mm para eliminar cualquier trozo de tejido no digerido. Recoja las suspensiones de los islotes en un nuevo tubo cónico de 50 ml.
- Centrifugar los tubos durante 3 min a 230 xg y 4 ° C y verter el sobrenadante cuidadosamente, sin alterar los gránulos de tejido.
- Resuspender los sedimentos de 3 ratones en 4 ml de gradiente de densidad de polisacáridos agitando vórtex suavemente o pIpetting la suspensión arriba y abajo unas cuantas veces. Lentamente pipetee 4 mL de HBSS por el lado del tubo hasta la parte superior de las soluciones de polisacáridos.
NOTA: Las dos soluciones deben ser capas bien separadas con una interfaz nítida.
NOTA: La adición de HBSS debe realizarse con cuidado, sin alterar el gradiente de densidad de polisacáridos en la parte inferior. - Centrifugar la suspensión durante 20 min a 900 xg y 4 ° C seleccionando una velocidad de aceleración muy lenta. Termine la centrifugación sin freno.
NOTA: Este es un paso para purificar los islotes de las células exocrinas, con la mayoría de los islotes migrando a la interfaz entre las capas de polisacárrea y HBSS y la mayoría de las células exocrinas se asientan en el fondo. - Retire la totalidad de las soluciones sobrenadantes de 8 mL usando una pipeta de 15 mL de gran calibre. Pase las soluciones a través de un colador invertido de 70 μm.
NOTA: Los islotes serán purificados y retenidos por el colador, mientras que las células exocrinasPasará a través del filtro.
Precaución: El gradiente de densidad polysucorse es tóxico para las células; La filtración ayudará a los islotes a deshacerse de la polisacáridos. - Pipetee 2 ml de solución de neutralización fría en una placa de Petri de 35 mm. Invertir el colador de la celda con el lado derecho hacia arriba, sumergir la superficie reteniendo los islotes en la solución y agitar suavemente para liberar los islotes.
- Recoger manualmente los islotes bajo un microscopio usando una pipeta de 20 μl con una punta blanca.
NOTA: Los islotes son agregados de células compactos amarillentos ( Figura 3A ), mientras que el tejido o células exocrinas contaminantes tienen una estructura negruzca y suelta bajo el microscopio de disección. - Colocar alrededor de 200 islotes en un plato de 35 mm con 2 ml de medio de cultivo e incubar a 37 ° C en un incubador suministrado con 5% de CO 2 durante 12 h.
NOTA: Normalmente se pueden cosechar 150-300 islotes de un ratón C57BL / 6J de 12 semanas de edad. Los islotes son propensos a formar agregados durante el cultivo,Y los grandes islotes (> 300 μm) son susceptibles a necrosis central ( Figura 1B , inserto). Agite bien la suspensión para distribuir uniformemente los islotes en el plato y reducir el aglomerado.
- Incubar los tubos cónicos que contienen el páncreas perfundido a 37 ° C durante 17 min.
2. Cultivo de islotes en el andamio
NOTA: DCS tiene una porosidad de aproximadamente 79%, un espesor de aproximadamente 0,6 mm y un tamaño de poro que varía de 12 a 300 μm.
- Cortar los andamios en discos de 7 mm, empaparlos en etanol al 70% y lavarlos con HBSS. Coloque los andamios en los insertos de cultivo de tejidos de 24 pocillos.
NOTA: Cuando los islotes frescos se recuperan después de un cultivo durante la noche, los islotes aparecen brillantes y apretados, con bordes lisos ( Figura 3B ). - Remueva el plato y recoja los islotes del centro del plato usando una pipeta de 20 μl con una punta blanca. Transferir los islotes a los andamios (250 islotes / andamio) usando una pipeta y agregar 2 ml de medio de cultivo ael pozo. Cultivo de los islotes durante 12 h antes del trasplante.
3. Transplante de islotes en el sitio EFP
- Inducción de la diabetes en ratones receptores.
- Coloque los ratones C57BL / 6J (más de 10 semanas de edad) en una jaula fresca con un suministro de agua, pero sin alimentos. Ayuno de los ratones durante 10 h antes de la inducción de la diabetes.
- Preparar soluciones tampón con valores de pH de 4,2-4,5 mezclando ácido cítrico 0,1 M con citrato sódico 0,1 M. Disolver STZ (10 mg / ml) en el tampón recién preparado y esterilizar la solución pasándola a través de un filtro de 0,22 μm.
NOTA: STZ es sensible a la luz y pierde actividad en 10 minutos; Siempre prepare la solución STZ fresca justo antes de la inyección. - Inyectar cada ratón intraperitonealmente con STZ a una dosis de 140-150 mg / kg por cada ratón C57BL / 6J.
NOTA: La dosis varía dependiendo de la edad y las especies del animal. Se recomienda realizar una optimización de la dosis a pequeña escala teSt para la especie dada antes de iniciar el experimento formal. - Recoger la sangre de la vena de la cola y controlar la glucosa en la sangre con un medidor de glucosa en los días 2, 3 y 4 post-STZ inyección.
NOTA: Cuando los animales son hiperglucémicos (glucosa en sangre sin ayuno> 16,7 mM) en dos días consecutivos, están listos para el trasplante de islotes.
- Transplante de islotes al sitio EFP.
- Anestesiar los ratones con pentobarbital administrado intraperitonealmente (50 mg / kg). Coloque el ratón en posición supina sobre una toalla de papel, con la cola apuntando hacia el operador. Afeitar el abdomen extensivamente para quitar la piel de alrededor del sitio de la incisión. Tape las cuatro extremidades y limpie la piel completamente con toallitas alternas de alcohol y yodóforo moviéndose de manera circular para esterilizar el sitio de la incisión. Cubra el ratón con un paño estéril, permitiendo sólo el acceso a la zona de la incisión. Haga una incisión de 7 mm a través de la pared peritonealLínea media, cerca de la zona genital.
NOTA: Todos los instrumentos utilizados durante la cirugía, incluidos los guantes, deben ser estériles. - Agarre suavemente y retire el EFP de la cavidad abdominal usando fórceps. Esparza el EFP sobre una gasa estéril húmeda. Coloque el andamio que contiene islotes en el EFP y dobla el EFP para envolver el trasplante. Asegurar el contacto directo entre los islotes y el EFP suturando el EFP con suturas absorbibles de 6-0. Humedezca la superficie del EFP con solución salina estéril usando un hisopo de algodón empapado para evitar que el EFP se seque.
- Coloque suavemente el EFP en la cavidad abdominal. Cierre la incisión suturando la pared peritoneal y sujetando la capa dérmica con clips de herida.
- Inyectar buprenorfina (0.1 mg / kg) por vía subcutánea como analgésico.
- Inyectar 1 mL de solución salina por vía subcutánea para prevenir la deshidratación.
- Coloque el ratón en una jaula en una almohadilla de calefacción hasta que el ratón se recupera de la anestesia.
- Compruebe la glucosa sin ayunoDos días después recogiendo sangre de la vena de la cola. Si recupera el injerto, repita los procedimientos de trasplante anteriores, retire suavemente la EFP, use sutura 3-0 para ligar el extremo de la almohadilla de grasa adyacente al epidídimo, obstruya los vasos sanguíneos, explante el injerto de EFP y consérvelo para histología .
NOTA: Explantar los islotes debe volver a rendir a los ratones receptores hiperglucémicos de nuevo dentro de 3 días, confirmando la función del injerto.
- Anestesiar los ratones con pentobarbital administrado intraperitonealmente (50 mg / kg). Coloque el ratón en posición supina sobre una toalla de papel, con la cola apuntando hacia el operador. Afeitar el abdomen extensivamente para quitar la piel de alrededor del sitio de la incisión. Tape las cuatro extremidades y limpie la piel completamente con toallitas alternas de alcohol y yodóforo moviéndose de manera circular para esterilizar el sitio de la incisión. Cubra el ratón con un paño estéril, permitiendo sólo el acceso a la zona de la incisión. Haga una incisión de 7 mm a través de la pared peritonealLínea media, cerca de la zona genital.
Resultados
Nuestro método de sujeción, realizado con una pinza hemostática microscópica, es sencillo y ahorra tiempo en comparación con la técnica de ligadura de sutura. Se tomó aproximadamente 4 h para aislar y purificar alrededor de 1.200 islotes de 6 ratones. Los islotes recién aislados tenían típicamente una periferia rugosa bajo un microscopio óptico ( Figura 3A ). Una vez que los islotes se recuperaron del proceso de aislamiento, parecían brillantes y apretados y adquirieron una superficie lisa. Sin embargo, el aislamiento estresante podría inducir la muerte celular, resultando en el desprendimiento de células de las superficies de los islotes, y los islotes malsanos a menudo contenían un núcleo necrótico oscuro ( Figura 3B ). Medimos los diámetros de 945 islotes de 5 ratones; El diámetro medio calculado de los islotes fue 130,42 ± 41,75 μm ( Figura 3C ).
Para evitar el receptor inmune Rechazo, se realizó transplante singénico en ratones C57BL / 6J. Típicamente, se transfirieron 500 DCS cargadas de islotes al sitio de la EFP e invertieron la hiperglucemia en 10 días, en comparación con los 30 días observados en el grupo de islotes libres. La normoglucemia se mantuvo durante unos 100 días, hasta la recuperación de los injertos ( Figura 3D ). Los islotes cargados se distribuyeron uniformemente en DCS y cubiertos por EFP. El DCS cargado de islotes también podría ser manejado fácilmente usando fórceps ( Figura 3E y 3F ). El estudio histológico mostró que los islotes distribuidos uniformemente fueron revascularizados y rodeados por el tejido EFP y el DCS después del trasplante durante 60 días ( Figura 3G ). La inmunotinción de insulina confirmó además el injerto exitoso de los islotes ( Figura 3H ).
Xfigimg "src =" / files / ftp_upload / 54995 / 54995fig3.jpg "/>
Figura 3: Transplante de islotes soportados por scaffold al sitio EFP. ( A ) Imagen representativa de los islotes frescos aislados de ratones. ( B ) Islotes cultivados durante 12 h, con células muertas desprendiéndose de la superficie del islote. Inseto: los islotes malsanos tienen un núcleo oscuro y necrótico. ( C ) Distribución del tamaño de 945 islotes de 5 ratones. ( D ) Nivel de glucosa en sangre sin ayuno de los ratones diabéticos trasplantados con islotes soportados por DCS e islotes libres. La flecha negra indica que el injerto se recuperó en este momento. ( E ) Fotografía que muestra la transferencia del andamio cargado de islotes sobre la superficie de un tejido EFP de propagación. ( F ) Imagen de contraste de fase representativa del DCS cargado de islotes. Inserción: imagen óptica del DCS, sostenida por fórceps. ( G ) Imagen histológica H & E representativa de laTransplantados, rodeados por DCS y EFP, después de 60 días. ( H ) Inmunotinción de los islotes soportados por DCS, explantados después de 60 días. Barras de escala = 150 μm (A, B), 100 μm (F), 500 μm (G) y 25 μm (H). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La perfusión del páncreas y el tiempo de digestión son dos parámetros clave que afectan el rendimiento y la calidad de los islotes. Moskalewski informó por primera vez el uso de una mezcla de colagenasa cruda para digerir el páncreas de conejillo de indias picada [ 11] . Lacy et al. Informó la inyección de enzimas en el sistema de conductos para perfundir el páncreas, lo que aumentó considerablemente el rendimiento de islotes [ 12] . La perfusión ductal de la enzima permite la exposición máxima de la superficie pancreática a la enzima, resultando en una digestión más homogénea y una mayor liberación de los islotes intactos en comparación con la digestión de páncreas picada [ 13] . En nuestra experiencia, la canulación exitosa del conducto biliar y la perfusión del páncreas entero fueron prerrequisitos para rendimientos altos de islotes. Esto se debe a que la cola pancreática (lóbulo esplénico) en realidad contiene la mayoría de los islotes en comparación con el tejido pancreático cerca del duodeno. Hay dos formas de canular El conducto biliar que se informa en la literatura: i) insertar la aguja cerca del sitio del hígado mientras se bloquea la entrada de la enzima en el duodeno 13 , 14 e ii) insertar la aguja cerca del duodeno mientras se bloquea la entrada de la enzima en el Hígado 15 . Aquí, hemos adoptado la última técnica, que no requiere doblar la aguja o reposicionar el ratón. Un investigador bien entrenado puede realizar la canulación de 10 ratones en 40 minutos al seguir nuestro protocolo. El tiempo de digestión para el páncreas varía con la edad y la especie de los ratones. El páncreas sobre-digerido produce pequeños islotes y el páncreas bajo digestión tiene células acinares unidas a los islotes. Por lo tanto, es importante optimizar el tiempo de digestión para obtener altos rendimientos de islotes saludables.
STZ es un compuesto antibiótico que específicamente destruye las células beta e induce la diabetes en los ratones dentro de 3 díasSs = "xref"> 16. La dosificación varía con la cepa específica del ratón y la edad y debe determinarse mediante pre-experimentos. Hasta donde sabemos, los ratones C57BL / 6J requieren una dosis más baja de STZ que los ratones Balb / C. Una sobredosis de STZ causaría hiperglucemia severa y conduciría a la muerte de los animales dentro de una semana, mientras que una dosis inadecuada de STZ disminuye la tasa de incidencia de diabetes.
EFPs son tejidos altamente vascularizados y convenientemente accesibles a la cirugía a través de procedimientos mínimamente invasivos. El trasplante de islotes a EFP es generalmente más fácil y seguro comparado con la cápsula renal, otro sitio comúnmente reportado para el trasplante de islotes en modelos de ratón. En particular, el riñón es un órgano esencial y es delicado de manejar; El trasplante de islotes puede fallar o los animales no pueden sobrevivir a la cirugía 4 . Los EFPs en ratones son también similares a la bolsa de omental en humanos. El estudio de trasplantes en EFP no sóloLa comprensión de los prerrequisitos tejido ambiente para la supervivencia de los islotes / función, sino también sentar las bases para el desarrollo de los procedimientos clínicos de trasplante [ 17] .
El DCS utilizado en este estudio se derivó de pericardio bovino y se hizo principalmente de colágeno. Los materiales descelularizados pueden no mostrar inmunogenicidad y sólo pueden inducir respuestas inflamatorias suaves in vivo 18 . Cuando los islotes se sembraron dentro de los poros del DCS, el andamio ofrecía protección mecánica y evitaba que los islotes se agruparan, lo que podría conducir a la necrosis de los islotes. El andamio DCS que contenía los islotes podría manejarse directamente con fórceps, lo que permitiría la fácil transferencia del trasplante. La incrustación de los andamios dentro de la EFP también redujo la fuga de islotes en el peritoneo, a diferencia de los islotes libres trasplantados sin un andamio [ 8] . Por lo tanto, el DCS ofreceT para el trasplante de islotes.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Wei Zhang de Guanhao Biotech por proporcionar los andamios decelularizados. Damos las gracias a Xiao-hong Peng por las discusiones útiles. Esta investigación fue apoyada financieramente por la Fundación Nacional de Ciencias Naturales de China (Proyecto No.31322021).
Materiales
| Name | Company | Catalog Number | Comments |
| Dissecting scissor | Ningbo Medical | ||
| Forceps | Ningbo Medical | ||
| 0.5 mm diameter wire mesh | Ningbo Medical | ||
| 70 μm cell strainer | Falcon | 352350 | |
| Artery hemostatic clamp | Ningbo Medical | ||
| Microscopic hemostatic clamp | Ningbo Medical | ||
| Hemostatic forceps | Ningbo Medical | ||
| Absorbable 6-0 PGLA sutures | JINHUAN | With needle | |
| Wound clip | Ningbo Medical | ||
| Cotton swab | Ningbo Medical | ||
| Gauze | Ningbo Medical | ||
| Sterile drapes | Ningbo Medical | ||
| 10mL syringe | JINGHUAN | ||
| 1 mL syringe | JINGHUAN | ||
| 27G intravenous needle | JINGHUAN | 0.45x15 RWSB | |
| 1.5 mL Eppendorf tube | Axygen | ||
| 15mL conical tube | Corning | 430791 | |
| 50mL conical tube | Corning | 430829 | |
| 35mm Non-treated Peri-dishes | Corning | 430588 | |
| Transwell | Corning | 3422 | |
| 0.22 μm filter | Pall | PN4612 | |
| 10 mL serological pipet | Corning | 4488 | |
| Pipet filler S1 | Thermo Scientific | 9501 | |
| Pipette (2-20μL) | Axygen | AP-20 | AXYPETTM |
| Dissecting microscope | Olympus | SZ61 | |
| Centrifuge | Eppendorf | 5810R | |
| Hank’s balanced salt solution | Gibco | C14175500CP | |
| Collagenase P | Roche | COLLP-RO | |
| Histopaque 1077 | Sigma | 10771 | |
| RPMI 1640 | Gibco | 11879-20 | |
| FBS | Gibco | 16000-044 | |
| D-glucose | Gibco | A24940-01 | |
| Glucose meter | Roche | ACCU-CHEK | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Streptozotocin | Sigma | V900890 | VetecTM |
| Chloral hydrate | J&K | C0073 | |
| Sodium citrate | Sigma | 71497 | |
| Citric acid | Sigma | C2404 | |
| Iodophors | Ningbo Medical | ||
| C57BL/6J, 10-12 weeks old | VitalRiver | Beijing, China | |
| Decellularized scaffold | Guanhao Biotec | 131102 | Guangzhou, China |
Referencias
- Shapiro, A. M., et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 343, 230-238 (2000).
- Shapiro, A. M. J., et al. International Trial of the Edmonton Protocol for Islet Transplantation. N Engl J Med. 355, 1318-1330 (2006).
- Ryan, E. A., et al. Five-year follow-up after clinical islet transplantation. Diabetes. 54, 2060-2069 (2005).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95, 1449-1461 (2008).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotechnol. 35 (1), (2017).
- Dufour, J. M., et al. Development of an ectopic site for islet transplantation, using biodegradable scaffolds. Tissue Eng. 11, 1323-1331 (2005).
- Weaver, J. D., et al. Controlled Release of Dexamethasone from Organosilicone Constructs for Local Modulation of Inflammation in Islet Transplantation. Tissue Eng Part A. 21, 2250-2261 (2015).
- Wang, K., et al. From Micro to Macro: The Hierarchical Design in a Micropatterned Scaffold for Cell Assembling and Transplantation. Adv Mater. 29, (2017).
- Blomeier, H., et al. Polymer Scaffolds as Synthetic Microenvironments for Extrahepatic Islet Transplantation. Transplantation. 82, 452-459 (2006).
- Gibly, R. F., et al. Extrahepatic islet transplantation with microporous polymer scaffolds in syngeneic mouse and allogeneic porcine models. Biomaterials. 32, 9677-9684 (2011).
- Moskalewski, S. Isolation and Culture of the Islets of Langerhans of the Guinea Pig. Gen Comp Endocrinol. 5, 342-353 (1965).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16, 35-39 (1967).
- Zmuda, E. J., Powell, C. A., Hai, T. A Method for Murine Islet Isolation and Subcapsular Kidney Transplantation. J Vis Exp. (50), (2011).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4, 1649-1652 (2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse Islet of Langerhans Isolation using a Combination of Purified Collagenase and Neutral Protease. J Vis Exp. (67), (2012).
- Sakata, N., Yoshimatsu, G., Tsuchiya, H., Egawa, S., Unno, M. Animal models of diabetes mellitus for islet transplantation. Exp Diabetes Res. , 256707(2012).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotech. 35, 8-8 (2017).
- Londono, R., Badylak, S. F. Biologic scaffolds for regenerative medicine: mechanisms of in vivo remodeling. Ann Biomed Eng. 43, 577-592 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados