Method Article
Transplante de islotes apoiado em andaimes na almofada de gordura epidídmica de ratos diabéticos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo demonstra isolamento de manchas murinas e semeadura em um andaime decelularizado. As ilhotas suportadas em andaimes foram transplantadas para a almofada de gordura epididimática de ratos diabéticos induzidos por estreptozotocina (STZ). As ilhotas sobreviveram no local do transplante e revertearam a condição hiperglicêmica.
Resumo
O transplante de ilhotas foi clinicamente comprovado para ser eficaz no tratamento da diabetes tipo 1. No entanto, a atual estratégia de transplante intra-hepático pode sofrer reações agudas de sangue total e resultar em enxerto de isleta pobre. Aqui, relatamos um protocolo robusto para o transplante de ilhotas no local de transplante extra-hepático - a almofada de gordura epidídima (EFP) - em um modelo de mouse diabético. É descrito um protocolo para isolar e purificar ilhotas com rendimentos elevados de ratinhos C57BL / 6J, bem como um método de transplante realizado pela criação de ilhéus em um andaime decelularizado (DCS) e implantá-los no local de EFP em camundongos C57BL / 6J singênicos rendidos diabéticos Por estreptozotocina. O enxerto DCS contendo 500 ilhotas reverteu a condição hiperglicêmica dentro de 10 dias, enquanto as ilhotas livres sem DCS exigiam pelo menos 30 dias. A normoglicemia foi mantida por até 3 meses até o enxerto foi explantado. Em conclusão, a DCS aumentou o enxerto de ilhotas em tO site extra-hepático do EFP, que poderia ser facilmente recuperado e poderia fornecer uma plataforma reprodutível e útil para investigar os materiais de andaime, bem como outros parâmetros de transplante necessários para um enxerto de ilhotas bem sucedido.
Introdução
O diabetes mellitus tipo 1 (T1D) é uma doença endócrina autoimune em que as células de ilhotas são abladas pelo sistema imunológico, tornando os pacientes dependentes da injeção de insulina exógena durante toda a vida. O protocolo de Edmonton representa um marco nos estudos clínicos do transplante de ilhotas; As ilhotas foram infundidas através da veia porta e transplantadas no local intra-hepático 1 . No entanto, dois principais obstáculos - fontes inadequadas de ilhotas de doadores e enxertos de ilhotas pobres - evitam o grande sucesso do transplante de ilhotas 2 . Normalmente, as ilhotas precisam ser coletadas de três doadores cadavéricos para reverter a condição hiperglicêmica de um paciente; Isto é devido ao baixo rendimento dos procedimentos de isolamento de ilhotas e à perda de ilhota após o transplante. Em particular, embora as ilhotas pós-transplante fossem banhadas em sangue rico em oxigênio, o contato direto com o sangue geralmente evocava a inflamação instantânea mediada pelo sangueTory reaction (IBMIR), o que poderia causar a perda aguda das ilhotas. A longo prazo, pensa-se que a perda gradual de ilhotas em pacientes representou a queda das taxas de reversão do diabetes nos grupos clínicos, que poderiam atingir 90% no primeiro ano e diminuíram para 30% e 10% em 2 e 5 Anos pós-transplante, respectivamente 3 .
O transplante de ilhotas em locais extra-hepáticos tem sido uma estratégia atractiva para reduzir o contato direto de ilhotas com sangue enquanto confinam os transplantes para locais mais definíveis em comparação com a infusão intra-hepática. Estudos foram realizados nas cápsulas de rim, olho, músculo, gordura e espaços subcutâneos nos últimos anos, mostrando que os islotes nesses locais são capazes de sobreviver e funcionar para restaurar normoglicemia 4 . Além disso, as ilhéus desses sites são recuperáveis, possibilitando biópsia ou mesmo para outros procedimentos de substituição. Sonda extrahepáticaPor isso, demonstra grande potencial de transplante clínico 5 .
Os andaimes baseados em biomateriais têm sido intensamente investigados para transplante de células e engenharia de tecidos. Os andaimes tridimensionais (3D) geralmente contêm estruturas porosas e podem servir como modelos celulares para gerar estrutura espacial / organização de células ou como reservatórios para fornecer a liberação controlada de pistas bioativas. Os andaimes também foram fabricados a partir de materiais poliméricos, tais como poli (glicolido-L-lactido) 6 , poli (dimetilsiloxano) 7 e poli (uretano) termoplástico 8 , para transplantar ilhotas no EFP. Em comparação com o transplante direto de ilhotas, verificou-se que o uso de andaimes reduziu a perda de ilhotas evitando o vazamento de ilhotas na cavidade intraperitoneal 9 , 10 , proporcionando proteção e modificação mecânicaProvocando a reação inflamatória local. Os andaimes assim podem ser desenvolvidos para promover o enxerto de ilhotas nos locais de transplante 7 .
Neste estudo, pretendemos demonstrar um paradigma de transplante de ilhotas no EFP, realizado em modelos de camundongos usando um DCS. Os andaimes derivados de matrizes extracelulares atraíram um grande interesse nos últimos anos devido à biocompatibilidade superior e estruturas porosas mais naturais em comparação com os produtos sintéticos. Aqui, descrevemos um protocolo de isolamento robusto para obter ilhotas pancreáticas com altos rendimentos de ratos C57BL / 6J. Os DCS processados a partir do pericárdio bovino foram então semeados com ilhotas e os enxertos foram transplantados para o EFP em modelos diabéticos singenéticos. A normoglicemia em camundongos foi alcançada dentro de 10 dias e foi mantida por até 100 dias, até a remoção dos enxertos.
Protocolo
Todos os experimentos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Pequim (IACUC, IACUC nº COE-LuoY-1).
1. Isau Isolamento
- Preparação de reagentes e equipamentos.
- Reconstitua o pó de colagenase P (2 U / mg) no HBSS para fazer uma solução de 5 mg / mL e filtre-o através de um filtro de 0,22 μm para remover as bactérias. Preparar soluções alíquotas de 0,6 ml de colagenase P em tubos cônicos de 15 mL e armazenar a -20 ° C.
NOTA: Durante o uso, cada alíquota é diluída com HBSS para dar soluções de trabalho de 6 mL com concentrações finais de 0,5 mg / mL, ou 1 U / mL (o suficiente para tratar 3 camundongos). A solução de trabalho é mantida em gelo para uso imediato dentro de 1 h. A solução de trabalho não deve ser restaurada ou re-congelada para uso adicional. - Prepare a solução de neutralização adicionando FBS (2,5%) e P / S (1%) no HBSS; Mantenha a solução no gelo. Prepare 60 mL de solução de neutralização para treaT 6 camundongos.
- Para o meio de cultura de ilhotas, adicione D-glucose (7 mM), FBS (10%) e P / S (1%) ao meio RPMI 1640.
- Autoclave os instrumentos cirúrgicos a 115 ° C durante 30 min e 15 psi de pressão.
- Reconstitua o pó de colagenase P (2 U / mg) no HBSS para fazer uma solução de 5 mg / mL e filtre-o através de um filtro de 0,22 μm para remover as bactérias. Preparar soluções alíquotas de 0,6 ml de colagenase P em tubos cônicos de 15 mL e armazenar a -20 ° C.
- Inflação do pâncreas.
- Prepare 12 mL de solução de trabalho com colagenase, conforme especificado no passo 1.1.1, para 6 camundongos (12 semanas de idade). Encha a seringa de 10 mL com 9 mL de solução de trabalho e conecte a seringa à agulha intravenosa de 27 G. Armazene a seringa no gelo e use a solução dentro de 1 h.
- Eutanizar o mouse pela luxação cervical. Coloque o mouse na posição supina sobre uma toalha de papel, com a cauda apontada para o operador. Pulverize todo o corpo com 70% de etanol, tornando-o completamente molhado.
- Faça uma incisão em V, a partir da área genital e se estendendo até o diafragma, usando tesoura de dissecação e fórceps. Dobre a pele no peito para revelar completamente a cavidade abdominal.
- MoverO intestino do lado direito do mouse e expõe o pâncreas e o ducto biliar comum. Pegue cuidadosamente o duodeno com fórceps e puxe-o até o ducto biliar ficar tenso ( Figura 1A- 1 e A-2 ).
- Encontre a veia porta e o ducto biliar que conduzem ao fígado. Aperte a veia porta e o ducto biliar com um grampo hemostático microscópico.
NOTA: O aperto evita o sangramento excessivo e a entrada da colagenase no fígado. - Enquanto ainda segura o intestino com a pinça, encontre a localização da ampola que conecta o ducto biliar e o duodeno. Insira a agulha intravenosa 27G no ducto biliar comum através da ampola ( Figura 1B -1 e B-2 ).
- Dispense cerca de 200 μL de solução de trabalho de colagenase para verificar se a canulação está completamente através do ducto biliar. Se a solução de colagenase começar a encher o duto ( Figura 1C- 1 e C2 ), a agulha está no lúmen do duto; Prender o segmento de duto contendo a agulha usando uma braçadeira hemostática e distribuir o restante dos 2 mL de solução a uma velocidade lenta e constante em 1 min ( Figura 2A -1 , A-2 e B-1 ).
NOTA: Se o tecido que envolve o ducto começa a inflar ( Figura 2B -2 ), a agulha penetrou através da parede do ducto biliar, tornando necessário reposicionar a agulha e tentar canular novamente o ducto biliar. Da mesma forma, se o duodeno começar a inflar ( Figura 2C- 1 e C-2 ), o grampo hemostático da artéria precisa ser ajustado e o ducto biliar re-canulado. À medida que a solução de colagenase enche o pâncreas, o tecido perto do duodeno infla primeiro, seguido pelo regioPerto da cauda pancreática. A perfusão da cauda pancreática (o lobo esplênico) é importante para maximizar o rendimento das ilhotas. - Após a inflação completa do pâncreas ( Figura 2C -1 ), empurre o intestino para o lado esquerdo do mouse e remova o pâncreas começando no cólon descendente. Use a pinça para levantar o intestino e separá-lo do pâncreas com outro par de fórceps. Continue a remover o pâncreas até que esteja desapegado do topo do estômago. Finalmente, retire o pâncreas do abdômen e baixe-o do bazo remanescente.
NOTA: A separação completa deve ser realizada rapidamente, à medida que a digestão continua durante o processo de remoção. - Coloque o pâncreas em um tubo cônico vazio de 15 mL e deixe-o sobre gelo. Repita o procedimento acima para os ratos restantes. Todo o pâncreas deve ser processado posteriormente dentro de 1 h imediatamente após o passo 1.3 para evitar a sobre-digestão por colagenase P.

Figura 1: Fotografias que mostram a canulação do ducto biliar e a perfusão do pâncreas com soluções de colagenase. ( A1 ) Puxar o duodeno até o ducto biliar ficar tenso. (Ampulla: a área triangular e leitosa na superfície do duodeno, o ducto biliar: a estrutura leitosa na estrutura da leite). ( B1 ) Inserindo a agulha no canal biliar da ampola. ( C1 ) Inflando o pâncreas com a injeção de enzima. ( A2, B2 e C2 ) Imagens de desenhos animados dos procedimentos mostrados em A1, B1 e C1, respectivamente. Clique aqui para ver uma versão maior desta figura.
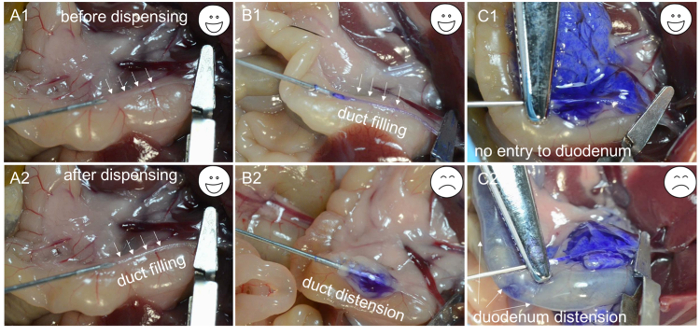
Figura 2: Solução de problemas para a canulação. ( A1 ) A ponta da agulha inserida no lúmen da via biliar. ( A2 ) O duto cheio com soluções enzimáticas. ( B1 ) A agulha inserida no lúmen do ducto biliar e o duto cheio com um tinte azul. ( B2 ) Devido a canulação inadequada, a agulha está abaixo do ducto biliar, e apenas uma cápsula inflada é observada após a distribuição do corante azul. ( C1 ) Uma canulação bem sucedida é evidenciada pela distensão do pâncreas. ( C2 ) Devido ao aperto impróprio, o corante azul entra no duodeno e causa distensão. Clique aqui para ver uma versão maior desta figura.
- Digestão e purificação de ilhotas.
- Incubar os tubos cônicos contendo o pâncreas perfusado a 37 ° C durante 17 min.
NOTA: O tempo de incubação pode variar com a idade e as espécies do animal. - Termine a digestão adicionando 7 mL de solução de neutralização e colocando os tubos no gelo.
- Dissocie o tecido agitando vigorosamente os tubos ( por exemplo, 20 vezes em 10 s) até obter partículas finas de tecido.
NOTA: O rendimento das ilhotas será baixo se o pâncreas falhar em dissociar completamente. - Filtre as amostras de tecido digeridas através de uma malha de arame de 0,5 mm para remover quaisquer pedaços de tecido não digeridos. Recolher as suspensões de ilhéus em um novo tubo cônico de 50 mL.
- Centrifugue os tubos por 3 min a 230 xg e 4 ° C e despeje cuidadosamente o sobrenadante, sem perturbar as bolinhas de tecido.
- Ressuspender os grânulos de 3 camundongos em 4 mL de gradiente de densidade de polissucrose agitando vortexamente ou pEvitando a suspensão para cima e para baixo algumas vezes. Puxe lentamente 4 mL de HBSS para baixo do lado do tubo até o topo das soluções de polissucrose.
NOTA: as duas soluções devem ser camadas bem separadas com uma interface afiada.
NOTA: A adição de HBSS deve ser realizada com cuidado, sem perturbar o gradiente de densidade de polissucrose na parte inferior. - Centrifugue a suspensão por 20 min a 900 xg e 4 ° C selecionando uma taxa de aceleração muito lenta. Termine a centrifugação sem freio.
NOTA: Este é um passo para purificar as ilhotas das células exócrinas, com a maioria das ilhotas migrando para a interface entre as camadas de polissonfa e HBSS e a maioria das células exócrinas se estabelecendo na parte inferior. - Remova a totalidade das soluções de sobrenadante de 8 mL usando uma pipeta de 15 mL de grande diâmetro. Passe as soluções através de um filtro inverso de 70 μm.
NOTA: As ilhotas serão mais purificadas e retidas pelo filtro, enquanto as células exócrinasPassará pelo filtro.
Cuidado: o gradiente de densidade do polysucorse é tóxico para células; A filtração ajudará as ilhotas a se livrar da polissonfa. - Pipetar 2 mL de solução de neutralização a frio em uma placa de Petri de 35 mm. Inverta o filtro da célula para o lado direito, mergulhe a superfície mantendo as ilhotas na solução e agite suavemente para liberar as ilhotas.
- Escolha manualmente as ilhotas ao microscópio usando uma pipeta de 20 μL com uma ponta branca.
NOTA: As ilhotas são agregados de células amareladas e compactas ( Figura 3A ), enquanto o tecido ou células exocrinas contaminantes possuem uma estrutura negruzca e solta sob o microscópio de dissecação. - Coloque cerca de 200 ilhéus em uma placa de 35 mm com 2 mL de meio de cultura e incuba a 37 ° C numa incubadora fornecida com 5% de CO 2 durante 12 h.
NOTA: Normalmente, 150-300 islets podem ser colhidos a partir de um mouse C57BL / 6J de 12 semanas de idade. As ilhotas são propensas a formar agregados durante a cultura,E os grandes ilhéus (> 300 μm) são suscetíveis à necrose central ( Figura 1B , inserção). Agite bem a suspensão para distribuir uniformemente as ilhotas no prato e para reduzir o aglomerado.
- Incubar os tubos cônicos contendo o pâncreas perfusado a 37 ° C durante 17 min.
2. Cultura do Islão no Andaime
NOTA: DCS tem uma porosidade de cerca de 79%, uma espessura de cerca de 0,6 mm e um tamanho de poro variando de 12 a 300 μm.
- Corte os andaimes em discos de 7 mm, mergulhe-os em etanol a 70% e lave-os com HBSS. Coloque os andaimes nas inserções de cultura de tecidos de 24 poços.
NOTA: Quando as ilhotas frescas são recuperadas após a cultura durante a noite, as ilhotas aparecem brilhantes e apertadas, com bordas lisas ( Figura 3B ). - Remova o prato e colete as ilhotas do centro do prato usando uma pipeta de 20 μL com uma ponta branca. Transfira as ilhotas para os andaimes (250 islotes / andaime) usando uma pipeta e adicione 2 mL de meio de cultura parao poço. Cultive as ilhotas por 12 h antes do transplante.
3. Transplante de ilhotas no site EFP
- Indução de diabetes em camundongos receptores.
- Coloque ratos C57BL / 6J (com mais de 10 semanas de idade) em uma gaiola fresca com um suprimento de água, mas sem alimentos. Rápido os ratos por 10 h antes da indução de diabetes.
- Prepare soluções tampão com valores de pH de 4,2-4,5 misturando ácido cítrico 0,1 M com citrato de sódio 0,1 M. Dissolver STZ (10 mg / mL) no tampão recém-preparado e esterilizar a solução passando através de um filtro de 0,22 μm.
NOTA: STZ é sensível à luz e perde atividade dentro de 10 min; Sempre prepare a solução STZ fresca antes da injeção. - Injecte cada rato por via intraperitoneal com STZ numa dose de 140-150 mg / kg para cada rato C57BL / 6J.
NOTA: A dose varia dependendo da idade e das espécies do animal. Recomenda-se a realização de um otimização da dose em pequena escalaSt para as espécies especificadas antes de iniciar o experimento formal. - Recolher o sangue da veia da cauda e monitorar a glicemia com um medidor de glicose nos dias 2, 3 e 4 pós-STZ.
NOTA: Quando os animais são hiperglicêmicos (glicemia não jejum> 16,7 mM) em dois dias consecutivos, eles estão prontos para o transplante de ilhotas.
- Transplante de ilhotas para o site EFP.
- Anestesiar os ratos com pentobarbital administrado intraperitonealmente (50 mg / kg). Coloque o mouse na posição supina sobre uma toalha de papel, com a cauda apontada para o operador. Raspe o abdômen extensivamente para remover a pele de todo o local da incisão. Tape os quatro membros e esfregue a pele completamente com álcool alternativo e toalhetes iodóforos movidos de forma circular para esterilizar o local da incisão. Drapele o mouse com uma cobertura esterilizada, permitindo apenas o acesso à área de incisão. Faça uma incisão de 7 mm através da parede peritoneal noLinha média, perto da área genital.
NOTA: Todos os instrumentos utilizados durante a cirurgia, incluindo luvas, devem ser estéreis. - Pegue delicadamente e remova o EFP da cavidade abdominal usando fórceps. Espalhe o EFP na gaze estéril molhada. Coloque o andaime contendo ilhéus no EFP e dobre o EFP para enrolar o transplante. Proteja o contato direto entre as ilhotas e EFP suturando o EFP com suturas absorventes de 6-0. Molhe a superfície do EFP com solução salina estéril usando um cotonete embebido para evitar que o EFP seque.
- Coloque suavemente o EFP na cavidade abdominal. Feche a incisão suturando a parede peritoneal e apertando a camada dérmica com os clipes de ferida.
- Injetar buprenorfina (0,1 mg / kg) subcutaneamente como analgésico.
- Injecte 1 mL de solução salina subcutânea para prevenir a desidratação.
- Coloque o mouse em uma gaiola em uma almofada de aquecimento até que o mouse se recupere da anestesia.
- Verifique o leito de glicose não em jejumDois dias depois, coletando sangue da veia da cauda. Se recuperando o enxerto, repita os procedimentos de transplante acima, retire suavemente o EFP, use a sutura 3-0 para ligar o fim da almofada de gordura adjacente ao epidídimo, obstrua os vasos sanguíneos, explante o enxerto EFP e conserve-o para a histologia .
NOTA: A explicação das ilhéus deve tornar os ratos receptores hiperglicêmicos novamente dentro de 3 dias, confirmando a função do enxerto.
- Anestesiar os ratos com pentobarbital administrado intraperitonealmente (50 mg / kg). Coloque o mouse na posição supina sobre uma toalha de papel, com a cauda apontada para o operador. Raspe o abdômen extensivamente para remover a pele de todo o local da incisão. Tape os quatro membros e esfregue a pele completamente com álcool alternativo e toalhetes iodóforos movidos de forma circular para esterilizar o local da incisão. Drapele o mouse com uma cobertura esterilizada, permitindo apenas o acesso à área de incisão. Faça uma incisão de 7 mm através da parede peritoneal noLinha média, perto da área genital.
Resultados
Nosso método de aperto, realizado usando grampo hemostático microscópico, é direto e economiza tempo em comparação com a técnica de ligadura de sutura. Levaram cerca de 4 h para isolar e purificar cerca de 1.200 ilhotas de 6 camundongos. As ilhotas recentemente isoladas tipicamente tinham uma periferia áspera sob um microscópio óptico ( Figura 3A ). Uma vez que as ilhotas se recuperaram do processo de isolamento, elas pareciam brilhantes e apertadas e adquiriram uma superfície lisa. No entanto, o isolamento estressante ainda poderia induzir a morte celular, resultando no desprendimento de células das superfícies das ilhotas, e as ilhotas não saudáveis frequentemente continham um núcleo necrótico escuro ( Figura 3B ). Medimos os diâmetros de 945 ilhotas de 5 camundongos; O diâmetro médio calculado da ilhotada foi de 130,42 ± 41,75 μm ( Figura 3C ).
Para evitar o imunológico do destinatário Rejeição, realizamos transplante singênico em camundongos C57BL / 6J. Tipicamente, 500 DCS carregados de islotes foram transplantados para o local do EFP e reverteu a hiperglicemia dentro de 10 dias, em comparação com os 30 dias observados no grupo islote livre. A normoglicemia foi mantida por cerca de 100 dias, até a recuperação dos enxertos ( Figura 3D ). As ilhotas carregadas foram uniformemente espalhadas no DCS e cobertas pela EFP. O DCS carregado com islotes também pode ser facilmente manipulado usando fórceps ( Figura 3E e 3F ). O estudo histológico mostrou que as ilhotas uniformemente distribuídas foram revascularizadas e cercadas pelo tecido EFP e DCS após transplante durante 60 dias ( Figura 3G ). A imunocoloração da insulina confirmou ainda o enxerto bem sucedido das ilhotas ( Figura 3H ).
Xfigimg "src =" / files / ftp_upload / 54995 / 54995fig3.jpg "/>
Figura 3: Transplante de islotes suportados por andaimes para o site EFP. ( A ) Imagem representativa de ilhotas frescas isoladas de camundongos. ( B ) Ilhotas cultivadas durante 12 h, com células mortas desprendendo a superfície da ilhota. Inseto: ilhotas insalubres têm um núcleo escuro e necrótico. ( C ) Distribuição de tamanho de 945 ilhotas de 5 camundongos. ( D ) Nível de glicose no sangue em jejum dos camundongos diabéticos transplantados com ilhotas suportadas por DCS e ilhotas livres. A seta preta indica que o enxerto foi recuperado neste momento. ( E ) Fotografia mostrando a transferência de andaimes de carga de ilhotas para a superfície de um tecido EFP espalhado. ( F ) Imagem de contraste de fase representativa do DCS com carga de ilhéus. Inserção: imagem óptica do DCS, realizada pela pinça. ( G ) Imagem H & E histológica representativa daIlhotas transplantadas, cercadas por DCS e EFP, após 60 dias. ( H ) Imunomarcação das ilhotas suportadas por DCS, explantadas após 60 dias. Barras de escala = 150 μm (A, B), 100 μm (F), 500 μm (G) e 25 μm (H). Clique aqui para ver uma versão maior desta figura.
Discussão
A perfusão e o tempo de digestão do pâncreas são dois parâmetros fundamentais que afetam o rendimento e a qualidade das ilhotas. Moskalewski relatou pela primeira vez o uso de uma mistura de colagenase em bruto para digerir pâncreas de cobaias picadas 11 . Lacy et al. Relatou a injeção de enzimas no sistema de duto para perfundir o pâncreas, o que aumentou muito o rendimento de ilhotas 12 . A perfusão ductal da enzima permite a exposição máxima da área de superfície pancreática à enzima, resultando em uma digestão mais homogênea e maior liberação de ilhotas intactas em comparação com a digestão do pâncreas picada 13 . Na nossa experiência, a canulação bem-sucedida do ducto biliar e a perfusão do pâncreas inteiro foram pré-requisitos para os rendimentos de ilhotas altas. Isso ocorre porque a cauda pancreática (lóbulo esplênico) realmente contém a maioria das ilhotas em comparação com o tecido pancreático próximo ao duodeno. Existem duas maneiras de canular O ducto biliar que é relatado na literatura: i) inserção da agulha próxima ao local do fígado, bloqueando a entrada de enzima no duodeno 13 , 14 e ii) inserção da agulha próxima ao duodeno, bloqueando a entrada de enzima na Fígado 15 . Aqui, adotamos a última técnica, que não requer dobrar a agulha ou reposicionar o mouse. Um pesquisador bem treinado pode realizar a canulação de 10 camundongos dentro de 40 min ao seguir nosso protocolo. O tempo de digestão para o pâncreas varia com a idade e a espécie dos camundongos. O pâncreas com excesso de digestão produz pequenas ilhotas e pâncreas sub-digerido possuem células acinares ligadas às ilhotas. Portanto, é importante otimizar o tempo de digestão para obter altos rendimentos de ilhotas saudáveis.
STZ é um composto antibiótico que destrói especificamente células beta e induz diabetes em camundongos dentro de 3 diasSs = "xref"> 16. A dosagem varia com a cepa e a idade específicas do mouse e deve ser determinada por pré-experimentos. A nosso conhecimento, os ratinhos C57BL / 6J requerem uma dose menor de STZ do que os ratinhos Balb / C. Uma sobredosagem de STZ causaria hiperglicemia grave e levaria à morte dos animais dentro de uma semana, enquanto uma dose inadequada de STZ diminui a taxa de incidência de diabetes.
EFPs são tecidos altamente vascularizados e convenientemente acessíveis à cirurgia através de procedimentos minimamente invasivos. O transplante de ilhotas para EFP é geralmente mais fácil e seguro em comparação com a cápsula renal, outro site comummente relatado para transplante de ilhotas em modelos de mouse. Em particular, o rim é um órgão essencial e é delicado de manejar; O transplante de ilhotas pode falhar ou os animais podem não sobreviver à cirurgia 4 . Os EFPs em camundongos também são semelhantes à bolsa omental em seres humanos. O estudo de transplante na EFP não só pode facilitar a nossaCompreensão do ambiente de tecido pré-requisito para a sobrevivência / função das ilhotas, mas também estabelecer as bases para o desenvolvimento de procedimentos de transplante clínico 17 .
O DCS utilizado neste estudo foi derivado do pericárdio bovino e foi principalmente feito de colágeno. Os materiais decelularizados podem não mostrar imunogenicidade e só podem induzir respostas inflamatórias suaves in vivo 18 . Quando as ilhotas foram semeadas nos poros do DCS, o andaime ofereceu proteção mecânica e impediu as ilhças de aglomerar, o que poderia levar à necrose das ilhotas. O andaime DCS contendo as ilhotas poderia ser tratado diretamente usando fórceps, permitindo a transferência fácil do transplante. Incorporar os andaimes dentro do EFP também reduziu o vazamento de ilhotas para o peritoneu, ao contrário das ilhotas livres transplantadas sem um andaime 8 . Portanto, o DCS fornece distintivoT vantagens para o transplante de ilhotas.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem a Wei Zhang da Guanhao Biotech por fornecer os andaimes decelularizados. Agradecemos a Xiao-hong Peng pelas discussões úteis. Esta pesquisa foi apoiada financeiramente pela Fundação Nacional de Ciências Naturais da China (Projeto No.31322021).
Materiais
| Name | Company | Catalog Number | Comments |
| Dissecting scissor | Ningbo Medical | ||
| Forceps | Ningbo Medical | ||
| 0.5 mm diameter wire mesh | Ningbo Medical | ||
| 70 μm cell strainer | Falcon | 352350 | |
| Artery hemostatic clamp | Ningbo Medical | ||
| Microscopic hemostatic clamp | Ningbo Medical | ||
| Hemostatic forceps | Ningbo Medical | ||
| Absorbable 6-0 PGLA sutures | JINHUAN | With needle | |
| Wound clip | Ningbo Medical | ||
| Cotton swab | Ningbo Medical | ||
| Gauze | Ningbo Medical | ||
| Sterile drapes | Ningbo Medical | ||
| 10mL syringe | JINGHUAN | ||
| 1 mL syringe | JINGHUAN | ||
| 27G intravenous needle | JINGHUAN | 0.45x15 RWSB | |
| 1.5 mL Eppendorf tube | Axygen | ||
| 15mL conical tube | Corning | 430791 | |
| 50mL conical tube | Corning | 430829 | |
| 35mm Non-treated Peri-dishes | Corning | 430588 | |
| Transwell | Corning | 3422 | |
| 0.22 μm filter | Pall | PN4612 | |
| 10 mL serological pipet | Corning | 4488 | |
| Pipet filler S1 | Thermo Scientific | 9501 | |
| Pipette (2-20μL) | Axygen | AP-20 | AXYPETTM |
| Dissecting microscope | Olympus | SZ61 | |
| Centrifuge | Eppendorf | 5810R | |
| Hank’s balanced salt solution | Gibco | C14175500CP | |
| Collagenase P | Roche | COLLP-RO | |
| Histopaque 1077 | Sigma | 10771 | |
| RPMI 1640 | Gibco | 11879-20 | |
| FBS | Gibco | 16000-044 | |
| D-glucose | Gibco | A24940-01 | |
| Glucose meter | Roche | ACCU-CHEK | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Streptozotocin | Sigma | V900890 | VetecTM |
| Chloral hydrate | J&K | C0073 | |
| Sodium citrate | Sigma | 71497 | |
| Citric acid | Sigma | C2404 | |
| Iodophors | Ningbo Medical | ||
| C57BL/6J, 10-12 weeks old | VitalRiver | Beijing, China | |
| Decellularized scaffold | Guanhao Biotec | 131102 | Guangzhou, China |
Referências
- Shapiro, A. M., et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 343, 230-238 (2000).
- Shapiro, A. M. J., et al. International Trial of the Edmonton Protocol for Islet Transplantation. N Engl J Med. 355, 1318-1330 (2006).
- Ryan, E. A., et al. Five-year follow-up after clinical islet transplantation. Diabetes. 54, 2060-2069 (2005).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95, 1449-1461 (2008).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotechnol. 35 (1), (2017).
- Dufour, J. M., et al. Development of an ectopic site for islet transplantation, using biodegradable scaffolds. Tissue Eng. 11, 1323-1331 (2005).
- Weaver, J. D., et al. Controlled Release of Dexamethasone from Organosilicone Constructs for Local Modulation of Inflammation in Islet Transplantation. Tissue Eng Part A. 21, 2250-2261 (2015).
- Wang, K., et al. From Micro to Macro: The Hierarchical Design in a Micropatterned Scaffold for Cell Assembling and Transplantation. Adv Mater. 29, (2017).
- Blomeier, H., et al. Polymer Scaffolds as Synthetic Microenvironments for Extrahepatic Islet Transplantation. Transplantation. 82, 452-459 (2006).
- Gibly, R. F., et al. Extrahepatic islet transplantation with microporous polymer scaffolds in syngeneic mouse and allogeneic porcine models. Biomaterials. 32, 9677-9684 (2011).
- Moskalewski, S. Isolation and Culture of the Islets of Langerhans of the Guinea Pig. Gen Comp Endocrinol. 5, 342-353 (1965).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16, 35-39 (1967).
- Zmuda, E. J., Powell, C. A., Hai, T. A Method for Murine Islet Isolation and Subcapsular Kidney Transplantation. J Vis Exp. (50), (2011).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4, 1649-1652 (2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse Islet of Langerhans Isolation using a Combination of Purified Collagenase and Neutral Protease. J Vis Exp. (67), (2012).
- Sakata, N., Yoshimatsu, G., Tsuchiya, H., Egawa, S., Unno, M. Animal models of diabetes mellitus for islet transplantation. Exp Diabetes Res. , 256707(2012).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotech. 35, 8-8 (2017).
- Londono, R., Badylak, S. F. Biologic scaffolds for regenerative medicine: mechanisms of in vivo remodeling. Ann Biomed Eng. 43, 577-592 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados