Method Article
Il trapianto di isole nel supporto del grasso epididimico dei topi diabetici
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo dimostra l'isolamento delle isole murine e la semina su un impalcatura decellulare. Isole supportate da ponteggi sono state trapiantate nel pad di grasso epididimo di topi diabetici indotti da streptozotocina (STZ). Isole sopravvissute al sito di trapianto e invertite la condizione iperglicemica.
Abstract
Il trapianto delle isole è stato clinicamente dimostrato efficace nel trattamento del diabete di tipo 1. Tuttavia, l'attuale strategia intraepatica di trapianto può comportare reazioni sanguigne intere acute e provocare un cattivo ingrasso di isole. Qui riportiamo un robusto protocollo per il trapianto di isole nel sito di trapianto extraepatico, il pad di grasso epididimo (EFP), in un modello di topi diabetici. Viene descritto un protocollo per isolare e purificare isole a rendimenti elevati da topi C57BL / 6J, nonché un metodo di trapianto eseguito da isole isolanti su un basamento decellulato (DCS) e implantarli sul sito EFP in topi sintesi C57BL / 6J resi diabetici Da streptozotocina. L'innesto DCS contenente 500 isole ha invertito la condizione iperglicemica entro 10 giorni, mentre gli isolotti liberi senza DCS hanno richiesto almeno 30 giorni. La normoglicemia è stata mantenuta fino a 3 mesi fino a quando l'innesto è stato esplorato. In conclusione, DCS ha potenziato l'inserimento di isole in tIl sito extraepatico dell'EFP, che potrebbe essere facilmente recuperato e potrebbe fornire una piattaforma riproducibile e utile per indagare i materiali dello scaffold, così come altri parametri di trapianto necessari per un successo nell'inserimento delle isole.
Introduzione
Il diabete mellito di tipo 1 (T1D) è un disturbo endocrino autoimmune in cui le cellule delle isole vengono ablate dal sistema immunitario, rendendo i pazienti dipendenti dall'iniezione di insulina esogena per tutta la vita. Il protocollo di Edmonton rappresenta una pietra miliare negli studi clinici del trapianto di isole; Isole sono state infuse attraverso la vena portale e trapiantate nel sito intraepatico 1 . Tuttavia, due principali ostacoli, inadeguate fonti di isole donatrici e una scarsa assunzione di isole, impediscono l'ampio successo del trapianto di isole 2 . Di solito, isolotti devono essere raccolti da tre donatori cadaverici per invertire la condizione iperglicemica di un paziente; Ciò è dovuto alla bassa resa delle procedure di isolamento delle isole e alla perdita di isole dopo il trapianto. In particolare, sebbene gli isolotti post-trapiantati venissero bagnati in sangue ricco di ossigeno, il contatto diretto con il sangue evocava spesso l'inflamma istantanea mediata dal sangue(IBMIR), che potrebbe causare la perdita acuta delle isole. A lungo termine, si pensa che la graduale perdita di isolotti nei pazienti rappresentasse la diminuzione dei tassi di inversione del diabete nei gruppi clinici, che potrebbero raggiungere il 90% nel primo anno e scendere al 30% e al 10% per 2 e 5 Anni post-trapianto, rispettivamente 3 .
Il trapianto delle isole nei siti extraepatici è stata una strategia attraente per ridurre il contatto diretto delle isole con il sangue e confinare i trapianti in posizioni più definibili rispetto all'infezione intraepatica. Gli studi sono stati condotti negli anni passati nella capsula, nell'occhio, nel muscolo, nei grassi e negli spazi sottocutanei, mostrando che le isole in questi siti sono in grado di sopravvivere e di funzionare per ripristinare la normoglicemia 4 . Inoltre, le isole in questi siti sono recuperabili, rendendo possibile la biopsia o persino per ulteriori procedure di sostituzione. Extrahepatic sPertanto dimostrano un grande potenziale per il trapianto clinico 5 .
Gli scaffold basati su biomateria sono stati studiati intensamente per il trapianto di cellule e l'ingegneria dei tessuti. Gli scaffoldi tridimensionali (3D) di solito contengono strutture porose e possono servire come modelli cellulari per generare struttura spaziale / organizzazione di cellule o come serbatoi per fornire il rilascio controllato di segnali bioattivi. I ponteggi sono stati inoltre fabbricati in materiali polimerici come poli (glicolide-L-lattido) 6 , poli (dimetilsilossano) 7 e poli (uretano) termoplastico 8 , a isole di trapianto nell'EFP. Rispetto al trapianto diretto delle isole, è stato riscontrato l'utilizzo di scaffold per ridurre la perdita di isole, prevenendo la perdita di isole nella cavità intraperitoneale 9 , 10 , fornendo protezione meccanica e moduLa reazione infiammatoria locale. Gli scaffold possono pertanto essere sviluppati per promuovere l'assunzione di isole nei siti di trapianto 7 .
In questo studio intendiamo dimostrare un paradigma del trapianto di isole nell'EFP, eseguito nei modelli di topi usando un DCS. Gli scaffali derivati da matrici extracellulari hanno attirato grande interesse negli ultimi anni a causa della biocompatibilità superiore e delle strutture porose più naturali rispetto ai prodotti sintetici. Qui descriviamo un robusto protocollo di isolamento per ottenere isole pancreatiche a rese elevate da topi C57BL / 6J. I DCS elaborati dal pericardio bovino sono stati poi seminati con isole e gli innesti sono stati trapiantati nell'EFP nei modelli diabetici singenici. La normoglicemia nei topi è stata raggiunta entro 10 giorni ed è stata mantenuta fino a 100 giorni, fino alla rimozione degli innesti.
Protocollo
Tutti gli esperimenti sono stati approvati dal comitato istituzionale per la cura e l'uso degli animali di Pechino (IACUC, IACUC no COE-LuoY-1).
1. Isolazione Isolamento
- Preparazione di reagenti e attrezzature.
- Ricostituire la polvere di collagenasi P (2 U / mg) in HBSS per ottenere una soluzione da 5 mg / mL e filtrarlo attraverso un filtro da 0,22 μm per rimuovere i batteri. Preparare soluzioni da 0,6 ml di aliquota di collagenasi P in 15 ml di tubi conici e conservare a -20 ° C.
NOTA: Durante l'uso, ogni aliquota viene diluita con HBSS per dare 6 ml di soluzioni di lavoro con concentrazioni finali di 0,5 mg / ml, o 1 U / ml (sufficiente per il trattamento di 3 topi). La soluzione di lavoro viene mantenuta in ghiaccio per un uso immediato entro 1 h. La soluzione di lavoro non deve essere ripristinata o re-congelata per un ulteriore utilizzo. - Preparare la soluzione di neutralizzazione aggiungendo FBS (2,5%) e P / S (1%) in HBSS; Mantenere la soluzione su ghiaccio. Preparare a trea 60 ml di soluzione di neutralizzazioneT 6 topi.
- Per il terreno di coltura di isole, aggiungere D-glucosio (7 mM), FBS (10%) e P / S (1%) al supporto RPMI 1640.
- Autoclave gli strumenti chirurgici a 115 ° C per 30 minuti e 15 psi di pressione.
- Ricostituire la polvere di collagenasi P (2 U / mg) in HBSS per ottenere una soluzione da 5 mg / mL e filtrarlo attraverso un filtro da 0,22 μm per rimuovere i batteri. Preparare soluzioni da 0,6 ml di aliquota di collagenasi P in 15 ml di tubi conici e conservare a -20 ° C.
- Inflazione del pancreas.
- Preparare 12 ml di soluzione di collagenasi, come specificato nel punto 1.1.1, per 6 topi (12 settimane). Riempire la siringa da 10 ml con 9 ml di soluzione di lavoro e collegare la siringa all'ago intravenoso di 27 G. Conservare la siringa sul ghiaccio e utilizzare la soluzione entro 1 ora.
- Eutanizzare il mouse dalla dislocazione cervicale. Posizionare il mouse in posizione supina su un tovagliolo di carta, con la coda rivolta verso l'operatore. Spruzzare tutto il corpo con il 70% di etanolo, rendendolo completamente umido.
- Fai un'incisione a V, partendo dall'area genitale e estendendola al diaframma, usando forbici e pinze per dissezione. Piegate la pelle sul petto per rivelare completamente la cavità addominale.
- MossaL'intestino a destra del mouse e esporre il pancreas e il canale biliare comune. Afferrate attentamente il duodeno con la pinza e tirarla fino a che il condotto biliare non è tirato ( Figura 1A -1 e A-2 ).
- Trovare la vena portale e il canale biliare che porta nel fegato. Morsettiamo la vena porta e il canale biliare con un morsetto emostatico microscopico.
NOTA: Il bloccaggio impedisce l'eccessivo sanguinamento e l'ingresso della collagenasi nel fegato. - Pur mantenendo l'intestino con le pinze, individuare la posizione dell'ampolla che collega il canale biliare e il duodeno. Inserire l'ago per via endovenosa 27G nel canale biliare comune attraverso l'ampolla ( Figura 1B -1 e B-2 ).
- Dispensare circa 200 μL di soluzione di lavoro collagenasi per verificare se la cannulazione è tutta la via attraverso il dotto biliare. Se la soluzione collagenasi inizia a riempire il condotto ( Figura 1C- 1 e C2 ), l'ago si trova nel lumen del condotto; Bloccare il segmento del condotto contenente l'ago utilizzando un morsetto emostatico dell'arteria e dispensare il resto della 2 ml di soluzione a una velocità lenta e costante entro 1 min ( Figura 2A -1 , A-2 e B-1 ).
NOTA: Se il tessuto che circonda il condotto inizia a gonfiarsi ( Figura 2B -2 ), l'ago è penetrato attraverso la parete del condotto biliare, rendendo necessario riposizionare l'ago e provare nuovamente a cannolare il dotto biliare. Allo stesso modo, se il duodeno inizia a gonfiarsi ( Figura 2C -1 e C-2 ), il morsetto emostatico dell'arteria deve essere regolato e il canale biliare re-cannulato. Poiché la soluzione collagenasi riempie il pancreas, il tessuto vicino al duodeno si gonfia prima, seguito dal regioN vicino alla coda pancreatica. La perfusione della coda pancreatica (il lobo dello splenicolo) è importante per massimizzare il rendimento delle isole. - Dopo l'inflazione completa del pancreas ( Figura 2C -1 ), spingere l'intestino verso il lato sinistro del mouse e rimuovere il pancreas partendo dal colon discendente. Usare le pinze per sollevare l'intestino e separarlo dal pancreas con un'altra coppia di pinze. Continuare a rimuovere il pancreas fino a quando non è attaccato dalla parte superiore dello stomaco. Infine, sollevate il pancreas dall'addome e tagliatelo dalla rimanente milza.
NOTA: L'intera separazione deve essere eseguita rapidamente, in quanto la digestione continua durante il processo di rimozione. - Posizionare il pancreas in un tubo vuoto da 15 ml e lasciarlo su ghiaccio. Ripetere la procedura sopra descritta per i topi rimanenti. Tutti i pancreas dovrebbero essere ulteriormente trattati entro 1 ora immediatamente seguendo il punto 1.3 per prevenire l'eccessiva digestione da parte della collagenasi P.

Figura 1: Fotografie che mostrano la cannulazione del canale biliare e la perfusione del pancreas con soluzioni collagenasi. ( A1 ) Tirare il duodeno finché il condotto biliare è tesa. (Ampolla: l'area triangolare, lattea sulla superficie del duodeno; il canale biliare: la struttura lattiginosa a forma di cordone sulla superficie). ( B1 ) Inserimento dell'ago nel condotto biliare dall'ampolla. ( C1 ) Inflare il pancreas con l'iniezione di enzimi. ( A2, B2 e C2 ) Le immagini del fumetto delle procedure descritte rispettivamente in A1, B1 e C1. Clicca qui per visualizzare una versione più grande di questa figura.
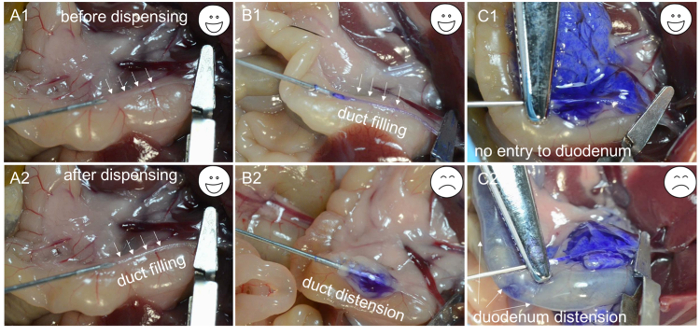
Figura 2: Risoluzione dei problemi per la cannulazione. ( A1 ) La punta dell'ago inserita nel lumen del canale biliare. ( A2 ) Il condotto è riempito con soluzioni enzimatiche. ( B1 ) L'ago inserito nel lumen del canale biliare e il condotto riempito con un colorante blu. ( B2 ) A causa della cannulazione inappropriata, l'ago è sotto il canale biliare e solo una capsula gonfiata viene osservata dopo l'erogazione del colorante blu. ( C1 ) Una cannulazione di successo è evidenziata dalla distensione del pancreas. ( C2 ) A causa di bloccaggio inadeguato, il colorante blu entra nel duodeno e provoca distensione. Clicca qui per visualizzare una versione più grande di questa figura.
- Digestione e purificazione di isole.
- Incubare i tubi conici contenenti il pancreas perfuso a 37 ° C per 17 minuti.
NOTA: Il tempo di incubazione può variare con l'età e le specie dell'animale. - Terminare la digestione aggiungendo 7 mL di soluzione di neutralizzazione e mettendo i tubi sul ghiaccio.
- Dissociare il tessuto scuotendo i tubi vigorosamente ( ad esempio, 20 volte in 10 s) fino a ottenere particelle di tessuto fine.
NOTA: la resa dell'isola sarà bassa se il pancreas non si dissociano completamente. - Filtrare i campioni di tessuto digerente attraverso una maglia metallica da 0,5 mm per rimuovere eventuali frammenti di tessuto non digeriti. Raccogliere le sospensioni in un nuovo tubo conico da 50 ml.
- Centrifugare i tubi per 3 min a 230 xg e 4 ° C e versare con cura il supernatante, senza disturbare i pellet di tessuto.
- Resuspendere i pellet da 3 topi in 4 ml di gradiente di densità di polysucrose vorticando delicatamente o pPonendo la sospensione su e giù alcune volte. Lentamente pipettare 4 ml di HBSS lungo il lato del tubo in cima alle soluzioni di polisolfuro.
NOTA: Le due soluzioni devono essere strati separati con un'interfaccia nitida.
NOTA: L'aggiunta di HBSS deve essere eseguita con cautela senza disturbare il gradiente di densità del polysucrose in basso. - Centrifugare la sospensione per 20 minuti a 900 xg e 4 ° C selezionando un tasso di accelerazione molto lento. Terminare la centrifugazione senza freni.
NOTA: Si tratta di un passo per purificare le isolette dalle cellule esocrine, con la maggior parte delle isole che migrano all'interfaccia tra gli strati di polisolfuro e HBSS e la maggior parte delle cellule esocrine che si stabiliscono in basso. - Rimuovere l'insieme delle soluzioni di supernatante da 8 ml utilizzando una pipetta da 15 ml di grandi dimensioni. Passare le soluzioni attraverso un filtro invertito da 70 μm.
NOTA: le isole saranno ulteriormente purificate e conservate dal filtro, mentre le cellule esocrinePasserà attraverso il filtro.
Attenzione: il gradiente di densità del polysucorse è cellulare-tossico; La filtrazione aiuterà le isole a sbarazzarsi del polisolfuro. - Pipettare 2 ml di soluzione di neutralizzazione fredda in un piatto di Petri da 35 mm. Invertire il filtro della cella a destra, immergere la superficie mantenendo le isole nella soluzione e scuotere delicatamente per liberare le isole.
- Raccogliere manualmente le isole sotto un microscopio usando una pipetta da 20 μl con una punta bianca.
NOTA: Le isole sono aggregati di cellule gialle e compatte ( Figura 3A ), mentre i tessuti o le cellule esocrini contaminanti hanno una struttura nera e sciolta sotto il microscopio di dissezione. - Inserire circa 200 isole in un piatto da 35 mm con 2 ml di terreno di coltura e incubare a 37 ° C in un incubatore fornito con 5% di CO 2 per 12 h.
NOTA: Solitamente 150-300 isole possono essere raccolte da un mouse C57BL / 6J di 12 settimane. Le isole sono inclini a formare aggregati durante la cultura,E le grandi isole (> 300 μm) sono suscettibili di necrosi centrale ( figura 1B , inset). Agitare bene la sospensione per distribuire uniformemente le isole nel piatto e per ridurre il clumping.
- Incubare i tubi conici contenenti il pancreas perfuso a 37 ° C per 17 minuti.
2. Cultura dell'isola sul ponteggio
NOTA: DCS ha una porosità di circa il 79%, uno spessore di circa 0,6 mm e una portata che va da 12 a 300 μm.
- Tagliare i ponteggi in dischi da 7 mm, immergerli in etanolo al 70% e lavare con HBSS. Inserire i ponteggi negli inserti della coltura dei tessuti da 24 pozzetti.
NOTA: quando le isole fresche vengono recuperate dopo la coltura durante la notte, le isolette appaiono luminose e strette, con bordi lisci ( Figura 3B ). - Girare il piatto e raccogliere le isole dal centro del piatto utilizzando una pipetta da 20 μl con punta bianca. Trasferire le isole ai ponteggi (250 isole / ponteggio) usando una pipetta e aggiungere 2 ml di terreno di coltura ail pozzo. Coltivi le isole per 12 ore prima del trapianto.
3. Ispirazione trapianto al sito EFP
- Induzione del diabete nei topi riceventi.
- Metti i topi C57BL / 6J (più di 10 settimane) in una gabbia fresca con acqua, ma senza cibo. Fast i topi per 10 ore prima dell'induzione del diabete.
- Preparare soluzioni tampone con valori pH di 4.2-4.5 mescolando 0,1 M acido citrico con 0,1 M citrato di sodio. Sciogliere STZ (10 mg / mL) nel tampone appena preparato e sterilizzare la soluzione passandola attraverso un filtro da 0,22 μm.
NOTA: STZ è sensibile alla luce e perde attività entro 10 minuti; Preparare sempre la soluzione fresca STZ prima dell'iniezione. - Iniettare ogni topo intraperitonealmente con STZ ad una dose di 140-150 mg / kg per ogni mouse C57BL / 6J.
NOTA: La dose varia a seconda dell'età e della specie dell'animale. Si raccomanda di eseguire un'ottimizzazione di dosaggio in piccole dimensioniSt per la specie data prima di iniziare l'esperimento formale. - Raccogliere il sangue della coda della coda e controllare il glucosio nel sangue con un misuratore di glucosio nei giorni 2, 3 e 4 iniezione post-STZ.
NOTA: quando gli animali sono iperglicemici (glucosio nel sangue non digiuno> 16,7 mM) in due giorni consecutivi, sono pronti per il trapianto di isole.
- Trapianto di isole al sito EFP.
- Anestetizzare i topi con pentobarbital consegnato intraperitonealmente (50 mg / kg). Posizionare il mouse in posizione supina su un tovagliolo di carta, con la coda rivolta verso l'operatore. Rasare l'addome ampiamente per rimuovere la pelliccia da tutto il sito di incisione. Tape giù i quattro arti e tamponare completamente la pelle con alcool alternato e salviettine iodofori spostati in modo circolare per sterilizzare il sito di incisione. Togliere il mouse con un drappo sterile, consentendo solo l'accesso all'area di incisione. Effettuare un'incisione di 7 mm attraverso la parete peritoneale dellaMidline, vicino alla zona genitale.
NOTA: Tutti gli strumenti utilizzati durante l'intervento chirurgico, inclusi i guanti, devono essere sterili. - Afferrare delicatamente e rimuovere l'EFP dalla cavità addominale usando le pinze. Spalmare l'EFP sulla garza sterile bagnata. Collocare gli isolotti contenenti l'impalcatura sul EFP e piegare l'EFP per avvolgere il trapianto. Proteggere il contatto diretto tra isole e EFP suturando l'EFP con suture assorbibili 6-0. Bagnare la superficie dell'EPP con salina sterile usando un tampone di cotone imbevuto per evitare che l'EFP si asciughi.
- Mettere delicatamente il EFP nella cavità addominale. Chiudere l'incisione suturando la parete peritoneale e bloccando lo strato dermico con le clip della ferita.
- Iniettare buprenorfina (0,1 mg / kg) sottocutanea come analgesico.
- Iniettare 1 ml di salina sottocutanea per prevenire la disidratazione.
- Posizionare il mouse in una gabbia su un tappetino di riscaldamento fino a quando il topo recupera dall'anestesia.
- Controllare il glucosio non digiunatoVela due giorni dopo raccogliendo sangue dalla vena della coda. Se si recupera l'innesto, ripetere le procedure sopra descritte, estrarre delicatamente l'EFP, utilizzare la sutura 3-0 per legare l'estremità del grasso adiacente all'epididimo, occludere i vasi sanguigni, esplodere l'innesto EFP e conservarlo per istologia .
NOTA: Spiegare le isole dovrebbero rendere nuovamente i topi riceventi iperglicemici entro 3 giorni, confermando la funzione dell'innesto.
- Anestetizzare i topi con pentobarbital consegnato intraperitonealmente (50 mg / kg). Posizionare il mouse in posizione supina su un tovagliolo di carta, con la coda rivolta verso l'operatore. Rasare l'addome ampiamente per rimuovere la pelliccia da tutto il sito di incisione. Tape giù i quattro arti e tamponare completamente la pelle con alcool alternato e salviettine iodofori spostati in modo circolare per sterilizzare il sito di incisione. Togliere il mouse con un drappo sterile, consentendo solo l'accesso all'area di incisione. Effettuare un'incisione di 7 mm attraverso la parete peritoneale dellaMidline, vicino alla zona genitale.
Risultati
Il nostro metodo di bloccaggio, eseguito utilizzando un morsetto emostatico microscopico, è semplice e risparmio di tempo rispetto alla tecnica di ligation della sutura. Ci sono voluti circa 4 ore per isolare e purificare circa 1.200 isole da 6 topi. Gli isolotti freschi isolati hanno tipicamente avuto una periferia ruvida sotto un microscopio ottico ( Figura 3A ). Una volta che le isole recuperate dal processo di isolamento, sembravano brillanti e stretti e acquisirono una superficie liscia. Tuttavia, l'isolamento stressante potrebbe ancora indurre la morte cellulare, provocando il crollo delle cellule dalle superfici delle isole e isolotti malsani spesso contenevano un nucleo necrotico scuro ( Figura 3B ). Abbiamo misurato i diametri di 945 isole da 5 topi; Il diametro medio dell'isolotto calcolato era di 130,42 ± 41,75 μm ( figura 3C ).
Per evitare che il destinatario sia immune Rifiuto, abbiamo eseguito il trapianto singenico nei topi C57BL / 6J. Tipicamente, 500 isole cariche DCS sono state trapiantate nel sito dell'EFP e hanno invertito l'iperglicemia entro 10 giorni, rispetto ai 30 giorni osservati nel gruppo libero di isole. La normoglicemia è stata mantenuta per circa 100 giorni, fino al recupero degli innesti ( Figura 3D ). Gli isolotti carichi sono stati distribuiti uniformemente su DCS e coperti da EFP. Il DCS caricato in isola potrebbe anche essere facilmente manipolato con pinze ( Figura 3E e 3F ). Lo studio istologico ha dimostrato che gli isolotti distribuiti in modo uniforme sono stati rivascolarizzati e circondati dal tessuto EFP e dal DCS dopo il trapianto per 60 giorni ( Figura 3G ). L'immunostaining dell'insulina ha confermato ulteriormente l'impegno di successo degli isole ( Figura 3H ).
Xfigimg "src =" / files / ftp_upload / 54995 / 54995fig3.jpg "/>
Figura 3: Trapianto di isole supportate da scaffali al sito EFP. ( A ) Rappresentativa di isole fresche isolate dai topi. ( B ) Isole coltivate per 12 h, con cellule morte che si stendono dalla superficie delle isole. Insetti: isolotti malsani hanno un nucleo oscuro e necrotico. ( C ) Distribuzione delle dimensioni di 945 isole da 5 topi. ( D ) Livello di glucosio nel digiuno dei topi diabetici trapiantati con isolotti DCS e isole libere. La freccia nera indica che l'innesto è stato recuperato in questo momento. ( E ) Fotografia che mostra il trasferimento di scaffold carichi di isole sulla superficie di un tessuto EFP diffuso. ( F ) Rappresentativa immagine di contrasto di fase del DCS caricato in isola. Inset: immagine ottica del DCS, tenuta da pinze. ( G ) Rappresentativa H & E immagine dell'istitutoIsole trapiantate, circondate da DCS e EFP, dopo 60 giorni. ( H ) Immunostaining delle isole supportate da DCS, esplorate dopo 60 giorni. Barre di scala = 150 μm (A, B), 100 μm (F), 500 μm (G) e 25 μm (H). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La perfusione del pancreas e il tempo di digestione sono due parametri chiave che influenzano la resa e la qualità delle isole. Moskalewski ha segnalato per la prima volta l'uso di una miscela di collagenasi grezzo per la digestione del pancreas di guinea pig macinato 11 . Lacy et al. Ha segnalato l'iniezione di enzimi nel sistema del condotto per perfezionare il pancreas, che ha notevolmente aumentato il rendimento delle isole 12 . La perfusione duttale di enzima permette la massima esposizione della superficie pancreatico all'enzima, con conseguente digestione più omogenea e un maggior rilascio di isolotti intatti rispetto a digerendo macinate pancreas 13. Nella nostra esperienza, la riuscita cannulazione del canale biliare e la perfusione dell'intero pancreas sono stati prerequisiti per i rendimenti elevati delle isole. Ciò è dovuto al fatto che la coda pancreatica (lobo splenico) contiene in realtà la maggior parte delle isole rispetto al tessuto pancreatico vicino al duodeno. Ci sono due modi per cannulare Il canale biliare riportato in letteratura: i) inserimento dell'ago vicino al sito del fegato, bloccando l'entrata dell'enzima nel duodeno 13 , 14 e ii) inserimento dell'ago vicino al duodeno bloccando l'ingresso dell'enzima nel Fegato 15 . Qui abbiamo adottato quest'ultima tecnica, che non richiede la piegatura dell'ago o il riposizionamento del mouse. Un ricercatore ben addestrato può eseguire la cannulazione di 10 topi entro 40 minuti quando segue il nostro protocollo. Il tempo di digestione del pancreas varia con l'età e le specie dei topi. Il pancreas sovradimensionato produce piccole isole e pancreas under-digested hanno cellule acinarie attaccate alle isole. È quindi importante ottimizzare il tempo di digestione per ottenere elevate rese di isole sane.
STZ è un composto antibiotico che distrugge specificamente le cellule beta e induce il diabete nei topi entro 3 giorniSs = "xref"> 16. Il dosaggio varia con il ceppo specifico e l'età del mouse e deve essere determinato mediante pre-esperimenti. A nostra conoscenza, i topi C57BL / 6J richiedono una dose minore di STZ rispetto ai topi Balb / C. Un sovradosaggio di STZ causerebbe una grave iperglicemia e portare alla morte degli animali entro una settimana, mentre una dose insufficiente di STZ abbassa il tasso di incidenza del diabete.
Gli EFP sono tessuti altamente vascolarizzati e facilmente accessibili alla chirurgia attraverso procedure minimamente invasive. Il trapianto di isole a EFP è generalmente più facile e più sicuro rispetto alla capsula renale, un altro sito comunemente riportato per il trapianto di isole nei modelli di topi. In particolare, il rene è un organo essenziale ed è delicato da gestire; Il trapianto di isole può fallire o gli animali non possono sopravvivere all'intervento 4 . Gli EFP nei topi sono anche simili alla tasca omentale degli esseri umani. Lo studio di trapianto in EFP non solo può facilitare la nostraComprensione dell'ambiente tissutale presupposto per la sopravvivenza / funzione degli isole, ma anche la base per lo sviluppo delle procedure di trapianto clinico 17 .
La DCS utilizzata in questo studio è stata derivata dal pericardio bovino ed è stata fatta principalmente di collagene. I materiali decellulati potrebbero non mostrare immunogenicità e potrebbero indurre solo reazioni infiammatorie lieve in vivo 18 . Quando le isole sono state seminate all'interno dei pori del DCS, l'impalcatura ha offerto protezione meccanica e impedito l'isolamento delle isole, che potrebbero portare alla necrosi delle isole. L'impalcatura DCS contenente le isole potrebbe essere gestita direttamente con pinze, permettendo l'facile trasferimento del trapianto. Incorporando gli scaffold all'interno dell'EFP ha anche ridotto la perdita di isole nel peritoneo, a differenza delle isole libere trapiantate senza un ponteggio 8 . Pertanto, il DCS fornisce distincT vantaggi per il trapianto di isole.
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
Gli autori vorrebbero ringraziare Wei Zhang da Guanhao Biotech per fornire gli scaffali decellulari. Ringraziamo Xiao-hong Peng per le discussioni utili. Questa ricerca è stata sostenuta finanziariamente dalla National Science Foundation della Cina (progetto n.31322021).
Materiali
| Name | Company | Catalog Number | Comments |
| Dissecting scissor | Ningbo Medical | ||
| Forceps | Ningbo Medical | ||
| 0.5 mm diameter wire mesh | Ningbo Medical | ||
| 70 μm cell strainer | Falcon | 352350 | |
| Artery hemostatic clamp | Ningbo Medical | ||
| Microscopic hemostatic clamp | Ningbo Medical | ||
| Hemostatic forceps | Ningbo Medical | ||
| Absorbable 6-0 PGLA sutures | JINHUAN | With needle | |
| Wound clip | Ningbo Medical | ||
| Cotton swab | Ningbo Medical | ||
| Gauze | Ningbo Medical | ||
| Sterile drapes | Ningbo Medical | ||
| 10mL syringe | JINGHUAN | ||
| 1 mL syringe | JINGHUAN | ||
| 27G intravenous needle | JINGHUAN | 0.45x15 RWSB | |
| 1.5 mL Eppendorf tube | Axygen | ||
| 15mL conical tube | Corning | 430791 | |
| 50mL conical tube | Corning | 430829 | |
| 35mm Non-treated Peri-dishes | Corning | 430588 | |
| Transwell | Corning | 3422 | |
| 0.22 μm filter | Pall | PN4612 | |
| 10 mL serological pipet | Corning | 4488 | |
| Pipet filler S1 | Thermo Scientific | 9501 | |
| Pipette (2-20μL) | Axygen | AP-20 | AXYPETTM |
| Dissecting microscope | Olympus | SZ61 | |
| Centrifuge | Eppendorf | 5810R | |
| Hank’s balanced salt solution | Gibco | C14175500CP | |
| Collagenase P | Roche | COLLP-RO | |
| Histopaque 1077 | Sigma | 10771 | |
| RPMI 1640 | Gibco | 11879-20 | |
| FBS | Gibco | 16000-044 | |
| D-glucose | Gibco | A24940-01 | |
| Glucose meter | Roche | ACCU-CHEK | |
| Penicillin-streptomycin | Gibco | 15140-122 | |
| Streptozotocin | Sigma | V900890 | VetecTM |
| Chloral hydrate | J&K | C0073 | |
| Sodium citrate | Sigma | 71497 | |
| Citric acid | Sigma | C2404 | |
| Iodophors | Ningbo Medical | ||
| C57BL/6J, 10-12 weeks old | VitalRiver | Beijing, China | |
| Decellularized scaffold | Guanhao Biotec | 131102 | Guangzhou, China |
Riferimenti
- Shapiro, A. M., et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med. 343, 230-238 (2000).
- Shapiro, A. M. J., et al. International Trial of the Edmonton Protocol for Islet Transplantation. N Engl J Med. 355, 1318-1330 (2006).
- Ryan, E. A., et al. Five-year follow-up after clinical islet transplantation. Diabetes. 54, 2060-2069 (2005).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95, 1449-1461 (2008).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotechnol. 35 (1), (2017).
- Dufour, J. M., et al. Development of an ectopic site for islet transplantation, using biodegradable scaffolds. Tissue Eng. 11, 1323-1331 (2005).
- Weaver, J. D., et al. Controlled Release of Dexamethasone from Organosilicone Constructs for Local Modulation of Inflammation in Islet Transplantation. Tissue Eng Part A. 21, 2250-2261 (2015).
- Wang, K., et al. From Micro to Macro: The Hierarchical Design in a Micropatterned Scaffold for Cell Assembling and Transplantation. Adv Mater. 29, (2017).
- Blomeier, H., et al. Polymer Scaffolds as Synthetic Microenvironments for Extrahepatic Islet Transplantation. Transplantation. 82, 452-459 (2006).
- Gibly, R. F., et al. Extrahepatic islet transplantation with microporous polymer scaffolds in syngeneic mouse and allogeneic porcine models. Biomaterials. 32, 9677-9684 (2011).
- Moskalewski, S. Isolation and Culture of the Islets of Langerhans of the Guinea Pig. Gen Comp Endocrinol. 5, 342-353 (1965).
- Lacy, P. E., Kostianovsky, M. Method for the isolation of intact islets of Langerhans from the rat pancreas. Diabetes. 16, 35-39 (1967).
- Zmuda, E. J., Powell, C. A., Hai, T. A Method for Murine Islet Isolation and Subcapsular Kidney Transplantation. J Vis Exp. (50), (2011).
- Li, D. S., Yuan, Y. H., Tu, H. J., Liang, Q. L., Dai, L. J. A protocol for islet isolation from mouse pancreas. Nat Protoc. 4, 1649-1652 (2009).
- Stull, N. D., Breite, A., McCarthy, R., Tersey, S. A., Mirmira, R. G. Mouse Islet of Langerhans Isolation using a Combination of Purified Collagenase and Neutral Protease. J Vis Exp. (67), (2012).
- Sakata, N., Yoshimatsu, G., Tsuchiya, H., Egawa, S., Unno, M. Animal models of diabetes mellitus for islet transplantation. Exp Diabetes Res. , 256707(2012).
- Schmidt, C. Pancreatic islets find a new transplant home in the omentum. Nat Biotech. 35, 8-8 (2017).
- Londono, R., Badylak, S. F. Biologic scaffolds for regenerative medicine: mechanisms of in vivo remodeling. Ann Biomed Eng. 43, 577-592 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon