Method Article
Трехмерная Суперразрешение Микроскопия F-актин филаментов интерферометрической фотоактивированного локализации микроскопии (iPALM)
В этой статье
Резюме
Мы представляем протокол для применения интерферометрических фотоактивированного локализации микроскопии (iPALM), 3-х мерной локализации одной молекулы методом микроскопии сверхвысокого разрешения, к визуализации актинового цитоскелета в прикрепленных клетках млекопитающих. Такой подход позволяет на основе света визуализации наноразмерных структурных особенностей, которые в противном случае остаются нерешенными обычными дифракционной оптической микроскопии.
Аннотация
Флуоресцентная микроскопия позволяет осуществлять прямую визуализацию конкретных биомолекул внутри клетки. Тем не менее, для обычной флуоресцентной микроскопии, пространственное разрешение ограничено дифракцией до ~ 200 нм в плоскости изображения и> 500 нм вдоль оптической оси. В результате, флуоресцентной микроскопии уже давно сильно ограничены в наблюдении ультраструктурных признаков внутри клеток. Новейшая разработка методов микроскопии сверхвысокого разрешения преодолела это ограничение. В частности, появление фотопереключаемых флуорофоров позволяет локализации на основе суперразрешением микроскопии, которая обеспечивает разрешающую способность приближающейся масштаб молекулярной длины. Здесь мы опишем применение трехмерного супер способа разрешения микроскопии на основе одиночной молекулы локализации микроскопии и многофазных интерферометрии, называемой интерферометрической фотоактивированного локализации микроскопии (iPALM). Этот метод обеспечивает почти изотропный разрешения напорядка 20 нм во всех трех измерениях. Протоколы для визуализации волокнистый актин цитоскелета, в том числе подготовки образцов и эксплуатации прибора iPALM, описаны здесь. Эти протоколы также могут быть легко адаптированы и поучительно для изучения других ультраструктурных признаков в клетках.
Введение
Визуализация сложных клеточных структур уже давно неотъемлемой частью биологических идей и открытий. Хотя флуоресцентная микроскопия позволяет получать изображения клетки с высокой молекулярной специфичности, его разрешающая способность ограничена дифракции до ~ 200 нм в плоскости изображения (X, Y, или поперечный размер) и> 500 нм вдоль оптической оси (Z, или осевого размера) 1,2. Таким образом, наблюдение за ультраструктурных особенностей исторически ограничена электронной микроскопии (ЭМ). К счастью, в последнее время развитие суперразрешением микроскопии обходили это ограничение, что позволяет пространственное разрешение в 10 - диапазоне 1-6 100 нм. В частности, Суперразрешение подходы , основанные на одной молекулы локализации, известной под аббревиатурами , такими как PALM (фотоактивированного локализация микроскопия) 4, FPALM (флуоресценция фотоактивированного локализации микроскопия) 5 (d) STORM (прямая Стохастический оптическая микроскопия Реконструкция) 6,7, PAINT ( PoINT Накопление для работы с изображениями наноразмерных Топография) 8, GSDIM (State Ground Истощение Микроскопия с последующей индивидуальной молекулярной возвращения) 9 или SMACM (Single-Molecule Active-Control Микроскопия) 10, а также их 3-мерные (3D) реализации, такие как интерферометрическое PALM (iPALM) 11 или 3D-STORM 12, был ценным в выявлении новых идеи в наноразмерных организации многочисленных биологических структур, в том числе аксонов и синапсов 13, очаговые спайки 14,15, межклеточных соединений 16, ядерные поры 17 и центросомы 18-20, чтобы назвать несколько.
Еще одна особенность ультраструктурным в клетках, для которых Суперразрешение микроскопия потенциально полезным является актин цитоскелета. Комплекс плетение нитчатых (F) актина в клетки коры головного мозга играет существенную роль в контроле клеточного формы и механических свойств 21. Организация оF F-актин активно и динамично регулируется , хотя многочисленные регуляторные белки , которые оказывают сильное влияние на полимеризацию, сшивание, оборот, стабильность и топологию сети 22. Тем не менее, хотя характеристика F-актин сетчатой архитектуры имеет важное значение для механистической способности проникновения в суть разнообразных клеточных процессов, малый размер (~ 8 нм) из F-актина нитей затрудняет их наблюдение с помощью обычной дифракционной световой микроскопии; Таким образом, визуализация актина тонкой структуры до настоящего времени исключительно в исполнении EM. Здесь мы описываем протоколы для визуализации F-актин цитоскелета в прикрепленных клетках млекопитающих, используя суперразрешением метод микроскопии iPALM , чтобы воспользоваться его очень высокой способности точности в 3D 11,23. Хотя прибор iPALM является узкоспециализированной, инструкция по настройке такого инструмента был описан недавно 23, в то время как доступ к микроскоп iPALM , организованном ХоWard Hughes Medical Institute также доступны для научного сообщества с минимальными затратами. Кроме того, способы получения образцов , описанные здесь , непосредственно применимы к альтернативным подходам 3D Super Resolution, таких как те , которые основаны на астигматизма расфокусировки функции рассеяния точки (PSF) 12 или би-плоскости обнаружения 24, которые более широко доступны.
Отметим , что необходимый компонент для одной молекулы локализации на основе суперразрешением микроскопии в целом является фотопереключаемых Флуорофор 25, что позволяет трем критическим требованиям для одной молекулы локализации на основе суперразрешением микроскопии должны быть выполнены: я) высокой одной молекулы яркость и контрастность по отношению к фоновых сигналов; б) разреженный распределение одиночных молекул в заданном кадре изображения; и III) высокая пространственная плотность маркировки, достаточной для захвата профиля базовой структуры (также известный как Найквиста-Шаnnon критерий выборки) 26. Таким образом, для удовлетворительных результатов, особое внимание следует уделять одинаково на обоих надлежащей подготовки образцов для оптимизации флуорофора photoswitching и сохранить основную ультраструктуры, а также на приобретение приборов и аспектов экспериментов.
протокол
1. Подготовка изображений образцов
- Так как фон сигналы флуоресценции мешают флуоресценции от флуорофоров меток, очистить coverglasses сначала ополаскивают в деионизированной воде (DDH 2 O) , а затем сушка на воздухе их с помощью сжатого воздуха. Затем выполняют плазменного травления в плазме очистителя в течение 15 секунд, или дольше, если это необходимо.
- Чтобы включить коррекцию дрейфа и калибровки iPALM, используйте # 1.5 круглая (диаметр 22 мм) предварительно очищенную coverglasses внедренные с люминесцентными наночастиц в качестве реперных знаков, которые служат высоко фотостабильным реперные для надежной калибровки и коррекции дрейфа. Из-за долгого времени накопления необходимого для накопления достаточной плотности флуорофора (> 15 - 30 мин), дрейф образца неизбежно.
- Поместите каждую fiducialed покровного стекла в 6-луночного планшета для культуры ткани с. Стерилизовать их с помощью ультрафиолетового (УФ) излучения в колпаке с ламинарным потоком в течение 15 мин.
- В стерильный ламинарный, подготовить фиброзноnectin раствор для покровного стекла покрытия путем разбавления 1 мг / мл фибронектина исходного раствора в фосфатно-буферном солевом растворе стерильного Дульбекко (DPBS) до конечной концентрации 2 - 10 мкг / мл. Промыть каждый покровного стекла трижды ДЗФР и инкубировать с 2 мл раствора фибронектина в течение ночи при температуре 4 ° С. Впоследствии, аспирата из раствора фибронектина и промыть один раз с ДЗФР.
- Промойте клетки на короткое время с ДЗФР. Инкубируйте с 1 - 2 мл трипсина в течение нескольких минут при температуре 37 ° С до тех пор, пока клетки не отделяться и гасят ~ 10 мл свежей сыворотки, содержащей среду для культивирования клеток. Например, для эндотелиальных клеток пупочной вены человека (HUVEC), используют большой культуральной среды эндотелиальных сосудов, дополненную с большими факторами эндотелиальных сосудов и пенициллин или стрептомицин.
- Replate клеток на покровного стекла , покрытой фибронектином (для разреженной плотности, пластины <50000 клеток на покровного стекла) и поддерживать культуру в инкубатор при влажности 95%, 5% CO 2, и 37 & #176; С.
- Для правильного сохранения тонких структур F-актин цитоскелета, используют буферные растворы на основе буферных реагентов Гуда 27.
- Например, подготовить ФЭУ буфер как 2x маточного раствора (120 мМ ТРУБЫ, 50 мМ HEPES, 20 мМ ЭДТА , 4 мМ MgCl 2, рН 7,0 с помощью КОН) путем растворения 6,5 г HEPES, 3,8 г EGTA, и 190 мг MgCl 2 в ~ 300 мл DDH 2 O, с рН , доведенным до 7,0 добавлением по каплям концентрированного раствора KOH; Затем, добавьте DDH 2 O , чтобы довести объем до 500 мл. Стерилизацию буфер через фильтр 0,22 мкм, хранить его при температуре 4 ° С, и разбавить его 1: 1 с DDH 2 O перед использованием.
- Для достижения наилучших результатов с высокой плотностью маркировки Ф-актина, использование фаллоидином, конъюгированного с органическими флуорофоры, такие как Alexa Fluor 647. в нужной точке времени после ячейки replating, зафиксировать клетки, следующим образом:
- Аспирируйте средств массовой информации из каждой культуры и содержащих СЕLL образца. Аккуратно, но быстро обойтись 2 мл теплого (37 ° C) фиксаторов экстракции, содержащей 0,25% глутаральдегида в ФЭУ буфере с 0,25% Triton X-100. Выдержите при комнатной температуре в течение 1 - 2 мин. Для последующих стадий, используют 2 мл фиксаторе или закалкой буфера на покровного стекла, если не указано иное.
- Заменить закрепитель экстракции с 2,5% глутаральдегида фиксатором в буфере ФЭУ и пусть образцы инкубировать в течение 10 - 12 мин. Это и следующие шаги все проводят при комнатной температуре.
- Аспирацию из фиксаторов на и аккуратно заменить их ФЭУ буфером. Наклон и водоворот осторожно, а затем промыть снова с ФЭУ. Повторите дважды.
- Утолить аутофлюоресценция от глутаральдегида, который может сокрушить сигналы от желаемых флуорофоров, инкубировать образцов со свежеприготовленным закаливания буфером , содержащим NaBH 4 при массовой концентрации 0,1% в ФЭУ. будет наблюдаться Профузные пузыри. Время от времени нажмите на образец блюдо аккуратно Дизльodge пузыри. Пусть инкубировать в течение 5 - 10 мин.
- Аспирацию из буфера быстрого охлаждения и аккуратно заменить его ФЭУ буфером. Промыть несколько раз, чтобы убрать пузырьки. Пипетка в 2 мл ФЭУ буфера и пусть он инкубировать в темноте в течение 5 мин. Повторите два раза, и пусть остальные образца в буфере ФЭУ, когда сделано.
- Подготовьте камеру влажности для фаллоидином инкубацию с помощью большой пластиковой чашки Петри , дополненный с куском бумажным полотенцем щедро смоченным 5 - 10 мл DDH 2 O. Поместите большой лист чистой Parafilm сверху влажным бумажным полотенцем.
- Из-за относительно высокой стоимости меченого фаллоидином, использовать небольшой объем для каждой маркировки. Для получения высокой плотности маркировки, начинаются с концентрации 0,3 мкМ. Приготовьте ~ 60 мкл на покровного стекла с использованием фаллоидином-Alexa Fluor 647 в буфере ФЭУ.
- Пипетка 55 - 60 мкл раствора фаллоидином на лист Parafilm в камере влажности. Использование тонких щипцов, осторожно удалите образец covergдеваха. Будьте осторожны, чтобы отметить правильный клеток, содержащих лицо.
- Быстро и аккуратно прикосновением избыток буфера, прикоснувшись к краю покровного стекла с сложенный лист тонким впитывающей бумагой, а затем поместить стороны покровного стекла клеток, обращенную вниз на каплю фаллоидином раствора на парафильмом. Убедитесь, что нет никаких пузырей, захваченных покровного стекла.
- Поместите крышку на камере влажности. Оберните камеру в алюминиевую фольгу, чтобы защитить его от окружающего света, и пусть образец инкубировать в течение ночи при 4 ° С. Образец может быть в этом состоянии в течение нескольких дней. Убедитесь, что камера влажность остается влажной, если длительное хранение планируется.
- До обработки изображений, осторожно поместить сторону покровного стекла клеток вверх на новый 6-луночного планшета, содержащую 2 мл ФЭУ буфера на каждую лунку.
- Подготовка к кислороду продуваемых тиоловых на основе буферов изображений с использованием следующих исходных растворов: 1 М глюкозы, 1 М цистеамин и 100x глюкозооксидаза / фермент микст каталазыЮр (4 мг каталазы и 10 мг глюкозооксидазы в 100 мкл буфера для ФЭУ, хорошо перемешивают встряхиванием) 28. Непосредственно перед изображениями, смешайте 75 мкл 1 М раствор глюкозы, 30 мкл 1 М раствора цистеамина, а также 3 мкл 100-кратного сток ферментной смеси. Отрегулируйте громкость до 300 мкл с ФЭУ буфера и использовать сразу же после смешивания для установки образца.
- Для iPALM, подготовить образец формирования изображения с использованием предварительно очищенное # 1,5 покровного стекла (диаметр 22 мм).
- В качестве альтернативы, использовать предметное стекло (3 "х 1") с двухсторонней клейкой прокладки для помощи в сборке , если астигматизм на основе 3D-STORM 12 должен использоваться вместо этого.
- Чтобы собрать образец изображения, использовать тонкий пинцет, чтобы аккуратно удалить образец покровного стекла из буфера хорошо. Затем, быстро и аккуратно прикосновением избыток буфера, прикоснувшись к краю покровного стекла с складчатой фильтровальной бумаги.
- Поместите сторону покровного стекла клеток стороной вверх на листе чистой бумаги линзы. Промыть образецпутем размещения 30 - 50 мкл буфера изображений на образец, и удалить избыточный буфер путем наклона и нарезание резьбы со сложенным впитывающей бумагой.
- Повторите операции полоскания несколько раз, а затем поместить 30 - 50 мкл буфера изображений на образец. Блот сухой край покровного стекла и поместить несколько очень маленьких точек быстрого отверждения эпоксидной смолы на высушенный области.
- Медленно опустите другой предварительно очищенную # 1.5 покровного стекла (обычный, круглый покровного стекла, диаметр 18 мм) на центре ячейки, содержащей 22-мм покровного стекла. Пусть буфер изображений намочить как coverglasses под действием капиллярных сил. Маленькие точки быстрого отверждения эпоксидной смолы следует придерживаться обоих coverglasses.
- Аккуратно нажмите на собранном образце с использованием сложенной фильтровальной бумагой, чтобы распределить давление равномерно. Используйте достаточное давление, чтобы сделать образец клеток тонкий и даже (<15 мкм), но не настолько, чтобы раздавить клетки. Калибр необходимой толщины, наблюдая Ньютона кольца шаблон. Кроме того, убедитесь, что для выполнения этой стер осторожно, чтобы свести к минимуму пузырьки воздуха. При необходимости практиковать с пустыми coverglasses несколько раз заранее.
- Печать образца с растопленным вазелиновым-ланолин-парафин (VALAP, запас получают из 100 г каждого из вазелина, ланолина и парафина, сплавлены вместе) 29, полоскание запечатанный образца с DDH 2 O, и продуйте сжатым воздухом. Образец теперь готов для монтажа на микроскоп для работы с изображениями.
2. Пример размещения и выравнивания iPALM
- Перемещение подпружиненную верхнюю линзу объектива вверх, чтобы обеспечить удаление держателя образца. Поместите запечатанном образца, полученного на стадии 1.10 на держатель образца и закрепите с помощью нескольких небольших магнитов редкоземельных. Нанесите иммерсионного масла на обеих сторонах образца изображения. Поместите держатель образца обратно в оптический путь и осторожно опустить верхнюю линзу объектива.
- Включите лазеров возбуждения. Включите электронного умножителя прибор с зарядовой связью (EMCCD) камеры в режиме кадра передачи.
- Поворот в соответствующих фильтров выбросов. Активировать механический затвор , чтобы блокировать верхнюю траекторию луча (рис 1А) и открыть нижнюю траекторию луча. Доведите нижнюю линзу объектива в фокус на перевод с небольшим шагом, используя привод пьезо.
- После того, как фидуциальное находится в фокусе, откройте верхнюю траекторию луча, блокируя нижний путь луча и довести верхнюю линзу объектива в фокус аналогичным образом. Монитор ширины фидуциального на дисплее компьютера для оптимальной фокусировки.
- Для правильной центрации, открытой в верхней и нижних траекторий лучей. Ручная регулировка верхнего объектива в то время как нижняя цель поддерживается на постоянном уровне, используя пару микро-тонкой установочных винтов, пока фидуциальные изображения не накладываются друг на друга настолько близко, насколько это возможно, в идеале в пределах одного пикселя.
- Затем выполнить точную настройку так, что фидуциальные изображения в шаге 2.3 перекрытия в пределах одной десятой EMCCD пикселя. Отрегулируйте верхнюю2-осевой пьезо монтажа зеркал с помощью программного обеспечения управления, удерживая обе объективы и нижней отражения зеркал постоянным. Сравните центры реперные верхних и нижних объективных взглядов с помощью дисплея компьютера для управления процессом.
3. Калибровка установки iPALM
Примечание: Поскольку флуоресцентное излучение некогерентно, за помех , которые должны соблюдаться в iPALM, путь длины через верхний и нижний цели должны быть близки друг к другу, в пределах нескольких микрон. Это может быть достигнуто следующим образом:
- С помощью лазеров на, камеры непрерывно потоковое, и обе верхние и нижние пути лучей открытыми, вибрировать держатель образца Z-пьезоэлемент с использованием синусоидальной формы напряжения, генерируемого программным обеспечением управления для непрерывной Z-оси колебаний по величине 400 нм ,
- Пользуясь тем, что, когда из оптимального выравнивания, фидуциальные интенсивность мало меняется с тон колебаний, вручную перевести моторизованный узел луча сплиттер вверх или вниз до интенсивности отправных колеблется из-за требуемого однофотонной эффекта интерференции. Это означает тесное согласование оптических длин путей. Отношение пика к долине> 10 может быть достигнуто в оптимальных случаях (рис 1D).
- Для того, чтобы гарантировать, что и амплитуда и фаза на каждой поверхности как можно более равномерным по полю, отрегулируйте нижнее зеркало узла светоделитель небольшими шагами для точной настройки зазора и углов наклона. Выполните расщепитель лучей точное выравнивание путем перевода образца в 8 нм Z-шагом более 800 нм.
- Монитор фидуциальные интенсивности среди камер # 1 - 3. Отрегулируйте высоту, положение и наклон нижнего зеркала в сборке светоделитель небольшими шагами, таким образом, что фаза колебаний камеры # 1 по отношению к камере # 2 развернуто, в идеале при 120 ° (рис 1B-D).
- Как только начальнаявыравнивание будет завершено, перевести образец для поиска подходящего поля зрения, которое содержит клетки к образу и нескольких реперных поблизости. Поместите кожух вокруг системы, чтобы блокировать посторонний свет и окружающей среды возмущения. После того, как область формирования изображения найдены, выполните процедуру, описанную в шаге 3.4 снова, и записывают кривую калибровки для использования в последующих Z-координат извлечений с помощью команды "Приобретать калибровки Сканы против образца Piezo Позиция" в главном интерфейсе.
4. Сбор данных
- После того, как желательное область найдена и получена калибровочную кривую, введите соответствующие имена файлов в программное обеспечение. Откройте обе верхние и нижние пути луча. Увеличение мощности возбуждения на 642-нм лазера до максимума. Для Alexa Fluor 647, начальный период флуорофора отключения может потребоваться (рис 2А).
- не выставляют с постоянной 642 нм возбуждения в течение 5 мин или дольше, если это необходимо, до тех пор, сиngle молекула мигания наблюдается (рис 2В). Программное обеспечение позволяет автоматическое увеличение 405 нм фотоактивации в процессе приобретения. Большое количество кадров сбора, как правило, требуется для нитевидные возможности быть четко виден (> 50000 кадров). Когда все будет готово, начать приобретение сырья наборов изображений с помощью команды "Start iPALM получения снимка" в главном интерфейсе.
- Во время приобретения, настройка уровня фотоактивация путем регулировки интенсивности 405 нм лазера для поддержания надлежащего мигающего плотности по мере необходимости (см примеры на рисунке 2B).
Примечание: После приобретения завершен, программа будет автоматически конвертировать файлы изображений в соответствующий двоичный формат. Хранилище данных на сервере вычислений устанавливается в качестве сетевого привода, позволяя данным быть скопирован там для дальнейшей обработки.
5. Обработка данныхи анализ
- Выполнить анализ локализации с помощью пользовательских разработанного программного обеспечения для извлечения наилучшего соответствия параметров для всех одиночных молекул, а также для реперных 11,15,23. Это дает не только х, у-координаты, но и интенсивность, которая используется для анализа калибровочной кривой.
- Импорт необработанных данных калибровки, полученных на этапе 3.5 с помощью команды "Извлечь Пикс несколько ярлыков" в меню "Файл", чтобы выполнить локализацию в одной молекуле. После первоначального анализа локализации, координаты получены из камер # 1 - 3 присутствуют в красном, зеленом и синем каналах, соответственно, и могут быть сохранены для дальнейшего анализа с помощью команды "Сохранить Обрабатываются как IDL (.sav)" под " меню Файл ".
- Для того, чтобы перенести данные из камеры № 1 - 3 в регистрации с использованием флуоресцентных реперные внедренные на покровные, выберите несколько ярких реперные , чтобы обеспечить покрытие центрального образа (например,Рисунок 1B) с помощью команды "Якорь фидуциального Точки" в меню "Image" Трансформации. Используйте тройные наборы локализации координат из камер # 1 - 3, полученной из ярких реперные на шаге 5.1 для вычисления поворота и масштабирования матрицы, которая приведет камеры # 1 и # 3 в регистр с камерой # 2. При достаточно большом количестве реперные, полиномиальное деформирование высшего порядка могут быть выполнены для лучшего припадков.
- После того, как матрица преобразования вычисляется, преобразование исходных данных камер # 1 - 3 вместе, чтобы получить суммированные исходных данных. Выполните еще один раунд анализа локализации, чтобы получить более точные х, у-координаты и определить относительный вклад каждого канала камеры к суммарному необработанных данных; используйте команду "Преобразовать RAW, Сохранить и Сохранить Sum (.dat)" в меню "Image" Трансформации. Это отношение интенсивности содержит информацию о Z-координаты.
- Выберите яркую фидуциального и выполнить Z-Калибровка установки с помощью функции "Test Wind Точка 3D" во всплывающем диалоге, нажав кнопку "Z-координате Операции" в меню "специальных функций". Это будет соответствовать 3-синусоидальной функции интенсивностей 3 каналов камер для определения калибровочной кривой. Файл калибровки затем сохраняется для дальнейшего использования на основных наборах данных.
- Чтобы проверить качество калибровочной кривой, выполнить Z-координате экстракции, как описано ранее 23. Для хорошо вели себя реперные в хорошо калиброванной системе Z-координата должна линейно масштабировать, так как калибровочные наборы данных принимаются с линейной разверткой в г-м положении. Кроме того, г-позиции всех реперных должны масштабировать с аналогичным наклоном.
- После удовлетворительной калибровки получается, выполнить локализацию и анализ преобразования для необработанных наборов данных изображения, полученных на этапе 4 следующий же процедуре, описанной в пунктах 5.1-5.3. Когда это сделано, загрузите файл калибровки с шага 5.4 и выполнить Z-координате экстракции с использованием функции "Pick Wnd Файл" и "Извлечь координаты Z" в всплывающем диалоговом окне, нажав кнопку "Z-координате Операции" в меню "специальных функций".
Примечание: Так как время приобретение> 15 мин, механическая дрейф следовало ожидать. - Для выполнения коррекции дрейфа по х, у, выберите яркую фидуциального от координат локализации. Этот фидуциальный должен присутствовать во всех кадрах. Затем, с помощью х, у-координату дрейф нормирующего выровнять все другие координаты в пределах одного кадра обратно в регистрации (Рисунок 3A-B) с помощью функции "Test / Write Guide Star" в меню "Image" Трансформации. регистрация Z-координата может быть выполнена аналогично путем доступа к "Test Guide Star" и "Записать Guide Star" функции во всплывающем диалоге, нажав кнопку "Z-координате Операции" в меню "специальных функций".
- По мере того как образец может демонстрировать небольшой наклон, выполнить коррекцию наклона, предоставляя х, у, Z-координаты 3 опорных точек, определяющих плоскость, которая должна быть установлена уровень с помощью функции "Удалить XYZ Tilt" в всплывающем диалоговом окне, нажав кнопку " Z-координате Операции "под" меню специальных функций ".
- После дрейфа и наклона поправок, сохранить координаты локализации. Реконструировать супер разрешение изображения для дальнейшего анализа (рис 4A-D) с помощью команды "визуализацией" на главном интерфейсе. Цвет может быть использовано для обозначения Z-координат. В качестве альтернативы, вид сбоку выделенной области также могут быть оказаны. Координаты локализации могут быть экспортированы в виде текстовых файлов для дальнейшей количественной оценки, или реконструированное изображение может быть сохранено в виде файла в формате TIF.
Результаты
Критические требования к iPALM являются выравнивание, регистрация и калибровка оптических систем. Они необходимы для обеспечения надлежащего вмешательства в течение 3-х ходового светоделитель реквизита для Z-координате экстракции. Для обеспечения непрерывного мониторинга, постоянные точечные источники флуоресценции необходимы. Это может быть достигнуто с помощью флуоресцентного Au или биметаллической наночастицы 23 , чьи фотолюминесценции возникают из локализованного поверхностного плазмонного резонанса (LSPR). Они действуют в качестве стабильного одного диполя при освещении и может, как правило, быть локализована с 5 - точностью 10 нм. Эти коммерчески доступные наночастицы излучают уровень яркости в диапазоне от большинства одиночных молекул флуорофоров, таким образом, что оба флуорофоры и реперные могут быть визуализируют с помощью сходный интенсивностях возбуждения и настройки коэффициента усиления от EMCCD камер, без насыщения (Фигура 1В). Кроме того, эти реперные также сильно FACilitate фокусировки, причем видимая ширина реперные можно контролировать во время регулировки фокуса. Кроме того, строгие очистка поверхности покровного стекла, например, с помощью Piranha травления или плазменной очистки, также необходимо, так как паразитный фон флуоресценции неочищенных или плохо очищенных coverglasses могут легко подавить сигналы одной молекулы, как описано выше.
iPALM опирается на многофазных интерферометрии, чтобы дать возможность высокоточной г-измерения координат одновременно с PALM (для х, у). В приборе iPALM, каждый испускаемый фотон флуоресценции можно рассматривать как распространяться через оба оптических путей, которые затем самостоятельно вмешиваются в пользовательском панельном 3-ходовым расщепитель луча. Z-координата, таким образом, закодированной в фазе вмешивались фотона. Взаимное разности фаз ~ 120 ° выходных лучей от 3-х ходового результате светоделитель в изменение интенсивности изображений одной молекулы между 3 Camerа, что позволяет г - координата экстракции из калибровочной кривой. Исходя из этого, держатель образца сборки iPALM является одним из основных компонентов, так как он оснащен парой пьезоэлектрических исполнительных, которые позволяют нм точности перевода в Z, который можно использовать для выравнивания и калибровки.
При правильном фокусе и выравнивание, перевод образца вдоль оси будет генерировать эффект интерференции. Это проявляется как колебания фидуциального интенсивности между тремя каналами камер (рис 1C-D). Эти колебания также показывают, что как верхний и нижний пути оптического луча, которые почти совпадают, что позволяет однофотонной интерференции. Как правило, при включении прибора, начальные фазы каждой камеры не будет оптимальным и сканирование г-позиции необходим в качестве диагностического инструмента для калибровки и выравнивания. Для того, чтобы прибыть в оптимальных фаз, нижний зеркало светоделителе(Рисунок 1А) можно регулировать с помощью пьезоэлектрического стадии наклонов. Калибровка сканирования г-позиции берется после каждого небольшого 10 - 20 нм регулировки. Интенсивность фидуциальные в каждом канале затем определяется с помощью анализа локализации (то есть фитинг с 2D-функцией Гаусса). Интенсивность нормирована суммарной интенсивности можно приблизить синусоидальной формой волны, что позволяет термин фазы необходимо рассчитать; Таким образом, фаза , соответствующая каждой камеры может быть определена, как показано на фиг.1С. Отметим, что принцип интерференции однофотонной используемый в iPALM также может быть продемонстрирована с помощью значительно более простой 2-полосная расщепитель луча. Тем не менее, светоделитель 2 артерией является непрактичным для 3D суперразрешением микроскопии, так как на уровне или вблизи предела деструктивной интерференции, сигнал в одном канале минимальна, в результате чего в зашумленных оценок интенсивности и локализации координат, которые эффективно ограничивают Z-координату определение к звенеле, когда обе камеры имеют значительную интенсивность (<100 нм). Минимальное число каналов , необходимых для преодоления этого эффекта три, и 3- и 4-ходовые проекционные системы были описаны в литературе 11,30.
При оптимальных условиях, для светоделителе 3-полосная, фазовые различия между 3 камерами должна быть около 120 °. Светоделитель 3-путь для iPALM содержит 3 отражательные интерфейсы, как показано на схеме на рисунке 1А. Расщепитель луча расположен над плоской диэлектрического зеркала, с тонким промежутком, заполненным преломления синхронизма масла, чтобы обеспечить тонкую регулировку длины пути в пределах светоделитель и для достижения оптимальных разности фаз. Как показано на рисунке 1C-D, на надлежащее выравнивание для iPALM, камеры близки к разности фаз взаимной 120 °. На практике разница больше, чем 105 ° фаза, как правило, приемлемо. Такая калибровка и Indicates, что система хорошо выровнены и что он будет использоваться для последующего Z-координате экстракции. Это также полезно для оценки калибровочной кривой генерируется с использованием различных реперных. Большинство реперные с умеренной яркостью в целом выделяют в виде одного диполя, что дает хорошо вели себя калибровочные кривые. Тем не менее, иногда агрегаты реперные (часто те с особой яркостью) может вести себя аномальным образом, что дает ненадежные калибровочные кривые. Кроме того , целесообразно выбирать реперные вблизи центра поля изображения и вблизи области биологического интереса (рис 1B), особенно в связи с высокой NA цели объектив , используемый в установке iPALM не плоского поля корректируется. Эффективный вид поля из-ограничена центральной области, очевидно из больших отправных ширины к краю поля.
После первоначального выравнивания, вид полей из-содержащих клетки с желательной моrphology и несколько реперных для обеспечения хорошей калибровки выбираются для работы с изображениями. Это может быть достигнуто путем медленного перевода держатель образца с помощью сервоприводах 2-оси. Перевод образца приведет к некоторому расфокусировки, поскольку образец не всегда идеально ровной. Таким образом, фокус должен быть постоянно корректируются в процессе перевода. После того, как поле изображения было выбрано, еще один раунд калибровки для оптимизации калибровочной кривой затем проводится для точной настройки выравнивания системы и получить фактическую кривую калибровки. Важно отметить, что площади под ядра или вблизи областей с гетерогенной показателя преломления (например, воздушные пузырьки) следует избегать в целом, так как это вызовет значительное изменение относительной длины пути, искажая Z-координаты.
При маркировке высокой плотности, сигналы флуоресценции от органических флуорофоров, таких как Alexa Fluor 647 может быть очень ярким. Как показано Iп Рисунок 2А, с надлежащей подготовки буфера , содержащего высокую концентрацию тиольных (-SH) групп 31, флуорофор должен быть быстро выключается при высокой освещенности возбуждения. Это приводит к подавлению сигналов флуоресценции от большинства молекул. На данном случае, очень небольшое меньшинство флуорофоров стохастически вернуться в состояние «включено». Ожидается, что они будут редко распределены и таким образом могут быть визуализированы в виде отдельных молекул для одного или нескольких кадров перед переключением "выкл." Динамика photoswitching сильно зависит от интенсивности возбуждения и концентрации -SH, и, таким образом, для данной системы, необходимо позаботиться, чтобы оптимизировать нужную плотность маркировки, особенно в связи с относительно высокой интенсивности возбуждения (640 - 647 нм) необходимо отключить большинство молекул Alexa Fluor 647. Если возбуждение не является достаточно сильным, значительная часть Alex Fluor 647 волиостаются в состоянии «включено», что приводит к высоким фоном, трудности в наблюдении флуоресценции одиночной молекулы, и, в конечном счете, плохое качество одной молекулы результатов локализации. При правильно сбалансированном состоянии, одномолекулярной Необработанные данные должны содержать достаточно большое количество молекул (сотни) за кадр (Фигура 2В), в то время как каждая молекула достаточно редкой , чтобы обеспечить однозначное обнаружение и анализ локализации. Стоит также отметить, что для iPALM, принципы photoswitching идентичны таковым из пальмовых или STORM, и, таким образом, образцы должным образом подготовленные для iPALM могут быть непосредственно использованы на более простых 3D-PALM или 3D-STORM систем. Для того, чтобы получить достаточно высокую плотность молекул , чтобы удовлетворить Найквиста выборки, как правило , 50000 или более кадров необработанных данных требуются (т.е. 150000 общие рамки для 3 -х камер). По ходу приобретения, растущая доля флуорофоров может быть истощены в результате разрушительного фотообесцвечиванию, в результате чего шпатаSer плотность одной молекулы. Чтобы компенсировать это, короткие импульсы 405 нм синего света (405 нм) может быть освещен на образец через интервалы, способствуют активации флуорофора.
Из-за долгого времени приобретения необходимого, оптимальные результаты для iPALM (или одной молекулы локализации микроскопии в целом) требуют малого дрейфа образца и / или хорошей коррекции дрейфа. Например, используя время экспозиции 50 мс в режиме передачи кадров (частота кадров 20 Гц), общее время приобретения за 50000 кадров составляет 42 мин. В течение этого периода, механический дрейф в течение десятков нм, как ожидается. В самом деле, в дополнение к высокой точности локализации и высокой плотности маркировки, разрешение также зависит от качества коррекции дрейфа. Есть несколько происхождение этих заносов с тепловыми флуктуация является одной из основных причин. В связи с этим рассмотрение, где это возможно, iPALM детали на заказ с использованием механической обработке инвара, сплав низкий коэффициент теплового расширения, или из нержавеющей стали,оба из которых имеют значительно более низкие характеристики теплового расширения, чем медь или алюминий. К сожалению, это также накладывает дополнительные расходы по сравнению с алюминием, который является более широко используется металл для оптико-механических компонентов, будучи намного дешевле и проще в машине. Другие источники дрейфа могут быть механические вибрации от периферийного оборудования, условий окружающей среды, или воздушными потоками. Они должны быть сведены к минимуму путем размещения системы в соответствующем корпусе и перенаправляя направление воздушного потока в области микроскопа. Установка должна быть построена на оптическом столе исследования класса и, если это возможно, вентилятор, содержащий компоненты должны быть размещены вне оптического стола. Тем не менее, несмотря на все меры предосторожности, некоторое количество дрейфа останется. Критически, эти наносы должны быть сведены к минимуму таким образом, что изображение остается в центре внимания на протяжении всего времени приобретения. В наших системах эти пассивные методы достаточно, чтобы свести к минимуму дрейф до приемлемого уровня. Тем не менее, должна быть возможность реализовать активный дрейф комМетоды пенсации для того, чтобы в долгосрочной перспективе и высокой точности обработки изображений 32.
После обработки исходных данных, 3D-координаты локализации может быть получена с обычно 5 - 10 млн пиков одиночных молекул в наборе данных. Как показано на рисунке 3, дрейф в зависимости от времени может быть визуализирована по локализации координат реперных. Несколько реперные можно использовать для расчета средней траектории коррекции дрейфа (рис 3А-В). Кроме того, принято отфильтровать пиков, которые соответствуют плохо к функции 2D-Gaussian при анализе локализации. Это может быть из-за паразитных шумов или частично перекрывающихся пиков одной молекулы и может быть дифференцирована по большой остаточной квадратичной ошибки, рассчитанной в ходе процесса подгонки. Пики с низкой яркостью (как указано на число фотонов) и, таким образом, высокую степень неопределенности (то есть больше , чем ~ 25 нм) также фильтруется вне,х годов эти, вероятно, возникают из неспецифической фоновой флуоресценции. Аналогичным образом, пики, для которых интенсивности от 3-х каналов камеры подходят плохо к калибровочной кривой, также отклонены, поскольку Z-координаты, полученные ненадежны. Следует отметить , что полное содержание информации о iPALM (и локализации микроскопии в целом) имеет массовый характер , так как результаты анализа не только в координатах флуорофором, но и в нескольких дополнительных параметров , таких как интенсивность, ширина, яркость и т.д. Однако, на практике, поскольку относительно небольшое число вычислительных средств в настоящее время доступны для анализа в пространстве координат, координаты локализации, как правило, оказаны или реконструированы в пиксельных на основе изображений для дальнейшего анализа.
Общепринятый подход для реконструкции iPALM изображения является представление каждой локализации координат с нормированной 2D функцией Гаусса, с неопределенностью локализации, установленной в качестве Гауssian ширина 33. Таким образом, высокоточные координаты (обычно пики одной молекулы с высокой яркостью с низким уровнем фона) появляются как острые и узкие пики, в то время как с низким уровнем точности координат (как правило, низкая яркость или высокие фоновые пики одной молекулы) появляются как диммер и шире пики. Таким образом, каждая молекула вносит одинаковое количество интенсивности к изображению. Для 3D - набора данных, то Z-координаты могут быть представлены с использованием цвета, как правило , основаны на шкале цветовых тонов (рис 4C-D). В качестве альтернативы, изображения могут быть показаны как вид сбоку (х, г или у, г) проекции или в виде томов. Ряд публично доступного программного обеспечения может быть использован для визуализации таких данных 34.
Как показано на рисунках 4-6, iPALM изображения дают значительное улучшение по сравнению с дифракционной расходимостью флуоресцентной микроскопии. F-актин архитектура в клетках HUVEC можно визуализировать с гораздо улучшенной пространственной РЕСОлюция. В областях коры, сети различных нитей можно видеть, в то время как в стрессовых волокон, пучков и ламеллоподиях, наблюдаются плотно упакованные F-актин сети, чтобы иметь волокнистые текстуры, хотя отдельные волокна не отличаются. Это, вероятно, из-за ограничений в области как яркость флуорофоров и точность локализации. Наличие отдельных корковых волокон позволяет предположить, что ультраструктура F-актин сети достаточно хорошо сохранились; Таким образом, iPALM может быть полезным инструментом для характеристики кортикального архитектуры. На рисунке 5, субрегион клетки HUVEC отображается с профилями актин нити количественно. Можно видеть, что Z-гистограмма нити составляет около 15 нм в ширину, относительно мала по сравнению с ~ 45 нм для поперечной (х, у) точки зрения, показывая, что iPALM дает значительное увеличение разрешения в Z-разрешением по отношению к х, у-плоскости, как и ожидалось. Однако, так как ACTUаль диаметр ф-актина составляет ~ 8 нм, то неясно, является ли наблюдаемая нить представляет собой одиночную нить или пучок из нескольких нитей. Коррелятивное изображения с использованием iPALM и EM может быть полезной стратегией для дальнейшей характеристики F-актин архитектуры, хотя этот подход не был применен для изучения Ф-актина еще 23.
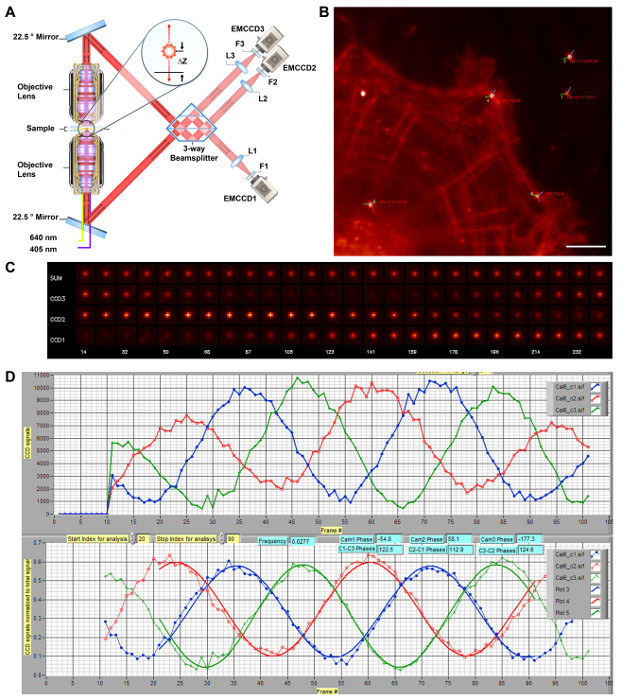
Рисунок 1: Принципиальная схема iPALM 3-D Super Resolution микроскопией. А) Схематическое iPALM оптики. Двойные объективы (Nikon, NA 1,49 60X) позволяют каждому излучается фотон флуоресценции распространяться как через верхнюю и нижнюю дорожкам оптического луча, и они перенаправляются вмешиваться в светоделителе парой зеркал, ориентированных на 22,5 °. Фаза автомодельного вмешивались фотона прямо пропорциональна δZ, таким образом, кодирующий г-координата флуорофора, и может быть измерена с намиING 3-полосная делитель луча с взаимной разности фаз ~ 120 ° между тремя выходными пучками. Они фокусируются трубными линз (L1-L3, F = 400 нм) и фильтруется фильтром эмиссии (F1 - F3). Каждая отдельная молекула поэтому появляется с различной интенсивностью между камерами (EMCCD1-3) , но в подобных х, у-координат. (А) воспроизводится и модифицирована из работы. 11. (В) Ограниченное дифракцией изображение клеток HUVEC , меченных для ф-актина с Alexa Fluor 647. Яркие пятна означают Au наночастицами реперные. Фазовые углы для камер # 1 - 3 представлены красными, зелеными и синими линиями, соответственно, в центре на каждом фидуциального, с разностью фаз между камерами # 1 - 3 указанного. Шкала бар:. 5 мкм (C) Исходные изображения , показывающие интерференционных эффектов. Изображения с наночастицами Au фидуциального для каждой камеры (CCD1-3) или полной (сумма), взятой в качестве г-положении (в нм, в нижнем ряду) сканируется для калибровки. Интенсивность в еач камеры можно увидеть вибрировать с фазовым соотношением, как показано в (B). калибровочной кривой (D) iPALM. Образец переводится вдоль оси. Интенсивности с наночастицами Au фидуциального для EMCCD1-3 являются шоу как красные, зеленые, и синие линии, соответственно (вверху). Затем они нормированы и подходят для определения разности фаз (внизу). Во время выравнивания, система регулируется для достижения максимальных разности фаз между всеми тремя камерами. Калибровочная кривая берется на каждом участке формирования изображения для использования при добыче г-координата каждой отдельной молекулы. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2: Single Molecule Визуализация Photoswitching Alэкса Fluor 647-фаллоидином в актиновых Ярлыки. (A) Начальный этап photoswitching. F-актина в клетках фиксированных помечена при высокой плотности фаллоидином , конъюгированного с Alexa Fluor подсветкой 647. высокой интенсивности в тиолсодержащим приводит буфер изображения в быстром отключении большинства флуорофоров. (В) Представительные кадры сырого одномолекулярной кадры. При стационарном миганием, активированный Alexa Fluor 647 должны быть достаточно редкими, что отдельные одиночные молекулы появляются как ФСФ размера пятна. Изображения тех же клеток, показанных на (A), показанного с обратным контрасте. Шкала баров в А и В:. 5 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
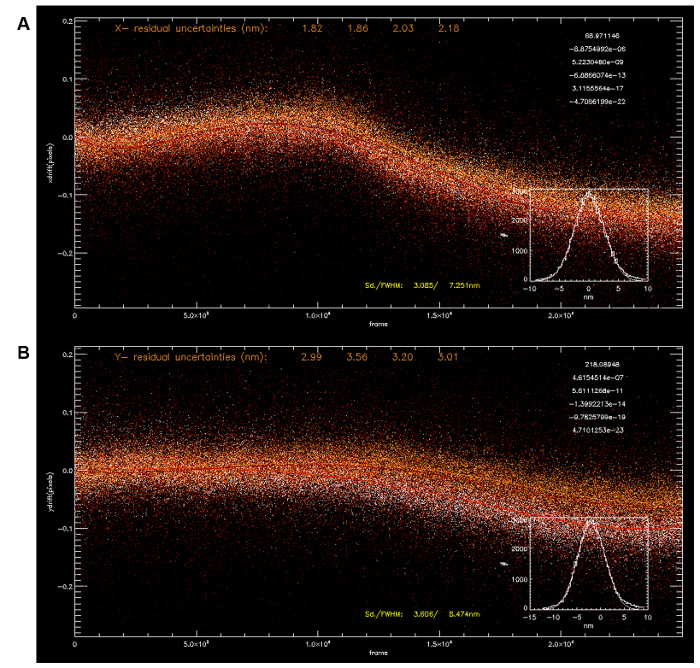
Рисунок 3: Дрейф Коррекция с помощью MULTIP. Le реперные Локализация координаты четырех реперных (А, х-координата; B, Y-координата) были использованы для расчета дрейфа с использованием полиномиальных арматуры (5 - го порядка, подходящие параметры в правом верхнем углу). Средняя траектория дрейфа позволяет коррекцию дрейфа с подп 5 нм точности (х: 3,085 нм, у: 3,606 нм). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
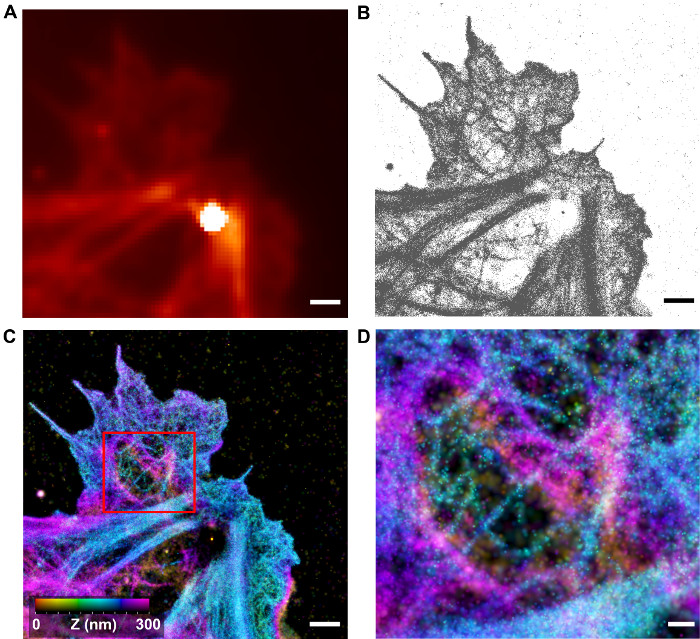
Рисунок 4: Визуализация 3-D F-актин архитектуру iPALM. (A) Ограниченное дифракцией изображение HUVEC клеток с Ф-актина , меченных Alexa Fluor 647-фаллоидином ( что соответствует подзонах ячейки на рисунке 2). Яркое пятно связано с наночастицами реперные Au. (B) Локализация координат определяется с помощью анализа iPALM для области в (A). (С) Реконструированный iPALM изображения, при каждой локализации координате вынесенное 2D-Гаусса с шириной , соответствующей неопределенности локализации. Г-координата окрашена в соответствии с цветовой шкалы. Области плотных и разреженных нитевидных особенностей можно увидеть. Масштабные бары (AC): 1 мкм (D) Увеличение в связи с коробочной области в С показывая волокнистый корковой топологию актина.. Шкала бар:. 250 нм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5: Наномасштабная Размер Ф-актина визуализировали iPALM. (A) Реконструированный iPALM изображения HUVEC клетки с F-актин меченого б у Alexa Fluor 647-фаллоидином. Цвет указывает на то, Z-координата в соответствии с цветовой шкалы. Шкала бар:. 1 мкм (Б) Поперечное сечение гистограмма х, у-координаты локализации вдоль длинной оси коробочной области в (а). Чтобы получить гистограмму, координаты проецируются на длинной оси коробки и Binned с 5 нм бен-размера. Серая кривая показывает Gaussian наилучшее соответствие гистограмме, с полуширина (FWHM) от 43,88 нм. (С) Гистограмма г-положении локализации координат в коробочной области в (А). Z-позиции Binned с размером бен 1 нм. Серая кривая показывает Gaussian наилучшее соответствие гистограммы, с полушириной 17.50 нм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
/files/ftp_upload/54774/54774fig6.jpg "/>
Рис . 6: Сравнение iPALM изображений Ф-актина с использованием различных Маркирование Реагенты Реконструированный iPALM изображения Ф-актина помечается с помощью Alexa Fluor 647-сопряженную фаллоидина (A), Alexa Fluor 568-сопряженную фаллоидина (B), или путем трансфекции с актином экспрессия белка вектор -mEos2 фьюжн (С). Масштабные бары (AC):. 1 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Оптическая система iPALM основана на 4-П двойственной оппозитных объективном конструкции, как показано на рисунке 1А. Установка построена с использованием как специально обработанную и коммерческие оптико-механические части, как описано ранее 23 и приведены в таблице 1. В дополнение к нашей установке Медицинского института Говарда Хьюза (HHMI) принимает систему, которая является доступной для научного сообщества на Advanced Imaging Center в университетском городке Janelia Research. Для получения полных механических чертежей, схем управления и программного обеспечения, читателям рекомендуется спросить с Харальдом Гесса в HHMI для получения дополнительной информации. Основное преимущество использования iPALM, а также другие методы локализации микроскопии одиночных молекул для визуализации Ф-актина является относительная простота подготовки образца по сравнению с методами EM, которые обычно требуют суровой обработки образцов, кропотливой подготовки, а также высококвалифицированных специалистов - практиков 3,23 , Additionallу, флуоресценция естественно поддаются многоканальной визуализации, которая остается трудным для EM. Тем не менее, как описано далее, существуют некоторые ограничения тока для подхода, как с точки зрения подготовки образцов и процесса формирования изображения. Во- первых, как это имеет место для подготовки EM образца, необходимо соблюдать осторожность , чтобы обеспечить хорошее ультраструктурную сохранение образцов 35, так как протокол адекватной для дифракционной уровнем разрешения может вызвать серьезные возмущения на уровне наноразмерных. Для визуализации актина, правильная фиксация клеток является важным фактором, влияющим на качество образца. Глютаральдегид является предпочтительным закрепителя, поскольку она сохраняет цитоскелета и мембраны очень хорошо, но в случае совместного окрашивания с антителами, эпитоп-сайты могут быть затронуты. В таких случаях, параформальдегид может предложить приемлемый компромисс, поскольку она имеет тенденцию к лучшему сохранению антител участки эпитоп. Важно для одной молекулы локализации микроскопии, эти фиксаторов, как правило,для создания фона аутофлюоресценция; Таким образом, после фиксации закалка боргидридом необходимо, в частности, в случае глутаровый альдегид.
Кроме того, правильный выбор флуорофоров и стратегий маркировки являются одними из наиболее важных факторов для успешных экспериментов. Благодаря наноразмерного размерности Ф-актина, высокие плотности меток необходимы , чтобы захватить основные нитевидные сети, как это предусмотрено по теореме Найквиста 36. Для актина, фаллоидином позволяет маркировки очень высокой плотности, с широким диапазоном органических флуорофоров приобрести у многих производителей. Однако, поскольку фаллоидином является токсичным, фиксация клеток и пермеабилизации требуется. Альтернативные стратегии для живых клеток маркировки совместимых актина включают в себя использование слияние флуоресцирующих белков (FP), либо с мономерного актина или с небольшими актин-связывающих полипептидов. Тем не менее, мы обнаружили, что они имеют тенденцию давать более низкую плотность маркировки по сравнению с фаллоидином ( Рисунок 6). Отметим , что очищенный актин может также быть непосредственно помечены органическими флуорофоров и введены в живые клетки с помощью электропорации 37, но такой подход , как ожидается, будет дорогостоящим и трудоемким. С точки зрения флуорофоров, Alexa Fluor 647, как было обнаружено, чтобы предложить стабильно хорошие показатели для локализации микроскопии. Это может быть описано в терминах отношения-контрастного яркости соотношени между одной молекулой пика и фоновой флуоресценции 38. Более высокая плотность маркировки требует более высокий коэффициент контрастности, так как фон может кумулятивно ухудшить точность локализации. По нашему опыту, некоторые другие флуорофоры, такие как ATTO488, ATTO520 и Alexa Fluor 568 (рис 6В), может быть использован для визуализации Ф-актина, хотя и с менее стабильные результаты по сравнению с Alexa Fluor 647, который предлагает надежную производительность photoswitching через широкий диапазон буферных условий формирования изображения.
С точки зрения процесса формирования изображения, ограничения в биологических методов визуализации часто осмысляется как компромисс в пространственным разрешением, временным разрешением и диапазоном изображений (оба поля-обзора / глубины резкости и продолжительность) 39. Это в равной степени относится к преимуществам и ограничениям iPALM. По сравнению с другими 3-мерных супер методов разрешения микроскопии, iPALM остается самым высокооплачиваемым разрешающую оптический подход на сегодняшний день, особенно вдоль оси г, с г-разрешением почти в 2 раза лучше , чем х, у разрешением 11. Тем не менее, зависимость от iPALM на интерферометрии для высокого разрешения г также накладывает ограничение на глубину изображения, так как кривая калибровки является периодическим. Другими словами, Z-координаты повторяют каждые 250 нм или около того (для ~ 700 нм длины волн излучения от Alexa Fluor 647). На практике эту проблему можно решить с помощью TIRF освещения, которая ограничивает зону возбуждения в пределах затухающих глубины поля <200 нм от покровного стекла. Таким образом, флуорофоры глубже в образец не возбуждаются и остаются невидимыми. Тем не менее, это также ограничивает биологические структуры, которые могут быть отображены для тех, в непосредственной близости от покровного стекла, такие как узловые спаек, кортикального цитоскелета и вентральной плазматической мембраны, в то время как более внутренние структуры находятся вне досягаемости. Для неподвижного образца, одно средство для выполнения cryosectioning 40. Тем не менее, такой подход является весьма трудоемким и требует специальных знаний, который не является широко доступным.
В качестве альтернативы, iPALM может быть адаптирован для расширенного г диапазона путем комбинирования интерферометрии с астигматизмом-расфокусировка схеме 12 , используемой в 3D-штормом. Такой подход обеспечивает двойную Z-координата отсчеты, первая по интерферометрии, которая с высокой точностью, но периодическим, а второй астигматизма расфокусировки, который является менее точным, но непериодическая. Последний затем может быть использован для "разворачивать" или разорвать вырожденностьинтерферометрические Z-координаты, что позволяет утроение глубины изображения iPALM до ~ 750 нм, эффективно приближаясь к внутренней глубины очага высоких объективов NA. С Развертка фазы, iPALM использовалась для структуры изображения глубоко в образцах, таких как митохондрии, хотя и с немного пониженной точностью во всех 3 -х измерениях из - за дополнительного расфокусировка 40.
Другой внутреннее ограничение iPALM является скорость формирования изображения. Так как большое количество кадров, необходимых для получения высокой плотности координат локализации, скорость камеры, как правило, ограничение по скорости сбора данных. С учетом современных камер EMCCD движется со скоростью 10 - 20 МГц скоростей считывания, десятки минут требуется для достаточного количества кадров. Такие временные шкалы требуют, чтобы образец фиксировано. Здесь, последние достижения в области технологии камеры, такие как гораздо быстрее научного комплементарный металло-оксид-полупроводник (sCMOS) камеры, может позволить быстрое увеличение имскорость старения 41, хотя это не было реализовано для iPALM еще. Для некоторых одиночных молекул локализации микроскопии подходов, плотное поле одной молекулы могут быть проанализированы с использованием модифицированного алгоритма 42 или сжат зондирования 43. Адаптация таких стратегий может также ускорить iPALM, позволяя более плотные изображения одиночных молекул и, следовательно, меньшее количество кадров.
С ограничениями по скорости и визуализации диапазона и сильные стороны в пространственным разрешением, основное применение для iPALM является как ультраструктурным метод , который использует преимущества флуоресцентной маркировки , чтобы раскрыть наноразмерных организации специфических белков 14,15,44. Дальнейшее улучшение, как с точки зрения оптики и флуорофором технологий, должна обеспечить возможность дальнейшего усиления пространственного разрешения iPALM. Например, обработка изображений iPALM в настоящее время использует относительно простой первого порядка аппроксимации подход, с каждой отдельной молекулой, моделируемого в 2D-Gaussian функции и, кактаются быть изотопно усредненная диполь. Это может быть дополнена новейшими методами, которые используют более точную модель функции ФРТ и ориентации диполей или явной обработки оптических аберраций по всему полю зрения, чтобы значительно улучшить пространственное разрешение. Точно так же, photocaging сообщалось, что повышает яркость флуорофора на несколько порядков 45. Действительно, так как ключевые элементы их ультраструктурным организации были хорошо охарактеризованы, F-актин цитоскелета может быть очень ценной моделью системы для тестирования дальнейших методологических разработок в iPALM. Умение анализировать организацию белка с помощью световой микроскопии с истинным EM уровня разрешающей способности, как ожидается, значительно улучшить наше понимание бесчисленных аспектов клеточной структуры и функции.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
YW и PK выражают глубокую признательность финансовую поддержку Сингапурского Национального исследовательского фонда, присужденной PK (СРН-NRFF-2011-04 и NRF2012NRF-CRP001-084). Мы также благодарим MBI открытые лаборатории и основные микроскопию средства для поддержки инфраструктуры.
Материалы
| Name | Company | Catalog Number | Comments |
| optical table | Newport, CA | RS4000 | iPALM, installed on 4 Newport Stabilizer vibration isolators |
| vibration isolator for optical table | Newport, CA | S-2000 | |
| laser-642 | Newport, CA | 1185055 | output power=100 mw |
| laser-561 | Newport, CA | 1168931 | output power=200 mw |
| laser-488 | Newport, CA | 1137970 | output power=200 mw |
| laser-405 | Newport, CA | 1142279 | output power=100 mw |
| broadband dielectric mirrors | Thorlabs, NJ | BB1-E02 | laser combiner |
| dichroic beamsplitter | Semrock, NY | LM01-427-25 | |
| acousto-optic tunable filter | AA Opto-Electronic, France | AOTFnC-VIS-TN | |
| Linear polarizer | Newport, CA | 05LP-VIS-B | |
| baseplate | local workshop | customized | |
| turning mirror (22.5°) | Reynard Corpporation, CA | customized | 22.5° mirror |
| motorized optic mounts | New Focus, CA | 8816 | |
| motorized XYZ translation stage | Thorlabs, NJ | MT3/M-Z6 | sample holder |
| T-Cube DC servo motor controller | Thorlabs, NJ | TDC001 | |
| Piezo Phase Shifter | Physik Instrumente, Germany | S-303.CD | |
| objective lens | Nikon, Japan | MRD01691 | objective. Apo TIRF 60X/1.49 oil |
| translation stage | New Focus, CA | 9062-COM-M | |
| Pico Motor Actuator | New Focus, CA | 8301 | |
| rotary Solenoid/Shutter | DACO Instruments, CT | 5423-458 | |
| 3-way beam splitter | Rocky Mountain Instruments, CO | customized | beamsplitter |
| Piezo Z/Tip/Tilt scanner | Physik Instrumente, Germany | S-316.10 | |
| motorized five-axis tilt aligner | New Focus, CA | 8081 | |
| Picmotor ethernet controller | New Focus, CA | 8752 | |
| Piezo controllers/amplifier/digital operation module | Physik Instrumente, Germany | E-509/E-503/E-517 | |
| band-pass filter | Semrock, NY | FF01-523/20 | filters |
| band-pass filter | Semrock, NY | FF01-588/21 | |
| band-pass filter | Semrock, NY | FF01-607/30 | |
| band-pass filter | Semrock, NY | FF01-676/37 | |
| notch filter | Semrock, NY | NF01-405/488/561/635 | |
| motorized filter wheel with controllter | Thorlabs, NJ | FW103H | |
| EMCCD | Andor, UK | DU-897U-CSO-#BV | 3 sets |
| Desktop computers for controlling cameras and synchronization | Dell | Precision T3500 | PC, 4 sets |
| coverslips with fiducial | Hestzig, VA | 600-100AuF | sample preparation. fiducial marks with various density and spectra available |
| fibronectin | Millipore, MT | FC010 | |
| paraformaldehyde | Electron Microscopy Sciences, PA | 15710 | fixation. 16% |
| glutaraldehyde | Electron Microscopy Sciences, PA | 16220 | 25% |
| triton X-100 | Sigma aldrich, MO | T8787 | |
| HUVEC cells | Life Technologies, CA | C-015-10C | |
| Medium 200 | Life Technologies, CA | M-200-500 | |
| Large Vessel Endothelial Factors | Life Technologies, CA | A14608-01 | |
| Dulbecco's Phosphate Buffered Saline | 14190367 | ||
| Pennicillin/Streptomycin | 15140122 | ||
| Trypsin/EDTA | Life Technologies, CA | 25200056 | |
| PIPES | Sigma aldrich, MO | P1851 | PHEM |
| HEPES | 1st base, Malaysia | BIO-1825 | |
| EGTA | Sigma aldrich, MO | E3889 | |
| MgCl2 | Millipore, MT | 5985 | |
| Alexa Fluor 647 Phalloidin | Invitrogen, CA | A22287 | staining |
| sodium borohydride (NaBH4) | Sigma aldrich, MO | 480886 | quenching |
| glucose | 1st base, Malaysia | BIO-1101 | imaging buffer |
| glucose oxidase | Sigma aldrich, MO | G2133 | |
| catalase | Sigma aldrich, MO | C9322 | |
| cysteamine | Sigma aldrich, MO | 30070 | |
| Epoxy | Thorlabs, NJ | G14250 | |
| vaseline | Sigma aldrich, MO | 16415 | sample sealing |
| lanolin | Sigma aldrich, MO | L7387 | |
| parafin wax | Sigma aldrich, MO | 327204 | |
| Immersion oil | Electron Microscopy Sciences, PA | 16915-04 | imaging. Cargille Type HF |
Ссылки
- Kanchanawong, P., Waterman, C. M. Localization-based super-resolution imaging of cellular structures. Methods Mol Biol. 1046, 59-84 (2013).
- Bertocchi, C., Goh, W. I., Zhang, Z., Kanchanawong, P. Nanoscale imaging by super resolution fluorescence microscopy and its emerging applications in biomedical research. Crit Rev Biomed Eng. 41, 281-308 (2013).
- Kanchanawong, P., Waterman, C. M. Advances in light-based imaging of three-dimensional cellular ultrastructure. Curr Opin Cell Biol. 24, 125-133 (2012).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Heilemann, M., et al. Subdiffraction-resolution fluorescence imaging with conventional fluorescent probes. Angew Chem Int Edit. 47, 6172-6176 (2008).
- Sharonov, A., Hochstrasser, R. M. Wide-field subdiffraction imaging by accumulated binding of diffusing probes. P Natl Acad Sci USA. 103, 18911-18916 (2006).
- Fölling, J., Bossi, M., Bock, H., Medda, R., Wurm, C. A., Hein, B., Jakobs, S., Eggeling, C., Hell, S. W. Fluorescence nanoscopy by ground-state depletion and single-molecule return. Nat Methods. 5, 943-945 (2008).
- Biteen, J., et al. Single-moldecule active-control microscopy (SMACM) with photo-reactivable EYFP for imaging biophysical processes in live cells. Nat Methods. 5, 947-949 (2008).
- Shtengel, G., et al. Interferometric fluorescent super-resolution microscopy resolves 3D cellular ultrastructure. P Natl Acad Sci USA. 106, 3125-3130 (2009).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319, 810-813 (2008).
- Dani, A., Huang, B., Bergan, J., Dulac, C., Zhuang, X. Super resolution imaging of chemical synapses in the brain. Neuron. 68, 843-856 (2010).
- Liu, J., et al. Talin determines the nanoscale architecture of focal adhesions. P Natl Acad Sci USA. 112 (35), E4864-E4873 (2015).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468, 580-584 (2010).
- Wu, Y., Kanchanawong, P., Zaidel-Bar, R. Actin-delimited adhesion-independent clustering of e-cadherin forms the nanoscale building blocks of adherens junctions. Dev Cell. 32 (2), 139-154 (2015).
- Szymborska, A., et al. Nuclear Pore Scaffold Structure Analyzed by Super-Resolution Microscopy and Particle Averaging. Science. 341, 655-658 (2013).
- Lawo, S., Hasegan, M., Gupta, G. D., Pelletier, L. Subdiffraction imaging of centrosomes reveals higher-order organizational features of pericentriolar material. Nat Cell Biol. 14, 1148-1158 (2012).
- Mennella, V., Agard, D. A., Huang, B., Pelletier, L. Amorphous no more: subdiffraction view of the pericentriolar material architecture. Trends Cell Biol. 24, 188-197 (2014).
- Mennella, V., et al. Subdiffraction-resolution fluorescence microscopy reveals a domain of the centrosome critical for pericentriolar material organization. Nat Cell Biology. 14, 1159-1168 (2012).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463, 485-492 (2010).
- Salbreux, G., Charras, G., Paluch, E. Actin cortex mechanics and cellular morphogenesis. Trends Cell Biol. 22, 536-545 (2012).
- Shtengel, G., et al. Imaging cellular ultrastructure by PALM, iPALM, and correlative iPALM-EM. Method Cell Biol. 123, 273-294 (2014).
- Juette, M. F., et al. Three-dimensional sub-100 nm resolution fluorescence microscopy of thick samples. Nat Methods. 5, 527-529 (2008).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. 19, 555-565 (2009).
- Shannon, C. Communication in the presence of noise. Proc. IRE. 37, 10-21 (1949).
- Good, N. E., et al. Hydrogen ion buffers for biological research. Biochemistry. 5, 467-477 (1966).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophys J. 94, 1826-1835 (2008).
- Shin, W. D., et al. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Swedlow, J. R., Spector, D. L. , Cold Spring Harbor Laboratory Press. (2010).
- Aquino, D., et al. Two-color nanoscopy of three-dimensional volumes by 4Pi detection of stochastically switched fluorophores. Nat Methods. 8, 353-359 (2011).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nat Methods. 8, 1027-1036 (2011).
- Pertsinidis, A., Zhang, Y., Chu, S. Subnanometre single-molecule localization, registration and distance measurements. Nature. 466, 647-651 (2010).
- Baddeley, D., Cannell, M. B., Soeller, C. Visualization of Localization Microscopy Data. Microsc Microanal. 16, 64-72 (2010).
- El Beheiry, M., Dahan, M. ViSP: representing single-particle localizations in three dimensions. Nat Methods. 10, 689-690 (2013).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. Immunolabeling artifacts and the need for live-cell imaging. Nat Methods. 9, 152-158 (2012).
- Shroff, H., Galbraith, C. G., Galbraith, J. A., Betzig, E. Live-cell photoactivated localization microscopy of nanoscale adhesion dynamics. Nat Methods. 5, 417-423 (2008).
- Yamashiro, S., et al. New single-molecule speckle microscopy reveals modification of the retrograde actin flow by focal adhesions at nanometer scales. Mol Biol Cell. 25, 1010-1024 (2014).
- Shroff, H., et al. Dual-color super resolution imaging of genetically expressed probes within individual adhesion complexes. P Natl Acad Sci USA. 104, 20308-20313 (2007).
- Chen, B. C., et al. Lattice light-sheet microscopy: imaging molecules to embryos at high spatiotemporal resolution. Science. 346, (2014).
- Brown, T. A., et al. Super resolution fluorescence imaging of mitochondrial nucleoids reveals their spatial range, limits, and membrane interaction. Mol Cell Biol. 31, 4994-5010 (2011).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Daostorm, S. DAOSTORM: an algorithm for high-density super-resolution microscopy. Nat methods. 8, 279(2011).
- Zhu, L., Zhang, W., Elnatan, D., Huang, B. Faster STORM using compressed sensing. Nat Methods. 9, 721-723 (2012).
- Van Engelenburg, S. B., et al. Distribution of ESCRT machinery at HIV assembly sites reveals virus scaffolding of ESCRT subunits. Science. 343, 653-656 (2014).
- Vaughan, J. C., Jia, S., Zhuang, X. Ultrabright photoactivatable fluorophores created by reductive caging. Nat Methods. 9, 1181-1184 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены