Method Article
Tridimensionale Super Resolution Microscopia di filamenti di F-actina da interferometrico fotoattivati localizzazione Microscopy (iPALM)
In questo articolo
Riepilogo
Presentiamo un protocollo di applicazione del interferometrica fotoattivati localizzazione Microscopy (iPALM), un metodo di risoluzione di microscopia eccellente 3-dimensional localizzazione singola molecola, per l'imaging del citoscheletro actina in cellule di mammifero aderenti. Questo approccio permette la visualizzazione basata sulla luce delle caratteristiche strutturali nanoscala che altrimenti rimarrebbero irrisolti da convenzionale microscopia ottica di diffrazione limitata.
Abstract
Microscopia a fluorescenza permette la visualizzazione diretta di biomolecole specifici all'interno delle cellule. Tuttavia, per microscopia a fluorescenza convenzionale, la risoluzione spaziale è limitata dalla diffrazione a ~ 200 nm entro il piano dell'immagine e> 500 nm lungo l'asse ottico. Come risultato, la microscopia a fluorescenza è stata a lungo fortemente limitato nell'osservazione delle caratteristiche ultrastrutturali all'interno delle cellule. Il recente sviluppo di metodi di microscopia Super Resolution ha superato questa limitazione. In particolare, l'avvento di fluorofori photoswitchable permette al microscopio di risoluzione super di localizzazione basati, che fornisce potere di risoluzione si avvicina alla scala molecolare di lunghezza. Qui, descriviamo l'applicazione di un metodo di risoluzione di microscopia eccellente tridimensionale sulla base di singola molecola di localizzazione, microscopia ed interferometria multifase, chiamato interferometrica fotoattivati localizzazione Microscopy (iPALM). Questo metodo fornisce una risoluzione quasi isotropa sulladell'ordine di 20 nm nelle tre dimensioni. Protocolli per la visualizzazione del citoscheletro actina filamentosa, compresa la preparazione del campione e il funzionamento dello strumento iPALM, sono descritte qui. Questi protocolli sono facilmente adattabili e istruttivo per lo studio di altre caratteristiche ultrastrutturali nelle cellule.
Introduzione
La visualizzazione delle strutture cellulari complesse è stata a lungo parte integrante di dati biologici e la scoperta. Sebbene microscopia a fluorescenza può celle di immagine con alta specificità molecolare, il suo potere di risoluzione è limitata dalla diffrazione a ~ 200 nm nel piano immagine (x, y, o dimensione laterale) e> 500 nm lungo l'asse ottico (z, o dimensione assiale) 1,2. Pertanto, l'osservazione delle caratteristiche ultrastrutturali è stato storicamente limitato a microscopia elettronica (EM). Fortunatamente, il recente sviluppo della microscopia super-risoluzione ha aggirato questo limite, consentendo la risoluzione spaziale nel 10-100 nm gamma 1-6. In particolare, super risoluzione approcci basati sulla localizzazione singola molecola, nota con acronimi quali PALM (fotoattivati localizzazione Microscopy) 4, FPALM (Fluorescence fotoattivati localizzazione Microscopy) 5 (d) STORM (diretta Stochastic Optical Reconstruction Microscopy) 6,7, VERNICE ( Point accumulo per l'imaging Nanoscale Topografia) 8, GSDIM (giardino Stato Depletion Microscopia seguito dal ritorno molecolare individuale) 9, o SMACM (Single-molecola attiva-Control Microscopy) 10, così come le loro implementazioni in 3 dimensioni (3D), come ad esempio PALM interferometrica (iPALM) 11 o 3D-STORM 12, sono stati preziosi nel rivelare nuove intuizioni l'organizzazione su scala nanometrica di numerose strutture biologiche, tra cui gli assoni e sinapsi neuronali 13, adesioni focali 14,15, giunzioni cellula-cellula 16, pori nucleari 17 e centrosomi 18-20, solo per citarne alcuni.
Un'altra caratteristica ultrastrutturale nelle cellule per i quali la microscopia super-risoluzione è potenzialmente utile è il citoscheletro di actina. Il complesso reticolo di filamentosa (f) actina nella corteccia cellulare gioca un ruolo fondamentale nel controllo della forma cellulare e le proprietà meccaniche 21. L'organizzazione of f-actina è attivamente e dinamicamente regolata anche se numerose proteine regolatrici che influenzano fortemente la polimerizzazione, reticolazione, il fatturato, la stabilità e la topologia di rete 22. Tuttavia, anche se la caratterizzazione dell'architettura trabecolato f-actina è importante per intuizioni meccanicistici in una vasta gamma di processi cellulari, le piccole dimensioni (~ 8 nm) dei filamenti F-actina ostacola la loro osservazione convenzionale microscopia ottica diffrazione limitata; in tal modo, la visualizzazione di struttura fine actina è finora stata eseguita esclusivamente da EM. Qui, descriviamo i protocolli per la visualizzazione del citoscheletro F-actina in cellule di mammifero aderenti, utilizzando la tecnica di microscopia super-risoluzione iPALM per sfruttare la sua capacità di altissima precisione in 3D 11,23. Anche se lo strumento iPALM è altamente specializzato, istruzioni sulla creazione di un tale strumento è stato descritto di recente 23, mentre l'accesso al microscopio iPALM ospitato dalla Horeparto Hughes Medical Institute è stato messo a disposizione della comunità di ricerca con un costo minimo. Inoltre, i metodi di preparazione dei campioni descritti sono direttamente applicabili agli approcci alternativi 3D Super Resolution, come quelli basati su defocalizzazione astigmatica della funzione di diffusione di punto (PSF) 12 o bi-piano di rivelazione 24, che sono più ampiamente disponibili.
Notiamo che un ingrediente necessario per basati su localizzazione singola molecola di microscopia super-risoluzione, in generale, è il fluoroforo photoswitchable 25, che permette i tre requisiti fondamentali per la microscopia di risoluzione super-based localizzazione singola molecola per essere soddisfatti: i) ad alta singola molecola luminosità e contrasto rispetto a segnali di fondo; ii) la distribuzione sparsa di singole molecole in un determinato lasso di immagine; e iii) ad alta densità spaziale di etichettatura sufficiente per catturare il profilo della struttura sottostante (noto anche come Nyquist-Shacriterio di campionamento nnon) 26. Così, per ottenere risultati soddisfacenti, enfasi dovrebbe essere posta ugualmente sia la corretta preparazione dei campioni per ottimizzare fluoroforo photoswitching e per garantire la ultrastruttura sottostante, nonché sugli aspetti strumentazione e acquisizione degli esperimenti.
Protocollo
1. Imaging Preparazione dei campioni
- Dal momento che i segnali fluorescenza di fondo interferiscono con fluorescenza dalle etichette fluoroforo, pulire i vetrini dal primo risciacquo in acqua deionizzata (DDH 2 O) e quindi aria di essiccazione utilizzando aria compressa. Successivamente, eseguire attacco in plasma e un detersivo plasma per 15 secondi, o più, se necessario.
- Per abilitare la correzione della deriva e la calibrazione iPALM, usare # 1.5 rotondo (diametro 22 mm) vetrini pre-puliti integrati con nanoparticelle fluorescenti come punti di riferimento, che servono fiducials come altamente fotostabili per la calibrazione affidabile e la correzione della deriva. A causa del lungo tempo di acquisizione necessario per accumulare sufficiente densità fluoroforo (> 15 - 30 min), campione deriva è inevitabile.
- Posizionare ogni coprioggetti fiducialed in una piastra di coltura tissutale 6-bene. sterilizzare dalla radiazione ultravioletta (UV) in una cappa a flusso laminare per 15 min.
- In una cappa a flusso laminare sterile, preparare fibrosoluzione Nectin per il rivestimento coverglass diluendo 1 mg / ml soluzione madre fibronectina in tampone fosfato soluzione salina sterile Dulbecco (DPBS) ad una concentrazione finale 2 - 10 mg / ml. Sciacquare ogni coprioggetti tre volte con DPBS e incubare con 2 ml di soluzione di fibronectina notte a 4 ° C. Successivamente, aspirare la soluzione fibronectina e risciacquare una volta con DPBS.
- Lavare le cellule brevemente con DPBS. Incubare di 1 - 2 ml di tripsina per alcuni minuti a 37 ° C finché le cellule si staccano e spegnere con ~ 10 ml di mezzo di coltura cellulare contenente siero fresco. Ad esempio, per le cellule umane ombelicale vena endoteliali (HUVEC), usare grande terreno di coltura nave endoteliale integrato con grandi fattori nave endoteliali e la penicillina o streptomicina.
- Replate le cellule su coprioggetti fibronectina rivestite (per densità sparse, piastra di <50.000 cellule per coprioggetti) e mantenere la cultura in un incubatore a 95% di umidità, 5% di CO 2, e 37 & #176; C.
- Per una buona conservazione delle belle strutture del citoscheletro F-actina, utilizzare soluzioni tampone sulla base di buone reagenti tampone 27.
- Ad esempio, preparare tampone PHEM come soluzione 2x magazzino (120 TUBI mM, 50 mM HEPES, 20 mM EGTA, 4 mM MgCl 2, pH 7,0 con KOH) sciogliendo 6,5 g di HEPES, 3,8 g di EGTA, e 190 mg di MgCl 2 in ~ 300 ml di DDH 2 O, con il pH regolato a 7,0 per aggiunta goccia a goccia di soluzione di KOH concentrato; quindi, aggiungere DDH 2 O per portare il volume a 500 ml. Sterilizzare il buffer usando un filtro di 0,22 micron, conservarlo a 4 ° C, e diluire 1: 1 con DDH 2 O prima dell'uso.
- Per ottenere i migliori risultati con etichettatura alta densità di f-actina, uso falloidina coniugata con fluorofori organici, come Alexa Fluor 647. Al punto di tempo desiderato dopo replating cellule, fissare le celle come segue:
- Aspirare i media di ogni cultura e che contengono il ceesemplare II. Delicatamente ma rapidamente erogare 2 ml di caldi fissativi estrazione (37 ° C) contenente 0,25% di glutaraldeide in tampone PHEM con 0,25% Triton X-100. Incubare a temperatura ambiente per 1 - 2 min. Per i passaggi successivi, usare 2 ml di fissativo o tempra tampone per coprioggetti, se non diversamente indicato.
- Sostituire il fissativo estrazione con un fissativo glutaraldeide 2,5% in tampone PHEM e lasciare che i campioni incubare per 10 - 12 min. Questo ed seguenti operazioni sono tutte effettuate a temperatura ambiente.
- Aspirare i fissativi e delicatamente sostituirli con tampone PHEM. Tilt e miscelare delicatamente, e poi lavare di nuovo con PHEM. Ripetere due volte.
- Per spegnere autofluorescenza da glutaraldeide, che può sopraffare segnali dai fluorofori desiderati, incubare i campioni con un buffer tempra preparata di recente contenente NaBH 4 ad una concentrazione di massa di 0,1% in PHEM. saranno osservati bolle abbondante. Di tanto in tanto toccare il piatto del campione delicatamente per dislodge le bolle. Lasciare incubare per 5 - 10 minuti.
- Aspirare il buffer di tempra e delicatamente sostituirlo con tampone PHEM. Risciacquare un paio di volte per eliminare le bolle. Pipettare in 2 ml di PHEM tampone e lasciarlo incubare al buio per 5 min. Ripetere due volte e lasciare che il resto del campione nel tampone PHEM quando fatto.
- Preparare una camera umida per falloidina incubazione con un grande plastico Petri riempita con un pezzo di carta assorbente generosamente inumidito con 5 - 10 ml di DDH 2 O. Mettere un grande foglio di Parafilm pulita sulla parte superiore del tovagliolo di carta bagnata.
- A causa del costo relativamente elevato dei phalloidin etichettato, utilizzare un piccolo volume per ogni etichettatura. Per l'etichettatura alta densità, iniziare con una concentrazione di 0,3 mM. Preparare ~ 60 microlitri per coprioggetti usando falloidina-Alexa Fluor 647 in tampone PHEM.
- Pipettare 55 - 60 microlitri della soluzione phalloidin sul foglio Parafilm nella camera umida. Utilizzando una pinza sottile, rimuovere delicatamente il campione coverglass. Fare attenzione a notare la faccia cellule contenenti corretta.
- Rapidamente e picchiettare delicatamente via il tampone in eccesso toccando il bordo del coprioggetti con un pezzo di carta piegato assorbenti delicata, e quindi posizionare il lato cella coverglass rivolto verso il basso sulla goccia di soluzione falloidina sul Parafilm. Assicurarsi che non vi siano bolle intrappolati dal coprioggetti.
- Posizionare il coperchio sulla camera umida. Avvolgere la camera di foglio d'alluminio per proteggerlo dalla luce ambientale, e lasciare che il campione incubare una notte a 4 ° C. Il campione può essere conservato in questa condizione per diversi giorni. Assicurarsi che la camera di umidità rimane umida se lunga conservazione è prevista.
- Prima di immagini, inserire delicatamente il lato della cella coverglass up su un nuovo 6-pozzetti contenente 2 ml di tampone PHEM per pozzetto.
- Preparare tiolo-based buffer di imaging di ossigeno scavenging utilizzando le seguenti soluzioni madre: 1 M di glucosio, 1 M cisteamina, e 100x glucosio ossidasi / mixt enzima catalasiure (4 mg di catalasi e 10 mg di glucosio ossidasi in 100 microlitri di tampone PHEM, mescolati bene nel vortex) 28. Proprio prima di imaging, mescolare 75 ml di soluzione 1 M di glucosio, 30 ml di soluzione di 1 M cisteamina, e 3 ml di 100x miscela magazzino di enzimi. Regolare il volume di 300 ml con tampone PHEM e utilizzare immediatamente dopo la miscelazione per montare il campione.
- Per iPALM, preparare il campione di imaging utilizzando un # 1.5 coprioggetti pre-pulito (diametro 22 mm).
- In alternativa, utilizzare un vetrino (3 "x 1") con una doppia faccia spacer adesivo per facilitare l'assemblaggio se astigmatismo basato 3D-STORM 12 deve essere utilizzato.
- Per assemblare il campione di imaging, usare una pinza sottile per rimuovere delicatamente il coprioggetti esemplare dal buffer bene. Poi, rapidamente e delicatamente toccare l'eccesso di tampone toccando il bordo del coprioggetti con carta assorbente piegato.
- Posizionare il lato cellule coverglass rivolto verso l'alto su un pezzo di carta per lenti pulite. Lavare il campioneposizionando 30 - 50 ml di tampone di imaging sul campione, e rimuovere il tampone in eccesso inclinando e toccando con carta assorbente piegato.
- Ripetere la fase di risciacquo un paio di volte, e quindi inserire 30 - 50 ml di buffer di immagini sul campione. Blot asciugare il bordo del coprioggetti e posizionare più molto piccoli punti di resina epossidica indurimento rapido sulla zona secca.
- Abbassare lentamente un'altra # 1.5 coprioggetti pre-puliti (comune, coverglass tondo, diametro 18 mm) sul centro del 22-mm coverglass cellule contenenti. Lasciate che il buffer di imaging bagnare entrambi vetrini per capillarità. I piccoli punti di resina epossidica indurimento rapido dovrebbero aderire ad entrambe le vetrini.
- Premere delicatamente sul campione assemblato utilizzando carta assorbente piegato per diffondere uniformemente la pressione. Utilizzare una pressione sufficiente a rendere cellula-sottile campione e persino (<15 micron), ma non così tanto da schiacciare le cellule. Gauge lo spessore corretto osservando gli anelli modello di Newton. Inoltre, assicurarsi di eseguire questa step delicatamente per ridurre al minimo le bolle d'aria. Se necessario, praticare con vetrini vuoti più volte in anticipo.
- Sigillare il campione con fuso vasellina-lanolina-paraffina (VALAP, fotografia preparato da 100 g ciascuno di vaselina, lanolina e paraffina, fusi insieme) 29, lavare il campione sigillato con DDH 2 O, e asciugare con aria compressa. Il campione è ora pronto per il montaggio sul microscopio per l'imaging.
2. Posizionamento del campione e iPALM Allineamento
- Spostare la lente obiettivo superiore a molla verso l'alto per consentire la rimozione del supporto del campione. Posizionare il campione sigillate previste al punto 1.10 sul supporto del campione e fissare con diversi piccoli magneti in terre rare. Applicare olio di immersione su entrambi i lati del campione imaging. Collocare il supporto del campione di nuovo nel percorso ottico e abbassare delicatamente la lente obiettivo superiore.
- Attivare i laser di eccitazione. Accendere il dispositivo Electron Moltiplicando Charge-Coupled (EMCCD) della fotocamera in modalità frame-trasferimento.
- Ruotare nei filtri di emissione adeguati. Attivare un otturatore meccanico per bloccare il percorso fascio superiore (Figura 1A) e aprire il percorso del fascio inferiore. Portare la lente dell'obiettivo fondo a fuoco da traduzione in piccoli incrementi utilizzando l'attuatore piezoelettrico.
- Una volta che il fiducial è a fuoco, aprire il percorso del fascio superiore bloccando il percorso del raggio inferiore e per portare la lente superiore dell'obiettivo a fuoco in modo simile. Monitorare la larghezza del fiducial sul display del computer per il fuoco ottimale.
- Per una corretta centratura, aperto sia la parte superiore e percorsi di raggio inferiore. Regolare manualmente la lente obiettivo superiore mentre l'obiettivo di fondo è mantenuto costante utilizzando una coppia di micro-fine viti, finché le immagini fiduciali sono sovrapposti più vicino possibile, idealmente entro un pixel.
- Successivamente, eseguire regolazioni di precisione in modo che le immagini di riferimento nel punto 2.3 si sovrappongono all'interno di un decimo di pixel EMCCD. Regolare la parte superiore2 assi specchi piezoelettrici montati tramite il software di controllo mentre si tiene entrambe le lenti dell'obiettivo e la riflessione di fondo specchi costante. Confronta i centri dei fiducial della parte superiore e la parte inferiore di vista oggettivi tramite il display del computer per guidare il processo.
3. La calibrazione del Setup iPALM
NOTA: Poiché emissione di fluorescenza è incoerente, per interferenza da osservare in iPALM, l'lunghezze di percorso attraverso la parte superiore e inferiore obiettivi devono essere vicini l'uno all'altro, in pochi micron. Ciò può essere ottenuto come segue:
- Con i laser, le telecamere continuamente in streaming, ed entrambi i percorsi ottici superiore e inferiore aperta, oscillare il portacampioni z-piezo utilizzando una forma d'onda di tensione sinusoidale generata dal software di controllo per un continuo di oscillazione asse z su una grandezza di 400 nm .
- Sfruttando il fatto che, in posizione di allineamento ottimale, l'intensità fiducial varia poco con tegli oscillazione, tradurre manualmente il gruppo separatore di fascio motorizzato su o giù fino l'intensità dei oscilla fiduciali per effetto di interferenza singolo fotone desiderato. Questo significa la stretta corrispondenza delle cammino ottico. Un rapporto picco-valle> 10 può essere realizzato in casi ottimali (Figura 1D).
- Per garantire che sia l'ampiezza e fase in ciascuna superficie sono più uniforme possibile attraverso il campo, regolare lo specchio fondo del gruppo beam splitter piccoli passi per perfezionare il divario e gli angoli di inclinazione. Eseguire fascio splitter bene allineamento traducendo il campione in 8 nm z-passi oltre 800 nm.
- Monitorare l'intensità fiducial tra telecamere # 1 - 3. Regolare l'altezza, la posizione e l'inclinazione dello specchio inferiore nell'assieme beam splitter a piccoli passi, in modo tale che la fase di oscillazione della fotocamera # 1 rispetto alla telecamera # 2 è massimizzata, idealmente a 120 ° (Figura 1B-D).
- Dopo l'inizialel'allineamento è completo, tradurre il campione per la ricerca di un campo adeguato di vista che contiene sia le cellule di immagine e più fiducials nelle vicinanze. Posizionare un recinto intorno al sistema per bloccare la luce diffusa e perturbazioni ambientali. Una volta che l'area di esposizione viene trovata, eseguire la procedura al punto 3.4 di nuovo, e registrare la curva di calibrazione per l'utilizzo nelle successive z coordinata estrazioni utilizzando il comando "Acquisisci scansioni di calibrazione vs campione Piezo Posizione" nell'interfaccia principale.
4. Acquisizione dati
- Una volta che una zona desiderata viene trovato e la curva di calibrazione si ottiene, inserire i nomi dei file appropriati nel software. Aprire sia la parte superiore e percorsi di raggio inferiore. Aumentare la potenza di eccitazione del laser 642 nm al massimo. Per Alexa Fluor 647, può essere necessario un periodo iniziale di fluoroforo spegnimento (Figura 2A).
- Esporre con una costante di eccitazione 642 nm per 5 minuti, o più, se necessario, fino SImolecola ngle lampeggiante viene osservato (Figura 2B). Il software consente di incrementare automaticamente l'attivazione foto 405 nm durante il corso di acquisizione. Un gran numero di fotogrammi di acquisizione sono di solito necessari per le funzionalità filamentosi da essere chiaramente visibile (> 50.000 fotogrammi). Quando si è pronti, iniziare l'acquisizione di set di immagini crude utilizzando il comando "Start iPALM Acquisition" nell'interfaccia principale.
- Durante l'acquisizione, regolare il livello di fotoattivazione regolando l'intensità del laser 405 nm per mantenere la giusta densità lampeggiante come necessario (vedi esempi della Figura 2B).
NOTA: Una volta che l'acquisizione è stata completata, il software permette di convertire automaticamente i file di immagine in formato binario corretto. L'archivio dati nel server calcolo viene montata come un'unità di rete, consentendo ai dati di essere copiati direttamente lì per l'ulteriore elaborazione.
5. Data Processinge analisi
- Eseguire l'analisi della localizzazione utilizzando un software personalizzato sviluppato per estrarre i parametri di best-fit per tutte le singole molecole, così come per i fiducial 11,15,23. Questo produce non solo i x, y-coordinate, ma anche l'intensità che viene utilizzato per l'analisi della curva di calibrazione.
- Importare i dati di calibrazione grezzi acquisiti nella fase 3.5 utilizzando il comando "Estrai Peaks più etichette" dal menu "File" per eseguire la localizzazione singola molecola. Dopo l'analisi iniziale di localizzazione, coordinate ottenute dalle telecamere # 1 - 3 sono presenti in canali rosso, verde e blu, rispettivamente, e possono essere salvati per ulteriori analisi utilizzando il comando "Salva elaborato come IDL (.sav)" nell'ambito del " menu File ".
- Per portare i dati dalle telecamere # 1 - 3 nella registrazione utilizzando i fiducial fluorescenti integrate sui vetrini, selezionare più fiducial luminose per fornire una copertura dell'immagine centrale (ad esempio,Figura 1B) utilizzando il comando "Anchor Fiducial punti" sotto il menu "Trasformazioni immagine". Utilizzare i set di triple di localizzazione coordinate dalle telecamere # 1 - 3 ottenuto dai fiducial brillanti nella fase 5.1 per calcolare la rotazione e ridimensionamento della matrice che porterà le telecamere # 1 e # 3 nel registro con la macchina fotografica # 2. Con un numero sufficientemente elevato di fiducial, di ordine superiore deformazione polinomio può essere eseguita per adatta meglio.
- Una volta che la matrice di trasformazione è calcolata, trasformare i dati grezzi di telecamere # 1 - 3 insieme per ottenere i dati grezzi sommati. Eseguire un altro giro di analisi di localizzazione per produrre un più precise x, y-coordinare e per determinare il contributo relativo di ciascun canale della telecamera per i dati grezzi sommati; utilizzare il comando "Transform Crudo, Salva e Salva Sum (.dat)" sotto il menu "Trasformazioni immagine". Questo rapporto di intensità contiene le informazioni coordinata z.
- Selezionare un fiduciale luminoso ed eseguire Z-calibrazione montaggio usando la funzione "Test Wind Point 3D" nella finestra di pop-up facendo clic su "Z-coordinare le operazioni" sotto il menu "Funzioni speciali". Questo si adatta funzioni 3-sinusoidali alle intensità dei 3 canali di telecamera per determinare la curva di calibrazione. Il file di calibrazione viene salvato per un ulteriore uso sui principali set di dati.
- Per verificare la qualità della curva di calibrazione, eseguire l'estrazione coordinata z, come descritto in precedenza 23. Per fiducials ben educati in un sistema ben calibrato, la coordinata z dovrebbe scalare linearmente, dal momento che i set di dati di calibrazione sono prese con uno sweep lineare z-posizione. Inoltre, gli z-posizioni di tutti fiducials dovrebbero scalare con una pendenza simile.
- Una volta che una calibrazione soddisfacente si ottiene, eseguire la localizzazione e l'analisi di trasformazione per i set di dati di immagine RAW acquisiti al punto 4 seguente stessa procedura descritta nei passaggi 5.1-5.3. Una volta fatto, caricare il file di calibrazione dal passaggio 5.4 ed eseguire l'estrazione z coordinata utilizzando le funzioni "Pick WND File" e "Estratto Z punto" nella finestra di pop-up facendo clic su "Z-coordinare le operazioni" sotto il menu "Funzioni speciali".
NOTA: Dal momento che il tempo di acquisizione è> 15 min, deriva meccanico deve essere previsto. - Per eseguire la correzione della deriva in x, y, selezionare un fiduciale luminoso dalle coordinate di localizzazione. Questo fiducial dovrebbe essere presente in tutti i fotogrammi. Quindi, utilizzare la x, deriva del fiduciali coordinata y per allineare tutte le altre coordinate entro lo stesso lasso di nuovo in registrazione (Figura 3A-B) con la funzione "Test / Scrivi Guide Star" sotto il menu "Trasformazioni immagine". Z-coordinare registrazione può essere eseguita in modo simile accedendo al "Test Guide Star" e le funzioni di "Write Guide Star" nella finestra pop-up facendo clic su "Z-coordinare le operazioni" sotto il menu "Funzioni speciali".
- Quando il campione può presentare leggera inclinazione, eseguire la correzione di inclinazione, fornendo i x, y, z-coordinate dei 3 punti di riferimento che definisce il piano che dovrebbe essere impostato il livello con la funzione "Elimina XYZ Tilt" nella finestra di pop-up facendo clic su " Z-coordinare le operazioni "nel menu" Funzioni speciali ".
- A seguito delle correzioni di deriva e di inclinazione, salvare le coordinate di localizzazione. Ricostruire immagine risoluzione eccellente per ulteriori analisi (Figura 4A-D) utilizzando il comando "Render" nell'interfaccia principale. Il colore può essere usato per indicare la coordinata z. In alternativa, una vista laterale della zona selezionata può anche essere reso. Le coordinate di localizzazione possono essere esportati come file di testo per l'ulteriore quantificazione, oppure l'immagine ricostruita possono essere salvati come file .tif.
Risultati
requisiti critici per iPALM sono l'allineamento, la registrazione e la calibrazione dei sistemi ottici. Queste sono necessarie per garantire una corretta interferenza all'interno del 3-way beam splitter requisito per l'estrazione coordinata z. Per attivare il monitoraggio continuo, costante punto di fonti di fluorescenza sono necessari. Ciò può essere ottenuto mediante fluorescenza Au o nanoparticelle bimetalliche 23 la cui fotoluminescenza derivare da localizzata di risonanza plasmonica di superficie (LSPR). Agiscono come una stabile singolo dipolo su illuminazione e in genere può essere localizzate con 5 - precisione di 10 nm. Queste nanoparticelle disponibili in commercio emettono un livello di luminosità all'interno della gamma di maggior fluorofori singola molecola, tali che entrambi i fluorofori e fiducial possono essere esposte con analoga intensità di eccitazione e impostazioni di guadagno sulle telecamere EMCCD, senza saturazione (Figura 1B). Inoltre, questi fiducial anche notevolmente facilitate messa a fuoco, per cui la larghezza apparente dei fiducial può essere monitorato durante la messa a fuoco. Inoltre, la pulizia rigorosa della superficie coprioggetti, ad esempio mediante Piranha attacco o pulizia al plasma, è anche necessario, poiché sfondo spuria fluorescenza vetrini ripuliti o mal puliti può facilmente sopraffare segnali singola molecola, come descritto in precedenza.
iPALM si basa su interferometria multifase per consentire ad alta precisione coordinata z misurazione simultanea con la palma (per x, y). Nello strumento iPALM, ciascun fotone fluorescenza emessa può essere considerato propagarsi attraverso entrambi i percorsi ottici, che poi auto-interferiscono in un divisore di fascio 3 vie custom-fabbricato. La coordinata z è quindi codificato nella fase del fotone interferita. Le differenze di fase reciproca di ~ 120 ° dei fasci di uscita dal 3 vie risultato beam splitter nella variazione dell'intensità delle immagini singola molecola tra il 3 camercome, consentendo z - coordinata estrazione da una curva di calibrazione. Sulla base di questo, il gruppo porta-campione iPALM è un componente essenziale, in quanto è dotato di una coppia di attuatori piezoelettrici che consentono Traduzione nm precisione in z che può essere utilizzato per l'allineamento e la calibrazione.
Alla corretta messa a fuoco e l'allineamento, la traduzione del campione lungo l'asse z genera un effetto di interferenza. Questo si manifesta come l'oscillazione dell'intensità fiducial tra i tre canali della telecamera (Figura 1C-D). Queste oscillazioni indicano anche che sia il percorsi di fascio ottico superiore e inferiore sono quasi abbinati, permettendo l'interferenza singolo fotone. Di solito, quando si accende lo strumento, le fasi iniziali di ciascuna telecamera non saranno ottimali e la scansione della posizione z è necessario come strumento diagnostico per la calibrazione ed allineamento. Per arrivare alle fasi ottimali, lo specchio inferiore del divisore di fascio(Figura 1A) può essere regolata utilizzando la fase di tip-tilt piezoelettrico. La scansione taratura di z-posizione viene presa dopo ogni piccolo 10 - Regolazione 20 nm. L'intensità della fiducial in ciascun canale viene quindi determinata mediante analisi di localizzazione (ossia che si adatta con una funzione 2D-gaussiana). L'intensità normalizzate intensità totale può essere approssimata da una forma d'onda sinusoidale, consentendo al termine di fase da calcolare; pertanto, la fase corrispondente ad ogni telecamera può essere determinata, come mostrato nella Figura 1C. Prendiamo atto che il principio di interferenza singolo fotone utilizzato in iPALM può anche essere dimostrata con un molto più semplice a 2 vie divisore di fascio. Tuttavia, un divisore di fascio 2 vie è pratico per microscopia risoluzione eccellente 3D poiché in corrispondenza o prossimità del limite di interferenza distruttiva, il segnale in un canale è minima, con conseguente stime rumorosi di intensità e localizzazione coordinate, che limitano efficacemente la coordinata z determinazione per il Range dove entrambe le fotocamere hanno notevole intensità (<100 nm). Il numero minimo di canali necessari per superare questo effetto è tre, e 3 e 4 vie sistemi di proiezione sono stati descritti in letteratura 11,30.
In condizioni ottimali, per un divisore di fascio a 3 vie, le differenze di fase tra le 3 telecamere dovrebbero essere di circa 120 °. Il beam splitter a 3 vie per iPALM contiene 3 interfacce riflettenti, come diagrammed nella Figura 1A. Il divisore di fascio è posizionato sopra uno specchio dielettrico piatta, con un gap sottile riempita con olio di rifrazione index-matching, per consentire una regolazione fine di lunghezze di percorso all'interno del divisore di fascio e per ottenere differenze di fase ottimali. Come mostrato nella Figura 1C-D, al corretto allineamento per iPALM, le telecamere sono vicino ad una differenza di fase reciproca di 120 °. In pratica, una differenza di fase superiore a 105 ° è generalmente accettabile. Tale calibrazione sia indicates che il sistema è ben allineato e che verrà utilizzato per la successiva estrazione coordinata z. E 'anche utile per valutare la curva di calibrazione generata utilizzando diversi fiducial. La maggior parte dei fiducial con luminosità moderata generalmente emettono come un singolo dipolo, ottenendo curve di calibrazione ben educati. Tuttavia, gli aggregati occasionali di fiducials (spesso quelli con estrema luminosità) possono comportarsi in modo anomalo, ottenendo curve di calibrazione inaffidabili. È inoltre consigliabile scegliere fiducial vicino al centro del campo dell'imaging e vicino alla zona di interesse biologico (Figura 1B), in particolare dopo la elevata NA obiettivi obiettivo utilizzato nella configurazione iPALM non è piatto-field corretto. Il campo di vista efficace è limitata alla zona centrale, risulta dalle larghezze superiori fiduciali verso il bordo del campo.
Successivamente l'allineamento iniziale, la vista campi-di-contenenti cellule con mo desiderabilerphology e molteplici fiducials per garantire una buona calibrazione vengono scelti per l'imaging. Ciò può essere ottenuto traducendo lentamente il supporto del campione usando trasmissioni di servomotori 2 assi. Traduzione del campione determinerà un certo defocalizzazione, poiché il campione non è sempre perfettamente piana. Pertanto, attenzione deve essere regolata continuamente durante la traslazione. Quando il campo di imaging è stato scelto, un altro giro di calibrazione per ottimizzare la curva di calibrazione viene effettuata per perfezionare l'allineamento del sistema e per ottenere la curva di taratura. È importante sottolineare che le aree sotto il nucleo, o vicino a regioni con indice di rifrazione eterogenea (ad esempio, le bolle d'aria) devono essere evitati in generale, dal momento che questi provocano alterazioni significative del percorso relativo lunghezze, distorcendo la coordinata z.
Con l'etichettatura ad alta densità, segnali di fluorescenza di fluorofori organici come Alexa Fluor 647 può essere estremamente luminoso. Come mostrato in Figura 2A, con l'adeguata preparazione tampone contenente un'alta concentrazione di tiolo (-SH) gruppi 31, il fluoroforo dovrebbe essere rapidamente spento sotto illuminazione eccitazione elevata. Ciò comporta la soppressione dei segnali di fluorescenza della maggioranza delle molecole. A un dato caso, una piccola minoranza di fluorofori stocasticamente tornare allo stato "on". Questi dovrebbero essere scarsamente distribuito e quindi può essere visualizzato come singole molecole per uno o pochi fotogrammi prima di passare "off". Le dinamiche photoswitching sono fortemente dipendente dall'intensità di eccitazione e la concentrazione di -SH, e quindi, per un dato sistema, bisogna fare attenzione per ottimizzare la giusta densità etichettatura, soprattutto perché un'intensità relativamente elevata di eccitazione (640 - 647 nm) viene necessaria per spegnere una maggioranza di Alexa Fluor 647 molecole. Se l'eccitazione non è sufficientemente forte, una frazione significativa di Alex Fluor 647 volontàrimanere nello stato "on", con conseguente elevato background, difficoltà di osservazione unico di fluorescenza molecola, e, in ultima analisi, di scarsa qualità singola molecola risultati della localizzazione. In una condizione ben bilanciata, singola molecola dati grezzi dovrebbe contenere un numero sufficientemente elevato di molecole (centinaia) per fotogramma (Figura 2B), mentre ogni molecola è abbastanza scarsa per consentire il rilevamento univoca e analisi localizzazione. E 'anche interessante notare che per iPALM, i principi della photoswitching sono identiche a quelle di Palm o STORM, e, quindi, i campioni adeguatamente preparati per iPALM può essere utilizzato direttamente sui sistemi 3D-PALM o 3D-Storm più semplici. Per acquisire un abbastanza alta densità di molecole per soddisfare campionamento di Nyquist, di solito sono necessari 50.000 o più fotogrammi di dati grezzi (cioè 150.000 fotogrammi totali per le 3 telecamere). Come l'acquisizione progredisce, una frazione crescente di fluorofori potrebbe essere esaurita da photobleaching distruttiva, con conseguente Sparser densità singola molecola. Per compensare questo, brevi impulsi di luce blu 405 nm (405 nm) possono essere illuminati sul campione ad intervalli di promuovere attivazione fluoroforo.
A causa del lungo tempo di acquisizione necessario, risultati ottimali per iPALM (o singola molecola di localizzazione microscopia in generale) richiedono bassa deriva campione e / o buona correzione deriva. Ad esempio, utilizzando il tempo di esposizione di 50 msec in modalità di trasferimento cornice (frame rate di 20 Hz), il tempo totale di acquisizione di 50.000 frame è 42 min. Durante questo periodo, si prevede deriva meccanica per decine di nm. Infatti, oltre alla elevata precisione di localizzazione e alta densità etichettatura, la risoluzione dipende anche dalla qualità di correzione della deriva. Ci sono molteplici origini a queste derive con fluttuazioni termiche essere una delle principali cause. A causa di questa considerazione, ove possibile, le parti iPALM sono personalizzati lavorati usando Invar, una lega bassa dilatazione termica, o acciaio inossidabile,entrambi i quali hanno caratteristiche di dilatazione termica molto inferiori ottone o alluminio. Purtroppo, questo impone anche addizionale rispetto all'alluminio, che è un metallo più comunemente usato per i componenti ottico-meccanici, essendo molto più economico e più facile da lavorare. Altre fonti di deriva possono essere vibrazioni meccaniche da apparecchiature periferiche, ambienti ambientali, o correnti d'aria. Questi dovrebbero essere minimizzati mettendo il sistema in un contenitore adatto reindirizzando la direzione del flusso d'aria nella zona microscopio. La configurazione dovrebbe essere costruito su un tavolo ottico di ricerca-grado e, se possibile, componenti del ventilatore contenenti deve essere collocato fuori dal tavolo ottico. Tuttavia, nonostante tutte le precauzioni, una certa quantità di deriva rimarrà. Criticamente, queste derive devono essere ridotti al minimo tale che l'immagine rimanga a fuoco per tutto il tempo di acquisizione. Nei nostri sistemi, questi metodi passivi sono sufficienti a ridurre la deriva a livelli accettabili. Tuttavia, dovrebbe essere possibile attuare drift com attivametodi pensazione per consentire a lungo termine e di imaging ad alta precisione 32.
In seguito al trattamento dei dati grezzi, le coordinate di localizzazione 3D possono essere ottenuti con tipicamente 5-10.000.000 picchi di singola molecola per set di dati. Come mostrato in figura 3, la deriva in funzione del tempo può essere visualizzata dalle coordinate di localizzazione dei fiducial. Fiducial multipli possono essere utilizzati per calcolare la media traiettoria correzione della deriva (Figura 3A-B). Inoltre, è consuetudine per filtrare i picchi che si adattano male alla funzione 2D-gaussiana durante l'analisi localizzazione. Questo potrebbe essere dovuto a rumori spuri o parzialmente sovrapposte picchi di singola molecola e può essere differenziato dalla grande errore quadratico residua calcolata durante il processo di adattamento. Picchi con bassa luminosità (come indicato dal numero di fotoni) e, quindi, una maggiore incertezza (cioè, più grande di ~ 25 nm) vengono filtrati, uns questi probabilmente derivano da sfondo non specifico fluorescenza. Allo stesso modo, i picchi per i quali le intensità dei 3 canali della telecamera si adattano male alla curva di calibrazione sono anche rifiutati, come le coordinate z ottenuti non sono affidabili. Va notato che il contenuto piena informazione di iPALM (e localizzazione microscopia in generale) è enorme, poiché i risultati dell'analisi non solo nelle coordinate fluoroforo, ma anche in molti altri parametri come l'intensità, larghezza, luminosità, ecc Tuttavia, in pratica, dal momento che relativamente pochi strumenti di calcolo sono attualmente disponibili per l'analisi nello spazio di coordinate, le coordinate di localizzazione sono in genere resi o ricostruiti in immagini basate sui pixel per ulteriori analisi.
L'approccio comunemente usato per la ricostruzione di immagini iPALM è quello di rappresentare coordinare ogni localizzazione con una funzione gaussiana 2D normalizzata, con l'incertezza di localizzazione impostato come Gaularghezza ssian 33. Così, le coordinate ad alta precisione (tipicamente i picchi singola molecola con alta luminosità contro basso sfondo) appaiono come picchi acuti e stretti, mentre le coordinate a bassa precisione (generalmente bassa luminosità o alta sfondo picchi singola molecola) appaiono come dimmer e più ampia picchi. In questo modo, ogni molecola contribuisce la stessa quantità di intensità all'immagine. Per un set di dati 3D, le coordinate z può essere rappresentato utilizzando il colore, tipicamente basate su una scala tonalità (Figura 4C-D). In alternativa, le immagini possono essere visualizzate come una vista laterale (x, z o y, z) proiezione o come volumi. Un certo numero di programmi disponibili pubblicamente può essere utilizzato per visualizzare tali dati 34.
Come mostrato nelle figure 4-6, immagini iPALM generano un significativo miglioramento rispetto microscopia a fluorescenza diffrazione limitata. L'architettura F-actina in cellule HUVEC può essere visualizzato con molta Reso spaziale migliorataluzione. Nelle regioni della corteccia, le reti di filamenti distinti possono essere visti, mentre in fibre di stress, fasci e lamellopodi, le reti di F-actina densamente sono osservate per avere una consistenza filamentosa, anche se i singoli filamenti non sono distinguibili. Ciò è probabilmente dovuto alle limitazioni sia la luminosità dei fluorofori e la precisione di localizzazione. La presenza di filamenti corticali distinte suggerisce che l'ultrastruttura della rete f-actina è sufficientemente ben conservato; pertanto, iPALM potrebbe essere un utile strumento per caratterizzare l'architettura corticale. Nella Figura 5, una sub-regione di una cella HUVEC viene visualizzata con i profili di un filamento di actina quantificato. Si può notare che la z-istogramma di un filamento è di circa 15 nm di larghezza, relativamente piccolo rispetto a ~ 45 nm per l'trasversale (x, y), dimostrando che iPALM produce un miglioramento significativo risoluzione in z risoluzione rispetto alla x, y, come previsto. Tuttavia, poiché la actual diametro del f-actina è ~ 8 nm, non è chiaro se il filamento osservato è un singolo filamento o un fascio di alcuni filamenti. Imaging Correlativo usando iPALM e EM potrebbe essere una strategia utile per un'ulteriore caratterizzazione dell'architettura f-actina, anche se questo approccio non è stato applicato per studiare f-actina ancora 23.
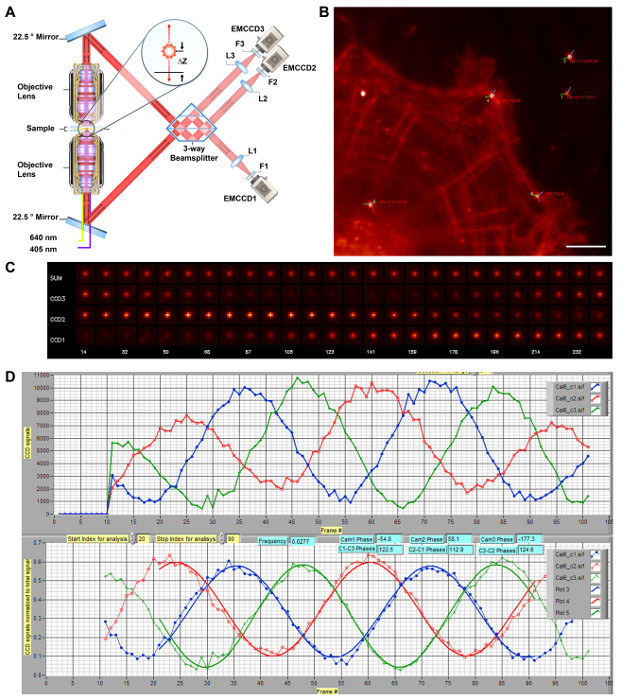
Figura 1: Schema di iPALM 3-D Super Resolution Microscopia. A) Schema di ottica iPALM. Il doppio lenti dell'obiettivo (Nikon, NA 1.49 60X) permettono ogni fotone fluorescenza emessa per propagare attraverso sia la parte superiore e percorsi di fascio ottico in basso, e vengono reindirizzati ad interferire nel divisore di fascio da una coppia di specchi orientati a 22,5 °. La fase del fotone auto-interferito è direttamente proporzionale alla Az, codifica così la coordinata z del fluoroforo, e può essere misurata noizione un divisore di fascio 3 vie con differenze di fase reciproca di ~ 120 ° tra i tre fasci di uscita. Essi sono concentrati dalle lenti tubo (L1-L3, f = 400 nm) e filtrati dal filtro di emissione (F1 - F3). Ogni singola molecola appare quindi con intensità diverse tra telecamere (EMCCD1-3) ma a x simili, coordinate y. (A) viene riprodotto e modificato dal Rif. 11. (B) immagine diffrazione limitata di cellule HUVEC etichettati per F-actina con Alexa Fluor 647. Punti luminosi denotano Au fiducials nanoparticelle. Gli angoli di fase per telecamere # 1 - 3 sono rappresentati da linee rosse, verde e blu, rispettivamente centrata su ogni fiducial, con la differenza di fase tra le telecamere # 1 - 3 indicato. Barra di scala:. 5 micron (C) immagini Fiducial che mostrano gli effetti interferometriche. Immagini di una nanoparticella fiduciale Au per ogni telecamera (CCD1-3) o totale (somma), preso come la posizione z (in nm, sulla riga in basso) viene analizzato per la calibrazione. L'intensità all'interno di EAfotocamera ch può essere visto in oscillazione con una relazione di fase, come mostrato in (B). curva di calibrazione (D) iPALM. Il campione viene traslato lungo l'asse z. Le intensità di una nanoparticella fiduciali Au per la EMCCD1-3 sono spettacolo come linee rosse, verdi e blu, rispettivamente (in alto). Questi sono poi normalizzati e si adattano per determinare le differenze di fase (in basso). Durante l'allineamento, il sistema viene regolata per ottenere le differenze di fase massime tra tutti tre telecamere. La curva di calibrazione è presa in ciascun sito di imaging da utilizzare nella estrazione del coordinata z di ogni singola molecola. Cliccate qui per vedere una versione più grande di questa figura.

Figura 2: singola molecola Imaging di Photoswitching Alexa Fluor 647-falloidina come actina etichette. (A) passo photoswitching iniziale. F-actina in cellule fisse è etichettato ad alta densità falloidina coniugato con Alexa Fluor illuminazione 647. ad alta intensità in un tiolo contenenti i risultati di buffer di immagini in rapida switch-off della maggior parte dei fluorofori. (B) fotogrammi rappresentativi di grezzo singola molecola cornici. Al lampeggio stato stazionario, l'attivazione Alexa Fluor 647 deve essere sufficientemente scarsa che i singoli singole molecole appaiono come una macchia PSF dimensioni. Immagini delle stesse cellule mostrati in (A), mostrate con contrasto inversa. Barre di scala in A e B:. 5 micron Clicca qui per vedere una versione più grande di questa figura.
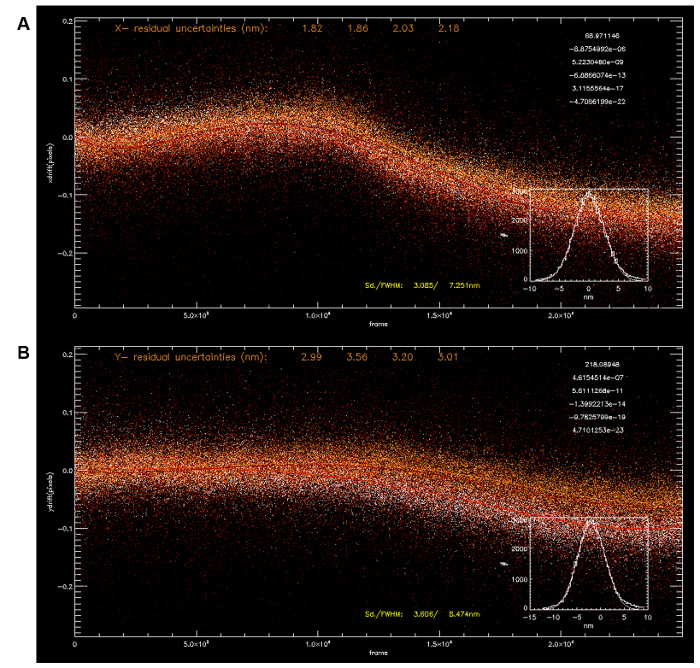
Figura 3: Correzione scostamento usando Multip. Le Fiducial le coordinate di localizzazione per quattro fiduciali (A, coordinata x, B, coordinata y) sono stati utilizzati per calcolare la deriva con raccordi polinomiali (5 ° ordine, i parametri di stare su in alto a destra). La traiettoria media deriva permette la correzione della deriva con sub-5 nm di precisione (x: 3.085 nm, y: 3.606 nm). Clicca qui per vedere una versione più grande di questa figura.
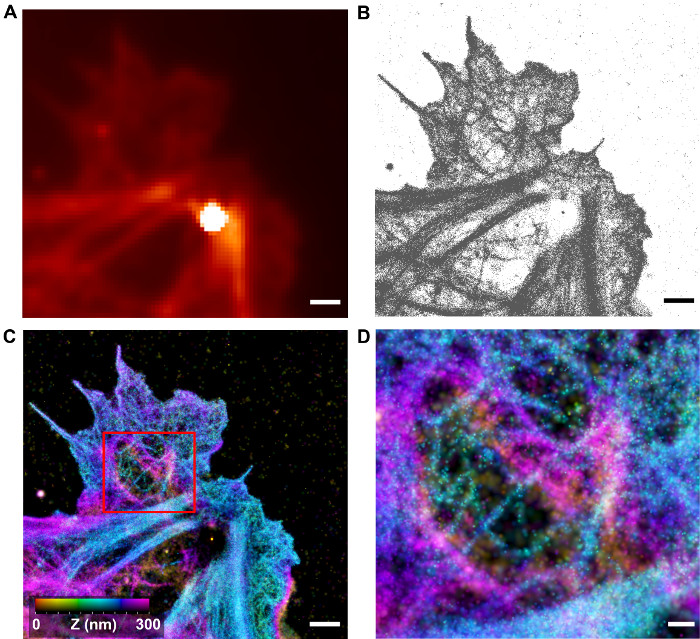
Figura 4: Visualizzazione di 3-D F-actina Architettura per iPALM. (A) immagine diffrazione limitata di cellule HUVEC con f-actina etichettati da Alexa Fluor 647-phalloidin (corrispondente a sottoaree della cella nella figura 2). Il punto luminoso è dovuto alle fiducial nanoparticelle di Au. (B) localizzazione coordinate determinato mediante analisi iPALM per l'area in (A). (C) immagine ricostruita iPALM, con ciascuna localizzazione coordinata reso da un 2D-gaussiana con larghezza corrispondente incertezza localizzazione. La coordinata z è colorata in base alla barra dei colori. Aree di caratteristiche filamentosi dense e sparse può essere visto. Barre di scala (AC): 1 micron (D) Zoom-in vista della zona in scatola in C che mostra topologia actina corticale filamentosa.. Barra di scala:. 250 nm Clicca qui per vedere una versione più grande di questa figura.

Figura 5: Nanoscale Dimensione di F-actina visualizzati da iPALM. (A) cellule HUVEC immagine ricostruita iPALM con F-actina etichetta B y Alexa Fluor 647-falloidina. Il colore indica la coordinata z in base alla barra dei colori. Bar Scala:. 1 micron (B) sezione trasversale istogramma di x, y-localizzazione coordinate lungo l'asse della zona in scatola in (A). Per ottenere l'istogramma, le coordinate vengono proiettate l'asse lungo della scatola e discretizzati con 5 nm bin-size. La curva grigia indica un migliore adattamento gaussiana al istogramma, con una larghezza a metà massimo (FWHM) di 43,88 nm. (C) Istogramma della posizione z della localizzazione coordinate nella zona in scatola in (A). Lo Z-posizioni sono cestinate con una dimensione bidone di 1 nm. La curva grigia indica una misura migliore gaussiana per l'istogramma, con una FWHM di 17,50 nm. Clicca qui per vedere una versione più grande di questa figura.
/files/ftp_upload/54774/54774fig6.jpg "/>
Figura 6:. Confronto di iPALM Imaging di f-actina Utilizzando reagenti diversi Etichettatura immagini ricostruite iPALM di F-actina etichettati con Alexa Fluor falloidina 647-coniugato (A), Alexa Fluor falloidina 568-coniugato (B), o da trasfezione con l'actina -mEos2 fusione espressione della proteina vettore (C). Barre di scala (AC):. 1 micron Clicca qui per vedere una versione più grande di questa figura.
Discussione
Il sistema ottico di iPALM si basa su un disegno obiettivo 4 π dual-opposti, come illustrato nella Figura 1A. La configurazione è costruito utilizzando parti sia custom-lavorati e commerciali opto-meccanici, come descritto in precedenza 23 ed elencati nella tabella 1. In aggiunta al nostro setup, l'Howard Hughes Medical Institute (HHMI) ospita un sistema che è accessibile alla comunità scientifica presso l'Advanced Imaging Center presso il Campus Janelia Research. Per i disegni pieni meccanici, schemi di controllo e software, i lettori sono invitati a informarsi con Harald Hess a HHMI per ulteriori informazioni. Un vantaggio principale per utilizzare iPALM così come altri metodi di localizzazione microscopia singola molecola per la visualizzazione f-actina è la relativa facilità di preparazione del campione rispetto alle tecniche EM, che generalmente richiedono campione di trasformazione dura, laboriosa preparazione, e operatori altamente specializzati 3,23 . Additionally, la fluorescenza è naturalmente suscettibile di immagini multicanale, che rimane difficile per EM. Tuttavia, come descritto più avanti, ci sono diverse limitazioni attuali per l'approccio, sia in termini di preparazione dei campioni e del processo di imaging. In primo luogo, come è il caso per la preparazione del campione EM, occorre prestare attenzione per garantire una buona conservazione ultrastrutturale dei campioni 35, dal momento che un protocollo adeguato per un livello di diffrazione limitata di risoluzione possono causare gravi perturbazioni su nanoscala. Per l'imaging actina, corretto fissaggio delle cellule è un fattore importante per la qualità del campione. La glutaraldeide è un fissativo preferita in quanto conserva il citoscheletro e la membrana molto bene, anche se in caso di co-colorazione con anticorpi, i siti epitopi potrebbero essere influenzati. In tali casi, paraformaldeide può offrire un compromesso accettabile, in quanto tende a conservare meglio siti anticorpali epitopi. È importante sottolineare che per la singola molecola di localizzazione al microscopio, queste tendono fissativiper generare sfondo autofluorescenza; pertanto, dopo fissazione quenching da boroidruro è necessario, in particolare nel caso di glutaraldeide.
Inoltre, la corretta selezione dei fluorofori e strategie di etichettatura sono tra i fattori più importanti per gli esperimenti di successo. A causa della dimensione su scala nanometrica di f-actina, alte densità di etichette sono tenuti a catturare le reti filamentosi sottostanti, come stabilito dal campionamento teorema di Nyquist 36. Per actina, falloidina consente l'etichettatura densità molto elevata, con una vasta gamma di fluorofori organici disponibili da molti produttori. Tuttavia, dal momento che falloidina è tossico, non è richiesta la fissazione delle cellule e permeabilizzazione. strategie alternative per live-cell etichettatura actina compatibili includono l'utilizzo di fusione di proteine fluorescenti (FP), sia con l'actina monomerica o con piccoli polipeptidi actina-vincolante. Tuttavia, abbiamo scoperto che questi tendono a produrre una densità di etichettatura inferiore rispetto a falloidina ( Figura 6). Notiamo che actina purificata può anche essere direttamente etichettata con fluorofori organici ed introdotto in cellule viventi mediante elettroporazione 37, ma questo approccio dovrebbe essere costoso e ad alta intensità di manodopera. In termini di fluorofori, Alexa Fluor 647 è generalmente stato trovato per offrire sempre buone prestazioni per la microscopia localizzazione. Questo può essere descritto in termini di rapporto-contrasto quoziente luminosità tra il singolo picco molecola e la fluorescenza di fondo 38. Una densità etichettatura superiore richiede un rapporto di contrasto superiore, poiché il fondo può cumulativamente degradare la precisione di localizzazione. Nella nostra esperienza, molti altri fluorofori, come ATTO488, ATTO520 e Alexa Fluor 568 (figura 6B), può essere utilizzato per visualizzare il f-actina, anche se con risultati meno consistenti rispetto a Alexa Fluor 647, che offre robuste prestazioni photoswitching tutti una vasta gamma di condizioni di buffer imaging.
Per quanto riguarda il processo di imaging, limitazioni nella metodi di imaging biologici sono spesso stato concettualizzato come un trade-off di risoluzione spaziale, risoluzione temporale, e la gamma di immagini (sia campo-di-vista / profondità di campo e la durata) 39. Ciò vale anche per i vantaggi ei limiti di iPALM. Rispetto ad altre tecniche di microscopia risoluzione super-3-dimensionale, iPALM è rimasta l'approccio ottica più alta risoluzione ad oggi, in particolare lungo l'asse z, con z risoluzione quasi 2 volte meglio di x, y-risoluzione 11. Tuttavia, la dipendenza di iPALM su interferometria per un alto z-risoluzione impone anche una limitazione della profondità delle immagini, dal momento che la curva di calibrazione è periodica. In altre parole, coordinate z ripetono ogni 250 nm o giù di lì (per ~ 700 lunghezze d'onda di emissione Nm di Alexa Fluor 647). In pratica, questo può essere affrontato utilizzando illuminazione TIRF, che limita la zona di eccitazione entro la profondità di campo evanescente <200 nm dalla coprioggetti. Così, fluorofori più in profondità il campione non sono eccitati e rimangono invisibili. Tuttavia, questo limita anche le strutture biologiche che possono essere esposte a quelle in prossimità coprioggetti, quali adesioni focali, citoscheletro corticale e membrana plasmatica ventrale, mentre le strutture più interne sono fuori portata. Per il facsimile fissi, un rimedio è quello di eseguire criosezionamento 40. Tuttavia, un tale approccio è molto laboriosa e richiede perizia specializzata che non è comunemente accessibile.
In alternativa, iPALM può essere adattato per z-gamma estesa combinando interferometria con lo schema astigmatica-defocalizzazione 12 utilizzati in 3D-STORM. Questo approccio fornisce dual coordinata z letture, la prima di interferometria, che è di alta precisione ma periodico, e la seconda per defocalizzazione astigmatica, che è meno preciso ma non periodico. Quest'ultimo può quindi essere utilizzato per "scartare" o rompere la degenerazionele interferometrici coordinate z, consentendo in tal modo la triplicazione della profondità di imaging iPALM a ~ 750 nm, si avvicina in modo efficace la profondità focale intrinseca di elevati obiettivi obiettivi NA. Con unwrapping fase iPALM è stato utilizzato per strutture dell'immagine profondità all'interno dei campioni, come mitocondri, anche se con leggermente ridotta precisione nelle 3 dimensioni a causa della ulteriore defocalizzazione 40.
Un'altra limitazione intrinseca del iPALM è la velocità di imaging. Poiché un grande numero di fotogrammi devono ottenere un'alta densità di coordinate di localizzazione, la velocità della camera è di solito il limite sul tasso di acquisizione. Con gli attuali telecamere EMCCD funziona a 10 - 20 MHz tassi di lettura, decine di minuti sono necessari per un numero sufficiente di fotogrammi. Tali scale temporali lunghe richiedono che il campione essere fissati. Qui, i recenti progressi nella tecnologia delle fotocamere, come la Complementary Metal Oxide Semiconductor (sCMOS) fotocamera molto più veloce scientifica, possono consentire un rapido aumento della iminvecchiamento velocità 41, anche se questo non è stato implementato per iPALM ancora. Per alcuni singola molecola approcci localizzazione di microscopia, un campo di singola molecola denso possono essere analizzati utilizzando un algoritmo modificato 42 o compresso sensing 43. L'adattamento di tali strategie può anche accelerare iPALM consentendo immagini singola molecola più densi e, di conseguenza, un minor numero di fotogrammi.
Con limitazioni nella gamma di velocità e di imaging e punti di forza di risoluzione spaziale, una grande domanda di iPALM è come un metodo ultrastrutturale che sfrutta i vantaggi della marcatura fluorescente per svelare l'organizzazione su scala nanometrica di specifiche proteine 14,15,44. Ulteriore miglioramento, sia in termini di tecnologie ottiche e fluoroforo, dovrebbe consentire un ulteriore miglioramento nella risoluzione spaziale iPALM. Ad esempio, iPALM elaborazione di immagini attualmente impiega relativamente semplice approccio approssimazione del primo ordine, con ogni singola molecola modellato da una funzione gaussiana 2D e comeconsumata essere un isotopicamente media dipolo. Questo potrebbe essere aumentata con metodi recenti, che impiegano un modello più accurata della funzione point-spread e l'orientamento dipolo, o il trattamento esplicito delle aberrazioni ottiche attraverso il campo di vista per migliorare significativamente la risoluzione spaziale. Allo stesso modo, photocaging stato segnalato, che ne esalta la luminosità fluorophore da ordini di grandezza 45. Infatti, dal momento che gli elementi chiave della loro organizzazione ultrastrutturale sono stati ben caratterizzati, il citoscheletro F-actina potrebbe essere un sistema modello di grande valore per testare ulteriori sviluppi metodologici in iPALM. La capacità di analizzare l'organizzazione delle proteine al microscopio ottico con il potere vero EM-livello di risolvere si prevede di migliorare notevolmente la nostra comprensione della miriade di aspetti della struttura e la funzione cellulare.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
YW e PK ringraziano sostegno finanziario della Fondazione Nazionale delle Ricerche di Singapore, assegnato a PK (NRF-NRFF-2011-04 e NRF2012NRF-CRP001-084). Ringraziamo anche il laboratorio e il nucleo di microscopia aperte strutture MBI per il supporto delle infrastrutture.
Materiali
| Name | Company | Catalog Number | Comments |
| optical table | Newport, CA | RS4000 | iPALM, installed on 4 Newport Stabilizer vibration isolators |
| vibration isolator for optical table | Newport, CA | S-2000 | |
| laser-642 | Newport, CA | 1185055 | output power=100 mw |
| laser-561 | Newport, CA | 1168931 | output power=200 mw |
| laser-488 | Newport, CA | 1137970 | output power=200 mw |
| laser-405 | Newport, CA | 1142279 | output power=100 mw |
| broadband dielectric mirrors | Thorlabs, NJ | BB1-E02 | laser combiner |
| dichroic beamsplitter | Semrock, NY | LM01-427-25 | |
| acousto-optic tunable filter | AA Opto-Electronic, France | AOTFnC-VIS-TN | |
| Linear polarizer | Newport, CA | 05LP-VIS-B | |
| baseplate | local workshop | customized | |
| turning mirror (22.5°) | Reynard Corpporation, CA | customized | 22.5° mirror |
| motorized optic mounts | New Focus, CA | 8816 | |
| motorized XYZ translation stage | Thorlabs, NJ | MT3/M-Z6 | sample holder |
| T-Cube DC servo motor controller | Thorlabs, NJ | TDC001 | |
| Piezo Phase Shifter | Physik Instrumente, Germany | S-303.CD | |
| objective lens | Nikon, Japan | MRD01691 | objective. Apo TIRF 60X/1.49 oil |
| translation stage | New Focus, CA | 9062-COM-M | |
| Pico Motor Actuator | New Focus, CA | 8301 | |
| rotary Solenoid/Shutter | DACO Instruments, CT | 5423-458 | |
| 3-way beam splitter | Rocky Mountain Instruments, CO | customized | beamsplitter |
| Piezo Z/Tip/Tilt scanner | Physik Instrumente, Germany | S-316.10 | |
| motorized five-axis tilt aligner | New Focus, CA | 8081 | |
| Picmotor ethernet controller | New Focus, CA | 8752 | |
| Piezo controllers/amplifier/digital operation module | Physik Instrumente, Germany | E-509/E-503/E-517 | |
| band-pass filter | Semrock, NY | FF01-523/20 | filters |
| band-pass filter | Semrock, NY | FF01-588/21 | |
| band-pass filter | Semrock, NY | FF01-607/30 | |
| band-pass filter | Semrock, NY | FF01-676/37 | |
| notch filter | Semrock, NY | NF01-405/488/561/635 | |
| motorized filter wheel with controllter | Thorlabs, NJ | FW103H | |
| EMCCD | Andor, UK | DU-897U-CSO-#BV | 3 sets |
| Desktop computers for controlling cameras and synchronization | Dell | Precision T3500 | PC, 4 sets |
| coverslips with fiducial | Hestzig, VA | 600-100AuF | sample preparation. fiducial marks with various density and spectra available |
| fibronectin | Millipore, MT | FC010 | |
| paraformaldehyde | Electron Microscopy Sciences, PA | 15710 | fixation. 16% |
| glutaraldehyde | Electron Microscopy Sciences, PA | 16220 | 25% |
| triton X-100 | Sigma aldrich, MO | T8787 | |
| HUVEC cells | Life Technologies, CA | C-015-10C | |
| Medium 200 | Life Technologies, CA | M-200-500 | |
| Large Vessel Endothelial Factors | Life Technologies, CA | A14608-01 | |
| Dulbecco's Phosphate Buffered Saline | 14190367 | ||
| Pennicillin/Streptomycin | 15140122 | ||
| Trypsin/EDTA | Life Technologies, CA | 25200056 | |
| PIPES | Sigma aldrich, MO | P1851 | PHEM |
| HEPES | 1st base, Malaysia | BIO-1825 | |
| EGTA | Sigma aldrich, MO | E3889 | |
| MgCl2 | Millipore, MT | 5985 | |
| Alexa Fluor 647 Phalloidin | Invitrogen, CA | A22287 | staining |
| sodium borohydride (NaBH4) | Sigma aldrich, MO | 480886 | quenching |
| glucose | 1st base, Malaysia | BIO-1101 | imaging buffer |
| glucose oxidase | Sigma aldrich, MO | G2133 | |
| catalase | Sigma aldrich, MO | C9322 | |
| cysteamine | Sigma aldrich, MO | 30070 | |
| Epoxy | Thorlabs, NJ | G14250 | |
| vaseline | Sigma aldrich, MO | 16415 | sample sealing |
| lanolin | Sigma aldrich, MO | L7387 | |
| parafin wax | Sigma aldrich, MO | 327204 | |
| Immersion oil | Electron Microscopy Sciences, PA | 16915-04 | imaging. Cargille Type HF |
Riferimenti
- Kanchanawong, P., Waterman, C. M. Localization-based super-resolution imaging of cellular structures. Methods Mol Biol. 1046, 59-84 (2013).
- Bertocchi, C., Goh, W. I., Zhang, Z., Kanchanawong, P. Nanoscale imaging by super resolution fluorescence microscopy and its emerging applications in biomedical research. Crit Rev Biomed Eng. 41, 281-308 (2013).
- Kanchanawong, P., Waterman, C. M. Advances in light-based imaging of three-dimensional cellular ultrastructure. Curr Opin Cell Biol. 24, 125-133 (2012).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Heilemann, M., et al. Subdiffraction-resolution fluorescence imaging with conventional fluorescent probes. Angew Chem Int Edit. 47, 6172-6176 (2008).
- Sharonov, A., Hochstrasser, R. M. Wide-field subdiffraction imaging by accumulated binding of diffusing probes. P Natl Acad Sci USA. 103, 18911-18916 (2006).
- Fölling, J., Bossi, M., Bock, H., Medda, R., Wurm, C. A., Hein, B., Jakobs, S., Eggeling, C., Hell, S. W. Fluorescence nanoscopy by ground-state depletion and single-molecule return. Nat Methods. 5, 943-945 (2008).
- Biteen, J., et al. Single-moldecule active-control microscopy (SMACM) with photo-reactivable EYFP for imaging biophysical processes in live cells. Nat Methods. 5, 947-949 (2008).
- Shtengel, G., et al. Interferometric fluorescent super-resolution microscopy resolves 3D cellular ultrastructure. P Natl Acad Sci USA. 106, 3125-3130 (2009).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319, 810-813 (2008).
- Dani, A., Huang, B., Bergan, J., Dulac, C., Zhuang, X. Super resolution imaging of chemical synapses in the brain. Neuron. 68, 843-856 (2010).
- Liu, J., et al. Talin determines the nanoscale architecture of focal adhesions. P Natl Acad Sci USA. 112 (35), E4864-E4873 (2015).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468, 580-584 (2010).
- Wu, Y., Kanchanawong, P., Zaidel-Bar, R. Actin-delimited adhesion-independent clustering of e-cadherin forms the nanoscale building blocks of adherens junctions. Dev Cell. 32 (2), 139-154 (2015).
- Szymborska, A., et al. Nuclear Pore Scaffold Structure Analyzed by Super-Resolution Microscopy and Particle Averaging. Science. 341, 655-658 (2013).
- Lawo, S., Hasegan, M., Gupta, G. D., Pelletier, L. Subdiffraction imaging of centrosomes reveals higher-order organizational features of pericentriolar material. Nat Cell Biol. 14, 1148-1158 (2012).
- Mennella, V., Agard, D. A., Huang, B., Pelletier, L. Amorphous no more: subdiffraction view of the pericentriolar material architecture. Trends Cell Biol. 24, 188-197 (2014).
- Mennella, V., et al. Subdiffraction-resolution fluorescence microscopy reveals a domain of the centrosome critical for pericentriolar material organization. Nat Cell Biology. 14, 1159-1168 (2012).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463, 485-492 (2010).
- Salbreux, G., Charras, G., Paluch, E. Actin cortex mechanics and cellular morphogenesis. Trends Cell Biol. 22, 536-545 (2012).
- Shtengel, G., et al. Imaging cellular ultrastructure by PALM, iPALM, and correlative iPALM-EM. Method Cell Biol. 123, 273-294 (2014).
- Juette, M. F., et al. Three-dimensional sub-100 nm resolution fluorescence microscopy of thick samples. Nat Methods. 5, 527-529 (2008).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. 19, 555-565 (2009).
- Shannon, C. Communication in the presence of noise. Proc. IRE. 37, 10-21 (1949).
- Good, N. E., et al. Hydrogen ion buffers for biological research. Biochemistry. 5, 467-477 (1966).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophys J. 94, 1826-1835 (2008).
- Shin, W. D., et al. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Swedlow, J. R., Spector, D. L. , Cold Spring Harbor Laboratory Press. (2010).
- Aquino, D., et al. Two-color nanoscopy of three-dimensional volumes by 4Pi detection of stochastically switched fluorophores. Nat Methods. 8, 353-359 (2011).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nat Methods. 8, 1027-1036 (2011).
- Pertsinidis, A., Zhang, Y., Chu, S. Subnanometre single-molecule localization, registration and distance measurements. Nature. 466, 647-651 (2010).
- Baddeley, D., Cannell, M. B., Soeller, C. Visualization of Localization Microscopy Data. Microsc Microanal. 16, 64-72 (2010).
- El Beheiry, M., Dahan, M. ViSP: representing single-particle localizations in three dimensions. Nat Methods. 10, 689-690 (2013).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. Immunolabeling artifacts and the need for live-cell imaging. Nat Methods. 9, 152-158 (2012).
- Shroff, H., Galbraith, C. G., Galbraith, J. A., Betzig, E. Live-cell photoactivated localization microscopy of nanoscale adhesion dynamics. Nat Methods. 5, 417-423 (2008).
- Yamashiro, S., et al. New single-molecule speckle microscopy reveals modification of the retrograde actin flow by focal adhesions at nanometer scales. Mol Biol Cell. 25, 1010-1024 (2014).
- Shroff, H., et al. Dual-color super resolution imaging of genetically expressed probes within individual adhesion complexes. P Natl Acad Sci USA. 104, 20308-20313 (2007).
- Chen, B. C., et al. Lattice light-sheet microscopy: imaging molecules to embryos at high spatiotemporal resolution. Science. 346, (2014).
- Brown, T. A., et al. Super resolution fluorescence imaging of mitochondrial nucleoids reveals their spatial range, limits, and membrane interaction. Mol Cell Biol. 31, 4994-5010 (2011).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Daostorm, S. DAOSTORM: an algorithm for high-density super-resolution microscopy. Nat methods. 8, 279(2011).
- Zhu, L., Zhang, W., Elnatan, D., Huang, B. Faster STORM using compressed sensing. Nat Methods. 9, 721-723 (2012).
- Van Engelenburg, S. B., et al. Distribution of ESCRT machinery at HIV assembly sites reveals virus scaffolding of ESCRT subunits. Science. 343, 653-656 (2014).
- Vaughan, J. C., Jia, S., Zhuang, X. Ultrabright photoactivatable fluorophores created by reductive caging. Nat Methods. 9, 1181-1184 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon