Method Article
干渉光活性化ローカライゼーション顕微鏡(iPALM)によってF-アクチンフィラメントの三次元超解像顕微鏡
要約
私たちは、接着性、哺乳動物細胞におけるアクチン細胞骨格のイメージングに、干渉光活性化ローカライゼーション顕微鏡(iPALM)、3次元の単一分子の局在超解像顕微鏡法の適用のためのプロトコルを提示します。このアプローチは、そうでなければ、従来の回折限界光学顕微鏡で未解決のままであるナノスケールの構造的特徴の光ベースの可視化を可能にします。
要約
蛍光顕微鏡は、細胞内の特定の生体分子の直接可視化を可能にします。しかし、従来の蛍光顕微鏡法のために、空間分解能は、光軸に沿って像面、> 500nmの範囲内〜200nmの回折により制限されています。結果として、蛍光顕微鏡法は、長い細胞内の超微細構造の特徴の観察に厳しく制限されています。超解像顕微鏡法の最近の開発は、この制限を克服しました。特に、photoswitchable蛍光体の出現は、分子長さスケールに近づいて解像力を提供ローカリゼーションベースの超解像顕微鏡を、可能にします。ここでは、干渉光活性化ローカライゼーション顕微鏡(iPALM)と呼ばれる単一分子の局在顕微鏡法および多相干渉に基づいて3次元超解像顕微鏡法の適用を説明します。この方法は、上のほぼ等方性の解像度を提供しますすべての3つの次元で20nmのオーダー。 iPALM機器の試料調製及び動作を含む、繊維状アクチン細胞骨格を可視化するためのプロトコルは、ここに記載されています。これらのプロトコルはまた、細胞内の他の超微細構造の特徴の研究に容易に適合し、有益です。
概要
複雑な細胞構造の可視化は、長い生物学的洞察と発見に不可欠となっています。蛍光顕微鏡は、高分子特異性を有する画像セルは、その分解能は〜像面(X、Y、または横寸法)で200 nmの光軸(Z、または軸方向の寸法)に沿って、> 500nmの回折によって制限されることができるが1,2。したがって、超微細な特徴の観察は、歴史的に、電子顕微鏡(EM)に限られていました。 100 nmの範囲1-6 -幸いなことに、超解像顕微鏡の最近の開発は、10の空間分解能を可能にする、この制限を回避しています。具体的には、超解像は、このようなPALM(光活性化ローカライゼーション顕微鏡)4、FPALM(蛍光光活性化ローカライゼーション顕微鏡)5(d)にSTORM(直接確率的光学再構築顕微鏡)などの頭字語によって知られている単一分子の局在化に基づくアプローチ6,7、PAINT(ポー川int型イメージングナノスケールの地形のための蓄積)8、GSDIM(基底状態枯渇顕微鏡は、個々の分子のリターンが続く)9、またはSMACM(単一分子アクティブ制御顕微鏡)10、ならびに、それらの3次元(3D)の実装、干渉PALM(iPALM)11または3D-STORM 12、神経細胞の軸索とシナプス13を含む多数の生物学的構造のナノスケールの組織に新たな洞察を明らかに貴重なされている、接着斑14,15、細胞間結合16、核膜孔17 、および中心体18-20は 、いくつかの名前を付けます。
超解像顕微鏡は、潜在的に有用であるために、細胞内の別の超微細構造の特徴は、アクチン細胞骨格です。細胞表層における糸状(F)アクチンの複雑な網目構造は、細胞の形状及び機械的特性21の制御において重要な役割を果たしています。組織OF F-アクチンは、積極的かつ動的に強く重合、架橋、売上高、安定性、およびネットワークトポロジー22に影響を与える多数の調節タンパク質も規制されています。 F-アクチン網目構造のキャラクタリゼーションは、細胞プロセスの多様な範囲に機械的な洞察のために重要であるものの、F-アクチンフィラメントの小さいサイズ(〜8 nm)は、従来の回折限界光学顕微鏡によって自分の観察を妨げます。従って、アクチン微細構造の可視化は、これまでもっぱらEMによって実行されています。ここでは、3D 11,23における非常に高精度の能力を活用するiPALM超分解能顕微鏡技術を用いて、接着性哺乳動物細胞におけるF-アクチン細胞骨格を可視化するためのプロトコルを説明します。 iPALM機器は専門性の高いですがiPALM顕微鏡へのアクセスはホーによってホストされている一方で、このような機器の設定に関する指示は、23最近記載されています病棟・ヒューズ医学研究所はまた、最小限のコストとの研究コミュニティに利用可能とされています。さらに、本明細書に記載の試料調製方法は、より広範に利用可能であるような点広がり関数(PSF)の非点収差のデフォーカスに基づくものなどの代替的な3D超解像手法、12又はバイプレーン検出24、に直接適用可能です。
私たちは、一般的には単一分子の局在化ベースの超解像顕微鏡のために必要な成分が満たされなければ、単一分子の局在化ベースの超解像顕微鏡のための3つの重要な要件を可能にするphotoswitchableフォア25、であることに注意した:i)高単一分子背景信号の明るさとコントラストの相対。 ⅱ)所与の画像フレーム内の単一分子のまばらな分布。また、ナイキスト・沙として知られている根本的な構造(のプロファイルをキャプチャするのに十分な標識及びiii)高い空間密度nnonサンプリング基準)26。このように、満足のいく結果を得るために、重点はフルオロフォアphotoswitchingを最適化するために、基礎となる超微細構造を維持するための試験片の適切な準備の両方で、同様の実験の計測および買収側面に均等に配置する必要があります。
プロトコル
1.イメージング試料の準備
- ので、バックグラウンド蛍光信号が最初に脱イオン水(のddH 2 O)でそれらをすすぎ、次いで圧縮空気を使用して空気乾燥させてカバーガラスを清掃し、フルオロフォア標識からの蛍光を妨害します。その後、15秒間プラズマクリーナープラズマエッチングを行う、または必要に応じてより長いです。
- ドリフト補正とiPALMキャリブレーションを有効にするには、信頼性の高いキャリブレーションおよびドリフト補正用として非常に光安定の基準点を提供する基準マーク、などの蛍光ナノ粒子を埋め込んだ#1.5ラウンド(22-mmの直径)予備洗浄カバーガラスを使用しています。十分な蛍光体密度蓄積するために必要な長い取得時間に(> 15から30分)、サンプルドリフトは避けられません。
- 6ウェル組織培養プレートに、各fiducialedカバーガラスを配置します。 15分間の層流フード内で、紫外線(UV)照射によって、それらを殺菌します。
- 無菌層流フードでは、線維を準備10μg/ mlの - 最終濃度2に無菌のダルベッコのリン酸緩衝生理食塩水(DPBS)中で1mg / mlのフィブロネクチンのストック溶液を希釈することにより、カバーガラスのコーティングのためのネクチン液。それぞれのDPBSで三回カバーガラスリンスし、4℃で一晩フィブロネクチン溶液2mlでインキュベートします。その後、フィブロネクチン液を吸引し、DPBSで一度すすいでください。
- DPBSで簡単に細胞を洗い流します。細胞を切り離し、新鮮な血清含有細胞培養培地〜10mlでクエンチされるまで、37℃で数分間トリプシン2mlの - 1でインキュベートします。例えば、ヒト臍帯静脈内皮細胞(HUVEC)は、大血管内皮因子及びペニシリン又はストレプトマイシンを補充した大血管内皮細胞培養培地を使用します。
- フィブロネクチンでコーティングしたカバーガラス(疎密度のため、プレート<カバーガラス当たり50,000細胞)上に細胞をReplateし、湿度95%、5%CO 2、および37&#に設定したインキュベーターに文化を維持176; C。
- F-アクチン細胞骨格の微細構造の適切な保存のため、グッド緩衝剤27に基づいて、緩衝液を使用しています。
- 例えば、EGTAを3.8g HEPESを6.5gを溶解させて2×ストック溶液(120mMのパイプ、50mMのHEPES、20mMのEGTA、4mMのMgCl 2を、KOHでpH 7.0)としてPHEM緩衝液を調製し、そして190mgの濃KOH水溶液を滴下することによって7.0に調整したpHを有するのddH 2 O、の〜300ml中のMgCl 2。その後、500ミリリットルにボリュームをもたらすためのddH 2 Oを追加します。 、0.22μmのフィルターを使用してバッファを滅菌4°Cでそれを格納し、それを1希釈する:使用前のddH 2 Oで1。
- F-アクチンの高密度標識と最良の結果を得るために、セル再播種後に所望の時点では、このようなアレクサフルオロ647のような有機蛍光色素分子とコンジュゲートファロイジンを使用し、次のように細胞を固定します:
- よくCEを含む各培養物から培地を吸引llの標本。穏やかにしかし迅速に0.25%トリトンX-100でPHEM緩衝液中の0.25%グルタルアルデヒドを含有する温かい(37℃)抽出固定剤を2mlを分注します。 2分 - 1、室温で静置します。その後の手順については、固定液の2ミリリットルを使用するか、他に示されない限り、カバーガラスごとにバッファを急冷します。
- PHEM緩衝液中の2.5%グルタルアルデヒド固定液で抽出固定液を交換し、サンプルは10インキュベートしましょう - 12分。この、次のステップは全て室温で実施されます。
- 吸引し固定液出て、ゆっくりとPHEM緩衝液に置き換えます。チルト旋回優しく、そしてその後PHEMで再び洗います。二回繰り返します。
- 希望のフルオロフォアからの信号を圧倒することができ、グルタルアルデヒド、から自家蛍光を消光するには、PHEM中の0.1%の質量濃度でのNaBH 4を含む新たに調製したクエンチング緩衝液を用いて試験片をインキュベートします。多量の気泡が観察されます。時折DISLに優しく試料皿をタップ気泡をodge。 10分 - それは5インキュベートしてみましょう。
- クエンチングバッファーアウト吸引し、軽くはPHEM緩衝液と交換してください。気泡を一掃するために数回すすいでください。 PHEM緩衝液2ml中ピペット、それは5分間、暗所でインキュベートしましょう。二回繰り返して行ったときにPHEM緩衝液中の試料の残りをしましょう。
- ddH 2 Oの10ミリリットル-惜しみなく5で湿らせたペーパータオルの一片で埋め大型プラスチックシャーレを用いてインキュベーションをファロイジンための湿度室を準備します湿ったペーパータオルの上にきれいなパラフィルムの大きなシートを置きます。
- 標識されたファロイジンの比較的高いコストのために、各標識のための小さなボリュームを使用しています。高密度の標識のために、0.3μMの濃度で始まります。 PHEMバッファにファロイジンアレクサフルオロ647を使用してカバーガラス当たり〜60μlのを準備します。
- ピペット55 - 湿度チャンバ内のパラフィルムシート上にファロイジン溶液を60μlの。細かい鉗子を使用して、静かに試料covergを削除小娘。正しい細胞含有顔を注意するように注意してください。
- 迅速かつ優しく繊細な吸収紙の折り返し片とカバーガラスの縁に触れることによって、過剰なバッファを離れてタップし、[パラフィルム上ファロイジン溶液の液滴の上に下向きにしてカバーガラスセル側に配置します。カバーガラスに捕捉された気泡がないことを確認します。
- 湿度室のカバーを置きます。周囲光から保護するためにアルミホイルでチャンバをラップし、試料を4℃で一晩インキュベートしましょう。試料は、数日間、この状態に保つことができます。長期保存が予定されている場合は、湿度室は湿ったままであることを確認してください。
- 撮影の前に、静かにウェル当たりPHEM緩衝液の2ミリリットルを含む新たな6ウェルプレート上にアップカバーガラスセル側に配置します。
- 1 Mグルコース、1 Mのシステアミン、および100Xグルコースオキシダーゼ/カタラーゼ酵素MIXT次ストック溶液を用いて、酸素捕捉チオールベースのイメージング・バッファを準備URE(カタラーゼの4 mgを、ボルテックスでよく混合PHEM緩衝液100μl、グルコースオキシダーゼの10 mg)を28。右撮像前に、1 Mグルコース溶液75μlを、1 Mシステアミン溶液30μL、および100倍株式酵素混合物の3μLを混合します。 PHEM緩衝液で300μlに音量を調整し、すぐにサンプルをマウントするために混合した後に使用します。
- iPALMについては、予め洗浄#1.5カバーガラス(22 mmの直径)を用いた撮像サンプルを準備します。
- 代替的に、非点収差ベースの3D-STORM 12が代わりに使用される場合、アセンブリを補助するために、両面接着スペーサでスライドガラス(3 "×1")を使用します。
- イメージングサンプルを組み立てるには、静かによくバッファから標本カバーガラスを除去するために、微細な鉗子を使用しています。そして、迅速かつ静かに折り畳まれた吸収紙でカバーガラスの縁に触れることによって、過剰なバッファを離れてタップします。
- きれいなレンズ紙の上に上向きにカバーガラスセル側に配置します。サンプルをすすぎます30置くことによって - と、サンプル上に結像する緩衝液50μlを傾けると、折り畳まれた吸収紙でタップすることで、過剰なバッファを削除します。
- すすぎ工程を数回繰り返し、その後、30置く - サンプル上に結像する緩衝液50μlを。ブロットは、カバーガラスのエッジを乾燥し、乾燥した領域に速硬化エポキシの複数の非常に小さなドットを配置します。
- ゆっくりと細胞含有22 mmのカバーガラスの中央に別の予備洗浄#1.5カバーガラス(プレーン、丸いカバーガラス、18 mmの直径)を下げます。撮像バッファは毛管作用によって両方のカバーガラスを湿らせてください。速硬化エポキシの小さなドットは、両方のカバーガラスに付着する必要があります。
- 静かに均等に圧力を分散するために折り畳まれた吸収紙を使用して組み立てたサンプル時に押してください。でも、試料セル薄いと作るために十分な圧力(<15μm)を使用しますが、細胞を破砕するほどではありません。ニュートンリングのパターンを観察することによって、適切な厚さを測ります。また、このSTを実行するようにしてください気泡を最小限に抑えるために穏やかにEP。必要に応じて、事前に空のカバーガラスで数回の練習。
- 29(VALAP、100グラムワセリン、ラノリン、パラフィンのそれぞれから調製された株式は、一緒に溶融)溶融ワセリン、ラノリン、パラフィンでサンプルを密封する、のddH 2 Oで密封されたサンプルを洗浄し、圧縮空気でブロー乾燥。サンプルは現在、イメージングのための顕微鏡に取り付けるための準備ができています。
2.サンプルの配置とiPALMアライメント
- サンプルホルダーの除去を可能にするために上向きにバネ仕掛けのトップ対物レンズを移動します。試料ホルダー上にステップ1.10で製造した密封された試料を置き、いくつかの小さな希土類磁石で固定します。撮像サンプルの両側に液浸油を適用します。光路に戻って試料ホルダーを置き、そっとトップ対物レンズを下げます。
- 励起レーザをオンにします。電子増倍電荷結合素子(EMCをオンにしますフレーム転送モードでCD)カメラ。
- 適切な発光フィルターに回転させます。トップビーム経路( 図1A)をブロックし、ボトムビーム経路を開くために、メカニカルシャッターをアクティブにします。ピエゾアクチュエータを使用して、少しずつ翻訳で焦点に底対物レンズを持参してください。
- 基準が焦点になると、ボトムビーム経路を遮断しながら、トップビーム経路を開き、同様の方法で焦点にトップの対物レンズをもたらします。最適なフォーカスのためのコンピュータディスプレイ上の基準の幅を監視します。
- 適切なセンタリングのために、上部と下部のビーム経路の両方を開きます。基準画像は、理想的には1画素内、可能な限り厳密に重なっているまで、ボトム目的は、マイクロファインセットネジのペアを使用して一定に保持されている間に手動でトップ対物レンズを調整します。
- 続いて、微調整を行うEMCCDピクセルの10分の1以内のステップで基準画像は2.3オーバーラップするように。トップを調整します制御ソフトウェアを介した2軸ピエゾ取り付けられたミラーの両方の対物レンズと底反射を保持しながら、一定のミラー。プロセスを導くために、コンピュータのディスプレイを介してトップの基点と下部目的のビューの中心を比較。
iPALMセットアップの3キャリブレーション
注:蛍光発光がインコヒーレントであるので、iPALMで観察される干渉のために、パスは上部と下部の目標を介して長さ数ミクロンの範囲内で、互いに近接していなければなりません。これは以下のように達成することができます:
- 上のレーザ、カメラは連続的にストリーミングし、上下両方のビーム経路が開いた状態で、400nmの大きさを超える連続z軸発振用の制御ソフトウェアによって生成された正弦波電圧波形を用いて試料ホルダーのzピエゾを振動。
- 最適なアラインメントのうち、基準強度はTで少し変化するという事実を利用して彼は振動、手動による所望の単一光子干渉効果に基準が振動の強さまで上または下電動式ビームスプリッターアセンブリを翻訳します。これは、光路長の近い一致を意味します。 > 10のピーク-谷比が最適な場合( 図1D)で達成することができます。
- ギャップ及びチルト角度を微調整するために小さなステップでビームスプリッタアセンブリの底面ミラーを調整し、それぞれの面での振幅と位相の両方がフィールド全体で可能な限り均一であることを確認してください。 800 nmの上に8 nmのz軸ステップでサンプルを翻訳することによって、ビームスプリッタファインアライメントを実行します。
- 理想的には、カメラ#2のカメラ#1相対の発振位相が最大になるように、高さ、位置、及び小さなステップでのビームスプリッタアセンブリ内の下部ミラーの傾きを調整します。3. - カメラ#1のうち、基準強度を監視します120°( 図1B-D)で。
- 最初の一回アライメントが完了し、近くの画像および複数の基点に、両方の細胞を含むビューの適切なフィールドをスキャンするためにサンプルを翻訳します。迷光と周囲の摂動を阻止するために、システムの周りに囲いを配置します。撮像領域が発見されると、再びステップ3.4の手順を実行し、メインインタフェースで「サンプルピエゾ位置対キャリブレーションスキャンを取得」コマンドを使用して、後続のz座標の抽出に使用するための検量線を記録します。
4.データ集録
- 所望の領域が検出された検量線が得られると、ソフトウェアに該当するファイル名を入力します。上部と下部のビーム経路の両方を開きます。最大642 nmのレーザーの励起パワーを増加させます。アレクサフルオロ647は、オフにフルオロフォアの初期期間は、( 図2A)を必要とすることができます。
- SIまで、5分、または必要に応じて長くするための定642 nmの励起で公開します点滅ngle分子は、( 図2B)が観察されます。ソフトウェアは、取得の過程で405 nmの光活性化の自動増加を可能にします。糸状の特徴がはっきりと見えるようにするための取得枠の多数が通常必要とされている(> 50,000フレーム)。準備ができたら、メインインターフェイスで "スタートiPALM取得」コマンドを使用して、生の画像セットの取得を開始します。
- ( 図2Bの例を参照)、必要に応じて取得中に、曲は405 nmのレーザーの強度を調整することによって光活性化のレベルは、適切な点滅密度を維持します。
注:買収が完了すると、ソフトウェアが自動的に画像ファイルが適切なバイナリ形式に変換されます。計算サーバ内のデータリポジトリは、データが直接、さらなる処理のためにそこにコピーされることを可能にする、ネットワークドライブとしてマウントされています。
5.データ処理そして、分析
- すべての単一の分子だけでなく、基準点11,15,23のために最もフィットするパラメータを抽出するためにカスタム開発されたソフトウェアを使用して、ローカライズ分析を実行します。これは、x、y座標だけでなく、較正曲線分析に使用され、強度だけでなく、得られます。
- コマンドを使用して、ステップ3.5で取得した生のキャリブレーションデータをインポートし、単一分子の局在を実行するには、「ファイル」メニューの下に「ピークス複数のラベルを抽出します」。初期局在分析を次のカメラ#1から得られた座標 - 3、それぞれ、赤、緑、および青のチャネルに存在しており、コマンドを使用して、さらなる分析のために保存することができ、「IDLとして加工SAVE(.SAV) ""下ファイル "メニュー。
- カメラ#1からデータをもたらすために-カバースリップ上に埋め込まれた蛍光の基準点を使用して、登録に3、中央の画像( 例えばのカバレッジを提供するために、いくつかの明るい基準点を選択し、「イメージ変換」メニューの下に「アンカー基準点のポイント」コマンドを使用して、 図1B)。カメラ#2でレジスタにカメラ#1と#3をもたらす回転とスケーリング行列を計算するためにステップ5.1で明るい基準点から得られた3 - 局在化はカメラ#1から座標のトリプルセットを使用してください。基準点の十分な数で、より高次の多項式の反りがより良いフィットのために行うことができます。
- 加算された生データを取得するために一緒に3 - 変換行列が計算されると、カメラ#1の生データを変換します。 y座標と加算され、生データに各カメラチャンネルの相対的な寄与を決定するために、より正確なXを得るためにローカライズ分析の別のラウンドを行います。 「イメージ変換」メニューの下に "生、保存して保存和(.datファイル)を変換」コマンドを使用します。この強度比は、z座標情報が含まれています。
- 明るい基準を選択し、Z-行います「特殊機能」メニューの「Z座標操作」をクリックして、ポップアップダイアログで機能「テスト・ウィンドポイント3D」を使用してフィッティングキャリブレーション。これは、較正曲線を決定するために、3のカメラチャンネルの強度に3正弦波関数をフィットします。キャリブレーションファイルは、メインのデータセットでのさらなる使用のために保存されます。
- 検量線の品質をテストするために、先に説明したように23、抽出z座標行います。よく較正されたシステムで行儀の基準点については、z座標は、キャリブレーションデータセットは、z位置でリニアスイープで撮影されているので、直線的に拡張する必要があります。さらに、すべての基準点のz位置は、同様の傾きに合わせて拡張する必要があります。
- 満足なキャリブレーションが得られると、ステップ5.1から5.3に概説したものと同じ手順に従って、ステップ4で取得された生の画像データセットの局在化および変換分析を行います。完了したら、ステップ5からのキャリブレーションファイルをロードします。4および関数を使用して、z座標抽出を行う「WNDファイルを選択してください」と「特殊機能」メニューの「Z座標操作」をクリックして、ポップアップダイアログで「Z座標抽出」。
注:取得時間が> 15分であるため、機械的なドリフトが予想されます。 - X、Yでドリフト補正を実行するには、ローカライズの座標から明るい基準を選択します。この基準は、すべてのフレームで存在すべきです。続いて、「イメージ変換」メニューの下に"ガイドスターを書く/テスト」機能を使用して( 図3A-B)登録に戻って、同一フレーム内の他のすべての座標を整列させるために基準のドリフトをy座標、Xを使用します。 Z座標登録は「特殊機能」メニューの下の「操作のZ座標」リンクをクリックして「テストガイド星」、ポップアップダイアログの "ガイドスターを書く」機能にアクセスすることで同様に行うことができます。
- サンプルはわずかな傾斜を示すことができるように、「クリックしてポップアップダイアログで「XYZチルトを削除」機能を使用してレベルを設定する必要があり平面を定義する3基準点のX、Y、Z座標を提供することにより、傾き補正を行います特殊機能「メニュー」の「操作のZ座標。
- ドリフトや傾き補正に続いて、ローカライズの座標を保存します。メインインターフェイス上で「レンダリング」コマンドを使用して、さらなる分析( 図4A-D)のための超解像度画像を再構成します。色はz座標を示すために使用することができます。あるいは、選択された領域の側面図でもレンダリングすることができます。ローカリゼーション座標は、さらに定量化のためにテキストファイルとしてエクスポートすることができ、または再構成された画像は、.tifファイルとして保存することができます。
結果
iPALMのための重要な要件は、光学系のアライメント、登録、およびキャリブレーションされています。これらは、z座標の抽出に3ウェイビームスプリッタ必要内の適切な干渉を確実にするために必要です。継続的な監視を有効にするには、蛍光の一定の点光源が必要です。これは、蛍光のAu又はそのフォトルミネッセンス局在表面プラズモン共鳴(LSPR)から生じる二金属ナノ粒子23を用いて達成することができます。彼らは、照明の際に安定した単一双極子として作用し、一般的に5でローカライズすることができます - 10 nmの精度。これらの市販のナノ粒子は、フルオロフォアと基準点の両方が飽和状態( 図1B)ことなく、EMCCDカメラに類似の励起強度とゲイン設定で撮像することができるように、大部分の単一分子の蛍光体の範囲内で明るさのレベルを放射します。さらに、これらの基準点も大幅FAC基準点の見かけの幅は、フォーカス調整中にモニターすることができる、集束ilitate。前述のように汚れた又は不十分な洗浄カバーガラスの偽バックグラウンド蛍光が容易に、単一分子のシグナルを圧倒することができるので、また、例えば、ピラニアエッチング又はプラズマ洗浄などによってカバーガラスの表面のストリンジェント洗浄は、また、必要とされます。
iPALMは(のx、yについて)PALMと同時に高精度のz座標測定を可能にするために、多相干渉に依存しています。 iPALM器具において、各放射された蛍光光子は、カスタム製作3方向ビームスプリッターでの自己干渉の両方の光路を通って伝播することが考えられます。 z座標は、このように干渉光子の位相で符号化されます。 3カマー間の単一分子画像の強度変化における3方向ビームスプリッターの結果からの出力ビームの〜120度の相互位相差検量線から抽出座標- zが可能、など。それはアライメント及び較正のために使用することができ、Zにおけるナノメートル精度の翻訳を可能にする、圧電アクチュエータの一対を備えているので、これに基づいて、iPALMサンプルホルダーアセンブリは、必須成分です。
ピントやアライメントでは、z軸に沿ったサンプルの翻訳は干渉効果を生成します。これは、3つのカメラチャンネル( 図1C-D)の間の基準強度の振動として現れます。これらの振動は、単一光子干渉を可能に、上部及び下部光ビーム経路の両方がほぼ一致していることを示しています。通常、測定器の電源を入れる時に、各カメラの初期段階では最適ではないだろうとz位置のスキャンは、キャリブレーションおよび位置合わせのための診断ツールとして必要とされています。最適なフェーズ、ビームスプリッタの下部ミラーに到達するには( 図1A)は 、圧電チップチルトステージを使用して調整することができます。 20 nmの調整 - z位置のキャリブレーションスキャンが各小10後に撮影されています。各チャネルの基準強度はその後( すなわち、2次元ガウス関数でフィッティング)局在分析によって決定されます。合計強度によって正規化強度は、位相項を算出できるように、正弦波で近似することができます。 図1Cに見られるように、このように、各カメラに対応する位相を決定することができます。我々はiPALMで使用される単一光子干渉の原理はまた、はるかに簡単な2ウェイビームスプリッタを用いて実証することができることに注意してください。破壊的干渉の限界またはその近くで、1チャンネルの信号が強度およびローカリゼーション座標のノイズの多い推定値で、その結果、最小であるので、2ウェイビームスプリッタは、効果的にz座標を制限する、3D超解像顕微鏡のための実用的ではありません鳴ったの決意両方のカメラが実質的な強度(<100 nm)を持つ電子。この影響を克服するために必要なチャネルの最小数は3であり、3-および4ウェイ投影システムは、文献11,30に記載されています。
最適な条件下では、3方向ビームスプリッターのために、3台のカメラの間の位相差は約120℃であるべきです。 図1Aに図解しているようiPALMための3ウェイビームスプリッタは、3反射インタフェースが含まれています。ビームスプリッタは、パスの微調整が最適な位相差を実現するために、ビームスプリッタ内に長さ及び可能にするために、屈折率マッチングオイルで満たされた薄い間隙と、フラット誘電体ミラーの上方に配置されます。 図1C-Dに示すように、iPALMのための適切なアライメントで、カメラが120°の相互位相差に接近しています。実際には、105°よりも大きい位相差は、一般的に許容可能です。このようなキャリブレーションの両方のindシステムが十分に整列され、それはその後のz座標抽出に使用されることをことをicates。異なる基準点を使用して生成された較正曲線を評価することも有用です。適度な明るさのほとんどの基準点は、一般的に行儀検量線を得、単一双極子として放出します。しかし、基準点の時折の集合体(極端な明るさを持つことが多いもの)は信頼できない検量線を得、異常な方法で動作をする場合があります。 iPALMセットアップで使用される高NA対物レンズのレンズはフラットフィールドが修正されていない、特に以来、撮像領域の中心付近および生物学的関心( 図1B)の周辺の基準点を選択することをお勧めいたします。効果的な視野は、視野の端に向かって大きな基準幅から明らかなように、中央領域に制限されています。
初期配向に続いて、望ましいカ月で細胞を含むフィールド・オブ・ビューrphologyと良いキャリブレーションを確保するために、複数の基準点は、画像化のために選択されます。これは、ゆっくりと2軸サーボモータドライブを使用して、サンプルホルダーを変換することによって達成することができます。サンプルはいつも完全に平坦ではないので、サンプルの翻訳は、いくつかのデフォーカスになります。したがって、焦点は継続的に、翻訳中に調整されなければなりません。撮像視野が選択されると、検量線を最適化するためのキャリブレーションの別のラウンドは、システムの位置合わせを微調整するために、実際の較正曲線を得るために行われます。これらは、z座標を歪め、相対パス長の有意な変化の原因となりますので、重要なのは、異種の屈折率( 例えば、気泡)と核または近い領域の下の領域は、一般的には避けるべきです。
高密度の標識を使用すると、このようなアレクサフルオロ647のような有機蛍光団からの蛍光シグナルは非常に明るいことができます。 Iに示すようにnは図2(a)は 、チオール(-SH)グループ31を高濃度に含む適切なバッファーの準備で、フルオロフォアは急速に高い励起照明下でオフにする必要があります。これは、分子の大部分からの蛍光シグナルの抑制をもたらします。特定のインスタンスでは、蛍光体の非常に少数が確率的に「オン」の状態に戻ります。これらは、まばらに分布するので、切り替える前に、1つまたは少数のフレームのための単一分子として可視化することができると期待される「オフ」をされている - (647 NM 640)photoswitchingダイナミクスは、励起強度および-SHの濃度に強く依存しており、従って、所与のシステムのため、注意は、特に、比較的高い励起強度は、適切な標識密度を最適化するように注意しなければなりませんアレクサフルオロ647分子の大部分をオフにする必要がありました。励起は、アレックスフルーア647意志のかなりの部分が十分に強くない場合単一分子蛍光を観察することの難しさ、高いバックグラウンドで、その結果、「オン」状態に残り、そして、最終的には、質の悪い単分子定位結果。各分子は明確な検出および局在解析を可能にするのに十分に希薄である一方で、適切にバランスのとれた状態で、単一分子の生データは、フレーム( 図2B)当たりの分子(数百)の十分な数を含める必要があります。 iPALMため、photoswitchingの原理は、PALMまたはSTORMのものと同一であるので、適切iPALMために調製された試料を直接単純な3D-PALMまたは3D-STORMシステムで使用することができることも注目に値します。ナイキストサンプリングを満たすために、分子の十分に高い密度を取得するには、通常、生データの50,000以上のフレームが必要とされている( すなわち、3台のカメラ150,000合計フレーム)。取得が進行すると、フルオロフォアの増加分率は、スパーを生じ、破壊的光退色により枯渇することができ単一分子密度のser。これを補償するために、405nmの青色光(405 nm)での短いパルスは、フルオロフォアの活性化を促進するために、間隔をおいて試料に照射することができます。
必要な長い取得時間に、iPALM(または一般に単一分子の局在顕微鏡)のための最適な結果は、低いサンプルドリフトおよび/または良好なドリフト補正を必要とします。例えば、フレーム転送モード(20Hzのフレームレート)で50ミリ秒の露光時間を用いて、50,000フレームの総取得時間は42分です。この期間中に、数十nm以上の機械的ドリフトが期待されます。実際、高ローカライズ精度と高ラベリング密度に加え、解像度もドリフト補正の品質に依存します。熱揺らぎが主な原因であることと、これらのドリフトへの複数の起源があります。 iPALM部がインバー、低熱膨張合金、またはステンレス鋼を使用して、カスタム加工されることが可能この考察に、それらの両方は、真鍮又はアルミニウムよりもはるかに低い熱膨張特性を有します。残念ながら、これはまたマシンにはるかに安価かつ容易であること、光学機械部品のためのより一般的に使用される金属であるアルミニウムに対する追加コストを相対的に、課します。ドリフトの他の供給源は、周辺機器、周囲の環境、または空気の流れから機械的振動することができます。これらは、適切な筐体内にシステムを配置することにより、顕微鏡の領域における空気の流れ方向をリダイレクトすることによって最小化されるべきです。可能な、ファン含有成分は、光学テーブルを離れて置かれるべきである場合、セットアップは、研究用光学テーブル上に構築されるべきです。それにもかかわらず、すべての予防措置にもかかわらず、ドリフトのいくつかの量が残ります。批判的に、これらのドリフトは、画像が取得時間を通して焦点に残るように最小化されなければなりません。我々のシステムでは、これらの受動的な方法は、許容可能なレベルへのドリフトを最小限にするために十分です。しかし、アクティブドリフトCOMを実装することが可能であるべきです長期的かつ高精度イメージング32を有効にするには、pensation方法。
セット1,000万単一分子ピーク - 生データの処理に続いて、3D定位座標は、典型的には、5を得ることができます。 図3に示すように 、時間の関数としてのドリフトは、基準点の定位座標から可視化することができます。複数の基準点は、平均ドリフト補正の軌跡( 図3A-B)を計算するために使用することができます。また、ローカリゼーション分析中に2D-ガウス関数に乏しいフィットピークを除外するのが通例です。これは、スプリアスノイズや部分的に重複する単一分子のピークが原因である可能性があり、フィッティングプロセス中に計算された大きな残留二乗誤差によって区別することができます。このように低輝度(光子計数によって示されるように)と、高い不確実性を持つピークが( すなわち、〜25 nmのより大きい)も、除外されこれらはおそらく、非特異的バックグラウンド蛍光から生じるのです。得られたz座標は信頼できないとして同様に、3カメラチャネルから強度が検量線に不十分フィットするためのピークも、拒否されます。 iPALM(および一般に局在顕微鏡)の完全な情報内容はフォア座標で、だけでなく、しかしなど強度、幅、明るさ、などいくつかの追加のパラメータだけでなく、解析結果ので、大規模であることに留意すべきです比較的少ない計算ツールは、座標空間の分析のために現在利用可能であるため、実際には、ローカライズ座標は一般的にレンダリングされるか、さらなる分析のためにピクセルベースの画像に再構成される。
iPALM画像再構成のために一般的に使用されるアプローチは、ガウとして設定ローカライゼーションの不確実性と、各局在が正規化された2次元ガウス関数との調整表すことですssian幅33。低精度の座標(典型的には、低輝度や高いバックグラウンド単一分子のピークが)調光器と広いとして表示しつつ、高精度の座標(低背景に対して輝度の高い一般的に単一分子ピークは)、など鋭く狭いピークに表示されますピーク。このようにして、各分子は、画像強度の同量に寄与する。 3Dデータセットの場合、z座標は、典型的には、色相スケール( 図4C-D)に基づいて色を使用して表すことができます。あるいは、画像は、側面図(X、Z又はY、Z)投影として、またはボリュームとして示すことができます。公に利用可能なソフトウェアの数は、データ34を視覚化するために使用することができます。
図4-6に示すように、iPALM画像が回折限界蛍光顕微鏡上有意な改善をもたらします。 HUVEC細胞におけるF-アクチンアーキテクチャが大幅に強化された空間RESOで可視化することができますリューション。個々のフィラメントは区別できないが、ストレス繊維束、及び葉状仮足に、密集したF-アクチンネットワークが、繊維状組織を有することが観察されるのに対し、皮質の領域では、異なるフィラメントのネットワークは、見ることができます。これは、蛍光体の輝度およびローカリゼーション精度の両方の制限に起因する可能性が高いです。明確な皮質フィラメントの存在は、F-アクチンネットワークの超微細構造が十分によく保存されていることを示唆しています。このように、iPALMは、皮質アーキテクチャを特徴づけるための有用なツールである可能性があります。 図5において、HUVEC細胞のサブ領域を定量し、アクチンフィラメントのプロファイルで表示されます。フィラメントのzヒストグラムiPALMのにZ分解能に対しての有意な解像度の改善をもたらすことを示し、横方向(x、y)はビューの〜45nmのに比べて、比較的小さい幅が約15nmであることがわかります予想されるように、X、Y平面、。しかし、ACTU以来F-アクチンのアル直径は〜8 nmである、観測されたフィラメントは、単一のフィラメントまたは少数のフィラメントの束であるかどうかは不明です。このアプローチはまだF-アクチン23を研究するために適用されていないもののiPALMとEMを使用して相関イメージングは、F-アクチンアーキテクチャのさらなる特徴付けのために有用な戦略である可能性があります。
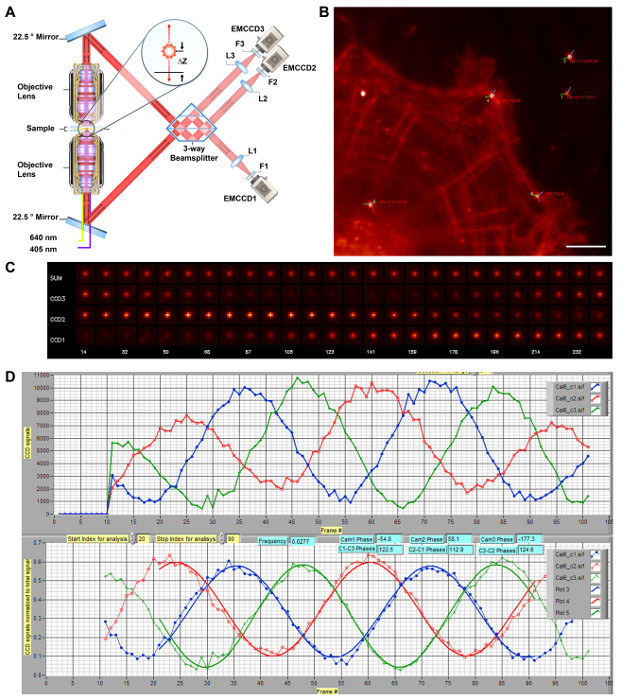
図1:iPALM 3-D超解像顕微鏡の概略図。 iPALM光学系のA)回路図。デュアル対物レンズ(ニコン、NA 1.49 60X)がそれぞれ放出される蛍光光子が上部と下部の光ビーム経路の両方を介して伝播することを可能にする、と彼らは22.5°に配向一対のミラーによってビームスプリッタに干渉するようにリダイレクトされます。自己干渉光子の位相は、従って、フルオロフォアのz座標コード、δZに直接比例し、私たちを測定することができます。3つの出力ビーム間〜120度の相互位相差を有する3ウェイビームスプリッタる。これらは、チューブレンズ(L1-L3、F = 400nmで)によって集束および発光フィルターによってフィルタリングされる(F1 - F3)。各単一分子は、したがって、カメラ間の異なる強度(EMCCD1-3)にも同様のx、y座標で表示されます。(A)参考文献から再生され、修正されます。アレクサフルオロ647明るいスポットとF-アクチンのために標識されたHUVEC細胞の11(B)回折限界画像は、Auナノ粒子の基準点を表します。カメラ#1の位相角 - 3は、それぞれ、赤、緑、青の線で示される各基準点を中心に、#1のカメラとの間の位相差としている - 3が示されました。スケールバー:5μmの干渉効果を示す(C)基準点の画像。 (nm単位で、一番下の行に)z位置とした金ナノ粒子の各カメラのための基準(CCD1-3)または合計(合計)、の画像は、キャリブレーションのためにスキャンされます。 EA内の強度(B)に示すようにCHカメラは、位相関係で振動することがわかる。(D)iPALM較正曲線。サンプルは、z軸に沿って平行移動されます。 EMCCD1-3ための金ナノ粒子基準の強度は、赤色、緑色、及び青色の線、それぞれ(上)として示しています。次いで、これらを標準化し、位相差(下)を決定するために合います。位置合わせの際に、システムは、すべての3つのカメラ間の最大位相差を達成するように調整されます。検量線は、それぞれ単一分子の-z座標の抽出に使用するように各撮像サイトで取られている。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:Photoswitching アルの1分子イメージングエクサフルーア647ファロイジンアクチンラベルとして。 (A)初期photoswitchingステップ。固定された細胞におけるF-アクチンは、ほとんどの蛍光体の迅速なスイッチオフでチオール含有画像バッファ結果にアレクサフルオロ647高輝度照明に結合ファロイジンにより高密度で標識されている。(B)生の単一分子の代表的なフレームフレーム。定常状態の点滅では、活性化されたアレクサフルオロ647は、個々の単一の分子がPSFサイズのスポットとして表示されていることを十分に疎であるべきです。 (A)に示した同じ細胞の画像は、逆のコントラストで示します。 AとBにおけるスケールバー:5μmのは、 この図の拡大版をご覧になるにはこちらをクリックしてください。
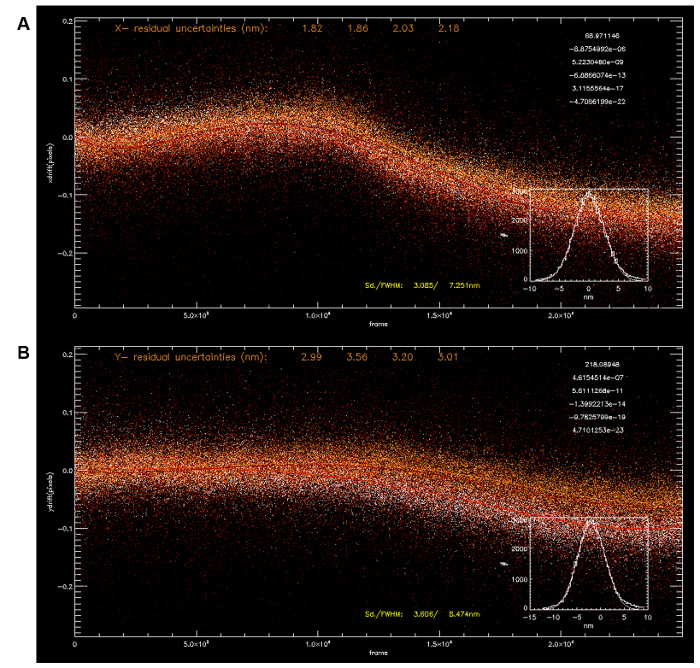
図3:Multip を使用して、ドリフト補正。ル基準点ローカリゼーションは、4つの基準点の座標を(A、x座標; Bは 、y座標)多項式フィッティングを使用してドリフトを計算するために使用した(5順目 、右上隅にフィットパラメータ)。 (:3.085 nmで、Y:X 3.606 nm)の平均ドリフト軌道は、サブ5 nmの精度でドリフトの補正を可能にする。 この図の拡大版をご覧になるにはこちらをクリックしてください。
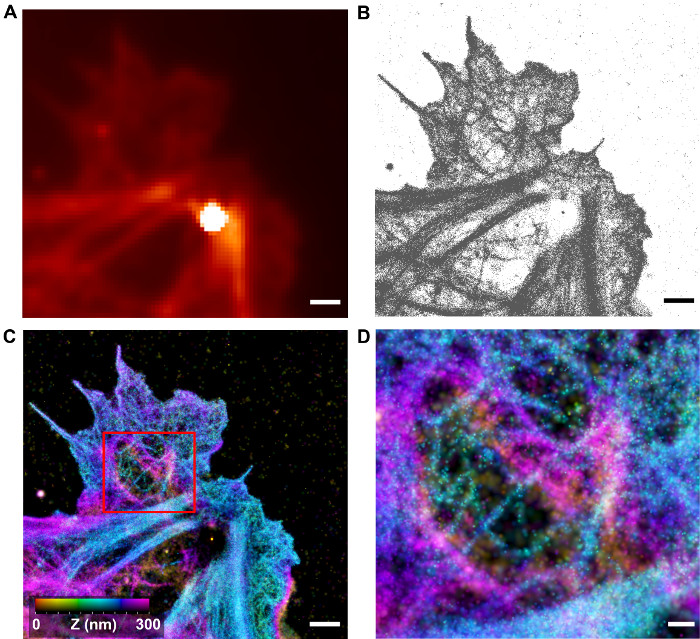
図4:iPALM による3次元のF-アクチンアーキテクチャの可視化。 (A)アレクサフルオロ647ファロイジンにより標識F-アクチンとHUVEC細胞の回折限界画像( 図2のセルのサブエリアに対応します)。明るいスポットは、Auナノ粒子の基準点に起因しています。 (B)ローカリゼーションは、各局在化と(A)。(C)中の領域のためのiPALM解析再構成iPALM画像によって決定座標は、2D-ガウス幅は、ローカリゼーションの不確実性に対応したことにより、レンダリング座標。 z座標は、カラーバーに応じて着色されています。密疎糸状機能の領域を見ることができます。スケールバー(AC):1ミクロン(D)ズーム・イン糸状皮質アクチントポロジを示すCにおける箱入りエリアの景色。スケールバー:250 nmで、この図の拡大版をご覧になるにはこちらをクリックしてください。

図5:iPALM によって可視化F-アクチンのナノスケール寸法。 (A)F-アクチン標識されたBとの再構成iPALMイメージHUVEC細胞 yのアレクサフルオロ647ファロイジン。色は、カラーバーに従ってz座標を示しています。スケールバー:1マイクロメートル(B)xの横断面のヒストグラム、Y-局在は(A)中の四角で囲まれた領域の長軸に沿って調整します。ヒストグラムを得るためには、座標が箱の長軸上に投影し、5 nmのビンサイズでビニングされています。灰色の曲線は43.88ナノメートルの半値全幅(FWHM)と、ヒストグラムのガウス最良フィットを示す。局在のz位置の(C)ヒストグラム(A)において四角で囲んだ領域の座標。 z位置は、1nmのビンサイズでビニングされています。灰色の曲線は、17.50ナノメートルのFWHMで、ヒストグラムのガウスベストフィットを示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
/files/ftp_upload/54774/54774fig6.jpg "/>
図6:F- アクチンのiPALMイメージングの比較異なる標識試薬を使用したアレクサフルオロ647ファロイジン(A)、アレクサフルオロ568-結合ファロイジン(B)を用いて標識F-アクチンの再構成iPALM画像、またはアクチンを用いたトランスフェクションすることにより-mEos2融合タンパク質発現ベクター(C)。スケールバー(AC):1μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
図1(a)に示すようiPALMの光学系は、4-πデュアル対向対物レンズの設計に基づいています。 表 1に先に23を説明し、記載されている設定は、カスタム機械加工や商業の両方の光学機械部品を用いて構成されています。私たちのセットアップに加えて、ハワード・ヒューズ医学研究所(HHMI)がJaneliaリサーチキャンパスでの高度なイメージングセンターでの科学界にアクセス可能なシステムをホストします。完全な機械図面、制御回路図、およびソフトウェアについては、読者は詳細についてHHMIでハラルドヘスにお問い合わせすることをお勧めします。 F-アクチンを可視化するためiPALMだけでなく、他の単一分子の局在顕微鏡法を使用する主な利点は、EM一般過酷なサンプル処理を必要とする技術は、面倒な準備、および高度に熟練した開業医3,23に比べて試料調製が比較的容易です。 Additionallyは、蛍光はEMのための困難なままでマルチチャンネルイメージング、に自然に適しています。さらに以下に記載されるように、それにもかかわらず、試料調製及びイメージングプロセスの点で両方のアプローチのためのいくつかの現在の制限があります。 EMのサンプル調製の場合のように、解像度の回折限界レベルのための適切なプロトコルは、ナノスケールレベルで深刻な摂動を引き起こす可能性がありますので、まず、ケアは、標本35の良好な超微細構造保全性を確保するために取られなければなりません。アクチンのイメージングのために、細胞の適切な固定は、試料の質に影響を与える重要な因子です。抗体との共染色の例では、エピトープ部位が影響を受ける可能性があるものの、それは、非常によく細胞骨格と膜を維持するので、グルタルアルデヒドが好適な固定剤です。それはより良い抗体エピトープ部位を維持する傾向があるような場合において、パラホルムアルデヒドは、許容可能な妥協点を提供することができます。重要な単一分子の局在顕微鏡検査のために、これらの固定剤は、傾向がありますバックグラウンド自己蛍光を生成します。このように、水素化ホウ素による後固定消光は、特にグルタルアルデヒドの場合には、必要です。
さらに、フルオロフォアと標識戦略の適切な選択は、成功した実験のための最も重要な要因の一つです。ナイキストサンプリング定理36によって規定されるによるF-アクチンのナノスケールの寸法に、ラベルの高い密度は、下にある繊維状ネットワークを捕捉するために必要とされます。アクチンのために、ファロイジンは、多くの製造業者から入手可能な有機蛍光体の広い範囲で、非常に高い密度の標識化を可能にします。ファロイジンは有毒であるので、細胞の固定及び透過処理が必要となります。生細胞互換性のあるアクチンの標識化のための代替戦略は、単量体アクチンまたは小型のアクチン結合ポリペプチドのいずれかで、蛍光タンパク質(FP)の融合を使用することを含みます。しかし、これらは、(ファロイジンと比較してより低い標識密度を生成する傾向があることがわかっ図6)。我々は、精製されたアクチンは、直接有機フルオロフォアで標識し、エレクトロポレーション37により生細胞に導入することができることに注意して、このアプローチは高価で労働集約的であると予想されます。フルオロフォアの観点から、アレクサフルオロ647は、一般的に局在化顕微鏡法のために一貫して良好な性能を提供することが見出されています。これは、単一分子のピークとバックグラウンド蛍光38のコントラスト比、輝度商の観点から説明することができます。背景が累積的にローカライズ精度が低下する可能性があるため、より高い標識密度は、高いコントラスト比を必要とします。あまり一貫性のある結果と全体の堅牢なphotoswitching性能を提供していますアレクサフルオロ647、と比較しているが、私たちの経験では、このようなATTO488、ATTO520、およびアレクサフルオロ568( 図6B)など、いくつかの他のフルオロフォアは、、F-アクチンを可視化するために使用することができます撮像バッファー条件の広い範囲。
画像形成プロセスに関しては、生物学的画像化方法の限界は、多くの場合、空間解像度、時間解像度、および撮像範囲(視野/被写界深度の両方において、トレードオフとして概念化されていますそして、持続時間)39。これは、均等iPALMの利点と限界に適用されます。他の3次元超分解能顕微鏡技術に比べて、iPALMは、x、yの解像度11よりもほぼ2倍優れZ分解能で、特にz軸に沿って、これまでの最高分解能の光学的なアプローチを続けています。検量線が周期的であるので、高zの解像度のための干渉計にiPALMの依存はまた、イメージング深さに制限を課しています。換言すれば、z座標は、すべて250nm以下程度(アレクサフルオロ647の700〜のためのnmの発光波長)を繰り返します。実際には、これは、エバネセント場の深さ内に励起領域を制限TIRF照明を使用することによって対処することができます<カバーガラスから200 nmの。このように、より深い試料に蛍光体が励起されないし、不可視のまま。しかし、これはまた、より多くの内部構造は手の届かないところであるが、このような接着斑、皮質細胞骨格、および腹側形質膜として、カバーガラスに近接したものに画像化することができる生物学的構造を制限します。固定標本の場合、1救済が40を凍結切片実行することです。しかし、このようなアプローチは非常に面倒であり、一般にはアクセスできません専門知識を必要とします。
あるいは、iPALMは、3D-STORMに使用される非点収差、デフォーカススキーム12で干渉法を組み合わせることにより、拡張zの範囲に適合させることができます。このアプローチは、デュアルz座標読み出し、高精度が、周期的である干渉による最初の、そしてあまり正確ではなく、非周期的である乱視デフォーカスによる第二を提供します。後者は、その後、「アンラップ」又は縮退を破壊するために使用することができ干渉計z座標は、このように効果的に高NA対物レンズの本質的な焦点深度に近づいて、〜750 nmのiPALMイメージング深さの三倍を可能にします。位相接続では、iPALMは、追加の40のデフォーカスにすべての3次元でわずかに減少精度ではあるが、そのようなミトコンドリアのように、深いサンプル内の画像構造に使用されてきました。
iPALMの別の本質的な制限は、撮像速度です。フレームの多数の定位座標の高い密度を得るために必要とされているので、カメラ速度は、通常、取得レートの上限です。現在のEMCCDカメラは10で動作していると - 20 MHzの読み出し速度、数十分は、フレームの十分な数のために必要とされます。このような長い時間スケールは、試料が固定されている必要があります。ここでは、そのような非常に高速の科学相補型金属酸化膜半導体(sCMOS)カメラのようなカメラ技術における最近の進歩は、IMの急速な増加を可能にすることができますこれはまだiPALMのために実装されていないが、速度41を老化。いくつかの単一分子局在化顕微鏡法アプローチのために、高密度の単分子フィールドは、修正アルゴリズム42または圧縮センシング43を用いて分析することができます。そのような戦略の適応はまた、それ故に、より少ないフレームを密単分子像を可能にすることによってiPALMを高速化することができます。
空間分解能の速度と撮影範囲の限界と強みを持つ、iPALMの主な用途は、特定のタンパク質14,15,44のナノスケール組織を発表する蛍光標識の利点を活用し、超微細方法としてあります。さらなる改善は、両方の光学系とフォア技術の面で、iPALM空間分解能のさらなる増強を有効にする必要があります。例えば、iPALM画像処理は、現在、2次元ガウス関数でモデル化され、各単一分子でれるように、比較的単純な一次近似法を採用して同位体平均双極子であることをsumed。これは、かなりの空間分解能を向上させる点広がり関数と双極子の向き、または視野を横切る光学収差の明示的な治療のより正確なモデルを用いる最近の方法で増強することができます。同様に、photocagingはマグニチュード45の命令によって、蛍光体の輝度を向上させており、報告されています。その超微細組織の重要な要素は十分に特徴づけされているので、実際、F-アクチン細胞骨格はiPALMでさらに方法論の開発をテストするための非常に貴重なモデル系である可能性があります。真のEM-レベルの解像力と光学顕微鏡によるタンパク質組織を分析する能力が大幅に細胞構造と機能の無数の側面の我々の理解を高めることが期待されます。
開示事項
著者らは、開示することは何もありません。
謝辞
YWとPKは感謝PK(NRF-NRFF-2011-04とNRF2012NRF-CRP001-084)に授与シンガポール国立研究財団から資金援助を認めます。また、インフラストラクチャのサポートのためのMBIオープンラボと顕微鏡の中核施設に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| optical table | Newport, CA | RS4000 | iPALM, installed on 4 Newport Stabilizer vibration isolators |
| vibration isolator for optical table | Newport, CA | S-2000 | |
| laser-642 | Newport, CA | 1185055 | output power=100 mw |
| laser-561 | Newport, CA | 1168931 | output power=200 mw |
| laser-488 | Newport, CA | 1137970 | output power=200 mw |
| laser-405 | Newport, CA | 1142279 | output power=100 mw |
| broadband dielectric mirrors | Thorlabs, NJ | BB1-E02 | laser combiner |
| dichroic beamsplitter | Semrock, NY | LM01-427-25 | |
| acousto-optic tunable filter | AA Opto-Electronic, France | AOTFnC-VIS-TN | |
| Linear polarizer | Newport, CA | 05LP-VIS-B | |
| baseplate | local workshop | customized | |
| turning mirror (22.5°) | Reynard Corpporation, CA | customized | 22.5° mirror |
| motorized optic mounts | New Focus, CA | 8816 | |
| motorized XYZ translation stage | Thorlabs, NJ | MT3/M-Z6 | sample holder |
| T-Cube DC servo motor controller | Thorlabs, NJ | TDC001 | |
| Piezo Phase Shifter | Physik Instrumente, Germany | S-303.CD | |
| objective lens | Nikon, Japan | MRD01691 | objective. Apo TIRF 60X/1.49 oil |
| translation stage | New Focus, CA | 9062-COM-M | |
| Pico Motor Actuator | New Focus, CA | 8301 | |
| rotary Solenoid/Shutter | DACO Instruments, CT | 5423-458 | |
| 3-way beam splitter | Rocky Mountain Instruments, CO | customized | beamsplitter |
| Piezo Z/Tip/Tilt scanner | Physik Instrumente, Germany | S-316.10 | |
| motorized five-axis tilt aligner | New Focus, CA | 8081 | |
| Picmotor ethernet controller | New Focus, CA | 8752 | |
| Piezo controllers/amplifier/digital operation module | Physik Instrumente, Germany | E-509/E-503/E-517 | |
| band-pass filter | Semrock, NY | FF01-523/20 | filters |
| band-pass filter | Semrock, NY | FF01-588/21 | |
| band-pass filter | Semrock, NY | FF01-607/30 | |
| band-pass filter | Semrock, NY | FF01-676/37 | |
| notch filter | Semrock, NY | NF01-405/488/561/635 | |
| motorized filter wheel with controllter | Thorlabs, NJ | FW103H | |
| EMCCD | Andor, UK | DU-897U-CSO-#BV | 3 sets |
| Desktop computers for controlling cameras and synchronization | Dell | Precision T3500 | PC, 4 sets |
| coverslips with fiducial | Hestzig, VA | 600-100AuF | sample preparation. fiducial marks with various density and spectra available |
| fibronectin | Millipore, MT | FC010 | |
| paraformaldehyde | Electron Microscopy Sciences, PA | 15710 | fixation. 16% |
| glutaraldehyde | Electron Microscopy Sciences, PA | 16220 | 25% |
| triton X-100 | Sigma aldrich, MO | T8787 | |
| HUVEC cells | Life Technologies, CA | C-015-10C | |
| Medium 200 | Life Technologies, CA | M-200-500 | |
| Large Vessel Endothelial Factors | Life Technologies, CA | A14608-01 | |
| Dulbecco's Phosphate Buffered Saline | 14190367 | ||
| Pennicillin/Streptomycin | 15140122 | ||
| Trypsin/EDTA | Life Technologies, CA | 25200056 | |
| PIPES | Sigma aldrich, MO | P1851 | PHEM |
| HEPES | 1st base, Malaysia | BIO-1825 | |
| EGTA | Sigma aldrich, MO | E3889 | |
| MgCl2 | Millipore, MT | 5985 | |
| Alexa Fluor 647 Phalloidin | Invitrogen, CA | A22287 | staining |
| sodium borohydride (NaBH4) | Sigma aldrich, MO | 480886 | quenching |
| glucose | 1st base, Malaysia | BIO-1101 | imaging buffer |
| glucose oxidase | Sigma aldrich, MO | G2133 | |
| catalase | Sigma aldrich, MO | C9322 | |
| cysteamine | Sigma aldrich, MO | 30070 | |
| Epoxy | Thorlabs, NJ | G14250 | |
| vaseline | Sigma aldrich, MO | 16415 | sample sealing |
| lanolin | Sigma aldrich, MO | L7387 | |
| parafin wax | Sigma aldrich, MO | 327204 | |
| Immersion oil | Electron Microscopy Sciences, PA | 16915-04 | imaging. Cargille Type HF |
参考文献
- Kanchanawong, P., Waterman, C. M. Localization-based super-resolution imaging of cellular structures. Methods Mol Biol. 1046, 59-84 (2013).
- Bertocchi, C., Goh, W. I., Zhang, Z., Kanchanawong, P. Nanoscale imaging by super resolution fluorescence microscopy and its emerging applications in biomedical research. Crit Rev Biomed Eng. 41, 281-308 (2013).
- Kanchanawong, P., Waterman, C. M. Advances in light-based imaging of three-dimensional cellular ultrastructure. Curr Opin Cell Biol. 24, 125-133 (2012).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Heilemann, M., et al. Subdiffraction-resolution fluorescence imaging with conventional fluorescent probes. Angew Chem Int Edit. 47, 6172-6176 (2008).
- Sharonov, A., Hochstrasser, R. M. Wide-field subdiffraction imaging by accumulated binding of diffusing probes. P Natl Acad Sci USA. 103, 18911-18916 (2006).
- Fölling, J., Bossi, M., Bock, H., Medda, R., Wurm, C. A., Hein, B., Jakobs, S., Eggeling, C., Hell, S. W. Fluorescence nanoscopy by ground-state depletion and single-molecule return. Nat Methods. 5, 943-945 (2008).
- Biteen, J., et al. Single-moldecule active-control microscopy (SMACM) with photo-reactivable EYFP for imaging biophysical processes in live cells. Nat Methods. 5, 947-949 (2008).
- Shtengel, G., et al. Interferometric fluorescent super-resolution microscopy resolves 3D cellular ultrastructure. P Natl Acad Sci USA. 106, 3125-3130 (2009).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319, 810-813 (2008).
- Dani, A., Huang, B., Bergan, J., Dulac, C., Zhuang, X. Super resolution imaging of chemical synapses in the brain. Neuron. 68, 843-856 (2010).
- Liu, J., et al. Talin determines the nanoscale architecture of focal adhesions. P Natl Acad Sci USA. 112 (35), E4864-E4873 (2015).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468, 580-584 (2010).
- Wu, Y., Kanchanawong, P., Zaidel-Bar, R. Actin-delimited adhesion-independent clustering of e-cadherin forms the nanoscale building blocks of adherens junctions. Dev Cell. 32 (2), 139-154 (2015).
- Szymborska, A., et al. Nuclear Pore Scaffold Structure Analyzed by Super-Resolution Microscopy and Particle Averaging. Science. 341, 655-658 (2013).
- Lawo, S., Hasegan, M., Gupta, G. D., Pelletier, L. Subdiffraction imaging of centrosomes reveals higher-order organizational features of pericentriolar material. Nat Cell Biol. 14, 1148-1158 (2012).
- Mennella, V., Agard, D. A., Huang, B., Pelletier, L. Amorphous no more: subdiffraction view of the pericentriolar material architecture. Trends Cell Biol. 24, 188-197 (2014).
- Mennella, V., et al. Subdiffraction-resolution fluorescence microscopy reveals a domain of the centrosome critical for pericentriolar material organization. Nat Cell Biology. 14, 1159-1168 (2012).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463, 485-492 (2010).
- Salbreux, G., Charras, G., Paluch, E. Actin cortex mechanics and cellular morphogenesis. Trends Cell Biol. 22, 536-545 (2012).
- Shtengel, G., et al. Imaging cellular ultrastructure by PALM, iPALM, and correlative iPALM-EM. Method Cell Biol. 123, 273-294 (2014).
- Juette, M. F., et al. Three-dimensional sub-100 nm resolution fluorescence microscopy of thick samples. Nat Methods. 5, 527-529 (2008).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. 19, 555-565 (2009).
- Shannon, C. Communication in the presence of noise. Proc. IRE. 37, 10-21 (1949).
- Good, N. E., et al. Hydrogen ion buffers for biological research. Biochemistry. 5, 467-477 (1966).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophys J. 94, 1826-1835 (2008).
- Shin, W. D., et al. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Swedlow, J. R., Spector, D. L. , Cold Spring Harbor Laboratory Press. (2010).
- Aquino, D., et al. Two-color nanoscopy of three-dimensional volumes by 4Pi detection of stochastically switched fluorophores. Nat Methods. 8, 353-359 (2011).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nat Methods. 8, 1027-1036 (2011).
- Pertsinidis, A., Zhang, Y., Chu, S. Subnanometre single-molecule localization, registration and distance measurements. Nature. 466, 647-651 (2010).
- Baddeley, D., Cannell, M. B., Soeller, C. Visualization of Localization Microscopy Data. Microsc Microanal. 16, 64-72 (2010).
- El Beheiry, M., Dahan, M. ViSP: representing single-particle localizations in three dimensions. Nat Methods. 10, 689-690 (2013).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. Immunolabeling artifacts and the need for live-cell imaging. Nat Methods. 9, 152-158 (2012).
- Shroff, H., Galbraith, C. G., Galbraith, J. A., Betzig, E. Live-cell photoactivated localization microscopy of nanoscale adhesion dynamics. Nat Methods. 5, 417-423 (2008).
- Yamashiro, S., et al. New single-molecule speckle microscopy reveals modification of the retrograde actin flow by focal adhesions at nanometer scales. Mol Biol Cell. 25, 1010-1024 (2014).
- Shroff, H., et al. Dual-color super resolution imaging of genetically expressed probes within individual adhesion complexes. P Natl Acad Sci USA. 104, 20308-20313 (2007).
- Chen, B. C., et al. Lattice light-sheet microscopy: imaging molecules to embryos at high spatiotemporal resolution. Science. 346, (2014).
- Brown, T. A., et al. Super resolution fluorescence imaging of mitochondrial nucleoids reveals their spatial range, limits, and membrane interaction. Mol Cell Biol. 31, 4994-5010 (2011).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Daostorm, S. DAOSTORM: an algorithm for high-density super-resolution microscopy. Nat methods. 8, 279(2011).
- Zhu, L., Zhang, W., Elnatan, D., Huang, B. Faster STORM using compressed sensing. Nat Methods. 9, 721-723 (2012).
- Van Engelenburg, S. B., et al. Distribution of ESCRT machinery at HIV assembly sites reveals virus scaffolding of ESCRT subunits. Science. 343, 653-656 (2014).
- Vaughan, J. C., Jia, S., Zhuang, X. Ultrabright photoactivatable fluorophores created by reductive caging. Nat Methods. 9, 1181-1184 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved