Method Article
תלת מימדי סופר רזולוציה מיקרוסקופית של סיבים F- אקטין ידי interferometric PhotoActivated לוקליזציה מיקרוסקופית (iPALM)
In This Article
Summary
אנו מציגים פרוטוקול עבור היישום של interferometric PhotoActivated לוקליזציה מיקרוסקופי (iPALM), שיטה מיקרוסקופית 3 ממדי מולקולה בודדת לוקליזציה סופר רזולוציה, אל ההדמיה של שלד התא יקטין בתאי יונקים חסידים. גישה זו מאפשרת הדמיה מבוססת אור של תכונות מבניות ננו שאחרת נותרו לא פתורים על ידי מיקרוסקופיה אופטית-מוגבל עקיפה קונבנציונלית.
Abstract
מיקרוסקופ פלואורסצנטי מאפשר הדמיה ישירה של ביומולקולות ספציפיות בתוך תאים. עם זאת, עבור מיקרוסקופ פלואורסצנטי קונבנציונאלי, ברזולוציה מרחבית מוגבלת על ידי עקיפה ל ~ 200 ננומטר בתוך המטוס תמונה> 500 ננומטר לאורך הציר האופטי. כתוצאה מכך, מיקרוסקופ פלואורסצנטי ארוך הוגבל קשות בהתבוננות תכונות ultrastructural בתוך תאים. ההתפתחות האחרונה של שיטות מיקרוסקופיה ברזולוציה סופר יש להתגבר על מגבלה זו. בפרט, כניסתו של fluorophores photoswitchable מאפשרת מיקרוסקופיה ברזולוציה סופרת מבוסס לוקליזציה, המספקת כושר הפרדה מתקרב המולקולרי באורך. כאן אנו מתארים את היישום של שיטה מיקרוסקופית תלת ממדי סופר רזולוציה המבוססת על מיקרוסקופיה לוקליזציה מולקולה בודדת ו interferometry רב שלבית, שנקראה interferometric PhotoActivated לוקליזציה מיקרוסקופי (iPALM). שיטה זו מספקת רזולוציה איזוטרופיים כמעט עלבסדר גודל של 20 ננומטר בכל שלושת הממדים. פרוטוקולים לדמיין את cytoskeleton יקטין פילמנטיות, כולל הכנת דגימת פעולת מכשיר iPALM, מתוארים כאן. פרוטוקולים אלה הם גם להתאמה ומאלף בקלות לחקר תכונות ultrastructural אחרות בתאים.
Introduction
הדמיה של מבנים הסלולר מורכב כבר זמן רב חלק בלתי נפרד תובנות ביולוגיות וגילוי. למרות מיקרוסקופ פלואורסצנטי יכולים תאי תמונה עם ייחוד מולקולרי גבוה, כושר ההפרדה שלה הוא מוגבל על ידי דיפרקציה ל ~ 200 ננומטר במישור התמונה (x, y, או ממד לרוחב) ו> 500 ננומטר לאורך הציר האופטי (z, או ממד צירי) 1,2. לפיכך, התצפית של תכונות ultrastructural הסטוריות הוגבלה במיקרוסקופ אלקטרונים (EM). למרבה המזל, ההתפתחות האחרונה של מיקרוסקופיה ברזולוציה סופר עקפה ממגבלה זו, מה שמאפשרת רזולוציה מרחבית של 10 - המגוון 100 ננומטר 1-6. בפרט, ברזולוציה סופר גישות המבוססת על לוקליזציה מולקולה בודדת, מוכרת בראשי תיבות כגון PALM (מיקרוסקופי לוקליזציה PhotoActivated) 4, FPALM (מיקרוסקופי לוקליזציה PhotoActivated קרינה) 5 (ד) STORM (מיקרוסקופי שחזור אופטי סטוכסטיים ישיר) 6,7, צבע ( Poהצטברות int עבור טופוגרפית ננו הדמיה) 8, GSDIM (קרקע מדינת דלדול מיקרוסקופי ואחריו לחזור מולקולרי בודד) 9, או SMACM (מולקולה בודדת Active-Control מיקרוסקופית) 10, וכן 3-ממדי (3D) ליישומם, כגון PALM interferometric (iPALM) 11 או 3D-STORM 12, כבר ערך בחשיפת תובנה רומן לתוך הארגון בקנה המידה ננומטרי של מבנים ביולוגיים רבים, בם אקסונים עצביים וסינפסות 13, מוקדי הידבקויות 14,15, צמתי תאי תאים 16, גרעיני נקבובי 17 , ו centrosomes 18-20, עד כמה שם.
תכונה נוספת ultrastructural בתאים עבורו מיקרוסקופ ברזולוציה סופר הוא שעשוי להיות שימושי הוא cytoskeleton אקטין. Meshwork המורכב של filamentous (ו) -actin בקליפת התא ממלא תפקיד חיוני בבקרה של צורה הסלולר תכונות מכאניות 21. ארגון of F- יקטין הוא פעיל באופן דינמי מוסדר אף חלבוני רגולטורים רבים משפיעים במידה רבה על פילמור, crosslinking, מחזור, יציבות, טופולוגיית רשת 22. עם זאת, למרות האפיון של אדריכלות meshwork F- יקטין חשוב תובנות מכניסטית לתוך מגוון רחב של תהליכים תאיים, בגודל הקטן (~ 8 ננומטר) של חוטי F- יקטין סלים לקיומם על ידי מיקרוסקופ אור-מוגבל עקיפה הקונבנציונלית; וכך, ההדמיה של מבנה עדין יקטין עד כה בוצעה באופן בלעדי על ידי EM. כאן אנו מתארים פרוטוקולים המאפשרים הדמית שלד תא F- יקטין בתאי יונקים חסידים, באמצעות טכניקת מיקרוסקופיה סופר רזולוצית iPALM לנצל יכולת הדיוק שלה גבוהה מאוד ב -3 D 11,23. למרות המכשיר iPALM מתמחה מאוד, הדרכה על הגדרת מכשיר כזה תוארה באחרונה 23, תוך גישה למיקרוסקופ iPALM בהנחיית הובמחלקה יוז רפואי מכון גם נעשה זמין לקהילה מחקר עם עלות מינימלית. בנוסף, שיטות הכנת הדגימה כפי שתתוארנה בהמשך חלות ישירות גישות ברזולוצית סופר 3D אלטרנטיביות, כמו אלו המבוססים על defocusing אסטיגמאטיק של פונקצית התפשטות נקודה (כוחות הביטחון הפלסטיני) 12 או דו-מטוס זיהוי 24, שהן לזמינות באופן נרחב יותר.
נציין כי מרכיב הכרחי עבור מיקרוסקופיה ברזולוציה הסופרת מבוססת לוקליזציה מולקולה בודדת בכלל הוא fluorophore photoswitchable 25, אשר מאפשר שלוש הדרישות הקריטיות עבור מיקרוסקופיה ברזולוציה סופרת מבוססת לוקליזציה מולקולה בודדת להתגשם: אני) מולקולה בודדת גבוהה בהירות יחסית בניגוד לאותות רקע; ii) ותפוצה דלילה של מולקולות בודדות בתוך מסגרת תמונה נתונה; ו- III) צפיפות מרחבית גבוהה של תיוג מספיק כדי ללכוד את הפרופיל של המבנה הבסיסי (הידוע גם בשם נייקוויסט-Shaקריטריון הדגימה nnon) 26. כך, תוצאות משביעות רצון, יש לשים דגש לא פחות משני ההכנה הנכונה של דגימות כדי לייעל photoswitching fluorophore וכדי לשמר את ultrastructure הבסיסית, כמו גם על היבטי מכשור ורכישת הניסויים.
Protocol
1. הכנת הדגימה הדמיה
- מאז אותות הקרינה רקע להפריע הקרינה מן תוויות fluorophore, לנקות את coverglasses ידי שטיפה אותם קודם במים דה מיונן (DDH 2 O) ולאחר מכן אוויר ייבוש אותם באמצעות אוויר דחוס. בהמשך לכך, לבצע תחריט הפלזמה שואב פלזמה במשך 15 שניות, או יותר במידת הצורך.
- כדי לאפשר תיקון להיסחף וכיול iPALM, השתמש # 1.5 עגול (22 מ"מ קוטר) coverglasses מראש לנקות מוטבעת עם חלקיקי ניאון כמו סימני fiducial, המשמשים fiducials photostable כפי מאוד לכיול אמין תיקון להיסחף. בשל הזמן הרב הנדרש לרכישת לצבור צפיפות fluorophore מספיק (> 15 - 30 דקות), להיסחף המדגם הוא בלתי נמנע.
- מניחים כל coverglass fiducialed לתוך צלחת בתרבית רקמה 6 באר. לעקר אותם על ידי אולטרה סגול (UV) במנדף זרימה למינרית במשך 15 דקות.
- במנדף זרימה למינרית סטרילי, להכין פיברופתרון nectin לציפוי coverglass ידי דילול 1 מ"ג / פתרון מניות פיברונקטין מ"ל מלוחים שנאגרו פוספט של סטרילית Dulbecco (DPBS) לריכוז סופי 2 - 10 מיקרוגרם / מ"ל. יש לשטוף כל coverglass שלוש פעמים עם DPBS דגירה עם 2 מ"ל של פתרון פיברונקטין לילה ב 4 מעלות צלזיוס. בהמשך לכך, לשאוב את הפתרון פיברונקטין ולשטוף פעם עם DPBS.
- שוטפים את התאים בקצרה עם DPBS. דגירה עם 1 - 2 מ"ל של טריפסין במשך כמה דקות ב 37 מעלות צלזיוס עד שהתאים לנתק להרוות עם ~ 10 מ"ל של מדיום תרבית תאים המכיל סרום טריים. לדוגמא, עבור תאי אנדותל וריד אדם טבור (HUVEC), להשתמש במדיום תרבות אנדותל כלי גדול בתוספת גורמי אנדותל הכלי גדולים ו פניצילין או סטרפטומיצין.
- Replate התאים על coverglass מצופה פיברונקטין (עבור צפיפות דלילה, צלחת <50,000 תאים לכל coverglass) ולשמור על תרבות להגדיר באינקובטור ב לחות 95%, 5% CO 2, ו -37 & #176; ג.
- לשימור תקין של מבנים קנס של שלד התא F- אקטין, השתמש תמיסות בופר מבוסס על ריאגנטים חיץ של טוב 27.
- לדוגמה, להכין חיץ PHEM כפתרון 2x המניות (120 צינורות מ"מ, 50 מ"מ HEPES, 20 מ"מ EGTA, 4 מ"מ MgCl 2, pH 7.0 עם KOH) על ידי המסת 6.5 גרם של HEPES, 3.8 גרם של EGTA, ו -190 מ"ג MgCl 2 ב ~ 300 מ"ל של DDH 2 O, עם pH מותאם 7.0 על ידי תוספת dropwise של פתרון KOH מרוכז; אז, להוסיף DDH 2 O ולהביא את נפח 500 מ"ל. לעקר את החיץ באמצעות מסנן 0.22-מיקרומטר, ולאחסן אותו ב 4 ° C, ו לדלל אותו 1: 1 עם DDH 2 O לפני השימוש.
- לקבלת התוצאות הטובות ביותר עם תיוג צפיפות גבוהה של F- אקטין, שימוש phalloidin מצומדות עם fluorophores אורגני, כגון Alexa פלואוריד 647. בנקודת הזמן הרצוי לאחר replating תא, לתקן את התאים כדלקמן:
- לשאוב את התקשורת בין כל תרבות היטב המכיל את ceדגימה שנייה של שנה. בעדינות אך במהירות לוותר 2 מ"ל של חם (37 מעלות צלזיוס) fixatives מיצוי המכיל glutaraldehyde 0.25% במאגר PHEM עם 0.25% Triton X-100. דגירה זה בטמפרטורת החדר למשך 1 - 2 דקות. על הצעדים הבאים, השתמש 2 מ"ל של מקבע או מרווה חיץ לכל coverglass, אלא אם כן צוין אחרת.
- החלף את מקבע החילוץ עם מקבע glutaraldehyde 2.5% חיץ PHEM ולתת דגימות דגירה במשך 10 - 12 דקות. זה והצעדים הבאים כל מבוצעים בטמפרטורת חדר.
- לשאוב את fixatives בעדינות להחליף אותם עם חיץ PHEM. הטיה ו מערבולת בעדינות, ולאחר מכן לשטוף שוב עם PHEM. חזור פעמיים.
- כדי להרוות autofluorescence מן glutaraldehyde, אשר יכול להציף אותות מן fluorophores הרצוי, דגירה דגימות עם חיץ מרווה מוכן טרי המכיל NaBH 4 בריכוז המוני של 0.1% ב PHEM. בועות פזרני יקויימו. לפעמים הקש על צלחת מדגם בעדינות dislodge הבועות. תן לזה דגירה במשך 5 - 10 דק '.
- לשאוב את החיץ מרווה בעדינות להחליף אותו עם חיץ PHEM. יש לשטוף כמה פעמים כדי לסלק את הבועות. פיפטה 2 מ"ל של PHEM חיץ ולתת לו דגירה בחושך במשך 5 דקות. חזור פעמיים ולתת לשאר הדגימה במאגר PHEM בסיום.
- הכינו תא לחות עבור phalloidin הדגירה באמצעות ניילון גדולה בצלחת פטרי מרופדת פיסת מגבת נייר טבולה בנדיבות עם 5 - 10 מ"ל של DDH 2 O. מניח גיליון גדול של Parafilm הנקי על גבי מגבת נייר הרטובה.
- בשל העלות הגבוהה יחסית של phalloidin שכותרתו, השתמש נפח קטן עבור כל תיוג. תיוג צפיפות גבוהה, להתחיל עם ריכוז של 0.3 מיקרומטר. הכן ~ 60 μl לכל coverglass באמצעות phalloidin-Alexa פלואוריד 647 חיץ PHEM.
- פיפטה 55 - 60 μl של פתרון phalloidin על הסדין Parafilm בתא לחות. בעזרת מלקחיים בסדר, בעדינות להסיר את הדגימה covergבַּחוּרָה. היזהר לציין בפניו תא המכיל הנכון.
- במהירות לטפוח בעדינות משם חיץ עודף על ידי נגיעה בקצה coverglass עם דף מקופל של נייר סופג עדין, ולאחר מכן למקם בצד התא coverglass פונה כלפי מטה על ירידה של פתרון phalloidin על Parafilm. ודא שאין בועות הלכודות על ידי coverglass.
- מניחים את המכסה על תא לחות. עוטף את החדר בנייר אלומיניום כדי להגן עליו מפני אור סביבתי, ולתת מדגם דגירת הלילה ב 4 ° C.. המדגם יכול להיות כל הזמן במצב זה במשך כמה ימים. ודא כי בתא הלחות נשאר לח אם מתוכנן לאחסון ארוך.
- לפני הדמיה, בעדינות למקם בצד התא coverglass עד לצלחת 6-באר חדשה המכילה 2 מ"ל של חיץ PHEM לכל טוב.
- כן מאגרי הדמיה מפסולת-חמצן מבוסס תיאול באמצעות פתרונות המניות הבאים: 1 M גלוקוז, 1 cysteamine M, ו גלוקוז אוקסידאז 100x / mixt אנזים קטלאזיור (4 מ"ג catalase ו -10 מ"ג של גלוקוז אוקסידאז ב 100 μl של חיץ PHEM, מעורבב היטב על ידי vortexing) 28. ממש לפני הדמיה, לערבב 75 μl של 1 M פתרון גלוקוז, 30 μl של 1 M פתרון cysteamine, ו -3 μl של 100x תערובת אנזים המניות. כוון את עוצמת הקול עד 300 μl עם חיץ PHEM ולהשתמש מיד לאחר ערבוב לעלות במדגם.
- לקבלת iPALM, להכין את המדגם הדמיה באמצעות coverglass 1.5 מראש לנקות # (קוטר 22 מ"מ).
- לחלופין, להשתמש זכוכית שקופית (3 "x 1") עם spacer דבק דו צדדי כדי לסייע באסיפה אם-STORM 3D מבוסס אסטיגמציה 12 הוא לשמש במקום.
- כדי להרכיב את מדגם הדמיה, להשתמש במלקחיים בסדר להסיר את coverglass הדגימה בעדינות מתוך המאגר היטב. ואז, במהירות ובעדינות בקצות האצבעות שלכם חיץ עודף על ידי נגיעה בקצה coverglass עם נייר סופג מקופל.
- מניחים בצד התא coverglass פונה כלפי מעלה על פיסת נייר העדשה נקי. יש לשטוף את המדגםעל ידי הצבת 30 - 50 μl של חיץ הדמיה על המדגם, ולהסיר עודפי חיץ ידי הטיה קשה עם נייר סופג מקופל.
- חזור על שלב השטיפה כמה פעמים, ולאחר מכן למקם 30 - 50 μl של חיץ הדמיה על המדגם. כתם לייבש את קצה coverglass ולמקם מספר נקודות קטנות מאוד של אפוקסי מהיר ריפוי על השטח המיובש.
- לאט לאט להוריד מראש לנקות אחר coverglass 1.5 # (רגיל, עגול coverglass, 18 מ"מ קוטר) על גבי במרכז של coverglass 22 מ"מ המכילים תאים. תנו חיץ ההדמיה להרטיב הן coverglasses ידי פעולת נימים. הנקודות הקטנות של אפוקסי מהיר ריפוי צריכות לדבוק בשני coverglasses.
- לחץ בעדינות על המדגם נאסף באמצעות נייר סופג מקופל להפיץ את הלחץ באופן שווה. הפעל לחץ מספיק כדי להפוך את המדגם תא-דק ואפילו (<15 מיקרומטר), אבל לא כל כך הרבה כמו לרסק את התאים. מדוד את העובי הנאות על ידי תבנית הטבעות של ניוטון. כמו כן, הקפד לבצע את זה stEP בעדינות כדי למזער בועות אוויר. במידת הצורך, להתאמן עם פעמי coverglasses כמה הריקה לפני כן.
- חותם את המדגם עם וזלין-לנולין-פרפין נמס (VALAP, מלאי מוכן מן 100 גרם כל אחד וזלין, לנולין, פרפין, הותכו יחד) 29, יש לשטוף את המדגם חתום עם DDH 2 O, מכה יבשה עם אוויר דחוס. המדגם הוא מוכן כעת גובר על מיקרוסקופ הדמיה.
2. מיקום לדוגמא מערך iPALM
- הזז את העדשה האובייקטיבית הקפיץ העליונה כלפי מעלה כדי לאפשר את הסרת בעל המדגם. מניח את הדגימה האטומה מוכנה בשלב 1.10 על בעל המדגם ומאובטח עם מגנטים נדיר ארץ קטנים מספר. החל שמן טבילה משני צידי מדגם ההדמיה. מניח את בעל המדגם בחזרה לתוך הנתיב האופטי בעדינות להוריד את העדשה האובייקטיבית העליונה.
- הפעל לייזרי העירור. הפעל את ההתקן תשלום מצמידים הכפלת אלקטרונים (EMCCD) מצלמה במצב מסגרת העברה.
- סובב את מסנני פליטה הנאותים. הפעל תריס מכני לחסום נתיב קרן העליון (איור 1 א) ולפתוח את נתיב קרן התחתונה. תביא את העדשה האובייקטיבית התחתונה אל מוקד על ידי תרגום במרווחים קטנים באמצעות מפעיל piezo.
- לאחר fiducial הוא בפוקוס, לפתוח את נתיב הקרן העליון תוך חסימת נתיב הקרן התחתונה ולהביא את העדשה האובייקטיבית העליונה אל מוקד באופן דומה. צג רוחב fiducial על צג המחשב עבור להתמקד אופטימלית.
- לקבלת centration הנכונה, הפתוח הוא בשורה העליונה והן נתיבי קורה תחתונים. התאמה ידנית העדשה האובייקטיבית העליונה בעוד המטרה התחתונה מוחזקת קבועה בעזרת זוג ברגי סט עדין מייקרו, עד שתמונות fiducial הם חפפו ככל האפשר, באופן אידיאלי בתוך פיקסל אחד.
- בהמשך לכך, לבצע התאמות בסדר כך שהתמונות fiducial בשלב 2.3 חפיפה בתוך עשירית פיקסל EMCCD. התאם העליון2-ציר מראות מותקנות פייזו באמצעות תוכנות שליטה בעת לחיצה על שניהם עדשות אובייקטיביות ההשתקפות התחתונה מראות מתמיד. השווה את המרכזים של fiducials של העליון ונופי המטרה התחתונים באמצעות צג המחשב כדי להנחות את התהליך.
כיול 3. הגדרת iPALM
הערה: מאז פליטת קרינה היא מבולבלת, להפרעה להיות שנצפתה iPALM, נתיב אורכי דרך החלק העליון ויעדים תחתונים חייבים להיות קרובים זה לזה, תוך כמה מיקרון. זו יכולה להיות מושגת כדלקמן:
- עם הלייזרים על, מצלמות הזרמה ברציפות, ושניהם מסלולי הקרנות העליונים ותחתונים פתוחות, להתנדנד בעל מדגם-piezo z באמצעות צורת גל של מתח סינוסי שנוצר על ידי תוכנות שליטה על תנודת Z- ציר רציפה על פני גודל של 400 ננומטר .
- ניצול העובדה, כאשר מתוך יישור אופטימלי, עוצמת fiducial משתנה מעט עם tהוא תנודה, לתרגם את מכלול קרן splitter ממונע ידני למעלה או למטה עד עוצמת נעה fiducial בשל השפעת התערבות פוטון יחיד הרצוי. זה מסמל את ההתאמה הקרובה של אורכי נתיב האופטיים. יחס השיא-העמק> 10 יכול להיות מושג במקרים אופטימליים (1D איור).
- כדי להבטיח כי הן את המשרעת והפאזה בכל השטח הם אחידים ככל האפשר על פני השדה, להתאים את המראה תחתית מכלול קרן splitter בצעדים קטנים כדי לכוונן את הפער ואת זוויות הטיה. בצע יישור קנס מפצל קרן על ידי תרגום המדגם ב 8 ננומטר Z- צעדים למעלה מ -800 ננומטר.
- לפקח על עוצמת fiducial בין מצלמות # 1 - 3. התאם את הגובה, את המיקום ואת ההטיה של המראה התחתונה בתוך הרכבת הקרן splitter בצעדים קטנים, כך שלב התנודה של מצלמת # 1 ביחס מצלמת # 2 מוגדל, באופן אידיאלי ב 120 מעלות (איור 1 ב-ד).
- לאחר ראשוניהיישור הושלם, לתרגם המדגם כדי לבצע סריקה לאיתור שדה מתאים מבט המכיל את שני תאי תמונת fiducials המרובה סמוכות. מניחים המתחם סביב למערכת לחסום אור תועה ואת הפרעות הסביבה. לאחר באזור ההדמיה נמצא, לבצע את ההליך בשלב 3.4 שוב, ולהקליט את עקומת הכיול לשימוש לאחר z לתאם עקירות באמצעות הפקודה "רוכש כיול סריקות vs עמד Piezo לדוגמא" בממשק הראשי.
4. קליטת נתונים
- פעם אזור רצוי נמצא ואת עקומת הכיול מתקבלת, הזן את שמות קבצים המתאימים לתוך התוכנה. פתח הוא בשורה העליונה והן נתיבי קורה תחתונים. להגדיל את כוח עירור של הלייזר 642 ננומטר למקסימום. עבור Alexa פלואוריד 647, לתקופה ראשונית של fluorophore כיבוי עשוי להיות נחוץ (איור 2 א).
- Expose עם עירור 642 ננומטר קבוע במשך 5 דקות, או יותר במידת הצורך, עד סימולקולת ngle המהבהבת הוא ציין (איור 2 ב). התוכנה מאפשרת גידול אוטומטי של הפעלת צילום 405 ננומטר במהלך הרכישה. מספר רב של מסגרות רכישה בדרך כלל נדרש עבור תכונות filamentous להיות נראות בבירור (> 50,000 מסגרות). כאשר מוכן, להתחיל רכישת ערכות תמונה גלם באמצעות הפקודה "רכישה התחל iPALM" בממשק הראשי.
- במהלך הרכישה, לכוון את רמת photoactivation על ידי התאמת עוצמת הלייזר 405 ננומטר כדי לשמור על צפיפות נכונה מהבהב לפי הצורך (ראה דוגמאות באיור 2B).
הערה: לאחר הרכישה הושלמה, התוכנה באופן אוטומטי להמיר את קבצי תמונה לפורמט בינארי הנכון. המאגר נתונים בשרת החישוב מותקן ככונן רשת, ומאפשר נתונים המיועדים להעתקה ישירות לשם לעיבוד נוסף.
5. עיבוד נתוניםוניתוח
- ביצוע ניתוח לוקליזציה באמצעות תוכנה שפותחה כדי לחלץ פרמטרים-התאמה הטובה ביותר עבור כל המולקולות הבודדות, כמו גם עבור fiducials 11,15,23. זה מניב לא רק את x, y לתאם, אלא גם את העוצמת המשמשת ניתוח עקום כיול.
- יבא את נתוני הכיול הגלם הנרכשים בשלב 3.5 באמצעות הפקודה "חלץ תוויות פיקס מרובים" תחת תפריט "קובץ" כדי לבצע לוקליזציה מולקולה בודדת. בעקבות ניתוח הלוקליזציה הראשוני, קואורדינטות המתקבלים ממצלמות # 1 - 3 נוכחים בערוצים אדומים, ירוק וכחול, בהתאמה, ניתן לשמור לניתוח נוסף באמצעות הפקודה "שמור מעובד כמו IDL (.sav)" תחת " בתפריט קובץ ".
- כדי להביא נתונים ממצלמות # 1 - 3 לתוך רישום באמצעות fiducials פלורסנט מוטבע על coverslips, לבחור כמה fiducials בהיר כדי לספק כיסוי של התמונה המרכזית (כגון,איור 1B) באמצעות הפקודה "נקודות העוגנות Fiducial" תחת תפריט "טרנספורמציות תמונה". השתמש סטים המשולשים של לוקליזציה קואורדינטות ממצלמות # 1 - 3 מתקבל fiducials הבהיר בשלב 5.1 לחשב את סיבוב מטריצה דרוגה שיביא מצלמות # 1 ו # 3 לתוך קופה עם מצלמת # 2. עם מספר גדול מספיק של fiducials, השתאה פולינום מסדר גבוה יכול להתבצע עבור מתאים יותר.
- לאחר המטריצה השינוי מחושב, לשנות את הנתונים הגולמיים של מצלמות # 1 - 3 יחד כדי להשיג את הנתונים הגולמיים סיכם. בצע סיבוב נוסף של ניתוח לוקליזציה להניב x מדויק יותר, y לתאם ולקבוע את תרומתו היחסית של כל ערוץ מצלמה על הנתונים הגולמיים סכמו; השתמש בפקודה "המרה גלם, שמור שמור Sum (.dat)" תחת תפריט "טרנספורמציות תמונה". יחס עוצם זה מכיל את מידע z לתאם.
- בחר fiducial בהיר ולבצע z-כיול מתאים באמצעות הפונקציה "3D נקודת מבחן הרוח" של מוקפץ שיח באמצעות לחיצה על "Z-לתאם פעולות" תחת תפריט "לתפקידים מיוחדים". זה יתאים פונקציות 3-סינוסי אל העוצמות של 3 ערוצי המצלמה כדי לקבוע את עקומת הכיול. קובץ הכיול אז נשמר לשימוש נוסף על מערכי הנתונים העיקריים.
- כדי לבדוק את האיכות של עקומת הכיול, לבצע z לתאם חילוץ, כפי שתואר לעיל 23. לקבלת fiducials ומחונך במערכת היטב מכוילת, z לתאם צריכה ליניארי, מאז מערכי נתוני הכיול נלקחים בהינף ליניארי-עמדת z. יתר על כן, z-עמדות כל fiducials צריך סולם עם מדרון דומה.
- לאחר כיול משביע רצון מתקבל, לבצע לוקליזציה ניתוח שינוי עבור מערכי נתוני תמונת הגלם שנרכשו בשלב 4 הבאים באותו הליך מתואר בצעדים 5.1-5.3. בסיום, לטעון את קובץ כיול משלב 5.4 ולבצע z לתאם החילוץ באמצעות הפונקציות "פיק קובץ WND" ו- "חלץ Z לתאם" בתיבת הדו-שיח המוקפץ על ידי לחיצה על "Z-לתאם פעולות" תחת תפריט "לתפקידים מיוחדים".
הערה: מאז הפעם הרכישה> 15 דק ', להיסחף מכני צפוי. - כדי לבצע להיסחף תיקון x, y, בחר fiducial בהיר מן הקואורדינטות לוקליזציה. fiducial זה צריך להיות נוכח בכל המסגרות. לאחר מכן, השתמש x, y לתאם להיסחף של fiducial כדי ליישר את כל הקואורדינטות האחרות בתוך אותה המסגרת בחזרה רישום (איור 3A-B) באמצעות הפונקציה "המבחן / כתיבת המדריך Star" תחת תפריט "טרנספורמציות תמונה". רישום Z-לתאם יכול להתבצע באופן דומה על ידי גישה "Test חוזה מדריך סטאר" ו "כתוב מדריך Star" הפונקציות מוקפץ שיח באמצעות לחיצה על "Z-לתאם פעולות" תחת תפריט "לתפקידים מיוחדים".
- כפי המדגם עשוי להפגין הטיה קלה, לבצע תיקון הטיה על ידי מתן x, y, z-הקואורדינטות של 3 נקודות התייחסות להגדרת המטוס שאמור להיות מוגדר ברמת באמצעות הפונקציה "הסר XYZ Tilt" של מוקפץ שיח על ידי לחיצה " Z-לתאם פעולות "תחת" תפריט לתפקידים מיוחדים ".
- לאחר התיקונים להיסחף והטיה, להציל את קואורדינטות הלוקליזציה. משחזרים תמונה ברזולוציה סופר לניתוח נוסף (איור 4 א-ד) באמצעות הפקודה "לדקלם" על הממשק הראשי. צבע יכול לשמש כדי לציין את z לתאם. לחלופין, נוף צדדי של האזור הנבחר יכול להיות גם שניתנו. קואורדינטות הלוקליזציה ניתן לייצא כקבצי טקסט כימות נוספת, או הדימוי המשוחזר ניתן לשמור כקובץ tif.
תוצאות
דרישות קריטיות עבור iPALM הם יישור, רישום, וכיול של מערכות אופטיות. אלה נחוצים כדי להבטיח הפרעות מתאימיבתוך הנדרשים קרן splitter 3 כיוונים עבור z לתאם חילוץ. כדי לאפשר ניטור רציף, ממקורות נקודות קבועים של קרינה נחוצים. זו יכולה להיות מושגת באמצעות פלורסנט Au או חלקיקים מתכתיים דו 23 אשר photoluminescence לנבוע תהודה plasmon משטח מקומי (LSPR). הם מתנהגים כמו דיפול אחת יציבה על תאורה ובדרך כלל יכול להיות מקומי עם 5 - 10 ננומטר דיוק. חלקיקים זמינים מסחרי אלו פולטים רמה של בהירות בטווח של fluorophores המולקולה הבודדה ביותר, כך הוא fluorophores ואת fiducials ניתן הדמיה עם עוצמות עירור דומה והגדרות רווח על מצלמות EMCCD, ללא רוויה (איור 1B). יתר על כן, fiducials אלה גם fac מאודilitate התמקדות, לפיה רוחב לכאורה של fiducials ניתן לנטר בזמן התאמת המוקד. כמו כן, ניקוי מחמיר של משטח coverglass, כגון על ידי תחריט פיראנה או ניקוי פלזמה, נדרש אף היא, שכן קרינת רקע המזויפת של uncleaned או לנקות היטב coverglasses יכולה בנקל להטביע אותות מולקולה בודדת, כפי שתואר קודם לכן.
iPALM מסתמכת על אינטרפרומטריה רבה שלבית כדי לאפשר דיוק גבוה z לתאם מדידה בו זמנית עם PALM (עבור x, y). במכשיר iPALM, כל פוטון קרינה נפלטת יכול להיחשב להפיץ דרך שני הנתיבים אופטיים, אשר לאחר מכן עצמית להתערב קרן splitter מנהג מפוברק 3 כיוונים. Z-לתאם ובכך מקודד בשלב של הפוטון הפריע. ההבדלים שלב הדדית של ~ 120 ° של קורות פלט מן התוצאה קרן splitter 3 כיווני בוריאציה עוצמת תמונות מולקולה בודדת בין camer 3z בדומה, המאפשר - לתאם החילוץ מעקום הכיול. על בסיס זה, את מכלול בעל מדגם iPALM הוא מרכיב חיוני, שכן הוא מצויד בזוג ומפעילי פיזואלקטריים המאפשרים תרגום ננומטר הדיוק ב z שיכול לשמש יישור וכיול.
במוקד והיישור הנכון, התרגום של המדגם לאורך ציר ה- z יפיק אפקט הפרעה. הדבר בא לידי ביטוי כמו תנודה של עוצמת fiducial בין שלושת הערוצים המצלמה (תרשים 1C-D). תנודות אלה גם עולות כי הן בשורה העליונה והן מסלולי קרנות אופטיים תחתונים כמעט מותאמים, המאפשרות התערבות פוטון יחיד. בדרך כלל, על הפעלת המכשיר, בשלבים הראשונים של כל מצלמה לא יהיו אופטימליים והסריקה של עמדת z נדרשת ככלי אבחונים לכיול ויישור. כדי להגיע לשלבים האופטימליים, במראה התחתון של קרן splitter(איור 1 א) יכול להיות מותאם באמצעות הבמה קצה להטות פיזואלקטריים. סריקת הכיול-עמדת z נלקחה לאחר כל קטנה 10 - התאמה ננומטר 20. עוצמת fiducial בכל ערוץ נקבעה אז על ידי ניתוח לוקליזציה (כלומר, מתאימה עם פונקצית 2D-גאוס). העוצמת מנורמל לפי עצמה כוללת יכולה להיות מקורבת על ידי צורת גל סינוסי, המאפשרת טווח השלב יחושב; וכך, בשלב המתאים לכל מצלמה ניתן לקבוע, כפי שניתן לראות באיור 1C. נציין כי עקרון התערבות פוטון יחיד המשמש iPALM יכול גם לבוא לידי ביטוי באמצעות מפצל קרן הרבה יותר פשוט 2-way. עם זאת, קרן splitter 2-way אינו מעשי עבור מיקרוסקופיה ברזולוצית סופר 3D מאז בבית או קרוב לגבול של הרס העצמי שלו, את האות בערוץ אחד היא מינימאלית, וכתוצאה מכך הערכות רועשות של קואורדינטות עוצמות ולוקליזציה, אשר למעשה להגביל את Z- לתאם נחישות הצלצלדואר שבו שני יש המצלמות העוצמות משמעותיים (<100 ננומטר). המספר המינימלי של ערוצי צורך להתגבר האפקט הזה הוא שלושה, ו 3- ו -4 כיווני מערכות הקרנה תוארו בספרות 11,30.
בתנאים אופטימליים, עבור קרן splitter 3 כיוונים, הפרשי המופע בין 3 המצלמות צריכים להיות בערך 120 מעלות. ספליטר הקורה 3 הכיוונים עבור iPALM מכיל 3 ממשקים רעיוניים, כמו נתח באיור 1 א. ספליטר הקורה ממוקם מעל מראה דיאלקטרי שטוח, עם פער דק מלא שמן מדד-התאמת שבירה, כדי לאפשר הסתגלות קנס של ואורכי נתיב בתוך מפצל הקרן וכדי להשיג הפרשי מופע אופטימליים. כפי שניתן לראות בתרשים 1 ג-ד, על היישור הנכון עבור iPALM, המצלמות קרובות הבדל שלב הדדית 120 °. בפועל, הבדל שלב גדול מ 105 ° מקובל בדרך כלל. כיול הוא ind כזהicates שהמערכת מיושרת היטב וכי הוא ישמש להפקת עוקבות z לתאם. כמו כן הוא מועיל להעריך את עקומת הכיול שנוצרה באמצעות fiducials השונה. רוב fiducials עם בהירות מתונה פולט בדרך כלל בתור דיפול יחיד, מניב עקומות כיול מחונך. עם זאת, אגרגטים מדי פעם fiducials (לעתים קרובות אלה עם בהירות קיצונית) עשוי להתנהג באופן חריג, מניב עקומות כיול אמין. כמו כן, מומלץ לבחור fiducials סמוך למרכז שדה ההדמיה בסמוך לאזור של עניין ביולוגי (איור 1 ב '), במיוחד מאז עדשת מטרות NA הגבוהה בשימוש התקנת iPALM אינה שטוח שדה תיקן. השדה של הנוף היעיל מוגבל באזור המרכז, לכאורה מן הרוחבי fiducial יותר לכיוון הקצה של השדה.
לאחר היישור הראשוני, בשדות של הנוף המכיל תאים עם מו הרצויrphology ו fiducials המרובה כדי להבטיח כיול טוב נבחר הדמיה. זו יכולה להיות מושגת על ידי לאט תרגום בעל המדגם באמצעות כונני סרוו 2-ציר. תרגום של המדגם עלול לגרום לכך שחלק defocusing, מאז המדגם הוא לא תמיד שטוח לחלוטין. לכן, המיקוד חייב להיות מותאם הרף ובמהלך התרגום. ברגע בתחום ההדמיה נבחר, סיבוב נוסף של כיול כדי לייעל את עקומת הכיול אז מתבצעת כדי לכוונן את יישור המערכת וכדי לקבל את עקומת הכיול בפועל. חשוב לציין, באזורים תחת הגרעין או האזורים קרובים עם מקדם שבירה הטרוגנית (למשל, בועות אוויר) יש להימנע בכלל, שכן אלה יגרמו שינוי משמעותי של נתיב יחסי אורכים, מעוות את z לתאם.
עם תיוג צפיפות גבוהה, אותות הקרינה מן fluorophores אורגני כגון Alexa פלואוריד 647 יכול להיות בהיר מאוד. כפי שניתן לראות אניn האיור 2A, עם הכנת החיץ ההולמת המכילה ריכוז גבוה של קבוצות תיאול (-SH) 31, fluorophore צריך להיות כבוי במהירות תחת תאורת עירור גבוהה. זו תוצאה של דיכוי אותות הקרינה מהרוב של המולקולות. בכל מקרה נתון, מיעוט קטן מאוד של fluorophores stochastically לחזור למצב "מופעל". אלה צפויים להיות בדלילות ולכן ניתן דמיינו כמו מולקולות בודדות עבור אחד או כמה מסגרות לפני המעבר "הנחה". דינמיקת photoswitching הם תלויות מאוד על עוצמת העירור ואת הריכוז של -SH, וכך, עבור מערכת נתונה, יש להקפיד על מנת לייעל את צפיפות התיוג הראויה, במיוחד מאז בעצמת עירור גבוהה יחסית (640 - 647 ננומטר) היא צריך לכבות ברוב של מולקולות 647 אלקסה פלואוריד. אם העירור אינו חזק מספיק, על אחוז ניכר של אלכס פלואוריד 647 רצוןלהישאר במצב "על", וכתוצאה מכך רקע גבוה, קשיי התבוננות קרינת מולקולה בודדת, ובסופו של דבר, תוצאות לוקליזציה מולקולה בודדת באיכות ירודה. תחת תנאי מאוזן כראוי, נתונים גולמיים מולקולה בודדת צריכים להכיל מספר גדול מספיק של מולקולות (מאה) לכל מסגרת (איור 2 ב), בעוד כל מולקולה דלילה מספיק כדי לאפשר ניתוח זיהוי ולוקליזציה שאינו משתמע לשני פן. כמו כן ראוי לציין כי עבור iPALM, עקרונות photoswitching זהים לאלה של PALM או STORM, ובכך, דגימות מוכנות כראוי iPALM ניתן להשתמש ישירות על מערכות 3D-PALM הפשוטות או 3D-STORM. כדי לרכוש צפיפות גבוהה מספיק של מולקולות כדי לספק דגימת נייקוויסט, בדרך כלל 50,000 או יותר מסגרות של נתונים גולמיים נדרשות (כלומר, 150,000 מסגרות כוללות של 3 מצלמות). כרכישה מתקדמת, שבר גדל והולך של fluorophores יכול להיות מדולדל ידי photobleaching ההרסני, וכתוצאה מכך להתנצחצפיפות יחידה מולקולת ser. כדי לפצות על זה, קטניות קצרות של 405 אור הכחול ננומטר (405 ננומטר), אפשר להאיר על המדגם במרווחים לקדם הפעלת fluorophore.
בשל זמן רב נדרש רכישה, תוצאות אופטימליות עבור iPALM (או במיקרוסקופ לוקליזציה מולקולה בודדת בכלל) דורשים להיסחף מדגם נמוך ו / או תיקון להיסחף טוב. לדוגמה, באמצעות זמן החשיפה של 50 מילי-שניות במצב העברת מסגרת (מסגרת הדולר 20 הרץ), הפעם הרכישה הכולל 50,000 מסגרות הוא 42 דקות. במהלך תקופה זו, להיסחף מכני על פני עשרות ננומטר צפוי. ואכן, בנוסף דיוק לוקליזציה גבוהה וצפיפות תיוג גבוהה, ההחלטה תלויה גם באיכות תיקון להיסחף. ישנם מקורות רבים כדי מרחף אלה עם תנודות תרמיות להיות אחד גורמים עיקריים. בשל שיקול זה, במידת האפשר, חלקים iPALM הם מותאמים אישית-במכונה באמצעות Invar, סגסוגת התפשטות תרמית נמוכה, או נירוסטה,שניהם בעלי הרבה מאפיינים התפשטות תרמית נמוכה מזו פליז או אלומיניום. למרבה הצער, זה גם מטיל ביחס עלות נוספת אלומיניום, שהינה מתכת יותר נפוצה עבור רכיבים ומכאניים, להיות הרבה יותר זול וקל למכונה. מקורות אחרים של סחיפה יכולים להיות רעידות מכאניות מציוד היקפי, סביבות סביבה, או זרמי אוויר. אלה צריכים להיות ממוזערים על ידי הצבת המערכת במארז מתאים ועל ידי הפניית כיוון זרימת האוויר באזור מיקרוסקופ. ההתקנה צריכה להיות בנויה על משטח אופטי מחקר כיתה, ואם אפשר, רכיבים המכיל אוהד צריכים להיות ממוקמים מחוץ לשולחן האופטי. אף על פי כן, למרות כל אמצעי הזהירות, מידה מסוימת של סחיפה יישאר. האנושות, המרחף אלה חייב להיות ממוזער כך הדימוי נשאר בפוקוס לאורך זמן הרכישה. במערכות שלנו, שיטות הפסיביות אלה יספיקו כדי למזער להיסחף לרמות מקובלות. עם זאת, זה צריך להיות אפשרי ליישם com להיסחף פעילשיטות פיצוי לאפשר לטווח ארוך הדמית דיוק גבוה 32.
בעקבות העיבוד של הנתונים הגולמיים, קואורדינטות לוקליזציה 3D ניתן להשיג עם בדרך כלל 5 - 10 מ'פסגות מולקולה בודדת בכל מערך נתונים. כפי שניתן לראות בתרשים 3, להיסחף כפונקציה של זמן ניתן דמיין מן קואורדינטות הלוקליזציה של fiducials. ניתן להשתמש fiducials המרובה כדי לחשב את מסלולו תיקון להיסחף הממוצע (איור 3 א-ב). כמו כן, נהוג לסנן פסגות שמתאימות גרוע לפונקצית 2D-גאוס במהלך ניתוח לוקליזציה. זה יכול להיות בגלל רעשים מזויפים או פסגות מולקולה בודדת חופפים חלקית וניתן נבדלי השגיאה המרובעת שיורית הגדול מחושב במהלך התהליך ההולם. פיקס עם בהירות נמוכה (כפי שצוין על ידי ספירת פוטון), ולכן אי-ודאות גבוהה יותר (כלומר, גדול יותר ~ 25 ננומטר) מסוננים החוצה כמו כן,זה אלה נובעים ככל הנראה מן קרינת רקע שאינו ספציפית. באופן דומה, פסגות עבורו את העוצמות מן 3 ערוצי המצלמה להתאים גרועות העקום הכיול גם נדחות, כמו z-קואורדינטות המתקבלים הן אמינות. יצוין כי תוכן המידע המלא של iPALM (במיקרוסקופ הלוקליזציה בכלל) הוא עצום, שכן תוצאות הניתוח לא רק את קואורדינטות fluorophore, אלא גם בכמה פרמטרים נוספים כגון עוצמת, רוחב, בהירות, וכו 'עם זאת, בפועל, מאז מעטים יחסית בכלים חישוביים זמינים כרגע לניתוח במרחב לתאם, קואורדינטות לוקליזציה בדרך כלל ניתנות או משוחזרות לדימויים פיקסל מבוססת לניתוח נוסף.
הגישה הנפוצה לשיקום תמונת iPALM היא לייצג כל לוקליזציה לתאם עם פונקצית גאוס 2D מנורמלת, עם חוסר ודאות הלוקליזציה המוגדר בתור גאיתירוחב ssian 33. לפיכך, קואורדינטות הדיוק הגבוה (בדרך כלל פסגות מולקולה בודדת עם בהירות גבוהה רקע נמוך) מופיעות פסגות חדות וצרות, כאשר הקואורדינטות נמוך הדיוק (בדרך כלל בהירות נמוכה או פסגות מולקולה בודדת רקע גבוה) מופיעות דימר ורחב פסגות. באופן זה, כל מולקולה תורמת אותה הכמות של אינטנסיביות על התמונה. עבור ערכת נתוני 3D, ה- z לתאם יכולה להיות מיוצגת באמצעות צבע, בדרך כלל מבוסס על סולם גוון (איור 4C-D). לחלופין, ניתן להציג תמונות כתצוגת צד (x, z או y, z) הקרנה או כמו כרכים. מספר תוכנות זמינות לציבור יכול לשמש כדי לחזות נתונים כאלה 34.
כפי שמוצג איורים 4-6, תמונות iPALM להניב שיפור משמעותי לעומת מיקרוסקופ פלואורסצנטי מוגבל עקיפה. הארכיטקטורה F- אקטין בתאים HUVEC ניתן דמיינו עם הרבה reso מרחבית משופרתlution. באזורים של הקורטקס, רשתות של סיבים מובהקים ניתן לראות, ואילו סיבי מתח, חבילות, ו lamellipodia, רשתות F- יקטין הצפופות הם נצפו יש מרקם filamentous, למרות חוטים בודדים אינם שונים. זהו ככל הנראה בשל המגבלות הן בהירות fluorophores ואת דיוק הלוקליזציה. הנוכחות של סיבי ברור קליפת המוח מצביעה על כך ultrastructure של רשת ה- F- יקטין הוא מספיק השתמר היטב; וכך, iPALM יכול להיות כלי שימושי לאפיון אדריכלות קליפת המוח. באיור 5, אזור תת-של תא HUVEC מוצג עם הפרופילים של נימה יקטין לכמת. ניתן לראות כי z-היסטוגרמה של נימה היא כ 15 ננומטר רוחב, קטנה יחסית ~ 45 ננומטר עבור הרוחבי (x, y) נוף, מראה כי iPALM מניב שיפור רזולוציה משמעותי ביחס z ברזולוציה x, y-המטוס, כצפוי. עם זאת, מאז actuקוטר אל של אקטין f הוא ~ 8 ננומטר, לא ברור אם הנימה לנצפית היא נימה אחת או חבילה של כמה חוטים. הדמיה גומלת באמצעות iPALM וא"מ יכול להיות אסטרטגיה שימושית עבור אפיון נוסף של אדריכלות F- יקטין, אם כי גישה זו לא יושמה ללמוד F- יקטין עדיין 23.
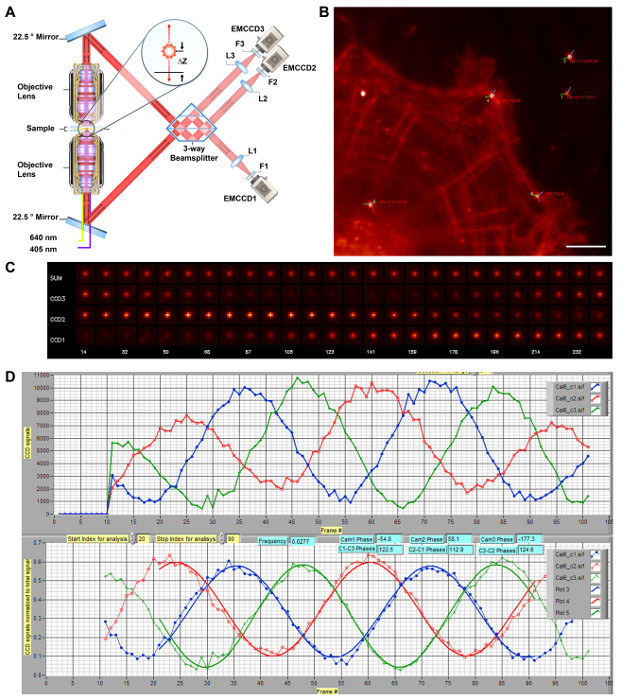
איור 1: תרשים סכמטי של iPALM 3-D סופר רזולוציה מיקרוסקופית. שרטוטים) של אופטיקה iPALM. עדשות המטרה הכפולות (ניקון, NA 1.49 60X) לאפשר לכל פוטון קרינה הנפלטת להפיץ דרך הוא בשורה העליונה והן מסלולי קרנות אופטיים תחתונים, והם מופנים להתערב ספליטר הקורה על ידי זוג המראות מונחות על 22.5 מעלות. השלב של פוטון-התערב עצמי עומד ביחס ישר δZ, ובכך קידוד ה- z לתאם של fluorophore, וניתן למדוד אותנוing קרן splitter 3 כיוונים עם הפרשי מופע הדדי של ~ 120 ° בין קורה הפלט השלוש. הם מתמקדים על ידי עדשות צינור (L1-L3, f = 400 ננומטר) ו מסוננים לפי מסנן פליטה (F1 - F3). מולקולה בודדת כל לכן הוא מופיע עם עוצמות שונות בין מצלמות (EMCCD1-3) אבל ב- x דומה, y-קואורדינטות. (א) הוא לשכפל ו שונה מן Ref. 11. (ב) תמונה מוגבלת השתברות של תאים HUVEC שכותרתו אקטין f עם אלקסה פלואוריד 647. נקודות האור לציין fiducials nanoparticle Au. זוויות שלב למצלמות # 1 - 3 מיוצגים על ידי קווים אדומים, ירוק וכחול, בהתאמה, התרכזו כל fiducial, עם הפרש הפאזה בין המצלמות # 1 - 3 הצביעו. סרגל קנה מידה:. 5 מיקרומטר (C) תמונות Fiducial מראה את ההשפעות interferometric. תמונות של fiducial nanoparticle Au לכל מצלמה (CCD1-3) או מלא (סכום), נלקח כמו Z-Position (ב ננומטר, על שורה תחתונה) נסרקו לכיול. עוצמת בתוך eaמצלמת ch ניתן לראות להתנדנד עם מערכת יחסי שלב, כפי שמוצגת (ב). (ד) עקומת כיול iPALM. המדגם מתורגם לאורך ציר z. העוצמות של fiducial nanoparticle Au עבור EMCCD1-3 הם מראים כקווים אדומים, ירוק וכחול, בהתאמה (למעלה). אלה הם אז מנורמלים ובכושר כדי לקבוע את הפרשי המופע (למטה). במהלך יישור, המערכת מותאמת להשיג את הבדלי שלב המקסימאליים בין כל שלוש המצלמות. עקומת הכיול נלקחה בכל אתר הדמיה להשתמש ב החילוץ של z לתאם של כל מולקולה בודדת. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2: הדמית מולקולה בודדת של Photoswitching אלEXA פלואוריד 647-phalloidin כמו תוויות אקטין. (א) צעד photoswitching ראשוני. F- אקטין בתאים קבוע מתויג בצפיפות גבוהה על ידי phalloidin מצומדות אלקסה פלואוריד 647. תאורה בעוצמה גבוהה בתוך תוצאות חיץ תמונה תיאול-המכילים כיבוי מהיר של רוב fluorophores. (ב) מסגרות נציג גלם מולקולה בודדת מסגרות. בשעה מהבהבת יציב, את מופעל אלקסה פלואוריד 647 צריך להיות דליל מספיק כי מולקולות בודדות עצמן מופיעות ככתם PSF בגודל. תמונות של אותם תאים שמוצגים (א), הראו עם ניגודיות הפוך. ברי סולם ב A ו- B:. 5 מיקרומטר אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
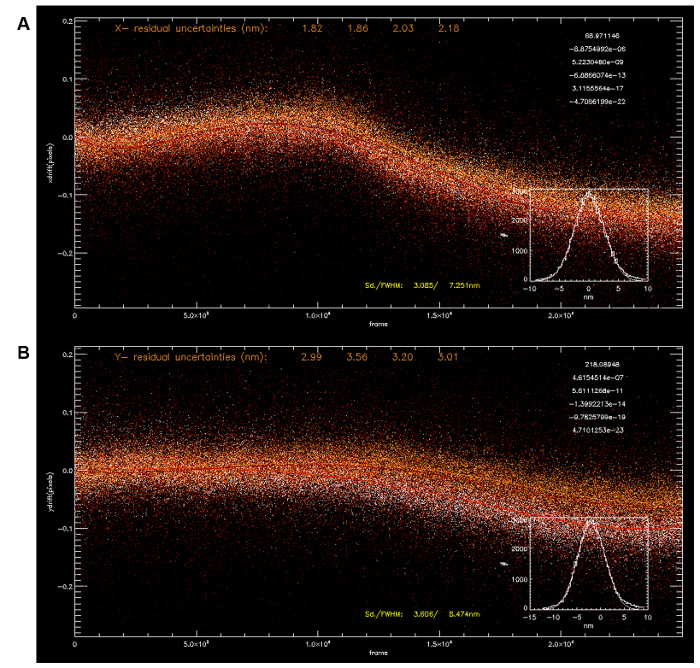
איור 3: תיקון הסחף באמצעות multip. le fiducials לוקליזציה קואורדינטות עבור ארבעה fiducials (A, x-לתיאום; B, y לתאם) ששימשו בחישוב להיסחף באמצעות אביזרי פולינום (5 th סדר, הפרמטרים לנכון על בפינה הימנית העליונה). המסלול להיסחף הממוצע מאפשר תיקון של סחיפה עם תת-5 ננומטר דיוק (x: 3.085 ננומטר, y: 3.606 ננומטר). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
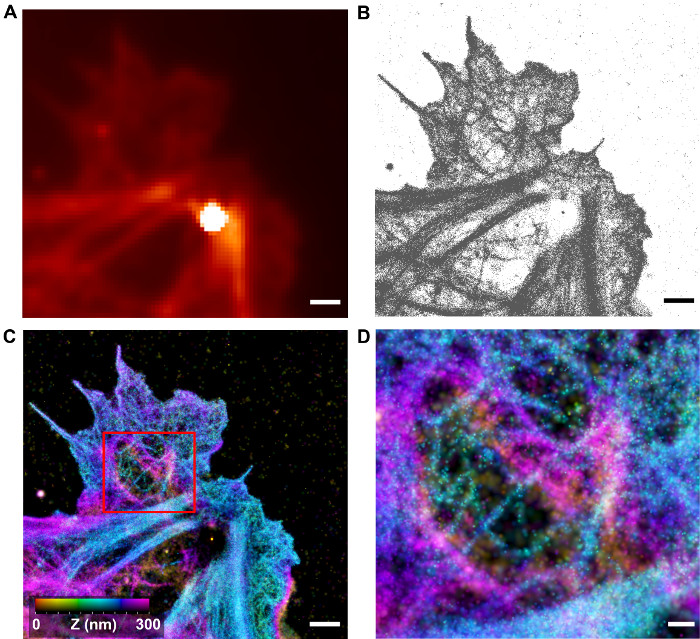
איור 4: ויזואליזציה של אדריכלות 3-D ו-יקטין ידי iPALM. (א) התמונה מוגבל השתברות של תאים HUVEC עם F- אקטין שכותרתו ידי אלקסה פלואוריד 647-phalloidin (המקביל ל subareas של התא באיור 2). נקודת האור היא בשל fiducials nanoparticle Au. (B) לוקליזציה קואורדינטות שנקבעה על ידי ניתוח iPALM על התחום (א). (ג) תמונה המשוחזרת iPALM, עם כל לוקליזציה קואורדינטות שניתנו על ידי 2D-גאוס עם הרוחב מתאים ודאות לוקליזציה. Z-לתאם הוא בצבע על פי פסי הצבע. תחומי תכונות filamentous צפופות דלילות ניתן לראות. ברי סולם (AC): 1 מיקרומטר (D) זום-לאור השטח התאגרף C מראה טופולוגיה יקטין קליפת מוח filamentous.. סרגל קנה מידה:. 250 ננומטר אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 5: ננו ממד של F- אקטין דמיינו ידי iPALM. (א) נבנה מחדש iPALM תמונת תאי HUVEC עם b שכותרתו תקטין f y אלקסה פלואוריד 647-phalloidin. הצבע מציין את z לתאם פי פסי הצבע. סרגל קנה מידה:. 1 מיקרומטר (ב) היסטוגרמה של x רוחבי חתך, y-לוקליזציה קואורדינטות לאורך ציר הזמן של האזור התאגרף ב (א). כדי להשיג את ההיסטוגרמה, הקואורדינטות מוקרנות על ציר הזמן של הקופסה זרקו לפח עם בן-גודל של 5 ננומטר. העקומה האפורה מציינת בכושר גאוס הטוב ביותר ההיסטוגרמה, עם רוחב חצי מקסימום (FWHM) של 43.88 ננומטר. (C) היסטוגרמה של z-עמדת לוקליזציה קואורדינטות באזור התאגרף ב (א). Z-העמדות זרקו לפח עם גודל סל של 1 ננומטר. העקומה האפורה מציינת בכושר גאוס הטוב ביותר ההיסטוגרמה, עם FWHM של 17.50 ננומטר. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
/files/ftp_upload/54774/54774fig6.jpg "/>
איור 6:. השוואת iPALM הדמיה של אקטין f באמצעות ריאגנטים תיוג שונים ותמונות נבנה מחדש iPALM של F- אקטין שכותרתו באמצעות Alexa פלואוריד 647 מצומדות phalloidin (א), אלקסה פלואוריד phalloidin 568 מצומדות (B), או על ידי transfection עם אקטין -mEos2 היתוך וקטור חלבון הביטוי (C). ברי סולם (AC):. 1 מיקרומטר אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
המערכת האופטית של iPALM מבוסס על עיצוב המטרה 4-π כפול מתנגדים, כפי שמוצג באיור 1 א. ההתקנה נבנתה באמצעות שני-מותאם אישית במכונה ומסחרי חלקים אופטו-מכאני, כפי שתוארה קודם לכן 23 ו המפורטים בטבלת 1. בנוסף ההתקנה שלנו, המכון הרפואי הווארד יוז (HHMI) מארחת מערכת נגישה הקהילה המדעית במרכז ההדמיה המתקדם בקמפוס מחקר Janelia. עבור הציורים המכאניים המלאים, השרטוטים שליטים, והתוכנה, קוראים מוזמנים לברר עם הרלד הס ב HHMI לקבלת מידע נוסף. יתרון עיקרי לשימוש iPALM כמו גם שיטות מיקרוסקופיה לוקליזציה מולקולה בודדת אחרות המאפשר הדמית F- יקטין הוא הקלות היחסית של הכנת מדגם לעומת טכניקות EM, הדורשות עיבוד מדגם קשה בדרך כלל, הכנה מפרכת, וטפל מיומנים 3,23 . Additionally, הקרינה ניתנת טבעי הדמיה רבה, אשר נשארה קשה EM. אף על פי כן, כמתואר בהמשך, ישנם מספר המגבלות הנוכחיות עבור הגישה, הן מבחינת הכנת הדגימה תהליך ההדמיה. ראשית, כפי שקורה להכנת מדגם EM, יש להקפיד על מנת להבטיח שימור ultrastructural הטוב של הדגימות 35, מאז פרוטוקול הולם ברמה מוגבלת עקיפה של רזולוציה יכולה לגרום הפרעות קשות ברמת ננו. עבור הדמיה יקטין, קיבעון התקין של התאים הוא גורם חשוב המשפיע איכות דגימה. Glutaraldehyde הוא מקבע מועדף שכן הוא משמר את שלד תא קרום טוב מאוד, אם כי במקרים של שיתוף מכתים עם נוגדן, אתרי epitope עשויים להיות מושפעים. במקרים כאלה, paraformaldehyde עשוי להציע פשרה מקובלת, כפי שהוא נוטה לשמר אתרי epitope נוגדן טוב יותר. חשוב לציין למיקרוסקופיה לוקליזציה מולקולה בודדת, fixatives אלה נוטיםכדי ליצור autofluorescence רקע; וכך, לאחר קיבוע מרווה ידי borohydride הכרחי, במיוחד במקרה של glutaraldehyde.
בנוסף, הבחירה הנכונה של fluorophores ואסטרטגיות תיוג היא בין הגורמים החשובים ביותר עבור ניסויים מוצלחים. בשל הממד ננומטריים של F- יקטין, צפיפות גבוהה של תוויות נדרשות כדי ללכוד את רשתות filamentous הבסיסיות, כפי שנקבעה על-ידי משפט דגימת נייקוויסט 36. עבור אקטין, phalloidin מאפשר תיוג צפיפות גבוהה מאוד, עם מגוון רחב של fluorophores האורגני זמין מיצרנים רבים. עם זאת, מאז phalloidin הוא רעיל, קיבעון התא permeabilization נדרש. אסטרטגיות חלופיות עבור תיוג תואם יקטין לחיות תאים כוללות שימוש היתוך של חלבוני ניאון (FP), או עם אקטין monomeric או עם פוליפפטידים יקטינו מחייב קטנים. עם זאת, מצאנו כי אלה נוטים להניב צפיפות תיוג נמוכה לעומת phalloidin ( ng> איור 6). נציין כי יקטין מטוהרים יכולים גם להיות מתויג ישירות עם fluorophores האורגני והציג לתוך תאי חיים על ידי electroporation 37, אך גישה זו צפויה להיות יקר ועבודה אינטנסיבית. במונחים של fluorophores, Alexa פלואוריד 647 כבר נמצא בדרך כלל להציע ביצועים טובים באופן עקבי עבור מיקרוסקופיה לוקליזציה. זו יכולה להיות מתוארת במונחים של היחס-ניגוד המנה הבהירה בין שיא המולקולה הבודד ואת קרינת רקע 38. צפיפות תיוג גבוהה דורשת יחס ניגודיות גבוה יותר, שכן ברקע יכול לבזות את דיוק הלוקליזציה במצטבר. מניסיוננו, כמה fluorophores אחרים, כגון ATTO488, ATTO520, ו אלקסה פלואוריד 568 (איור 6), שניתן להשתמש בהם כדי להמחיש את ה- F- אקטין, אם כי עם תוצאות עקביות פחות לעומת אלקסה פלואוריד 647, המציעה ביצועים photoswitching חזקים על פני מגוון רחב של מצבי חיץ הדמיה.
= ילדה "jove_content"> במונחים של תהליך ההדמיה, מגבלות בשיטות הדמיה ביולוגיות פעמים רבות להמשיג trade-off ברזולוציה מרחבית, רזולוציה טמפורלית, וטווח הדמיה (הן בתחום של נוף / עומק השדה ומשך) 39. זה לא פחות חל על היתרונות ומגבלות של iPALM. לעומת שיטות מיקרוסקופיה 3 ממדי סופר החלטה אחרות, iPALM נותר הגישה האופטית הגבוה ביותר לפתרון עד כה, בעיקר לאורך ציר z, עם z ברזולוציה כמעט פי 2 יותר מאשר x, y ברזולוצית 11. עם זאת, ההסתמכות של iPALM על אינטרפרומטריה עבור z ברזולוציה גבוהה גם מטילה מגבלה על עומק ההדמיה, מאז עקומת הכיול תקופתית. במילים אחרות, z-קואורדינטות לחזור כל 250 ננומטר או כך (עבור ~ 700 אורכי גל הפליטה ננומטר של אלקסה פלואוריד 647). בפועל, זה יכול להיות ממוען באמצעות תאורת TIRF, אשר מגבילה את אזור העירור בתוך עומק שדה החלוף של <200 ננומטר מן coverglass. לפיכך, fluorophores עמוק לתוך הדגימה לא שמחה ולהישאר בלתי נראה. עם זאת, זה גם מגביל את המבנים הביולוגיים כי ניתן הדמיה לאלה בסמיכות coverglass, כגון הידבקויות מוקד, שלד התא קליפת המוח, קרום הפלזמה הגחון, בעוד מבנים פנים יותר הם מחוץ להישג ידם. עבור דגימה קבועה, תרופה אחת היא לבצע Cryosectioning 40. עם זאת, גישה כזו היא מאוד מייגעת ומחייב מומחיות בתחום שאינו נגישה כלל.
לחלופין, ניתן להתאים iPALM עבור z-טווח מוגדל על ידי שילוב interferometry עם ערכת אסטיגמאטיק-defocusing 12 ששימשו-STORM 3D. גישה זו מספקת readouts הכפול לתאם z, התערוכה הראשונה של אינטרפרומטריה, המהווה דיוק גבוה אבל תקופתי, והשני על ידי defocusing אסטיגמאטיק, שהוא פחות מדויק אך לא תקופתי. האחרון יכול לשמש כדי "לגולל" או לשבור את הניוון שלZ-קואורדינטות interferometric, ובכך לאפשר את שילוש עומק הדמית iPALM ל ~ 750 ננומטר, מתקרבות העומק הפנימי המוקדים ביעילות של עדשות אובייקטיביות גבוהות NA. עם והסירה את השלב, iPALM נעשה שימוש למבנים תמונה עמוק בתוך דגימות, כגון המיטוכונדריה, אם כי עם דיוק מופחת מעט בכל 3 מימדים בשל נוספים defocusing 40.
הגבלה מהותית נוספת של iPALM היא מהירות ההדמיה. מאז מספר רב של מסגרות נדרשים להשיג צפיפות גבוהה של קואורדינטות לוקליזציה, מהירות המצלמה היא בדרך כלל המגבלה על שיעור הרכישה. עם מצלמות EMCCD הנוכחי לפעול בשעה 10 - 20 שיעורי readout MHz, עשרות דקות נדרשים עבור מספר מספיק של מסגרות. קשקשי זמן רבים אלה נדרשים הדגימה להיות קבועה. הנה, שיפורים אחרונים בטכנולוגית מצלמה, כגון סמיקונדקטור משלים Metal Oxide המדעית הרבה יותר מהר (sCMOS) מצלמה, עשויים לאפשר גידול מהיר imהזדקנות מהירה 41, אם כי זה לא יושם עבור iPALM עדיין. עבור כמה גישות מיקרוסקופיה לוקליזציה מולקולה בודדת, בשדה מולקולה בודדת צפוף ניתן לנתח באמצעות אלגוריתם שונה 42 או דחוס חישת 43. התאמת אסטרטגיות כאלה גם להאיץ iPALM בכך שהוא מאפשר תמונות מולקולה בודדת צפופות, ולכן, מסגרות פחות.
עם מגבלות בטווח מהירות הדמיה עוצמות ברזולוציה מרחבית, יישומים מרכזיים עבור iPALM הוא כשיטת ultrastructural ממנפת את היתרונות של תיוג פלורסנט לחשוף ארגון ננומטרי של חלבונים ספציפיים 14,15,44. שיפור נוסף, הן מבחינת טכנולוגיות אופטיקה fluorophore, צריך לאפשר שיפור נוסף ב ברזולוציה מרחבית iPALM. לדוגמה, עיבוד תמונה iPALM מעסיקה כיום גישה קירוב מסדר ראשון פשוט יחסית, עם כל מולקולה בודדת הדגם ידי פונקציה 2D-גאוס וכפיsumed להיות בממוצע דיפול isotopically. זה יכול להיות מוגבר עם שיטות אחרונות, אשר מעסיקות מודל מדויק יותר של נקודת הפונקציה-התפשטות וכיוון דיפול, או טיפול מפורש של סטיות אופטיות פני שדה הראייה כדי לשפר רזולוציה מרחבית משמעותי. כמו כן, photocaging דווחה, אשר משפר בהירות fluorophore ידי סדרי גודל 45. ואכן, מאז מרכיבים העיקריים של ארגון ultrastructural שלהם כבר היטב מאופיינים, שלד התא F- יקטין יכול להיות מערכת מודל יקרה מאוד לבדיקת התפתחויות מתודולוגית נוספות iPALM. היכולת לנתח ארגון חלבון על ידי מיקרוסקופ אור עם כושר הפרדת EM-רמה אמיתית צפויה לשפר במידה רבה את הבנתנו של היבטים עצומים של מבנה תאי ותפקוד.
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
YW ו PK בתודה להכיר תמיכה במימון קרן המחקר הלאומית של סינגפור, הוענק PK (NRF-NRFF-2011-04 ו NRF2012NRF-CRP001-084). אנו מודים גם במתקני מעבדת ליבת מיקרוסקופיה הפתוחים MBI עבור תמיכה בתשתיות.
Materials
| Name | Company | Catalog Number | Comments |
| optical table | Newport, CA | RS4000 | iPALM, installed on 4 Newport Stabilizer vibration isolators |
| vibration isolator for optical table | Newport, CA | S-2000 | |
| laser-642 | Newport, CA | 1185055 | output power=100 mw |
| laser-561 | Newport, CA | 1168931 | output power=200 mw |
| laser-488 | Newport, CA | 1137970 | output power=200 mw |
| laser-405 | Newport, CA | 1142279 | output power=100 mw |
| broadband dielectric mirrors | Thorlabs, NJ | BB1-E02 | laser combiner |
| dichroic beamsplitter | Semrock, NY | LM01-427-25 | |
| acousto-optic tunable filter | AA Opto-Electronic, France | AOTFnC-VIS-TN | |
| Linear polarizer | Newport, CA | 05LP-VIS-B | |
| baseplate | local workshop | customized | |
| turning mirror (22.5°) | Reynard Corpporation, CA | customized | 22.5° mirror |
| motorized optic mounts | New Focus, CA | 8816 | |
| motorized XYZ translation stage | Thorlabs, NJ | MT3/M-Z6 | sample holder |
| T-Cube DC servo motor controller | Thorlabs, NJ | TDC001 | |
| Piezo Phase Shifter | Physik Instrumente, Germany | S-303.CD | |
| objective lens | Nikon, Japan | MRD01691 | objective. Apo TIRF 60X/1.49 oil |
| translation stage | New Focus, CA | 9062-COM-M | |
| Pico Motor Actuator | New Focus, CA | 8301 | |
| rotary Solenoid/Shutter | DACO Instruments, CT | 5423-458 | |
| 3-way beam splitter | Rocky Mountain Instruments, CO | customized | beamsplitter |
| Piezo Z/Tip/Tilt scanner | Physik Instrumente, Germany | S-316.10 | |
| motorized five-axis tilt aligner | New Focus, CA | 8081 | |
| Picmotor ethernet controller | New Focus, CA | 8752 | |
| Piezo controllers/amplifier/digital operation module | Physik Instrumente, Germany | E-509/E-503/E-517 | |
| band-pass filter | Semrock, NY | FF01-523/20 | filters |
| band-pass filter | Semrock, NY | FF01-588/21 | |
| band-pass filter | Semrock, NY | FF01-607/30 | |
| band-pass filter | Semrock, NY | FF01-676/37 | |
| notch filter | Semrock, NY | NF01-405/488/561/635 | |
| motorized filter wheel with controllter | Thorlabs, NJ | FW103H | |
| EMCCD | Andor, UK | DU-897U-CSO-#BV | 3 sets |
| Desktop computers for controlling cameras and synchronization | Dell | Precision T3500 | PC, 4 sets |
| coverslips with fiducial | Hestzig, VA | 600-100AuF | sample preparation. fiducial marks with various density and spectra available |
| fibronectin | Millipore, MT | FC010 | |
| paraformaldehyde | Electron Microscopy Sciences, PA | 15710 | fixation. 16% |
| glutaraldehyde | Electron Microscopy Sciences, PA | 16220 | 25% |
| triton X-100 | Sigma aldrich, MO | T8787 | |
| HUVEC cells | Life Technologies, CA | C-015-10C | |
| Medium 200 | Life Technologies, CA | M-200-500 | |
| Large Vessel Endothelial Factors | Life Technologies, CA | A14608-01 | |
| Dulbecco's Phosphate Buffered Saline | 14190367 | ||
| Pennicillin/Streptomycin | 15140122 | ||
| Trypsin/EDTA | Life Technologies, CA | 25200056 | |
| PIPES | Sigma aldrich, MO | P1851 | PHEM |
| HEPES | 1st base, Malaysia | BIO-1825 | |
| EGTA | Sigma aldrich, MO | E3889 | |
| MgCl2 | Millipore, MT | 5985 | |
| Alexa Fluor 647 Phalloidin | Invitrogen, CA | A22287 | staining |
| sodium borohydride (NaBH4) | Sigma aldrich, MO | 480886 | quenching |
| glucose | 1st base, Malaysia | BIO-1101 | imaging buffer |
| glucose oxidase | Sigma aldrich, MO | G2133 | |
| catalase | Sigma aldrich, MO | C9322 | |
| cysteamine | Sigma aldrich, MO | 30070 | |
| Epoxy | Thorlabs, NJ | G14250 | |
| vaseline | Sigma aldrich, MO | 16415 | sample sealing |
| lanolin | Sigma aldrich, MO | L7387 | |
| parafin wax | Sigma aldrich, MO | 327204 | |
| Immersion oil | Electron Microscopy Sciences, PA | 16915-04 | imaging. Cargille Type HF |
References
- Kanchanawong, P., Waterman, C. M. Localization-based super-resolution imaging of cellular structures. Methods Mol Biol. 1046, 59-84 (2013).
- Bertocchi, C., Goh, W. I., Zhang, Z., Kanchanawong, P. Nanoscale imaging by super resolution fluorescence microscopy and its emerging applications in biomedical research. Crit Rev Biomed Eng. 41, 281-308 (2013).
- Kanchanawong, P., Waterman, C. M. Advances in light-based imaging of three-dimensional cellular ultrastructure. Curr Opin Cell Biol. 24, 125-133 (2012).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313, 1642-1645 (2006).
- Hess, S. T., Girirajan, T. P., Mason, M. D. Ultra-high resolution imaging by fluorescence photoactivation localization microscopy. Biophys J. 91, 4258-4272 (2006).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Methods. 3, 793-795 (2006).
- Heilemann, M., et al. Subdiffraction-resolution fluorescence imaging with conventional fluorescent probes. Angew Chem Int Edit. 47, 6172-6176 (2008).
- Sharonov, A., Hochstrasser, R. M. Wide-field subdiffraction imaging by accumulated binding of diffusing probes. P Natl Acad Sci USA. 103, 18911-18916 (2006).
- Fölling, J., Bossi, M., Bock, H., Medda, R., Wurm, C. A., Hein, B., Jakobs, S., Eggeling, C., Hell, S. W. Fluorescence nanoscopy by ground-state depletion and single-molecule return. Nat Methods. 5, 943-945 (2008).
- Biteen, J., et al. Single-moldecule active-control microscopy (SMACM) with photo-reactivable EYFP for imaging biophysical processes in live cells. Nat Methods. 5, 947-949 (2008).
- Shtengel, G., et al. Interferometric fluorescent super-resolution microscopy resolves 3D cellular ultrastructure. P Natl Acad Sci USA. 106, 3125-3130 (2009).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319, 810-813 (2008).
- Dani, A., Huang, B., Bergan, J., Dulac, C., Zhuang, X. Super resolution imaging of chemical synapses in the brain. Neuron. 68, 843-856 (2010).
- Liu, J., et al. Talin determines the nanoscale architecture of focal adhesions. P Natl Acad Sci USA. 112 (35), E4864-E4873 (2015).
- Kanchanawong, P., et al. Nanoscale architecture of integrin-based cell adhesions. Nature. 468, 580-584 (2010).
- Wu, Y., Kanchanawong, P., Zaidel-Bar, R. Actin-delimited adhesion-independent clustering of e-cadherin forms the nanoscale building blocks of adherens junctions. Dev Cell. 32 (2), 139-154 (2015).
- Szymborska, A., et al. Nuclear Pore Scaffold Structure Analyzed by Super-Resolution Microscopy and Particle Averaging. Science. 341, 655-658 (2013).
- Lawo, S., Hasegan, M., Gupta, G. D., Pelletier, L. Subdiffraction imaging of centrosomes reveals higher-order organizational features of pericentriolar material. Nat Cell Biol. 14, 1148-1158 (2012).
- Mennella, V., Agard, D. A., Huang, B., Pelletier, L. Amorphous no more: subdiffraction view of the pericentriolar material architecture. Trends Cell Biol. 24, 188-197 (2014).
- Mennella, V., et al. Subdiffraction-resolution fluorescence microscopy reveals a domain of the centrosome critical for pericentriolar material organization. Nat Cell Biology. 14, 1159-1168 (2012).
- Fletcher, D. A., Mullins, R. D. Cell mechanics and the cytoskeleton. Nature. 463, 485-492 (2010).
- Salbreux, G., Charras, G., Paluch, E. Actin cortex mechanics and cellular morphogenesis. Trends Cell Biol. 22, 536-545 (2012).
- Shtengel, G., et al. Imaging cellular ultrastructure by PALM, iPALM, and correlative iPALM-EM. Method Cell Biol. 123, 273-294 (2014).
- Juette, M. F., et al. Three-dimensional sub-100 nm resolution fluorescence microscopy of thick samples. Nat Methods. 5, 527-529 (2008).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. 19, 555-565 (2009).
- Shannon, C. Communication in the presence of noise. Proc. IRE. 37, 10-21 (1949).
- Good, N. E., et al. Hydrogen ion buffers for biological research. Biochemistry. 5, 467-477 (1966).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophys J. 94, 1826-1835 (2008).
- Shin, W. D., et al. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Swedlow, J. R., Spector, D. L. , Cold Spring Harbor Laboratory Press. (2010).
- Aquino, D., et al. Two-color nanoscopy of three-dimensional volumes by 4Pi detection of stochastically switched fluorophores. Nat Methods. 8, 353-359 (2011).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nat Methods. 8, 1027-1036 (2011).
- Pertsinidis, A., Zhang, Y., Chu, S. Subnanometre single-molecule localization, registration and distance measurements. Nature. 466, 647-651 (2010).
- Baddeley, D., Cannell, M. B., Soeller, C. Visualization of Localization Microscopy Data. Microsc Microanal. 16, 64-72 (2010).
- El Beheiry, M., Dahan, M. ViSP: representing single-particle localizations in three dimensions. Nat Methods. 10, 689-690 (2013).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. Immunolabeling artifacts and the need for live-cell imaging. Nat Methods. 9, 152-158 (2012).
- Shroff, H., Galbraith, C. G., Galbraith, J. A., Betzig, E. Live-cell photoactivated localization microscopy of nanoscale adhesion dynamics. Nat Methods. 5, 417-423 (2008).
- Yamashiro, S., et al. New single-molecule speckle microscopy reveals modification of the retrograde actin flow by focal adhesions at nanometer scales. Mol Biol Cell. 25, 1010-1024 (2014).
- Shroff, H., et al. Dual-color super resolution imaging of genetically expressed probes within individual adhesion complexes. P Natl Acad Sci USA. 104, 20308-20313 (2007).
- Chen, B. C., et al. Lattice light-sheet microscopy: imaging molecules to embryos at high spatiotemporal resolution. Science. 346, (2014).
- Brown, T. A., et al. Super resolution fluorescence imaging of mitochondrial nucleoids reveals their spatial range, limits, and membrane interaction. Mol Cell Biol. 31, 4994-5010 (2011).
- Huang, F., et al. Video-rate nanoscopy using sCMOS camera-specific single-molecule localization algorithms. Nat Methods. 10, 653-658 (2013).
- Daostorm, S. DAOSTORM: an algorithm for high-density super-resolution microscopy. Nat methods. 8, 279(2011).
- Zhu, L., Zhang, W., Elnatan, D., Huang, B. Faster STORM using compressed sensing. Nat Methods. 9, 721-723 (2012).
- Van Engelenburg, S. B., et al. Distribution of ESCRT machinery at HIV assembly sites reveals virus scaffolding of ESCRT subunits. Science. 343, 653-656 (2014).
- Vaughan, J. C., Jia, S., Zhuang, X. Ultrabright photoactivatable fluorophores created by reductive caging. Nat Methods. 9, 1181-1184 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved