Method Article
подготовки и
В этой статье
Резюме
Здесь мы описываем получение и использование одного из видов деятельности на основе зонда (ARN14686, ундец-10-ynyl- N - [(3 S) -2-оксоазетидин-3-ил] карбамат) , что позволяет обнаруживать и количественное активная форма фермента провоспалительных N амидазы -acylethanolamine кислоты (NAAA), как в пробирке и экс естественных условиях.
Аннотация
Деятельность на основе белка профилирование (ABPP) представляет собой способ идентификации фермента интерес в сложном протеома за счет использования химического зонда, который нацелен активных участков фермента. Репортер тег введен в зонд позволяет для обнаружения меченого фермента в геле сканирования флуоресценции, белка-блот, флуоресцентной микроскопии, или жидкостной хроматографии-масс-спектрометрии. Здесь мы опишем приготовление и применение соединения ARN14686, химии кликах на основе зонда (CC-ABP) , который селективно распознает фермент N амидазу -acylethanolamine кислоты (Naaa). NAAA представляет собой цистеин гидролазная, что способствует воспаление деактивируя эндогенные активатора пролиферации пероксисом рецептора (PPAR) -альфа агонисты, такие как пальмитоилэтаноламид (ПЭА) и oleoylethanolamide (OEA). NAAA синтезируется как неактивный полнометражного профермента, который активируется autoproteolysis в кислом рН лизосом. Локализация исследования чпр показано, что NAAA преимущественно экспрессируется в макрофагах и других моноцитарных клеток, а также в В-лимфоцитов. Мы приводим примеры того , как ARN14686 могут быть использованы для обнаружения и количественного определения активного Naaa исключая виво в тканях грызунов с помощью белков - блоттинга и флуоресцентной микроскопии.
Введение
Обычно используемые методы для изучения паттернов экспрессии, взаимодействия и функции белков, в том числе для жидкостной хроматографии-масс - спектрометрии платформ для анализа дробовика 1,2, дрожжи двух гибридных методов 3,4, а в анализах пробирке, ограничены в том , что они не в состоянии оценить активность белков в их нативном состоянии. Деятельность на основе белка профилирование (ABPP) может быть использован, чтобы заполнить этот пробел. При таком подходе, малые молекулы зондов способна ковалентного связывания с активным участком фермента, представляющего интерес, конъюгированного с репортером группы, что позволяет обнаруживать мишени. С помощью химии щелчок (CC), репортер может быть встроен в зонд или может быть введен после того, как поражение цели произошло 5,6. Последняя процедура требует использования зондов, содержащих соответствующие химические группы, такие как терминальное алкина или азида, который может быть модифицирован с рядом репортерных реагентов с помощью био-ортогональный реакций SUCч как Cu (I) -catalyzed Huisgen [3 + 2] циклоприсоединения 7-9 или Штаудингер лигирование 10,11.
Недавно мы раскрыли соединение ARN14686 в качестве первого АВР для в пробирке и в естественных условиях обнаружения цистеина гидролазы, Naaa 12. NAAA катализирует гидролитическое дезактивацию насыщенных и мононенасыщенных Faes, включая oleoylethanolamide (OEA) и пальмитоилэтаноламид (ПЭА), которые являются эндогенными агонистами противовоспалительного ядерных рецепторов PPAR-альфа 13-15. NAAA преимущественно экспрессируется в макрофагах и других моноцитарных клеток, а также в В-лимфоцитов 14,16, что указывает на роль в регуляции врожденной иммунной реакции. Фермент синтезируется в шероховатой эндоплазматической сети в неактивной форме и активируется в кислой отсеках клетки с помощью autoproteolytic механизма 17. Autoproteolytic расщепления генерирует новый N - терминальном цистеин (C131 у мышей и крыс, C126 в организме человека), который является ответственным за нуклеофил FAE гидролиз 18,19. Фармакологическое ингибирование активности Naaa изменяет FAE баланс синтеза / деградации в пользу увеличения клеточных уровней Faes 16,20,21. Несколько производных β-лактон и β-лактамные было показано ингибировать активность Naaa с высокой активностью и селективностью 16,22-26. Эти ингибиторы действуют через S -acylation каталитического цистеина 16,27,28.
Соединение ARN14686 был разработан на основе химической структуры активного системно, серин полученный ингибитор β-лактамным Naaa, ARN726 (4-cyclohexylbutyl- N - [(S) -2-оксоазетидин-3-ил] карбамата) 16. 4-бутил-циклогексил группа ARN726 была заменена С9 насыщенной алифатической цепи, несущего концевой алкиновой метку для последующего CC конъюгации с репортером меткой азид-подшипника. Мы решили разработать двухступенчатую АВР для minimallY изменяют структуру исходного помост, сохраняя тем самым сродство зонда для Naaa. К тому же , избегая введения громоздких тегов, такой зонд может быть более подходящим для лечения в естественных условиях , чем прямое АБП. ARN14686 ингибирует Naaa с высокой активностью (hNAAA IC 50 = 6 нМ, rNAAA IC 50 = 13 нМ) путем образования ковалентной аддукта с каталитической цистеина фермента 12. Эксперименты в живых крысах показали, что зонд является селективным в захвате NAAA выражается в легких. Кислота ceramidase, еще один цистеин амидазы , который разделяет 33-34% идентичность с Naaa, также был идентифицирован как мишень с низкой аффинности при использовании высоких концентраций зонда (10 мкМ в пробирке, 10 мг / мл для внутривенного введения, внутривенно) 12. Мы также использовали ARN14686 изучить наличие активного Naaa в воспаленных тканях крыс после введения адъюванта Фрейнда (CFA) 29.
Здесь мы приводим протокол для препаратов в базе данныхна из ARN14686 (рисунок 1) и его применение к исследованию активации Naaa экс естественных условиях. В качестве примера, мы опишем экспериментальную процедуру визуализации Naaa в лапы крыс после введения CFA. В этом эксперименте белки извлекают из ткани лапы после инъекции зонда, и АБП-меченых протеом подвергают КХ с биотин-азида. Биотинилированные образцы обогащены с использованием стрептавидином бусинки, и белковые кляксы выполняются. В другом приложении мы описываем локализацию активного Naaa с помощью флуоресцентной микроскопии в легких мышей из зондовых обработанных мышей. В этом случае ткань секционного и секции подвергаются CC для родамина дополнение. Схема рабочего процесса показана на рисунке 2.
протокол
Внимание: Все реакции химии должны проводиться в вентилируемом вытяжном шкафу и с использованием лаборатории пальто, перчатки и защитные очки. Реакции должны быть также проведены в атмосфере азота.
Этическое заявление: Наши процедуры с участием животных осуществляется в соответствии с итальянскими правилами о защите животных, используемых для экспериментальных и других научных целей (DM 116192), а также правилами Европейского экономического сообщества (OJ ЭК L 358/1 12/18/1986 ).
Примечание: Получение [(3 S) -2-оксоазетидин-3-ил] ацетата аммония описывается для крупных выходов (50 г N -CBZ-L-серин), но она может быть легко уменьшена.
1. Синтез
Примечание: На рисунке 1 схеме реакции синтеза.
- Получение 2-пиридил карбоната ундец-10-инил и ундец-10-инил 2-oxopyridine 1-карбоновой кислоты
- В 50 мл круглодонную колбу, растворяют 350 мг undec-10-ин-1-ола в 3,5 мл сухого дихлорметана.
- К полученному раствору в 1.1.1, добавляют 25 мг 4-диметиламинопиридина (DMAP) и 530 мг 2-dipyridylcarbonate (ДПЗ). Смесь перемешивают при комнатной температуре (RT) в течение 16 часов.
- Добавить 20 мл дихлорметана.
- Перенести смесь в делительную воронку. Добавьте 15 мл воды, встряхните его, и дайте две фазы для разделения.
- Откройте водопроводный кран, собрать органическую фазу (внизу), а затем закройте запорный кран. Добавьте 15 мл насыщенного раствора NaHCO 3. Встряхнуть делительную воронку и пусть две фазы отделяют. Повторите этот шаг еще два раза.
- Органический слой сушат с помощью Na 2 SO 4, фильтруют через вату в круглодонную колбу (вес тары первого), и выпаривают досуха при пониженном давлении (роторный испаритель).
- Взвешивают колбу и получают 600 мг масла, которое представляет собой смесь 2-пиридил карбоната ундец-10-инил и ундец-10-инил 2-oxopyridine 1-карбоновой кислоты в соотношении 1,7: 1,
1 Н - ЯМР (400 МГц, ДМСО - d 6) основным компонентом δ = 8,39 (дд, J = 5,0, 2,0, 1H), 7,98 (тд, J = 7,9, 2,0, 1H), 7,40 (дд, J = 7,2, 4,9, 0,9, 1H), 7,30 (д, J = 8,2, 1H), 4,22 (т, J = 6,6, 2H), 2,73 (т, J = 2,4, 1H), 2,18 - 2,11 (м, 2H), 1,76 - 1,62 (м, 2H), 1,50 - 1,23 (м, 12H).
1 Н - ЯМР (400 МГц, ДМСО - d 6) δ минорный компонент = 7,74 (дд, J = 7,2, 1,9, 1H), 7,47 (дд, J = 6,7, 2,3, 1H), 6,44 (д, J = 9,4, 1H), 6,30 - 6,25 (м, 1H), 4,35 (т, J = 6,5, 2H), 2,72 (т, J = 2,4, 1H), 2,18 - 2,11 (м, 2H), 1,77 - 1,60 (м, 2H ), 1,52 - 1,20 (м, 12H). - Используйте масло без дальнейшего разделения или очистки.
- Получение [(3 S) -2-оксоазетидин-3-ил] ацетат аммония
- Получение бензилового N - [(S) -1- (гидроксиметил) -2 - [(4-метоксифенил) амино] -2-oxoethил] карбамата.
- В 4-литровую круглодонную колбу, растворяют 141,5 г п -anisidine в 1,5 л тетрагидрофурана и 0,5 л дихлорметана.
- Охлаждают раствор до 0 ° С на бане со льдом.
- Добавить 50,0 г N -CBZ-L-серин и 43,9 г N - (3-диметиламинопропил) - -ethylcarbodiimide гидрохлорид N '.
- Перемешать смесь с магнитной мешалкой при 0 ° С в течение 30 мин.
- Удалить раствор из бани со льдом и размешать с магнитной мешалкой при комнатной температуре в течение 16 ч.
- Выпаривают растворители при пониженном давлении (роторный испаритель).
- Добавить 400 мл 1: 1 циклогексан / этилацетат, перемешать с помощью шпателя, и переливать.
- Повторите шаг 1.2.1.7 еще два раза.
- Растворите смолистый остаток суспендируют в 500 мл этилацетата и промывают 400 мл 0,1 М раствора HCl ( до 10 раз), 400 мл насыщенного раствора NaHCO 3 (2 раза), и с 400 мл насыщенного раствора соли.
- Органический слой сушат сNa 2 SO 4, фильтруют раствор через вату в круглодонную колбу (тарные первый) и выпаривают его досуха при пониженном давлении (роторный испаритель).
- Взвешивают колбу и получают 61,4 г белого твердого вещества.
1 Н - ЯМР (400 МГц, ДМСО - d 6) & delta ; = 9,86 (шс, 1H), 7,52 (д, 2H, J = 9,0 Гц), 7.42-7.25 (м, 6H), 6.91-6.85 (м, 2H) , 5,06 (д, 1H, J = 12,9 Гц), 5,02 (д, 1H, J = 12,9 Гц), 4,98 (т, 1H, J = 5,6 Гц), 4.24-4.15 (м, 1H), 3,72 (с, 3H), 3.70-3.57 (м, 2H).
- Получение бензилового N - [(S) -1- (4-метоксифенил) -2-оксо-азетидин-3-ил] карбамата.
- Растворить 58,6 г N - [(S) -1- (гидроксиметил) -2 - [(4-метоксифенил) амино] -2-оксо-этил] карбамата в 1,6 л N, N - диметилформамид.
- Охлаждают раствор до 0 ° С на бане со льдом.
- Добавить 50,6 г 1,1'-sulfonyldiimidazole и размешать с магнитной мешалкой в течение 30 мин.
- Охлаждают раствордо -20 ° С с лед / NaCl баню и добавляют 10,2 г гидрида натрия (60% в минеральном масле) порционно.
- Смесь перемешивали при -20 ° С в течение 1 ч, а затем гасили 2 мл метанола и 1 л воды.
- Вакуум-фильтр осадок, промывают 200 мл воды, и сушат в вакууме.
- Получают 42,2 г белого твердого вещества.
1 Н - ЯМР (400 МГц, ДМСО - d 6) δ = 8,08 (д, 1H, J = 8,5 Гц), 7.42-7.28 (м, 5H), 7,30 (д, 2H, J = 8,9 Гц), 6,95 (д , 2H, J = 8,9 Гц), 5,06 (с, 2H), 4,86 (дд, 1H, J = 8,5, 5,6, 2,6 Гц), 3,90 (т, 1H, J = 5,6 Гц), 3,73 (с, 3H) , 3,55 (дд, 1H, J = 5,6, 2,6 Гц).
- Получение бензилового N - [(S) -2-оксоазетидин-3-ил] карбамата.
- Приостановка 9,0 г бензилового N - [(S) -1- (4-метоксифенил) -2-оксоазетидин-3-ил] карбамата в 500 мл ацетонитрила и 400 мл воды.
- Охлаждают раствор до 0 ° С на бане со льдом.
- Добавить 45,4 г КериC нитрат аммония порционно в течение 45 мин и перемешивают магнитной мешалкой при 0 ° С в течение 15 мин.
- Добавить 500 мл насыщенного раствора NaHCO 3 осторожно, а затем добавляют 500 мл этилацетата.
- Фильтр осадок и промывают 200 мл этилацетата.
- Отделить двухфазного раствора и промывают водный слой с помощью 200 мл этилацетата (3 раза).
- Органический слой сушат с помощью Na 2 SO 4, добавляют 5 г активированного угля, фильтруют через слой диатомовой кремнезема, и выпаривают досуха при пониженном давлении (роторный испаритель).
- Добавляют диэтиловый эфир и перемешивают с помощью шпателя.
- Фильтр твердого вещества и получают 4,85 г не совсем белого твердого вещества.
1 Н - ЯМР (400 МГц, ДМСО - d 6) δ = 7,97 (д, 1H, J = 8,7 Гц), 7,94 (шс, 1H), 7.42- 7.30 (м, 5H), 5,05 (с, 2H), 4,67 (ддд, 1H, J = 8,7, 5,4, 2,7 Гц), 3,40 (т, 1H, J = 5,4 Гц,), 3,09 (дд, 1H, J = 5,4, 2,7 Гц).
- Получение [(S) -2-оксоазетидин-3-ил] аммоний ацетатом.
- Растворить 0,93 мл уксусной кислоты в 245 мл этилацетата. Отметьте это как "захват решения."
- Растворить 3,28 г бен- N - [(R) -2-оксоазетидин-3-ил] карбамата в 298 мл этанола.
- Добавить 14,1 мл циклогексадиен и 3,27 г 10% палладия на угле.
- Перемешивают суспензию при комнатной температуре в течение 12 ч, а затем фильтруют через слой диатомовой земли. Налейте элюирующего жидкость непосредственно в раствор отлова.
- Выпаривают растворитель при пониженном давлении (роторный испаритель), поддерживая температуру ниже 35 ° C.
- Растирают полученного твердого вещества с тетрагидрофурана и получают 1,72 г белого твердого вещества.
1 Н - ЯМР (400 МГц, ДМСО - d 6) & delta ; = 7,68 (шс, 1H), 3,99 (дд, 1H, J = 5,2, 2,4, 1,2 Гц), 3,32 (т, 1H, J = 5,2 Гц), 2,79 (дд, 1H, J = 5,2, 2,4 Гц), 1,90 (с, 3H).
- Получение бензилового N - [(S) -1- (гидроксиметил) -2 - [(4-метоксифенил) амино] -2-oxoethил] карбамата.
- Приготовление ундец-10-ynyl- N - [(3 S) -2-оксоазетидин-3-ил] карбамат
- В 10 - мл круглодонную колбу, растворяют 60 мг [(3 S) -2-оксоазетидин-3-ил] ацетата аммония в 2 мл безводного дихлорметана.
- Охлаждают раствор до 0 ° С в бане со льдом и добавляют 81 мкл N, N - диизопропилэтиламина по каплям.
- Растворить 350 мг неочищенной смеси, содержащей ундец-10-инил 2-oxopyridine 1-карбоновой кислоты в 2 мл безводного дихлорметана, добавляют его к раствору и перемешивают при комнатной температуре в течение 15 часов. Выпаривают растворитель досуха при пониженном давлении (роторный испаритель).
- Очищают с помощью колоночной хроматографии (силикагель) с использованием автоматического устройства для колоночной хроматографии:
- Поглощенный образец на силикагель, уравновешивают колонку с циклогексан, и загрузить образец в картридж.
- Элюировать циклогексан / этилацетат от 100: 0 до 0: 100 и собирать пики на пробирках.
- Выпаривают растворитель из фракций, соответствующих соединению досуха при пониженном давлении (роторный испаритель), и получают 40 мг белого твердого вещества.
2. Получение CC Реагенты
- Получение 5 мМ исходного раствора Tag-азида молекул
- Растворить 1,5 мг азида PEG3-Fluor 545 в 0,5 мл диметилсульфоксида (ДМСО). Сделайте аликвоты в 0,5 мл микропробирок и хранить при температуре -20 ° C.
- Растворить 1,1 мг азида PEG3-биотин в 0,5 мл ДМСО. Сделайте аликвоты в 0,5 мл микропробирок и хранить при температуре -20 ° C.
- Приготовление 50 мМ исходного раствора трис (2-карбоксиэтил) фосфин (ТСЕР)
- Растворить 14,3 мг ТСЕР в 1 мл воды, и сделать его свежим каждый раз.
- Приготовление 50 мМ раствора CuSO 4 · 5H 2 O
- В стеклянном флаконе, растворяют 12.48 Мг CuSO 4 · 5H 2 O в 1 мл воды. Хранить при комнатной температуре в течение до одного месяца.
- Приготовление 83,5 мМ маточного раствора трис [(1-бензил-1H-1,2,3-триазол-4-ил) метил] амин (TBTA)
- В стеклянную пробирку, растворяют 8,85 мг ТБТА в 200 мкл ДМСО. Хранить при комнатной температуре в течение до одного месяца.
- Получение 1,7 мМ рабочего раствора TBTA (непосредственно перед использованием)
- Добавьте 20 мкл 83,5 мМ ТБТА в стеклянную пробирку и разбавляют 180 мл ДМСО.
- Добавьте 800 мкл трет - бутанола и вихря.
3. Анализ экспрессии NAAA в Paw ткани CFA обработанных крыс
Примечание: Использование самцов Sprague-Dawley крыс, весом 175-200 г, а также выполнять все процедуры в соответствии с руководящими принципами этического использования животных. Дом крысы в вентилируемых клетках на 12-часовой свет / темнота цикла и дать им свободный доступ к пище и воде. Для протокола CFЛечение, обратитесь к статье , опубликованной Bonezzi и др. 29 Использовать животных через 7 дней после введения CFA.
- Внутривенное введение ARN14686
- Растворите ARN14686 в транспортном средстве (15% PEG и 15% -ного раствора Tween физиологический раствор). Вычислить концентрацию раствора в зависимости от веса крысы (доза 3 мг / кг, вводимый объем 5 мл / кг).
- Продолжайте внутривенных инъекций в трех наивным и трех CFA обработанных крыс. Поместите каждую крысу в соответствующем пластмассовом устройстве удерживающего. Затем поместите хвост крысы в теплой воде в течение 2-4 мин, чтобы позволить вазодилатацию и впрыснуть соединение IV через хвостовую вену.
- Вводят три крысы (наивные и CFA-обработанную) IV только с транспортным средством.
- Paw Сбор и Препарирование
- Жертвоприношение крыс от CO 2 ингаляции 4 ч после того, как зонд или транспортного средства управления и собирать их лапы путем разрезания их на 0,5 см выше коленного сустава с помощью скальпеля.
- Осторожно снимите кожу с помощью ножниц помощь рассечения и рассекают из мягких тканей, очищая их от кости. Выбросить кости и собирают мягкие ткани лап. Привязать образцы замораживают в жидком азоте и хранят при -80 ° С.
- Paw Гомогенизация и лизосом Получение белка
Примечание: Не следует использовать моющие средства и аминсодержащее буферы, так как они могут ингибировать реакцию CC.- Объединить ткани лапы от 3 крыс (полученного , как описано в разделе 3.2.1) и гомогенизируют их в 4 мл 320 мМ сахарозы в фосфатно-солевом буфере (PBS, рН 7,4) и ингибиторов протеаз (см Материал / реактив таблицу); использовать Диспергатор высокопроизводительную (см Материал / Реагент таблицу).
- Центрифуга гомогената ткани в течение 20 мин при 1000 х г при 4 ° С; сохранить супернатант.
- Добавляют 2 мл 320 мМ сахарозы в PBS и ингибитор протеаз к осадку ткани игомогенизируют еще раз.
- Центрифуга в течение 20 мин при 1000 х г при 4 ° С, и добавляют супернатант к одному из шага 3.3.2.
- Центрифуга собранных супернатантов в течение 30 мин при 12000 х г при 4 ° С.
- Взвесить осадок и ресуспендируют в двух объемах PBS (то есть, по 200 мкл на каждые 100 мг осадка). Передача в 1,5 мл пробирку для сбора и в замерзать при температуре -80 ° С в течение 1 часа.
- Растаяйте образцы и заморозить снова в течение 1 ч при -80 ° С.
- Повторите замораживания / оттаивания цикл еще два раза.
Примечание: Этот шаг предназначен для солюбилизации белка. Замораживание в течение ночи, если это необходимо. - Центрифуга в течение 1 часа при 100000 х г при 4 ° С. Собирают супернатант, который содержит растворимые белки, лизосомальные, и отбросить осадок. Хранить при температуре -80 ° С или сразу приступить Количественную оценку белка.
- Количественное содержание белка с использованием анализа ВСА белка 30 коммерческого набора (см Материал / Реагент Таблица ), следуя инструкциям изготовителя.
- Хранить образцы при температуре -80 ° С до использования.
- CC с азидом-PEG3-биотин
Примечание: Протокол CC и стрептавидин обогащения шарик (шаги 3.4-3.6) немного изменены из протокола , опубликованного и Cravatt Спирс 31.- Подготовьте 500 мкл (1 мг / мл, в PBS) лизосомных белков из и через зонд, обработанных носителем крыс (наивные и CFA-обработанных крыс).
- Преклире образцов с 40 мкл 50% -ной суспензии стрептавидин агарозе с (мыть три раза с 1 мл PBS перед использованием) в течение 1 ч при 4 ° С. Центрифуга в течение 4 мин при 1000 х г при 4 ° С и принимать супернатант.
- Добавить 11,3 мкл 5 мМ исходного раствора азида-PEG3-биотин и вихря.
- Добавить 11,3 мкл 50 мМ исходного раствора свежеприготовленного ТСЕР и вихря.
- Премикс 34 мкл свежеприготовленного рабочего раствора 1,7 мМ TBTA с 11,3 мкл 50 мМ CuSO 4 · 5H 2 O запас.
- Добавить 45,3 мл предварительно смешанного TBTA / CuSO 4 · 5H 2 O раствора и вихря.
- Инкубируйте реакции при 25 ° С в течение 2 ч (более длительное время инкубации не влияет на реакцию). Обратите внимание осаждение белков на этом шаге. Смешайте после первого часа инкубации.
- Удаление излишков CC Реагенты
- Центрифуга образцы в течение 4 мин при 6500 х г при 4 ° C и удалить супернатант.
- Добавить 750 мкл холодного метанола и ресуспендируют с помощью ультразвуковой обработки (5 сек с зондом для обработки ультразвуком).
- Центрифуга образцов в течение 4 мин при 6500 х г при температуре 4 ° C и удалить супернатант с помощью шприца и иглы.
- Повторите шаг 3.5.2 дважды (Озвучивание не требуется).
- После последней промывки добавляют 325 мкл додецилсульфата натрия (SDS) 2,5% в PBS к белковым гранул и соникатные 3x в течение 5 сек.
- Тепло образцов в течение 5 мин при 65 ° С и разрушать ультразвукомусиление.
- Центрифуга в течение 5 мин при 6500 х г при комнатной температуре и сохранить супернатант.
- Добавить 1,4 мл PBS, чтобы разбавить концентрацию SDS до 0,5%. Хранить при температуре -20 ° С или продолжать обогащение стрептавидин.
- стрептавидином Обогащение
- С помощью PBS, довести объем образцов, полученных на этапе 3.5.8 до 4,2 мл. Добавьте 40 мкл 50% суспензии стрептавидин агарозы с использованием вырез заостренного конца в (мыть три раза с 1 мл PBS перед использованием).
- Инкубировать в течение 2 ч при комнатной температуре с вращением, а затем центрифугировать в течение 2 мин при 1400 х г.
- Удалить супернатант без сушки гранулы гранул и использовать остаточный супернатант для переноса бусинок в 1 мл колонку спина (см Материал / Реагент таблицу).
- Промыть под действием силы тяжести с 3x 1 мл 1% -ного SDS (в PBS), 3x 1 мл 6 М мочевины (в PBS), и 4x 1 мл PBS.
- Используйте 2x 500 мкл PBS, чтобы передать бусинки в 1,5 мл пробирку и центрифугируют в течение 2 мин при 1400 х г при комнатной температуре, Аккуратно аспирата супернатант с помощью шприца и иглы.
- Элюируйте связанные со смолой белки путем добавления 25 мкл буфера для элюции (6 М мочевина, 2 М тиомочевина, 2% SDS, и 6 мМ биотина, все в PBS) в течение 15 мин при комнатной температуре с последующим 15 мин при 95 ° C 32.
- Белок Клякса
- Добавьте 5 мкл 6х Laemmli буфера ( в течение 9 мл: 0,5 мл 1 М Трис-HCl , рН 6,8, 5 мл 20% SDS, 5 мг бромфеноловый синий, 3 мл глицерина и Н 2 O до 9 мл) и добавить 5% β-меркаптоэтанола, непосредственно перед использованием. Кратко Центрифуга образцов при 2000 х г для осаждения смолы и нагрузки 25 мкл полученного супернатанта в полиакриламидном геле 4-12%.
- Выполните гель - электрофореза и переноса белков на фильтровальную мембрану в соответствии с инструкциями изготовителя 33.
- Пропитайте промокательную мембрану в течение 1 часа с 10 мл блокирующего буфера (см Материал / реактив таблицу) , содержащей 0,1% твин-20.Избегайте использования молока, так как это может увеличить фон.
- Промывают мембрану с 10 мл 0,05% Tween-20 в PBS и добавляют 10 мкл флуоресцентного стрептавидином (см Материал / Реагент Таблица) , растворенного в 10 мл блокирующего буфера, содержащего 0,1% твин-20 в течение 1 ч при комнатной температуре.
- Промыть 4 раза с 0,05% Tween-20 в PBS и один раз PBS в одиночку (10 мин каждый).
- Использование сканера изображения (см Материал / Реагент таблицу). Включите прибор и подключенного компьютера. Подождите до готовности.
- Запустите программу сбора данных и выбора режима флуоресценции. Выберите область мембраны и выбрать папку для сохранения файлов.
- Установите следующие параметры измерения: 680 нм длина возбуждения, BPFR700 фильтр, значение 1000 В фотоэлектронный умножитель (ФЭУ) (канал 2), и 25 мкм размер пикселя. Приобретать изображение.
4. Локализация каталитически активных Naaa в Mouse Легких с помощью флуоресцентной Microsкопия
Примечание: Используйте мужчина от 8 до 10 недельных мышей и выполнять все процедуры в соответствии с руководящими принципами этического использования животных. Дом мышей в вентилируемых клетках на 12-часовом цикле свет / темнота и дать им свободный доступ к пище и воде.
- Внутривенное введение ARN14686 у мышей
- Растворите ARN14686 в автомобиле: 15% ПЭГ и 15% Tween-20 физиологического раствора. Вычислить концентрацию раствора в зависимости от веса мыши (доза 3 мг / кг, вводимый объем 5 мл / кг).
- Продолжайте инъекцией 3 мышей. Поместите каждую мышь в соответствующем пластмассовом устройстве удерживающего. Затем поместите хвост мыши в теплой воде в течение 2-4 мин, чтобы позволить вазодилатацию и ввести соединение IV через хвостовую вену.
- Вводят 3 мышей внутривенно с единственным транспортным средством.
- Сбор и легких Кусочек Приготовление
Внимание: Ручка параформальдегида с осторожностью в вытяжном шкафу и в перчатках!- Обезболить мышей с Chloгидрат цвета RAL (400 мг / кг). Подтверждение анестезии с пальца щепоткой. Выполните transcardial перфузию следующим образом:
- Поверхностно разрезать брюшную кожу с помощью ножниц и подвергать грудном и брюшину поверхности.
- Поверхностно разрезать брюшину ножницами, чуть ниже мечевидный отросток, и выставить диафрагму и внутренних органов. Будьте осторожны, чтобы не терзать каких-либо значительных сосудистую сеть.
- Откройте грудной полости за счет сокращения диафрагмы от одного бокового аспекта к другому.
- Вставьте иглу 25 G, соединенный с автоматизированным шприцевой насос и влить 20 мл 0,9% физиологического раствора, затем 60 мл 4% PFA в фосфатном буфере (0,1 М, рН 7,4).
- После того, как перфузия завершена, потяните сердце с помощью пинцета и тщательно проанализируем его. Возьмитесь трахеи с пинцетом и вырезать полностью через него с помощью ножниц. Слегка потяните трахеи вверх и снимите легкие от грудной клетки. Рассеките ткани,отделить правого легкого с левой стороны.
- Постфикс ткань в параформальдегидом 4% в течение 1 ч, образцы замерзнет в холодном 2-метилбутана, и хранить их при температуре -80 ° С.
- Собирают 40 мкм секций, использу криостат, смонтировать их непосредственно на предметном стекле (один каждый пятый), и обрабатывать их для иммуногистохимии, как описано ниже.
- Обезболить мышей с Chloгидрат цвета RAL (400 мг / кг). Подтверждение анестезии с пальца щепоткой. Выполните transcardial перфузию следующим образом:
- Ткань Кусочки пермеабилизирующего и преграждать
- Промывают ЗФР (2 раза в течение 5 мин) и проницаемыми с 0,1% тритона Х-100 PBS в течение 15 мин при комнатной температуре.
- Промывают ЗФР (2 раза в течение 5 мин) и блок с 3% бычьего сывороточного альбумина (BSA) в PBS в течение 30 мин при комнатной температуре.
- Мытье с PBS (2х в течение 5 мин) и продолжить CC.
- CC с азидом-PEG3-Fluor 545 на ткани Ломтики
- Готовят раствор путем смешивания CC реагентов, полученных, как описано в разделе 2. Для получения 1 мл раствора, добавляют: 2 мкл азида PEG3-Fluor 545 (5 мМ маточного), 20 мкл ТСЕР (свежеприготовленного 50 мМ КТВЗРK), 58,8 мкл ТБТА (свежеприготовленный 1,7 рабочего раствора мМ), 20 мкл CuSO 4 · 5H 2 O (50 мМ исходного), и 900 мкл PBS.
- Добавьте около 400 мкл CC смеси на срезах тканей, которые были подготовлены в соответствии с разделом 4.2. Обратите внимание, что выбранный объем CC смеси достаточно, чтобы покрыть ломтиками. Инкубировать в течение 1 ч при комнатной температуре в защищенном от света.
- Мытье с PBS (1x в течение 5 мин), холодным метанолом (1 раз в течение 5 мин), раствор 1% твина-20 и 0,5 мМ ЭДТА в PBS (3 раза в течение 2 мин) и PBS (1x в течение 5 мин).
- Воздух сухой, добавить каплю antifade mountant с DAPI (см Материал / Реагент Table), рядом с покровных стеклах (избегая образования пузырьков), и печать с лаком. Хранить при температуре 4 ° С до анализа.
- Image Acquisition
- С помощью конфокальной микроскопии , оборудованный 546 нм и 450 нм лазеров возбуждения (см Материал / Реагент таблицу) следующиеинструкции.
- Выберите 60X объектив с NA = 1,40, убедившись в том, чтобы предварительно просмотреть слайд через окуляры и сосредоточиться на интересующей области.
- Определить параметры сбора данных в соответствии с образцом и оборудования функций.
Результаты
ARN14686 был разработан на основе эшафот ингибитора ARN726 Naaa. 4-бутил-циклогексил группа ARN726 была замещена С9 насыщенной алифатической цепью , несущей концевой алкиновой тег (рисунок 1). Алкиновая тег был введен для того, чтобы разрешить использование процедуры маркировки двухступенчатым, чтобы добавить флуорофор или биотин молекулы через CC. Эта особенность делает ARN14686 очень универсальный инструмент для того чтобы зондировать Naaa в пробирке и в естественных условиях.
Здесь мы покажем два приложения ARN14686, которые являются репрезентативными потенциал этой молекулы. На рисунке 2 представлена схема экспериментальной методике , описанной здесь. После внутривенного введения зонда, могут быть использованы два различных метода обнаружения: I) анализ активного экспрессии Naaa белком-блоттинга и II) анализ активного выражения Naaa и локализации внутри клеток с помощью fluorescencэлектронной микроскопии.
Первый представитель результат был недавно опубликован в нашей группе 29. Мы проанализировали экспрессию Naaa в крысиной модели CFA-индуцированного воспаления лапы. Зонд (3 мг / кг) или носитель вводили внутривенно в наивных и CFA обработанных крыс. Кроликов забивали 4 ч позже. СС проводили на обогащенных экстрактов лизосомальных ввести биотин-тег на зонд-меченных белков. Биотинилированные белки были следующими обогащена использованием стрептавидином бусинки. Элюированные белки анализировали с помощью белков - блот, показывающий , что уровни активного Naaa были заметно увеличились в лапах крыс , получавших CFA относительно тех , у контрольных крыс (рисунок 3). Преимущество анализа белка блот является то, что она позволяет детально изучить зонда-реактивного протеома, который отделен с помощью электрофореза в геле. Такой подход позволяет также открытие потенциальных зондов отходящими мишеней. Элемент управления не-зонд должен быть альспособы включены для того, чтобы исключить эндогенные биотинилированные белки, которые представляют собой экспериментальную фон. Стрелолист на рисунке 3 показывает такие фоновые белки, которые , в свою очередь , могут быть использованы в качестве нагрузочного информацию об управлении.
Во втором эксперименте неопубликованной (рисунок 4), мы использовали ARN14686 зонд Naaa для обнаружения экс естественных условиях с помощью флуоресцентной микроскопии. Мы вводили ARN14686 мышам в дозе 3 мг / кг (внутривенно) и умерщвляли их через 2 часа после обработки transcardial перфузией. Легких были собраны, оканчиваются, и замораживают в холодном 2-metylbutane. Реакцию CC для флуорофора Кроме того была проведена непосредственно на ткани срезов толщиной 40 мкм, собранных с помощью криостата. Анализ с помощью флуоресцентной микроскопии показал наличие каталитически активного Naaa при рассеянном везикулярных структур, принадлежащих к альвеолярных макрофагов. По сравнению с использованием антител белка специфических, только внаблюдается ctive фермента.
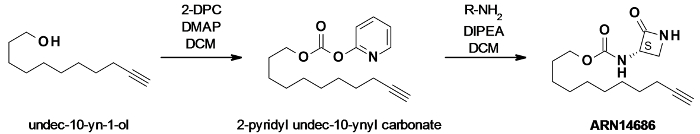
Рисунок 1:. ARN14686 схема реакции синтеза ундец-10-ин-2-ол был активирован dipyridylcarbonate (DPC) в присутствии каталитического 4-диметиламинопиридина (ДМАП) с получением смешанного карбоната. Этот карбонат затем реагирует с аминокислотой лактама , чтобы получить молекулу - мишень ARN14686. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
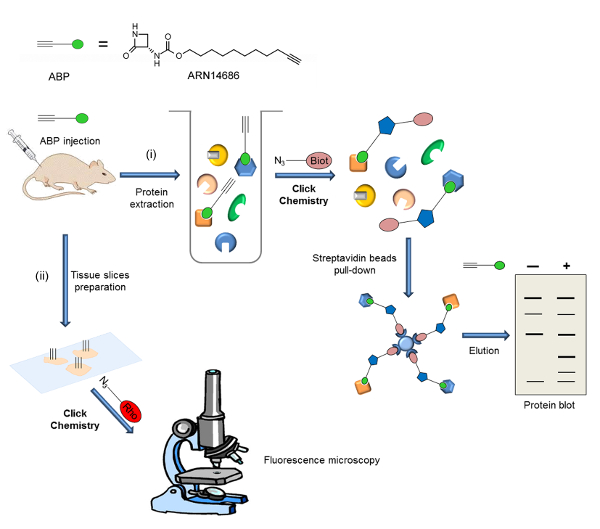
Рис . 2: Workflow схема общей стратегии , показанной в настоящей работе Зонд вводится в животных (крыс или мышей) и целевой экспрессии анализируют следующие два различных экспериментальной процедурыs: я) Меченый протеом извлекается и биотин добавляется CC. После обогащения фазы биотинилированных белков на стрептавидином бусин, мишени зонда анализируют с помощью белков-блоттинга. б) срезы тканей подготавливаются и флуорофор добавляется CC. цель локализации зонда анализируют с помощью микроскопии цветения. Эта цифра была заимствована из Bonezzi и др. 29 Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
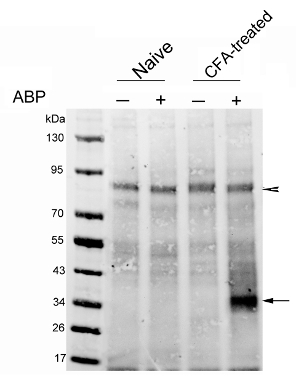
Рисунок 3:. Анализ активации Naaa в лапы CFA крыс , обработанных Протеин - блот - анализ стрептавидином обогащенные белков из нативных крыс (полосы 1 и 2) или CFA крыс , инъецированных через 7 дней после инъекции (дорожки 3 и 4). Крысы получали внутривенные инъекции транспортного средства или ARN14686 (3 мг / кг). Промокательной мембранызондировали с флуоресцентным стрептавидином. Стрелка указывает на полосу Naaa; острие стрелы указывает биотин, содержащий полосу приблизительно 90 кДа, показывая, что было загружено аналогичное количество белка в каждой полосе. Эта цифра была изменена с Bonezzi и др. 29 Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 4: Пример естественных условиях обнаружение зонда , меченного NAAA в легких мышей с помощью флуоресцентной микроскопии Представительные фотографии участков легочных vehicle- (А) или ARN14686 впрыском (В) у мышей после CC с азидом-PEG3-Fluor 545 сообщаются.. Положительный сигнал (эритроциты) был обнаружен в ARN14686-вводили мышам, в то время как ни один сигнал не был обнаружен в Vehicle вводили мышам. Деталь азид-PEG3-Fluor 545 положительным альвеолярного макрофага показан на C при большем увеличении. Ядра были отмечены DAPI (синий). Шкала бар = 50 мкм в А и 10 мкм в C. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Ферментативная активность тонко регулируется на различных уровнях, в том числе транскрипции РНК, синтез белка, транслокация белка, пост-трансляционной модификации и белок-белковых взаимодействий. Часто, экспрессия фермента в одиночку не учитывает его деятельности. ABPP была разработана с целью изучения активности белков в их нативном состоянии. Две особенности необходимы: химический датчик, который ковалентно связывается с активным центром фермента, представляющего интерес, и репортерной метке для обнаружения зонда, меченного ферментом.
Конструкция зонда и синтез являются критическими точками процедуры. Зонд должен иметь достаточное сродство и селективность к своей цели. К тому же, наличие репортера тега не должен влиять на поражение цели. Эта проблема в значительной степени преодолеть за счет конструкции двухступенчатого ABP, в котором репортер тег вводится после того, как цель была поймана. Tag-фри зонды особенно хорошо подходят для исследований в естественных условиях, в которых активность белкаможет быть оценена в живой клетке или организме, с минимальным внешним изменением. Зонд ARN14686 NAAA был разработан для выполнения требований, изложенных выше. Β-лактамным был выбран реактивная боеголовка на основе предшествующих результатов , полученных с классом β-лактамным ингибиторов Naaa 16,26. Эти соединения ингибируют Naaa в мощным и селективным способом, путем ковалентного связывания с каталитическим цистеина фермента. Кроме того, соединения было показано , системно активными 16. Мы ввели С9 насыщенную алифатическую цепь, принимая во внимание повышенную аффинность Naaa для длинных алифатических цепей. Терминал алкиновая был добавлен, чтобы позволить двухступенчатого маркировки.
Другим важным шагом является выбор дозы и времени введения в естественных условиях. Это зависит от стабильности зонда в плазме, ее целевой аффинности и селективности. Правильная доза должна быть выбрана для обеспечения целевого захвата, избегая при этом участия роssible отходящие цели. Мы обнаружили, что 3 мг / кг ARN14686 IV была оптимальной для захвата Naaa выборочно. Более высокие дозы приводило к захвату гомологичной цистеина амидазы, кислоты ceramidase. Что касается длины лечения, при анализе хорошо перфузированных органы, как легкие, короткое время (2 ч), может быть достаточным, чтобы позволить зонду реагировать с мишенью. Для лап, однако, мы были вынуждены удвоить время реакции.
Возможная проблема в целевом анализе белком-блоттинга обусловлена наличием естественно биотинилированных белков. Они неизбежно будут определены вместе с конкретными целями зонда. Мы обнаружили, что введение preclearing шаг с стрептавидином бисером перед выполнением CC значительно повысило качество наших результатов. С другой стороны, присутствие родных биотинилированных белков могут быть использованы для управления для возможных артефактов нагрузки. И, наконец, в отношении исследований локализации методом флуоресцентной микроскопии, это очень важно, чтобы быть в курсе роблачи селективностью, так как, в отличие от белка-блоттинга, флуоресцентной микроскопии не допускает различие мишени от офф-мишеней. Предварительные исследования селективности должны быть выполнены для оценки возможности и создать оптимальные условия эксперимента.
Ограничения описанной методики в основном относятся к необходимости избежать условий эксперимента, которые могут повлиять на реакцию CC, например, с использованием моющих средств и аминов, содержащих буферы. Эти аспекты должны быть приняты, чтобы учесть при подготовке клеточного лизата или гомогената ткани. Кроме того, когда требуется стрептавидин обогащение фазы, количество исходного материала составляет другую проблему, так как эта процедура применима только тогда, когда содержание белка не менее 250 мкг. Этот предел устанавливается из-за технических проблем, таких как рабочие объемы, восстановление белка, после осаждения CC-индуцированной, а количество стрептавидин- смолы, которая должна быть использована.
Previouslу, активность NAAA может быть оценена только путем проведения анализов активности, которые требуют использования буфера активации для активации в пробирке фермента и субстрата для солюбилизации 14. Такой подход дает информацию о суммарном выражении Naaa, а не о наличии активного Naaa. Другая возможность состоит в том, чтобы измерить уровни ткани гороховой и OEA, но этот метод представляет собой лишь косвенную способ оценки активности Naaa 34,35. Кроме того, уровни FAE может быть под влиянием других факторов, таких как биосинтез. Химический зонд ARN14686 является первым ABP для Naaa. Протокол , описанный здесь , иллюстрирует простую процедуру для захвата и визуализации активной формы Naaa, как в пробирке и в естественных условиях. Все образцы манипуляции после зонд-мишень реакций, что дает достоверную информацию о состоянии в естественных условиях фермента. Кроме того, использование ARN14686 в флуоресцентной микроскопии представляет собой уникальный инструмент то локализации активного Naaa. Доступные антитела, которые распознают каталитическая субъединица Naaa, не дискриминировать между Naaa полнометражного профермента и активного фермента.
Начиная с протоколом, описанным здесь, выражение NAAA и активации могут быть проанализированы в различных клеточных линий и животных моделях воспаления. Co-локализации исследования могут быть выполнены, чтобы лучше охарактеризовать роль Naaa в физиологических и патологических состояниях.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors thank the Nikon Imaging Center at Istituto Italiano di Tecnologia, Genova, Italy (NIC@IIT).
Материалы
| Name | Company | Catalog Number | Comments |
| 1,1’-sulfonyldiimidazole | Sigma Aldrich | 367818 | Harmful |
| 2-dipyridylcarbonate | Fluorochem | 11331 | Harmful |
| 2-Methylbutan | Sigma Aldrich | M32631 | Flamable, toxic,hazardous to the aquatic environment |
| 4-(Dimethylamino)pyridine | Sigma Aldrich | 107700 | Toxic |
| Acetic acid | Sigma Aldrich | 695092 | Flammable, Corrosive |
| Acetonitrile | Sigma Aldrich | 34998 | Flammable, Toxic |
| Activated charcoal | Sigma Aldrich | 161551 | |
| Ammonium chloride | Sigma Aldrich | A9434 | Harmful |
| Azide-PEG3-Biotin | Jena Biosciences | CLK-AZ104P4 | |
| Azide-PEG3-Fluor 545 | Jena Biosciences | CLK-AZ109 | |
| BCA protein assay kit | Thermo Fisher Scientific | 23227 | |
| Bio-spin columns | Biorad | 732-6204 | |
| Biotin | Sigma Aldrich | B4501 | |
| Blocking buffer | Li-Cor Biosciences | 927-40000 | |
| β-mercaptoethanol | Sigma Aldrich | M6250 | Higly toxic |
| Bovin serum albumine (BSA) | Sigma Aldrich | A7030 | |
| Bromophenol blue | Sigma Aldrich | B0126 | |
| Bruker Avance III 400 | Bruker | ||
| Celite | Sigma Aldrich | 419931 | Health hazard |
| Ceric ammonium nitrate | Sigma Aldrich | 22249 | Oxidizing, Harmful |
| Chloral hydrate | Sigma Aldrich | C8383 | Higly toxic |
| CuSO4.5H2O | Sigma Aldrich | 209198 | Toxic |
| Cyclohexadiene | Sigma Aldrich | 125415 | Flammable, Health hazard |
| Cyclohexane | Sigma Aldrich | 34855 | Flammable, Harmful, Health hazard, Environmental hazard |
| Dichloromethane | Sigma Aldrich | 34856 | Harmful, Health hazard |
| Diethyl ether | Sigma Aldrich | 296082 | Flammable, Harmful |
| Dimethyl sulfoxide (DMSO) | Acros Organics | 348441000 | |
| Dimethyl sulfoxide d6 (DMSO-d6) | Sigma Aldrich | 175943 | |
| Ethanol | Sigma Aldrich | 2860 | Flammable, Harmful |
| Ethyl acetate | Sigma Aldrich | 34858 | Flammable, Harmful |
| Glycerol | Sigma Aldrich | G5516 | |
| Irdye 680-LT Streptavidin | Li-Cor Biosciences | 925-68031 | |
| IRDye680-LT Streptavidin | Licor | 925-68031 | Briefly centrifuge before use to precipitate protein complexes |
| Methanol | Sigma Aldrich | 34966 | Highly toxic |
| Methanol | Sigma Aldrich | 34860 | Flammable, Toxic, Health hazard |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride | Sigma Aldrich | E7750 | Harmful, Corrosive |
| N,N-diisopropylethylamine | Sigma Aldrich | D125806 | Flammable, Corrosive, Toxic |
| N,N-dimethylformamide | Sigma Aldrich | 227056 | Flammable, Harmful, Health hazard |
| N-Cbz-L-Serine | Fluorochem | M03053 | Harmful |
| Nikon A1 confocal microscopy | Nikon | Read the user manual | |
| NuPAGE 4-12% Bis-Tris gel | Thermo Fisher Scientific | NP0335BOX | |
| Palladium on carbon | Sigma Aldrich | 330108 | |
| p-anisidine | Sigma Aldrich | A88255 | Toxic, Health hazard, Environmental hazard |
| Paraformaldehyde | sigma Aldrich | 441244 | Toxic, respiratory harmful, corrosive, falmable |
| Poly(ethylene glycol) | Sigma Aldrich | P3265 | |
| ProLong Gold antifade mountant with DAPI | Thermo Fisher Scientific | P36931 | Avoid bubbles formation |
| Protease inhibitor cocktail | Sigma Aldrich | P8340 | |
| Sodium bicarbonate | Sigma Aldrich | S6014 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | L3771 | Toxic, corrosive, falmmable |
| Sodium hydride | Sigma Aldrich | 452912 | Flammable |
| Sodium sulfate | Sigma Aldrich | 239313 | |
| Starion FLA-9000 immage scanner | FUJIFILM | Read the user manual | |
| Streptavidin agarose | Thermo Fisher Scientific | 20349 | |
| Sucrose | Sigma Aldrich | S7903 | |
| Tert-butanol | Sigma Aldrich | 360538 | Toxic, flammable |
| Tetrahydrofuran | Sigma Aldrich | 186562 | Flammable, Harmful, Health hazard |
| Thiourea | Acros Organics | 424542500 | Toxic, warm at 50 °C to dissolve |
| Tris | Sigma Aldrich | RDD008 | |
| Tris(2-carboxyethyl)phosphine (TCEP) | Sigma Aldrich | C4706 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Sigma Aldrich | 678937 | |
| Triton-x100 | Sigma Aldrich | X100 | Toxic |
| Tween-20 | Sigma Aldrich | P9416 | |
| Tween-80 | Sigma Aldrich | P1754 | |
| Ultra turrax IKA T18 basic tissue homogenizer | IKA | ||
| Undec-10-yn-1-ol | Fluorochem | 13739 | Harmful |
| Urea | Sigma Aldrich | U5378 | Toxic, warm at 50 °C to dissolve |
Ссылки
- Gygi, S. P., Han, D. K., Gingras, A. C., Sonenberg, N., Aebersold, R. Protein analysis by mass spectrometry and sequence database searching: tools for cancer research in the post-genomic era. Electrophoresis. 20, 310-319 (1999).
- Washburn, M. P., Wolters, D., Yates, J. R. Large-scale analysis of the yeast proteome by multidimensional protein identification technology. Nat Biotechnol. 19, 242-247 (2001).
- Zhu, H., Bilgin, M., Snyder, M. Proteomics. Annu Rev Biochem. 72, 783-812 (2003).
- Ito, T., et al. Roles for the two-hybrid system in exploration of the yeast protein interactome. Mol Cell Proteomics. 1, 561-566 (2002).
- Evans, M. J., Cravatt, B. F. Mechanism-based profiling of enzyme families. Chem Rev. 106, 3279-3301 (2006).
- Cravatt, B. F., Wright, A. T., Kozarich, J. W. Activity-based protein profiling: from enzyme chemistry to proteomic chemistry. Annu Rev Biochem. 77, 383-414 (2008).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew Chem Int Ed Engl. 41, 2596-2599 (2002).
- Meldal, M., Tornoe, C. W. Cu-catalyzed azide-alkyne cycloaddition. Chem Rev. 108, 2952-3015 (2008).
- Speers, A. E., Adam, G. C., Cravatt, B. F. Activity-based protein profiling in vivo using a copper(i)-catalyzed azide-alkyne [3 + 2] cycloaddition. J Am Chem Soc. 125, 4686-4687 (2003).
- Saxon, E., Bertozzi, C. R. Cell surface engineering by a modified Staudinger reaction. Science. 287, 2007-2010 (2000).
- Kohn, M., Breinbauer, R. The Staudinger ligation-a gift to chemical biology. Angew Chem Int Ed Engl. 43, 3106-3116 (2004).
- Romeo, E., et al. Activity-Based Probe for N-Acylethanolamine Acid Amidase. ACS Chem Biol. 10, 2057-2064 (2015).
- Ueda, N., Yamanaka, K., Yamamoto, S. Purification and characterization of an acid amidase selective for N-palmitoylethanolamine, a putative endogenous anti-inflammatory substance. J Biol Chem. 276, 35552-35557 (2001).
- Tsuboi, K., et al. Molecular characterization of N-acylethanolamine-hydrolyzing acid amidase, a novel member of the choloylglycine hydrolase family with structural and functional similarity to acid ceramidase. J Biol Chem. 280, 11082-11092 (2005).
- Tsuboi, K., Takezaki, N., Ueda, N. The N-acylethanolamine-hydrolyzing acid amidase (NAAA). Chem Biodivers. 4, 1914-1925 (2007).
- Ribeiro, A., et al. A Potent Systemically Active N-Acylethanolamine Acid Amidase Inhibitor that Suppresses Inflammation and Human Macrophage Activation. ACS Chem Biol. 10, 1838-1846 (2015).
- Zhao, L. Y., Tsuboi, K., Okamoto, Y., Nagahata, S., Ueda, N. Proteolytic activation and glycosylation of N-acylethanolamine-hydrolyzing acid amidase, a lysosomal enzyme involved in the endocannabinoid metabolism. Biochim Biophys Acta. 1771, 1397-1405 (2007).
- Wang, J., et al. Amino acid residues crucial in pH regulation and proteolytic activation of N-acylethanolamine-hydrolyzing acid amidase. Biochim Biophys Acta. 1781, 710-717 (2008).
- West, J. M., Zvonok, N., Whitten, K. M., Wood, J. T., Makriyannis, A. Mass spectrometric characterization of human N-acylethanolamine-hydrolyzing acid amidase. J Proteome Res. 11, 972-981 (2012).
- Bandiera, T., Ponzano, S., Piomelli, D. Advances in the discovery of N-acylethanolamine acid amidase inhibitors. Pharmacol Res. 86, 11-17 (2014).
- Sasso, O., et al. Antinociceptive effects of the N-acylethanolamine acid amidase inhibitor ARN077 in rodent pain models. Pain. 154, 350-360 (2013).
- Duranti, A., et al. N-(2-oxo-3-oxetanyl)carbamic acid esters as N-acylethanolamine acid amidase inhibitors: synthesis and structure-activity and structure-property relationships. J Med Chem. 55, 4824-4836 (2012).
- Ponzano, S., et al. Synthesis and structure-activity relationship (SAR) of 2-methyl-4-oxo-3-oxetanylcarbamic acid esters, a class of potent N-acylethanolamine acid amidase (NAAA) inhibitors. J Med Chem. 56, 6917-6934 (2013).
- Solorzano, C., et al. Synthesis and structure-activity relationships of N-(2-oxo-3-oxetanyl)amides as N-acylethanolamine-hydrolyzing acid amidase inhibitors. J Med Chem. 53, 5770-5781 (2010).
- Vitale, R., et al. Synthesis, structure-activity, and structure-stability relationships of 2-substituted-N-(4-oxo-3-oxetanyl) N-acylethanolamine acid amidase (NAAA) inhibitors. ChemMedChem 9. 9, 323-336 (2014).
- Fiasella, A., et al. 3-Aminoazetidin-2-one derivatives as N-acylethanolamine acid amidase (NAAA) inhibitors suitable for systemic administration. ChemMedChem 9. 9, 1602-1614 (2014).
- Armirotti, A., et al. beta-Lactones Inhibit N-acylethanolamine Acid Amidase by S-Acylation of the Catalytic N-Terminal Cysteine. ACS Med Chem Lett. 3, 422-426 (2012).
- Nuzzi, A., et al. Potent alpha-amino-beta-lactam carbamic acid ester as NAAA inhibitors. Synthesis and structure-activity relationship (SAR) studies. Eur J Med Chem. 111, 138-159 (2016).
- Bonezzi, F. T., et al. An Important Role for N-Acylethanolamine Acid Amidase in the Complete Freund's Adjuvant Rat Model of Arthritis. J Pharmacol Exp Ther. 356, 656-663 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150, 76-85 (1985).
- Speers, A. E., Cravatt, B. F. Activity-Based Protein Profiling (ABPP) and Click Chemistry (CC)-ABPP by MudPIT Mass Spectrometry. Curr Protoc Chem Biol. 1, 29-41 (2009).
- Rybak, J. N., Scheurer, S. B., Neri, D., Elia, G. Purification of biotinylated proteins on streptavidin resin: a protocol for quantitative elution. Proteomics. 4, 2296-2299 (2004).
- Penna, A., Cahalan, M. Western Blotting using the Invitrogen NuPage Novex Bis Tris minigels. J Vis Exp. (264), (2007).
- Giuffrida, A., Piomelli, D. Isotope dilution GC/MS determination of anandamide and other fatty acylethanolamides in rat blood plasma. FEBS Lett. 422, 373-376 (1998).
- Buczynski, M. W., Parsons, L. H. Quantification of brain endocannabinoid levels: methods, interpretations and pitfalls. Br J Pharmacol. 160, 423-442 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены