Method Article
הכנה
In This Article
Summary
כאן, אנו מתארים את ההכנה והשימוש תחקיר מבוססי פעילות (ARN14686, undec-10-ynyl- N - [(3 S) -2-oxoazetidin-3-י.ל.] carbamate) המאפשר איתור וכימות של צורה פעילה של amidase החומצה המעודד דלקת אנזים N -acylethanolamine (NAAA), הוא במבחנת vivo לשעבר.
Abstract
פרופיל חלבון מבוסס פעילות (ABPP) הוא שיטה לזיהוי של אנזים של עניין proteome מורכב באמצעות בדיקה כימית שמכוונת את האתר הפעיל של האנזים. תג כתב הציג לתוך החללית מאפשר זיהוי של האנזים שכותרתו ידי סריקת קרינה-ג'ל, כתם חלבון, מיקרוסקופ פלואורסצנטי, או ספקטרומטריית כרומטוגרפיה-מסה נוזלית. כאן, אנו מתארים את ההכנה ושימוש של ARN14686 המתחם, כימיה לחץ פעילות מבוססת בדיקה (CC-ABP) באופן סלקטיבי מזהה אנזים N -acylethanolamine חומצת amidase (NAAA). NAAA הוא hydrolase ציסטאין שמקדם דלקת ידי השבתת peroxisome אנדוגני קולטן proliferator המופעל (PPAR) אגוניסטים -alpha כגון palmitoylethanolamide (PEA) ו oleoylethanolamide (OEA). NAAA הוא מסונתז כקובץ proenzyme באורך מלא פעיל, אשר מופעל על ידי autoproteolysis ב- pH חומצי של ליזוזום. מחקרי לוקליזציה hותעיף הראה כי NAAA מתבטא בעיקר מקרופאגים ותאי מונוציטים נגזרות אחרים, וכן לימפוציטים מסוג B. אנו מספקים דוגמאות כיצד ניתן להשתמש ARN14686 כדי לזהות ולכמת פעיל NAAA vivo לשעבר ברקמות מכרסמים על ידי כתם חלבון מיקרוסקופ פלואורסצנטי.
Introduction
בשימוש נפוץ שיטות לחקור את דפוסי הביטוי, אינטראקציות, ופונקציות של חלבונים, כולל פלטפורמות ספקטרומטריית כרומטוגרפיה-מסה נוזליות לניתוח רובה 1,2, שמרים שיטות שני היברידיות 3,4, ו ב מבחני חוץ גופייה, מוגבלות שהם לא ניתן להעריך את הפעילות של חלבונים במצב הטבעי שלהם. פרופיל חלבון מבוססי פעילות (ABPP) שניתן להשתמש בהם כדי למלא את הפער. לפי גישה זו, מולקולות קטנות בוחנות מסוגלות מחייב קוולנטית אל האתר הפעיל של אנזים אינטרסים מצומדות לקבוצת כתב המאפשרת איתור היעד. באמצעות כימיה לחץ (CC), הכתב ניתן לשלב את החללית או יכול להיות מוצג לאחר אירוסי היעד התרחשו 5,6. ההליך האחרון מחייב שימוש בדיקות המכילות קבוצות כימיות מתאימות, כגון אלקין או תזיד מסוף, אשר יכול להיות שונה עם מספר ריאגנטים כתב דרך תגובות ביו-מאונך such כמו Cu (I) -catalyzed Huisgen [3 + 2] cycloaddition 7-9 או Staudinger קשירת 10,11.
לאחרונה, אנו חשפנו את ARN14686 המתחם כמו ABP הראשון עבור במבחנת איתור vivo של hydrolase ציסטאין, 12 NAAA. NAAA מזרז את שחרור משרות והידרוליזה של FAES רווי בלתי רווי, כולל oleoylethanolamide (OEA) ו palmitoylethanolamide (PEA), שהן אגוניסטים אנדוגני של רצפטור גרעיני אנטי דלקתיות PPAR-alpha 13-15. NAAA מתבטא בעיקר מקרופאגים ותאי מונוציטים הנגזרות אחרים, כמו גם ב-לימפוציטים 14,16, דבר המצביע על תפקיד בוויסות התגובה החיסונית המולדת. האנזים הוא מסונתז reticulum endoplasmic המחוספס בצורה פעילה מופעל בתאים החומצית של התא על ידי מנגנון autoproteolytic 17. מחשוף autoproteolytic יוצר ציסטאין חדש N -terminal (C131 בעכברים וחולדות, C126 בבני אדם), כי הוא אחראי נוקלאופיל עבור FAE הידרוליזה 18,19. עיכוב תרופתי פעילות NAAA משנה את איזון FAE סינתזה / שפלה לטובת רמות תאיים מרובות יותר של 16,20,21 FAES. כמה נגזרים β-lactone ו β-לקטם הוכחו לעכב פעילות NAAA עם עוצמה גבוהה סלקטיביות 16,22-26. מעכבים אלה פועלים באמצעות S -acylation של ציסטאין קטליטי 16,27,28.
ARN14686 המתחם תוכנן בהתבסס על המבנה הכימי של פעיל מערכתית, נגזר-סרין β-לקטם NAAA מעכב, ARN726 (4-cyclohexylbutyl- N - [(S) -2-oxoazetidin-3-י.ל.] carbamate) 16. קבוצת 4-בוטיל-cyclohexyl של ARN726 הוחלפה שרשרת אליפטיות רווי C9 נושאות תג אלקין מסוף נטיית CC הבאה עם תג עיתונאי יזיד נושאות. בחרנו לעצב ABP שני שלבים כדי minimally לשנות את מבנה הפיגום המקורי, ובכך שמירה על הזיקה של החללית עבור NAAA. יתר על כן, הימנעות כניסתה של תגים מגושמים, בדיקה כזו יכולה להיות מתאימה יותר לטיפול in vivo מאשר ABP ישיר. ARN14686 מעכב NAAA עם עוצמה גבוהה (hNAAA IC 50 = ננומטר 6, rNAAA IC 50 = 13 ננומטר) על ידי יצירת adduct קוולנטיים עם ציסטאין הקטליטית של האנזים 12. ניסויים בחולדות חיים הראו כי החללית היא סלקטיבית לכידה NAAA לידי ביטוי ריאות. חומצה ceramidase, אחר ציסטאין amidase שחולקת זהות 33-34% עם NAAA, זוהה גם כמטרה בעלת זיקה נמוכה בעת שימוש בריכוזים גבוהים בדיקה (10 מיקרומטר במבחנה, 10 מ"ג / מ"ל תוך ורידי, iv) 12. יש לנו גם השתמשתי ARN14686 ללמוד בנוכחות NAAA הפעיל ברקמות עכברוש מודלקות לאחר נטילה של אדג'ובנט של שלמה פרוינד (CFA) 29.
כאן, אנו מתארים פרוטוקול עבור preparatiעל של ARN14686 (איור 1) ויישומה לחקירת ההפעלה NAAA vivo לשעבר. כדוגמה, אנו מתארים הליך הניסוי לדמיין NAAA בכפות עכברוש לאחר מתן CFA. בניסוי זה, חלבונים המחולצים רקמות כפה לאחר ההזרקה iv של החללית, ואת proteome שכותרתו ABP הוא נתון סמ"ק עם-אזיד ביוטין. דגימות Biotinylated מועשרות באמצעות חרוזי streptavidin, וכתמי חלבון מבוצעים. ביישום אחר, אנו מתארים את הלוקליזציה של NAAA הפעיל על ידי מיקרוסקופ פלואורסצנטי בתוך ריאות עכבר מעכברים שטופל חללית. במקרה זה, הרקמה מחולקת וחתכים חשופים CC עבור בנוסף rhodamine. ערכת עבודה מתוארת באיור 2.
Protocol
זהירות: כל תגובות הכימיה צריכות להתבצע במנדף מאוורר ועם השימוש חלוק מעבדה, כפפות, משקפי מגן. התגובות צריכות גם להתבצע בסביבת חנקן.
הצהרה אתית: הנהלים שלנו מעורבים בעלי חיים מבוצעות בהתאם לתקנות האיטלקית להגנה על בעלי החיים המשמשים למטרות מדעיות ניסיוניים אחרים (DM 116,192), ותקנות הקהילה האירופית הכלכלית (OJ של EC L 358/1 1986/12/18 ).
הערה: סינתזה של [(3 S) -2-oxoazetidin-3-י.ל.] אמוניום אצטט מתואר על תשואות בקנה מידה גדול (50 גרם של N -Cbz-L-סרין), אבל זה יכול להיות scaled למטה בקלות.
סינתזה 1.
הערה: ראה איור 1 עבור ערכת סינתזת התגובה.
- הכנת קרבונט 2-pyridyl Undec-10-ynyl ו Undec-10-ynyl 2-oxopyridine 1-carboxylate
- בבקבוק מסביב לתחתית 50 מ"ל, לפזר 350 מ"ג של undec-10-yn-1-ol ב 3.5 מ"ל של dichloromethane יבש.
- כדי הפתרון ב 1.1.1, להוסיף 25 מ"ג של 4-dimethylaminopyridine (DMAP) ו- 530 מ"ג של 2-dipyridylcarbonate (DPC). מערבבים את התערובת בטמפרטורת החדר (RT) במשך 16 שעות.
- הוסף 20 מ"ל של dichloromethane.
- מעבירים את התערובת לתוך משפך מפריד. הוסף 15 מ"ל מים, לנער אותו, ולאפשר לשני שלבים להפריד.
- פתח את השסתום, לאסוף את השלב האורגני (למטה), ולאחר מכן לסגור את הברז. הוסף 15 מ"ל של פתרון NaHCO 3 רווי. לנער את המשפך המפריד ולתת שני שלבים נפרדים. חזור על פעולה זו עוד פעמיים.
- ייבש את השכבה האורגנית עם Na 2 SO 4, לסנן דרך כותנה לתוך בקבוק מסביב לתחתית (ראשון הטרה), להתאדות עד יובש תחת לחץ מופחת (מאייד סיבובי).
- לשקול את הבקבוק ולקבל 600 מ"ג של שמן כי הוא תערובת של קרבונט 2-pyridyl undec-10-ynyl ו undec-10-ynyl 2-oxopyridine 1-carboxylate על יחס של 1.7: 1.
1 H NMR (400 מגה-הרץ, DMSO- ד 6) מרכיב מרכזי δ = 8.39 (dd, J = 5.0, 2.0, 1H), 7.98 (TD, J = 7.9, 2.0, 1H), 7.40 (DDD, J = 7.2, 4.9, 0.9, 1H), 7.30 (ד, J = 8.2, 1H), 4.22 (t, J = 6.6, 2H), 2.73 (t, J = 2.4, 1H), 2.18 - 2.11 (מ ', 2H), 1.76 - 1.62 (מ ', 2H), 1.50 - 1.23 (מ', 12H).
1 H NMR (400 מגה-הרץ, DMSO- ד 6) מרכיב קטן δ = 7.74 (dd, J = 7.2, 1.9, 1H), 7.47 (dd, J = 6.7, 2.3, 1H), 6.44 (ד, J = 9.4, 1H), 6.30 - 6.25 (מ ', 1H), 4.35 (t, J = 6.5, 2H), 2.72 (t, J = 2.4, 1H), 2.18 - 2.11 (מ', 2H), 1.77 - 1.60 (מ ', 2H ), 1.52 - 1.20 (מ ', 12H). - השתמש השמן ללא כל פרדה או לטיהור נוספת.
- הכנת [(3 S) -2-oxoazetidin-3-י.ל.] אמוניום אצטט
- הכנת בנזיל N - [(S) -1- (hydroxymethyl) -2 - [(4-methoxyphenyl) אמינו] -2-oxoethי.ל.] carbamate.
- בבקבוק 4-L מסביב לתחתית, לפזר 141.5 גרם של -anisidine p ב 1.5 ליטר של tetrahydrofuran ו -0.5 ליטר של dichloromethane.
- מצננים את הפתרון 0 מעלות צלזיוס באמבט קרח.
- הוסף 50.0 גרם של N -Cbz-L-סרין ו 43.9 גרם של N - (3-dimethylaminopropyl) - הידרוכלוריד -ethylcarbodiimide N '.
- מערבבים את התערובת עם פס מגנטי ב 0 מעלות צלזיוס למשך 30 דקות.
- הסר את הפתרון מהאמבטיה הקרח ומערבבים עם פס מגנטי ב RT במשך 16 שעות.
- לאדות את הממסים בלחץ מופחת (מאייד סיבובי).
- להוסיף 400 מ"ל של 1: 1 cyclohexane / אתיל אצטט, מערבבים עם מרית, למזוג.
- חזור על שלב 1.2.1.7 פעמים נוספות.
- ממיסים את שאריות דביק ב 500 מ"ל של אתיל אצטט ולשטוף עם 400 מ"ל של 0.1 פתרון M HCl (10 פעמים), עם 400 מ"ל של תמיסת NaHCO 3 רווי (2 פעמים), ועם 400 מ"ל של מי מלח.
- ייבש את השכבה האורגנית עם2 Na SO 4, לסנן את הפתרון דרך כותנה לתוך בקבוק מסביב לתחתית (ראשון טרה), להתאדות זה ליובש בלחץ מופחת (מאייד סיבובי).
- לשקול את הבקבוק ולקבל 61.4 גרם של מוצק לבן.
1 H NMR (400 מגה-הרץ, DMSO- ד 6) δ = 9.86 (BS, 1H), 7.52 (ד, 2H, J = 9.0 הרץ), 7.42-7.25 (מ ', 6 שעות), 6.91-6.85 (מ', 2H) , 5.06 (ד, 1H, J = 12.9 Hz), 5.02 (ד, 1H, J = 12.9 Hz), 4.98 (t, 1H, J = 5.6 הרץ), 4.24-4.15 (מ ', 1H), 3.72 (ים, 3H), 3.70-3.57 (מ ', 2H).
- הכנת בנזיל N - [(S) -1- (4-methoxyphenyl) -2-אוקסו-azetidin-3-י.ל.] carbamate.
- ממיסים 58.6 גרם של N - [(S) -1- (hydroxymethyl) -2 - [(4-methoxyphenyl) אמינו] -2-אוקסו-אתיל] carbamate ב 1.6 ליטר של N, N -dimethylformamide.
- מצננים את הפתרון 0 ° C עם באמבט קרח.
- הוסף 50.6 גרם של 1,1'-sulfonyldiimidazole ומערבבים עם פס מגנטי למשך 30 דקות.
- מצננים את הפתרוןל -20 מעלות צלזיוס עם אמבט קרח / NaCl ולהוסיף 10.2 גרם של הידריד נתרן (60% שמן מינרלים) חלק חכם.
- מערבבים את התערובת ב -20 ° C למשך שעה 1, ולאחר מכן להרוות עם 2 מ"ל של מתנול 1 ליטר של מים.
- אבק לסנן את המשקע, לשטוף עם 200 מ"ל מים, ויבש תחת ואקום.
- השג 42.2 גרם של מוצק לבן.
1 H NMR (400 מגה-הרץ, DMSO- ד 6) δ = 8.08 (ד, 1H, J = 8.5 הרץ), 7.42-7.28 (מ ', 5H), 7.30 (ד, 2H, J = 8.9 הרץ), 6.95 (ד , 2H, J = 8.9 הרץ), 5.06 (ים, 2H), 4.86 (DDD, 1H, J = 8.5, 5.6, 2.6 הרץ), 3.90 (t, 1H, J = 5.6 הרץ), 3.73 (ים, 3H) , 3.55 (dd, 1H, J = 5.6, 2.6 הרץ).
- הכנת בנזיל N - [(S) -2-oxoazetidin-3-י.ל.] carbamate.
- להשעות 9.0 גרם של בנזיל N - [(S) -1- (4-methoxyphenyl) -2-oxoazetidin-3-י.ל.] carbamate ב 500 מ"ל של אצטוניטריל ו -400 מ"ל מים.
- מצננים את הפתרון 0 מעלות צלזיוס באמבט קרח.
- הוסף 45.4 גרם של קריחלק מבחינת אמוניום חנקתי ג מעל 45 דקות ומערבבים עם פס מגנטי ב 0 מעלות צלזיוס במשך 15 דקות.
- הוסף 500 מ"ל של תמיסת NaHCO 3 רווי בזהירות, ולאחר מכן להוסיף 500 מ"ל של אתיל אצטט.
- סנן את המשקע ולשטוף עם 200 מ"ל של אתיל אצטט.
- הפרד את הפתרון biphasic ולשטוף את השכבה המימית עם 200 מ"ל של אתיל אצטט (3 פעמים).
- ייבש את השכבה האורגנית עם Na 2 SO 4, להוסיף 5 גרם של פחם פעיל, מסנן באמצעות כרית של סיליקה diatomaceous, להתאדות עד יובש תחת לחץ מופחת (מאייד סיבובי).
- הוספת אתר diethyl ומערבבים במרית.
- סנן את המוצק להשיג 4.85 גרם של מוצק אוף-וויט.
1 H NMR (400 מגה-הרץ, DMSO- ד 6) δ = 7.97 (ד, 1H, J = 8.7 הרץ), 7.94 (BS, 1H), 7.42- 7.30 (מ ', 5H), 5.05 (ים, 2H), 4.67 (DDD, 1H, J = 8.7, 5.4, 2.7 הרץ), 3.40 (t, 1H, J = 5.4 הרץ,), 3.09 (dd, 1H, J = 5.4, 2.7 הרץ).
- הכנת [(S) -2-oxoazetidin-3-י.ל.] -ammonium אצטט.
- ממיסים 0.93 מ"ל של חומצה אצטית ב 245 מ"ל של אתיל אצטט. סמן כדואר "השמנת פתרון."
- ממיסים 3.28 גרם של benzyl- N - [(R) -2-oxoazetidin-3-י.ל.] carbamate ב 298 מ"ל של אתנול.
- הוסף 14.1 מ"ל של cyclohexadiene ו 3.27 גרם של פלדיום 10% על פחמן.
- מערבבים את ההשעיה על RT במשך 12 שעות, ולאחר מכן עובר דרך המסננת של כרית קצר של כדור הארץ diatomaceous. יוצקים את הנוזל משחררי ישירות לתוך התמיסה השמנה.
- להתאדות הממס בלחץ מופחת (מאייד סיבובי), שמירה על הטמפרטורה מתחת ל -35 מעלות צלזיוס.
- Triturate מוצק שהושג עם tetrahydrofuran ולקבל 1.72 גרם של מוצק לבן.
1 H NMR (400 מגה-הרץ, DMSO- ד 6) δ = 7.68 (BS, 1H), 3.99 (DDD, 1H, J = 5.2, 2.4, 1.2 הרץ), 3.32 (t, 1H, J = 5.2 הרץ), 2.79 (dd, 1H, J = 5.2, 2.4 הרץ), 1.90 (ים, 3H).
- הכנת בנזיל N - [(S) -1- (hydroxymethyl) -2 - [(4-methoxyphenyl) אמינו] -2-oxoethי.ל.] carbamate.
- הכנת Undec-10-ynyl- N - [(3 S) -2-oxoazetidin-3-י.ל.] carbamate
- בבקבוק מסביב לתחתית 10 מ"ל, לפזר 60 מ"ג [(3 S) -2-oxoazetidin-3-י.ל.] אמוניום אצטט ב 2 מ"ל של dichloromethane יבש.
- מצננים את הפתרון 0 מעלות צלזיוס באמבט קרח ולהוסיף 81 μl של N, ירידה מבחינת -diisopropylethylamine N.
- ממיסים 350 מ"ג של תערובת גולמי המכיל undec-10-ynyl 2-oxopyridine 1-carboxylate ב 2 מ"ל של dichloromethane יבש, להוסיף אותו הפתרון, ומערבבים ב RT במשך 15 שעות. להתאדות הממס ליובש בלחץ מופחת (מאייד סיבובי).
- לטהר ידי כרומטוגרפיה בעמודה (ג'ל סיליקה) באמצעות מנגנון כרומטוגרפיה בעמודה אוטומטי:
- ספוג את המדגם על ג'ל סיליקה, לאזן את העמודה עם cyclohexane, ו לטעון את המדגם לתוך המחסנית.
- Elute עם אצטט cyclohexane / אתיל מ 100: 0 עד 0: 100 ולאסוף פסגות על מבחנות.
- להתאדות הממס של השברים המתאימים למתחם ליובש בלחץ מופחת (מאייד סיבובי) ולקבל 40 מ"ג של מוצק לבן.
2. הכנת ריאגנטים CC
- הכנת 5 מ"מ Stock פתרון של מולקולות Tag-אזיד
- ממיסים 1.5 מ"ג של אזיד-PEG3-פלואוריד 545 ב 0.5 מ"ל של sulfoxide דימתיל (DMSO). הפוך aliquots ב 0.5 מ"ל צינורות microcentrifuge וחנות ב -20 ° C.
- ממיסים 1.1 מ"ג של אזיד-PEG3-ביוטין 0.5 מ"ל של DMSO. הפוך aliquots ב 0.5 מ"ל צינורות microcentrifuge וחנות ב -20 ° C.
- הכנת פתרון במלאי 50 מ"מ של טריס (2-carboxyethyl) phosphine (TCEP)
- ממיסים 14.3 מ"ג של TCEP ב 1 מ"ל של מים, ולהפוך אותו טרי בכל פעם.
- הכנת 50 מ"מ פתרון של CuSO 4 · 5H 2 O
- בקבוקון זכוכית, לפזר 12.48 מ"ג של CuSO 4 · 5H 2 O ב 1 מ"ל מים. חנות ב RT במשך עד חודש.
- הכנת 83.5 מ"מ Stock פתרון של טריס [(1-בנזיל-1H-1,2,3-triazol-4-י.ל.) מתיל] אמין (TBTA)
- בקבוקון זכוכית, לפזר 8.85 מ"ג של TBTA ב 200 μl של DMSO. חנות ב RT במשך עד חודש.
- הכנת 1.7 מ"מ עבודה פתרון של TBTA (מיד לפני השימוש)
- הוסף 20 μl של 83.5 מ"מ TBTA בקבוקון זכוכית לדלל עם 180 מ"ל של DMSO.
- להוסיף 800 μl של טרט -Butanol מערבולת.
3. ניתוח ביטוי NAAA רקמות Paw של חולדות שטופלו CFA
הערה: השתמש זכר Sprague-Dawley חולדות, במשקל 175-200 גרם, ולבצע את כל הנהלים בהתאם להנחיות לשימוש מוסרי לחיות. חולדות בית בכלובים מאווררים על אור 12-hr / חושך מחזור ולתת להם גישה חופשית למזון ומים. בשביל הפרוטוקול של CFטיפול, עיין במאמר שפרסם Bonezzi et al. 29 חיות השתמש 7 ימים לאחר מתן CFA.
- עירוי לוריד של ARN14686
- ממיסים ARN14686 ברכב (PEG 15% ו -15% פתרון Tween מלוחים). חשב את הריכוז פתרון על פי משקל חולדה (במינון 3 מ"ג / ק"ג, נפח הזרקה 5 מ"ל / ק"ג).
- המשך עם iv זריקות בשלוש נאיבי שלושה עכברושים שטופלו CFA. מניח כל עכברוש מכשיר איפוק פלסטיק מתאים. ואז, במקום זנב-עכברוש במים חמים במשך 2-4 דקות, כדי לאפשר התרחבות, ולהזריק את iv המתחם דרך וריד הזנב.
- להזריק שלושה עכברושים (נאיבי CFA שטופלה) iv עם רכב בלבד.
- Paw איסוף Dissection
- להקריב את החולדות על ידי hr משאיפת 4 2 CO לאחר מתן בדיקה או רכב ולאסוף כפותיהם ידי חיתוכם 0.5 ס"מ מעל מפרק הברך באמצעות אזמל.
- מוציא בזהירות את העור על ידי לנתיחה בסיוע מספרית לנתח את רקמות רכות על ידי גירוד אותם מן העצם. מחק את העצמות לאסוף את הרקמות הרכות של הכפות. דגימות להקפיא צמד בחנקן נוזל חנות ב -80 ° C.
- הכנת חלבון Paw המגון ו ליזוזומלית
הערה: הימנע משימוש בחומרי ניקוי או מאגר המכיל אמין, כפי שהם יכולים לעכב את תגובת CC.- שלב רקמות כפה מן 3 חולדות (שהושגו כמפורט בסעיף 3.2.1) ו homogenize אותם סוכרוז 4 מ"ל של 320 מ"מ ב פוספט שנאגרו מלוחים (PBS, pH 7.4) ו קוקטייל מעכבי פרוטאז (ראו טבלה חומר / מגיב); להשתמש באמצעי פיזור בעל ביצועים גבוהים (ראה טבלת חומר / מגיב).
- צנטריפוגה homogenate רקמות במשך 20 דקות XG ב 1000 ב 4 מעלות צלזיוס; להציל את supernatant.
- הוסף 2 מ"ל של סוכרוז 320 מ"מ ב- PBS ואת מעכבי פרוטאז קוקטייל על גלולה רקמותhomogenize פעם נוספת.
- צנטריפוגה במשך 20 דקות ב 1000 XG ב 4 ° C, ולהוסיף את supernatant אל אחד משלב 3.3.2.
- צנטריפוגה supernatants שנאספו במשך 30 דקות ב XG 12,000 ב 4 ° C..
- לשקול גלולה ו resuspend בשני כרכים של PBS (כלומר, 200 μl לכל 100 מ"ג של גלולה). מעבירים צינור 1.5 מ"ל אוסף ולהקפיא ב -80 מעלות צלזיוס במשך שעה 1.
- הפשרת הדגימות ולהקפיא שוב במשך שעה 1 ב -80 מעלות צלזיוס.
- חזור על מחזור ההקפאה / הפשרה עוד פעמיים.
הערה: צעד זה נועד solubilize החלבון. להקפיא לילה במידת הצורך. - צנטריפוגה במשך שעה 1 ב 100,000 XG ב 4 מעלות צלזיוס. אסוף את supernatant, אשר מכיל חלבונים ליזוזומלית מסיסים, וזורקים את הכדור. חנות ב -80 ° C או מיד להמשיך עם כימות חלבון.
- לכמת את תכולת החלבון באמצעות assay חלבון BCA 30 ערכה מסחרית (ראה חומר / לוח מגיב ), בעקבות הוראות היצרן.
- אחסן את דגימות ב -80 ° C עד השימוש.
- CC עם אזיד-PEG3-ביוטין
הערה: הפרוטוקול של CC והעשרת חרוז streptavidin (שלבי 3.4-3.6) הם שונים מעט מן הפרוטוקול בהוצאת Speers ו Cravatt 31.- הכן 500 μl (1 מ"ג / מ"ל, ב PBS) של חלבונים ליזוזומלית חולדות probe- ורכב שטופלו (נאיבי וחולדות שטופלו CFA).
- דגימות הפרקליר עם 40 μl של slurry 50% agarose streptavidin (לשטוף שלוש פעמים עם 1 מ"ל של PBS לפני השימוש) במשך שעה 1 ב 4 ° C. צנטריפוגות במשך 4 דקות XG ב 1000 ב 4 ° C ולקחת את supernatant.
- להוסיף 11.3 μl של המניה 5 מ"מ של אזיד-PEG3-ביוטין ו מערבולת.
- להוסיף 11.3 μl של המניה 50 מ"מ של המוכן טרי TCEP מערבולת.
- Premix 34 μl של פתרון עובד מוכן טרי של 1.7 מ"מ TBTA עם 11.3 μl של 50 מ"מ CuSO 4 · 5H 2 O המניות.
- הוסף 45.3 מ"ל של 4 premixed TBTA / CuSO · 5H 2 O פתרון מערבולת.
- דגירה התגובה על 25 מעלות צלזיוס למשך 2 שעות (זמן הדגירה כבר אינו משפיע על התגובה). שים ממטרי חלבון בשלב זה. מערבבים לאחר השעה הראשונה של דגירה.
- הסרת ריאגנטים CC העודפים
- צנטריפוגה דגימות במשך 4 דקות ב 6,500 XG ב 4 ° C ולהסיר את supernatant.
- הוסף 750 μl של מתנול קר resuspend ידי sonication (5 שניות עם sonicator בדיקה).
- צנטריפוגה דגימות במשך 4 דקות ב 6,500 XG ב 4 ° C ולהסיר את supernatant באמצעות מזרק ומחט.
- חזור על שלב 3.5.2 פעמיים (sonication אינה נדרשת).
- לאחר לשטוף האחרון, להוסיף 325 μl של סולפט dodecyl נתרן (SDS) 2.5% ב PBS על 3x חלבון גלולה sonicate במשך 5 שניות.
- מחממים את הדגימות במשך 5 דקות ב 65 מעלות צלזיוס ו sonicateלְהַשִׂיג.
- צנטריפוגות במשך 5 דקות ב 6,500 XG ב RT ולשמור את supernatant.
- להוסיף 1.4 מ"ל של PBS על מנת לדלל את ריכוז SDS 0.5%. חנות ב -20 ° C או להמשיך עם העשרת streptavidin.
- עשרה streptavidin
- עם PBS, ולהביא את הנפח של הדגימות שהתקבלו בשלב 3.5.8 ל -4.2 מיליליטר. הוסף 40 μl של slurry 50% agarose streptavidin באמצעות קצה לחתוך-סוף (לשטוף שלוש פעמים עם 1 מ"ל של PBS לפני השימוש).
- דגירה עבור שעה 2 ב RT עם סיבוב ואז צנטריפוגות במשך 2 דקות ב g x 1,400.
- הסר את supernatant מבלי לייבש את החרוזים גלולים ולהשתמש supernatant שיורית להעביר את החרוזים על 1 מיליליטר ספין עמודה (ראה טבלת חומר / מגיב).
- לשטוף על ידי כוח הכבידה עם 3x 1 מ"ל של 1% SDS (PBS), 3x 1 מ"ל של 6 M אוריאה (PBS), ו 4x 1 מ"ל של PBS.
- השתמש 2x 500 μl של PBS להעביר את החרוזים כדי צינור 1.5 מ"ל ו צנטריפוגות במשך 2 דקות ב 1400 XG ב RT. בעדינות לשאוב supernatant עם מזרק ומחט.
- Elute החלבונים הנכנס שרף על ידי הוספת 25 μl של חיץ elution (6 אוריאה M, 2 M thiourea, 2% SDS, ו ביוטין 6 מ"מ, כל PBS) במשך 15 דקות ב RT ואחריו 15 דקות ב 95 מעלות צלזיוס 32.
- כתם חלבון
- הוסף 5 μl של חיץ 6x Laemmli (עבור 9 מ"ל: 0.5 מ"ל של 1 M טריס- HCl pH 6.8, 5 מ"ל של 20% SDS, 5 מ"ג bromophenol כחול, 3 מ"ל גליצרול, ו- H 2 O עד 9 מ"ל) ולהוסיף 5% β-mercaptoethanol מיד לפני השימוש. בקצרה בצנטריפוגה דגימות XG ב 2000 עד גלולה שרף עומס 25 μl של supernatant המתקבל לג'ל polyacrylamide 4-12%.
- בצע ג'ל אלקטרופורזה והעביר חלבון על קרום סופג פי הוראות היצרן 33.
- להרוות את הקרום הסופג עבור שעה 1 עם 10 מיליליטר של חיץ חסימה (ראה טבלת חומר / מגיב) המכיל 0.1% Tween-20.הימנע משימוש חלב, כפי שהוא יכול להגדיל את הרקע.
- לשטוף את הממברנה עם 10 מ"ל של 0.05% Tween-20 ב PBS ולהוסיף 10 μl של streptavidin ניאון (ראה חומר / מגיב טבלה) מומס ב 10 מ"ל של חיץ חסימת בתוספת 0.1% Tween-20 עבור שעה 1 ב RT.
- לשטוף 4 פעמים עם 0.05% Tween-20 ב PBS ופעם עם PBS לבד (10 דקות כל אחד).
- השתמש סורק תמונה (ראה חומר / מגיב טבלה). הפעל את המכשיר ואת המחשב המחובר. מתן עד מוכן.
- הפעל את תכנית הרכישה ובחרת במצב הקרינה. בחר באזור הקרום ולבחור את תיקיית היעד עבור קבצים שמורים.
- הגדר את הפרמטרים רכישת הבאים: 680 אורך עירור ננומטר, מסנן BPFR700, 1,000 V צינור מכפיל (PMT) ערך (ערוץ 2), ו -25 מיקרומטר גודל פיקסל. רוכש את התמונה.
4. לוקליזציה של קטליטית Active NAAA עכבר הריאות על ידי הקרינה במיקרועותק
הערה: זכר השתמש 8 עד 10 שבועות בן עכברים ולבצע את כל הנהלים בהתאם להנחיות לשימוש מוסרי לחיות. עכברי בית בכלובים מאווררים על מחזור 12 שעות אור / חושך ולתת להם גישה חופשית למזון ומים.
- עירוי לוריד של ARN14686 עכברים
- ממיסים ARN14686 ברכב: 15% PEG ו -15% תמיסת מלח Tween-20. חשב את הריכוז פתרון על פי משקל העכבר (במינון 3 מ"ג / ק"ג, נפח הזרקה 5 מ"ל / ק"ג).
- המשך עם זריקת iv של 3 עכברים. מניח כל עכבר בהתקן ריסון פלסטיק מתאים. ואז, במקום זנב עכבר במים חמים במשך 2-4 דקות, כדי לאפשר התרחבות ולהזריק את iv המתחם דרך וריד הזנב.
- להזריק 3 iv עכברים עם רכב בלבד.
- אוסף ריאות והכנת פרוסה
אזהרה: טפל paraformaldehyde בזהירות במנדף, וללבוש כפפות!- להרדים עכברים עם Chloמימה RAL (400 מ"ג / ק"ג). אשר הרדמה עם קמצוץ הבוהן. בצע זלוף transcardial כדלקמן:
- באופן שטחי לחתוך את העור הגחון במספריים ולחשוף את משטחי קרום החזה ואת הצפק.
- באופן שטחי לחתוך את הקרום הצפק עם מספריים, ממש מתחת תהליך xyphoid, ולחשוף את הסרעפת ואיברים קרביים. היזהר שלא לקרוע כל כלי דם משמעותיים.
- פתח את חלל בית החזה על ידי חיתוך הסרעפת מהיבט לרוחב אחת לשנייה.
- הכנס את המחט 25 G מחובר משאבת מזרק אוטומטי להשרות 20 מ"ל של תמיסת מלח 0.9% ואחריו 60 מ"ל של 4% PFA חיץ פוספט (0.1 מ ', pH 7.4).
- לאחר זלוף יושלם, למשוך את הלב באמצעות מלקחיים ובזהירות לנתח את זה. אחוז קנה הנשימה עם מלקחיים ולחתוך לחלוטין דרך אותו במספריים. בעדינות מושך כלפי מעלה קנה הנשימה ולהסיר את הריאות מן כלוב הצלעות. לנתח את הרקמהלהפריד את הריאה הימנית משמאל.
- Postfix רקמות% paraformaldehyde 4 עבור שעה 1, דגימות הקפאת 2-methylbutane קר, ולאחסן אותם ב -80 ° C.
- אסוף 40 מיקרומטר חלקים באמצעות cryostat, לעגן אותן מיד בשקופיות (אחד ולכל חמישי), ולעבד אותם אימונוהיסטוכימיה כמפורט להלן.
- להרדים עכברים עם Chloמימה RAL (400 מ"ג / ק"ג). אשר הרדמה עם קמצוץ הבוהן. בצע זלוף transcardial כדלקמן:
- רקמות פרוסות Permeabilization וחסימה
- לשטוף עם PBS (2x למשך 5 דקות) ו permeabilize עם 0.1% Triton X-100 PBS במשך 15 דקות ב RT.
- לשטוף עם PBS (2x למשך 5 דקות) ולחסום עם אלבומין 3% שור (BSA) ב- PBS במשך 30 דקות ב RT.
- לשטוף עם PBS (2x למשך 5 דקות) ולהמשיך עם CC.
- CC עם אזיד-PEG3-פלואוריד 545 על בחתכי רקמה
- הכן פתרון על ידי ערבוב חומרים כימיים CC מוכן כמתואר בסעיף 2. 1 מ"ל פתרון, להוסיף: 2 μl של אזיד-PEG3-פלואוריד 545 (5 המניות מ"מ), 20 μl של TCEP (מוכן טרי 50 מ"מ stocיא), 58.8 μl של TBTA (מוכן טרי 1.7 הפתרון עובד מ"מ), 20 μl של CuSO 4 · 5H 2 O (המניה 50 מ"מ), ו -900 μl של PBS.
- להוסיף כ -400 μl של תמהיל CC אל בחתכי רקמה, אשר הוכנו על פי סעיף 4.2. שים לב כי ההיקף הנבחר של תמהיל CC מספיק לכסות את הפרוסות. דגירה במשך שעה 1 ב RT מוגן מפני אור.
- לשטוף עם PBS (1x במשך 5 דקות), מתנול קר (1x במשך 5 דקות), פתרון של 1% Tween-20 ו- 0.5 mM EDTA ב PBS (3x 2 דקות), ו- PBS (1x במשך 5 דקות).
- האוויר יבש, להוסיף טיפה של antifade mountant עם DAPI (ראה חומר / לוח מגיב), הדוק עם מכסה מחליק (הימנעות היווצרות בועה), ואת החותם עם לק. חנות ב 4 ° C עד הניתוח.
- רכישת תמונה
- שימוש במיקרוסקופ confocal מצויד 546 ננומטר ו -450 לייזרי עירור ננומטר (ראה חומר / לוח מגיב) הבאבמדריך למשתמש.
- בחר עדשה 60X אובייקטיבית עם NA = 1.40, והקפד לצפות בתצוגה מקדימה של וחלק הדרך העיני ולהתמקד על שטח של עניין.
- קבע את הפרמטרים הרכישה לפי תכונות מדגם וציוד.
תוצאות
ARN14686 תוכנן בהתבסס על הפיגום של ARN726 מעכב NAAA. קבוצת 4-בוטיל-cyclohexyl של ARN726 הוחלפה עם שרשרת אליפטיות רווי C9 נושאות תג אלקין מסוף (איור 1). תג אלקין הוצג על מנת לאפשר את השימוש של הליך תיוג שני שלבים להוסיף fluorophore או מולקולה ביוטין באמצעות CC. תכונה זו מבצעת רינדור ARN14686 כלי תכליתי מאוד לחקור NAAA במבחנה in vivo.
כאן, אנו מציגים שתי בקשות של ARN14686, אשר מייצגות את הפוטנציאל של המולקולה הזו. איור 2 היא ערכה של הליך הניסוי דיווח כאן. לאחר מתן iv של החללית, שתי שיטות זיהוי שונות יכולות לשמש: i) ניתוח של ביטוי NAAA הפעיל על ידי כתם חלבון ו- II) ניתוח של ביטוי NAAA הפעיל ולוקליזציה בתוך תאים על ידי fluorescencמיקרוסקופיה דואר.
תוצאת הנציג הראשונה פורסמה לאחרונה על ידי הקבוצה שלנו 29. ניתחנו ביטוי NAAA במודל עכברים של דלקת כפה הנגרמת CFA. החללית (3 מ"ג / ק"ג) או הרכב הוזרק iv בחולדות נאיבית CFA שטופלו. החולדות הוקרבו 4 שעות מאוחר יותר. CC בוצע על תמציות ליזוזומלית מועשרות להציג תג ביוטין על החלבונים שכותרתו בדיקה. חלבוני Biotinylated היו הבאים מועשרים באמצעות חרוזי streptavidin. החלבונים eluted נותחו על ידי כתם חלבון, מראה כי רמות של פעיל NAAA הוגדלו במידה ניכרת הכפות של חולדות שטופלו ביחס CFA לאלו של חולדות הביקורת (איור 3). היתרון של ניתוח חלבון כתם הוא בכך שהוא מאפשר בחינה מדוקדקת של proteome תגובתי-החללית, אשר מופרד על ידי ג'ל אלקטרופורזה. גישה זו מאפשרת גם הסרת הלוט מעל מחוץ מטרות בדיקה פוטנציאליות. פקד ללא בדיקה חייב להיות אלדרכים כלולות כדי לכלול חלבוני biotinylated אנדוגני, המהווים את הרקע הניסיוני. ראש החץ באיור 3 מציין חלבוני רקע כזה, אשר בתורו יכול לשמש כביקורת התייחסות טעינה.
בניסוי לא פורסם השני (איור 4), השתמשנו ARN14686 לחקור NAAA לגילוי לשעבר vivo על ידי מיקרוסקופ פלואורסצנטי. אנחנו מנוהל ARN14686 לעכברים ב 3 מ"ג / ק"ג (iv) והקריב אותם 2 שעות לאחר הטיפול על ידי זלוף transcardial. ריאות נאספו, postfixed, וקפוא 2-metylbutane הקר. תגובת CC עבור בנוסף fluorophore בוצעה ישירות על בחתכי רקמה של 40 מיקרומטר עובי, שנאספו עם cryostat. ניתוח על ידי מיקרוסקופ פלואורסצנטי הראו נוכחות של NAAA פעיל קטליטית במבנים שלפוחי מתפזרת השייכים מקרופאגים מכתשיים. לעומת השימוש של נוגדן לחלבון ספציפי, רק אאנזים ctive הוא ציין.
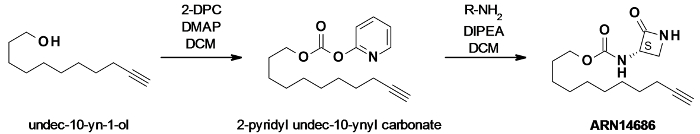
איור 1:. ערכת תגובת סינתזת ARN14686 Undec-10-yn-2-ol הופעלה על ידי dipyridylcarbonate (DPC) בנוכחות של 4-dimethylaminopyridine (DMAP) קטליטי לייצר קרבונט מעורב. קרבונט זה היה אז מגיב עם לקטם אמינו להשיג מולקולת היעד ARN14686. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
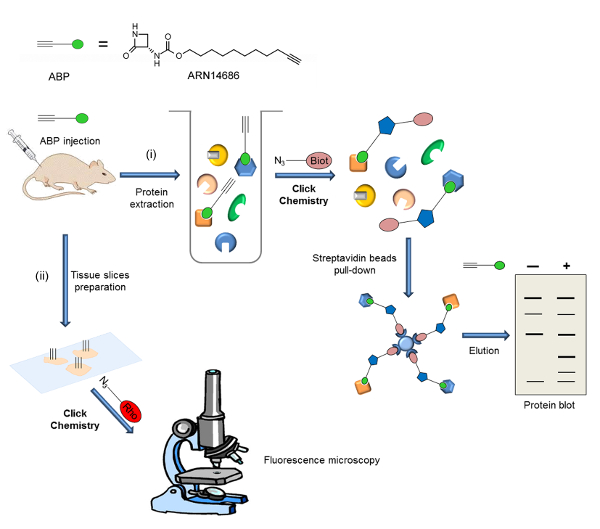
איור 2:. ערכת Workflow של האסטרטגיה הכללית מוצגת בעבודה הנוכחית החללית מוזרק לתוך חיים (חולדות או עכברים), ולמקד ביטוי מנותח בעקבות שני הליך ניסוי שונהים: ט) proteome שכותרתו מופק ו ביוטין הוא הוסיף ידי CC. לאחר שלב העשרת חלבוני biotinylated על חרוזי streptavidin, מטרות בדיקה מנותחות על ידי כתם חלבון. ii) פרוסות רקמות ערוכים ו fluorophore מתווסף ידי CC. לוקליזציה יעד Probe מנותחת על ידי מיקרוסקופ בתפרחת. נתון זה הותאם מ Bonezzi et al. 29 אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
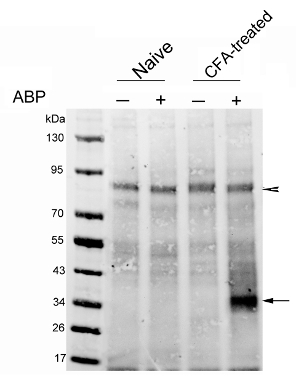
איור 3:. ניתוח של הפעלת NAAA בכפותיו של חולדות שטופלו CFA ניתוח כתם חלבון חלבונים מועשר streptavidin חולדות נאיבי (מסלולים 1 ו -2) או חולדות-מוזרק CFA 7 ימים לאחר ההזרקה (נתיבי 3 ו -4). החולדות קיבלו iv זריקות של הרכב או ARN14686 (3 מ"ג / ק"ג). הקרום הסופגעבר מבחנים עם streptavidin ניאון. החץ מציין להקת NAAA; ראש החץ מצביע על להקה המכיל ביוטין של כ -90 kDa, מראה כי כמות דומה של חלבון נטענת בנתיב אחד. נתון זה יש הבדל בין Bonezzi et al. 29 אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 4: זיהוי גופיים של שכותרתו הבדיקה NAAA ריאות עכבר על ידי מיקרוסקופ פלואורסצנטי תמונות נציגי סעיפי ריאות של הרכב שהיה מעורב (א) או מוזרק ARN14686 (B) עכברים לאחר CC עם תזיד-PEG3-פלואוריד 545 מדווחים.. איתות חיובית (תאים אדומים) זוהתה בעכברים מוזרקים ARN14686, בעוד אין אות זוהתה נעכברים-מנוהל ehicle. פרט של מקרופאג המכתשית החיובי 545 יזיד-PEG3-פלואוריד מוצג ב- C בהגדלה גבוהה יותר. גרעינים סומנו DAPI (כחול). סרגל קנה מידה = 50 מיקרומטר A ו- 10 מיקרומטר ב C. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
פעילות האנזים מוסדר דק ברמות שונות, כולל שעתוק RNA, סינתזת החלבון, טרנסלוקציה חלבון, שינוי שלאחר translational, ואינטראקציה בין חלבונים. לעתים קרובות, ביטוי האנזים אינו לבד חשבון עבור פעילותה. ABPP פותח כדי לחקור את פעילותם של חלבונים במצב הטבעי שלהם. שתי תכונות נדרשות: בדיקה כימית שקושרה קוולנטית אל האתר הפעיל של אנזים עניין ותג כתב כדי לזהות את האנזים שכותרתו בדיקה.
עיצוב וסינתזה Probe הם נקודות קריטיות של ההליך. החללית חייבת להיות זיקת סלקטיביות הולם היעד שלה. יתר על כן, הנוכחות של תג עיתונאי אסור להשפיע למקד אירוסין. בעיה זו היא להתגבר במידה רבה על ידי העיצוב של ABP שני שלבים, שבו תג הכתב הוא הציג לאחר היעד נתפס. תג ללא בדיקות מתאימות במיוחד מחקרי in vivo, בם מתקיימים פעילות חלבוןניתן להעריכם תא או אורגניזם חי, עם שינוי חיצוני מינימלי. ARN14686 החללית NAAA נועד למלא את הדרישות המפורטות לעיל. Β-לקטם תגובתי ראש נפץ נבחר על סמך תוצאות קודמות שהושגו עם הכיתה β-לקטם של מעכבי NAAA 16,26. תרכובות אלו מעכבות NAAA באופן ובררן באמצעות קשירת קוולנטית אל ציסטאין הקטליטית של האנזים. יתר על כן, התרכובות הוצגו להיות פעיל באופן מערכתי 16. הצגנו שרשרת אליפטיות רווי C9, תוך לקיחה בחשבון את הזיקה המוגברת NAAA לרשתות אליפטיות ארוכות. אלקין מסוף נוסף כדי לאפשר תיוג בן שני שלבים.
שלב קריטי נוסף הוא בחירת המינון ועבר זמנה של ממשל in vivo. זה תלוי ביציבות של החללית בפלזמה, זיקת היעד שלה, סלקטיביות שלה. המינון הנכון יש לבחור כדי לאפשר לכידת היעד תוך הימנעות אירוסין של פומחוץ מטרות ssible. מצאנו כי 3 מ"ג / ק"ג iv ARN14686 היה אופטימלי ללכוד NAAA סלקטיבי. מינונים גבוהים יותר הביאו ללכידתו של amidase ציסטאין ההומולוגי, ceramidase חומצה. לגבי משך הטיפול, כאשר מנתחים איברים perfused היטב, כמו הריאות, זמן קצר (שעה 2) עשוי להיות מספיק כדי לאפשר בדיקה להגיב עם המטרה. עבור כפות, לעומת זאת, נאלצנו להכפיל את זמן התגובה.
להנפקה אפשרית בניתוח היעד על ידי כתם חלבון הוא בשל נוכחותם של חלבונים biotinylated באופן טבעי. אלה בהכרח יזוהו יחד עם מטרות בדיקה ספציפיות. מצאנו כי החדרת צעד preclearing עם חרוזים streptavidin לפני ביצוע CC בצורה ניכרת את איכות התוצאות שלנו. מצד השני, הנוכחות של חלבוני biotinylated יליד עשויה לשמש כדי לשלוט על חפצי טעינה אפשריים. לבסוף, בכל הקשור ללימודי לוקליזציה על ידי מיקרוסקופ פלואורסצנטי, חשוב מאוד להיות מודעים pחלוק סלקטיביות משום שבניגוד כתמי חלבון, מיקרוסקופ פלואורסצנטי אינו מאפשר את ההבחנה של היעד מ מחוץ מטרות. יש לבצע מחקרים סלקטיביות ראשוניים להעריך היתכנות להקים תנאי ניסוי אופטימליים.
מגבלות הטכניקה התואר בעיקר נוגעות הצורך להימנע תנאי ניסוי שיכול להשפיע על תגובת CC, כגון השימוש של חומרי ניקוי מאגרים המכילים אמינים. היבטים אלה חייבים להילקח בחשבון כאשר מכינים lysate תא או רקמה homogenate. יתר על כן, כאשר שלב העשרה streptavidin נדרש, הכמות של חומר מוצא מהווה בעיה אחרת, כי הליך זה ישים רק כאשר תכולת החלבון היא לא פחות מ 250 מיקרוגרם. הגבלה זו מוגדרת עקב בעיות טכניות, כגון כרכים עובדים, התאוששות חלבון, לאחר ממטרים הנגרמת CC, וכמות שרף streptavidin לשמש.
Previously, פעילות NAAA יכול להיות מוערך רק על ידי ביצוע מבחני פעילות, אשר דורשים את השימוש של חיץ הפעלה עבור ההפעלה במבחנה של האנזים ועבור solubilization מצע 14. גישה זו מספקת מידע על ביטוי NAAA שלם, ולא על הנוכחות של NAAA הפעיל. אפשרות נוספת היא למדוד את רמות רקמות של אפונה OEA, אך שיטה זו מייצגת רק באופן עקיף לשם הערכת הפעילות NAAA 34,35. בנוסף, רמות FAE יכולות להיות מושפעות מגורמים אחרים כגון ביוסינתזה. החללית הכימית ARN14686 הוא ABP הראשון עבור NAAA. הפרוטוקול המתואר כאן מדגים פרוצדורה פשוטה עבור לכידה לדמיין את הצורה הפעילה של NAAA, הוא במבחנת in vivo. כל המניפולציות מדגם לאחר תגובות-יעד חללי, ובכך נותנים מידע אמין על מצב in vivo של האנזים. יתר על כן, השימוש ARN14686 מיקרוסקופ פלואורסצנטי מייצג t כלי ייחודיo למקם NAAA פעיל. נוגדנים זמינים, אשר מזהים את למקטע קטליטי NAAA, אינם מפלים בין proenzyme באורך מלא NAAA ואת האנזים הפעיל.
החלו מן הפרוטוקול המתואר כאן, ביטוי הפעלת NAAA ניתן לנתח שורות תאים שונות במודלים של בעלי החיים של דלקת. ניתן לבצע שיתוף לוקליזציה מחקרים לאפיין את התפקיד של NAAA טוב יותר בתנאים פיסיולוגיים ופתולוגיים.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank the Nikon Imaging Center at Istituto Italiano di Tecnologia, Genova, Italy (NIC@IIT).
Materials
| Name | Company | Catalog Number | Comments |
| 1,1’-sulfonyldiimidazole | Sigma Aldrich | 367818 | Harmful |
| 2-dipyridylcarbonate | Fluorochem | 11331 | Harmful |
| 2-Methylbutan | Sigma Aldrich | M32631 | Flamable, toxic,hazardous to the aquatic environment |
| 4-(Dimethylamino)pyridine | Sigma Aldrich | 107700 | Toxic |
| Acetic acid | Sigma Aldrich | 695092 | Flammable, Corrosive |
| Acetonitrile | Sigma Aldrich | 34998 | Flammable, Toxic |
| Activated charcoal | Sigma Aldrich | 161551 | |
| Ammonium chloride | Sigma Aldrich | A9434 | Harmful |
| Azide-PEG3-Biotin | Jena Biosciences | CLK-AZ104P4 | |
| Azide-PEG3-Fluor 545 | Jena Biosciences | CLK-AZ109 | |
| BCA protein assay kit | Thermo Fisher Scientific | 23227 | |
| Bio-spin columns | Biorad | 732-6204 | |
| Biotin | Sigma Aldrich | B4501 | |
| Blocking buffer | Li-Cor Biosciences | 927-40000 | |
| β-mercaptoethanol | Sigma Aldrich | M6250 | Higly toxic |
| Bovin serum albumine (BSA) | Sigma Aldrich | A7030 | |
| Bromophenol blue | Sigma Aldrich | B0126 | |
| Bruker Avance III 400 | Bruker | ||
| Celite | Sigma Aldrich | 419931 | Health hazard |
| Ceric ammonium nitrate | Sigma Aldrich | 22249 | Oxidizing, Harmful |
| Chloral hydrate | Sigma Aldrich | C8383 | Higly toxic |
| CuSO4.5H2O | Sigma Aldrich | 209198 | Toxic |
| Cyclohexadiene | Sigma Aldrich | 125415 | Flammable, Health hazard |
| Cyclohexane | Sigma Aldrich | 34855 | Flammable, Harmful, Health hazard, Environmental hazard |
| Dichloromethane | Sigma Aldrich | 34856 | Harmful, Health hazard |
| Diethyl ether | Sigma Aldrich | 296082 | Flammable, Harmful |
| Dimethyl sulfoxide (DMSO) | Acros Organics | 348441000 | |
| Dimethyl sulfoxide d6 (DMSO-d6) | Sigma Aldrich | 175943 | |
| Ethanol | Sigma Aldrich | 2860 | Flammable, Harmful |
| Ethyl acetate | Sigma Aldrich | 34858 | Flammable, Harmful |
| Glycerol | Sigma Aldrich | G5516 | |
| Irdye 680-LT Streptavidin | Li-Cor Biosciences | 925-68031 | |
| IRDye680-LT Streptavidin | Licor | 925-68031 | Briefly centrifuge before use to precipitate protein complexes |
| Methanol | Sigma Aldrich | 34966 | Highly toxic |
| Methanol | Sigma Aldrich | 34860 | Flammable, Toxic, Health hazard |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride | Sigma Aldrich | E7750 | Harmful, Corrosive |
| N,N-diisopropylethylamine | Sigma Aldrich | D125806 | Flammable, Corrosive, Toxic |
| N,N-dimethylformamide | Sigma Aldrich | 227056 | Flammable, Harmful, Health hazard |
| N-Cbz-L-Serine | Fluorochem | M03053 | Harmful |
| Nikon A1 confocal microscopy | Nikon | Read the user manual | |
| NuPAGE 4-12% Bis-Tris gel | Thermo Fisher Scientific | NP0335BOX | |
| Palladium on carbon | Sigma Aldrich | 330108 | |
| p-anisidine | Sigma Aldrich | A88255 | Toxic, Health hazard, Environmental hazard |
| Paraformaldehyde | sigma Aldrich | 441244 | Toxic, respiratory harmful, corrosive, falmable |
| Poly(ethylene glycol) | Sigma Aldrich | P3265 | |
| ProLong Gold antifade mountant with DAPI | Thermo Fisher Scientific | P36931 | Avoid bubbles formation |
| Protease inhibitor cocktail | Sigma Aldrich | P8340 | |
| Sodium bicarbonate | Sigma Aldrich | S6014 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | L3771 | Toxic, corrosive, falmmable |
| Sodium hydride | Sigma Aldrich | 452912 | Flammable |
| Sodium sulfate | Sigma Aldrich | 239313 | |
| Starion FLA-9000 immage scanner | FUJIFILM | Read the user manual | |
| Streptavidin agarose | Thermo Fisher Scientific | 20349 | |
| Sucrose | Sigma Aldrich | S7903 | |
| Tert-butanol | Sigma Aldrich | 360538 | Toxic, flammable |
| Tetrahydrofuran | Sigma Aldrich | 186562 | Flammable, Harmful, Health hazard |
| Thiourea | Acros Organics | 424542500 | Toxic, warm at 50 °C to dissolve |
| Tris | Sigma Aldrich | RDD008 | |
| Tris(2-carboxyethyl)phosphine (TCEP) | Sigma Aldrich | C4706 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Sigma Aldrich | 678937 | |
| Triton-x100 | Sigma Aldrich | X100 | Toxic |
| Tween-20 | Sigma Aldrich | P9416 | |
| Tween-80 | Sigma Aldrich | P1754 | |
| Ultra turrax IKA T18 basic tissue homogenizer | IKA | ||
| Undec-10-yn-1-ol | Fluorochem | 13739 | Harmful |
| Urea | Sigma Aldrich | U5378 | Toxic, warm at 50 °C to dissolve |
References
- Gygi, S. P., Han, D. K., Gingras, A. C., Sonenberg, N., Aebersold, R. Protein analysis by mass spectrometry and sequence database searching: tools for cancer research in the post-genomic era. Electrophoresis. 20, 310-319 (1999).
- Washburn, M. P., Wolters, D., Yates, J. R. Large-scale analysis of the yeast proteome by multidimensional protein identification technology. Nat Biotechnol. 19, 242-247 (2001).
- Zhu, H., Bilgin, M., Snyder, M. Proteomics. Annu Rev Biochem. 72, 783-812 (2003).
- Ito, T., et al. Roles for the two-hybrid system in exploration of the yeast protein interactome. Mol Cell Proteomics. 1, 561-566 (2002).
- Evans, M. J., Cravatt, B. F. Mechanism-based profiling of enzyme families. Chem Rev. 106, 3279-3301 (2006).
- Cravatt, B. F., Wright, A. T., Kozarich, J. W. Activity-based protein profiling: from enzyme chemistry to proteomic chemistry. Annu Rev Biochem. 77, 383-414 (2008).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew Chem Int Ed Engl. 41, 2596-2599 (2002).
- Meldal, M., Tornoe, C. W. Cu-catalyzed azide-alkyne cycloaddition. Chem Rev. 108, 2952-3015 (2008).
- Speers, A. E., Adam, G. C., Cravatt, B. F. Activity-based protein profiling in vivo using a copper(i)-catalyzed azide-alkyne [3 + 2] cycloaddition. J Am Chem Soc. 125, 4686-4687 (2003).
- Saxon, E., Bertozzi, C. R. Cell surface engineering by a modified Staudinger reaction. Science. 287, 2007-2010 (2000).
- Kohn, M., Breinbauer, R. The Staudinger ligation-a gift to chemical biology. Angew Chem Int Ed Engl. 43, 3106-3116 (2004).
- Romeo, E., et al. Activity-Based Probe for N-Acylethanolamine Acid Amidase. ACS Chem Biol. 10, 2057-2064 (2015).
- Ueda, N., Yamanaka, K., Yamamoto, S. Purification and characterization of an acid amidase selective for N-palmitoylethanolamine, a putative endogenous anti-inflammatory substance. J Biol Chem. 276, 35552-35557 (2001).
- Tsuboi, K., et al. Molecular characterization of N-acylethanolamine-hydrolyzing acid amidase, a novel member of the choloylglycine hydrolase family with structural and functional similarity to acid ceramidase. J Biol Chem. 280, 11082-11092 (2005).
- Tsuboi, K., Takezaki, N., Ueda, N. The N-acylethanolamine-hydrolyzing acid amidase (NAAA). Chem Biodivers. 4, 1914-1925 (2007).
- Ribeiro, A., et al. A Potent Systemically Active N-Acylethanolamine Acid Amidase Inhibitor that Suppresses Inflammation and Human Macrophage Activation. ACS Chem Biol. 10, 1838-1846 (2015).
- Zhao, L. Y., Tsuboi, K., Okamoto, Y., Nagahata, S., Ueda, N. Proteolytic activation and glycosylation of N-acylethanolamine-hydrolyzing acid amidase, a lysosomal enzyme involved in the endocannabinoid metabolism. Biochim Biophys Acta. 1771, 1397-1405 (2007).
- Wang, J., et al. Amino acid residues crucial in pH regulation and proteolytic activation of N-acylethanolamine-hydrolyzing acid amidase. Biochim Biophys Acta. 1781, 710-717 (2008).
- West, J. M., Zvonok, N., Whitten, K. M., Wood, J. T., Makriyannis, A. Mass spectrometric characterization of human N-acylethanolamine-hydrolyzing acid amidase. J Proteome Res. 11, 972-981 (2012).
- Bandiera, T., Ponzano, S., Piomelli, D. Advances in the discovery of N-acylethanolamine acid amidase inhibitors. Pharmacol Res. 86, 11-17 (2014).
- Sasso, O., et al. Antinociceptive effects of the N-acylethanolamine acid amidase inhibitor ARN077 in rodent pain models. Pain. 154, 350-360 (2013).
- Duranti, A., et al. N-(2-oxo-3-oxetanyl)carbamic acid esters as N-acylethanolamine acid amidase inhibitors: synthesis and structure-activity and structure-property relationships. J Med Chem. 55, 4824-4836 (2012).
- Ponzano, S., et al. Synthesis and structure-activity relationship (SAR) of 2-methyl-4-oxo-3-oxetanylcarbamic acid esters, a class of potent N-acylethanolamine acid amidase (NAAA) inhibitors. J Med Chem. 56, 6917-6934 (2013).
- Solorzano, C., et al. Synthesis and structure-activity relationships of N-(2-oxo-3-oxetanyl)amides as N-acylethanolamine-hydrolyzing acid amidase inhibitors. J Med Chem. 53, 5770-5781 (2010).
- Vitale, R., et al. Synthesis, structure-activity, and structure-stability relationships of 2-substituted-N-(4-oxo-3-oxetanyl) N-acylethanolamine acid amidase (NAAA) inhibitors. ChemMedChem 9. 9, 323-336 (2014).
- Fiasella, A., et al. 3-Aminoazetidin-2-one derivatives as N-acylethanolamine acid amidase (NAAA) inhibitors suitable for systemic administration. ChemMedChem 9. 9, 1602-1614 (2014).
- Armirotti, A., et al. beta-Lactones Inhibit N-acylethanolamine Acid Amidase by S-Acylation of the Catalytic N-Terminal Cysteine. ACS Med Chem Lett. 3, 422-426 (2012).
- Nuzzi, A., et al. Potent alpha-amino-beta-lactam carbamic acid ester as NAAA inhibitors. Synthesis and structure-activity relationship (SAR) studies. Eur J Med Chem. 111, 138-159 (2016).
- Bonezzi, F. T., et al. An Important Role for N-Acylethanolamine Acid Amidase in the Complete Freund's Adjuvant Rat Model of Arthritis. J Pharmacol Exp Ther. 356, 656-663 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150, 76-85 (1985).
- Speers, A. E., Cravatt, B. F. Activity-Based Protein Profiling (ABPP) and Click Chemistry (CC)-ABPP by MudPIT Mass Spectrometry. Curr Protoc Chem Biol. 1, 29-41 (2009).
- Rybak, J. N., Scheurer, S. B., Neri, D., Elia, G. Purification of biotinylated proteins on streptavidin resin: a protocol for quantitative elution. Proteomics. 4, 2296-2299 (2004).
- Penna, A., Cahalan, M. Western Blotting using the Invitrogen NuPage Novex Bis Tris minigels. J Vis Exp. (264), (2007).
- Giuffrida, A., Piomelli, D. Isotope dilution GC/MS determination of anandamide and other fatty acylethanolamides in rat blood plasma. FEBS Lett. 422, 373-376 (1998).
- Buczynski, M. W., Parsons, L. H. Quantification of brain endocannabinoid levels: methods, interpretations and pitfalls. Br J Pharmacol. 160, 423-442 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved