Method Article
Vorbereitung und
In diesem Artikel
Zusammenfassung
Hier beschreiben wir die Herstellung und Verwendung eines aktivitätsbasierten Sonde (ARN14686, undec-10-ynyl- N - [(3 S) -2-oxoazetidin-3-yl] carbamat) , die zum Nachweis und zur Quantifizierung des ermöglicht aktive Form des proinflammatorischen Enzym N -acylethanolamine Säure Amidase (NAAA), sowohl in vitro und ex vivo.
Zusammenfassung
Aktivitätsbasierte Protein Profilierung (ABPP) ist ein Verfahren zur Identifizierung eines Enzyms von Interesse in einer komplexen Proteom durch die Verwendung einer chemischen Sonde, die das Enzym der aktiven Stellen richtet. Ein Reporter-Tag in die Sonde eingeführt ermöglicht die Detektion des markierten Enzyms durch in-Gel-Fluoreszenz-Scanning, Protein-Blot, Fluoreszenz-Mikroskopie, oder Flüssigkeitschromatographie-Massenspektrometrie. Hier beschreiben wir die Herstellung und die Verwendung der Verbindung ARN14686, eine Click - Chemie aktivitätsbasierte Sonde (CC-ABP), die das Enzym N -acylethanolamine Säure Amidase selektiv erkennt (NAAA). NAAA ist ein Cystein-Hydrolase, die Entzündung durch Deaktivierung endogenen Peroxisomenproliferator-aktivierten Rezeptor (PPAR) -alpha-Agonisten wie Palmitoylethanolamide (PEA) und oleoylethanolamide (OEA) fördert. NAAA wird als inaktives Proenzym in voller Länge synthetisiert, die durch Autoproteolyse in dem sauren pH des Lysosom aktiviert wird. Lokalisationsstudien have gezeigt, dass NAAA überwiegend in Makrophagen und anderen Monozyten abgeleiteten Zellen exprimiert wird, als auch in B-Lymphozyten. Wir stellen Beispiele dafür , wie ARN14686 verwendet werden können , zu erkennen und zu aktiven NAAA ex vivo in Nagetiergeweben durch Protein - Blot und Fluoreszenzmikroskopie quantifiziert.
Einleitung
Üblicherweise Methoden verwendet , um die Expressionsmuster, Interaktionen und Funktionen von Proteinen zu untersuchen, einschließlich Flüssigchromatographie-Massenspektrometrie Plattformen für shotgun Analyse 1,2, Hefe - Zwei-Hybrid - Verfahren 3,4 und in vitro - Assays sind in begrenzt , dass sie nicht in der Lage, die Aktivität der Proteine in ihrem nativen Zustand zu beurteilen. Die aktivitätsbasierte Proteinprofilierung (ABPP) können verwendet werden, um diese Lücke zu füllen. In diesem Ansatz werden die Sonden mit kleinem Molekül, das an die aktive Stelle eines Enzyms von Interesse konjugiert an eine Reportergruppe kovalent Bindung, die für die Zielerfassung ermöglicht. Mit Klick - Chemie (CC), kann der Reporter in die Sonde integriert oder eingeführt werden , nachdem Ziel Engagement 5,6 aufgetreten ist. Das letztere Verfahren erfordert die Verwendung von Sonden geeigneten chemischen Gruppen, wie beispielsweise einem terminalen Alkin oder Azid, die mit einer Anzahl von Reporterreagenzien über bioorthogonalen Reaktionen modifiziert werden kann such als Cu (I) -katalysierte Huisgen [3 + 2] -Cycloaddition 7-9 oder Staudinger - Ligation 10,11.
Vor kurzem offenbarten wir die Verbindung ARN14686 als erste ABP für die in - vitro- und in - vivo - Nachweis der Cystein - Hydrolase, NAAA 12. NAAA katalysiert die hydrolytische Deaktivierung von gesättigten und einfach ungesättigten FAEs, einschließlich oleoylethanolamide (OEA) und Palmitoylethanolamid (PEA), die 13-15 endogene Agonisten des anti-inflammatory nukleären Rezeptor PPAR-alpha sind. NAAA wird überwiegend in Makrophagen und anderen Monozyten abgeleiteten Zellen exprimiert werden , als auch in B-Lymphozyten 14,16, eine Rolle in der Regulation der angeborenen Immunantwort hinweist. Das Enzym wird im rauhen endoplasmatischen Retikulum in einer inaktiven Form synthetisiert und in sauren Kompartimenten der Zelle durch eine autoproteolytische Mechanismus 17 aktiviert. Die autoproteolytische Spaltung erzeugt ein neues N -terminale Cystein (C131 in Mäusen und Ratten, C126 beim Menschen), das heißt das Nukleophil für FAE 18,19 Hydrolyse. Pharmakologische Hemmung der NAAA Aktivität verändert die FAE - Synthese / Abbau Gleichgewicht zugunsten der erhöhten zellulären Ebenen der FAE 16,20,21. Mehrere β-lacton und β-Lactam - Derivate wurden 16,22-26 NAAA Aktivität mit hoher Wirksamkeit und Selektivität gezeigt , zu hemmen. Diese Inhibitoren wirken durch S - Acylierung des katalytischen Cystein 16,27,28.
(- [(S) -2-oxoazetidin-3-yl] carbamat 4-cyclohexylbutyl- N) 16 Die Verbindung ARN14686 wurde basierend auf der chemischen Struktur des systemisch aktiven, Serin abgeleiteten β-Lactam NAAA Inhibitor, ARN726 gestaltet. Das 4-Butyl-cyclohexyl Gruppe von ARN726 wurde mit einem C9 gesättigte aliphatische Kette ersetzt ein terminales Alkin-Tag für die nachfolgende CC Konjugation mit einem Azid-Lager Reporter-Tag trägt. Wir entschieden uns für einen zweistufigen ABP-Design, um minimally die Struktur des ursprünglichen Gerüsts verändert, wodurch die Affinität der Sonde für NAAA aufrechterhalten wird. Darüber hinaus die Einführung von sperrigen Tags zu vermeiden, eine solche Sonde könnte besser geeignet sein für in vivo - Behandlung als eine direkte ABP. ARN14686 hemmt NAAA mit hoher Potenz (hNAAA IC 50 = 6 nM, rNAAA IC 50 = 13 nM) durch eine kovalente Addukt mit dem katalytischen Cystein des Enzyms 12 bilden. Experimente mit lebenden Ratten zeigten, dass die Sonde bei der Erfassung von NAAA selektiv ist in Lunge ausgedrückt. Acid Ceramidase, eine andere Cystein - Amidase , die 33-34% Identität mit NAAA teilt, wurde auch als niedriger Affinität Ziel identifiziert , wenn eine hohe Sondenkonzentrationen (10 & mgr; M in vitro, 10 mg / ml intravenös, iv) unter Verwendung von 12. Wir haben auch ARN14686 zur Untersuchung der Anwesenheit von aktiven NAAA in entzündeten Rattengeweben nach der Verabreichung von komplettem Freund'schen Adjuvans (CFA) 29 verwendet.
Hier beschreiben wir ein Protokoll für die preparatiauf der ARN14686 (Abbildung 1) und ihre Anwendung auf die Untersuchung von NAAA Aktivierung ex vivo. Als Beispiel beschreiben wir ein experimentelles Verfahren NAAA visualisieren in Rattenpfoten nach CFA Verabreichung. In diesem Experiment werden die Proteine aus paw Gewebe nach intravenöser Injektion der Sonde extrahiert und die ABP-markiertem Proteom unterzogen mit Biotin-Azid zu CC. Biotinylierte Proben werden unter Verwendung von Streptavidin-Kügelchen angereichert, und Protein-Blots durchgeführt werden. In einer anderen Anwendung beschreiben wir die Lokalisation der aktiven NAAA durch Fluoreszenzmikroskopie in Mauslungen von der Sonde behandelten Mäusen. In diesem Fall wird das Gewebe geschnitten und Abschnitte sind CC für Rhodamin-Addition unterzogen. Ein Workflow - Schema ist in Abbildung 2 dargestellt.
Protokoll
Achtung: Alle Chemie Reaktionen in einem belüfteten Laborabzug durchgeführt und mit der Verwendung eines Laborkittel, Handschuhe und Schutzbrille werden sollte. Die Reaktionen sollten auch in einer Stickstoffumgebung durchgeführt werden.
Ethische Erklärung: Unsere Verfahren Tiere werden in Übereinstimmung mit den italienischen Vorschriften zum Schutz der für Versuche und andere wissenschaftliche Zwecke (DM 116.192) und Europäische Wirtschaftsgemeinschaft Vorschriften (ABl EG-L 358/1 1986.12.18 verwendet durchgeführt ).
HINWEIS: Synthese von [(3 S) -2-oxoazetidin-3-yl] Ammoniumacetat für große Ausbeuten (50 g N Cbz-L-serin) beschrieben ist, aber es kann leicht nach unten skaliert werden.
1. Synthese
HINWEIS: Siehe Abbildung 1 für die Synthese Reaktionsschema.
- Herstellung von 2-pyridyl undec-10-inyl Carbonat und undec-10-inyl 2-oxopyridin 1-carboxylat
- In einem 50 ml Rundkolben, lösen sich 350 mg undec-10-yn-1-ol in 3,5 ml trockenem Dichlormethan.
- Zu der Lösung in 1.1.1, werden 25 mg 4-Dimethylaminopyridin (DMAP) und 530 mg 2-dipyridylcarbonate (DPC). Rühre das Gemisch bei Raumtemperatur (RT) für 16 Stunden.
- In 20 ml Dichlormethan.
- Übertragen der Mischung in einen Scheidetrichter. In 15 ml Wasser, schütteln Sie sie und lassen Sie die zwei Phasen zu trennen.
- Öffnen Sie den Hahn, sammeln die organische Phase (unten) und dann den Wasserhahn zu schließen. 15 ml einer gesättigten NaHCO 3 -Lösung. Schütteln Sie den Scheidetrichter und lassen die beiden Phasen trennen. Wiederholen Sie diesen Schritt zwei weitere Male.
- Die organische Schicht wird mit Na 2 SO 4, filtriert durch Baumwolle in einen Rundkolben (Tara zuerst) und dampft zur Trockne unter vermindertem Druck (Rotationsverdampfer).
- Wiegen des Kolbens und seines erhalten 600 mg Öl, das ein Gemisch aus 2-pyridyl undec-10-inyl Carbonat und undec-10-inyl 2-oxopyridin 1-carboxylat in einem Verhältnis von 1,7: 1.
1 H NMR (400 MHz, DMSO - d 6) Hauptkomponente δ = 8,39 (dd, J = 5,0, 2,0, 1H), 7,98 (td, J = 7,9, 2,0, 1H), 7,40 (ddd, J = 7,2, 4,9, 0,9, 1H), 7,30 (d, J = 8,2, 1H), 4,22 (t, J = 6,6, 2H), 2,73 (t, J = 2,4, 1H), 2,18-2,11 (m, 2H), 1,76 - 1,62 (m, 2H), 1,50 - 1,23 (m, 12H).
1 H NMR (400 MHz, DMSO - d 6) Nebenkomponente δ = 7,74 (dd, J = 7,2, 1,9, 1H), 7,47 (dd, J = 6,7, 2,3, 1H), 6,44 (d, J = 9.4, 1H), 6,30-6,25 (m, 1H), 4,35 (t, J = 6,5, 2H), 2,72 (t, J = 2,4, 1H), 2,18-2,11 (m, 2H), 1,77-1,60 (m, 2H ), 1,52-1,20 (m, 12H). - Verwenden Sie das Öl ohne weitere Trennung oder Reinigung.
- Herstellung von [(3 S) -2-oxoazetidin-3-yl] ammonium Acetate
- Herstellung von Benzyl - N - [(S) -1- (hydroxymethyl) -2 - [(4-methoxyphenyl) amino] -2-oxoethyl] carbamat.
- In einem 4-l - Rundkolben, lösen sich 141,5 g p - Anisidin in 1,5 l Tetrahydrofuran und 0,5 l Dichlormethan.
- Die Lösung wird auf 0 ° C in einem Eisbad.
- 50,0 g N Cbz-L-Serin und 43,9 g N - (3-dimethylaminopropyl) - hydrochlorid -ethylcarbodiimide 'N.
- Rühren Sie die Mischung mit einem Magnetrührer bei 0 ° C für 30 min.
- Entfernen Sie die Lösung aus dem Eisbad und unter Rühren mit einem Magnetstab bei RT für 16 Stunden.
- Man dampft die Lösungsmittel unter vermindertem Druck (Rotationsverdampfer).
- In 400 ml 1: 1 Cyclohexan / Ethylacetat, unter Rühren mit einem Spatel, und dekantieren.
- Wiederholen Sie Schritt 1.2.1.7 zwei weitere Male.
- Man löst den gummiartigen Rückstand in 500 ml Essigester und wäscht mit 400 ml 0,1 M HCl - Lösung (10 - mal), mit 400 ml gesättigter NaHCO 3 -Lösung (2 mal) und mit 400 ml Kochsalzlösung.
- Die organische Schicht wird mitNa 2 SO 4, filtriert die Lösung durch Baumwolle in einen Rundkolben (Tara zuerst) und dampft sie unter vermindertem Druck (Rotationsverdampfer) bis zur Trockne.
- Wiegen Sie den Kolben und erhalten 61,4 g eines weißen Feststoffs.
1 H NMR (400 MHz, DMSO - d 6) δ = 9.86 (bs, 1H), 7,52 (d, 2H, J = 9,0 Hz), 7,42-7,25 (m, 6H), 6,91-6,85 (m, 2H) 5,06 (d, 1H, J = 12,9 Hz), 5,02 (d, 1H, J = 12,9 Hz), 4,98 (t, 1H, J = 5,6 Hz), 4,24 bis 4,15 (m, 1H), 3,72 (s, 3H), 3,70-3,57 (m, 2H).
- Herstellung von Benzyl - N - [(S) -1- (4-methoxyphenyl) -2-oxo-azetidin-3-yl] carbamat.
- Man löst 58,6 g N - [(S) -1- (hydroxymethyl) -2 - [(4-methoxyphenyl) amino] -2-oxo-ethyl] carbamat in 1,6 l N, N - Dimethylformamid.
- Die Lösung wird auf 0 ° C mit einem Eisbad.
- In 50,6 g 1,1'-sulfonyldiimidazole und rühren mit einem Magnetstab für 30 min.
- Die Lösung wirdbis -20 ° C mit einem Eis / NaCl-Bad und 10,2 g Natriumhydrid (60% in Mineralöl) portionsweise hinzu.
- Rühren Sie die Mischung bei -20 ° C für 1 Stunde und dann mit 2 ml Methanol und 1 l Wasser quenchen.
- Vakuumfilter den Niederschlag, wäscht mit 200 ml Wasser, und unter Vakuum getrocknet.
- Erhalten 42,2 g eines weißen Feststoffs.
1 H NMR (400 MHz, DMSO - d 6) δ = 8,08 (d, 1H, J = 8,5 Hz), 7,42-7,28 (m, 5H), 7,30 (d, 2H, J = 8,9 Hz), 6,95 (d , 2H, J = 8,9 Hz), 5,06 (s, 2H), 4,86 (ddd, 1H, J = 8,5, 5,6, 2,6 Hz), 3,90 (t, 1H, J = 5,6 Hz), 3,73 (s, 3H) , 3,55 (dd, 1H, J = 5,6, 2,6 Hz).
- Herstellung von Benzyl - N - [(S) -2-oxoazetidin-3-yl] carbamat.
- Suspend 9,0 g Benzyl - N - [(S) -1- (4-methoxyphenyl) -2-oxoazetidin-3-yl] carbamat in 500 ml Acetonitril und 400 ml Wasser.
- Die Lösung wird auf 0 ° C in einem Eisbad.
- In 45,4 g ceric Ammoniumnitrat portionsweise über 45 min und unter Rühren mit einem Magnetstab bei 0 ° C für 15 min.
- In 500 ml gesättigter NaHCO 3 -Lösung vorsichtig, und fügen Sie dann 500 ml Ethylacetat.
- Filtriere den Niederschlag und wäscht mit 200 ml Essigester.
- Trennen Sie die zweiphasige Lösung und waschen Sie die wässrige Phase mit 200 ml Ethylacetat (3-mal).
- Die organische Schicht wird mit Na 2 SO 4, 5 g Aktivkohle, filtriert durch ein Polster aus Kieselgur und Eindampfen zur Trockne unter vermindertem Druck (Rotationsverdampfer).
- In Diethylether und rührt mit einem Spatel.
- Filtriere den Feststoff und erhalten 4,85 g eines gebrochen weißen Feststoff.
1 H NMR (400 MHz, DMSO - d 6) δ = 7.97 (d, 1H, J = 8,7 Hz), 7,94 (bs, 1H), 7.42- 7.30 (m, 5H), 5,05 (s, 2H), 4,67 (ddd, 1H, J = 8,7, 5,4, 2,7 Hz), 3,40 (t, 1H, J = 5,4 Hz,), 3,09 (dd, 1H, J = 5,4, 2,7 Hz).
- Herstellung von [(S) -2-oxoazetidin-3-yl] -ammonium Acetate.
- Man löst 0,93 ml Essigsäure in 245 ml Essigester. Markieren Sie diese als "Trapping-Lösung."
- Man löst 3,28 g Benzyl- N - [(R) -2-oxoazetidin-3-yl] carbamat in 298 ml Ethanol gegeben .
- Hinzufügen 14,1 ml Cyclohexadien und 3,27 g 10% Palladium auf Kohlenstoff.
- Rühre die Suspension bei RT für 12 h und dann filtriert durch ein kurzes Kissen aus Diatomeenerde. Gießen Sie die eluierende Flüssigkeit direkt in die Trapping-Lösung.
- Dampfe das Lösungsmittel unter vermindertem Druck (Rotationsverdampfer), um die Temperatur unter 35 ° C gehalten wurde.
- Man reibt die erhaltene Feststoff mit Tetrahydrofuran und erhalten 1,72 g eines weißen Feststoffs.
1 H NMR (400 MHz, DMSO - d 6) δ = 7,68 (bs, 1H), 3,99 (ddd, 1H, J = 5,2, 2,4, 1,2 Hz), 3,32 (t, 1H, J = 5,2 Hz), 2,79 (dd, 1H, J = 5,2, 2,4 Hz), 1,90 (s, 3H).
- Herstellung von Benzyl - N - [(S) -1- (hydroxymethyl) -2 - [(4-methoxyphenyl) amino] -2-oxoethyl] carbamat.
- Herstellung von Undec-10-ynyl- N - [(3 S) -2-oxoazetidin-3-yl] carbamat
- In einem 10 ml Rundkolben, lösen sich 60 mg [(3 S) -2-oxoazetidin-3-yl] Ammoniumacetat in 2 ml trockenem Dichlormethan.
- Die Lösung wird auf 0 ° C in einem Eisbad und füge 81 & mgr; l N, N - Diisopropylethylamin tropfenweise.
- Man löst 350 mg des rohen Mischung undec-10-inyl 2-oxopyridin 1-carboxylat in 2 ml trockenem Dichlormethan, fügen Sie es zu der Lösung enthält, und rührt bei RT für 15 Stunden. Dampfe das Lösungsmittel unter vermindertem Druck (Rotationsverdampfer) bis zur Trockne.
- Reinige durch Säulenchromatographie (Kieselgel) unter Verwendung eines automatisierten Säulenchromatographie apparatus:
- Nehmen Sie die Probe auf Kieselgel, ins Gleichgewicht der Säule mit Cyclohexan, und laden Sie die Probe in die Kassette.
- Eluieren mit Cyclohexan / Essigester 100: 0 bis 0: 100 und sammeln Spitzen auf Reagenzgläser.
- Dampfe das Lösungsmittel der Fraktionen zur Verbindung bis zur Trockne unter vermindertem Druck (Rotationsverdampfer) und erhalten 40 mg eines weißen Feststoffs entspricht.
2. Herstellung von CC Reagents
- Herstellung von 5 mM Stammlösung von Tag-Azid - Moleküle
- Man löst 1,5 mg Azid-PEG3-Fluor 545 in 0,5 ml Dimethylsulfoxid (DMSO). Make-Aliquots in 0,5 ml Mikrozentrifugenröhrchen und bei -20 ° C.
- Man löst 1,1 mg Azid-PEG3-Biotin in 0.5 ml DMSO. Make-Aliquots in 0,5 ml Mikrozentrifugenröhrchen und bei -20 ° C.
- Herstellung von 50 mM Stammlösung von Tris (2-carboxyethyl) phosphin (TCEP)
- Man löst 14,3 mg TCEP in 1 ml Wasser, und machen es frisch jedes Mal.
- Herstellung von 50 mM Lösung von CuSO 4 · 5H 2 O
- In einem Glasfläschchen, lösen sich 120,48 mg CuSO 4 · 5H 2 O in 1 ml Wasser. Lagern Sie bei RT für bis zu einem Monat.
- Herstellung von 83,5 mM Stammlösung von Tris [(1-benzyl-1H-1,2,3-triazol-4-yl) methyl] amin (TBTA)
- In einem Glasfläschchen, lösen sich 8,85 mg TBTA in 200 ul DMSO. Lagern Sie bei RT für bis zu einem Monat.
- Herstellung von 1,7 mM Arbeitslösung von TBTA (unmittelbar vor der Verwendung)
- Geben Sie 20 & mgr; l von 83,5 mM TBTA zu einem Glasfläschchen und verdünnt mit 180 ml DMSO.
- In 800 & mgr; l tert - Butanol und Wirbel.
3. NAAA Expressionsanalyse in Paw Gewebe von CFA-behandelten Ratten
HINWEIS: Die Verwendung männliche Sprague-Dawley-Ratten mit einem Gewicht von 175-200 g, und führen Sie alle Verfahren in Übereinstimmung mit den Richtlinien für die ethische Nutzung von Tieren. Hausratten in belüfteten Käfigen auf einer 12-Stunden-Licht / Dunkel-Zyklus und geben ihnen freien Zugang zu Nahrung und Wasser. Für das Protokoll von CFEine Behandlung finden Sie in dem Artikel veröffentlicht von Bonezzi et al. 29 Verwenden Tiere 7 Tage nach der CFA - Administration.
- Die intravenöse Verabreichung von ARN14686
- Auflösen ARN14686 in Vehikel (15% PEG und 15% Tween Kochsalzlösung). Berechne die Lösungskonzentration nach Rattengewicht (Dosis 3 mg / kg, Injektionsvolumen 5 ml / kg).
- Fahren Sie mit iv-Injektionen in drei naiv und drei CFA-behandelten Ratten. Platzieren Sie jede Ratte in einer geeigneten Kunststoff-Rückhalteeinrichtung. Dann den Rattenschwanz in warmem Wasser für 2-4 min Vasodilatation zu ermöglichen, und die Verbindung iv über die Schwanzvene injiziert.
- Injizieren drei Ratten (naiv und CFA-behandelten) iv mit dem Vehikel allein.
- Paw - Sammlung und Dissection
- Opfern , um die Ratten durch CO 2 Inhalation 4 Stunden nach Sonde oder die Fahrzeugverwaltung und sammeln ihre Pfoten von ihnen 0,5 cm über dem Kniegelenk mit einem Skalpell zu schneiden.
- Entfernen Sie vorsichtig die Haut durch Scheren unterstützt Dissektion und sezieren aus Weichgewebe, indem sie aus den Knochen kratzen. Entsorgen Sie die Knochen und sammeln Sie die Weichteile der Pfoten. Schnellfrost Proben in flüssigem Stickstoff und bei -80 ° C.
- Paw Homogenisieren und lysosomalen Proteinpräparat
HINWEIS: Vermeiden Sie Reinigungsmittel und aminhaltige Puffer verwendet, da sie die CC-Reaktion hemmen können.- Kombinieren paw Gewebe von 3 Ratten (erhalten wie beschrieben in Abschnitt 3.2.1) und homogenisieren sie in 4 ml 320 mM Saccharose in phosphatgepufferter Salzlösung (PBS, pH 7,4) und einem Protease - Inhibitor - Cocktail (siehe Material / Reagent Tabelle); verwenden , um eine Hochleistungs-Dispergiergerät (siehe Material / Reagenz Tabelle).
- Zentrifugieren Sie die Gewebehomogenat für 20 min bei 1000 × g bei 4 ° C; speichern den Überstand.
- 2 ml von 320 mM Saccharose in PBS und die Protease-Inhibitor-Cocktail zur Gewebepellet undHomogenisieren nochmals.
- Zentrifuge für 20 min bei 1.000 × g bei 4 ° C, und fügen Sie den Überstand zu dem aus Schritt 3.3.2.
- Zentrifugiere die gesammelten Überstände für 30 Minuten bei 12.000 × g bei 4 ° C.
- Wiegen Sie das Pellet und resuspendieren in zwei Bänden von PBS (dh 200 & mgr; l für jede 100 mg Pellet). Transfer zu einem 1,5-ml-Sammelröhrchen und frieren bei -80 ° C für 1 Stunde.
- Tauen Sie die Proben und frieren wieder für 1 Stunde bei -80 ° C.
- Wiederholen Sie das Einfrieren / Auftauen-Zyklus zwei weitere Male.
HINWEIS: Dieser Schritt soll das Protein zu solubilisieren. Frieren Sie über Nacht, wenn nötig. - Zentrifuge für 1 Stunde bei 100.000 × g bei 4 ° C. Sammeln Sie den Überstand, der lösliche lysosomale Proteine enthält, und das Pellet verwerfen. Bei -80 ° C oder unmittelbar mit Proteinquantifizierung fortzufahren.
- Quantifizierung der Proteingehalt eines BCA - Protein - Assay - 30 im Handel erhältlichen Kits (siehe Material / Reagenz Tabelle ), nach den Anweisungen des Herstellers.
- Lagern Sie die Proben bei -80 ° C bis zur Verwendung.
- CC mit Azid-PEG3-Biotin
HINWEIS: Das Protokoll von CC und Streptavidin Wulst Anreicherung (Schritte 3,4-3,6) aus dem Protokoll , das von Speers und Cravatt 31 veröffentlicht leicht modifiziert.- Bereiten 500 & mgr; l (1 mg / ml, in PBS) von lysosomalen Proteinen aus Sonden- und Vehikel-behandelten Ratten (naiver und CFA behandelten Ratten).
- Preclear Proben mit 40 ul einer 50% igen Aufschlämmung von Streptavidin-Agarose (wasche dreimal mit 1 ml PBS vor der Verwendung) für 1 h bei 4 ° C. Zentrifuge 4 min bei 1000 × g bei 4 ° C und nehmen den Überstand.
- In 11,3 ul einer 5 mM Lager von Azid-PEG3-Biotin und Wirbel.
- In 11,3 ul einer 50 mM Stamm an frisch zubereiteten TCEP und Wirbel.
- Premix 34 & mgr; l einer frisch hergestellten Arbeitslösung von 1,7 mM TBTA mit 11,3 ul einer 50 mM CuSO 4 · 5 H 2 O Lager.
- In 45,3 ml einer vorgemischten TBTA / CuSO 4 · 5 H 2 O - Lösung und Wirbel.
- Inkubieren der Reaktion bei 25 ° C für 2 Stunden (eine längere Inkubationszeit beeinflusst nicht die Reaktion). Beobachten Proteinfällung bei diesem Schritt. Mischen nach der ersten Stunde der Inkubation.
- Entfernung von überschüssigem CC Reagents
- Zentrifugieren Sie die Proben für 4 min bei 6.500 × g bei 4 ° C, und entfernen Sie den Überstand.
- In 750 & mgr; l kaltem Methanol und resuspendieren durch Beschallung (5 sec mit einer Sonde Beschallungsgerät).
- Zentrifugiere die Proben für 4 min bei 6.500 × g bei 4 ° C und entfernt den Überstand mit einer Spritze und Nadel.
- Wiederholen Sie Schritt 3.5.2 zweimal (Beschallung ist nicht erforderlich).
- Nach der letzten Waschung, fügen 325 ul Natriumdodecylsulfat (SDS) 2,5% in PBS zu den Proteinpellet und beschallen 3x für 5 sec.
- Erhitzen Sie die Proben für 5 min bei 65 ° C und beschallen eingewinnen.
- Zentrifuge für 5 Minuten bei 6.500 × g bei RT und den Überstand zu speichern.
- Fügen 1,4 ml PBS, die SDS-Konzentration auf 0,5% zu verdünnen. Lagerung bei -20 ° C oder mit Streptavidin Anreicherung fortzusetzen.
- Streptavidin Anreicherung
- Mit PBS, bringen das Volumen der in Schritt 3.5.8 auf 4,2 ml erhaltenen Proben. In 40 ul einer 50% igen Aufschlämmung von Streptavidin-Agarose unter Verwendung eines Cut-Endrohr (Waschen dreimal mit 1 ml PBS vor der Verwendung).
- Inkubieren für 2 h bei RT mit der Drehung und dann 2 min bei 1.400 x g zentrifugieren.
- Entfernen Sie den Überstand ohne Trocknen die Kügelchen pelletieren und Restüberstand verwenden , um die Perlen auf eine 1 - ml - Säule übertragen drehen (siehe Material / Reagenz Tabelle).
- Waschen durch die Schwerkraft mit 3x 1 ml 1% SDS (in PBS), 3x 1 ml von 6 M Harnstoff (in PBS) und 4 x 1 ml PBS.
- Verwenden 2x 500 ul PBS die Kügelchen in ein 1,5-ml-Röhrchen und Zentrifuge für 2 min bei 1400 × g bei RT zu übertragen. aspirieren Den Überstand vorsichtig mit einer Spritze und Nadel.
- Eluieren die harzgebundene Proteine , die durch 25 & mgr; l Elutionspuffer Zugabe (6 M Harnstoff, 2 M Thioharnstoff, 2% SDS und 6 mM Biotin, alle in PBS) für 15 min bei RT , gefolgt von 15 min bei 95 ° C 32.
- Protein - Blot
- Werden 5 ul 6x Laemmli - Puffer (für 9 ml: 0,5 ml 1 M Tris-HCl pH 6,8, 5 ml 20% SDS, 5 mg Bromphenolblau, 3 ml Glycerin und H 2 O bis zu 9 ml) und füge 5% β-Mercaptoethanol unmittelbar vor der Verwendung. Zentrifuge kurz die Proben bei 2000 · g zur Pelletierung der Harz und der Last 25 ul des erhaltenen Überstand in ein 4-12% Polyacrylamidgel.
- Führen Gelelektrophorese und Proteintransfer auf einer Blotting - Membran gemäß den Anweisungen des Herstellers 33.
- Sättigen die Blotting - Membran für 1 Stunde mit 10 ml eines Blockierungspuffers (siehe Material / Reagent Tabelle) , enthaltend 0,1% Tween-20.Vermeiden Sie Milch verwenden, da sie den Hintergrund zu erhöhen.
- Waschen der Membran mit 10 ml 0,05% Tween-20 in PBS und 10 ul fluoreszierendes Streptavidin hinzugefügt werden (siehe Material / Reagent Tabelle) , gelöst in 10 ml Blockierungspuffer plus 0,1% Tween-20 für 1 Stunde bei RT.
- Wasche 4 Mal mit 0,05% Tween-20 in PBS und einmal mit PBS allein (jeweils 10 min).
- Verwenden Sie einen Bildscanner (siehe Material / Reagenz Tabelle). Schalten Sie das Gerät und den angeschlossenen Computer. Warten Sie, bis bereit.
- Starten Sie das Akquisitionsprogramm und wählen Sie die Fluoreszenz-Modus. Wählen Sie die Membranfläche und wählen Sie den Zielordner für gespeicherte Dateien.
- Legen Sie die folgenden Erfassungsparameter: 680 nm Anregungslänge, BPFR700 Filter, 1.000 V Fotovervielfacherröhre (PMT) Wert (Kanal 2) und 25 & mgr; m Pixelgröße. Erwerben Sie das Bild.
4. Lokalisierung von katalytisch aktiven NAAA in der Mäuselunge durch Fluoreszenz MicrosKopieren
HINWEIS: Verwenden Sie männlich 8 bis 10 Wochen alten Mäusen und führen Sie alle Verfahren in Übereinstimmung mit den Richtlinien für die ethische Nutzung von Tieren. Hausmäuse in belüftete Käfige auf einem 12 Stunden Licht / Dunkel-Zyklus und geben ihnen freien Zugang zu Nahrung und Wasser.
- Die intravenöse Verabreichung von ARN14686 bei Mäusen
- Man löst ARN14686 im Fahrzeug: 15% PEG und 15% Tween-20 Kochsalzlösung. Berechne die Lösungskonzentration nach Mausgewicht (Dosis 3 mg / kg, Injektionsvolumen 5 ml / kg).
- Fahren Sie mit der iv-Injektion von 3 Mäusen. Platzieren Sie jede Maus in einer geeigneten Kunststoff-Rückhalteeinrichtung. Dann setzen Sie die Maus Schwanz in warmem Wasser für 2-4 min Vasodilatation zu ermöglichen und die Verbindung iv über die Schwanzvene injiziert.
- Injizieren 3 Mäuse iv mit dem Vehikel allein.
- Lung Sammlung und Scheibe Vorbereitung
Achtung: Die beim Umgang mit Paraformaldehyd Pflege in einer Abzugshaube und Handschuhe tragen!- Anesthetize Mäuse mit Chloral-Hydrat (400 mg / kg). Bestätigen Anästhesie mit einer Zehe Prise. Führen Sie eine transkardialer Perfusion wie folgt:
- schneiden Oberflächlich die Bauchhaut mit einer Schere und setzen die Brust- und Bauchfellmembranoberflächen.
- Oberflächlich betrachtet schneiden die Peritonealmembranfunktion mit einer Schere, knapp unter dem Xyphoid Prozess, und setzen die Membran und inneren Organe. Achten Sie darauf, keine signifikante Gefäßsystem zu zerfleischen.
- Öffnen der Brusthöhle durch die Membran von einer lateralen Seite zur anderen zu schneiden.
- Legen Sie die 25 G Nadel der automatisierten Spritzenpumpe verbunden ist, und 20 ml von 0,9% Kochsalzlösung von 60 ml von 4% PFA in Phosphatpuffer (0,1 M, pH 7,4) gefolgt infundieren.
- Sobald die Perfusion abgeschlossen ist, ziehen Sie das Herz einer Pinzette und sorgfältig sezieren aus. Fassen Sie die Luftröhre mit einer Pinzette und schneiden vollständig durch Schere. Ziehen Sie vorsichtig die Luftröhre nach oben und entfernen Sie die Lunge aus dem Brustkorb. Präparieren Sie das Gewebetrennen der rechten Lunge von links.
- Postfix das Gewebe in Paraformaldehyd 4% für 1 Stunde, einfrieren Proben in kaltem 2-Methyl, und lagern Sie sie bei -80 ° C.
- Sammeln Sie 40 um Abschnitte unter Verwendung eines Kryostats, montieren sie sofort auf den Folien (ein jeder fünfte), und verarbeiten sie für die Immunhistochemie wie nachfolgend beschrieben.
- Anesthetize Mäuse mit Chloral-Hydrat (400 mg / kg). Bestätigen Anästhesie mit einer Zehe Prise. Führen Sie eine transkardialer Perfusion wie folgt:
- Gewebeschnitte Permeabilisierungs und Blocking
- Waschen mit PBS (2x 5 min) und Permeabilisierung mit 0,1% Triton X-100 PBS für 15 min bei RT.
- Waschen mit PBS (2x 5 min) und der Block mit 3% Rinderserumalbumin (BSA) in PBS für 30 min bei RT.
- Waschen mit PBS (2x 5 min) und fahren Sie mit CC.
- CC mit Azid-PEG3-Fluor 545 auf Gewebeschnitten
- Bereiten Sie eine Lösung, die durch die CC Mischen der Reagenzien hergestellt, wie in Abschnitt 2 beschrieben, für 1 ml Lösung hinzu: 2 ul Azid-PEG3-Fluor 545 (5 mM Lager), 20 & mgr; l TCEP (frisch 50 mM stoc vorbereitetk), 58,8 ul TBTA (frisch 1,7 mM Arbeitslösung) hergestellt, 20 ul CuSO 4 · 5 H 2 O (50 mM Lager) und 900 ul PBS.
- In etwa 400 & mgr; l von CC-Mix in den Gewebeschnitten, die 4.2 gemäß Abschnitt hergestellt. Achten Sie darauf, dass das gewählte Volumen von CC-Mix ausreicht, um die Scheiben zu decken. Inkubation für 1 h bei RT vor Licht geschützt.
- Waschen mit PBS (1x für 5 min), kaltem Methanol (1x 5 min), einer Lösung von 1% Tween-20 und 0,5 mM EDTA in PBS (3x für 2 min), und PBS (1x für 5 min).
- Luft trocknen lassen , was einem Rückgang von Antifade mountant mit DAPI hinzufügen (siehe Material / Reagenz Tabelle), in der Nähe mit Deckgläsern (Vermeidung von Blasenbildung) und Dichtung mit Politur. Lagerung bei 4 ° C bis zur Analyse.
- image Acquisition
- Verwenden Sie ein konfokales Mikroskop mit 546 nm und 450 nm Anregungslaser (siehe Material / Reagenz Tabelle) im Anschluss andie Bedienungsanleitung.
- Wählen Sie eine 60X Objektivlinse mit NA = 1,40, so dass Sie sicher, dass die Folie durch die Okulare in der Vorschau anzeigen und auf einer Fläche von Interesse zu konzentrieren.
- Bestimmen Sie die Aufnahmeparameter entsprechend der Probe und Ausstattungsmerkmale.
Ergebnisse
ARN14686 wurde basierend auf dem Gerüst des NAAA Inhibitors ARN726 gestaltet. Das 4-butyl-cyclohexyl Gruppe von ARN726 wurde mit einem C9 gesättigte aliphatische Kette Lager ein terminales Alkin - Tag (1) substituiert. Das Alkin-Tag wurde eingeführt, um die Verwendung eines zweistufigen Markierungsverfahren zu ermöglichen, ein Fluorophor oder ein Biotin-Molekül über CC hinzuzufügen. Diese Funktion macht ARN14686 ein sehr vielseitiges Werkzeug NAAA in vitro zu untersuchen und in vivo.
Hier zeigen wir zwei Anwendungen von ARN14686, das von dem Potential dieses Moleküls repräsentativ sind. 2 ist ein Schema des experimentellen Verfahrens hier berichtet. Nach iv Verabreichung der Sonde können zwei verschiedene Nachweismethoden verwendet werden: i) Analyse der aktiven NAAA Expression von Protein-Blot und ii) Analyse der aktiven NAAA Expression und Lokalisation innerhalb der Zellen durch fluorescence Mikroskopie.
Der erste Vertreter Ergebnis wurde vor kurzem von unserer Gruppe 29 veröffentlicht. Wir analysierten NAAA Expression in einem Rattenmodell der CFA-induzierte Pfotenentzündung. Die Sonde (3 mg / kg) oder Vehikel wurden iv in naiven und injizierte CFA behandelten Ratten. Die Ratten wurden 4 Stunden später geopfert. CC wurde auf angereicherte lysosomalen Extrakte führten eine Biotin-Tag auf die Sonden-markierte Proteine einzuführen. Biotinylierte Proteine wurden als nächstes angereichert Streptavidinkügelchen verwenden. Die eluierten Proteine wurden durch Protein - Blot analysiert, die zeigen , dass das Niveau der aktiven NAAA wurden in die Pfoten von Ratten , die mit CFA relativ zu denen der Kontrollratten (3) behandelt , deutlich erhöht. Der Vorteil der Protein-Blot-Analyse ist, dass es eine genaue Prüfung der Sonde reaktiven Proteoms ermöglicht, die durch Gelelektrophorese aufgetrennt wird. Dieser Ansatz ermöglicht es auch für die Enthüllung der Potentialsonde off-Ziele. A no-Sondensteuerung muss al seinWege enthalten, um endogene biotinylierte Proteine auszuschließen, die den experimentellen Hintergrund bilden. Die Pfeilspitze in Figur 3 zeigt eine solche Hintergrundproteine, die wiederum als Ladereferenzkontrolle verwendet werden.
In einem zweiten Experiment nicht veröffentlichten (Abbildung 4), haben wir ARN14686 NAAA Sonde für ex - vivo - Nachweis durch Fluoreszenzmikroskopie. Wir verabreichten ARN14686 an Mäuse bei 3 mg / kg (iv) und geopfert sie 2 Stunden nach der Behandlung durch transcardial Perfusion. Lungs wurden gesammelt, nachgestellt und in kaltem 2-metylbutane gefroren. Die CC-Reaktion für Fluorophore Zugabe wurde direkt auf Gewebeschnitten von 40 & mgr; m Dicke ausgeführt, mit einem Kryostaten gesammelt. Analyse durch Fluoreszenzmikroskopie zeigten die Gegenwart von katalytisch aktiven NAAA in diffusem vesikulären Strukturen zu Alveolarmakrophagen gehören. Im Vergleich zu der Verwendung eines Protein-spezifischen Antikörpers, nur die einective Enzym beobachtet.
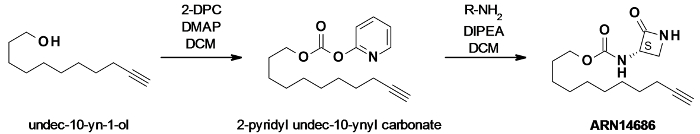
Abb . 1: ARN14686 Synthesereaktionsschema undec-10-yn-2-ol durch dipyridylcarbonate (DPC) in Gegenwart von katalytischen 4-Dimethylaminopyridin (DMAP) aktiviert wurde ein gemischtes Carbonat zu erzeugen. Das Carbonat wurde dann umgesetzt mit dem Amino - Lactam das Zielmolekül ARN14686. Zu erhalten Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
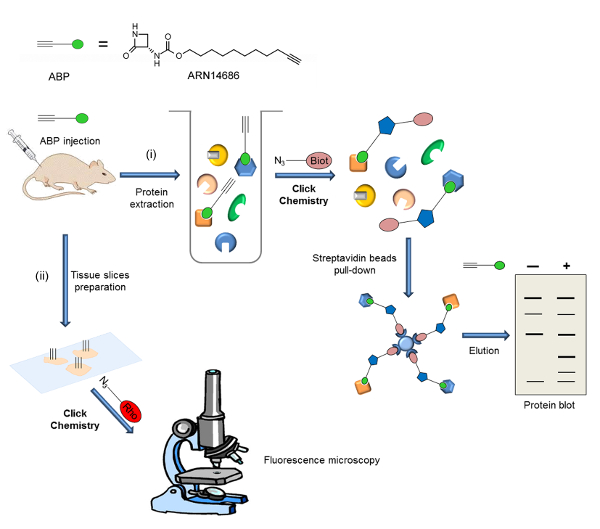
Abbildung 2:. Workflow - Schema der allgemeinen Strategie in der vorliegenden Arbeit gezeigt , dass die Sonde in Tieren (Ratten oder Mäusen) injiziert wird , und Ziel ist Ausdruck nach zwei verschiedenen experimentellen Verfahren analysierts: i) Das markierte Proteom wird extrahiert und Biotin wird durch CC hinzugefügt. Nach einer Anreicherungsphase von biotinylierten Proteinen auf Streptavidin-Kügelchen, Sonde Ziele werden durch Protein-Blot analysiert. ii) Gewebeschnitte hergestellt und ein Fluorophor wird durch CC hinzugefügt. Sonde Ziel Lokalisierung wird durch Fluoreszenz-Mikroskopie analysiert. Diese Zahl wurde von Bonezzi et al angepasst. 29 Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
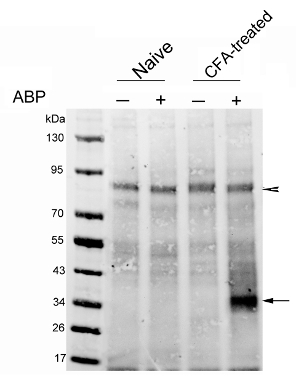
Abb . 3: Analyse von NAAA Aktivierung in die Pfoten von CFA behandelten Ratten Protein - Blot - Analyse von Streptavidin angereicherten Proteine aus naiven Ratten (Spuren 1 und 2) oder CFA-injizierten Ratten 7 Tage nach der Injektion (Spuren 3 und 4). Ratten erhielten iv-Injektionen von Fahrzeug oder ARN14686 (3 mg / kg). Die Blotting-Membranwurde mit einem fluoreszierenden Streptavidin sondiert. Der Pfeil zeigt die NAAA Band; die Pfeilspitze zeigt ein Biotin- enthaltenden Bande von etwa 90 kDa, dass eine ähnliche Menge an Protein zeigt, wurde in jede Spur geladen. Diese Zahl wurde von Bonezzi et al modifiziert. 29 Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 4: Ex vivo Detektion von Sonde-markierte NAAA in Mauslungen durch Fluoreszenzmikroskopie Repräsentative Bilder der Lungenschnitte von fahrzeug- (A) oder ARN14686-injizierten (B) Mäusen nach der CC mit Azid-PEG3-Fluor 545 gemeldet werden.. Ein positives Signal (rote Blutkörperchen) wurde in ARN14686-injizierten Mäusen nachgewiesen, während kein Signal in v erkannt wurdeehicle behandelten Mäuse. Ein Ausschnitt aus einem Azid-PEG3-Fluor 545 positive Alveolarmakrophage wird bei höherer Vergrößerung in C gezeigt. Die Kerne wurden mit DAPI (blau) markiert. Maßstabsbalken = 50 & mgr; m in A und 10 & mgr; m in C. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Die Enzymaktivität wird auf verschiedenen Ebenen fein reguliert, einschließlich RNA-Transkription, Proteinsynthese, Protein Translokation, post-translationale Modifikation und Protein-Protein-Wechselwirkung. Oft allein Enzym-Expression nicht für seine Tätigkeit ausmachen. ABPP wurde die Aktivität von Proteinen in ihrem nativen Zustand zu studieren entwickelt. Zwei Merkmale sind erforderlich: eine chemische Sonde, die kovalent bindet an die aktive Stelle eines Enzyms von Interesse und einem Reporter-Tag die Sonde-markierte Enzym zu detektieren.
Probe Design und die Synthese sind die kritischen Punkte des Verfahrens. Die Sonde muss eine ausreichende Affinität und Selektivität für sein Ziel. Darüber hinaus wirken sich auf das Vorhandensein eines Reporter-Tag darf nicht Engagement zielen. Dieses Problem wird durch die Gestaltung eines zweistufigen ABP, in denen die Reporter-Tag eingebracht wird, nachdem das Ziel abgefangen wurde weitgehend überwunden. Tag freien Sonden sind besonders geeignet für die in - vivo - Studien, in denen die Proteinaktivitätin einer lebenden Zelle oder eines Organismus ausgewertet werden, mit minimalen externen Veränderung kann. Die NAAA Sonde ARN14686 wurde entwickelt, um die oben genannten Anforderungen zu erfüllen. Die β-Lactam - reaktiven Gefechtskopf wurde auf Basis von früheren Ergebnissen mit dem β-Lactam - Klasse von NAAA Inhibitoren 16,26 erhalten gewählt. Diese Verbindungen hemmen NAAA in ein potenter und selektiver Weise durch kovalent an das katalytische Cystein des Enzyms binden. Darüber hinaus wurden die Verbindungen systemisch wirksam 16 erwiesen. Wir führten eine C9 gesättigte aliphatische Kette, unter Berücksichtigung der erhöhten Affinität von NAAA für lange aliphatische Ketten. Ein terminales Alkin wurde hinzugefügt für zweistufigen Kennzeichnung zu erlauben.
Ein weiterer wichtiger Schritt ist die Auswahl der Dosis und die Zeit für die in vivo Verabreichung. Dies hängt von der Stabilität der Sonde in Plasma, die Zielaffinität und seine Selektivität. Die richtige Dosis muss gewählt werden, für die Zielerfassung zu ermöglichen, während Engagement von po vermeidenssible off-Ziele. Wir fanden, dass 3 mg / kg iv ARN14686 optimal war selektiv zu erfassen NAAA. Höhere Dosen führten zur Erfassung des homologe Cystein-Amidase, sauren Ceramidase. Im Hinblick auf die Behandlungsdauer bei der Analyse gut durchbluteten Organen, wie Lunge, eine kurze Zeit (2 h), kann ausreichend sein für die Sonde zu ermöglichen, mit dem Ziel zu reagieren. Für Pfoten jedoch waren wir verpflichtet, die Reaktionszeit zu verdoppeln.
Ein mögliches Problem in Zielanalyse von Protein-Blot ist auf die Anwesenheit von natürlich biotinylierten Proteinen durch. Diese werden zwangsläufig identifiziert werden zusammen mit spezifischen Sonde Ziele. Wir fanden heraus, dass ein Preclearing Schritt mit Streptavidinkügelchen Einführung vor CC stark die Qualität der Ergebnisse der Durchführung erhöht. Auf der anderen Seite könnte das Vorhandensein von nativen biotinylierten Proteine verwendet werden für mögliche Lade Artefakte zu steuern. Schließlich bezüglich Lokalisationsstudien durch Fluoreszenzmikroskopie, ist es sehr wichtig, sich bewusst zu sein probe Selektivität, da, im Gegensatz zu Protein-Blots, Fluoreszenzmikroskopie nicht die Unterscheidung des Ziels von off-Ziele ermöglichen. Vorläufige Selektivität Studien sollten Machbarkeit zu bewerten durchgeführt werden und eine optimale Versuchsbedingungen einzurichten.
Einschränkungen der beschriebenen Technik hauptsächlich auf die Notwendigkeit beziehen experimentellen Bedingungen zu vermeiden, die den CC-Reaktion, wie die Verwendung von Wasch- und aminhaltigen Puffer beeinflussen können. Diese Aspekte müssen aufgenommen werden, zu berücksichtigen, wenn ein Zelllysat oder ein Gewebehomogenat vorbereitet. Wenn darüber hinaus eine Streptavidin Anreicherungsphase erforderlich ist, die Menge an Ausgangsmaterial stellt ein weiteres Problem, da dieses Verfahren nur anwendbar ist, wenn der Proteingehalt nicht weniger als 250 & mgr; g ist. Diese Grenze ist aufgrund von technischen Problemen, wie zum Beispiel Arbeitsvolumen, Proteingewinnung, nach CC-induzierte Fällung, und die Menge an Streptavidin-Harz verwendet werden.
Previously, NAAA Aktivität nur durch Ausführen Aktivitätsassays ausgewertet werden konnten, die für die in vitro Aktivierung des Enzyms die Verwendung eines Aktivierungspuffer erfordern und für die Substrat Solubilisierung 14. Dieser Ansatz liefert Informationen über den Gesamt NAAA Ausdruck, nicht über das Vorhandensein von aktiven NAAA. Eine andere Möglichkeit ist , um Gewebespiegel von PEA und OEA messen, aber dieses Verfahren stellt nur einen indirekten Weg NAAA Aktivität 34,35 zu bewerten. Zusätzlich kann FAE Ebenen durch andere Faktoren wie Biosynthese beeinflussen. Die chemische Sonde ARN14686 ist die erste ABP für NAAA. Das hier beschriebene Protokoll veranschaulicht ein einfaches Verfahren für die Erfassung und die aktive Form von NAAA Visualisierung sowohl in vitro als auch in vivo. Alle Proben Manipulationen sind im Anschluss an Sonden-Target - Reaktionen, so dass zuverlässige Informationen über die in vivo Zustand des Enzyms zu geben. Außerdem stellt die Verwendung von ARN14686 in der Fluoreszenzmikroskopie ein einzigartiges Werkzeug to lokalisieren aktive NAAA. Verfügbare Antikörper, die die NAAA katalytische Untereinheit erkennen, unterscheiden nicht zwischen dem NAAA voller Länge Proenzym und das aktive Enzym.
Ausgehend von dem hier beschriebenen Protokoll, NAAA Expression und Aktivierung kann in verschiedenen Zelllinien und Tiermodellen der Entzündung untersucht werden. Co-Lokalisationsstudien kann besser durchgeführt werden, um die Rolle von NAAA in physiologischen und pathologischen Bedingungen charakterisieren.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors thank the Nikon Imaging Center at Istituto Italiano di Tecnologia, Genova, Italy (NIC@IIT).
Materialien
| Name | Company | Catalog Number | Comments |
| 1,1’-sulfonyldiimidazole | Sigma Aldrich | 367818 | Harmful |
| 2-dipyridylcarbonate | Fluorochem | 11331 | Harmful |
| 2-Methylbutan | Sigma Aldrich | M32631 | Flamable, toxic,hazardous to the aquatic environment |
| 4-(Dimethylamino)pyridine | Sigma Aldrich | 107700 | Toxic |
| Acetic acid | Sigma Aldrich | 695092 | Flammable, Corrosive |
| Acetonitrile | Sigma Aldrich | 34998 | Flammable, Toxic |
| Activated charcoal | Sigma Aldrich | 161551 | |
| Ammonium chloride | Sigma Aldrich | A9434 | Harmful |
| Azide-PEG3-Biotin | Jena Biosciences | CLK-AZ104P4 | |
| Azide-PEG3-Fluor 545 | Jena Biosciences | CLK-AZ109 | |
| BCA protein assay kit | Thermo Fisher Scientific | 23227 | |
| Bio-spin columns | Biorad | 732-6204 | |
| Biotin | Sigma Aldrich | B4501 | |
| Blocking buffer | Li-Cor Biosciences | 927-40000 | |
| β-mercaptoethanol | Sigma Aldrich | M6250 | Higly toxic |
| Bovin serum albumine (BSA) | Sigma Aldrich | A7030 | |
| Bromophenol blue | Sigma Aldrich | B0126 | |
| Bruker Avance III 400 | Bruker | ||
| Celite | Sigma Aldrich | 419931 | Health hazard |
| Ceric ammonium nitrate | Sigma Aldrich | 22249 | Oxidizing, Harmful |
| Chloral hydrate | Sigma Aldrich | C8383 | Higly toxic |
| CuSO4.5H2O | Sigma Aldrich | 209198 | Toxic |
| Cyclohexadiene | Sigma Aldrich | 125415 | Flammable, Health hazard |
| Cyclohexane | Sigma Aldrich | 34855 | Flammable, Harmful, Health hazard, Environmental hazard |
| Dichloromethane | Sigma Aldrich | 34856 | Harmful, Health hazard |
| Diethyl ether | Sigma Aldrich | 296082 | Flammable, Harmful |
| Dimethyl sulfoxide (DMSO) | Acros Organics | 348441000 | |
| Dimethyl sulfoxide d6 (DMSO-d6) | Sigma Aldrich | 175943 | |
| Ethanol | Sigma Aldrich | 2860 | Flammable, Harmful |
| Ethyl acetate | Sigma Aldrich | 34858 | Flammable, Harmful |
| Glycerol | Sigma Aldrich | G5516 | |
| Irdye 680-LT Streptavidin | Li-Cor Biosciences | 925-68031 | |
| IRDye680-LT Streptavidin | Licor | 925-68031 | Briefly centrifuge before use to precipitate protein complexes |
| Methanol | Sigma Aldrich | 34966 | Highly toxic |
| Methanol | Sigma Aldrich | 34860 | Flammable, Toxic, Health hazard |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride | Sigma Aldrich | E7750 | Harmful, Corrosive |
| N,N-diisopropylethylamine | Sigma Aldrich | D125806 | Flammable, Corrosive, Toxic |
| N,N-dimethylformamide | Sigma Aldrich | 227056 | Flammable, Harmful, Health hazard |
| N-Cbz-L-Serine | Fluorochem | M03053 | Harmful |
| Nikon A1 confocal microscopy | Nikon | Read the user manual | |
| NuPAGE 4-12% Bis-Tris gel | Thermo Fisher Scientific | NP0335BOX | |
| Palladium on carbon | Sigma Aldrich | 330108 | |
| p-anisidine | Sigma Aldrich | A88255 | Toxic, Health hazard, Environmental hazard |
| Paraformaldehyde | sigma Aldrich | 441244 | Toxic, respiratory harmful, corrosive, falmable |
| Poly(ethylene glycol) | Sigma Aldrich | P3265 | |
| ProLong Gold antifade mountant with DAPI | Thermo Fisher Scientific | P36931 | Avoid bubbles formation |
| Protease inhibitor cocktail | Sigma Aldrich | P8340 | |
| Sodium bicarbonate | Sigma Aldrich | S6014 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | L3771 | Toxic, corrosive, falmmable |
| Sodium hydride | Sigma Aldrich | 452912 | Flammable |
| Sodium sulfate | Sigma Aldrich | 239313 | |
| Starion FLA-9000 immage scanner | FUJIFILM | Read the user manual | |
| Streptavidin agarose | Thermo Fisher Scientific | 20349 | |
| Sucrose | Sigma Aldrich | S7903 | |
| Tert-butanol | Sigma Aldrich | 360538 | Toxic, flammable |
| Tetrahydrofuran | Sigma Aldrich | 186562 | Flammable, Harmful, Health hazard |
| Thiourea | Acros Organics | 424542500 | Toxic, warm at 50 °C to dissolve |
| Tris | Sigma Aldrich | RDD008 | |
| Tris(2-carboxyethyl)phosphine (TCEP) | Sigma Aldrich | C4706 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Sigma Aldrich | 678937 | |
| Triton-x100 | Sigma Aldrich | X100 | Toxic |
| Tween-20 | Sigma Aldrich | P9416 | |
| Tween-80 | Sigma Aldrich | P1754 | |
| Ultra turrax IKA T18 basic tissue homogenizer | IKA | ||
| Undec-10-yn-1-ol | Fluorochem | 13739 | Harmful |
| Urea | Sigma Aldrich | U5378 | Toxic, warm at 50 °C to dissolve |
Referenzen
- Gygi, S. P., Han, D. K., Gingras, A. C., Sonenberg, N., Aebersold, R. Protein analysis by mass spectrometry and sequence database searching: tools for cancer research in the post-genomic era. Electrophoresis. 20, 310-319 (1999).
- Washburn, M. P., Wolters, D., Yates, J. R. Large-scale analysis of the yeast proteome by multidimensional protein identification technology. Nat Biotechnol. 19, 242-247 (2001).
- Zhu, H., Bilgin, M., Snyder, M. Proteomics. Annu Rev Biochem. 72, 783-812 (2003).
- Ito, T., et al. Roles for the two-hybrid system in exploration of the yeast protein interactome. Mol Cell Proteomics. 1, 561-566 (2002).
- Evans, M. J., Cravatt, B. F. Mechanism-based profiling of enzyme families. Chem Rev. 106, 3279-3301 (2006).
- Cravatt, B. F., Wright, A. T., Kozarich, J. W. Activity-based protein profiling: from enzyme chemistry to proteomic chemistry. Annu Rev Biochem. 77, 383-414 (2008).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew Chem Int Ed Engl. 41, 2596-2599 (2002).
- Meldal, M., Tornoe, C. W. Cu-catalyzed azide-alkyne cycloaddition. Chem Rev. 108, 2952-3015 (2008).
- Speers, A. E., Adam, G. C., Cravatt, B. F. Activity-based protein profiling in vivo using a copper(i)-catalyzed azide-alkyne [3 + 2] cycloaddition. J Am Chem Soc. 125, 4686-4687 (2003).
- Saxon, E., Bertozzi, C. R. Cell surface engineering by a modified Staudinger reaction. Science. 287, 2007-2010 (2000).
- Kohn, M., Breinbauer, R. The Staudinger ligation-a gift to chemical biology. Angew Chem Int Ed Engl. 43, 3106-3116 (2004).
- Romeo, E., et al. Activity-Based Probe for N-Acylethanolamine Acid Amidase. ACS Chem Biol. 10, 2057-2064 (2015).
- Ueda, N., Yamanaka, K., Yamamoto, S. Purification and characterization of an acid amidase selective for N-palmitoylethanolamine, a putative endogenous anti-inflammatory substance. J Biol Chem. 276, 35552-35557 (2001).
- Tsuboi, K., et al. Molecular characterization of N-acylethanolamine-hydrolyzing acid amidase, a novel member of the choloylglycine hydrolase family with structural and functional similarity to acid ceramidase. J Biol Chem. 280, 11082-11092 (2005).
- Tsuboi, K., Takezaki, N., Ueda, N. The N-acylethanolamine-hydrolyzing acid amidase (NAAA). Chem Biodivers. 4, 1914-1925 (2007).
- Ribeiro, A., et al. A Potent Systemically Active N-Acylethanolamine Acid Amidase Inhibitor that Suppresses Inflammation and Human Macrophage Activation. ACS Chem Biol. 10, 1838-1846 (2015).
- Zhao, L. Y., Tsuboi, K., Okamoto, Y., Nagahata, S., Ueda, N. Proteolytic activation and glycosylation of N-acylethanolamine-hydrolyzing acid amidase, a lysosomal enzyme involved in the endocannabinoid metabolism. Biochim Biophys Acta. 1771, 1397-1405 (2007).
- Wang, J., et al. Amino acid residues crucial in pH regulation and proteolytic activation of N-acylethanolamine-hydrolyzing acid amidase. Biochim Biophys Acta. 1781, 710-717 (2008).
- West, J. M., Zvonok, N., Whitten, K. M., Wood, J. T., Makriyannis, A. Mass spectrometric characterization of human N-acylethanolamine-hydrolyzing acid amidase. J Proteome Res. 11, 972-981 (2012).
- Bandiera, T., Ponzano, S., Piomelli, D. Advances in the discovery of N-acylethanolamine acid amidase inhibitors. Pharmacol Res. 86, 11-17 (2014).
- Sasso, O., et al. Antinociceptive effects of the N-acylethanolamine acid amidase inhibitor ARN077 in rodent pain models. Pain. 154, 350-360 (2013).
- Duranti, A., et al. N-(2-oxo-3-oxetanyl)carbamic acid esters as N-acylethanolamine acid amidase inhibitors: synthesis and structure-activity and structure-property relationships. J Med Chem. 55, 4824-4836 (2012).
- Ponzano, S., et al. Synthesis and structure-activity relationship (SAR) of 2-methyl-4-oxo-3-oxetanylcarbamic acid esters, a class of potent N-acylethanolamine acid amidase (NAAA) inhibitors. J Med Chem. 56, 6917-6934 (2013).
- Solorzano, C., et al. Synthesis and structure-activity relationships of N-(2-oxo-3-oxetanyl)amides as N-acylethanolamine-hydrolyzing acid amidase inhibitors. J Med Chem. 53, 5770-5781 (2010).
- Vitale, R., et al. Synthesis, structure-activity, and structure-stability relationships of 2-substituted-N-(4-oxo-3-oxetanyl) N-acylethanolamine acid amidase (NAAA) inhibitors. ChemMedChem 9. 9, 323-336 (2014).
- Fiasella, A., et al. 3-Aminoazetidin-2-one derivatives as N-acylethanolamine acid amidase (NAAA) inhibitors suitable for systemic administration. ChemMedChem 9. 9, 1602-1614 (2014).
- Armirotti, A., et al. beta-Lactones Inhibit N-acylethanolamine Acid Amidase by S-Acylation of the Catalytic N-Terminal Cysteine. ACS Med Chem Lett. 3, 422-426 (2012).
- Nuzzi, A., et al. Potent alpha-amino-beta-lactam carbamic acid ester as NAAA inhibitors. Synthesis and structure-activity relationship (SAR) studies. Eur J Med Chem. 111, 138-159 (2016).
- Bonezzi, F. T., et al. An Important Role for N-Acylethanolamine Acid Amidase in the Complete Freund's Adjuvant Rat Model of Arthritis. J Pharmacol Exp Ther. 356, 656-663 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150, 76-85 (1985).
- Speers, A. E., Cravatt, B. F. Activity-Based Protein Profiling (ABPP) and Click Chemistry (CC)-ABPP by MudPIT Mass Spectrometry. Curr Protoc Chem Biol. 1, 29-41 (2009).
- Rybak, J. N., Scheurer, S. B., Neri, D., Elia, G. Purification of biotinylated proteins on streptavidin resin: a protocol for quantitative elution. Proteomics. 4, 2296-2299 (2004).
- Penna, A., Cahalan, M. Western Blotting using the Invitrogen NuPage Novex Bis Tris minigels. J Vis Exp. (264), (2007).
- Giuffrida, A., Piomelli, D. Isotope dilution GC/MS determination of anandamide and other fatty acylethanolamides in rat blood plasma. FEBS Lett. 422, 373-376 (1998).
- Buczynski, M. W., Parsons, L. H. Quantification of brain endocannabinoid levels: methods, interpretations and pitfalls. Br J Pharmacol. 160, 423-442 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten