Method Article
調製と
要約
ここでは、アクティビティベースのプローブの調製および使用を記載する(ARN14686、ウンデカ-10- ynyl- N - [(3 S)-2-オキソアゼチジン-3-イル]カルバメート)の検出および定量を可能にします前炎症性酵素Nの活性形態は、in vitroおよびex vivoの両方、酸アミダーゼ(NAAA)を-acylethanolamine。
要約
活性に基づくタンパク質プロファイリング(ABPP)は、酵素の活性部位を標的とする化学的プローブの使用を介して複雑なプロテオームにおける目的の酵素を同定するための方法です。プローブに導入されたレポータータグは、ゲル内蛍光スキャニング、タンパク質ブロット、蛍光顕微鏡、または液体クロマトグラフィー - 質量分析法による酵素標識の検出を可能にします。ここでは、化合物のARN14686、選択的にNが酸アミダーゼ(NAAA)を-acylethanolamine酵素を認識し、クリックケミストリーアクティビティベースのプローブ(CC-ABP)の製造および使用を記載します。 NAAAは、パルミトイルエタノールアミド(PEA)及びオレオイルエタノールアミド(OEA)などの内因性ペルオキシソーム増殖因子活性化受容体(PPAR) - アルファアゴニストを非活性化することによって炎症を促進するシステイン加水分解酵素です。 NAAAは、リソソームの酸性pHで自己タンパク質分解によって活性化される不活性な完全長プロ酵素として合成されます。ローカリゼーション研究の時間AVEは、NAAAは、主にマクロファージおよび他の単球由来細胞における、並びにBリンパ球で発現されることを示します。我々はARN14686タンパク質ブロット、蛍光顕微鏡によりげっ歯類組織において活性NAAA エクスビボの検出および定量化するために使用できる方法の例を提供します。
概要
一般的に使用される発現パターン、相互作用、及びショットガン分析1,2のための液体クロマトグラフィー-質量分析プラットフォームを含むタンパク質の機能を調査する方法、酵母ツーハイブリッド法3,4、およびインビトロアッセイにおいて 、それらがあることで制限されていますその天然の状態でタンパク質の活性を評価することができません。活性に基づくタンパク質プロファイリング(ABPP)は、このギャップを埋めるために使用することができます。このアプローチでは、共有結合的に目的の酵素の活性部位に結合することができる小分子プローブは、標的検出を可能にするレポーター基に結合しています。クリックケミストリー(CC)を使用して、レポータープローブに組み込むことができ、または標的係合5,6を発生した後に導入することができます。後者の手順は、SUCバイオ直交反応を介してレポーター試薬の数に変更することができ、そのような末端アルキンまたはアジドなどの適切な化学基を含有するプローブの使用を必要としますCu(I)などのhはヒュイゲン[3 + 2]環7-9またはシュタウディンガーライゲーション10,11 -触媒。
最近、我々は、in vitroでの最初のABPとしてシステイン加水分解酵素、NAAA 12のインビボでの検出中の化合物ARN14686を開示しました。 NAAAは、抗炎症性核内受容体PPAR-α13-15の内因性アゴニストであるオレオイルエタノールアミド(OEA)とパルミトイルエタノールアミド(PEA)を含む飽和および一価不飽和のFAE、の加水分解不活性化を触媒します。 NAAAは、主に先天性免疫応答の調節における役割を示唆し、ならびにBリンパ球14,16のように、マクロファージおよび他の単球由来細胞において発現されます。酵素は不活性型の粗面小胞体で合成され、自己タンパク質分解機構17によって、細胞の酸性区画において活性化されます。自己タンパク質分解切断は、新しいN末端システイン(C13を生成し、マウスおよびラットにおける1、ヒトにおけるC126)、すなわちFAE加水分解18,19のための求核責任があります。 NAAA活性の薬理学的阻害は、のFAE 16,20,21の増加細胞レベルの賛成でFAE合成/分解のバランスを変化させます。いくつかのβラクトンおよびβラクタム誘導体は高い効力および選択16,22-26でNAAA活性を阻害することが示されています。これらの阻害剤は、触媒システイン16,27,28 のS -acylationを介して作用します。
( - [(S)-2-オキソアゼチジン-3-イル]カルバミン酸4- cyclohexylbutyl- N)16化合物ARN14686は全身活性、セリン由来βラクタムNAAA阻害剤の化学構造、ARN726に基づいて設計しました。 ARN726の4-t-ブチルシクロヘキシル基は、アジドベアリングレポータータグとその後のCCのコンジュゲートのための末端アルキンタグを担持するC9飽和脂肪族鎖で置換しました。私たちは、minimallに2段階のABPを設計することにしましたyはこのようにNAAAに対するプローブの親和性を維持し、元の足場の構造を変更します。また、かさばるタグの導入を避け、そのようなプローブは、直接ABPよりin vivoでの治療のためのより適切である可能性があります。 ARN14686は、酵素12の触媒システインと共有結合付加物を形成することにより、高い効力を有するNAAA(hNAAA IC 50 = 6 nMで、rNAAA IC 50 = 13 nM)を阻害します。生きたラットの実験では、プローブは、NAAAは肺で発現撮影において選択的であることが示されました。高いプローブ濃度( インビトロでの 10μM、10ミリグラム/静脈、静脈ミリリットル)12を使用する際に酸セラミダーゼ、NAAAと33-34%の同一性を共有する他のシステインアミダーゼは、低親和性標的として同定されました。我々はまた、完全フロイントアジュバント(CFA)29の投与後の炎症を起こしたラット組織における活性NAAAの存在を研究するためにARN14686を使用しています。
ここでは、preparatiためのプロトコルの概要を説明します( 図1)及びex vivoで NAAA活性化の調査への応用ARN14686の上。例として、我々は、CFA投与後のラットの足でNAAAを可視化する実験手順を説明します。この実験では、タンパク質は、プローブの静脈注射後の足の組織から抽出され、ABP標識プロテオームは、ビオチンアジドとCCに供されます。ビオチン化されたサンプルは、ストレプトアビジンビーズを使用して濃縮され、そしてタンパク質ブロットが行われます。別のアプリケーションでは、我々は、プローブ処置マウスからのマウスの肺における蛍光顕微鏡により活性NAAAの局在化を説明します。この場合には、組織を切片化し、切片をローダミン添加用CCに供されます。ワークフロー方式は、図2に示されています。
プロトコル
注意:すべての化学反応は、換気ドラフト中や白衣、手袋、保護用眼鏡を使用して行われるべきです。反応はまた、窒素環境下で行われるべきです。
倫理的な声明:動物を伴う私たちの手順は、実験や他の科学的な目的(DM 116192)、および欧州経済共同体の規制のために使用される動物の保護に関するイタリアの規則に従って行われている(OJ EC Lの1分の358 1986年12月18日)。
注:の合成[(3 S)-2-オキソアゼチジン-3-イル]酢酸アンモニウムは、大規模な収率(N -Cbz-L-セリン50gの)について記載されているが、それは容易に縮小することができます。
1.合成
注:合成反応スキームについては、 図1を参照してください。
- 2-ピリジルウンデカ-10-イニルカーボネートおよびウンデカ-10-イニル2-オキソピリジン-1-カルボキシレートの調製
- 50mLの丸底フラスコに、undec-の350 mgの溶解10-YN-1オール乾燥ジクロロメタン3.5ミリリットルインチ
- 1.1.1で溶液に、4-ジメチルアミノピリジン(DMAP)と2-dipyridylcarbonate(DPC)の530 mgの25mgを追加します。 16時間室温(RT)で混合物を撹拌しました。
- ジクロロメタン20mlを追加します。
- 分液漏斗に混合物を転送します。水15mlを加え、それを振ると、2つの相を分離することができます。
- 、コックを開いて、有機相(下)を収集し、その後コックを閉じます。飽和NaHCO 3溶液の15ミリリットルを追加します。分液ロートを振ると、2相を分離しましょう。このステップをさらに2回繰り返します。
- し、Na 2 SO 4で有機層を乾燥丸底フラスコ(風袋最初)に綿を通して濾過し、そして減圧(回転蒸発器)の下で乾燥するまで蒸発させます。
- フラスコを秤量し、2-ピリジルウンデカ10イニル、炭酸ウンデカ10イニル1.7の比率で2-オキソピリジン-1-カルボキシレートの混合物である油の600 mgを得る:1。
1 H NMR(400 MHzの、DMSO-dの6)主要成分δ= 8.39(ddの、J = 5.0、2.0、1H)、7.98(tdの、J = 7.9、2.0、1H)、7.40(dddの、J = 7.2、 4.9、0.9、1H)、7.30(D、J = 8.2、1H)、4.22(T、J = 6.6、2H)、2.73(T、J = 2.4、1H)、2.18から2.11(メートル、2H)、1.76 - 1.62(M、2H)、1.50 - 1.23(M、12H)。
1 H NMR(400 MHzの、DMSO-dの6)微量成分δ= 7.74(ddの、J = 7.2、1.9、1H)、7.47(ddの、J = 6.7、2.3、1H)、6.44(D、J = 9.4、 1H)、6.30から6.25(メートル、1H)、4.35(T、J = 6.5、2H)、2.72(T、J = 2.4、1H)、2.18から2.11(メートル、2H)、1.77から1.60(メートル、2H )1.52 - 1.20(M、12H)。 - 任意のさらなる分離または精製することなく、オイルを使用してください。
- [(3 S)-2-オキソアゼチジン-3-イル]酢酸アンモニウムの調製
- ベンジルNの調製- [(S)-1-(ヒドロキシメチル)-2 - [(4-メトキシフェニル)アミノ] -2- oxoethイル]カルバミン酸。
- 4-L丸底フラスコに、テトラヒドロフラン、ジクロロメタンの0.5 Lの1.5 L のP -anisidineの141.5グラムを溶解します。
- 氷浴中で0℃に溶液を冷却します。
- N -Cbz-L-セリン50.0gのを追加し、N 43.9 - G(3-ジメチルアミノプロピル) - N 'エチルカルボジイミド塩酸塩。
- 0℃で30分間磁気棒との混合物を撹拌しました。
- 氷浴から溶液を除去し、16時間室温で磁気棒でかき混ぜます。
- 減圧下(回転蒸発器)下で溶媒を蒸発させます。
- へらでかき混ぜ、1シクロヘキサン/酢酸エチル、およびデカント:1の400ミリリットルを追加します。
- 手順を繰り返し1.2.1.7 2回以上。
- 酢酸エチル500mlにゴム状残留物を溶解し、飽和NaHCO 3溶液(2回)の400mlで、0.1 M HCl溶液(10倍)400mlで洗浄し、ブライン400mLで。
- 有機層を乾燥Na 2 SO 4、丸底フラスコ(風袋最初)に綿を通して溶液を濾過し、減圧下(ロータリーエバポレーター)下で乾燥して蒸発させます。
- フラスコを計量し、白色固体の61.4グラムを得ます。
1 H NMR(400 MHzの、DMSO-dを6)δ= 9.86(BS、1H)、7.52(D、2H、J = 9.0 Hz)と、7.42から7.25(M、6H)、6.91から6.85(M、2H) 、5.06(D、1H、J = 12.9 Hz)で、5.02の(d、1H、J = 12.9 Hz)で、4.98(T、1H、J = 5.6 Hz)と、4.24から4.15(M、1H)、3.72(S、 3H)、3.70から3.57(メートル、2H)。
- ベンジルNの調製- [(S)-1-(4-メトキシフェニル)-2-オキソ-アゼチジン-3-イル]カルバメート。
- N 58.6グラム溶解- [(S)-1-(ヒドロキシメチル)-2 - [(4-メトキシフェニル)アミノ] -2-オキソ-エチル]カルバミン酸N、N-ジメチルホルムアミドの1.6 Lです。
- 氷浴で0℃にソリューションを冷却します。
- 1,1'- sulfonyldiimidazoleの50.6グラムを加え、30分間磁気棒でかき混ぜます。
- ソリューションをクール氷/塩化ナトリウム浴で-20℃にし、水素化ナトリウムの10.2グラム(鉱油中60%)を少量ずつを追加します。
- 1時間-20℃で混合物を撹拌し、次いでメタノール2ml及び水1Lでクエンチしました。
- 真空は、沈殿物をフィルタリングし、200mlの水で洗浄し、そして真空下で乾燥しました。
- 白色固体の42.2グラムを取得します。
1 H NMR(400 MHzの、DMSO-dの6)δ= 8.08の(d、1H、J = 8.5 Hz)で、7.42から7.28(メートル、5H)、7.30(D、2H、J = 8.9 Hz)で、6.95の(d 、2H、J = 8.9ヘルツ)、5.06(S、2H)、4.86(DDD、1H、J = 8.5、5.6、2.6ヘルツ)、3.90(T、1H、J = 5.6ヘルツ)、3.73(S、3H) 、3.55(ddの、1H、J = 5.6、2.6ヘルツ)。
- ベンジルNの調製- [(S)-2-オキソアゼチジン-3-イル]カルバメート。
- ベンジルN 9.0gのサスペンド- [(S)-1-(4-メトキシフェニル)-2-オキソアゼチジン-3-イル]カルバメートアセトニトリルを500mlと水400mlです。
- 氷浴中で0℃に溶液を冷却します。
- CERIの45.4グラムを追加します。C硝酸アンモニウム部単位45分かけて、15分間0℃で磁気棒で撹拌しました。
- 慎重に飽和NaHCO 3溶液500mlを追加し、酢酸エチル500mlを加えます。
- 沈殿物を濾過し、200mlの酢酸エチルで洗浄します。
- 二相溶液を分離し、200mlの酢酸エチル(3回)で水層を洗浄します。
- し、Na 2 SO 4で有機層を乾燥珪藻土シリカのパッドに通して活性炭の5グラム、フィルタを追加し、減圧下(回転蒸発器)の下で乾燥するまで蒸発させます。
- ジエチルエーテルを加え、へらでかき混ぜます。
- 固体を濾過し、オフホワイトの固体の4.85グラムを得ます。
1 H NMR(400 MHzの、DMSO-dを6)δ= 7.97(D、1H、J = 8.7 Hz)と、7.94(BS、1H)、7.42- 7.30(M、5H)、5.05(S、2H)、4.67 (DDD、1H、J = 8.7、5.4、2.7ヘルツ)、3.40(トン、1H、J = 5.4 Hzで、)、3.09(ddの、1H、J = 5.4、2.7ヘルツ)。
- [(S)-2-オキソアゼチジン-3-イル] -アンモニウムアセテートの調製。
- 酢酸エチル245 ml中酢酸0.93 mlで溶解します。マークこれは、「トラッピングソリューションです。」
- エタノール298 ml中[(R)-2-オキソアゼチジン-3-イル]カルバミン酸tert-ブチル-ベンジルN 3.28gのを溶かします。
- シクロヘキサジエンの14.1ミリリットルと10%パラジウム炭素の3.27グラムを追加します。
- 12時間室温でサスペンションを撹拌し、次いでケイソウ土の短いパッドを通して濾過しました。捕獲溶液に直接溶出液を注ぎます。
- 35℃以下の温度を維持しながら、減圧下(回転蒸発器)下で溶媒を蒸発させます。
- テトラヒドロフランで得られた固体をトリチュレートし、白色固体1.72 gを得ました。
1 H NMR(400 MHzの、DMSO-dの6)δ= 7.68(BS、1H)、3.99(dddの、1H、J = 5.2、2.4、1.2ヘルツ)、3.32(トン、1H、J = 5.2 Hz)で、2.79 (DD、1H、J = 5.2、2.4ヘルツ)、1.90(S、3H)。
- ベンジルNの調製- [(S)-1-(ヒドロキシメチル)-2 - [(4-メトキシフェニル)アミノ] -2- oxoethイル]カルバミン酸。
- 調製ウンデカ-10- ynyl- N - [(3 S)-2-オキソアゼチジン-3-イル]カルバメート
- 10 mLの丸底フラスコに、乾燥ジクロロメタン2ml中の[(3 S)-2-オキソアゼチジン-3-イル]酢酸アンモニウムの60ミリグラムを溶解します。
- 氷浴中で0℃に溶液を冷却し、Nの81μLを、N-ジイソプロピルエチルアミン滴ずつ加えます。
- 、乾燥ジクロロメタン2mlにウンデカ10イニル2-オキソピリジン-1-カルボキシレートを含む粗混合物350mgのを溶かした溶液にそれを追加し、15時間室温で攪拌します。減圧下(回転蒸発器)下で乾燥するまで溶剤を蒸発させます。
- 自動化されたカラムクロマトグラフィー装置を使用して、カラムクロマトグラフィー(シリカゲル)で精製:
- 、シリカゲル上にサンプルを吸収シクロヘキサンでカラムを平衡化し、カートリッジにサンプルをロードします。
- 0:0:100からシクロヘキサン/酢酸エチルで溶出100および試験管にピークを集めます。
- 減圧下(回転蒸発器)下で乾燥し、白色固体の40 mgを得た化合物に対応する画分の溶媒を蒸発させます。
CC試薬の調製
- タグアジド分子の5 mMのストック溶液の調製
- ジメチルスルホキシド(DMSO)のアジドPEG3-フルーア545 0.5でミリリットルの1.5ミリグラムを溶解させます。 -20℃で0.5 mlマイクロチューブ中のアリコートとストアを行います。
- DMSO 0.5mlにアジドPEG3ビオチンの1.1ミリグラムを溶解させます。 -20℃で0.5 mlマイクロチューブ中のアリコートとストアを行います。
- トリス(2-カルボキシエチル)ホスフィン(TCEP)の50mMのストック溶液の調製
- 水1ml中TCEPの14.3ミリグラムを溶解し、そして新鮮なたびにそれを作ります。
- CuSO 4の50 mMの溶液の調製・5H 2 O
- ガラスバイアル中、12を溶解水1ml中のCuSO 4・5H 2 Oの0.48ミリグラム。までの1ヶ月間室温で保管してください。
- トリス83.5 mMのストック溶液の調製(1-ベンジル-1H-1,2,3-トリアゾール-4-イル)メチル]アミン(TBTA)
- ガラスバイアルでは、DMSO200μlにTBTAの8.85ミリグラムを溶解します。までの1ヶ月間室温で保管してください。
- (使用直前に)TBTAの1.7mMの作業溶液の調製
- ガラスバイアルに83.5 mMのTBTAの20μlを添加して、DMSOの180ミリリットルで希釈します。
- ターシャリーブタノールと渦の800μLを加えます。
CFA-処置されたラットの足組織における3 NAAA発現解析
注:175〜200グラムの重量を量る、雄性Sprague-Dawleyラットを使用し、動物の倫理的な使用のためのガイドラインに従って、すべての手順を実行します。ハウス、12時間の明/暗サイクル上の換気ケージのラットに、彼らに食料と水を自由に与えます。 CFのプロトコルの場合治療は、7日CFA投与後Bonezzi ら 29使用動物によって掲載された記事を参照してください。
- ARN14686の静脈内投与
- 車両におけるARN14686(15%PEGおよび15%のトゥイーン食塩水)を溶解します。ラットの体重(投与量は3mg / kgであり、注入量5ミリリットル/キログラム)に応じて溶液濃度を計算します。
- 3ナイーブと3 CFA処置ラットにおける静脈内注射を続行します。適切なプラスチック製の拘束装置に各ラットを置きます。その後、血管拡張を可能にするために2-4分間温水でラットの尾を置き、尾静脈を介して化合物IVを注入。
- ビヒクルのみで3匹のラット(ナイーブおよびCFA-処理したもの)を静脈注射します。
- ポウコレクションと解剖
- プローブまたは車両投与後にCO 2吸入4時間によってラットを犠牲にし、メスを用いて0.5センチメートル膝関節の上にそれらを切断することによって、彼らの足を集めます。
- 慎重にはさみ補助切開によって皮膚を除去し、骨からそれらをこすることによって軟組織を解剖します。骨を捨て、足の軟組織を収集します。 -80℃で液体窒素とストア内のスナップ凍結サンプル。
- ポウ均質化とライソゾームタンパク質調製
注:彼らはCCの反応を阻害することができるように、界面活性剤およびアミン含有緩衝液を使用しないでください。- ( 材料/試薬の表を参照)足組織は3匹のラット(セクション3.2.1で説明したように得た)から結合してリン酸緩衝生理食塩水(PBS、pH7.4)中320 mMのスクロースおよびプロテアーゼ阻害剤カクテル4mlにそれらをホモジナイズ。高性能な分散器を使用( 素材/試薬の表を参照されたいです)。
- 4℃で千×gで20分間、組織ホモジネートを遠心。上清を保存します。
- 組織ペレットに2 PBS中の320 mMのスクロースmlのプロテアーゼ阻害剤カクテルを追加し、もう一度均質化します。
- 4℃で千×gで20分間遠心分離し、ステップ3.3.2から1に上清を追加します。
- 4℃で12,000×gで30分間回収した上清を遠心します。
- PBSの2容量でペレットを再懸濁を計量( すなわち、ペレットの各100 mgのために200μl)。 1.5ミリリットルのコレクションチューブに移し、1時間-80℃で凍結します。
- サンプルを解凍し、-80℃で1時間、再び凍結します。
- 凍結/解凍サイクルをさらに2回繰り返します。
注:このステップは、タンパク質を可溶化することを意図しています。必要に応じて、一晩凍結。 - 4°C 10万×gで1時間遠心分離します。可溶性のリソソームタンパク質を含んでいる上清を、収集し、ペレットを捨てます。 -80℃で保存したり、すぐにタンパク質定量を進めます。
- BCAタンパク質アッセイ30市販のキットを用いて、タンパク質含有量を定量化する(参照素材/試薬表 )、製造元の指示に従います。
- 使用するまで-80℃でサンプルを保管してください。
- アジドPEG3ビオチンとCC
注:CCおよびストレプトアビジンビーズ濃縮(3.4から3.6ステップ)のプロトコルは、わずかSpeersとCravatt 31によって公開されたプロトコルから変更されています。- プローブ - 車両処置ラット(ナイーブおよびCFAで処置したラット)からリソソームタンパク質を500μl(PBS中1mg / mlのを、)を準備します。
- ストレプトアビジンアガロースの50%スラリーの40μlを有するプリ・クリアーサンプルを4℃で1時間(使用前にPBS 1mlで3回洗浄します)。 4℃で千×gで4分間遠心分離し、上澄みを取ります。
- アジドPEG3ビオチンと渦の5 mMストックの11.3μlを添加します。
- 新たに調製したTCEPおよび渦の50 mMストックの11.3μlを添加します。
- 50 mMの硫酸銅の11.3μlの1.7 mMのTBTAの新たに調製したワーキング溶液のプレミックス34μlの・5H 2 Oの株式。
- 予混合TBTA /のCuSO 4・5H 2 O溶液と渦の45.3ミリリットルを追加します。
- 2時間25℃で反応をインキュベート(長いインキュベーション時間は、反応に影響を与えません)。この段階で、タンパク質の沈殿を観察します。インキュベーションの最初の一時間後に混ぜます。
- 過剰CC試薬の除去
- 4℃で6500×gで4分間遠心分離サンプル、上清を除去します。
- 超音波処理(プローブ超音波処理器で5秒)により冷メタノール再懸濁750μlのを追加します。
- 4℃、6500×gで4分間のサンプルを遠心分離し、注射器と針を用いて上清を除去します。
- (超音波処理が必要とされない)を2回繰り返し手順3.5.2。
- 最後の洗浄後、タンパク質ペレットと5秒間超音波処理3倍にPBSでドデシル硫酸ナトリウム(SDS)2.5%の325μlを添加します。
- 65℃で5分間サンプルを加熱し、超音波処理利得。
- 室温で6500×gで5分間遠心し、上清を保存します。
- 0.5%にSDSの濃度を希釈するためにPBSの1.4ミリリットルを追加します。 -20℃で保存またはストレプトアビジン濃縮を続けます。
- ストレプトアビジン濃縮
- PBSで、4.2ミリリットルにステップ3.5.8で得られた試料の体積をもたらします。 (使用前に1mlのPBSで3回洗浄)カットエンドチップを用いて、ストレプトアビジンアガロースの50%スラリー40μLを加えます。
- 回転させながら室温で2時間インキュベートした後、1400×gで2分間遠心します。
- ビーズペレットを乾燥させずに上清を除去し、( 素材/試薬表を参照してください)1ミリリットルスピンカラムにビーズを転送するために、残留上清を使用しています。
- 、(PBS中)1%SDSの3×1mlで重力によって(PBS中)6 M尿素の3倍1ミリリットル、およびPBSの4倍の1ミリリットルを洗います。
- PBSの使用2回500μlを室温で1400×gで2分間、1.5mlチューブと遠心分離機にビーズを転送します。ゆっくり注射器と針で上清を吸引除去します。
- 95°C 32で15分間、続いて室温で15分間、溶出緩衝液の25μlの(6 M尿素、2 Mチオ尿素、2%SDS、6 mMのビオチン、すべてのPBS中)を添加して、樹脂に結合したタンパク質を溶出させます。
- タンパク質ブロット
- (:9ミリリットルまで0.5ミリリットルの1MのTris-HClのpH 6.8、5ミリリットル20%のSDS、5 mgのブロモフェノールブルー、3ミリリットルグリセロール、およびH 2 Oを9ミリリットル用)および追加6X Laemmli緩衝液の5μLを追加使用直前にβメルカプトエタノール5%。簡単に言えば4〜12%ポリアクリルアミドゲルに得られた上清の樹脂と負荷を25μlをペレット化するために2000×gでサンプルを遠心します。
- 製造元の指示33に従ってブロッティング膜上のゲル電気泳動およびタンパク質の転送を行います。
- ブロッキング緩衝液10mlで1時間ブロッティング膜を飽和0.1%のTween-20を含有する( 材料/試薬の表を参照のこと )。それはバックグラウンドを増加させることができるように、牛乳を使用しないでください。
- RTで1時間バッファー+ 0.1%のTween-20を遮断する10ミリリットルに溶解( 素材/試薬の表を参照されたい)PBS中の0.05%のTween-20 10mlでメンブレンを洗浄し、蛍光ストレプトアビジンの10μlを添加します。
- PBS単独(10分毎)で1回、PBS中0.05%Tween-20で4回洗浄し、。
- ( 素材/試薬の表を参照されたい)イメージスキャナを使用してください。楽器と接続されたコンピュータのスイッチをオンにします。準備ができるまで待ちます。
- 取得プログラムを起動し、蛍光モードを選択します。膜面積を選択し、保存されたファイルの保存先フォルダを選択します。
- 次の取得パラメータを設定します:680nmの励起長、BPFR700フィルタ、千V光電子増倍管(PMT)の値(チャンネル2)、および25ミクロンのピクセルサイズ。画像を取得します。
蛍光ミクロスによるマウス肺における触媒活性NAAAの4ローカライズコピー
注:使用して男性の8〜10週齢のマウスや動物の倫理的な使用のためのガイドラインに従って、すべての手順を実行します。ハウス12時間の明/暗サイクル上の換気ケージのマウスと彼らに食料と水を自由に与えます。
- マウスにおけるARN14686の静脈内投与
- 車両にARN14686を溶解:15%PEGおよび15%のTween-20食塩水。マウス体重(投与量は3mg / kgであり、注入量5ミリリットル/キログラム)に応じて溶液濃度を計算します。
- 3匹のマウスの静脈注射を続行します。適切なプラスチック製の拘束装置に各マウスを置きます。その後、血管拡張を可能にし、尾静脈を介して化合物IVを注入するために2-4分間温水にマウス尾を置きます。
- ビヒクルのみで3匹のマウス静脈注入します。
- 肺コレクションとスライスの準備
警告:ヒュームフードに注意してパラホルムアルデヒドを持ち、手袋を着用!- chloでマウスを麻酔RAL水和物(400 mgの/キログラム)。つま先のピンチで麻酔を確認してください。次のようにtranscardial灌流を実行します。
- 表面的にハサミで腹側皮膚をカットし、胸部および腹膜表面を露出させます。
- 表面的だけで剣状突起の下に、はさみで腹膜をカットし、ダイヤフラムと内臓を露出させます。いずれかの重要な血管系を引き裂くしないように注意してください。
- もう一方の外側面から振動板を切断して胸腔を開きます。
- 自動化されたシリンジポンプに接続された25 G針を挿入し、リン酸緩衝液(0.1M、pH7.4)中の4%PFAを60ml、続いて0.9%食塩溶液20mlを注入します。
- 潅流が完了したら、鉗子を用いて心臓を引き、慎重にそれを解剖します。鉗子で気管をつかみ、ハサミを使用して、それを介して完全に切断。そっと上向きに気管を引っ張ると胸郭から肺を除去します。に組織を解剖左から右肺を分離します。
- Postfixは冷2-メチルブタン中で1時間、凍結サンプルの4%パラホルムアルデヒド中で組織し、-80℃で保管してください。
- クライオスタットを用いて、40μmのセクションを収集し、スライド上にすぐにそれらをマウント(1五回ごと)、および以下に詳述するように、免疫組織化学のためにそれらを処理します。
- chloでマウスを麻酔RAL水和物(400 mgの/キログラム)。つま先のピンチで麻酔を確認してください。次のようにtranscardial灌流を実行します。
- 組織スライス透過処理し、ブロッキング
- PBS(5分間2回)で洗浄し、室温で15分間、0.1%トリトンX-100 PBSで透過性。
- PBS(5分間2回)で洗浄し、室温で30分間、PBS中の3%ウシ血清アルブミン(BSA)でブロックします。
- PBS(5分間2x)で洗浄し、CCを続行します。
- 組織切片上のアジドPEG3-フルーア545とCC
- 1ミリリットルの溶液については、セクション2に記載のように調製CC試薬を混合して溶液を調製し、追加:アジドPEG3-フルーア545(5 mMストック)の2μlを、TCEP20μlの(新たに調製した50ミリモルのSTOCをk)は、TBTAの58.8μlのワーキング溶液(新たに調製した1.7 mM)の、のCuSO 4の20μlの・5H 2 O(50 mMストック)、およびPBS900μlの。
- セクション4.2に従って調製した組織切片にCCミックスの約400μLを加えます。 CCミックスの選択されたボリュームはスライスをカバーするのに十分であることを注意してください。光から保護し、室温で1時間インキュベートします。
- PBS(5分間×)、冷メタノール(5分間×)、PBS中の1%のTween-20および0.5mM EDTA(2分間3回)の溶液、及びPBS(5分間1×)で洗浄します。
- 空気乾燥は、カバースリップ(気泡形成を回避する)と密接DAPIと退色防止封入の低下を( 素材/試薬表を参照)、追加、およびポリッシュでシールします。分析まで4℃で保存。
- 画像収集
- 546 nmおよび450 nmの励起レーザを搭載した共焦点顕微鏡を使用して、次の( 素材/試薬表を参照してください)ユーザーガイド。
- 接眼レンズを介してスライドをプレビューし、関心のある領域に集中することを確認して、NA = 1.40で60X対物レンズを選択します。
- サンプルおよび機器の機能に応じて収集パラメータを決定します。
結果
ARN14686はNAAA阻害剤ARN726の足場に基づいて設計されました。 ARN726の4-t-ブチル-シクロヘキシル基は、C9の飽和脂肪族鎖は、末端アルキンタグ( 図1)を有する基で置換しました。アルキンタグは、フルオロフォアまたはCCを介してビオチン分子を追加するために二段階標識化手順の使用を可能にするために導入されました。この機能は、in vitroおよびin vivoで NAAAを調査するために非常に汎用性の高いツールをARN14686レンダリングします。
ここでは、この分子の潜在的なの代表的なものであるARN14686の二つのアプリケーションを示す。 図2は、ここで報告された実験手順のスキームです。プローブの静脈内投与した後、二つの異なる検出方法を使用することができる:タンパク質ブロットによるアクティブNAAA式のⅰ)分析とfluorescencによる細胞内の活性NAAAの発現と局在のii)の分析電子顕微鏡。
最初の代表的結果は、最近、我々のグループ29によって出版されました。我々は、CFA誘発性の足の炎症のラットモデルでNAAAの発現を解析しました。プローブ(3mg / kg)またはビヒクルは、ナイーブおよびCFAで処置したラットにおいて静脈内注射しました。ラットは、4時間後に屠殺しました。 CCは、プローブ標識タンパク質にビオチンタグを導入するために濃縮されたリソソーム抽出物で行いました。ビオチン化タンパク質は、次のストレプトアビジンビーズを用いて濃縮しました。溶出したタンパク質は、活性NAAAのレベルが顕著に対照ラットのものとCFAの相対的( 図3)で処置したラットの足で増加したことを示す、タンパク質ブロットによって分析しました。タンパク質ブロット分析の利点は、ゲル電気泳動によって分離されたプローブ反応プロテオームの詳細な検査を可能にすることです。このアプローチは、潜在的なプローブのオフターゲットの除幕式を可能にします。無プローブ制御はアルでなければなりません方法は実験的背景を構成する内因性のビオチン化タンパク質を排除するために含まれます。 図3の矢印は、次にロード基準コントロールとして使用することができ、このような背景のタンパク質を示します。
第二の未発表の実験( 図4)では、我々は蛍光顕微鏡によってex vivoで検出するためNAAAをプローブするARN14686を使用しました。私たちは、3ミリグラム/キログラム(IV)でマウスにARN14686を投与し、2時間transcardial灌流による治療後にそれらを屠殺しました。肺は、収集後固定し、冷2- metylbutane中で凍結しました。フルオロフォアの添加のためのCC反応は、クライオスタットを用いて収集さ40μm厚の組織切片上で直接行いました。蛍光顕微鏡による分析は、肺胞マクロファージに属する拡散小胞構造における触媒活性NAAAの存在を示しました。タンパク質特異的抗体の使用、唯一のAと比較するとctive酵素が観察されます。
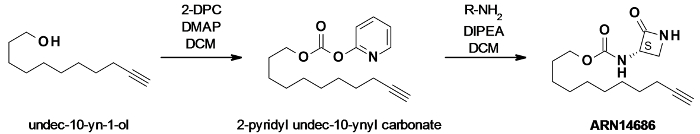
図1:ARN14686合成反応スキームウンデカ-10- YN -2-オール、混合炭酸塩を生成するために、触媒の4-ジメチルアミノピリジン(DMAP)の存在下でdipyridylcarbonate(DPC)によって活性化しました。この炭酸塩は、その後、標的分子ARN14686を得るために、アミノラクタムと反応させた。 この図の拡大版をご覧になるにはこちらをクリックしてください。
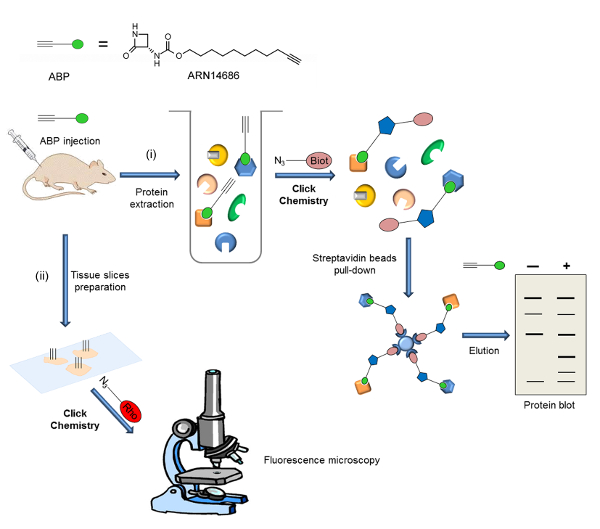
図2:本研究で示された一般的な戦略のワークフロースキームプローブは、動物(ラットまたはマウス)に注入し、標的とされる式は、二つの異なる実験手順に従い分析されますS:ⅰ)ラベルされたプロテオームが抽出され、ビオチンはCCで追加されます。ストレプトアビジンビーズ上のビオチン化タンパク質の濃縮段階の後、プローブの標的は、タンパク質ブロットにより分析します。 ii)の組織切片を調製し、フルオロフォアは、CCによって付加されます。プローブターゲット局在を蛍光顕微鏡により分析します。この図は、Bonezzi らから適応されています。29は、 この図の拡大版をご覧になるにはこちらをクリックしてください。
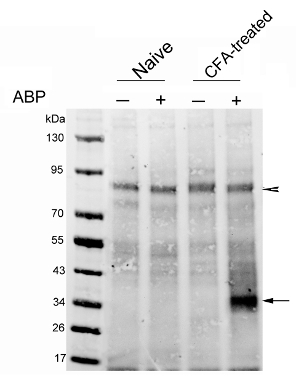
図3:CFA処置ラットの足でNAAA活性化の分析ナイーブラット(レーン1および2)またはCFA-注射したラットからのストレプトアビジンに富むタンパク質注射の7日後のタンパク質ブロット分析(レーン3および4)。ラットは、車両やARN14686(3mg / kg)の静脈注射を受けました。ブロッティング膜蛍光ストレプトアビジンでプローブしました。矢印は、NAAAバンドを示しています。矢印は、タンパク質の同様の量が各レーンにロードされたことを示す、約90キロダルトンのビオチン含有バンドを示しています。この図は、Bonezzi らから変更されている。29は、 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4: プローブで標識された蛍光顕微鏡によって、マウスの肺でNAAAのビヒクル(A)の肺切片またはアジドPEG3-フルーア545とCC後ARN14686-注入(B)マウスの代表的な写真を報告するの ex vivoで 検出します 。無信号がVで検出されなかった正のシグナル(赤血球)は、ARN14686注入マウスで検出されましたehicle投与マウス。アジドPEG3-フルーア545正肺胞マクロファージの詳細は、より高い倍率でCに示されています。核はDAPI(青)でマークしました。スケールバー= Aが50μmとCが10μm この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
酵素活性は、微RNA転写、タンパク質合成、タンパク質の転座、翻訳後修飾、およびタンパク質 - タンパク質相互作用を含む種々のレベルで調節されます。多くの場合、単独の酵素の発現は、その活性を考慮していません。 ABPPは、その天然の状態でタンパク質の活性を研究するために開発されました。二つの機能が必要とされている:共有結合プローブで標識された酵素を検出するために、興味のある酵素の活性部位とレポータータグに結合する化学プローブを。
プローブ設計と合成は、手順の重要なポイントです。プローブは、その標的に対する十分な親和性と選択性を持っている必要があります。また、レポータータグの存在は、目標係に影響を及ぼしてはなりません。この問題は、大部分は、ターゲットが捕捉された後のレポータータグが導入された二段ABPの設計によって克服されます。タグを含まないプローブは、 インビボ研究のために特に適しているタンパク質の活性最小限の外部の変化と、生きた細胞または生物で評価することができます。 NAAAプローブARN14686は、上記で概説した要件を満たすように設計されました。 βラクタム反応弾頭はNAAA阻害剤16,26のβラクタムクラスで得られた以前の結果に基づいて選択されました。これらの化合物は、共有結合酵素の触媒システインに結合することによって、強力かつ選択的な方法でNAAAを阻害します。さらに、化合物は、16全身的に活性であることが示されました。私たちは、長い脂肪族鎖のアカウントにNAAAの親和性の増加を取って、C9飽和脂肪族鎖を導入しました。末端アルキンは、二段階標識を可能にするために添加しました。
もう一つの重要なステップは、用量およびin vivo投与のための時間を選択しています。これは、血漿中のプローブの安定性、その標的親和性、およびその選択に依存します。正確な用量は、経口の係合を回避しながら、標的捕捉を可能にするように選択されなければなりませんssibleオフターゲット。我々は、/ kgのARN14686静脈3mgの選択的NAAAを捕捉するために最適であることがわかりました。より高い用量は、相同システインアミダーゼ、酸性セラミダーゼの取り込みをもたらしました。肺のような十分に灌流器官を分析する場合、治療の長さに関しては、短時間(2時間)は、ターゲットと反応するプローブを可能にするのに十分であり得ます。足のために、しかし、我々は反応時間を倍増することが義務付けられました。
タンパク質ブロットによる標的分析で可能な問題は自然にビオチン化タンパク質の存在によるものです。これらは、必然的に、特定のプローブ対象と一緒に識別されます。私たちは、CCを実行する前に、ストレプトアビジンビーズとのpreclearingステップを導入することは非常に我々の結果の品質を増加させることを見出しました。一方、天然のビオチン化タンパク質の存在は、可能なローディングアーチファクトを制御するために使用されるかもしれません。最後に、蛍光顕微鏡による局在化研究に関しては、pを認識することが非常に重要ですローブ選択タンパク質ブロットとは異なり、蛍光顕微鏡は、オフターゲットからターゲットの区別を許可していないからです。予備選択の研究では、実現可能性を評価するために、最適な実験条件を設定するために実行する必要があります。
記載された技術の制限は主に、このような界面活性剤およびアミン含有緩衝液の使用などのCC反応に影響を与えることができる実験条件を、避けることの必要性に関係します。これらの態様は、細胞溶解物または組織ホモジネートを調製する際のアカウントに注意しなければなりません。タンパク質含有量が250μgのない場合、この手順は、適用可能であるため、また、ストレプトアビジン濃縮段階が必要とされる場合、出発物質の量は、別の問題を構成します。この制限は、このような作業CC誘発性沈殿後のボリューム、タンパク質回収、および使用されるストレプトアビジン樹脂の量などの技術的問題に設定されています。
PreviouslY、NAAAの活性は、酵素のインビトロ活性化および基質の可溶化14の活性化緩衝液の使用を必要とする活性アッセイを実施することによって評価することができます。このアプローチは、総NAAAの表現について、アクティブでないNAAAの存在に関する情報を提供します。別の可能性は、PEAとOEAの組織レベルを測定することで、この方法は、NAAA活性34,35を評価する唯一の間接的な方法を表します。また、FAEレベルは、生合成などの他の要因によって影響され得ます。化学プローブARN14686はNAAAの最初のABPです。ここで説明するプロトコルは、 インビトロおよびインビボの両方で 、NAAAの活性型を捕捉し、可視化するための簡単な手順を示しています。すべてのサンプルの操作は、このように、酵素のインビボ状態に関する信頼できる情報を提供する、プローブ-標的反応に続いています。また、蛍光顕微鏡でARN14686の使用は、固有の工具Tを表しますOアクティブNAAAをローカライズ。 NAAA触媒サブユニットを認識する利用可能な抗体は、NAAA全長のプロ酵素および活性酵素を区別しません。
ここに記載したプロトコルから出発して、NAAAの発現および活性化は、炎症の種々の細胞株および動物モデルで分析することができます。共局在の研究は、より良好な生理学的および病理学的状態におけるNAAAの役割を特徴付けるために実施することができます。
開示事項
The authors have nothing to disclose.
謝辞
The authors thank the Nikon Imaging Center at Istituto Italiano di Tecnologia, Genova, Italy (NIC@IIT).
資料
| Name | Company | Catalog Number | Comments |
| 1,1’-sulfonyldiimidazole | Sigma Aldrich | 367818 | Harmful |
| 2-dipyridylcarbonate | Fluorochem | 11331 | Harmful |
| 2-Methylbutan | Sigma Aldrich | M32631 | Flamable, toxic,hazardous to the aquatic environment |
| 4-(Dimethylamino)pyridine | Sigma Aldrich | 107700 | Toxic |
| Acetic acid | Sigma Aldrich | 695092 | Flammable, Corrosive |
| Acetonitrile | Sigma Aldrich | 34998 | Flammable, Toxic |
| Activated charcoal | Sigma Aldrich | 161551 | |
| Ammonium chloride | Sigma Aldrich | A9434 | Harmful |
| Azide-PEG3-Biotin | Jena Biosciences | CLK-AZ104P4 | |
| Azide-PEG3-Fluor 545 | Jena Biosciences | CLK-AZ109 | |
| BCA protein assay kit | Thermo Fisher Scientific | 23227 | |
| Bio-spin columns | Biorad | 732-6204 | |
| Biotin | Sigma Aldrich | B4501 | |
| Blocking buffer | Li-Cor Biosciences | 927-40000 | |
| β-mercaptoethanol | Sigma Aldrich | M6250 | Higly toxic |
| Bovin serum albumine (BSA) | Sigma Aldrich | A7030 | |
| Bromophenol blue | Sigma Aldrich | B0126 | |
| Bruker Avance III 400 | Bruker | ||
| Celite | Sigma Aldrich | 419931 | Health hazard |
| Ceric ammonium nitrate | Sigma Aldrich | 22249 | Oxidizing, Harmful |
| Chloral hydrate | Sigma Aldrich | C8383 | Higly toxic |
| CuSO4.5H2O | Sigma Aldrich | 209198 | Toxic |
| Cyclohexadiene | Sigma Aldrich | 125415 | Flammable, Health hazard |
| Cyclohexane | Sigma Aldrich | 34855 | Flammable, Harmful, Health hazard, Environmental hazard |
| Dichloromethane | Sigma Aldrich | 34856 | Harmful, Health hazard |
| Diethyl ether | Sigma Aldrich | 296082 | Flammable, Harmful |
| Dimethyl sulfoxide (DMSO) | Acros Organics | 348441000 | |
| Dimethyl sulfoxide d6 (DMSO-d6) | Sigma Aldrich | 175943 | |
| Ethanol | Sigma Aldrich | 2860 | Flammable, Harmful |
| Ethyl acetate | Sigma Aldrich | 34858 | Flammable, Harmful |
| Glycerol | Sigma Aldrich | G5516 | |
| Irdye 680-LT Streptavidin | Li-Cor Biosciences | 925-68031 | |
| IRDye680-LT Streptavidin | Licor | 925-68031 | Briefly centrifuge before use to precipitate protein complexes |
| Methanol | Sigma Aldrich | 34966 | Highly toxic |
| Methanol | Sigma Aldrich | 34860 | Flammable, Toxic, Health hazard |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride | Sigma Aldrich | E7750 | Harmful, Corrosive |
| N,N-diisopropylethylamine | Sigma Aldrich | D125806 | Flammable, Corrosive, Toxic |
| N,N-dimethylformamide | Sigma Aldrich | 227056 | Flammable, Harmful, Health hazard |
| N-Cbz-L-Serine | Fluorochem | M03053 | Harmful |
| Nikon A1 confocal microscopy | Nikon | Read the user manual | |
| NuPAGE 4-12% Bis-Tris gel | Thermo Fisher Scientific | NP0335BOX | |
| Palladium on carbon | Sigma Aldrich | 330108 | |
| p-anisidine | Sigma Aldrich | A88255 | Toxic, Health hazard, Environmental hazard |
| Paraformaldehyde | sigma Aldrich | 441244 | Toxic, respiratory harmful, corrosive, falmable |
| Poly(ethylene glycol) | Sigma Aldrich | P3265 | |
| ProLong Gold antifade mountant with DAPI | Thermo Fisher Scientific | P36931 | Avoid bubbles formation |
| Protease inhibitor cocktail | Sigma Aldrich | P8340 | |
| Sodium bicarbonate | Sigma Aldrich | S6014 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | L3771 | Toxic, corrosive, falmmable |
| Sodium hydride | Sigma Aldrich | 452912 | Flammable |
| Sodium sulfate | Sigma Aldrich | 239313 | |
| Starion FLA-9000 immage scanner | FUJIFILM | Read the user manual | |
| Streptavidin agarose | Thermo Fisher Scientific | 20349 | |
| Sucrose | Sigma Aldrich | S7903 | |
| Tert-butanol | Sigma Aldrich | 360538 | Toxic, flammable |
| Tetrahydrofuran | Sigma Aldrich | 186562 | Flammable, Harmful, Health hazard |
| Thiourea | Acros Organics | 424542500 | Toxic, warm at 50 °C to dissolve |
| Tris | Sigma Aldrich | RDD008 | |
| Tris(2-carboxyethyl)phosphine (TCEP) | Sigma Aldrich | C4706 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Sigma Aldrich | 678937 | |
| Triton-x100 | Sigma Aldrich | X100 | Toxic |
| Tween-20 | Sigma Aldrich | P9416 | |
| Tween-80 | Sigma Aldrich | P1754 | |
| Ultra turrax IKA T18 basic tissue homogenizer | IKA | ||
| Undec-10-yn-1-ol | Fluorochem | 13739 | Harmful |
| Urea | Sigma Aldrich | U5378 | Toxic, warm at 50 °C to dissolve |
参考文献
- Gygi, S. P., Han, D. K., Gingras, A. C., Sonenberg, N., Aebersold, R. Protein analysis by mass spectrometry and sequence database searching: tools for cancer research in the post-genomic era. Electrophoresis. 20, 310-319 (1999).
- Washburn, M. P., Wolters, D., Yates, J. R. Large-scale analysis of the yeast proteome by multidimensional protein identification technology. Nat Biotechnol. 19, 242-247 (2001).
- Zhu, H., Bilgin, M., Snyder, M. Proteomics. Annu Rev Biochem. 72, 783-812 (2003).
- Ito, T., et al. Roles for the two-hybrid system in exploration of the yeast protein interactome. Mol Cell Proteomics. 1, 561-566 (2002).
- Evans, M. J., Cravatt, B. F. Mechanism-based profiling of enzyme families. Chem Rev. 106, 3279-3301 (2006).
- Cravatt, B. F., Wright, A. T., Kozarich, J. W. Activity-based protein profiling: from enzyme chemistry to proteomic chemistry. Annu Rev Biochem. 77, 383-414 (2008).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew Chem Int Ed Engl. 41, 2596-2599 (2002).
- Meldal, M., Tornoe, C. W. Cu-catalyzed azide-alkyne cycloaddition. Chem Rev. 108, 2952-3015 (2008).
- Speers, A. E., Adam, G. C., Cravatt, B. F. Activity-based protein profiling in vivo using a copper(i)-catalyzed azide-alkyne [3 + 2] cycloaddition. J Am Chem Soc. 125, 4686-4687 (2003).
- Saxon, E., Bertozzi, C. R. Cell surface engineering by a modified Staudinger reaction. Science. 287, 2007-2010 (2000).
- Kohn, M., Breinbauer, R. The Staudinger ligation-a gift to chemical biology. Angew Chem Int Ed Engl. 43, 3106-3116 (2004).
- Romeo, E., et al. Activity-Based Probe for N-Acylethanolamine Acid Amidase. ACS Chem Biol. 10, 2057-2064 (2015).
- Ueda, N., Yamanaka, K., Yamamoto, S. Purification and characterization of an acid amidase selective for N-palmitoylethanolamine, a putative endogenous anti-inflammatory substance. J Biol Chem. 276, 35552-35557 (2001).
- Tsuboi, K., et al. Molecular characterization of N-acylethanolamine-hydrolyzing acid amidase, a novel member of the choloylglycine hydrolase family with structural and functional similarity to acid ceramidase. J Biol Chem. 280, 11082-11092 (2005).
- Tsuboi, K., Takezaki, N., Ueda, N. The N-acylethanolamine-hydrolyzing acid amidase (NAAA). Chem Biodivers. 4, 1914-1925 (2007).
- Ribeiro, A., et al. A Potent Systemically Active N-Acylethanolamine Acid Amidase Inhibitor that Suppresses Inflammation and Human Macrophage Activation. ACS Chem Biol. 10, 1838-1846 (2015).
- Zhao, L. Y., Tsuboi, K., Okamoto, Y., Nagahata, S., Ueda, N. Proteolytic activation and glycosylation of N-acylethanolamine-hydrolyzing acid amidase, a lysosomal enzyme involved in the endocannabinoid metabolism. Biochim Biophys Acta. 1771, 1397-1405 (2007).
- Wang, J., et al. Amino acid residues crucial in pH regulation and proteolytic activation of N-acylethanolamine-hydrolyzing acid amidase. Biochim Biophys Acta. 1781, 710-717 (2008).
- West, J. M., Zvonok, N., Whitten, K. M., Wood, J. T., Makriyannis, A. Mass spectrometric characterization of human N-acylethanolamine-hydrolyzing acid amidase. J Proteome Res. 11, 972-981 (2012).
- Bandiera, T., Ponzano, S., Piomelli, D. Advances in the discovery of N-acylethanolamine acid amidase inhibitors. Pharmacol Res. 86, 11-17 (2014).
- Sasso, O., et al. Antinociceptive effects of the N-acylethanolamine acid amidase inhibitor ARN077 in rodent pain models. Pain. 154, 350-360 (2013).
- Duranti, A., et al. N-(2-oxo-3-oxetanyl)carbamic acid esters as N-acylethanolamine acid amidase inhibitors: synthesis and structure-activity and structure-property relationships. J Med Chem. 55, 4824-4836 (2012).
- Ponzano, S., et al. Synthesis and structure-activity relationship (SAR) of 2-methyl-4-oxo-3-oxetanylcarbamic acid esters, a class of potent N-acylethanolamine acid amidase (NAAA) inhibitors. J Med Chem. 56, 6917-6934 (2013).
- Solorzano, C., et al. Synthesis and structure-activity relationships of N-(2-oxo-3-oxetanyl)amides as N-acylethanolamine-hydrolyzing acid amidase inhibitors. J Med Chem. 53, 5770-5781 (2010).
- Vitale, R., et al. Synthesis, structure-activity, and structure-stability relationships of 2-substituted-N-(4-oxo-3-oxetanyl) N-acylethanolamine acid amidase (NAAA) inhibitors. ChemMedChem 9. 9, 323-336 (2014).
- Fiasella, A., et al. 3-Aminoazetidin-2-one derivatives as N-acylethanolamine acid amidase (NAAA) inhibitors suitable for systemic administration. ChemMedChem 9. 9, 1602-1614 (2014).
- Armirotti, A., et al. beta-Lactones Inhibit N-acylethanolamine Acid Amidase by S-Acylation of the Catalytic N-Terminal Cysteine. ACS Med Chem Lett. 3, 422-426 (2012).
- Nuzzi, A., et al. Potent alpha-amino-beta-lactam carbamic acid ester as NAAA inhibitors. Synthesis and structure-activity relationship (SAR) studies. Eur J Med Chem. 111, 138-159 (2016).
- Bonezzi, F. T., et al. An Important Role for N-Acylethanolamine Acid Amidase in the Complete Freund's Adjuvant Rat Model of Arthritis. J Pharmacol Exp Ther. 356, 656-663 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150, 76-85 (1985).
- Speers, A. E., Cravatt, B. F. Activity-Based Protein Profiling (ABPP) and Click Chemistry (CC)-ABPP by MudPIT Mass Spectrometry. Curr Protoc Chem Biol. 1, 29-41 (2009).
- Rybak, J. N., Scheurer, S. B., Neri, D., Elia, G. Purification of biotinylated proteins on streptavidin resin: a protocol for quantitative elution. Proteomics. 4, 2296-2299 (2004).
- Penna, A., Cahalan, M. Western Blotting using the Invitrogen NuPage Novex Bis Tris minigels. J Vis Exp. (264), (2007).
- Giuffrida, A., Piomelli, D. Isotope dilution GC/MS determination of anandamide and other fatty acylethanolamides in rat blood plasma. FEBS Lett. 422, 373-376 (1998).
- Buczynski, M. W., Parsons, L. H. Quantification of brain endocannabinoid levels: methods, interpretations and pitfalls. Br J Pharmacol. 160, 423-442 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved