Method Article
Préparation et
Dans cet article
Résumé
Ici, nous décrivons la préparation et l' utilisation d'une sonde basée sur les activités (ARN14686, undéc-10-ynyl- N - [(3S) -2-oxoazétidin-3-yl] carbamate) , qui permet la détection et la quantification de la forme active de l'enzyme proinflammatoire N amidase d'acide -acylethanolamine (PNEDA), à la fois in vitro et ex vivo.
Résumé
Le profilage de protéines à base d'activité (ABPP) est une méthode pour l'identification d'une enzyme d'intérêt dans un protéome complexe par l'utilisation d'une sonde chimique qui cible les sites actifs de l'enzyme. Un marqueur rapporteur introduit dans la sonde permet la détection de l'enzyme marquée par un balayage en gel par fluorescence, de la protéine par transfert, la microscopie de fluorescence, ou par spectrométrie de masse Chromatographie en phase liquide. Ici, nous décrivons la préparation et l' utilisation du ARN14686 composé, une sonde à base d'activité click chemistry (CC-ABP) qui reconnaît sélectivement la N amidase d'acide -acylethanolamine enzymatique (PNEDA). NAAA est une hydrolase cystéine qui favorise l'inflammation en désactivant endogène récepteur peroxysomes proliferator-activated (PPAR) agonistes de -Alpha tels que palmitoyléthanolamide (PEA) et oléoyléthanolamide (OEA). NAAA est synthétisée sous la forme d'une proenzyme inactive pleine longueur, qui est activé par autoprotéolyse dans le pH acide du lysosome. études de localisation have montré que NAAA est principalement exprimé dans les macrophages et d'autres cellules dérivées de monocytes, ainsi que dans les lymphocytes B. Nous fournissons des exemples de la façon dont ARN14686 peut être utilisée pour détecter et quantifier NAAA actif ex vivo dans les tissus de rongeurs par transfert de la protéine et la microscopie de fluorescence.
Introduction
Communément utilisé des méthodes pour étudier les profils d'expression, les interactions et les fonctions des protéines, y compris liquides plates - formes de spectrométrie de chromatographie de masse pour l' analyse de fusil de chasse 1,2, la levure méthodes deux hybrides 3,4, et des essais in vitro, sont limités en ce qu'ils sont incapable d'évaluer l'activité des protéines dans leur état natif. par activité protéine profilage (ABPP) peut être utilisé pour combler cette lacune. Dans cette approche, des petites molécules sondes capables de se lier de manière covalente au site actif d'une enzyme d'intérêt sont conjugués à un groupe reporter qui permet la détection de la cible. Utilisation de chimie clic (CC), le journaliste peut être intégré dans la sonde ou peut être introduit après l' engagement de la cible est survenue 5,6. Cette dernière procédure nécessite l'utilisation de sondes contenant des groupes chimiques appropriés, tel qu'un alcyne ou azoture terminal, qui peut être modifié avec un certain nombre de réactifs de rapporteur par des réactions bio-orthogonale SUCh comme le Cu (I) catalysées Huisgen [3 + 2] ou une cycloaddition 7-9 Staudinger ligation 10,11.
Récemment, nous avons dévoilé le ARN14686 composé comme le premier ABP pour la in vitro et in vivo de détection de l'hydrolase de cystéine, NAAA 12. NAAA catalyse la désactivation hydrolytique d'acides gras saturés et mono - insaturés, y compris FAE oléoyléthanolamide (BAE) et palmitoyléthanolamide (PEA), qui sont des agonistes endogènes du récepteur nucléaire PPAR-alpha anti-inflammatoire 13-15. NAAA est principalement exprimé dans les macrophages et d' autres cellules dérivées de monocytes, ainsi que dans les lymphocytes B 14,16, ce qui suggère un rôle dans la régulation de la réponse immunitaire innée. L'enzyme est synthétisée dans le réticulum endoplasmique rugueux sous une forme inactive et est activé dans les compartiments acides de la cellule par un mécanisme autoprotéolytique 17. Le clivage autoprotéolytique génère une nouvelle cystéine -terminale N (C131 chez la souris et le rat, chez l' homme C126), qui est le nucléophile chargé de l' hydrolyse EAF 18,19. L' inhibition pharmacologique de l' activité NAAA modifie l'équilibre de synthèse / dégradation EAF en faveur des niveaux cellulaires accrus du FAES 16,20,21. Plusieurs dérivés de β-lactone et de β-lactame a été démontré que pour inhiber l' activité NAAA avec une puissance élevée et une sélectivité 16,22-26. Ces inhibiteurs agissent par S acylation de la cystéine catalytique 16,27,28.
ARN14686 le composé a été conçu sur la base de la structure chimique de l'inhibiteur à action systémique, de la sérine dérivé β-lactame NAAA, ARN726 (4-cyclohexylbutyl- N - [(S) -2-oxoazétidin-3-yl] carbamate) 16. Le groupe 4-butyl-cyclohexyle de ARN726 a été remplacé par une chaîne aliphatique C9 saturé portant une étiquette alcyne terminal pour CC ultérieure conjugaison avec un journaliste de tag azoture de palier. Nous avons choisi de concevoir un ABP en deux étapes pour Minimally modifier la structure de l'échafaudage d'origine, conservant ainsi l'affinité de la sonde pour NAAA. De plus, en évitant l'introduction d'étiquettes volumineux, une telle sonde pourrait être plus approprié pour le traitement in vivo d'une ABP directe. ARN14686 inhibe NAAA avec une puissance élevée (hNAAA CI50 = 6 nM, rNAAA IC50 = 13 nM) en formant un adduit covalent avec la cysteine catalytique de l'enzyme 12. Des expériences sur des rats vivants ont montré que la sonde est sélective dans la capture NAAA exprimé dans les poumons. Céramidase acide, une autre cystéine amidase qui partage une identité de 33-34% avec NAAA, a également été identifiée comme étant une cible de faible affinité pour l'utilisation de concentrations élevées de sonde (10 uM in vitro, 10 mg / ml par voie intraveineuse, iv) 12. Nous avons également utilisé ARN14686 pour étudier la présence de NAAA actif dans les tissus de rats enflammées après l' administration de l'adjuvant complet de Freund (CFA) 29.
Ici, nous décrivons un protocole pour les preparatisur des ARN14686 (Figure 1) et son application à l'enquête de NAAA activation ex vivo. A titre d'exemple, nous décrivons une procédure expérimentale pour visualiser NAAA dans les pattes de rat après administration CFA. Dans cette expérience, les protéines sont extraites à partir du tissu de la patte après l'injection intraveineuse de la sonde, et le protéome PBA marqué est soumis à CC avec de la biotine-azide. échantillons biotinylés sont enrichis en utilisant des billes de streptavidine, et empreintes de protéines sont effectuées. Dans une autre application, on décrit la localisation de NAAA actif par microscopie de fluorescence dans les poumons de souris provenant de souris traitées à la sonde. Dans ce cas, le tissu est sectionné et sections sont soumis à CC pour l'addition de rhodamine. Un système de workflow est illustré à la figure 2.
Protocole
Attention: Toutes les réactions chimiques doivent être effectuées dans une hotte ventilée et avec l'utilisation d'une blouse de laboratoire, des gants et des lunettes de protection. Les réactions doivent également être effectuées dans un environnement d'azote.
déclaration éthique: Nos procédures impliquant des animaux sont effectués en conformité avec la réglementation italienne sur la protection des animaux utilisés à des fins expérimentales ou à d'autres scientifiques (DM 116192), et la réglementation communautaire économique européenne (JO des CE L 358/1 18.12.1986 ).
REMARQUE: Synthèse de la [(3S) -2-oxoazétidin-3-yl] acétate d'ammonium est décrite pour obtenir des rendements à grande échelle (50 g de N Cbz-L-sérine), mais il peut être facilement mis à l' échelle vers le bas.
1. Synthèse
REMARQUE: Voir la Figure 1 pour le schéma de réaction de synthèse.
- Préparation de la 2-pyridyl carbonate undéc-10-ynyle et undéc-10-ynyle 2-oxopyridine 1-carboxylate d' éthyle
- Dans un ballon de 50 ml à fond rond, dissoudre 350 mg de undec-10-yn-1-ol dans 3,5 ml de dichlorométhane sec.
- À la solution 1.1.1, ajouter 25 mg de 4-diméthylaminopyridine (DMAP) et 530 mg de 2-dipyridylcarbonate (DPC). On agite le mélange à la température ambiante (TA) pendant 16 h.
- Ajouter 20 ml de dichlorométhane.
- Transférer le mélange dans une ampoule à décanter. Ajouter 15 ml d'eau, secouer, et laisser les deux phases se séparer.
- Ouvrez le robinet d'arrêt, de recueillir la phase organique (en bas), puis fermer le robinet. Ajouter 15 ml d'une solution saturée de NaHCO 3. Agiter l'ampoule à décanter et laisser les deux phases se séparent. Répétez cette étape deux fois plus.
- Sécher la couche organique avec Na 2 SO 4, filtrer à travers le coton dans un ballon à fond rond (tare en premier), et évaporer à sec sous pression réduite (évaporateur rotatif).
- Peser le flacon et obtenir 600 mg d'une huile qui est un mélange de 2-pyridyl carbonate undéc-10-ynyle et undéc-10-ynyle 2-oxopyridine 1-carboxylate d'éthyle dans un rapport de 1,7: 1.
RMN 1H (400 MHz, DMSO - d6) δ = composante majeure 8,39 (dd, J = 5,0, 2,0, 1H), 7,98 (td, J = 7,9, 2,0, 1 H), 7,40 (ddd, J = 7,2, 4,9, 0,9, 1 H), 7,30 (d, J = 8,2, 1H), 4,22 (t, J = 6,6, 2H), 2,73 (t, J = 2,4, 1H), 2,18 à 2,11 (m, 2H), 1,76 - 1,62 (m, 2H), 1,50 - 1,23 (m, 12H).
RMN 1H (400 MHz, DMSO - d6) δ = composante mineure 7,74 (dd, J = 7,2, 1,9, 1H), 7,47 (dd, J = 6,7, 2,3, 1H), 6,44 (d, J = 9,4, 1H), 06.30 à 06.25 (m, 1 H), 4,35 (t, J = 6,5, 2H), 2,72 (t, J = 2,4, 1H), de 2,18 à 2,11 (m, 2H), 1,77 à 1,60 (m, 2H ), 1,52 à 1,20 (m, 12H). - Utilisez l'huile sans autre séparation ou de purification.
- Préparation de [(3 S) -2-oxoazétidin-3-yl] acétate d' ammonium
- Préparation de benzyle de N - [(S) -1- (hydroxyméthyl) -2 - [(4-méthoxyphényl) amino] -2-oxoethyl] carbamate.
- Dans un 4-L ballon à fond rond, on dissout 141,5 g de p - anisidine dans 1,5 litre de tétrahydrofuranne et 0,5 L de dichlorométhane.
- Refroidir la solution à 0 ° C dans un bain de glace.
- Ajouter 50,0 g de N Cbz-L-sérine et de 43,9 g de N - (3-diméthylaminopropyl) - chlorhydrate -ethylcarbodiimide N '.
- Incorporer le mélange avec un barreau magnétique à 0 ° C pendant 30 min.
- Retirer la solution du bain de glace et mélanger à l'aide d'un barreau magnétique à température ambiante pendant 16 heures.
- Evaporer les solvants sous pression réduite (évaporateur rotatif).
- Ajouter 400 ml de 1: 1 acétate cyclohexane / acétate d'éthyle, mélanger à l'aide d'une spatule, et décanter.
- Répétez l'étape 1.2.1.7 deux fois plus.
- On dissout le résidu gommeux dans 500 ml d'acétate d'éthyle et on lave avec 400 ml d' une solution de HCl 0,1 M (10 fois), avec 400 ml d' une solution saturée de NaHCO3 (2 fois) et 400 ml de saumure.
- Sécher la couche organique avecNa 2 SO 4, filtrer la solution à travers le coton dans un ballon à fond rond (première tare) et évaporer à sec sous pression réduite (évaporateur rotatif).
- Peser le flacon et obtenir 61,4 g d'un solide blanc.
RMN 1H (400 MHz, DMSO - d6) ô = 9,86 ( s large, 1 H), 7,52 (d, 2H, J = 9,0 Hz), 7,42 à 7,25 (m, 6H), 6,91 à 6,85 (m, 2H) , 5,06 (d, 1H, J = 12,9 Hz), 5,02 (d, 1H, J = 12,9 Hz), 4,98 (t, 1H, J = 5,6 Hz), 4,24 à 4,15 (m, 1 H), 3,72 (s, 3H), 3,70 à 3,57 (m, 2H).
- Préparation de Benzyl N - [(S) -1- (4-méthoxyphényl) -2-oxo-azétidin-3-yl] carbamate.
- Dissoudre 58,6 g de N - [(S) -1- (hydroxyméthyl) -2 - [(4-méthoxyphényl) amino] -2-oxo-éthyl] carbamate de 1,6 L de N, N - diméthylformamide.
- Refroidir la solution à 0 ° C avec un bain de glace.
- Ajouter 50,6 g de 1,1'-sulfonyldiimidazole et remuer avec un barreau magnétique pendant 30 min.
- Refroidir la solutionà -20 ° C avec un bain de glace / NaCl bain et ajoute 10,2 g d'hydrure de sodium (60% dans l'huile minérale) par portions.
- On agite le mélange à -20 ° C pendant 1 heure, puis refroidir avec 2 ml de methanol et 1 litre d'eau.
- Vacuum filtrer le précipité, laver avec 200 ml d'eau, et sécher sous vide.
- Obtenir 42,2 g d'un solide blanc.
RMN 1H (400 MHz, DMSO - d6) δ = 8,08 (d, 1H, J = 8,5 Hz), 7,42 à 7,28 (m, 5H), 7,30 (d, 2H, J = 8,9 Hz), 6,95 (d , 2H, J = 8,9 Hz), 5,06 (s, 2H), 4,86 (ddd, 1H, J = 8,5, 5,6, 2,6 Hz), 3,90 (t, 1H, J = 5,6 Hz), 3,73 (s, 3H) , 3,55 (dd, 1H, J = 5,6, 2,6 Hz).
- Préparation de Benzyl N - [(S) -2-oxoazétidin-3-yl] carbamate.
- Suspendre 9,0 g de benzyle , le N - [(S) -1- (4-méthoxyphényl) -2-oxoazétidin-3-yl] carbamate dans 500 ml d'acétonitrile et 400 ml d'eau.
- Refroidir la solution à 0 ° C dans un bain de glace.
- Ajouter 45,4 g de ceric portions en 45 min et de nitrate d'ammonium remuez avec un barreau magnétique à 0 ° C pendant 15 min.
- Ajouter 500 ml de solution saturée de NaHCO3 avec prudence, puis ajoutez 500 ml d'acétate d'éthyle.
- Filtrer le précipité et on lave avec 200 ml d'acétate d'éthyle.
- Séparer la solution à deux phases et laver la couche aqueuse avec 200 ml d'acétate d'éthyle (3 fois).
- Sécher la couche organique avec du Na 2 SO 4, ajouter 5 g de charbon actif, filtre à travers un tampon de diatomite, et on évapore à sec sous pression réduite (évaporateur rotatif).
- Ajouter de l'éther de diéthyle et remuer avec une spatule.
- Filtrer le solide et d'obtenir 4,85 g d'un solide blanc cassé.
RMN 1H (400 MHz, DMSO - d6) δ = 7,97 (d, 1H, J = 8,7 Hz), 7,94 ( s large, 1H), 7.42- 7.30 (m, 5H), 5,05 (s, 2H), 4,67 (ddd, 1H, J = 8,7, 5,4, 2,7 Hz), 3,40 (t, 1H, J = 5,4 Hz), 3,09 (dd, 1H, J = 5,4, 2,7 Hz).
- Préparation de [(S) -2-oxoazétidin-3-yl] acétate -ammonium.
- Dissoudre 0,93 ml d'acide acétique dans 245 ml d'acétate d'éthyle. Cochez cette "solution de piégeage."
- Dissoudre 3,28 g de benzyl- N - [(R) -2-oxoazétidin-3-yl] carbamate dans 298 ml d'éthanol.
- Ajouter 14,1 ml de cyclohexadiène et 3,27 g de palladium à 10% sur du carbone.
- Incorporer la suspension à la température ambiante pendant 12 heures, puis filtrer à travers un court tampon de terre de diatomées. Verser le liquide d'élution directement dans la solution de piégeage.
- On évapore le solvant sous pression réduite (évaporateur rotatif), en maintenant la température inférieure à 35 ° C.
- Triturer le solide obtenu avec du tétrahydrofuranne et d'obtenir 1,72 g d'un solide blanc.
RMN 1H (400 MHz, DMSO - d6) ô = 7,68 ( s large, 1 H), 3,99 (ddd, 1H, J = 5,2, 2,4, 1,2 Hz), 3,32 (t, 1H, J = 5,2 Hz), 2,79 (dd, 1H, J = 5,2, 2,4 Hz), 1,90 (s, 3H).
- Préparation de benzyle de N - [(S) -1- (hydroxyméthyl) -2 - [(4-méthoxyphényl) amino] -2-oxoethyl] carbamate.
- Préparation d'undéc-10-ynyl- N - [(3S) -2-oxoazétidin-3-yl] carbamate de
- Dans un ballon de 10 ml à fond rond, on dissout 60 mg de [(3S) -2-oxoazétidin-3-yl] acétate d'ammonium dans 2 ml de dichlorométhane sec.
- On refroidit la solution à 0 ° C dans un bain de glace et ajouter 81 ul de N, N de la goutte à goutte.
- Dissoudre 350 mg du mélange brut contenant undéc-10-ynyl 2-oxopyridine 1-carboxylique dans 2 ml de dichlorométhane sec, ajouter à la solution, et on agite à température ambiante pendant 15 heures. Evaporer le solvant à sec sous pression réduite (évaporateur rotatif).
- Purifier par une Chromatographie sur colonne (gel de silice) en utilisant un appareil de Chromatographie sur colonne automatisée:
- Absorber l'échantillon sur un gel de silice, équilibrer la colonne avec du cyclohexane, et de charger l'échantillon dans la cartouche.
- Éluer avec du cyclohexane / acétate d'éthyle de 100: 0 à 0: 100 et de recueillir des pics sur les tubes à essai.
- Évaporer le solvant des fractions correspondant au composé à sec sous pression réduite (évaporateur rotatif) et d'obtenir 40 mg d'un solide blanc.
2. Préparation des réactifs CC
- Préparation de 5 mM Stock Solution de Molécules Tag-azoture
- Dissoudre 1,5 mg d'azoture PEG3-Fluor 545 dans 0,5 ml de diméthylsulfoxyde (DMSO). Faire aliquotes dans 0,5 ml microtubes et conserver à -20 ° C.
- Dissoudre 1,1 mg d'azoture PEG3-Biotine dans 0,5 ml de DMSO. Faire aliquotes dans 0,5 ml microtubes et conserver à -20 ° C.
- Préparation de 50 mM Solution de Tris (2-carboxyéthyl) phosphine (TCEP)
- Dissoudre 14,3 mg de PTCE dans 1 ml d'eau, et la rendre fraîche à chaque fois.
- Préparation d' une solution 50 mM de CuSO 4 .5H 2 O
- Dans un flacon en verre, dissoudre 12.48 Mg de CuSO 4 · 5H 2 O dans 1 ml d'eau. Stocker à température ambiante pendant jusqu'à un mois.
- Préparation de 83,5 mM solution de tris [(1-benzyl-1H-1,2,3-triazol-4-yl) méthyl] amine (TBTA)
- Dans un flacon en verre, on dissout 8,85 mg de TBTA dans 200 ul de DMSO. Stocker à température ambiante pendant jusqu'à un mois.
- Préparation du travail 1,7 mM Solution de TBTA (immédiatement avant utilisation)
- Ajouter 20 pi de 83,5 mM TBTA dans un flacon en verre et on dilue avec 180 ml de DMSO.
- Ajouter 800 ul de tert -butanol et de vortex.
3. NAAA Analyse d'expression dans Paw Tissue des rats CFA traités
REMARQUE: Utilisez Sprague-Dawley rats, pesant 175-200 g, et d'effectuer toutes les procédures conformément aux lignes directrices pour une utilisation éthique des animaux. rats Maison dans des cages ventilées sur un cycle de lumière de 12 h / obscurité et leur donner accès libre à la nourriture et de l'eau. Pour le protocole de CFUn traitement, se reporter à l'article publié par Bonezzi et al. 29 Utiliser les animaux 7 jours après l' administration CFA.
- L' administration intraveineuse de ARN14686
- ARN14686 se dissoudre dans le véhicule (15% de PEG et de solution aqueuse à 15% de Tween saline). Calculer la concentration de la solution en fonction du poids du rat (dose de 3 mg / kg, le volume d'injection de 5 ml / kg).
- Procéder à des injections iv en trois naïfs et trois rats CFA traités. Placez chaque rat dans un dispositif de retenue en plastique approprié. Ensuite, placez la queue de rat dans l'eau chaude pendant 2-4 min pour permettre la vasodilatation, et injecter le iv composé via la veine de la queue.
- Injecter iv trois rats (naïfs et CFA-traitée) uniquement avec le véhicule.
- Paw Collection et Dissection
- Sacrifiez les rats par inhalation de CO 2 4 heures après la sonde ou d'un véhicule administration et de recueillir leurs pattes en les coupant de 0,5 cm au- dessus de l'articulation du genou à l' aide d' un scalpel.
- Retirez délicatement la peau par dissection assistée ciseaux et disséquer les tissus mous en les raclant de l'os. Jeter les os et recueillir les tissus mous des pattes. Prenez des échantillons de gel dans de l'azote liquide et conserver à -80 ° C.
- Paw Homogénéisation et lysosomales Protein Préparation
REMARQUE: Évitez d'utiliser des détergents et des tampons contenant des amines, car ils peuvent inhiber la réaction de CC.- Combiner les tissus de la patte de 3 rats (obtenus comme décrit dans la section 3.2.1) et homogénéiser les dans 4 ml de 320 sucrose mM dans une solution saline tamponnée au phosphate (PBS, pH 7,4) et un cocktail d'inhibiteurs de la protéase (voir Matériel / Réactif Table); utiliser un instrument de dispersion haute performance (voir Matériel / Réactif Table).
- Centrifuger l'homogénat de tissu pendant 20 minutes à 1000 g à 4 ° C; enregistrer le surnageant.
- Ajouter 2 ml de 320 mM de saccharose dans du PBS et de l'inhibiteur de protéase de cocktail au culot tissulaire ethomogénéiser à nouveau.
- Centrifugeuse pendant 20 min à 1000 xg à 4 ° C, et ajouter le surnageant à celui de l'étape 3.3.2.
- Centrifuger les surnageants collectés pendant 30 min à 12000 xg à 4 ° C.
- Peser le culot et remettre en suspension dans deux volumes de PBS (ie, 200 pi pour chaque 100 mg de granulés). Transférer dans un tube de 1,5 ml de collecte et congeler à -80 ° C pendant 1 heure.
- Décongeler les échantillons et de geler à nouveau pendant 1 heure à -80 ° C.
- Répétez le cycle de congélation / décongélation deux fois plus.
REMARQUE: Cette étape est destinée à solubiliser la protéine. Congeler la nuit si nécessaire. - Centrifugeuse pendant 1 heure à 100 000 xg à 4 ° C. Recueillir le surnageant, qui contient des protéines lysosomales solubles, et jeter le culot. Conserver à -80 ° C ou procéder immédiatement à la quantification des protéines.
- Quantifier la teneur en protéines en utilisant un dosage de protéines BCA 30 kit commercial (voir Matériel / Tableau Réactif ), en suivant les instructions du fabricant.
- Conserver les échantillons à -80 ° C jusqu'à utilisation.
- CC avec un azide PEG3-Biotine
NOTE: Le protocole de CC et à l' enrichissement de billes streptavidine (étapes 3,4-3,6) sont légèrement modifié par le protocole publié par Speers et Cravatt 31.- Préparer 500 ul (1 mg / ml dans du PBS) des protéines lysosomiques à partir de rats Probe- et traités par un véhicule (rats naïfs et traités par CFA).
- échantillons préclair avec 40 ul d'une suspension à 50% d'agarose streptavidine (laver trois fois avec 1 ml de PBS avant utilisation) pendant 1 h à 4 ° C. Centrifuger pendant 4 min à 1000 xg à 4 ° C et de prendre le surnageant.
- Ajouter 11,3 ul d'un stock de 5 mM d'azoture-PEG3-biotine et vortex.
- Ajouter 11,3 ul d'un stock de 50 mM fraîchement préparé PTCE et vortex.
- Prémix 34 ul d'une solution fraîchement préparée de travail de 1,7 mM TBTA 11,3 ul d'une mM de CuSO 4 50 · 5H 2 O stock.
- Ajouter 45,3 ml d'une TBTA / CuSO 4 · 5H 2 O solution et vortex prémélange.
- Laisser incuber la réaction à 25 ° C pendant 2 heures (temps d'incubation plus longue ne modifie pas la réaction). Observer la précipitation des protéines à cette étape. Mélanger après la première heure d'incubation.
- Élimination de l' excès Réactifs CC
- Centrifuger les échantillons pendant 4 min à 6.500 xg à 4 ° C et retirer le surnageant.
- Ajouter 750 ul de methanol froid et remettre en suspension par sonication (5 sec avec un sonicateur à sonde).
- Centrifuger les échantillons pendant 4 min à 6.500 xg à 4 ° C et retirer le surnageant à l'aide d'une seringue et une aiguille.
- Répétez l'étape 3.5.2 deux fois (sonication est pas nécessaire).
- Après le dernier lavage, ajouter 325 pi de dodécylsulfate de sodium (SDS) 2,5% dans du PBS pour les protéines granulés et sonication 3x pendant 5 sec.
- Chauffer les échantillons pendant 5 min à 65 ° C et à une sonicationGain.
- Centrifuger pendant 5 min à 6.500 xg à la température ambiante et enregistrez le surnageant.
- Ajouter 1,4 ml de PBS pour diluer la concentration de SDS à 0,5%. Conserver à -20 ° C ou continuer avec l'enrichissement de streptavidine.
- Streptavidin enrichissement
- Avec du PBS, amener le volume des échantillons obtenus à l'étape 3.5.8 à 4,2 ml. Ajouter 40 ul d'une suspension à 50% d'agarose streptavidine en utilisant une pointe cut-end (laver trois fois avec 1 ml de PBS avant utilisation).
- Incuber pendant 2 heures à température ambiante avec rotation et puis centrifuger pendant 2 min à 1400 x g.
- Retirer le surnageant sans sécher les perles granulés et utiliser le surnageant résiduel pour transférer les perles à un 1 ml de spin colonne (voir Matériel / Réactif Table).
- Laver par gravité avec 3 x 1 ml de SDS à 1% (dans du PBS), 3 x 1 ml d'urée 6 M (dans du PBS) et 4 x 1 ml de PBS.
- Utilisation 2x 500 ul de PBS pour transférer les billes dans un tube de 1,5 ml et on centrifuge pendant 2 min à 1400 x g à température ambiante. Aspirer doucement le surnageant avec une seringue et une aiguille.
- Éluer les protéines liées à la résine par addition de 25 pi de tampon d'élution (urée 6 M, 2 M thiourée, 2% de SDS et mM de biotine 6, tous dans du PBS) pendant 15 min à température ambiante puis 15 minutes à 95 ° C , 32.
- Protein blot
- Ajouter 5 ul de tampon 6x Laemmli (par 9 ml: 0,5 ml de 1 M de Tris-HCl pH 6,8, 5 ml de SDS à 20%, 5 mg de bleu de bromophénol, 3 ml de glycerol, et H 2 O jusqu'à 9 ml) et on ajoute 5% β-mercaptoéthanol immédiatement avant utilisation. centrifuger brièvement les échantillons à 2.000 x g pour sédimenter la résine et la charge 25 ul du surnageant obtenu en un gel de polyacrylamide 4-12%.
- Effectuer une électrophorèse sur gel et le transfert des protéines sur une membrane de transfert selon les instructions du fabricant 33.
- Saturer la membrane de transfert pendant 1 heure avec 10 ml d'un tampon de blocage (voir Matériel / Réactif Table) contenant 0,1% de Tween-20.Évitez d'utiliser le lait, car il peut augmenter l'arrière-plan.
- Laver la membrane avec 10 ml de 0,05% de Tween-20 dans du PBS et on ajoute 10 pi de streptavidine fluorescente (voir Matériaux / Réactif Table) dissous dans 10 ml de tampon de blocage plus 0,1% de Tween-20 pendant 1 heure à température ambiante.
- Laver 4 fois avec 0,05% de Tween-20 dans du PBS et une fois avec du PBS seul (10 min à chaque fois).
- Utilisez un scanner d'image (voir Matériel / Réactif Table). Allumer l'appareil et l'ordinateur connecté. Attendez jusqu'à ce que prêt.
- Démarrez le programme d'acquisition et de sélectionner le mode de fluorescence. Sélectionnez la zone de membrane et de choisir le dossier de destination pour les fichiers enregistrés.
- Définissez les paramètres d'acquisition suivants: 680 nm de longueur d'excitation, filtre BPFR700, 1000 V tube photomultiplicateur (PMT) valeur (canal 2), et 25 um taille de pixel. Acquérir l'image.
4. La localisation des catalytiquement active NAAA dans Souris Lungs par Fluorescence Microscopie
REMARQUE: Utiliser des hommes de souris 8 à 10 semaines d'âge et d'effectuer toutes les procédures en conformité avec les lignes directrices pour l'utilisation éthique des animaux. souris Maison dans des cages ventilées sur un cycle de 12 heures de lumière / obscurité et leur donner accès libre à la nourriture et de l'eau.
- L' administration intraveineuse de ARN14686 chez la souris
- ARN14686 se dissoudre dans le véhicule: 15% de PEG et 15% de Tween-20 solution saline. Calculer la concentration de la solution en fonction du poids de la souris (dose de 3 mg / kg, le volume d'injection de 5 ml / kg).
- Procéder à l'injection intraveineuse de 3 souris. Placez chaque souris dans un dispositif de retenue en plastique approprié. Ensuite, placez la queue de la souris dans l'eau chaude pendant 2-4 minutes pour permettre la vasodilatation et injecter le iv composé via la veine de la queue.
- Injecter 3 souris iv uniquement avec le véhicule.
- Collection Lung and Slice Préparation
Attention: Manipuler paraformaldéhyde avec soin dans une hotte, et porter des gants!- Anesthetize souris avec chlohydrate ral (400 mg / kg). Confirmer l'anesthésie avec une pincée d'orteil. Effectuer une perfusion transcardial comme suit:
- couper Superficiellement la peau ventrale avec des ciseaux et exposer les surfaces membranaires thoraciques et péritonéale.
- couper Superficiellement la membrane péritonéale avec des ciseaux, juste en dessous du processus xiphoïde, et exposer le diaphragme et les organes viscéraux. Veillez à ne pas déchirer toute vascularisation importante.
- Ouvrir la cavité thoracique en coupant le diaphragme d'un côté latéral à l'autre.
- Insérer l'aiguille 25 G raccordée à la pompe à seringue automatique et perfuser 20 ml de solution saline à 0,9%, suivi par 60 ml de PFA à 4% dans un tampon phosphate (0,1 M, pH 7,4).
- Une fois que la perfusion est terminée, retirez le cœur à l'aide de pinces et de disséquer le délicatement. Attrapez la trachée avec une pince et couper complètement à travers à l'aide de ciseaux. Tirez doucement la trachée vers le haut et retirer les poumons de la cage thoracique. Disséquer le tissu àséparer le poumon droit de la gauche.
- Postfix le tissu dans paraformaldéhyde 4% pendant 1 h, des échantillons de gel dans 2-méthylbutane froid, et les stocker à -80 ° C.
- Collecter 40 um sections à l'aide d'un cryostat, montez-les immédiatement sur des lames (un sur cinq), et de les traiter pour l'immunohistochimie comme détaillé ci-dessous.
- Anesthetize souris avec chlohydrate ral (400 mg / kg). Confirmer l'anesthésie avec une pincée d'orteil. Effectuer une perfusion transcardial comme suit:
- Tissue Tranches perméabilisation et blocage
- Laver avec du PBS (2 x 5 min) et perméabiliser avec 0,1% de Triton X-100 PBS pendant 15 min à température ambiante.
- Laver avec du PBS (2 x 5 min) et bloquer avec 3% d'albumine de sérum bovin (BSA) dans du PBS pendant 30 min à température ambiante.
- Laver avec du PBS (2x pendant 5 min) et procéder à CC.
- CC avec Azide-PEG3-Fluor 545 sur des tranches de tissu
- Préparer une solution en mélangeant les réactifs CC préparés comme décrit dans la section 2. Pour 1 ml de solution, ajouter: 2 pl de Azide-PEG3-Fluor 545 (mM de stock 5), 20 pi de PTCE (fraîchement préparé mM stoc 50k), 58,8 pi de TBTA (fraîchement préparé une solution de travail de 1,7 mM), 20 pl de CuSO 4 · 5H 2 O (50 mM), et 900 pi de PBS.
- Ajouter environ 400 ul de CC mélange des tranches de tissu, qui ont été préparés conformément au paragraphe 4.2. Faites attention que le volume choisi de CC mélange est suffisant pour couvrir les tranches. Incuber pendant 1 heure à température ambiante à l'abri de la lumière.
- Laver avec du PBS (1 x 5 min), du methanol froid (1 x 5 min), une solution de 1% de Tween 20 et 0,5 mM d'EDTA dans du PBS (3 x 2 min) et du PBS (1 x 5 min).
- Air sec, ajouter une goutte de antifade avec DAPI milieu de montage (voir Matériel / Réactif Table), fermer avec des lamelles ( en évitant la formation de bulles), et sceller avec du vernis. Conserver à 4 ° C jusqu'à l'analyse.
- Acquisition d'image
- Utiliser un microscope confocal équipé de 546 nm et 450 nm lasers d'excitation (voir Matériel / Tableau Réactif) suivantla notice.
- Sélectionnez un objectif 60X avec NA = 1,40, en veillant à un aperçu de la diapositive à travers les oculaires et de se concentrer sur un domaine d'intérêt.
- Déterminer les paramètres d'acquisition en fonction des caractéristiques de l'échantillon et du matériel.
Résultats
ARN14686 a été conçu sur la base de l'échafaudage de l'inhibiteur ARN726 NAAA. Le groupe 4-butyl-cyclohexyle , de ARN726 a été substituée par une chaîne aliphatique saturée C9 portant une étiquette alcyne terminal (figure 1). La balise alcyne a été introduite afin de permettre l'utilisation d'une procédure d'étiquetage en deux étapes pour ajouter un fluorophore ou une molécule biotine via CC. Cette caractéristique rend ARN14686 un outil très polyvalent pour sonder NAAA in vitro et in vivo.
Ici, nous montrons deux applications de ARN14686, qui sont représentatifs du potentiel de cette molécule. La figure 2 est un schéma de la procédure expérimentale rapportée ici. Après administration intraveineuse de la sonde, deux méthodes de détection différentes peuvent être utilisées: i) analyse de l'expression NAAA actif par la protéine blot et ii) analyse de l'expression actif NAAA et la localisation dans les cellules par fluorescence microscopie.
Le premier résultat représentatif a été publié récemment par notre groupe 29. Nous avons analysé l'expression NAAA dans un modèle de rat de l'inflammation de la patte induite par CFA. La sonde (3 mg / kg) ou le véhicule a été injecté iv chez des rats naïfs et traités par CFA. Les rats ont été sacrifiés 4 heures plus tard. CC a été réalisée sur des extraits de lysosomales enrichis d'introduire une biotine-étiquette sur les protéines de la sonde marquée. protéines biotinylées ont ensuite été enrichis en utilisant des billes de streptavidine. Les protéines éluées ont été analysées par transfert de protéines, montrant que les niveaux d'activité étaient NAAA nettement augmenté dans les pattes des rats traités avec du CFA par rapport à celles des rats témoins (figure 3). L'avantage de l'analyse de la protéine de transfert est qu'elle permet un examen détaillé du protéome de sonde réactive, qui est séparé par électrophorèse sur gel. Cette approche permet également pour le dévoilement de la sonde hors-cibles potentielles. Un contrôle sans sonde doit être aldes moyens inclus afin d'exclure les protéines biotinylées endogènes, qui constituent l'arrière-plan expérimental. La pointe de flèche sur la figure 3 indique que de telles protéines de fond, qui à son tour peut être utilisé en tant que témoin de référence de chargement.
Dans une seconde expérience , non publiée (figure 4), on a utilisé pour sonder ARN14686 NAAA ex vivo détection par microscopie à fluorescence. Nous avons administré ARN14686 à des souris à 3 mg / kg (iv) et les sacrifiés 2 heures après le traitement par perfusion transcardial. Poumons ont été recueillies, postfixés, et congelés dans 2-metylbutane froid. La réaction CC pour l'addition fluorophore a été réalisée directement sur des coupes de tissu de 40 um d'épaisseur, prélevées avec un cryostat. L'analyse par microscopie par fluorescence a montré la présence de NAAA catalytiquement actif dans des structures vésiculaires diffus appartenant à des macrophages alvéolaires. Par rapport à l'utilisation d'un anticorps spécifique à la protéine, seul l'unenzyme ctive est observée.
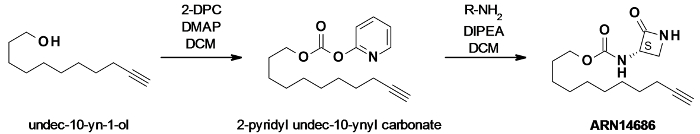
Figure 1:. ARN14686 schéma réactionnel de synthèse undéc-10-yn-2-ol a été activé par dipyridylcarbonate (DPC) , en présence de catalyseur de 4-diméthylaminopyridine (DMAP) pour produire un carbonate mixte. Ce carbonate a ensuite été mis à réagir avec l'aminé lactame pour obtenir la molécule cible ARN14686. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
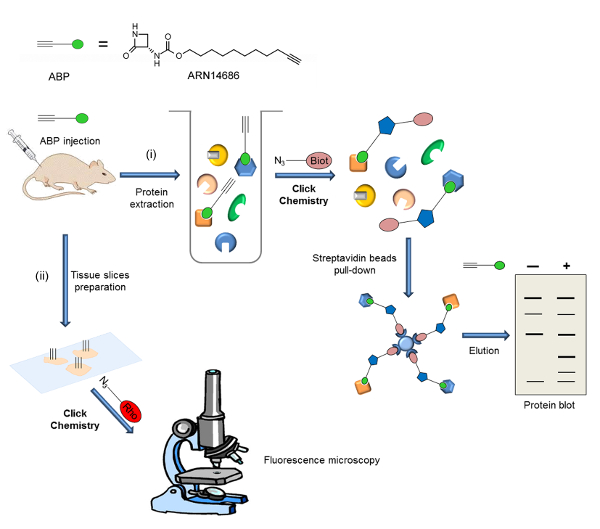
Figure 2:. Schéma de workflow de la stratégie générale présentée dans le présent ouvrage La sonde est injecté dans des animaux (rats ou souris) et de cibler l' expression est analysée suivant deux procédure expérimentale différentes: i) Le protéome marqué est extrait et la biotine est ajouté par CC. Après une phase d'enrichissement des protéines biotinylées sur des billes de streptavidine, cibles de test sont analysés par la protéine blot. ii) des tranches de tissus sont préparés et un fluorophore est ajouté par CC. Probe localisation des cibles est analysée par microscopie de fluorescence. Ce chiffre a été adapté de Bonezzi et al. 29 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
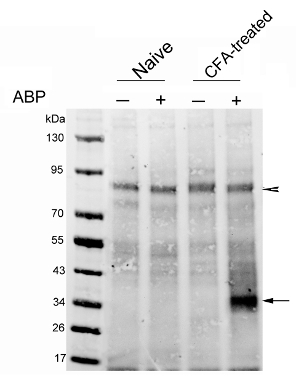
Figure 3:. Analyse de l' activation NAAA dans les pattes de rats CFA traités analyse Protein blot de protéines de streptavidine enrichi de rats naïfs (voies 1 et 2) des rats ou CFA injectés 7 jours après l' injection (pistes 3 et 4). Les rats ont reçu des injections IV de véhicules ou ARN14686 (3 mg / kg). La membrane buvarda été sondé avec une streptavidine fluorescente. La flèche indique la bande NAAA; la pointe de flèche indique une bande contenant de la biotine d'environ 90 kDa, indiquant que la même quantité de protéine a été chargée dans chaque couloir. Ce chiffre a été modifié depuis Bonezzi et al. 29 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4: détection ex vivo des images représentatives des sections de poumon de véhicule - (A) ou ARN14686 injection (B) chez la souris après CC avec un azide PEG3-Fluor 545 sonde marquée NAAA dans les poumons de souris par microscopie de fluorescence sont signalés.. Un signal positif (globules rouges) a été détectée chez des souris ARN14686-injecté, alors qu'aucun signal n'a été détecté dans vsouris éhicule-administré. Un détail d'un azoture-PEG3-Fluor 545 macrophage alvéolaire positive est montrée en C à plus fort grossissement. Les noyaux ont été marqués avec du DAPI (bleu). Barre d'échelle = 50 pm A et 10 pm C. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
L'activité enzymatique est finement réglée à différents niveaux, y compris la transcription d'ARN, la synthèse protéique, la translocation des protéines, modification post-traductionnelle, et une interaction protéine-protéine. Souvent, l'expression de l'enzyme seule ne tient pas compte de son activité. ABPP a été développé pour étudier l'activité des protéines dans leur état natif. Deux éléments sont nécessaires: une sonde chimique qui se lie de manière covalente au site actif d'une enzyme d'intérêt et un marqueur rapporteur pour détecter l'enzyme de la sonde marquée.
la conception de la sonde et la synthèse sont des points critiques de la procédure. La sonde doit avoir une affinité et une sélectivité suffisantes pour sa cible. En outre, la présence d'une étiquette de journaliste ne doit pas affecter la cible engagement. Ce problème est en grande partie surmonté par la conception d'un ABP en deux étapes, dans lequel l'étiquette de journaliste est introduite après que la cible a été pris. Sondes gratuit Tag-sont particulièrement appropriés pour des études in vivo, dans laquelle l' activité de la protéinepeut être évaluée dans une cellule ou un organisme vivant, avec altération externe minimal. La sonde ARN14686 NAAA a été conçu pour répondre aux exigences énoncées ci-dessus. Le β-lactame charge militaire réactif a été choisi en fonction des résultats antérieurs obtenus avec la classe β-lactame des inhibiteurs PNEDA 16,26. Ces composés inhibent NAAA d'une manière puissante et sélective par liaison covalente à la cystéine catalytique de l'enzyme. En outre, les composés se sont révélés être actifs 16 par voie systémique. Nous avons introduit une chaîne aliphatique C9 saturé, en tenant compte de l'affinité accrue de NAAA pendant de longues chaînes aliphatiques. Un alcyne terminal a été ajouté pour permettre l'étiquetage en deux étapes.
Une autre étape importante est de sélectionner la dose et le temps pour l' administration in vivo. Cela dépend de la stabilité de la sonde dans le plasma, son affinité pour la cible, et sa sélectivité. La dose correcte doit être sélectionnée pour permettre la capture de cible tout en évitant l'engagement de pohors-cibles ssible. Nous avons constaté que 3 mg / kg iv ARN14686 était optimale pour capturer sélectivement NAAA. Des doses plus élevées ont abouti à la capture de l'amidase cystéine homologue, céramidase acide. En ce qui concerne la durée du traitement, lors de l'analyse des organes bien perfusés, comme les poumons, un court laps de temps (2 heures) peut être suffisante pour permettre à la sonde de réagir avec la cible. Pour les pattes, cependant, nous avons été obligés de doubler le temps de réaction.
Un problème possible dans l'analyse de la cible par la protéine blot est due à la présence de protéines naturellement biotinylé. Ceux-ci seront inévitablement identifiés ainsi que des objectifs de sondes spécifiques. Nous avons constaté que l'introduction d'une étape précontrôle avec des billes de streptavidine avant d'effectuer CC considérablement augmenté la qualité de nos résultats. D'autre part, la présence de protéines biotinylées natives peut être utilisé pour contrôler les artefacts de chargement possibles. Enfin, en ce qui concerne les études de localisation par microscopie à fluorescence, il est très important d'être conscient de probe sélectivité parce que, contrairement blots de protéines, la microscopie par fluorescence ne permet pas la distinction entre la cible et hors cibles. études de sélectivité préliminaires doivent être effectuées pour évaluer la faisabilité et de mettre en place des conditions expérimentales optimales.
Limites de la technique décrite concernent principalement la nécessité d'éviter des conditions expérimentales qui peuvent affecter la réaction de CC, tels que l'utilisation de détergents et des tampons contenant des amines. Ces aspects doivent être pris en compte lors de la préparation d'un lysat de cellules ou un homogénat tissulaire. De plus, lorsqu'une phase d'enrichissement streptavidine est nécessaire, la quantité de matière de départ constitue un autre problème, car cette procédure est uniquement applicable lorsque la teneur en protéines est égale ou supérieure à 250 ug. Cette limite est fixée en raison de problèmes techniques, tels que les volumes de travail, la récupération des protéines, après la précipitation induite par CC-et la quantité de résine streptavidine à utiliser.
Previously, l' activité NAAA pourrait être évaluée uniquement en effectuant des essais d'activité, qui nécessitent l'utilisation d'un tampon d'activation pour l'activation in vitro de l'enzyme et le substrat 14 solubilisation. Cette approche fournit des informations sur l'expression totale NAAA, pas sur la présence de NAAA active. Une autre possibilité consiste à mesurer les niveaux de PEA et de tissus OEA, mais cette méthode ne représente qu'une façon indirecte pour évaluer l' activité NAAA 34,35. En outre, les niveaux EAF peuvent être influencés par d'autres facteurs tels que la biosynthèse. La ARN14686 sonde chimique est la première ABP pour NAAA. Le protocole décrit ici illustre un procédé simple pour la capture et la visualisation de la forme active de NAAA, à la fois in vitro et in vivo. Toutes les manipulations échantillons sont postérieures à des réactions sonde-cible, donnant ainsi des informations fiables sur l'état in vivo de l'enzyme. De plus, l'utilisation de ARN14686 en microscopie de fluorescence représente un outil unique de to localiser NAAA active. anticorps disponibles, qui reconnaissent la sous-unité catalytique NAAA, ne font pas de discrimination entre la pleine longueur NAAA proenzyme et l'enzyme active.
En partant du protocole décrit ici, l'expression et l'activation NAAA peuvent être analysées dans différentes lignées cellulaires et des modèles animaux d'inflammation. Des études Co-localisation peuvent être effectuées pour mieux caractériser le rôle des NAAA dans des conditions physiologiques et pathologiques.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The authors thank the Nikon Imaging Center at Istituto Italiano di Tecnologia, Genova, Italy (NIC@IIT).
matériels
| Name | Company | Catalog Number | Comments |
| 1,1’-sulfonyldiimidazole | Sigma Aldrich | 367818 | Harmful |
| 2-dipyridylcarbonate | Fluorochem | 11331 | Harmful |
| 2-Methylbutan | Sigma Aldrich | M32631 | Flamable, toxic,hazardous to the aquatic environment |
| 4-(Dimethylamino)pyridine | Sigma Aldrich | 107700 | Toxic |
| Acetic acid | Sigma Aldrich | 695092 | Flammable, Corrosive |
| Acetonitrile | Sigma Aldrich | 34998 | Flammable, Toxic |
| Activated charcoal | Sigma Aldrich | 161551 | |
| Ammonium chloride | Sigma Aldrich | A9434 | Harmful |
| Azide-PEG3-Biotin | Jena Biosciences | CLK-AZ104P4 | |
| Azide-PEG3-Fluor 545 | Jena Biosciences | CLK-AZ109 | |
| BCA protein assay kit | Thermo Fisher Scientific | 23227 | |
| Bio-spin columns | Biorad | 732-6204 | |
| Biotin | Sigma Aldrich | B4501 | |
| Blocking buffer | Li-Cor Biosciences | 927-40000 | |
| β-mercaptoethanol | Sigma Aldrich | M6250 | Higly toxic |
| Bovin serum albumine (BSA) | Sigma Aldrich | A7030 | |
| Bromophenol blue | Sigma Aldrich | B0126 | |
| Bruker Avance III 400 | Bruker | ||
| Celite | Sigma Aldrich | 419931 | Health hazard |
| Ceric ammonium nitrate | Sigma Aldrich | 22249 | Oxidizing, Harmful |
| Chloral hydrate | Sigma Aldrich | C8383 | Higly toxic |
| CuSO4.5H2O | Sigma Aldrich | 209198 | Toxic |
| Cyclohexadiene | Sigma Aldrich | 125415 | Flammable, Health hazard |
| Cyclohexane | Sigma Aldrich | 34855 | Flammable, Harmful, Health hazard, Environmental hazard |
| Dichloromethane | Sigma Aldrich | 34856 | Harmful, Health hazard |
| Diethyl ether | Sigma Aldrich | 296082 | Flammable, Harmful |
| Dimethyl sulfoxide (DMSO) | Acros Organics | 348441000 | |
| Dimethyl sulfoxide d6 (DMSO-d6) | Sigma Aldrich | 175943 | |
| Ethanol | Sigma Aldrich | 2860 | Flammable, Harmful |
| Ethyl acetate | Sigma Aldrich | 34858 | Flammable, Harmful |
| Glycerol | Sigma Aldrich | G5516 | |
| Irdye 680-LT Streptavidin | Li-Cor Biosciences | 925-68031 | |
| IRDye680-LT Streptavidin | Licor | 925-68031 | Briefly centrifuge before use to precipitate protein complexes |
| Methanol | Sigma Aldrich | 34966 | Highly toxic |
| Methanol | Sigma Aldrich | 34860 | Flammable, Toxic, Health hazard |
| N-(3-Dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride | Sigma Aldrich | E7750 | Harmful, Corrosive |
| N,N-diisopropylethylamine | Sigma Aldrich | D125806 | Flammable, Corrosive, Toxic |
| N,N-dimethylformamide | Sigma Aldrich | 227056 | Flammable, Harmful, Health hazard |
| N-Cbz-L-Serine | Fluorochem | M03053 | Harmful |
| Nikon A1 confocal microscopy | Nikon | Read the user manual | |
| NuPAGE 4-12% Bis-Tris gel | Thermo Fisher Scientific | NP0335BOX | |
| Palladium on carbon | Sigma Aldrich | 330108 | |
| p-anisidine | Sigma Aldrich | A88255 | Toxic, Health hazard, Environmental hazard |
| Paraformaldehyde | sigma Aldrich | 441244 | Toxic, respiratory harmful, corrosive, falmable |
| Poly(ethylene glycol) | Sigma Aldrich | P3265 | |
| ProLong Gold antifade mountant with DAPI | Thermo Fisher Scientific | P36931 | Avoid bubbles formation |
| Protease inhibitor cocktail | Sigma Aldrich | P8340 | |
| Sodium bicarbonate | Sigma Aldrich | S6014 | |
| Sodium dodecyl sulfate (SDS) | Sigma Aldrich | L3771 | Toxic, corrosive, falmmable |
| Sodium hydride | Sigma Aldrich | 452912 | Flammable |
| Sodium sulfate | Sigma Aldrich | 239313 | |
| Starion FLA-9000 immage scanner | FUJIFILM | Read the user manual | |
| Streptavidin agarose | Thermo Fisher Scientific | 20349 | |
| Sucrose | Sigma Aldrich | S7903 | |
| Tert-butanol | Sigma Aldrich | 360538 | Toxic, flammable |
| Tetrahydrofuran | Sigma Aldrich | 186562 | Flammable, Harmful, Health hazard |
| Thiourea | Acros Organics | 424542500 | Toxic, warm at 50 °C to dissolve |
| Tris | Sigma Aldrich | RDD008 | |
| Tris(2-carboxyethyl)phosphine (TCEP) | Sigma Aldrich | C4706 | |
| Tris[(1-benzyl-1H-1,2,3-triazol-4-yl)methyl]amine (TBTA) | Sigma Aldrich | 678937 | |
| Triton-x100 | Sigma Aldrich | X100 | Toxic |
| Tween-20 | Sigma Aldrich | P9416 | |
| Tween-80 | Sigma Aldrich | P1754 | |
| Ultra turrax IKA T18 basic tissue homogenizer | IKA | ||
| Undec-10-yn-1-ol | Fluorochem | 13739 | Harmful |
| Urea | Sigma Aldrich | U5378 | Toxic, warm at 50 °C to dissolve |
Références
- Gygi, S. P., Han, D. K., Gingras, A. C., Sonenberg, N., Aebersold, R. Protein analysis by mass spectrometry and sequence database searching: tools for cancer research in the post-genomic era. Electrophoresis. 20, 310-319 (1999).
- Washburn, M. P., Wolters, D., Yates, J. R. Large-scale analysis of the yeast proteome by multidimensional protein identification technology. Nat Biotechnol. 19, 242-247 (2001).
- Zhu, H., Bilgin, M., Snyder, M. Proteomics. Annu Rev Biochem. 72, 783-812 (2003).
- Ito, T., et al. Roles for the two-hybrid system in exploration of the yeast protein interactome. Mol Cell Proteomics. 1, 561-566 (2002).
- Evans, M. J., Cravatt, B. F. Mechanism-based profiling of enzyme families. Chem Rev. 106, 3279-3301 (2006).
- Cravatt, B. F., Wright, A. T., Kozarich, J. W. Activity-based protein profiling: from enzyme chemistry to proteomic chemistry. Annu Rev Biochem. 77, 383-414 (2008).
- Rostovtsev, V. V., Green, L. G., Fokin, V. V., Sharpless, K. B. A stepwise huisgen cycloaddition process: copper(I)-catalyzed regioselective "ligation" of azides and terminal alkynes. Angew Chem Int Ed Engl. 41, 2596-2599 (2002).
- Meldal, M., Tornoe, C. W. Cu-catalyzed azide-alkyne cycloaddition. Chem Rev. 108, 2952-3015 (2008).
- Speers, A. E., Adam, G. C., Cravatt, B. F. Activity-based protein profiling in vivo using a copper(i)-catalyzed azide-alkyne [3 + 2] cycloaddition. J Am Chem Soc. 125, 4686-4687 (2003).
- Saxon, E., Bertozzi, C. R. Cell surface engineering by a modified Staudinger reaction. Science. 287, 2007-2010 (2000).
- Kohn, M., Breinbauer, R. The Staudinger ligation-a gift to chemical biology. Angew Chem Int Ed Engl. 43, 3106-3116 (2004).
- Romeo, E., et al. Activity-Based Probe for N-Acylethanolamine Acid Amidase. ACS Chem Biol. 10, 2057-2064 (2015).
- Ueda, N., Yamanaka, K., Yamamoto, S. Purification and characterization of an acid amidase selective for N-palmitoylethanolamine, a putative endogenous anti-inflammatory substance. J Biol Chem. 276, 35552-35557 (2001).
- Tsuboi, K., et al. Molecular characterization of N-acylethanolamine-hydrolyzing acid amidase, a novel member of the choloylglycine hydrolase family with structural and functional similarity to acid ceramidase. J Biol Chem. 280, 11082-11092 (2005).
- Tsuboi, K., Takezaki, N., Ueda, N. The N-acylethanolamine-hydrolyzing acid amidase (NAAA). Chem Biodivers. 4, 1914-1925 (2007).
- Ribeiro, A., et al. A Potent Systemically Active N-Acylethanolamine Acid Amidase Inhibitor that Suppresses Inflammation and Human Macrophage Activation. ACS Chem Biol. 10, 1838-1846 (2015).
- Zhao, L. Y., Tsuboi, K., Okamoto, Y., Nagahata, S., Ueda, N. Proteolytic activation and glycosylation of N-acylethanolamine-hydrolyzing acid amidase, a lysosomal enzyme involved in the endocannabinoid metabolism. Biochim Biophys Acta. 1771, 1397-1405 (2007).
- Wang, J., et al. Amino acid residues crucial in pH regulation and proteolytic activation of N-acylethanolamine-hydrolyzing acid amidase. Biochim Biophys Acta. 1781, 710-717 (2008).
- West, J. M., Zvonok, N., Whitten, K. M., Wood, J. T., Makriyannis, A. Mass spectrometric characterization of human N-acylethanolamine-hydrolyzing acid amidase. J Proteome Res. 11, 972-981 (2012).
- Bandiera, T., Ponzano, S., Piomelli, D. Advances in the discovery of N-acylethanolamine acid amidase inhibitors. Pharmacol Res. 86, 11-17 (2014).
- Sasso, O., et al. Antinociceptive effects of the N-acylethanolamine acid amidase inhibitor ARN077 in rodent pain models. Pain. 154, 350-360 (2013).
- Duranti, A., et al. N-(2-oxo-3-oxetanyl)carbamic acid esters as N-acylethanolamine acid amidase inhibitors: synthesis and structure-activity and structure-property relationships. J Med Chem. 55, 4824-4836 (2012).
- Ponzano, S., et al. Synthesis and structure-activity relationship (SAR) of 2-methyl-4-oxo-3-oxetanylcarbamic acid esters, a class of potent N-acylethanolamine acid amidase (NAAA) inhibitors. J Med Chem. 56, 6917-6934 (2013).
- Solorzano, C., et al. Synthesis and structure-activity relationships of N-(2-oxo-3-oxetanyl)amides as N-acylethanolamine-hydrolyzing acid amidase inhibitors. J Med Chem. 53, 5770-5781 (2010).
- Vitale, R., et al. Synthesis, structure-activity, and structure-stability relationships of 2-substituted-N-(4-oxo-3-oxetanyl) N-acylethanolamine acid amidase (NAAA) inhibitors. ChemMedChem 9. 9, 323-336 (2014).
- Fiasella, A., et al. 3-Aminoazetidin-2-one derivatives as N-acylethanolamine acid amidase (NAAA) inhibitors suitable for systemic administration. ChemMedChem 9. 9, 1602-1614 (2014).
- Armirotti, A., et al. beta-Lactones Inhibit N-acylethanolamine Acid Amidase by S-Acylation of the Catalytic N-Terminal Cysteine. ACS Med Chem Lett. 3, 422-426 (2012).
- Nuzzi, A., et al. Potent alpha-amino-beta-lactam carbamic acid ester as NAAA inhibitors. Synthesis and structure-activity relationship (SAR) studies. Eur J Med Chem. 111, 138-159 (2016).
- Bonezzi, F. T., et al. An Important Role for N-Acylethanolamine Acid Amidase in the Complete Freund's Adjuvant Rat Model of Arthritis. J Pharmacol Exp Ther. 356, 656-663 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150, 76-85 (1985).
- Speers, A. E., Cravatt, B. F. Activity-Based Protein Profiling (ABPP) and Click Chemistry (CC)-ABPP by MudPIT Mass Spectrometry. Curr Protoc Chem Biol. 1, 29-41 (2009).
- Rybak, J. N., Scheurer, S. B., Neri, D., Elia, G. Purification of biotinylated proteins on streptavidin resin: a protocol for quantitative elution. Proteomics. 4, 2296-2299 (2004).
- Penna, A., Cahalan, M. Western Blotting using the Invitrogen NuPage Novex Bis Tris minigels. J Vis Exp. (264), (2007).
- Giuffrida, A., Piomelli, D. Isotope dilution GC/MS determination of anandamide and other fatty acylethanolamides in rat blood plasma. FEBS Lett. 422, 373-376 (1998).
- Buczynski, M. W., Parsons, L. H. Quantification of brain endocannabinoid levels: methods, interpretations and pitfalls. Br J Pharmacol. 160, 423-442 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon