Method Article
Одновременная запись электроретинография и визуальных Вызванные Потенциалы в анестезированных крыс
В этой статье
Резюме
This protocol describes simultaneous measurement of electroretinogram and visual evoked potentials in anesthetized rats.
Аннотация
The electroretinogram (ERG) and visual evoked potential (VEP) are commonly used to assess the integrity of the visual pathway. The ERG measures the electrical responses of the retina to light stimulation, while the VEP measures the corresponding functional integrity of the visual pathways from the retina to the primary visual cortex following the same light event. The ERG waveform can be broken down into components that reflect responses from different retinal neuronal and glial cell classes. The early components of the VEP waveform represent the integrity of the optic nerve and higher cortical centers. These recordings can be conducted in isolation or together, depending on the application. The methodology described in this paper allows simultaneous assessment of retinal and cortical visual evoked electrophysiology from both eyes and both hemispheres. This is a useful way to more comprehensively assess retinal function and the upstream effects that changes in retinal function can have on visual evoked cortical function.
Введение
Измерение электроретинограмму (ЭРГ) и вызванный потенциал зрительного нерва (ВЭП) обеспечивают полезные количественные оценки целостности зрительного пути. ERG измеряет электрические реакции сетчатки к световой стимуляции, в то время как ВЭП измеряет соответствующую функциональную целостность зрительных путей от сетчатки к первичной зрительной коре следующий же светлым событием. Эта рукопись описывает протокол для записи и анализа ЭРГ и ЗВП ответов в широко используемом лабораторной модели, крысы.
ERG обеспечивает индекс функциональной целостности ряда ключевых классов клеток сетчатки путем количественной оценки валовой электрический ответ сетчатки к вспышке света. Согласованный ряд ионных потоков, инициирована света начало и окончание, производства обнаруживаемыми изменения напряжения, которые можно измерить с помощью поверхностных электродов, размещенных вне глаза. Полученный сигнал представляет собой сочетание себеРиз хорошо определенных компонентов, отличающихся по амплитуде, времени и частоте. Значительное число исследований показало, что эти компоненты относительно хорошо сохраняются во многих позвоночной сетчатке и что компоненты могут быть отделены друг от друга. При разумном выборе стимула (вспышки стимула, фон, межстимульный интервал) условий и выбора конкретных особенностей составного сигнала для анализа можно быть уверенным в возврате меру определенной группы клеток сетчатки глаза 1,2. Эти характеристики лежат в основе полезности и, следовательно, широкое применение ЭРГ в качестве неинвазивного измерения функции сетчатки глаза. Эта рукопись посвящена методологии измерения ЭРГ и анализа своих возможностей, чтобы возвратить информацию о некоторых из основных классов клеток в сетчатке, а именно фоторецепторов (компонент PIII), биполярные клетки (компонент PII) и ганглиозных клеток сетчатки (положительный скотопическое порог срабатывания или pSTR).
ВЭП обеспечивает анализ корковой реакции на свет; первых , происходящих из сетчатки , а затем передаваться последовательно через зрительный нерв, зрительный тракт, таламус (боковое коленчатое ядро, ЛГН) и оптического излучения в зоне V1 коры 3. У грызунов, большинство (90 - 95%) волокон зрительного нерва от каждого глаза 4 пересекающийся под прямым углом и иннервируют контралатеральной среднего мозга. В отличие от ERG, это еще не представляется возможным приписать различные компоненты ВЭП к конкретным классам клеток, 5 , таким образом , изменяется в любом месте вдоль зрительного пути может повлиять на форму волны ВЭП. Тем не менее, ВЭП является полезным неинвазивным мерой зрительной эффективности и целостности зрительного пути. ВЭП, при использовании в сочетании с ERG, могут обеспечить более полную оценку зрительной системы (то есть, сетчатка / визуальный путь).
ЭРГ и ЗВП записи могут проводиться отдельно или в комбинации, в зависимости от примекатион. Методология, описанная в данной статье позволяет одновременно оценить и сетчатке корковой зрительных вызванных электрофизиологии от обоих глаз и обоих полушарий у наркотизированных крыс. Это полезный способ более полно оценить функцию сетчатки глаза и вверх по течению эффекты, что изменения в функции сетчатки может иметь на зрительной функции коры головного мозга вызывала.
протокол
Все экспериментальные процедуры были проведены в соответствии с австралийским Кодекса практики по уходу и использованию животных в научных целях, установленный Национальным Советом по медицинским исследованиям здравоохранения и в Австралии. Зазор этика была получена из Мельбурнского университета, факультета наук, Комитета по этике животных (номер разрешения 0911322,1).
1. предимплантационной хронического ВЭП электродах
Примечание: Если одновременно ЭРГ и ЗВП сигналы должны быть собраны животные должны быть хирургическим путем имплантировали электроды ВЭП по крайней мере за 1 неделю до сигнала сбора.
- Стерилизацию хирургического скамью перед экспериментом путем очистки с хлоргексидином (0,5% в 70% этаноле). Автоклав все хирургическое оборудование перед использованием. Накройте животное с стерилизованную хирургической простыне. Убедитесь, что все экспериментаторы носить хирургические маски, халаты и стерилизовать перчатки.
- Индуцируют анестезия с 3 - 3,5% изофлуран с O 2 , при скорости потока 3 л / мин. Поддерживать ANEsthesia на уровне 1,5% и 2 л / мин в течение всего хирургического вмешательства. Обеспечить достаточную глубину анестезии при отсутствии лапа пинч рефлекса.
- Применяют 1% карбоксиметилцеллюлозы натрия на роговице, чтобы предотвратить высыхание глаз.
- Бритье 30 мм площадь х 30 мм на лоб, кзади от глаза и впереди ушей.
- Поместите животное на площадку тепла (37 ° С) для поддержания температуры тела и стабилизации головы животных с стереотаксической рамы.
- Лечить выбритый участок с 10% повидон-йода в три раза. Избегайте употребления алкоголя на основе антисептиков для области возле глаз, будучи в соответствии со стандартом практики изложены Ассоциацией хирургических технологов.
- Сделать средний сагиттальной разрез на голове с помощью скальпеля и от этого акциза круг диаметром ~ 20 мм кожной ткани подвергать черепной кости.
- Удалите основную надкостницы путем соскоба и сушки с марлей, чтобы выставить корональной и сагиттальной черепных швов.
- НасING зубной заусенцев, прикрепленного к дрели, трепанировать два отверстия (диаметр 0,7 мм, глубина ~ 1 мм) через череп на обоих полушарий на стереотаксической координат: 7 мм каудально брегмы, 3 мм сбоку от средней линии.
- Завинтить винты из нержавеющей стали (диаметр 0,7 мм, длина 3 мм, стерилизуется с хлоргексидином) в двух предварительно сделанных отверстий глубиной до ~ 1 мм (2 мм винта выставляется), чтобы позволить надежное крепление. Это связывается с Dura без повреждения основной ткани коры.
- Приготовьте хирургическую область для зубной амальгамы путем сушки черепной кости с марлей и втягивания дряблая кожа с двумя 3 - 0 наложения швов на ~ 4 и 8 часов.
- Спред зубной амальгамы над открытой черепа, чтобы закрепить винт электроды (винты из нержавеющей стали, описанные в пункте 1.10) на месте. Обеспечить ~ 1,5 мм винтов остаются открытыми для записи.
- Удалить втягивания швами.
- Вводят 0,5% карпрофен подкожно (5 мг / кг) в обезболивающих и насыщенным раствором соли (хлорида натрия 0,9%, 10,5 мл) подкожно для замены жидкости.
- Разрешить животных для восстановления в отдельных клетках. Не оставляйте животное без присмотра, пока он не пришел в сознание достаточное для поддержания грудины лежачее.
- Не вернуть животное в компании других животных, пока он не полностью восстановился после операции (минимум 5 дней).
- Продолжайте вводить 0,5% карпрофен подкожно в обезболивании (5 мг / кг) один раз в день в течение 4-х дней.
- Запись ЭРГ и ЗВП 1 неделю после операции.
2. ЭРГ и ЗВП записи
- Подготовка Сбор данных
- С помощью компьютерного программного обеспечения для одновременного запуска стимул и получать данные 2 в соответствии с настройками , рекомендуемыми ниже.
- Усилить сигналы 3 (ЭРГ: × 1000, ВЭП: x10,000) с коэффициентом усиления внутри установленного изолированной предварительного усилителя и усилителя, и с обоими глазами подобранных для импеданса.
- Установите частоту дискретизации для ЭРГ до 4 кГц в течение 650Окно записи Мс (2560 очков), Для этого нажмите на вкладку "временной базы" в программном обеспечении сбора данных (для имени и версии программного обеспечения смотрите таблицу материалов), выберите "2560" для образцов, и "500 мс" за время, которое возвратит окно записи 650 мс.
- Используйте тот же метод, чтобы установить частоту дискретизации для ППЭ до 10 кГц в течение 250 мс эпохи. Разрешить 10 мс до стимула базового уровня для обоих ЭРГ и ЗВП записей. Для этого перейдите на вкладку "Настройка"; выберите "Стимулятор", чтобы открыть новое окно диалога; В этом окне выберите "импульс" из выпадающего списка "Mode"; и установите значение "задержки" до "10 мс".
- Набор ERG полосовой фильтрации до 0,3 - 1000 Гц (- 3 дБ). Это делается, нажав кнопку "Bio Amplifier" в программном обеспечении сбора данных. Затем установите значение "High Pass" до "0,3 Гц", а значение для "низкого прохода" на "1 кГц".
- Используя метод в вышеупомянутую 2.1.1.3, установите настройки полосовых ВЭП до 0,1 - 100 Гц (- 3 дБ), а Международным обществом рекомендованной клинической электрофизиологии зрения (ISCEV) для человеческих ЗВП записей 6.
- С помощью компьютерного программного обеспечения для одновременного запуска стимул и получать данные 2 в соответствии с настройками , рекомендуемыми ниже.
- подготовка электродов
- Специально сделать ЭРГ активным / неактивным и ВЭП активный / неактивный электроды путем присоединения серебряной проволоки или зажим аллигатора к электродной свинца, соответственно 2. Коммерчески получить заземляющий электрод.
- Для 4 заказных электродов, вырезать мужской конец от расширения электрода свинца. Удалить 1 см наружного изоляционного покрытия из политетрафторэтилена с скальпелем обеспечивая внутренний провод не поврежден.
- Предварительно моды ЭРГ неактивные электроды резанием длиной 70 мм из серебряной проволоки (толщиной 0,3 мм) и образуя петлю ~ 8 мм в диаметре, чтобы окружить глаз крысы. Подготовить однородный круг, формируя петлю на пипетки 1 мл. Pre-моды VEP неактивные электроды резанием длиной 70 мм из серебра и формирования эллипса ~ 8 мм в длину мудр диаметра, чтобы зацепиться резцами крыс.
- Предварительно моды ЭРГ активные электроды путем разрезания длиной 30 мм серебряной проволоки и образуя небольшую петлю, чтобы аккуратно контакт с роговицей крысы (~ 1-2 мм в диаметре)
- Надежно закрепите электроды (2 ЭРГ активные, 2 ERG неактивным, 1 ВЭП неактивным) к электроду свинца переплетая серебро с открытой внутренней проволоки.
- Изолировать избыток открытых металлических частей с помощью клейкой ленты, чтобы уменьшить фотоэлектрические артефакты.
- На неактивные электроды ERG воткнуть небольшой кусочек с крючками и липучка (~ 5 мм × 20 мм) с помощью клейкой ленты, чтобы позволить стабильное крепление к ремню с грызунами шеи.
- Прикрепите крокодил к внутреннему проводу электрода приводит сделать активные электроды ВЭП.
- До начала записи, гальванизирует открытые поверхности серебряных проволок (то есть неактивный кольцо и Actiве TIP) с хлоридом с использованием источника 9 В постоянного тока в течение 20 секунд для улучшения сигнала проводимости.
- Чтобы сделать это, погрузить серебряный наконечник провода электрода ERG (действующий в качестве анода первичной ячейки) в нормальном физиологическом растворе; а другой конец этого провода электрода к положительному полюсу 9 В батареи.
- Подключите другой провод (катод) к отрицательной клемме аккумуляторной батареи, и погрузите другой конец в физиологическом растворе, а также. Отключите через 20 сек и наблюдать щепка кончик электродной проволоки ERG должна быть покрыта равномерно белого цвета.
Примечание: Подготовка новых электродов ЭРГ для каждой экспериментальной сессии (~ до 8 часов), чтобы обеспечить проходимость покрытия хлорида.
- подготовка животных
- Темно-адаптировать животных в течение ночи (≥ 8 ч) до записи в светонепроницаемый комнате. Обеспечить максимальную адаптацию к темноте, отключив комнате свет, закрыть все двери и жалюзи. Сведение к минимуму утечки света, разместив светонепроницаемыми материалы вокругстыки дверей / окон и размещение экранов компьютеров за пределами толстыми черными шторами.
- Провести подготовку животных в темной комнате с помощью тусклый красный светоизлучающий диод (LED; 17,4 cd.m -2, X макс = 600 нм) для поддержания чувствительности стержня.
- Обезболить крысе путем инъекции кетамина / ксилазина (60: 5 мг / кг) внутримышечно. Confirm достаточную глубину анестезии при отсутствии лапа пинч рефлекса.
- Для поддержания седативного эффекта, вводить дополнительную дозу анестезии (50% от начальной дозы) после того, как 50 минут, если это необходимо.
- Для получения дополнительной местной анестезии применяют одну каплю 0,5% proxymetacaine для каждого глаза, и моргания лишнюю жидкость.
- Для расширением зрачка применяют одну каплю 0,5% тропикамид для каждого глаза, а затем высушить лишнюю жидкость.
- ЭРГ и ЗВП позиционирования электрода
- Поместите животное на платформе ERG перед миской Ganzfeld, расположенной в клетке Фарадея. Не используйте электрическую грелку, поскольку Cввести электрический шум в электрофизиологических записей. Примечание: Платформа крепится к распространенной нагретой платформы воды для поддержания температуры тела.
- Безопасное животное на платформу с полосой с крючками и липучка помещенного твердо, но не плотно вокруг затылка.
- Крючок неактивный электрод ВЭП вокруг нижних резцов наркозом крыс.
- Расположите электроды неактивные ЭРГ окружив склеры кольцо неинвазивным вокруг экватора глаза. Стабилизировать это путем присоединения электродов к крючками и липучка полосы вокруг затылка. Повторите эти действия для второго глаза.
- Закрепить ВЭП активные электроды путем присоединения зажимами для нержавеющей стали винтов предварительно имплантированных на черепе.
- Поместите небольшую каплю 1% карбоксиметилцеллюлозы натрия на роговицу до размещения активного электрода ЭРГ для улучшения качества сигнала. Примечание: вискоза жидкость также помогает поддерживать гидратации роговицы на протяжении экспериментов с миниMize образование усыхание типа катаракты у грызунов 7.
- Поместите небольшую каплю 1% карбоксиметилцеллюлозы натрия на нижних резцах, чтобы улучшить контакт пассивный электрод ВЭП и, таким образом, качество сигнала.
- Расположите активные электроды ЭРГ слегка прикоснуться к центральной поверхности роговицы с помощью микроманипулятора, прикрепленный к заказного стереотаксической руку.
- Вставка 2 - 5 мм наземном игольчатого электрода (нержавеющая сталь) подкожно в хвост.
- При необходимости высушить любую лишнюю жидкость из нижнего века перед записью для улучшения качества сигнала.
- Slide платформа ближе к шару Ganzfeld обеспечивая глаза животного согласовывались с отверстием чаши, чтобы включить равномерное освещение обеих сетчаток (см шаг 2.4.1).
- Закройте клетку Фарадея, чтобы уменьшить посторонний шум.
- Сбор данных
- Используйте тусклый тест-вспышки (- 0,52 журнал cd.sm -2) , чтобы оценить , является ли электрод placemлор является удовлетворительным 2. В условиях контроля это привело бы к амплитуде эрг ~ 800 мкВ и вариабельность глаз от не более чем на 10%. При необходимости репозиции электродов.
- После тест-вспышки позволяют животным приспособиться к темноте в течение 10 минут в полной темноте до записи.
- Современные вспышки световых раздражителей, используя миску Ganzfeld при сборе ЭРГ и ЗВП сигналы одновременно в течение мс временного окна ~ 500. Прогресс от диммер ярче уровень света, чтобы сохранить достаточную темно-адаптации для конкретных форм сигналов.
- Сбор сигналов в диапазоне световых энергий, чтобы вызвать STR, б-волны и A / B-волновые формы волны ЭРГ. Средние больше сигналов на диммер уровня освещенности (20 повторов) и в меньшей степени на более яркую светящихся энергий (1 повтор). Постепенно удлинять интервал между стимула от 1 до 180 сек от тусклой до самого яркого уровня освещенности. Приведены в таблице 1 для примера протокола.
- Для ISOпоздно палочек и колбочек ответов ЭРГ, используют спаренных флэш парадигмы 8. Инициировать четыре вспышки в 1,52 журнала cd.sm -2 с 500 мс между стимулом интервал 2 между ними. Цифровым вычесть форму волны конуса (3 - й или 4 - й вспышки) из смешанного сигнала (1 - й вспышки) , чтобы получить предполагаемую реакцию стержня.
- Для записи ВЭП сигналов, в среднем 20 повторений на яркие светящиеся энергии (то есть, - от 0,52 до 1,52 журнал cd.sm -2, 5 сек интервал между раздражителем). Обратите внимание, что первая вспышка в этой последовательности возвращает обычный темно-адаптированный ответ ERG.
- Разрешить 1 - 3 мин для повторной адаптации после того, как (20) ВЭП подметает до следующего более ярким ЭРГ шагом, в зависимости от световой энергии.
- После завершения сбора данных, эвтаназии наркотизированных животное с инъекцией внутрисердечного натрия фенобарбитала (325 мг / мл, 3 мл).
| форма волны | Стимул световой энергии (журнал cd.sm -2) | Количество повторов | межстимульный интервал (сек) |
| STR | -6,24 | 20 | 2 |
| STR | -5,93 | 20 | 2 |
| STR | -5,6 | 20 | 2 |
| STR | -5,33 | 20 | 2 |
| Род б-волна | -4,99 | 10 | 2 |
| Род б-волна | -4,55 | 10 | 2 |
| Род б-волна | -4,06 | 5 | 5 |
| Род б-волна | -3,51 | 5 | 5 |
| Род б-волна | -3,03 | 1 | 15 |
| Род б-волна | -2,6 | 1 | 15 |
| Род б-волна | -1,98 | 1 | 15 |
| Смешанное а- / б-волна | -1,38 | 1 | 30 |
| Смешанное а- / б-волна | -0,94 | 1 | 30 |
| Вспышка 1: Смешанный A- / B-волны в среднем 20: ВЭП | -0,52 | 20 | 5 |
| (90 секунд до следующего) | |||
| Вспышка 1: Смешанный A- / B-волны в среднем 20: ВЭП | 0.04 | 20 | 5 |
| (120 секунд до следующего) | |||
| Вспышка 1: Смешанный A- / B-волны в среднем 20: ВЭП | 0,58 | 20 | 5 |
| (180 секунд до следующего) | |||
| Flasч 1: Смешанный A- / B-волны в среднем 20: ВЭП | 1.2 | 20 | 5 |
| (180 секунд до следующего) | |||
| Вспышка 1: Смешанный A- / B-волны в среднем 20: ВЭП | 1,52 | 20 | 5 |
| (180 секунд до следующего) | |||
| Конус а- / б-волна | 1,52 | 4 | 0,5 |
Таблица 1. ERG и Протокол ВЭП Запись с использованием ряда Стимул энергии. Стимул презентации прогресс от тусклого (сверху) до ярких (внизу) мигает, с достаточным интервалом между стимул для обеспечения темной адаптации. В конце протокола, повторение четырех вспышек с коротким интервалом представлен, чтобы вызвать конус опосредованной реакции.
3. Анализ ЭРГ осциллограмм
Примечание: ЭРГ и ЗВП анализ был подробно описан ранее 3,9,10 The.В следующих разделах содержится краткий обзор.
- Экспорт сигналов в цифровом формате напряжения времени в электронную таблицу программного обеспечения для анализа данных.
- Род photoreceptoral функция
- Модель передний край а-волны PIII с задержкой гауссовского (уравнение 1) 11.
PIII (я, т) = Кт PIII ∙ [1 - ехр (- я ∙ S (т - т д) 2)] при Т> d (уравнение 1) - Оптимизация подгонку по ансамблю двух ярких светящихся энергий 12,13 (т.е., 1,22 и 1,52 журнала cd.sm -2).
- Модель до 90% от амплитуды а-волны , чтобы избежать пост-receptoral интрузии 14.
Примечание: Модель возвращает насыщенную амплитуду (Кт PIII, мкВ), чувствительность (S, м 2 .cd -1 .с -3) и задержку (т д, мс) от photoreceptoral ответа.
- Модель передний край а-волны PIII с задержкой гауссовского (уравнение 1) 11.
- Род биполярная клетка функцион
- Цифровым вычесть модель PIII (см выше) из смешанных форм волны, чтобы вернуть смешанную PII с вышележащих колебательные потенциалов.
- Для извлечения PII стержня из смешанного PII, в цифровой форме вычитают ответ конуса (3 - й или 4 - й вспышки в 1,52 журнала cd.sm -2) из смешанного PII (1 - й вспышки на 1,52 журнала cd.sm -2).
- Затем примените фильтр низких частот, а в форме волны (46,9 Гц, -3 дБ, окно Blackman), чтобы удалить колебательные потенциалы. Оставшийся сигнал жезла ответ PII 10.
- Извлечь максимальную амплитуду стержень PII и построить его против всех интенсивностей стимула (ниже -2 журнала cd.sm -2 и стержневой изоляции на 1,52 PII журнала cd.sm -2) 10.
- Модель этих данных с помощью гиперболической функции (уравнение 2), который обеспечивает измерение внутренней целостности ретинальных клеток.
V (I) = V макс (я п / (я п+ К п)) (уравнение 2)
Примечание: Это уравнение возвращает максимальный ответ PII (V макс, мкВ), 1 / чувствительность (к, журнал cd.sm-2) и наклон функции (п) 15.
- Конус функция биполярная ячейка
Примечание: В ответ конус берется при одной интенсивности (1,52 журнал cd.sm -2) амплитуда и сроки будут перенастроены на этом уровне света.- Извлечь максимальный конус PII ответ 2,16.
- Экстракт неявный , к которому этот максимальный ответ соответствует 2,16.
- Функция ганглиозных клеток
- Поскольку STR является небольшой сигнал, применить фильтр нижних частот с частотой 50 Гц с выемкой формы сигнала для устранения высокой частоты и шумов на линии (46,9 Гц, -3 дБ, окно Blackman).
- Извлечь ответ максимальное pSTR 3,17.
- Экстракт неявный , к которому этот максимальный ответ соответствует 3,17.
4. Анализис ЗВП осциллограмм
- Извлечение максимальных и минимальных компонентов ВЭП (P1, N1 и P2). Для подробно ссылки см 3,6.
- Экспресс амплитуды как корыто до пика амплитуд от их предыдущего пика или корыто (p1n1 и N1P2). 3,6
- Выдержка времени неявное (это) , к которому эта максимальная соответствует ответ (P1 это, N1 это, P2 она) 3,6.
Результаты
ERG а-волна (> -1,38 журнал cd.sm -2), б-волны (> - 4,99 журнал cd.sm -2) о подозрительных операциях (<- 4,99 журнал cd.sm -2) и вепсы (> - 0,52 журнал cd.sm -2) записывались одновременно (рис 1 и 3). При очень тусклые вспышки, положительная СТР (pSTR) рассматривается приблизительно 110 мс после вспышки, а отрицательное СТР (НСТР) приблизительно при 220 мс (фиг.1 и 2). ЭРГ с большим б-волны, пики от 50 до 100 мс после начала умеренной вспышки , которая может быть проанализирован на его реакции PII (фиг.1 и 2). На этот стимул энергии, отрицательное а-волны до пика незначительна. При ярче светящихся энергиях отрицательное отклонение а-волна становится более заметным , которая может быть определена количественно с ответом PIII (рисунок 2). Скотопическое ВЭП сигнал показывает отрицательный ответ (p1n1, 15 - 70 мс окна), а затем положительное отклонение (N1P2; 30 - 100 мс) (3 и 4).
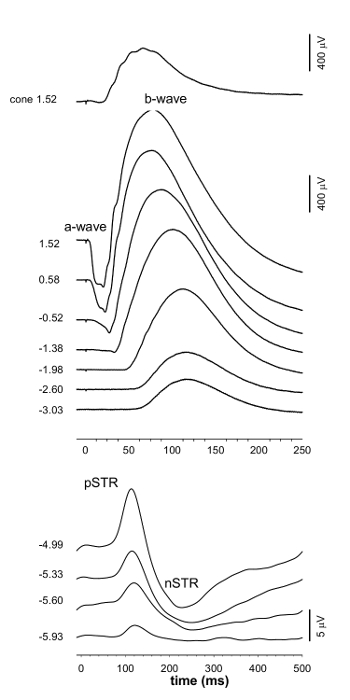
Рисунок 1. Группа Средние ERG осциллограмм. ЭРГ изменяет с увеличением интенсивности стимула. Цифры слева от сигнала указывают световой экспозиции, используемый для выявления формы сигнала. Обратите внимание на различные амплитуды и временные шкалы для каждой панели. При тусклых светящихся энергий положительные и отрицательные компоненты скотопического порога реакции может быть вызвана (pSTR, НСТР). Как энергии стимула получить ярче, а и Ь-волны ответ может быть проанализирована и парный вспышка парадигма позволяет ответ конуса необходимо измерить. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
pload / 54158 / 54158fig2.jpg "/>
Рисунок 2. ERG анализ. (A) Rod функция фоторецепторов может быть проанализирована с помощью PIII для моделирования на волну. A-волны в 1,22 и 1,52 журнала cd.sm -2 (незаполненные кружки, ○) подходят как ансамбль с PIII (серые линии, уравнение 1) до 90% от минимума , который возвращает Rm PIII (насыщенный амплитудой, мкВ) S (чувствительность, м 2 .cd -1 .с -3) и тд (задержка синхронизации, мс) параметры. (B) Rod функцию биполярного клеток (среднее ± SEM) могут быть проанализированы с помощью моделирования серии отклика интенсивности на PII стержня (незаполненные кружки ○) с функцией Нака-Раштон (серая линия). Это возвращает V макс (насыщенный амплитуду, мкВ), к (1 / чувствительность, бревенчатый кд см -2) и п (наклон). (С) Ретинальная функция ганглиозных клеток анализируют при тусклом светящихся энергий и количественно пиковой амплитудой pSTR (pSTR ампер) и времени (pSTR него ). (D) Конус биполярное функции клеток выявляется с парного флэш парадигмы количественно конуса PII пиковой амплитуды (конус PII ампер) и времени (конус PII его). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
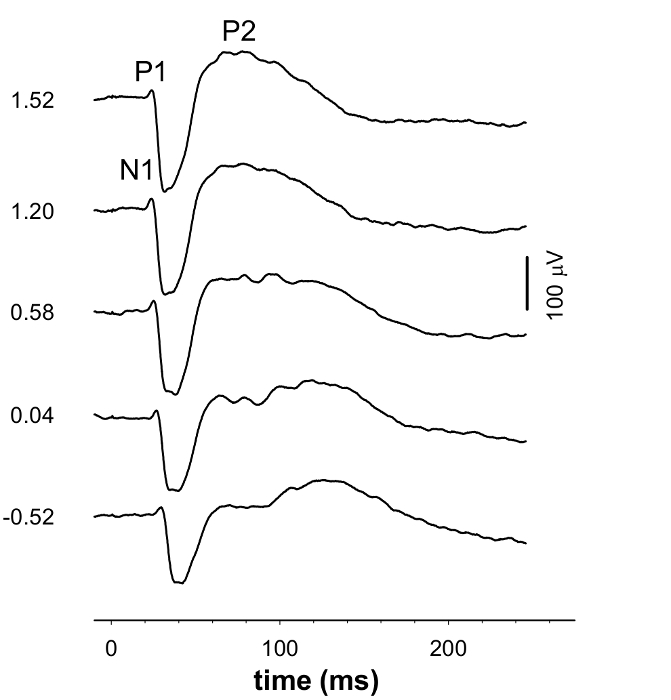
Рисунок 3. Группа ВЭП Среднее осциллограмм. Форма сигнала ВЭП изменяет с увеличением энергии стимула. Числа слева от сигнала указывают световой экспозиции , используемый для выявления формы сигнала. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
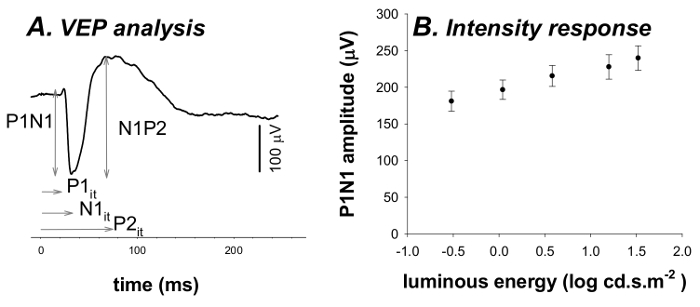
FIGURe 4. ВЭП анализа и функции интенсивности отклика. (A) Amplitude анализ ВЭП берется в качестве пика до корыта (p1n1) и впадины до пика (N1P2) амплитуды. Неявные раз (она) этих ответов также возвращается (P1 это, N1 это, P2 это). (В) Амплитуда ВЭП p1n1 (среднее ± SEM) возрастает с увеличением энергии стимула. Пожалуйста , нажмите здесь , чтобы увидеть увеличенную версию эта фигура.
Обсуждение
ЭРГ и ЗВП объективные показатели зрительной функции от сетчатки и коры головного мозга, соответственно. Преимущество одновременной записи является то, что более полное представление всего зрительного пути, обеспечивает ее. В частности, дополнительная информация от их одновременной оценки могли бы обеспечить более четкое разграничение места повреждения в зрительного пути (например, для лечения расстройств с перекрытием ERG еще отличаются ВЭП проявлений 18, когда оптическая невропатия может сосуществовать с первичной атрофии головного мозга 19, 20, или когда потеря ВЭП могут быть искажены проявления травм в нескольких местах в зрительного пути 21,22). Путем измерения ЭРГ и ЗВП одновременно, показатель усиления между сетчатке и корковом ответ также может быть получена. Это может стать полезным инструментом для выявления тонких патологических изменений. Текущий протокол позволяет ЭРГ и ЗВП измерения в наиболее часто используемых лабораторных крыс, но может быть легко объявленияЭптед для других видов млекопитающих 23-25. ЭРГ и ЗВП сигналы от грызунов обеспечивают достаточную доклинические суррогат ответов , наблюдаемых в человеческих глазах 26-28.
При разработке конкретного протокола стимула, как ЭРГ и ЗВП ответ может быть получен в течение одного сеанса записи. Таблица 1 показывает прогрессию в легких уровнях с соответствующим учетом времени восстановления между последовательными вспышками. Этот протокол обеспечивает баланс между необходимостью максимального сигнала к шуму характеристики и ограничения времени записи в окне анестетика, предоставленной одной дозы кетамина: ксилазина. Следовательно, этот метод может быть полезен для объективной количественной меры зрительной функции для исследований в области основы физиологии и болезней.
Комплексная оценка зрительной системы может быть достигнуто при одновременном оценке двусторонних ответов сетчатки глаза и визуально навеянные корковых ответов, Тем не менее, каждый метод может быть также проведена в изоляции и монокулярно вместо бинокулярно для упрощения процедуры. Текущий протокол описывает скотопическими ЭРГ и ЗВП сигналы, выбранные для изоляции и стержневые пути при условии, что у крыс есть стержень с преобладанием сетчатку. Если свет адаптированный ответы больший интерес к изучению, можно также проводить Фотопическое ЭРГ и ЗВП сигналы путем предварительной адаптации к фоновым светом.
Одним из основных ограничений этого метода является необходимость проводить процедуру под наркозом условий для того, чтобы стабильное размещение электрода. Тем не менее этот подход обеспечивает устойчивые характеристики сигнала к шуму позволяет обнаружить тонкие изменения лечения.
Из-за малой амплитуды НТР и ее чувствительности к световой адаптации, несколько шагов, которые должны быть внимательно следили, чтобы обеспечить успешную запись этого ответа. Во-первых, достаточно, темная адаптация должна быть реализована, которая включает в себяночи адаптация к темноте (≥ 8 часов), размещение электродов при слабом красном освещении (17,4 cd.m -2, λ макс = 600 нм), и вновь адаптация к темноте после тусклом тест-вспышки (10 мин для - 0,52 кд журнал. см -2). Кроме того, характеристики сигнал-шум НТР может быть улучшена путем усреднения по множеству сигналов (то есть, 20 сигналов) , собранных с короткими интервалами между раздражитель (то есть, 2 сек). Одним из преимуществ этой комплексной оценки обоих глаз и кортикальных является , чтобы позволить сравнение с контрлатеральной 3 записи. Таким образом , особое внимание должно быть принято в электродной решений (то есть, те же размеры и форму электродов), чтобы обеспечить минимальный среди глаз и между корковой изменчивость.
Принимая во внимание широкое использование обоих методов ЭРГ и ЗВП , чтобы обеспечить в естественных условиях мер зрительного пути и ее процессов , связанных с болезнью, было бы полезно для сопоставления Другой путь конкретного рrotocols (например, ON / OFF или конусной подтипу конкретного), а также одновременно выполнять записи ERG / ВЭП с различными условиями стимулирования (например, мерцание, картины, пилообразных) , чтобы расширить применение этой методики в клинических диагнозов. Еще одним логическим шагом этого приложения в будущем будет также записывать ЭРГ и ЗВП одновременно с осознанной 29, свободно движущихся животных , чтобы избежать влияния на анестезирующие нервной физиологии 30.
Раскрытие информации
The authors have no disclosures relevant to this work.
Благодарности
Funding for this project was provided by the National Health and Medical Research Council (NHMRC) 1046203 (BVB, AJV) and Melbourne Neuroscience Institute Fellowship (CTN).
Материалы
| Name | Company | Catalog Number | Comments |
| Alligator clip | generic brand | HM3022 | Stainless steel 26 mm clip for connecting VEP screw electrodes to cables |
| Bioamplifier | ADInstruments | ML 135 | For amplifying ERG and VEP signals |
| Carboxymethylcellulose sodium 1.0% | Allergan | CAS 0009000-11-7 | Viscous fluid for improving signal quality of the active ERG electrode |
| Carprofen 0.5% | Pfizer Animal Health Group | CAS 53716-49-7 | Proprietary name: Rimadyl injectable (50 mg/ml). For post-surgery analgesia, diluted to 0.5% (5 mg/ml) in normal saline |
| Chlorhexadine 0.5% | Orion Laboratories | 27411, 80085 | For disinfecting surgical instruments |
| Circulating water bath | Lauda-Königshoffen | MGW Lauda | For maintaining body temperature of the anesthetized animal during surgery and electrophysiological recordings |
| Dental amalgam | DeguDent GmbH | 64020024 | For encasing the electrode-skull assembly to make it more robust |
| Dental burr | Storz Instruments, Bausch and Lomb | #E0824A | A miniature drill head of ~ 0.7 mm diameter for making a small hole in the skull over each hemisphere to implant VEP screws |
| Drill | Bosch | Dremel 300 series | An automatic drill for trepanning |
| Electrode lead | Grass Telefactor | F-E2-30 | Platinum cables for connecting silver wire electrodes to the amplifier |
| Faraday Cage | custom-made | Ensures light proof to maintain dark adaptation. Encloses the Ganzfeld setup to improve signal to noise ratio | |
| Gauze swabs | Multigate Medical Products Pty Ltd | 57-100B | For drying the surgical incision and exposed skull surface during surgery |
| Ganzfeld integrating sphere | Photometric Solutions International | Custom designed light stimulator: 36 mm diameter, 13 cm aperture size | |
| Velcro | VELCRO Australia Pty Ltd | VELCRO Brand Reusable Wrap | Hook-and-loop fastener to secure the electrodes and the animal on the recording platform |
| Isoflurane 99.9% | Abbott Australasia Pty Ltd | CAS 26675-46-7 | Proprietary Name: Isoflo(TM) Inhalation anaaesthetic. Pharmaceutical-grade inhalation anesthetic mixed with oxygen gas for VEP electrode implant surgery |
| Ketamine | Troy Laboratories | Ilium Ketamil | Proprietary name: Ketamil Injection, Brand: Ilium. Pharmaceutical-grade anesthetic for electrophysiological recording |
| Luxeon LEDs | Phillips Lighting Co. | For light stimulation twenty 5 W and one 1 W LEDs. | |
| Micromanipulator | Harvard Apparatus | BS4 50-2625 | Holds the ERG active electrode during recordings |
| Needle electrode | Grass Telefactor | F-E2-30 | Subcutaneously inserted in the tail to serve as the ground electrode for both the ERG and VEP |
| Phenylephrine 2.5% minims | Bausch and Lomb | CAS 61-76-7 | Instilled with Tropicamide to achieve maximal dilation for ERG recording |
| Povidone iodine 10% | Sanofi-Aventis | CAS 25655-41-8 | Proprietory name: Betadine, Antiseptic to prepare the shaved skin for surgery 10%, 500 ml |
| Powerlab data acquisition system | ADInstruments | ML 785 | Controls the LEDs |
| Proxymetacaine 0.5% | Alcon Laboratories | CAS 5875-06-9 | For corneal anaesthesia during ERG recordings |
| Saline solution | Gelflex | Non-injectable, for electroplating silver wire electrodes | |
| Scope Software | ADInstruments | version 3.7.6 | Simultaneously triggers the stimulus via the Powerlab system and collects data |
| Silver (fine round wire) | A&E metal | 0.3 mm | Used to make active and inactive ERG electrodes, and the inactive VEP electrode |
| Stainless streel screws | MicroFasterners | 0.7 mm shaft diameter, 3 mm in length to be implanted over the primary visual cortex and serve as the active VEP electrodes | |
| Stereotaxic frame | David Kopf | Model 900 | A small animal stereotaxic instrument for locating the primary visual cortices according to Paxinos & Watson's 2007 rat brain atlas coordinates |
| Surgical blade | Swann-Morton Ltd. | 0206 | For incising the area of skin overlaying the primary visual cortex to implant the VEP electrodes |
| Suture | Shanghai Pudong Jinhuan Medical Products Co.,Ltd | 3-0 silk braided suture non-absorbable, for skin retraction during VEP electrode implantation surgery | |
| Tobramycine eye ointment 0.3% | Alcon Laboratories | CAS 32986-56-4 | Proprietary name: Tobrex. Prophylactic antibiotic ointment applied around the skin wound after surgery |
| Tropicamide 0.5% | Alcon Laboratories | CAS 1508-75-4 | Proprietary name: 0.5% Mydriacyl eye drop, Instilled to achieve mydriasis for ERG recording |
| Xylazine | Troy Laboratories | Ilium Xylazil-100 | Pharmaceutical-grade anesthetic for electrophysiological recording |
| Pipette tip | Eppendorf Pty Ltd | 0030 073.169 | Eppendorf epTIPS 100 - 5,000 ml, for custom-made electrodes |
| Microsoft Office Excel | Microsoft | version 2010 | spreadsheet software for data analysis |
| Lethabarb Euthanazia Injection | Virbac (Australia) Pty Ltd | LETHA450 | 325 mg/ml pentobarbital sodium for rapid euthanazia |
Ссылки
- Nguyen, C. T. O., Vingrys, A. J., Bui, B. V. Dietary omega-3 fatty acids and ganglion cell function. Invest Ophthalmol Vis Sci. 49, 3586-3594 (2008).
- Weymouth, A. E., Vingrys, A. J. Rodent electroretinography: methods for extraction and interpretation of rod and cone responses. Prog Retin Eye Res. 27, 1-44 (2008).
- Tsai, T. I., Bui, B. V., Vingrys, A. J. Effect of acute intraocular pressure challenge on rat retinal and cortical function. Invest Ophthalmol Vis Sci. 55, 1067-1077 (2014).
- Cowey, A., Franzini, C. The retinal origin of uncrossed optic nerve fibres in rats and their role in visual discrimination. Exp Brain Res. 35, 443-455 (1979).
- Weinstein, G. W., Odom, J. V., Cavender, S. Visually evoked potentials and electroretinography in neurologic evaluation. Neurol Clin. 9, 225-242 (1991).
- Odom, J. V., et al. Visual evoked potentials standard (2004). Doc Ophthalmol. 108, 115-123 (2004).
- Ridder, W. H., Nusinowitz, S., Heckenlively, J. R. Causes of cataract development in anesthetized mice. Exp Eye Res. 75, 365-370 (2002).
- Nixon, P. J., Bui, B. V., Armitage, J. A., Vingrys, A. J. The contribution of cone responses to rat electroretinograms. Clin Experiment Ophthalmol. 29, 193-196 (2001).
- Bui, B. V., et al. Using the electroretinogram to understand how intraocular pressure elevation affects the rat retina. J Ophthalmol. 2013, 262467(2013).
- Nguyen, C. T., Vingrys, A. J., Bui, B. V. Dietary omega-3 fatty acids and ganglion cell function. Invest Ophthalmol Vis Sci. 49, 3586-3594 (2008).
- Hood, D. C., Birch, D. G. A quantitative measure of the electrical activity of human rod photoreceptors using electroretinography. Vis Neurosci. 5, 379-387 (1990).
- Birch, D. G., Hood, D. C., Locke, K. G., Hoffman, D. R., Tzekov, R. T. Quantitative electroretinogram measures of phototransduction in cone and rod photoreceptors - Normal aging, progression with disease, and test-retest variability. Arch Ophthalmol. 120, 1045-1051 (2002).
- Bui, B. V., Vingrys, A. J. Development of receptoral responses in pigmented and albino guinea-pigs (Cavia porcellus). Doc Ophthalmol. 99, 151-170 (1999).
- Robson, J. G., Saszik, S. M., Ahmed, J., Frishman, L. J. Rod and cone contributions to the a-wave of the electroretinogram of the macaque. J Physiol. 547, 509-530 (2003).
- Severns, M. L., Johnson, M. A. The care and fitting of Naka-Rushton functions to electroretinographic intensity-response data. Doc Ophthalmol. 85, 135-150 (1993).
- Bui, B. V., Fortune, B. Origin of electroretinogram amplitude growth during light adaptation in pigmented rats. Vis Neurosci. 23, 155-167 (2006).
- Bui, B. V., Fortune, B. Ganglion cell contributions to the rat full-field electroretinogram. J Physiol. 555, 153-173 (2004).
- Tremblay, F., Laroche, R. G., Debecker, I. The Electroretinographic Diagnosis of the Incomplete Form of Congenital Stationary Night Blindness. Vision Res. 35, 2383-2393 (1995).
- Bayer, A. U., Keller, O. N., Ferrari, F., Maag, K. P. Association of glaucoma with neurodegenerative diseases with apoptotic cell death: Alzheimer's disease and Parkinson's disease. Am J Ophthalmol. 133, 135-137 (2002).
- Wostyn, P., Audenaert, K., De Deyn, P. P. An abnormal high trans-lamina cribrosa pressure difference: A missing link between Alzheimer's disease and glaucoma. Clinical Neurology and Neurosurgery. 110, 753-754 (2008).
- Yucel, Y. H., Zhang, Q. A., Weinreb, R. N., Kaufman, P. L., Gupta, N. Effects of retinal ganglion cell loss on magno-, parvo-, koniocellular pathways in the lateral geniculate nucleus and visual cortex in glaucoma. Prog Retin Eye Res. 22, 465-481 (2003).
- Gupta, N., Yucel, Y. H. What changes can we expect in the brain of glaucoma patients. Survey of Ophthalmology. 52, 122-126 (2007).
- Kong, Y. X., et al. Impact of aging and diet restriction on retinal function during and after acute intraocular pressure injury. Neurobiol Aging. 33, 1115-1125 (2012).
- Bui, B. V., Sinclair, A. J., Vingrys, A. J. Electroretinograms of albino and pigmented guinea-pigs (Cavia porcellus). Aust N Z J Ophthalmol. 26, Suppl 1 98-100 (1998).
- Jobling, A. I., Wan, R., Gentle, A., Bui, B. V., McBrien, N. A. Retinal and choroidal TGF-beta in the tree shrew model of myopia: isoform expression, activation and effects on function. Exp Eye Res. 88, 458-466 (2009).
- Robson, J. G., Frishman, L. J. Dissecting the dark-adapted electroretinogram. Doc Ophthalmol. 95, 187-215 (1998).
- Robson, J. G., Frishman, L. J. The rod-driven a-wave of the dark-adapted mammalian electroretinogram. Prog Retin Eye Res. 39, 1-22 (2014).
- Hudnell, H. K., Boyes, W. K. The comparability of rat and human visual-evoked potentials. Neurosci Biobehav Rev. 15, 159-164 (1991).
- Charng, J., et al. Conscious wireless electroretinogram and visual evoked potentials in rats. PLoS One. 8, e74172(2013).
- Hetzler, B. E., Berger, L. K. Ketamine-Induced Modification of Photic Evoked-Potentials in the Superior Colliculus of Hooded Rats. Neuropharmacology. 23, 473-476 (1984).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены