Method Article
麻酔ラットにおける電図および視覚誘発電位の同時記録
要約
This protocol describes simultaneous measurement of electroretinogram and visual evoked potentials in anesthetized rats.
要約
The electroretinogram (ERG) and visual evoked potential (VEP) are commonly used to assess the integrity of the visual pathway. The ERG measures the electrical responses of the retina to light stimulation, while the VEP measures the corresponding functional integrity of the visual pathways from the retina to the primary visual cortex following the same light event. The ERG waveform can be broken down into components that reflect responses from different retinal neuronal and glial cell classes. The early components of the VEP waveform represent the integrity of the optic nerve and higher cortical centers. These recordings can be conducted in isolation or together, depending on the application. The methodology described in this paper allows simultaneous assessment of retinal and cortical visual evoked electrophysiology from both eyes and both hemispheres. This is a useful way to more comprehensively assess retinal function and the upstream effects that changes in retinal function can have on visual evoked cortical function.
概要
電図(ERG)と視覚誘発電位(VEP)の測定は、視覚経路の完全性の有用な定量的評価を提供します。 VEPは、同じ光のイベント、次の一次視覚野への網膜から視覚経路の対応する機能の完全性を測定しながら、ERGは、光刺激に対する網膜の電気的応答を測定します。この原稿は、一般的に使用される実験用モデル、ラットにおけるERGおよびVEP応答の記録と分析のためのプロトコルについて説明します。
ERGは、光のフラッシュに網膜の総電気的応答を定量化することにより、キー網膜細胞クラスの数の機能的完全性の指標を提供します。イオンフラックスの協調一連の光開始によって開始され、オフセット、眼の外側に配置された表面電極を用いて測定することができる電圧の検出可能な変化を生じます。得られた波形がseの組み合わせを表し、振幅、タイミングおよび周波数の異なる明確に定義されたコンポーネントのリース、。研究の実質的な本体は、これらのコンポーネントは、比較的、多くの脊椎動物の網膜を横切って部品を互いに分離することができる保存されていることを示しています。思慮深く刺激(フラッシュ刺激、背景、刺激間隔)の条件を選択し、分析するために合成波形の特定の機能を選択することによって1は網膜細胞1,2の特定のグループの測定値を返すのを確信することができます。これらの特性は、網膜機能の非侵襲的測定として有用性ひいてはERGの広範なアプリケーションの基礎となります。この原稿が正(すなわち、光受容体(PIII成分)、双極細胞(PII成分)と網膜神経節細胞、ERGを測定し、網膜の主要な細胞のクラスのいくつかについての情報を返すために、その機能を解析するための方法論に焦点を当てて暗順応閾値応答またはPSTR)。
VEPは、光に対する皮質応答のアッセイを提供します。最初の網膜から発信され、その後皮質3の領域V1に視神経、視索、視床(外側膝状核、LGN)と光学放射を介してシリアルに伝え。げっ歯類では、大多数-それぞれの目のX字形の4から視神経線維の(90〜95%)とは反対側の中脳を支配します。 ERGとは異なり、特定の細胞のクラスにVEPの異なるコンポーネントを帰するようまだできていない、どこにも視覚的な経路に沿って5こうして変更はVEP波形に影響を与える可能性があります。それにもかかわらず、VEPは、ビジュアル性能と視覚路の完全性の有用な非侵襲性の尺度です。 VEPは、ERGと組み合わせて使用される場合、視覚系( すなわち、網膜/視覚経路)のより完全な評価を提供することができます。
ERGおよびVEP記録は、アプリに応じて、単独で又は組み合わせて実施することができますカチオン。この論文に記載の方法は、網膜と皮質視覚誘発両眼からの電気生理学や麻酔したラットにおける両半球の同時評価を可能にします。これは、より包括的に網膜機能および網膜機能の変化が視覚誘発皮質機能に持つことができる上流の効果を評価するための便利な方法です。
プロトコル
全ての実験手順は、オーストラリアで国立保健医療研究評議会が定めた科学的な目的のための動物の管理と使用に関する実践のオーストラリアの規範に従って行われました。倫理クリアランスはメルボルン大学、科学学部、動物倫理委員会(承認番号0911322.1)から入手しました。
1.慢性VEP電極の着床前
注:同時ERGおよびVEP信号は外科的にVEPを移植しなければならない動物は、少なくとも1週間コレクションを通知する前に電極を収集する場合。
- クロルヘキシジン(70%エタノール中0.5%)で洗浄することにより、実験前に手術用のベンチを滅菌します。使用前に、すべての手術用機器をオートクレーブ。滅菌外科用ドレープで動物をカバーしています。すべての実験者は外科用マスク、ガウン、滅菌手袋を着用することを確認します。
- 3 L /分の流量でO 2と3.5%のイソフルラン- 3で麻酔を誘導します。 ANEを維持手術全体で1.5%と2 L / minでsthesia。足のピンチ反射の欠如によって麻酔の十分な深さを確認してください。
- 眼の乾燥を防ぐために、角膜上の1%カルボキシメチルセルロースナトリウムを適用します。
- 目に、額の上に後部を30ミリメートル×30ミリメートルの領域を剃るし、耳に前方。
- 体温を維持し、定位フレームに動物の頭を安定させるために、熱パッド(37℃)で動物を置きます。
- 10%ポビドンヨードで3回剃らエリアを消毒します。外科技師の協会が定め実践の標準と一致している、目に近い領域のアルコール系消毒薬の使用は避けてください。
- 頭蓋骨を露出するためにメスでと真皮組織のこの物品A〜20ミリメートルの直径の円から頭の上に正中矢状切開を行います。
- 掻きコロナル、サジタル頭蓋縫合を露出するようにガーゼで乾燥することにより、基礎となる骨膜を削除します。
- 米国ドリルに取り付けられた歯科用バーをる、定位座標で両半球上の頭蓋骨を介して2つの穴(直径0.7mm、深さ約1 mm)をトレパン:ブレグマへ7ミリメートル尾側、正中線に横3ミリメートルを。
- しっかりと足場を可能にするために〜1ミリメートル(ネジ曝さの2ミリメートル)の深さまで2既製の穴にステンレス製ビス(クロルヘキシジンで滅菌直径0.7ミリメートル、長さ3ミリメートル)にねじ込みます。根底にある皮質組織にダメージを与えることなく、これは、連絡先硬膜。
- 〜4と8時0縫合糸 - ガーゼで頭蓋骨を乾燥させ、そして2 3でたるんだ皮膚を後退させることにより歯科用アマルガムのための手術領域を準備します。
- 代わりに(ステップ1.10に記載されたステンレス鋼製ねじ)ねじ電極を固定するために露出した頭蓋骨の上に歯科用アマルガムを広げます。 〜ネジの1.5ミリメートルを記録するために露出したままで確認してください。
- 後退縫合糸を取り外します。
- 鎮痛および生理食塩水(塩化ナトリウム0.9%、1 0.5%カルプロフェン皮下(5ミリグラム/キログラム)を注入します水分補給のための0.5ミリリットル)を皮下。
- 動物は別々のケージで回復することを可能にします。それは胸骨横臥位を維持するのに十分な意識を取り戻したまで無人の動物を放置しないでください。
- それは完全に手術(最小5日)から回復するまで他の動物の会社に動物を返しません。
- 4日間一日一回鎮痛のための0.5%カルプロフェン皮下(5ミリグラム/キログラム)を管理し続けます。
- 録音ERGおよびVEP手術後1週間。
2. ERGおよびVEP記録
- データ収集の準備
- 同時に刺激を誘発し、以下の推奨設定に従ってデータ2を取得するためにコンピュータソフトウェアを使用してください。
- 内部で分離された前置増幅器と、増幅器により、インピーダンスをマッチ両目で設定された利得との間で信号3(x10,000:千、VEP×ERG)を増幅。
- 650の上に4 kHzにERGのためのサンプリングレートを設定しますミリ秒、書き込みウィンドウ(2560ポイント)、これを行うには、(ソフトウェアの名前とバージョン用材料のための表を参照)、サンプルのために「2560」を選択し、データ収集ソフトの「時間軸」のタブをクリックし、「500ミリ秒」時間を650ミリ秒の記録ウィンドウを返しますします。
- 250ミリ秒エポックの上に10 kHzにVEPのためのサンプリングレートを設定するために、同じメソッドを使用します。 ERGおよびVEPの両方の記録のための10ミリ秒の刺激前ベースラインを許可します。これを行うには、「設定」タブをクリックします。新しいダイアログウィンドウを開き、「刺激」を選択します。そのウィンドウで「モード」のためのドロップダウンリストから「パルス」を選択します。そして「10ミリ秒」に「遅延」の値を設定します。
- 千ヘルツ( - - 3デシベル)0.3にフィルタリングを設定するERGのバンドパス。これは、データ収集ソフトウェアの「バイオ・アンプ」をクリックすることによって行われます。そして、「0.3Hz」を「ハイ・パス」の値、および「1 kHzまでの「ローパス」の値を設定"。
- 100 Hzの( - - 3デシベル)ビジョン(ISCEV)の臨床電気生理学のための国際学会が推奨するように人間のVEPの録音6用の2.1.1.3に上記の方法を用いて、0.1にVEPバンドパス設定を行います。
- 同時に刺激を誘発し、以下の推奨設定に従ってデータ2を取得するためにコンピュータソフトウェアを使用してください。
- 電極の準備
- それぞれ2、電極リードに銀線またはワニ口クリップを取り付けることにより、ERGのアクティブ/非アクティブとVEPのアクティブ/非アクティブ電極をカスタムメイク。商業的に接地電極を得ます。
- 4カスタムメイドの電極は、電極リード延長からのオス側をカット。インナーワイヤを確実に手術用メスの刃が破損していないと、外側のポリテトラフルオロエチレン絶縁被膜の1cmに削除します。
- 事前ファッションラットの眼を取り囲むように、直径ループ〜8ミリメートルの銀線(厚さ0.3mm)の70ミリメートルの長さをカットし、形成することによりERG非アクティブ電極。 1ミリリットルピペットチップ上のループを成形することによって均一な円を準備します。 をプリファッションVEP非アクティブ電極。
- 事前ファッション銀線の30ミリメートルの長さをカットし、静かにラットの角膜に接触するように、小さなループを形成することによりERG活性電極(〜直径1〜mm)の
- 確実に露出した内部ワイヤーで銀をentwiningことにより、電極リードに電極(アクティブ2 ERG、非アクティブの2 ERG、1 VEPの非アクティブ)を添付。
- 太陽光発電のアーチファクトを低減するためにマスキングテープで過剰露出した金属を絶縁します。
- ERG非アクティブ電極上にげっ歯類のネックストラップに安定した取り付けを可能にするために、マスキングテープに面ファスナー(20ミリメートル×〜5ミリメートル)の小片を貼り付けます。
- VEP活性電極を作るために、電極リードのインナーワイヤにワニ口クリップを取り付けます。
- 録音の前に、銀配線の露出面( すなわち、非アクティブリングとACTIを電気めっき信号伝導を向上させるために20秒間9 V DC電源を使用して塩化物と先端)まし。
- これを行うには、通常の生理食塩水に(一次電池の負極として作用する)ERG電極ワイヤの銀先端を浸します。 9 Vバッテリーのプラス端子に、この電極ワイヤのもう一方の端を接続します。
- バッテリーのマイナス端子に別の配線(カソード)を接続し、同様に生理食塩水の中にもう一方の端を浸します。 20秒後に外し、白い色で均等にコーティングされるERG電極線のスライバーの先端を観察します。
注:塩化コーティングの開通性を確保するために、各実験セッションの新しいERG電極(〜最大8時間)を準備します。
- 動物の準備
- 一晩(≥8時間)前に遮光部屋でレコーディングに動物を暗適応させます。すべてのドアとブラインドを閉じ、部屋の照明をオフにすることで、最大暗順応を確認してください。周りの光を通さない素材を配置することによって、光漏れを最小限に抑えますドア/窓と太い黒のカーテンの外にコンピュータの画面を配置する接合部。
- ロッド感度を維持するために、暗赤色の発光ダイオード(17.4 cd.m -2、λ 最大 = 600nmのLED)の助けを借りて、暗い部屋で動物の準備を行っています。
- 筋肉内:(5ミリグラム/キログラム60)ケタミン/キシラジンを注入することにより、ラットを麻酔。足のピンチ反射の欠如によって麻酔の十分な深さを確認してください。
- 必要に応じて鎮静を維持するために、50分後に麻酔のさらなる用量(初期投与量の50%)を管理。
- 追加の局所麻酔のためにそれぞれの眼に0.5%proxymetacaineの1滴を適用し、過剰な液体をオフに点滅します。
- 瞳孔拡張のために、各眼に0.5%トロピカミドの一滴を適用し、その後、過剰な液体をオフに乾燥させます。
- ERGおよびVEP電極の位置
- ファラデーケージ内に位置全体野ボウルの前にERGプラットフォーム上で動物を置きます。それはCのような、電気加熱パッドを使用しないでください電気生理学的記録に電気的なノイズを導入します。注:プラットフォームは、体温を維持するために循環温水プラットフォームに取り付けられています。
- うなじの周りにしっかりとしっかりと配置されただけではない面ファスナーのストリップとプラットフォームへの安全な動物。
- 麻酔したラットの下門歯の周りに不活性なVEP電極を引っ掛けます。
- 目の赤道の周りに非侵襲的に強膜リングを囲むことにより、ERG非アクティブ電極を配置します。うなじの周囲面ファスナーストリップに電極を取り付けることにより、これを安定化させます。反対側の眼のために繰り返します。
- ステンレス製のネジ頭蓋骨に事前に移植さにワニ口クリップを取り付けることによりVEP活性電極を固定します。
- 信号品質を向上させるために前ERG活性電極の配置に角膜上の1%カルボキシメチルセルロースナトリウムの小滴を置きます。注:ビスコース液もminiに実験を通して角膜の水和を維持するのに役立ちますげっ歯類7における乾燥型白内障の形成をマイズ。
- VEP不活性電極ので、信号品質の接触を改善するために、下の前歯に1%カルボキシメチルセルロースナトリウムの小滴を置きます。
- 軽くカスタム構築された定位固定アームに取り付けられたマイクロマニピュレーターを用いて、中央の角膜表面に触れERG活性電極を配置します。
- 皮下尾にアース針電極(ステンレス製)の5ミリメートル - 2を挿入します。
- 必要に応じて、下眼瞼からの事前の信号品質を向上させるために記録に余分な液を乾燥させます。
- 近い動物の目は両方の網膜の均一な照明を可能にするためにボウルの開口部に合わせ確保全体野のボウルにスライドプラットフォーム(ステップ2.4.1を参照してください)。
- 外来ノイズを低減するためにファラデーケージを閉じます。
- データ収集
- 薄暗いテストフラッシュを使用します( - 0.52ログcd.sm -2)電極placemかどうかを評価しますENTは2満足のいくものです。対照条件下で、これは〜800μVのERG振幅と10%以下の間の眼の変動をもたらします。必要な再配置電極の場合。
- テスト・フラッシュ以下の暗適応記録の前に完全な暗闇で10分間に動物を可能にします。
- ERGおよびVEPを収集しながら、全体野のボウルを用いた光刺激の存在が点滅〜500ミリ秒の時間窓を介して同時に信号を送ります。特定の波形の十分な暗順応を維持するために明るい光レベルまで調光器からの進捗状況。
- STR、b波およびERGの/ b波の波形を引き出すために、発光エネルギーの範囲に渡って信号を収集します。平均よりディマー光レベルの信号(20リピート)と明るく発光エネルギー(1リピート)で少ないです。徐々に最も暗いから明るい光レベルに1から180秒に刺激間間隔を長くします。例えばプロトコルについては、 表1を参照してください。
- イソへ後半ERGロッドとコーンの応答、ペアリングフラッシュパラダイム8を利用します 。 1.52ログcd.smで4点滅を開始-2で-間500ミリ秒刺激間隔2で。デジタル推定されるロッド応答を誘導するために混合波形(1 回目のフラッシュ)からコーン波形( 第3または第 4 のフラッシュを)引きます。
- 明るく発光エネルギーでVEP信号、平均20のリピートを記録するには( すなわち 、 - 0.52ログcd.sm -2、5秒刺激間間隔1.52)。このシーケンスの最初のフラッシュは、従来の暗順応ERG応答を返すことに注意してください。
- 許可1 - (20)VEP後の再適応のための3分間は、光量に応じて、次の明るくERG工程の前に掃引します。
- データ収集が完了した後、ペントバルビタールナトリウム(325 mg / mlで3 ml)を心臓内注射で麻酔した動物を安楽死させます。
| 波形 | 刺激光エネルギー(cd.smを記録-2) | 繰り返し数 | 刺激間隔(秒) |
| STR | -6.24 | 20 | 2 |
| STR | -5.93 | 20 | 2 |
| STR | -5.6 | 20 | 2 |
| STR | -5.33 | 20 | 2 |
| ロッドb波 | -4.99 | 10 | 2 |
| ロッドb波 | -4.55 | 10 | 2 |
| ロッドb波 | -4.06 | 5 | 5 |
| ロッドb波 | -3.51 | 5 | 5 |
| ロッドb波 | -3.03 | 1 | 15 |
| ロッドb波 | -2.6 | 1 | 15 |
| ロッドb波 | -1.98 | 1 | 15 |
| ミックスA / B波 | -1.38 | 1 | 30 |
| ミックスA / B波 | -0.94 | 1 | 30 |
| フラッシュ1:20の混合A / B波の平均:VEP | -0.52 | 20 | 5 |
| (次の前90秒) | |||
| フラッシュ1:20の混合A / B波の平均:VEP | 0.04 | 20 | 5 |
| (次の前120秒) | |||
| フラッシュ1:20の混合A / B波の平均:VEP | 0.58 | 20 | 5 |
| (次の前180秒) | |||
| FLA時間1:20の混合A / B波の平均:VEP | 1.2 | 20 | 5 |
| (次の前180秒) | |||
| フラッシュ1:20の混合A / B波の平均:VEP | 1.52 | 20 | 5 |
| (次の前180秒) | |||
| コーンA / B波 | 1.52 | 4 | 0.5 |
刺激エネルギーの範囲を使用して、表1 ERGおよびVEP記録プロトコル。刺激プレゼンテーションは暗い適応を確実にするために十分な刺激間間隔で、明るい(下)が点滅に薄暗い(上)から進行します。プロトコルの最後に、短い間隔を有する4つのフラッシュの繰り返しは、円錐媒介応答を誘発するために提示されています。
ERG波形の3解析
注:ERGおよびVEPの分析は、以前に詳細に記載されている3,9,10ザ。次のセクションでは、簡単な概要を提供します。
- データ解析のための表計算ソフトへのデジタル電圧 - 時間形式でエクスポート信号。
- ロッドphotoreceptoral機能
- 遅延ガウス(式1)11とA波PIIIの先端をモデル化します。
トン>トンD(式1)のためのPIII(I、T)= RmのPIII∙[1 - EXP( - トン d)の 2 - 私は Sを∙( トン )] - 2明るい発光エネルギー12,13( すなわち 、1.22と1.52ログcd.sm -2)のアンサンブルの上にフィットを最適化します。
- ポストreceptoral侵入14を回避するために、A波の振幅の90%までのモデル。
注:このモデルはphotoreceptoral応答の飽和振幅(RmのPIII、μV)、感度(S、M 2 .cd -1 .S -3)と遅延(T dを、ミリ秒)を返します。
- 遅延ガウス(式1)11とA波PIIIの先端をモデル化します。
- 桿体双極細胞FUNCTイオン
- デジタル上層振動電位が混合PIIを返すために、混合波形から(上記参照)PIIIモデルを引きます。
- 混合PIIからロッドPIIを抽出するには、デジタルで錐体応答(1.52ログcd.smで3 番目か4 番目のフラッシュ -2)混合PII(1.52ログcd.smでの1 回目のフラッシュ-2)からを引きます。
- そして、振動電位を除去するために、波形(46.9 Hzで、-3dBで、ブラックマン窓)にローパスフィルタを適用します。残りの波形は、ロッドPII応答10です。
- ロッドPIIのピーク振幅を抽出し、10(1.52ログcd.sm -2で-2ログcd.sm -2とロッド絶縁PIIの下に)すべての刺激強度に対してそれをプロットします。
- 内側の網膜細胞の完全性の尺度を提供する双曲線関数(式2)を用いてこれらのデータをモデル化します。
V(i)は iが n個 (iが n /(V maxに =+ k個の N))(式2)
注:この式は、最大のPII応答(V 最大 、μV)、1 /感度(K、cd.sm-2を記録)、および機能(n)が15の傾きを返します。
- 錐体双極細胞機能
注:錐体応答が単一の強度(1.52ログcd.sm -2)で取られているように、振幅とタイミングは、この光レベルで再調整されています。- 最大のコーンPII応答2,16を抽出します。
- この最大の応答が2,16を対応するに暗黙の時間を抽出します。
- 神経節細胞の機能
- STRが小信号であるように、高い周波数とラインノイズ(46.9 Hzで、-3dBで、ブラックマン窓を)排除するために波形に50 Hzのノッチとローパスフィルタを適用します。
- 最大PSTR応答-3,17-を抽出します。
- この最大の応答が-3,17-を対応するに暗黙の時間を抽出します。
4.アナVEP波形の溶解
- VEP(P1、N1とP2)の最大値と最小値の構成要素を抽出します。詳細については参考文献3,6を参照してください。
- その前のピーク又は谷から谷・ツー・ピーク振幅としてエクスプレス振幅(P1N1とN1P2)3,6。
- ( それは P1 に 、N1 それ 、P2)3,6をこの最大応答の対応への暗黙の時間( それを )解凍します。
結果
ERG波(> -1.38ログcd.sm -2)、B波(> - 4.99ログcd.sm -2)のSTR(< - 4.99ログcd.sm -2)とVEPに(> - 0.52 cd.smを記録-2)( 図1および3)を同時に記録しました。非常に薄暗い点滅で約220ミリ秒( 図1および図2)では、正のSTR(PSTR)をフラッシュした後、約110ミリ秒を見られて、負のSTR(NSTR)。大B波とのERG、そのPII応答を分析することができる適度なフラッシュの発症後50〜100ミリ秒の間のピーク( 図1および図2)。この刺激エネルギーで、ピークの前に負の波は無視できます。明るく発光エネルギーでは負のたわみ波はPIII応答( 図2)を用いて定量することができる、より顕著になります。続い - ;暗所視のVEP波形は否定応答(70ミリ秒ウィンドウ15 P1N1)を示しています正の振れ(N1P2; 30から100ミリ秒)( 図3と図4)。
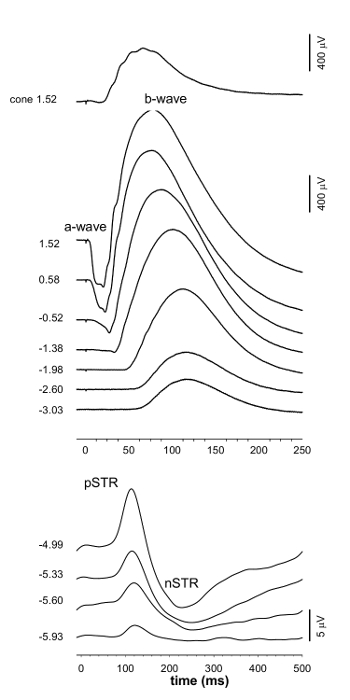
図1.グループの平均ERG波形。ERGは、刺激強度の増加に伴って変化します。波形の左側の数字は、波形を誘発するために使用露光量を示しています。パネルごとに異なる振幅と時間スケールを注意してください。調光器の発光エネルギーでは暗順応閾値応答の正と負のコンポーネントが(PSTR、NSTR)誘発することができます。刺激エネルギーが明るくなるにつれ、aおよびb波応答をアッセイすることができる、と対になっフラッシュパラダイムは、錐体応答を測定することができる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
PLOAD / 54158 / 54158fig2.jpg "/>
図2 ERG分析を示す。(A)桿体機能は、A波をモデル化するためにPIIIを用いてアッセイすることができます。 1.22と1.52ログcd.sm -2(白丸、○)での波はRmのPIII(飽和振幅、μV)を返す最小の90%にPIII(灰色の線、式1)とのアンサンブルとして適合していますS(感度、メートル2 .cd -1 .S -3)とTD(タイミングの遅延、ミリ秒)パラメータを設定します。(B)ロッド双極細胞の機能は、(平均±SEM)ロッドPIIの強度応答シリーズをモデル化することによってアッセイすることができます那珂ラシュトン機能(灰色の線)と(白丸○)。これは、V 最大 (飽和振幅、μV)を返し、K(1 /感度、CDのSMを記録-2)とn(スロープ)。(C)網膜神経節細胞の機能は、薄暗い光エネルギーでアッセイし、PSTRのピーク振幅によって定量化される(PSTR アンペア )とタイミング( それ PSTR UB>)。(D)コーン双極細胞の機能は、コーンPIIのピーク振幅(コーンPII アンプ )とタイミング(コーンPII それ )によって定量化ペアリングフラッシュパラダイムで誘発される。 この図の拡大版をご覧になるにはこちらをクリックしてください。
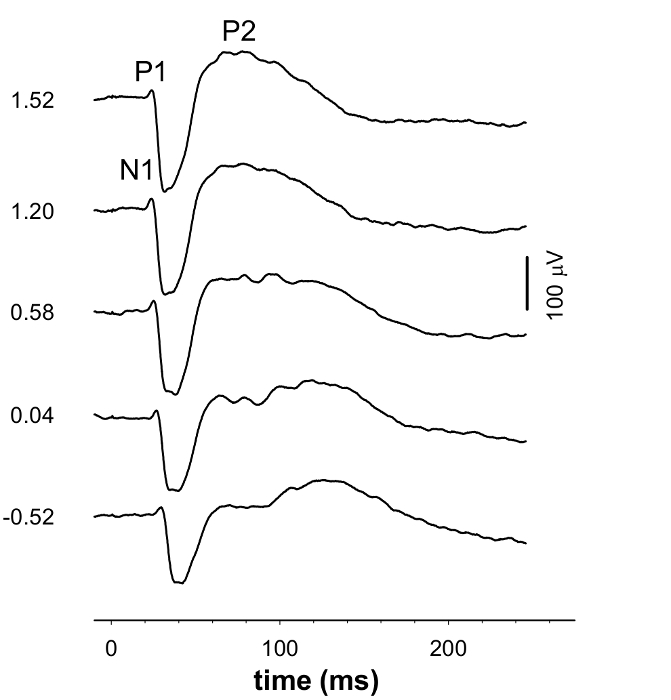
図3.グループの平均VEP波形。VEP波形の形状は、刺激エネルギーの増加に伴って変化します。波形の左側の数字は、波形を誘発するために使用される露光量を示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
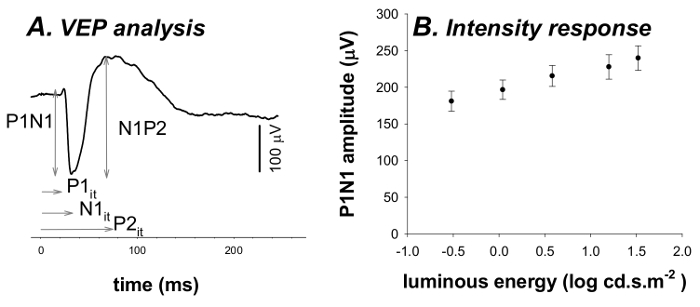
Figu4. VEPの解析と強度応答関数再。 (A)VEPの振幅分析は(P1N1)の谷と(N1P2)振幅をピークに谷するピークとします。これらの応答の暗黙的な倍は( それ )も返されます(P1 それ 、N1 それ 、P2 それ )。(B)VEP P1N1振幅(平均±SEM)刺激エネルギーの増加に伴って増加する。 の拡大版をご覧になるにはこちらをクリックしてください。この図。
ディスカッション
ERGおよびVEPはそれぞれ網膜と皮質からの視覚機能の客観的な尺度です。同時記録の利点は、全体の視覚経路のより包括的なビューが与えられるということです。具体的には、それらの同時評価から補足情報は例えば、視神経障害がプライマリ脳萎縮19と共存することができる、ERGはまだ明確なVEPは18症状重複する障害のために(視覚路に損傷部位の鮮明な描写を提供することができ、 20、またはVEP損失)は視覚路21,22にいくつかの場所での怪我の症状によって混乱することができるとき。同時にERGおよびVEPを測定することによって、網膜および皮質応答の間のゲインの指数も導出することができます。これは微妙な病理学的変化を検出するための有用なツールを提供することができます。現在のプロトコルは、一般的に使用される実験用ラットにERGおよびVEP測定を可能にするが、容易に広告することができます他の哺乳動物種23-25 にapted。げっ歯類からERGおよびVEP波形は26-28人間の目で観察された応答のための合理的な前臨床サロゲートを提供します。
特定の刺激プロトコルを設計することにより、双方のERGおよびVEP応答が単一の記録セッション中に取得することができる。 表1は、連続フラッシュ間の回復時間を適切に考慮した光レベルの進行を示しています。キシラジン:このプロトコルは、信号対雑音特性を最大にし、ケタミンの単回投与によって提供麻酔ウィンドウ内録画時間を制限する必要性とのバランスを提供します。従って、この技術は、基本的な生理機能および疾患の研究のための視覚機能の客観的な定量的測定のために有用であり得ます。
視覚系の総合的な評価は、同時に両側性網膜応答と視覚誘発皮質応答を評価することにより達成することができます。しかし、各技術は、単独で実施することができ、単眼の代わりに、両眼の手順を簡略化します。現在のプロトコルは、ラットは、ロッド支配網膜を持っていることを考えると、ロッドの経路を分離するために選ばれた暗順応ERGおよびVEP信号を説明しています。光適合応答が研究に大きな関心がある場合には、背景光に予め適応によって明ERGおよびVEP信号を行うことも可能です。
この手法の1つの主要な制限は、安定した電極配置を可能にするために麻酔条件下で手順を実施する必要があります。それにもかかわらず、このアプローチは、微妙な処理変化の検出を可能にする堅牢な信号対ノイズ特性を提供します。
STRと光順応に対する感度の小振幅に、いくつかのステップが密接にこの応答の成功記録を確実にするために観察する必要があります。まず、十分な暗順応を含む、実施される必要があります0.52ログCD -薄暗いテストフラッシュ(10分以下の一夜暗暗赤色照明下での適応(≥8時間)、電極配置(17.4 cd.m -2、λ 最大 = 600 nm)であり、再暗順応。 SM -2)。さらに、STRの信号対雑音特性が短い刺激間間隔( すなわち 、2秒)で収集し、複数の信号( 即ち、20信号)にわたって平均することによって改善することができます。目と皮質の両方のこの包括的な評価の利点の1つは、反対側の記録3との比較を可能にすることです。このように、特に注意は、最小限の眼間と間の皮質の変動性を確保するために、( すなわち 、同じ大きさと形状の電極)電極の製造に取られるべきです。
生体内の視覚路の対策とその疾患関連のプロセスに提供するために、両方のERGおよびVEP技術の広範な利用を考えると、他の経路特異的Pを照合するために有用であろうrotocols( 例えば 、ON / OFFまたはコーンサブタイプ特異的)、および臨床診断にこの技術のアプリケーションを拡張するために、異なる刺激モダリティ( 例えば 、ちらつき、パターン、のこぎり波)との同時ERG / VEPの記録を行います。将来的には、このアプリケーションのもう一つの論理的なステップはまた、神経生理学30に麻酔薬の影響を避けるために、意識的な29から同時に自由に動く動物をERGおよびVEPを記録することであろう。
開示事項
The authors have no disclosures relevant to this work.
謝辞
Funding for this project was provided by the National Health and Medical Research Council (NHMRC) 1046203 (BVB, AJV) and Melbourne Neuroscience Institute Fellowship (CTN).
資料
| Name | Company | Catalog Number | Comments |
| Alligator clip | generic brand | HM3022 | Stainless steel 26 mm clip for connecting VEP screw electrodes to cables |
| Bioamplifier | ADInstruments | ML 135 | For amplifying ERG and VEP signals |
| Carboxymethylcellulose sodium 1.0% | Allergan | CAS 0009000-11-7 | Viscous fluid for improving signal quality of the active ERG electrode |
| Carprofen 0.5% | Pfizer Animal Health Group | CAS 53716-49-7 | Proprietary name: Rimadyl injectable (50 mg/ml). For post-surgery analgesia, diluted to 0.5% (5 mg/ml) in normal saline |
| Chlorhexadine 0.5% | Orion Laboratories | 27411, 80085 | For disinfecting surgical instruments |
| Circulating water bath | Lauda-Königshoffen | MGW Lauda | For maintaining body temperature of the anesthetized animal during surgery and electrophysiological recordings |
| Dental amalgam | DeguDent GmbH | 64020024 | For encasing the electrode-skull assembly to make it more robust |
| Dental burr | Storz Instruments, Bausch and Lomb | #E0824A | A miniature drill head of ~ 0.7 mm diameter for making a small hole in the skull over each hemisphere to implant VEP screws |
| Drill | Bosch | Dremel 300 series | An automatic drill for trepanning |
| Electrode lead | Grass Telefactor | F-E2-30 | Platinum cables for connecting silver wire electrodes to the amplifier |
| Faraday Cage | custom-made | Ensures light proof to maintain dark adaptation. Encloses the Ganzfeld setup to improve signal to noise ratio | |
| Gauze swabs | Multigate Medical Products Pty Ltd | 57-100B | For drying the surgical incision and exposed skull surface during surgery |
| Ganzfeld integrating sphere | Photometric Solutions International | Custom designed light stimulator: 36 mm diameter, 13 cm aperture size | |
| Velcro | VELCRO Australia Pty Ltd | VELCRO Brand Reusable Wrap | Hook-and-loop fastener to secure the electrodes and the animal on the recording platform |
| Isoflurane 99.9% | Abbott Australasia Pty Ltd | CAS 26675-46-7 | Proprietary Name: Isoflo(TM) Inhalation anaaesthetic. Pharmaceutical-grade inhalation anesthetic mixed with oxygen gas for VEP electrode implant surgery |
| Ketamine | Troy Laboratories | Ilium Ketamil | Proprietary name: Ketamil Injection, Brand: Ilium. Pharmaceutical-grade anesthetic for electrophysiological recording |
| Luxeon LEDs | Phillips Lighting Co. | For light stimulation twenty 5 W and one 1 W LEDs. | |
| Micromanipulator | Harvard Apparatus | BS4 50-2625 | Holds the ERG active electrode during recordings |
| Needle electrode | Grass Telefactor | F-E2-30 | Subcutaneously inserted in the tail to serve as the ground electrode for both the ERG and VEP |
| Phenylephrine 2.5% minims | Bausch and Lomb | CAS 61-76-7 | Instilled with Tropicamide to achieve maximal dilation for ERG recording |
| Povidone iodine 10% | Sanofi-Aventis | CAS 25655-41-8 | Proprietory name: Betadine, Antiseptic to prepare the shaved skin for surgery 10%, 500 ml |
| Powerlab data acquisition system | ADInstruments | ML 785 | Controls the LEDs |
| Proxymetacaine 0.5% | Alcon Laboratories | CAS 5875-06-9 | For corneal anaesthesia during ERG recordings |
| Saline solution | Gelflex | Non-injectable, for electroplating silver wire electrodes | |
| Scope Software | ADInstruments | version 3.7.6 | Simultaneously triggers the stimulus via the Powerlab system and collects data |
| Silver (fine round wire) | A&E metal | 0.3 mm | Used to make active and inactive ERG electrodes, and the inactive VEP electrode |
| Stainless streel screws | MicroFasterners | 0.7 mm shaft diameter, 3 mm in length to be implanted over the primary visual cortex and serve as the active VEP electrodes | |
| Stereotaxic frame | David Kopf | Model 900 | A small animal stereotaxic instrument for locating the primary visual cortices according to Paxinos & Watson's 2007 rat brain atlas coordinates |
| Surgical blade | Swann-Morton Ltd. | 0206 | For incising the area of skin overlaying the primary visual cortex to implant the VEP electrodes |
| Suture | Shanghai Pudong Jinhuan Medical Products Co.,Ltd | 3-0 silk braided suture non-absorbable, for skin retraction during VEP electrode implantation surgery | |
| Tobramycine eye ointment 0.3% | Alcon Laboratories | CAS 32986-56-4 | Proprietary name: Tobrex. Prophylactic antibiotic ointment applied around the skin wound after surgery |
| Tropicamide 0.5% | Alcon Laboratories | CAS 1508-75-4 | Proprietary name: 0.5% Mydriacyl eye drop, Instilled to achieve mydriasis for ERG recording |
| Xylazine | Troy Laboratories | Ilium Xylazil-100 | Pharmaceutical-grade anesthetic for electrophysiological recording |
| Pipette tip | Eppendorf Pty Ltd | 0030 073.169 | Eppendorf epTIPS 100 - 5,000 ml, for custom-made electrodes |
| Microsoft Office Excel | Microsoft | version 2010 | spreadsheet software for data analysis |
| Lethabarb Euthanazia Injection | Virbac (Australia) Pty Ltd | LETHA450 | 325 mg/ml pentobarbital sodium for rapid euthanazia |
参考文献
- Nguyen, C. T. O., Vingrys, A. J., Bui, B. V. Dietary omega-3 fatty acids and ganglion cell function. Invest Ophthalmol Vis Sci. 49, 3586-3594 (2008).
- Weymouth, A. E., Vingrys, A. J. Rodent electroretinography: methods for extraction and interpretation of rod and cone responses. Prog Retin Eye Res. 27, 1-44 (2008).
- Tsai, T. I., Bui, B. V., Vingrys, A. J. Effect of acute intraocular pressure challenge on rat retinal and cortical function. Invest Ophthalmol Vis Sci. 55, 1067-1077 (2014).
- Cowey, A., Franzini, C. The retinal origin of uncrossed optic nerve fibres in rats and their role in visual discrimination. Exp Brain Res. 35, 443-455 (1979).
- Weinstein, G. W., Odom, J. V., Cavender, S. Visually evoked potentials and electroretinography in neurologic evaluation. Neurol Clin. 9, 225-242 (1991).
- Odom, J. V., et al. Visual evoked potentials standard (2004). Doc Ophthalmol. 108, 115-123 (2004).
- Ridder, W. H., Nusinowitz, S., Heckenlively, J. R. Causes of cataract development in anesthetized mice. Exp Eye Res. 75, 365-370 (2002).
- Nixon, P. J., Bui, B. V., Armitage, J. A., Vingrys, A. J. The contribution of cone responses to rat electroretinograms. Clin Experiment Ophthalmol. 29, 193-196 (2001).
- Bui, B. V., et al. Using the electroretinogram to understand how intraocular pressure elevation affects the rat retina. J Ophthalmol. 2013, 262467(2013).
- Nguyen, C. T., Vingrys, A. J., Bui, B. V. Dietary omega-3 fatty acids and ganglion cell function. Invest Ophthalmol Vis Sci. 49, 3586-3594 (2008).
- Hood, D. C., Birch, D. G. A quantitative measure of the electrical activity of human rod photoreceptors using electroretinography. Vis Neurosci. 5, 379-387 (1990).
- Birch, D. G., Hood, D. C., Locke, K. G., Hoffman, D. R., Tzekov, R. T. Quantitative electroretinogram measures of phototransduction in cone and rod photoreceptors - Normal aging, progression with disease, and test-retest variability. Arch Ophthalmol. 120, 1045-1051 (2002).
- Bui, B. V., Vingrys, A. J. Development of receptoral responses in pigmented and albino guinea-pigs (Cavia porcellus). Doc Ophthalmol. 99, 151-170 (1999).
- Robson, J. G., Saszik, S. M., Ahmed, J., Frishman, L. J. Rod and cone contributions to the a-wave of the electroretinogram of the macaque. J Physiol. 547, 509-530 (2003).
- Severns, M. L., Johnson, M. A. The care and fitting of Naka-Rushton functions to electroretinographic intensity-response data. Doc Ophthalmol. 85, 135-150 (1993).
- Bui, B. V., Fortune, B. Origin of electroretinogram amplitude growth during light adaptation in pigmented rats. Vis Neurosci. 23, 155-167 (2006).
- Bui, B. V., Fortune, B. Ganglion cell contributions to the rat full-field electroretinogram. J Physiol. 555, 153-173 (2004).
- Tremblay, F., Laroche, R. G., Debecker, I. The Electroretinographic Diagnosis of the Incomplete Form of Congenital Stationary Night Blindness. Vision Res. 35, 2383-2393 (1995).
- Bayer, A. U., Keller, O. N., Ferrari, F., Maag, K. P. Association of glaucoma with neurodegenerative diseases with apoptotic cell death: Alzheimer's disease and Parkinson's disease. Am J Ophthalmol. 133, 135-137 (2002).
- Wostyn, P., Audenaert, K., De Deyn, P. P. An abnormal high trans-lamina cribrosa pressure difference: A missing link between Alzheimer's disease and glaucoma. Clinical Neurology and Neurosurgery. 110, 753-754 (2008).
- Yucel, Y. H., Zhang, Q. A., Weinreb, R. N., Kaufman, P. L., Gupta, N. Effects of retinal ganglion cell loss on magno-, parvo-, koniocellular pathways in the lateral geniculate nucleus and visual cortex in glaucoma. Prog Retin Eye Res. 22, 465-481 (2003).
- Gupta, N., Yucel, Y. H. What changes can we expect in the brain of glaucoma patients. Survey of Ophthalmology. 52, 122-126 (2007).
- Kong, Y. X., et al. Impact of aging and diet restriction on retinal function during and after acute intraocular pressure injury. Neurobiol Aging. 33, 1115-1125 (2012).
- Bui, B. V., Sinclair, A. J., Vingrys, A. J. Electroretinograms of albino and pigmented guinea-pigs (Cavia porcellus). Aust N Z J Ophthalmol. 26, Suppl 1 98-100 (1998).
- Jobling, A. I., Wan, R., Gentle, A., Bui, B. V., McBrien, N. A. Retinal and choroidal TGF-beta in the tree shrew model of myopia: isoform expression, activation and effects on function. Exp Eye Res. 88, 458-466 (2009).
- Robson, J. G., Frishman, L. J. Dissecting the dark-adapted electroretinogram. Doc Ophthalmol. 95, 187-215 (1998).
- Robson, J. G., Frishman, L. J. The rod-driven a-wave of the dark-adapted mammalian electroretinogram. Prog Retin Eye Res. 39, 1-22 (2014).
- Hudnell, H. K., Boyes, W. K. The comparability of rat and human visual-evoked potentials. Neurosci Biobehav Rev. 15, 159-164 (1991).
- Charng, J., et al. Conscious wireless electroretinogram and visual evoked potentials in rats. PLoS One. 8, e74172(2013).
- Hetzler, B. E., Berger, L. K. Ketamine-Induced Modification of Photic Evoked-Potentials in the Superior Colliculus of Hooded Rats. Neuropharmacology. 23, 473-476 (1984).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved