Method Article
Registrazione simultanea di elettroretinografia e Potenziali evocati visivi nei ratti anestetizzati
In questo articolo
Riepilogo
This protocol describes simultaneous measurement of electroretinogram and visual evoked potentials in anesthetized rats.
Abstract
The electroretinogram (ERG) and visual evoked potential (VEP) are commonly used to assess the integrity of the visual pathway. The ERG measures the electrical responses of the retina to light stimulation, while the VEP measures the corresponding functional integrity of the visual pathways from the retina to the primary visual cortex following the same light event. The ERG waveform can be broken down into components that reflect responses from different retinal neuronal and glial cell classes. The early components of the VEP waveform represent the integrity of the optic nerve and higher cortical centers. These recordings can be conducted in isolation or together, depending on the application. The methodology described in this paper allows simultaneous assessment of retinal and cortical visual evoked electrophysiology from both eyes and both hemispheres. This is a useful way to more comprehensively assess retinal function and the upstream effects that changes in retinal function can have on visual evoked cortical function.
Introduzione
Misura della elettroretinogramma (ERG) e potenziali evocati visivi (PEV) fornire valutazioni quantitative utili dell'integrità della via visiva. L'ERG misura le risposte elettriche della retina alla stimolazione luminosa, mentre il VEP misura corrispondente integrità funzionale delle vie visive dalla retina alla corteccia visiva primaria seguendo lo stesso evento luce. Questo manoscritto descrive un protocollo per la registrazione e analisi delle risposte ERG e PEV in un modello di laboratorio comunemente usato, il ratto.
Il ERG fornisce un indice della integrità funzionale di un certo numero di classi principali di cellule retiniche quantificando risposta elettrica lordo del retina un lampo di luce. Una serie coordinata di flussi ionici iniziata da insorgenza luce e offset, producono cambiamenti rilevabili in tensione che può essere misurato con elettrodi di superficie posizionati al di fuori dell'occhio. La forma d'onda risultante rappresenta la combinazione di un séRies di componenti ben definiti, che differiscono in ampiezza, i tempi e la frequenza. Una importante ricerca ha dimostrato che questi componenti sono relativamente ben conservati tra i molti retine vertebrati e che i componenti possono essere separati l'uno dall'altro. Selezionando giudiziosamente lo stimolo (stimolo flash, sfondo, intervallo interstimulus) le condizioni e la scelta di caratteristiche specifiche della forma d'onda composita di analizzare si può essere sicuri di tornare una misura di un gruppo specifico di cellule retiniche 1,2. Queste caratteristiche sono alla base del programma di utilità e quindi le applicazioni diffuse della ERG come una misura non invasiva della funzione della retina. Questo manoscritto si concentra sulla metodologia per misurare l'ERG e analizzando le sue caratteristiche per restituire informazioni su alcune delle principali classi di cellule nella retina, vale a dire fotorecettori (il componente PIII), cellule bipolari (il componente PII) e le cellule gangliari della retina (il positivo risposta soglia scotopica o PSTR).
Il VEP offre un saggio della risposta corticale alla luce; prima proveniente dalla retina e successivamente comunicato seriale tramite il nervo ottico, tratto ottico, talamo (genicolato laterale nucleo, LGN) e la radiazione ottica all'area V1 della corteccia 3. Nei roditori, la maggioranza (90 - 95%) di fibre del nervo ottico da ciascun occhio decussate 4 e innervano controlaterale cervello medio. A differenza della ERG, è ancora possibile attribuire diversi componenti del VEP a classi cellulari specifici, 5 cambia così ovunque lungo il percorso visivo potrebbe influenzare la forma d'onda VEP. Tuttavia, il VEP è una misura utile non invasiva di prestazioni visive e dell'integrità via visiva. Il VEP, quando utilizzato in combinazione con l'ERG, può fornire una valutazione più completa del sistema visivo (cioè, retina / via visiva).
ERG e PEV registrazioni possono essere condotte isolatamente o in combinazione, a seconda del applicazione. La metodologia descritta in questo documento permette la valutazione contemporanea di elettrofisiologia evocati visivi della retina e corticale da entrambi gli occhi e entrambi gli emisferi nei ratti anestetizzati. Questo è un modo utile per valutare in modo più completo la funzione della retina e gli effetti a monte che i cambiamenti nella funzione retinica possono avere sulla funzione corticale evocati visivi.
Protocollo
Tutte le procedure sperimentali sono state condotte secondo il Codice di condotta australiano per la cura e l'uso di animali a scopi scientifici, stabilito dal National Health and Medical Research Council in Australia. Etica spazio è stato ottenuto presso l'Università di Melbourne, Facoltà di Scienze, comitato etico degli animali (numero di riconoscimento 0.911.322,1).
1. Pre-impianto di elettrodi cronica VEP
Nota: Se simultanei segnali ERG e PEV devono essere raccolti gli animali devono essere impiantati chirurgicamente con VEP elettrodi di almeno 1 settimana prima per segnalare la raccolta.
- Sterilizzare la panchina chirurgica prima sperimentazione pulendo con clorexidina (0,5% nel 70% di etanolo). Autoclave tutte apparecchi chirurgici prima dell'uso. Coprire l'animale con un telo chirurgico sterilizzato. Assicurarsi che tutti gli sperimentatori indossare mascherine chirurgiche, camici e guanti sterilizzati.
- Indurre l'anestesia: 3 - 3,5% isoflurano con O 2 ad una portata di 3 l / min. mantenere anesthesia al 1,5% e 2 L / min durante l'intervento chirurgico. Garantire la sufficiente profondità dell'anestesia per l'assenza di zampa pizzico reflex.
- Applicare 1% di sodio carbossimetilcellulosa sulla cornea per evitare l'essiccazione degli occhi.
- Rasatura 30 mm Area x 30 mm sopra la fronte, posteriormente agli occhi e anteriore alle orecchie.
- Mettere animale su un blocco di calore (37 ° C) per mantenere la temperatura corporea e stabilizzare la testa animali con un telaio stereotassico.
- Disinfettare la zona rasata con il 10% povidone-iodio tre volte. Evitare l'uso di antisettici a base alcolica per l'area vicino all'occhio, essere coerente con la norma di prassi illustrato dall'Associazione dei tecnologi chirurgici.
- Effettuare una incisione mediana sagittale sulla testa con un bisturi e da questo accise un ~ 20 millimetri cerchio di diametro di tessuto dermico per esporre l'osso cranico.
- Rimuovere periostio sottostante raschiando e asciugare con una garza per esporre le suture craniche coronali e sagittali.
- Noiing una fresa dentale attaccato ad un trapano, trapano due fori (0,7 mm di diametro, profondità ~ 1 mm) attraverso il cranio su entrambi gli emisferi ai stereotassica coordinate: 7 mm caudale a Bregma 3 mm lateralmente alla linea mediana.
- Avvitare viti in acciaio inossidabile (diametro 0,7 mm lunghezza 3 mm sterilizzato con clorexidina) nei due fori pre-fatti fino ad una profondità di circa 1 mm (2 mm vite esposto) per consentire fissaggio sicuro. Questa contatti la dura senza danneggiare il tessuto corticale sottostante.
- Preparare area chirurgica per l'amalgama dentale con l'essiccazione l'osso cranico con una garza, e ritraendo pelle flaccida con due 3-0 punti di sutura a ~ 4 e 08:00.
- Stendere l'amalgama dentale sul cranio esposto per fissare gli elettrodi a vite (viti in acciaio inox descritte al punto 1.10) in atto. Assicurarsi ~ 1,5 mm delle viti rimangono esposti per la registrazione.
- Rimuovere le suture retrazione.
- Iniettare 0,5% sottocutanea carprofen (5 mg / kg) per l'analgesia e soluzione salina (cloruro di sodio 0,9%, 10,5 ml) per via sottocutanea per la sostituzione del fluido.
- Lasciare animali di recuperare in gabbie separate. Non lasciare animali incustoditi fino a quando non ha ripreso conoscenza sufficiente a mantenere decubito sternale.
- Non restituire animali alla compagnia di altri animali fino a quando non ha pienamente recuperato da un intervento chirurgico (minimo 5 giorni).
- Continuare somministrare 0,5% sottocutanea carprofen per l'analgesia (5 mg / kg) una volta al giorno per 4 giorni.
- Record ERG e PEV 1 settimana dopo l'intervento.
2. ERG e PEV registrazione
- Preparazione La raccolta dei dati
- Utilizzare il software del computer per attivare contemporaneamente stimolo e acquisire dati 2 in base alle impostazioni consigliate di seguito.
- Amplificare i segnali 3 (ERG: × 1.000, VEP: x10,000) con il guadagno impostato internamente da un isolato di pre-amplificatore e amplificatore, e con entrambi gli occhi abbinati per l'impedenza.
- frequenza di campionamento Set per l'ERG a 4 kHz per un 650finestra di registrazione msec (2.560 punti), per fare questo, fare clic sulla scheda per la "base dei tempi" nel software di acquisizione dati (per il nome e la versione del software si veda la tabella dei materiali), selezionare "2560" per i campioni, e "500 ms" per il tempo che restituirà una finestra di registrazione di 650 msec.
- Utilizzare lo stesso metodo per impostare la frequenza di campionamento per la VEP a 10 kHz sopra un'epoca msec 250. Lasciare un msec base 10 pre-stimolo per entrambe le registrazioni ERG e PEV. Per fare questo, fare clic sulla scheda "Impostazioni"; selezionare "stimolatore" per aprire una nuova finestra di dialogo; in quella finestra selezionare "pulse" dalla discesa di "Mode" verso il basso; e impostare il valore per il "ritardo" a "10 ms".
- Passa-banda Set ERG filtraggio a 0,3 - 1.000 Hz (- 3 dB). Questo viene fatto clic "Bio Amplifier" nel software di acquisizione dati. Quindi impostare il valore per "passa alto" a "0.3Hz", e il valore per "passa-basso" a "1 kHz".
- Utilizzando il metodo di cui sopra in 2.1.1.3, impostare le impostazioni passa-banda VEP a 0.1 - 100 Hz (- 3 dB), come raccomandato dalla Società Internazionale per Elettrofisiologia clinica di Vision (ISCEV) per le registrazioni VEP umano 6.
- Utilizzare il software del computer per attivare contemporaneamente stimolo e acquisire dati 2 in base alle impostazioni consigliate di seguito.
- preparazione degli elettrodi
- Custom-fare le ERG elettrodi attivi / Inattivo Attivo / inattivo e VEP collegando filo d'argento o di un coccodrillo ad un cavo elettrodo, rispettivamente, 2. Commercialmente ottenere elettrodo di massa.
- Per i 4 elettrodi su misura, tagliare l'estremità maschio dall'estensione piombo degli elettrodi. Rimuovere 1 cm del rivestimento isolante politetrafluoroetilene esterna con una lama di bisturi garantire il filo interno non sia danneggiato.
- Pre-fashion le ERG elettrodi inattive tagliando una lunghezza di 70 mm filo d'argento (spessore 0,3 millimetri) e forma un anello ~ 8 mm di diametro per circondare l'occhio di ratto. Preparare un cerchio uniforme modellando l'anello su una punta della pipetta 1 ml.
- Pre-fashion PEV elettrodi inattive tagliando una lunghezza di 70 mm argento e formare un'ellisse ~ 8 mm di diametro senso della lunghezza per agganciare incisivi ratto.
- Pre-moda le ERG elettrodi attivi dal taglio di una lunghezza di 30 mm di filo d'argento e formando un piccolo anello di contattare delicatamente la cornea di ratto (~ 1-2 mm di diametro)
- Fissare in modo sicuro elettrodi (2 ERG attiva, 2 ERG inattivo, 1 VEP inattivo) al cavo di elettrodo intrecciando l'argento con il filo interno esposto.
- Isolare metallo esposto in eccesso con del nastro adesivo per ridurre gli artefatti fotovoltaici.
- Sugli elettrodi inattive ERG bastone un piccolo pezzo di gancio-e-velcro (di ~ 5 mm × 20 mm) per il nastro adesivo per consentire l'attaccamento stabile per la tracolla roditore.
- Fissare coccodrillo per il filo interno dell'elettrodo porta a fare gli elettrodi attivi PEV.
- Prima di registrazioni, placcare le superfici esposte dei fili d'argento (cioè, l'anello inattiva e active punta) con cloruro utilizzando una fonte 9 V CC per 20 secondi per migliorare la conduzione del segnale.
- Per fare questo, immergere la punta d'argento del filo dell'elettrodo ERG (in qualità di anodo di una cella primaria) in soluzione fisiologica; collegare l'altra estremità del filo dell'elettrodo al terminale positivo di una batteria 9 V.
- Collegare un altro filo (catodo) al terminale negativo della batteria, ed immergere l'altra estremità in salina pure. Scollegare dopo 20 secondi e osservare la punta frammento del filo dell'elettrodo ERG da rivestire in modo uniforme nel colore bianco.
Nota: Preparare nuovi elettrodi ERG per ogni sessione sperimentale (~ fino a 8 ore) per assicurare la pervietà del rivestimento di cloruro.
- preparazione degli animali
- Dark-adattare gli animali durante la notte (≥ 8 ore) prima di registrazioni in una camera a tenuta di luce. Garantire la massima adattamento al buio spegnendo luci della stanza, chiudendo tutte le porte e le persiane. Ridurre al minimo la dispersione della luce mettendo materiali a prova di luce intornogiunzioni di porte / finestre e schermi di computer collocazione al di fuori spesse tende nere.
- Condurre la preparazione degli animali in una stanza buia con l'aiuto di dim rosso diodi emettitori di luce (LED; 17,4 cd.m -2, λ max = 600 nm) per sostenere la sensibilità asta.
- Anestetizzare ratto iniettando ketamina / xilazina (60: 5 mg / kg) per via intramuscolare. Conferma sufficiente profondità dell'anestesia dall'assenza di un riflesso paw pinch.
- Per mantenere sedazione, somministrare una dose aggiuntiva di anestesia (50% della dose iniziale) dopo 50 min se necessario.
- Per ulteriori anestesia topica applicare una goccia di 0,5% proximetacaina a ciascun occhio, e lampeggia fuori il liquido in eccesso.
- Per la dilatazione della pupilla applicare una goccia di 0,5% tropicamide a ciascun occhio, poi asciugare il liquido in eccesso.
- ERG e PEV posizionamento degli elettrodi
- Posizionare animale sulla piattaforma di ERG davanti ciotola Ganzfeld situata nella gabbia di Faraday. Evitare l'uso di un rilievo di riscaldamento elettrico, come si cun introdurre rumore elettrico nelle registrazioni elettrofisiologiche. Nota: La piattaforma è collegata a una piattaforma circolare acqua riscaldata per mantenere la temperatura corporea.
- animale sicuro alla piattaforma con una striscia di gancio-e-velcro posto con fermezza, ma non strettamente intorno alla nuca.
- Agganciare gli inattivi VEP elettrodo intorno incisivi inferiori del topo anestetizzato.
- Posizionare gli elettrodi inattive ERG circondando l'anello sclerale in modo non invasivo intorno all'equatore dell'occhio. Stabilizzare questo collegando gli elettrodi alla striscia di fissaggio hook-and-loop intorno alla nuca. Ripetere l'operazione per l'occhio controlaterale.
- Fissare VEP elettrodi attivi per il fissaggio morsetti a coccodrillo di viti in acciaio inossidabile pre-impiantati sul cranio.
- Mettere una piccola goccia di 1% di sodio carbossimetilcellulosa sulla cornea prima del posizionamento dell'elettrodo attivo ERG per migliorare la qualità del segnale. Nota: Il fluido viscoso aiuta anche a mantenere l'idratazione corneale durante la sperimentazione di miniMize la formazione di essiccazione-tipo di cataratta nei roditori 7.
- Mettere una piccola goccia di 1% sodio carbossimetilcellulosa sugli incisivi inferiori per migliorare il contatto dell'elettrodo inattiva VEP e quindi segnalare qualità.
- Posizionare gli elettrodi attivi ERG a toccare leggermente la superficie corneale centrale utilizzando un micromanipolatore attaccato ad un braccio stereotassica custom-built.
- Inserire 2 - 5 mm dell'elettrodo spillo terra (acciaio inox) per via sottocutanea nella coda.
- Se necessario asciugare il liquido in eccesso dalla palpebra inferiore prima di registrare per migliorare la qualità del segnale.
- piattaforma di scorrere più vicino alla ciotola Ganzfeld assicurare gli occhi dell'animale si allineano con l'apertura della vasca per consentire un'illuminazione uniforme di entrambe le retine (vedi punto 2.4.1).
- Chiudere la gabbia di Faraday per ridurre il rumore estranei.
- Raccolta dati
- Utilizzare un dim test-flash (- 0,52 log cd.sm -2) per valutare se l'elettrodo collocament è soddisfacente 2. In condizioni di controllo ciò comporterebbe un'ampiezza ERG di ~ 800 mV ed una variabilità inter-eye non superiore al 10%. Se gli elettrodi Riposizionare richiesti.
- Dopo il test-flash consentire agli animali di scuro si adattano per 10 minuti al buio completo prima della registrazione.
- lampi attuali di stimoli luminosi che utilizzano una ciotola Ganzfeld mentre la raccolta di ERG e PEV segnali contemporaneamente più di un ~ 500 finestra temporale msec. Il progresso da dimmer ne più chiara livelli di luce al fine di mantenere una sufficiente adattamento al buio per particolari forme d'onda.
- Raccogliere i segnali in un range di energie luminose di suscitare STR, b-wave e a / b forme d'onda delle onde della ERG. Media più segnali a livello commutazione luce (20 ripetizioni), inferiore a energie più luminosi luminosi (1 ripetizione). A poco a poco allungare l'intervallo inter-stimolo da 1 a 180 secondi dal più debole al livello di luce più brillante. Vedi Tabella 1 per un protocollo di esempio.
- per isofine dell'asta e cono risposte ERG, utilizzare un paradigma accoppiato-Flash 8. Iniziare quattro lampeggia a 1,52 log cd.sm -2 con un intervallo di 500 msec inter-stimolo 2 in-between. Sottrarre digitalmente la forma d'onda del cono (3 ° e 4 ° flash) dalla forma d'onda mista (1 ° flash) per ricavare la risposta dell'asta putativo.
- Per registrare i segnali VEP, media di 20 ripetizioni alle energie più luminoso luminosi (ad esempio, - 0,52-1,52 registro cd.sm -2, 5 sec intervallo inter-stimolo). Si noti che il primo flash in questa sequenza restituisce la risposta convenzionale adattato al buio ERG.
- Lasciare 1 - 3 min per riadattamento dopo (20) VEP spazza prima della successiva luminoso ERG passo, a seconda dell'energia luminosa.
- Dopo il completamento della raccolta dei dati, l'eutanasia l'animale anestetizzato con iniezione intracardiaca di sodio pentobarbital (325 mg / ml, 3 ml).
| Forma d'onda | Energia luminosa Stimolo (log cd.sm -2) | Numero di ripetizioni | Intervallo interstimolo (sec) |
| STR | -6,24 | 20 | 2 |
| STR | -5,93 | 20 | 2 |
| STR | -5.6 | 20 | 2 |
| STR | -5,33 | 20 | 2 |
| Rod B-wave | -4,99 | 10 | 2 |
| Rod B-wave | -4,55 | 10 | 2 |
| Rod B-wave | -4,06 | 5 | 5 |
| Rod B-wave | -3,51 | 5 | 5 |
| Rod B-wave | -3,03 | 1 | 15 |
| Rod B-wave | -2.6 | 1 | 15 |
| Rod B-wave | -1.98 | 1 | 15 |
| a- mista / b-wave | -1.38 | 1 | 30 |
| a- mista / b-wave | -0.94 | 1 | 30 |
| Flash 1: Mixed a- / b-wave media di 20: VEP | -0.52 | 20 | 5 |
| (90 sec prima del prossimo) | |||
| Flash 1: Mixed a- / b-wave media di 20: VEP | 0.04 | 20 | 5 |
| (120 sec prima del prossimo) | |||
| Flash 1: Mixed a- / b-wave media di 20: VEP | 0.58 | 20 | 5 |
| (180 sec prima del prossimo) | |||
| flash 1: Mixed a- / b-wave media di 20: VEP | 1.2 | 20 | 5 |
| (180 sec prima del prossimo) | |||
| Flash 1: Mixed a- / b-wave media di 20: VEP | 1.52 | 20 | 5 |
| (180 sec prima del prossimo) | |||
| Cono a- / b-wave | 1.52 | 4 | 0.5 |
Tabella 1. ERG e PEV registrazione protocollo utilizzando una gamma di stimolo energia. Presentazioni di stimolo progressi da dim (in alto) per luminose (in basso) lampeggia, con sufficiente intervallo inter-stimolo al fine di garantire l'adattamento scuro. Alla fine del protocollo, ripetizione di quattro flash con breve intervallo viene presentato per suscitare la risposta mediata cono.
3. Analisi delle forme d'onda ERG
Nota: ERG e PEV analisi è stata descritta in dettaglio in precedenza 3,9,10 The.seguenti sezioni forniscono una breve panoramica.
- segnali di esportazione in formato tensione digitale in tempo ad un software foglio di calcolo per l'analisi dei dati.
- Funzione photoreceptoral Rod
- Modellare il bordo anteriore della un-onda PIII con un ritardo gaussiana (Equazione 1) 11.
PIII (i, t) = Rm PIII ∙ [1 - exp (- i ∙ S (t - t d) 2)] per t> t D (Equazione 1) - Ottimizzare la misura su un insieme di due energie più brillanti luminosi 12,13 (cioè, 1,22 e 1,52 log cd.sm -2).
- Modello fino al 90% dell'ampiezza un onda per evitare intrusioni post-recettoriali 14.
Nota: Il modello riporta l'ampiezza saturo (Rm PIII, mV), la sensibilità (S, m 2 .CD -1 .s -3) e il ritardo (t d, msec) della risposta photoreceptoral.
- Modellare il bordo anteriore della un-onda PIII con un ritardo gaussiana (Equazione 1) 11.
- Rod funct cellule bipolariione
- sottrarre al computer il modello PIII (vedi sopra) dalle forme d'onda misti per restituire il mista PII con potenziali oscillatorie soprastanti.
- Per estrarre il PII asta dal mista PII, sottrarre digitalmente la risposta cono (3 ° e 4 ° lampo a 1.52 log cd.sm -2) dal mista PII (1 ° lampo a 1.52 log cd.sm -2).
- Quindi, applicare un filtro passa-basso per la forma d'onda (46.9 Hz, -3 dB, finestra Blackman) per rimuovere potenziali oscillatori. La forma d'onda residua è l'asta risposta PII 10.
- Estrarre il picco di ampiezza asta di PII e tracciare contro tutte le intensità di stimolo (inferiore a -2 log cd.sm -2 e l'asta-isolato PII a 1,52 log cd.sm -2) 10.
- Modello questi dati utilizzando una funzione iperbolica (Equazione 2), che fornisce una misura della integrità delle cellule della retina interna.
V (i) = V max (i n / (n i+ K n)) (Equazione 2)
Nota: Questa equazione restituisce risposta PII massima (V max, mV), 1 / sensibilità (k, log cd.sm-2) e la pendenza della funzione (n) 15.
- la funzione delle cellule bipolari Cone
Nota: Poiché la risposta del cono è preso in una sola intensità (1,52 log cd.sm -2) l'ampiezza e la tempistica sono retuned a questo livello di luce.- Estrarre massima cono PII risposta 2,16.
- Estrarre il tempo implicito a che questa risposta massima corrisponde 2,16.
- la funzione delle cellule gangliari
- Poiché la STR è un piccolo segnale, applicare un filtro passa basso con 50 Hz tacca alla forma d'onda per eliminare alta frequenza e rumore (46,9 Hz, -3 dB, finestra Blackman).
- Estrarre risposta massima PSTR 3,17.
- Estrarre il tempo implicito a che questa risposta massima corrisponde 3,17.
4. Analisi delle forme d'onda VEP
- Estrarre componenti massimi e minimi della VEP (P1, N1 e P2). Per i dettagli vedi riferimenti 3,6.
- Ampiezze Express come ampiezze di valle-picco rispetto al picco precedente o depressione (P1N1 e N1P2) 3,6.
- Estrarre tempo implicita (esso) a cui questa massimi corrisponde risposta (P1 esso, N1 esso, P2 esso) 3,6.
Risultati
L'ERG un onda (> -1.38 log cd.sm -2), b-onde (> - 4,99 log cd.sm -2) STR (<- 4,99 log cd.sm -2) e le PEV (> - 0,52 cd.sm log -2) sono state registrate contemporaneamente (Figura 1 e 3). Al molto dim lampeggia, un STR positivo (PSTR) è visto a circa 110 msec dopo il flash, e STR negativo (nSTR) in circa 220 msec (Figure 1 e 2). Un ERG con un grande b-wave, picchi tra 50 a 100 msec dopo l'inizio di un lampo moderata che può essere analizzato per la sua risposta PII (Figure 1 e 2). A questa energia stimolo, il negativo di una onda prima del picco è trascurabile. Ad energie luminose luminose deflessione negativo a-onda diventa più importante che può essere quantificata con la risposta PIII (Figura 2). La forma d'onda scotopic VEP mostra una risposta negativa (P1N1; 15 - 70 finestra msec) seguito da una deviazione positiva (N1P2; 30 - 100 msec) (figure 3 e 4).
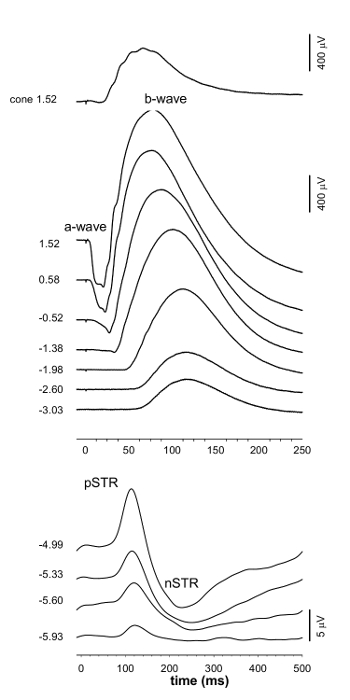
Figura 1. Gruppo medio ERG forme d'onda. L'ERG altera con crescente intensità dello stimolo. Numeri a sinistra della forma d'onda indicano l'esposizione luminosa utilizzata per suscitare la forma d'onda. Notare le diverse scale di ampiezza e di tempo per ogni pannello. Al dimmer energie luminose le componenti positive e negative della risposta soglia di scotopica possono essere suscitato (PSTR, nSTR). Come le energie di stimolo ottenere più luminoso, la A e B-wave risposta può essere analizzato, e un paradigma accoppiato-flash permette la risposta cono da misurare. Cliccate qui per vedere una versione più grande di questa figura.
PLOAD / 54158 / 54158fig2.jpg "/>
Figura 2.. (A) funzione fotorecettore asta analisi ERG può essere saggiata usando un PIII per modellare l'a-onda. A-onde a 1,22 e 1,52 log cd.sm -2 (cerchi vuoti, ○) sono in forma come un insieme con un PIII (linee grigie, l'equazione 1) al 90% del minimo che restituisce Rm PIII (ampiezza saturi, mV) S (sensibilità, m 2 .CD -1 .s -3) e TD (ritardo di temporizzazione, msec) parametri. (B) la funzione delle cellule bipolari Rod (media ± SEM) possono essere analizzati modellando la serie risposta intensità del PII dell'asta (cerchi vuoti ○) con un (linea grigia) funzione di Naka-Rushton. Ciò restituisce V max (ampiezza saturo, mV), k (1 / sensibilità, log cd sm -2) e n (pendenza). (C) la funzione delle cellule gangliari della retina è analizzato ad energie luminose fioche e quantificato da PSTR picco di ampiezza (PSTR amp) e tempi (PSTR esso ). (D) la funzione delle cellule bipolari Cono è suscitato con un paradigma abbinato-flash quantificato dal cono PII picco di ampiezza (cono PII amp) e la tempistica (cono PII esso). Clicca qui per vedere una versione più grande di questa figura.
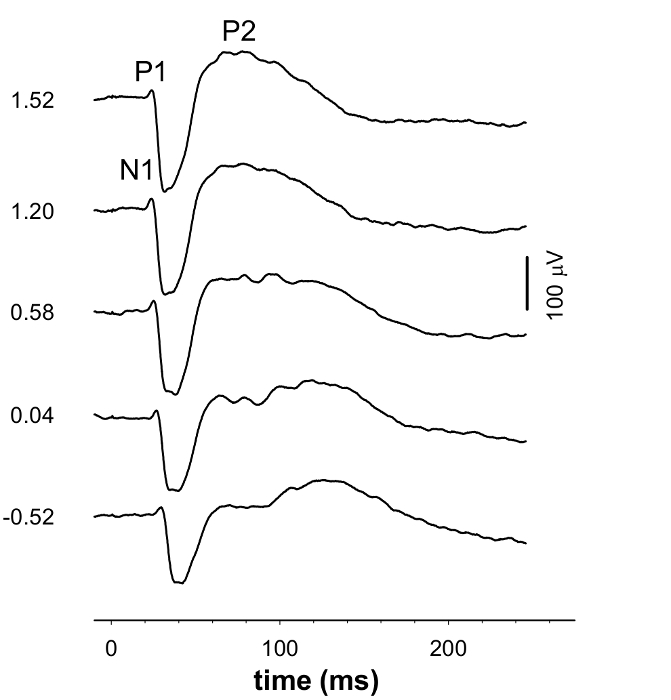
Figura 3. Gruppo medio VEP forme d'onda. La forma della forma d'onda PEV altera al crescere dell'energia stimolo. I numeri a sinistra della forma d'onda indicano l'esposizione luminosa utilizzata per suscitare la forma d'onda. Cliccate qui per vedere una versione più grande di questa figura.
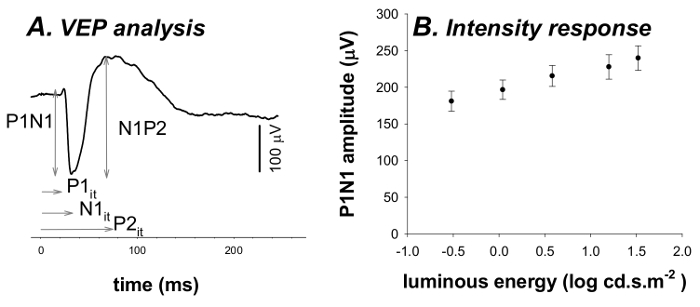
Figure 4. Analisi VEP e funzione di risposta intensità. (A) Analisi ampiezza del VEP è preso come massimo al minimo (P1N1) e concentrazioni minime e massime ampiezze (N1P2). I tempi impliciti (it) di queste risposte è anche restituito (P1 esso, N1 esso, P2 esso). (B) L'ampiezza VEP P1N1 (media ± SEM) aumenta con l'aumentare l'energia dello stimolo. Cliccate qui per vedere una versione più grande questa figura.
Discussione
L'ERG e VEP sono misure oggettive della funzione visiva dalla retina e la corteccia, rispettivamente. Il vantaggio di registrazione simultanea è che una visione più completa di tutto il percorso visivo è prestata. In particolare, le informazioni complementari da loro valutazione concomitante potrebbe fornire una più chiara delimitazione del sito di lesioni in via visiva (per esempio, per i disturbi con sovrapposizione ERG ancora distinto VEP manifestazioni 18, quando neuropatia ottica può coesistere con primaria atrofia cerebrale 19, 20, o quando la perdita di VEP può essere confuso con la manifestazione di lesioni in diverse località nel percorso visivo 21,22). Misurando la ERG e PEV contemporaneamente, un indice di guadagno tra la risposta della retina e corticale può anche essere derivato. Questo può fornire un utile strumento per rilevare i cambiamenti patologici sottili. L'attuale protocollo consente la misurazione ERG e PEV nei ratti di laboratorio comunemente usati, ma può facilmente essere annuncioApted ad altre specie di mammiferi 23-25. ERG e PEV forme d'onda da roditori forniscono un surrogato preclinico ragionevole per risposte osservate in occhi umani 26-28.
Progettando uno specifico protocollo di stimolo, sia la risposta ERG e PEV può essere ottenuto durante una singola sessione di registrazione. La tabella 1 mostra una progressione a livelli di luce con un'adeguata considerazione del tempo di recupero tra lampi consecutivi. Questo protocollo fornisce un equilibrio tra la necessità di ottimizzare le caratteristiche di segnale-rumore e per limitare il tempo di registrazione nella finestra anestetico fornito da una singola dose di ketamina: xilazina. Pertanto, questa tecnica può essere utile per una misura quantitativa oggettiva della funzione visiva per la ricerca in fisiologia di base e la malattia.
Una valutazione completa del sistema visivo può essere ottenuto valutando contemporaneamente le risposte retiniche bilaterali e le risposte corticali evocati visivamente. Tuttavia, ogni tecnica può anche essere condotta in isolamento e monocularmente anziché binocularmente semplificare la procedura. L'attuale protocollo descrive scotopica segnali ERG e PEV scelti per isolare l'asta-via dato che i ratti hanno una retina asta-dominato. Se le risposte luce adattato sono di maggiore interesse per lo studio, è anche possibile condurre fotopica segnali ERG e PEV pre-adattamento ad uno sfondo chiaro.
Una limitazione importante di questa tecnica è la necessità di condurre la procedura in condizioni anestetizzati per consentire il posizionamento degli elettrodi stabile. Tuttavia questo approccio fornisce caratteristiche di resistenza del segnale-rumore che permettono la rilevazione di cambiamenti di trattamento sottili.
A causa della piccola ampiezza del STR e la sua sensibilità alla luce adattamento, diversi passaggi devono essere attentamente controllati per garantire una scrittura di questa risposta. In primo luogo, sufficiente adattamento al buio deve essere attuata, che comprendedurante la notte adattamento al buio (≥ 8 ore), il posizionamento degli elettrodi in condizioni di luce rossa fioca (17,4 cd.m -2, λ max = 600 nm), e l'adattamento ri-scuro a seguito di una fioca di test-flash (10 min per - 0,52 log cd. sm -2). Inoltre, le caratteristiche del segnale-rumore del STR possono essere migliorate la media su più segnali (cioè, 20 segnali) raccolti con brevi intervalli inter-stimolo (cioè 2 sec). Uno dei vantaggi di questa valutazione globale di entrambi gli occhi e cortecce è quello di consentire un confronto alla registrazione controlaterale 3. In quanto tale, particolare attenzione dovrebbe essere presa nel processo elettrodo (vale a dire, stessi elettrodi di dimensioni e forma), al fine di garantire il minimo tra gli occhi e la variabilità inter-corticale.
Dato l'ampio uso di entrambe le tecniche ERG e PEV per fornire a misure in vivo del percorso visivo e dei suoi processi correlati alla malattia, sarebbe utile per raccogliere altre specifiche del percorso protocols (ad esempio, ON / OFF o cono sottotipo specifico), e di eseguire simultaneamente le registrazioni ERG / VEP con diverse modalità di stimolo (ad esempio, sfarfallio, modello, dente di sega) per estendere l'applicazione di questa tecnica nella diagnosi clinica. Un altro passo logico di questa applicazione in futuro sarebbe anche di registrare l'ERG e PEV contemporaneamente da 29 cosciente, animali liberamente muoversi per evitare influenze anestetici sulla fisiologia neurale 30.
Divulgazioni
The authors have no disclosures relevant to this work.
Riconoscimenti
Funding for this project was provided by the National Health and Medical Research Council (NHMRC) 1046203 (BVB, AJV) and Melbourne Neuroscience Institute Fellowship (CTN).
Materiali
| Name | Company | Catalog Number | Comments |
| Alligator clip | generic brand | HM3022 | Stainless steel 26 mm clip for connecting VEP screw electrodes to cables |
| Bioamplifier | ADInstruments | ML 135 | For amplifying ERG and VEP signals |
| Carboxymethylcellulose sodium 1.0% | Allergan | CAS 0009000-11-7 | Viscous fluid for improving signal quality of the active ERG electrode |
| Carprofen 0.5% | Pfizer Animal Health Group | CAS 53716-49-7 | Proprietary name: Rimadyl injectable (50 mg/ml). For post-surgery analgesia, diluted to 0.5% (5 mg/ml) in normal saline |
| Chlorhexadine 0.5% | Orion Laboratories | 27411, 80085 | For disinfecting surgical instruments |
| Circulating water bath | Lauda-Königshoffen | MGW Lauda | For maintaining body temperature of the anesthetized animal during surgery and electrophysiological recordings |
| Dental amalgam | DeguDent GmbH | 64020024 | For encasing the electrode-skull assembly to make it more robust |
| Dental burr | Storz Instruments, Bausch and Lomb | #E0824A | A miniature drill head of ~ 0.7 mm diameter for making a small hole in the skull over each hemisphere to implant VEP screws |
| Drill | Bosch | Dremel 300 series | An automatic drill for trepanning |
| Electrode lead | Grass Telefactor | F-E2-30 | Platinum cables for connecting silver wire electrodes to the amplifier |
| Faraday Cage | custom-made | Ensures light proof to maintain dark adaptation. Encloses the Ganzfeld setup to improve signal to noise ratio | |
| Gauze swabs | Multigate Medical Products Pty Ltd | 57-100B | For drying the surgical incision and exposed skull surface during surgery |
| Ganzfeld integrating sphere | Photometric Solutions International | Custom designed light stimulator: 36 mm diameter, 13 cm aperture size | |
| Velcro | VELCRO Australia Pty Ltd | VELCRO Brand Reusable Wrap | Hook-and-loop fastener to secure the electrodes and the animal on the recording platform |
| Isoflurane 99.9% | Abbott Australasia Pty Ltd | CAS 26675-46-7 | Proprietary Name: Isoflo(TM) Inhalation anaaesthetic. Pharmaceutical-grade inhalation anesthetic mixed with oxygen gas for VEP electrode implant surgery |
| Ketamine | Troy Laboratories | Ilium Ketamil | Proprietary name: Ketamil Injection, Brand: Ilium. Pharmaceutical-grade anesthetic for electrophysiological recording |
| Luxeon LEDs | Phillips Lighting Co. | For light stimulation twenty 5 W and one 1 W LEDs. | |
| Micromanipulator | Harvard Apparatus | BS4 50-2625 | Holds the ERG active electrode during recordings |
| Needle electrode | Grass Telefactor | F-E2-30 | Subcutaneously inserted in the tail to serve as the ground electrode for both the ERG and VEP |
| Phenylephrine 2.5% minims | Bausch and Lomb | CAS 61-76-7 | Instilled with Tropicamide to achieve maximal dilation for ERG recording |
| Povidone iodine 10% | Sanofi-Aventis | CAS 25655-41-8 | Proprietory name: Betadine, Antiseptic to prepare the shaved skin for surgery 10%, 500 ml |
| Powerlab data acquisition system | ADInstruments | ML 785 | Controls the LEDs |
| Proxymetacaine 0.5% | Alcon Laboratories | CAS 5875-06-9 | For corneal anaesthesia during ERG recordings |
| Saline solution | Gelflex | Non-injectable, for electroplating silver wire electrodes | |
| Scope Software | ADInstruments | version 3.7.6 | Simultaneously triggers the stimulus via the Powerlab system and collects data |
| Silver (fine round wire) | A&E metal | 0.3 mm | Used to make active and inactive ERG electrodes, and the inactive VEP electrode |
| Stainless streel screws | MicroFasterners | 0.7 mm shaft diameter, 3 mm in length to be implanted over the primary visual cortex and serve as the active VEP electrodes | |
| Stereotaxic frame | David Kopf | Model 900 | A small animal stereotaxic instrument for locating the primary visual cortices according to Paxinos & Watson's 2007 rat brain atlas coordinates |
| Surgical blade | Swann-Morton Ltd. | 0206 | For incising the area of skin overlaying the primary visual cortex to implant the VEP electrodes |
| Suture | Shanghai Pudong Jinhuan Medical Products Co.,Ltd | 3-0 silk braided suture non-absorbable, for skin retraction during VEP electrode implantation surgery | |
| Tobramycine eye ointment 0.3% | Alcon Laboratories | CAS 32986-56-4 | Proprietary name: Tobrex. Prophylactic antibiotic ointment applied around the skin wound after surgery |
| Tropicamide 0.5% | Alcon Laboratories | CAS 1508-75-4 | Proprietary name: 0.5% Mydriacyl eye drop, Instilled to achieve mydriasis for ERG recording |
| Xylazine | Troy Laboratories | Ilium Xylazil-100 | Pharmaceutical-grade anesthetic for electrophysiological recording |
| Pipette tip | Eppendorf Pty Ltd | 0030 073.169 | Eppendorf epTIPS 100 - 5,000 ml, for custom-made electrodes |
| Microsoft Office Excel | Microsoft | version 2010 | spreadsheet software for data analysis |
| Lethabarb Euthanazia Injection | Virbac (Australia) Pty Ltd | LETHA450 | 325 mg/ml pentobarbital sodium for rapid euthanazia |
Riferimenti
- Nguyen, C. T. O., Vingrys, A. J., Bui, B. V. Dietary omega-3 fatty acids and ganglion cell function. Invest Ophthalmol Vis Sci. 49, 3586-3594 (2008).
- Weymouth, A. E., Vingrys, A. J. Rodent electroretinography: methods for extraction and interpretation of rod and cone responses. Prog Retin Eye Res. 27, 1-44 (2008).
- Tsai, T. I., Bui, B. V., Vingrys, A. J. Effect of acute intraocular pressure challenge on rat retinal and cortical function. Invest Ophthalmol Vis Sci. 55, 1067-1077 (2014).
- Cowey, A., Franzini, C. The retinal origin of uncrossed optic nerve fibres in rats and their role in visual discrimination. Exp Brain Res. 35, 443-455 (1979).
- Weinstein, G. W., Odom, J. V., Cavender, S. Visually evoked potentials and electroretinography in neurologic evaluation. Neurol Clin. 9, 225-242 (1991).
- Odom, J. V., et al. Visual evoked potentials standard (2004). Doc Ophthalmol. 108, 115-123 (2004).
- Ridder, W. H., Nusinowitz, S., Heckenlively, J. R. Causes of cataract development in anesthetized mice. Exp Eye Res. 75, 365-370 (2002).
- Nixon, P. J., Bui, B. V., Armitage, J. A., Vingrys, A. J. The contribution of cone responses to rat electroretinograms. Clin Experiment Ophthalmol. 29, 193-196 (2001).
- Bui, B. V., et al. Using the electroretinogram to understand how intraocular pressure elevation affects the rat retina. J Ophthalmol. 2013, 262467 (2013).
- Nguyen, C. T., Vingrys, A. J., Bui, B. V. Dietary omega-3 fatty acids and ganglion cell function. Invest Ophthalmol Vis Sci. 49, 3586-3594 (2008).
- Hood, D. C., Birch, D. G. A quantitative measure of the electrical activity of human rod photoreceptors using electroretinography. Vis Neurosci. 5, 379-387 (1990).
- Birch, D. G., Hood, D. C., Locke, K. G., Hoffman, D. R., Tzekov, R. T. Quantitative electroretinogram measures of phototransduction in cone and rod photoreceptors - Normal aging, progression with disease, and test-retest variability. Arch Ophthalmol. 120, 1045-1051 (2002).
- Bui, B. V., Vingrys, A. J. Development of receptoral responses in pigmented and albino guinea-pigs (Cavia porcellus). Doc Ophthalmol. 99, 151-170 (1999).
- Robson, J. G., Saszik, S. M., Ahmed, J., Frishman, L. J. Rod and cone contributions to the a-wave of the electroretinogram of the macaque. J Physiol. 547, 509-530 (2003).
- Severns, M. L., Johnson, M. A. The care and fitting of Naka-Rushton functions to electroretinographic intensity-response data. Doc Ophthalmol. 85, 135-150 (1993).
- Bui, B. V., Fortune, B. Origin of electroretinogram amplitude growth during light adaptation in pigmented rats. Vis Neurosci. 23, 155-167 (2006).
- Bui, B. V., Fortune, B. Ganglion cell contributions to the rat full-field electroretinogram. J Physiol. 555, 153-173 (2004).
- Tremblay, F., Laroche, R. G., Debecker, I. The Electroretinographic Diagnosis of the Incomplete Form of Congenital Stationary Night Blindness. Vision Res. 35, 2383-2393 (1995).
- Bayer, A. U., Keller, O. N., Ferrari, F., Maag, K. P. Association of glaucoma with neurodegenerative diseases with apoptotic cell death: Alzheimer's disease and Parkinson's disease. Am J Ophthalmol. 133, 135-137 (2002).
- Wostyn, P., Audenaert, K., De Deyn, P. P. An abnormal high trans-lamina cribrosa pressure difference: A missing link between Alzheimer's disease and glaucoma. Clinical Neurology and Neurosurgery. 110, 753-754 (2008).
- Yucel, Y. H., Zhang, Q. A., Weinreb, R. N., Kaufman, P. L., Gupta, N. Effects of retinal ganglion cell loss on magno-, parvo-, koniocellular pathways in the lateral geniculate nucleus and visual cortex in glaucoma. Prog Retin Eye Res. 22, 465-481 (2003).
- Gupta, N., Yucel, Y. H. What changes can we expect in the brain of glaucoma patients. Survey of Ophthalmology. 52, 122-126 (2007).
- Kong, Y. X., et al. Impact of aging and diet restriction on retinal function during and after acute intraocular pressure injury. Neurobiol Aging. 33, 1115-1125 (2012).
- Bui, B. V., Sinclair, A. J., Vingrys, A. J. Electroretinograms of albino and pigmented guinea-pigs (Cavia porcellus). Aust N Z J Ophthalmol. 26, 98-100 (1998).
- Jobling, A. I., Wan, R., Gentle, A., Bui, B. V., McBrien, N. A. Retinal and choroidal TGF-beta in the tree shrew model of myopia: isoform expression, activation and effects on function. Exp Eye Res. 88, 458-466 (2009).
- Robson, J. G., Frishman, L. J. Dissecting the dark-adapted electroretinogram. Doc Ophthalmol. 95, 187-215 (1998).
- Robson, J. G., Frishman, L. J. The rod-driven a-wave of the dark-adapted mammalian electroretinogram. Prog Retin Eye Res. 39, 1-22 (2014).
- Hudnell, H. K., Boyes, W. K. The comparability of rat and human visual-evoked potentials. Neurosci Biobehav Rev. 15, 159-164 (1991).
- Charng, J., et al. Conscious wireless electroretinogram and visual evoked potentials in rats. PLoS One. 8, e74172 (2013).
- Hetzler, B. E., Berger, L. K. Ketamine-Induced Modification of Photic Evoked-Potentials in the Superior Colliculus of Hooded Rats. Neuropharmacology. 23, 473-476 (1984).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon