Method Article
Модель культивирования органотипической кусочки глиобластомы человека для изучения миграции опухолевых клеток и специфических для пациента эффектов антиинвазивных препаратов
В этой статье
Резюме
Текущие модели ex vivo глиобластомы (GBM) не оптимизированы для физиологически значимого изучения инвазии опухоли человека. Здесь мы представляем протокол для генерации и поддержания органотипических культур срезов из свежей ткани человеческого GBM. Приводится описание методов временной микроскопии и количественного анализа миграции клеток.
Аннотация
Глиобластома (GBM) по-прежнему имеет крайне плохой клинический прогноз, несмотря на хирургическую, химиотерапевтическую и лучевую терапию. Прогрессивная инвазия опухоли в окружающую паренхиму мозга представляет собой прочный терапевтический вызов. Для разработки антимиграционных методов лечения для GBM необходимы моделирующие системы, которые обеспечивают физиологически обоснованный фон для контролируемых экспериментов. Здесь мы представляем протокол для получения срезов культур из ткани GBM человека, полученных во время хирургической резекции. Эти культуры позволяют проводить эксперименты ex vivo без прохождения через ксенотрансплантаты животных или культуры отдельных клеток. Кроме того, мы описываем использование латентно-сканирующей конфокальной микроскопии с временной задержкой в сочетании с отслеживанием клеток для количественного изучения миграционного поведения опухолевых клеток и связанного с ними ответа на терапию. Срезы воспроизводимо генерируются в течение 90 минут после приобретения хирургической ткани. Ретровирально-опосредованная флуоресцентная клетка laЭпиляция, конфокальная визуализация и анализ миграции опухолевых клеток затем завершаются в течение двух недель после культивирования. Мы успешно использовали эти срезовые культуры для выявления генетических факторов, связанных с увеличением миграционного поведения в человеческом GBM. Кроме того, мы подтвердили способность модели обнаруживать специфические для пациента вариации в ответ на антимиграционную терапию. Двигаясь вперед, человеческие культуры срезов GBM являются привлекательной платформой для быстрой оценки ex vivo чувствительности опухоли к терапевтическим агентам, чтобы продвигать персонализированную нейро-онкологическую терапию.
Введение
Лабораторное исследование глиобластомы (GBM) затруднено отсутствием моделей, которые добросовестно повторяют необходимые патологические характеристики заболевания человека, а именно миграцию и инвазию опухолевых клеток. Сравнительные исследования двумерных и трехмерных исследований инвазии in vitro, а также трехмерных моделей культивирования кусочков грызунов выявили механически разрозненные программы миграции клеток в этих двух контекстах, что потенциально ограничивает возможность переводимости результатов 2D-систем на болезнь человека 1 , 2 , 3 . Описанная здесь органотипическая культура кусочков опухоли и парадигма визуализации позволяют изучать миграцию опухолевых клеток внутри срезов ткани опухоли человека ex vivo, полученных при хирургической резекции. Таким образом, срезовые культуры хирургически резецированной опухолевой ткани в сочетании с временной конфокальной микроскопией обеспечивают платформу для изучения миграции опухолевых клеток в нативнойМикросреды без растворения ткани или пассирования культуры.
Существует обширная литература, в которой используются модели культивирования мозговых срезов грызунов GBM, полученные из ксенотрансплантатов опухолей человека, опухолей, индуцированных ретровирусом, и клеточных оверлеев для изучения инвазии опухоли 1 , 2 , 3 , 4 , 5 . Недавно несколько групп описали генерацию органотипических срезов кусочков непосредственно из ткани GBM человека 6 , 7 , 8 , 9 , 10 . Тем не менее, среди опубликованных протоколов есть заметные различия в отношении техники среза и культуральных сред. Кроме того, использование органотипических культур срезов было сосредоточено на статических экспериментальных конечных точках, которые включали изменения в сигнале клетокНг, пролиферацию и смерть. Протокол, описанный здесь, раскрывается по предшествующим парадигмам культуры среза путем включения разрешенного во времени наблюдения динамического поведения опухолевых клеток с помощью скоростной лазерной сканирующей конфокальной микроскопии. Недавнее обнаружение интер- 11 и внутриутробной 12 , 13 генетической вариации в человеческом GBM подчеркивает важность увязки этой гетерогенности с поведением опухолевых клеток и ее последствиями для ответа опухоли на терапию. Здесь мы сообщаем об упорядоченном и воспроизводимом протоколе для использования прямых культур срезов из раковой ткани человека для визуализации миграции опухолевых клеток в почти реальном времени.
протокол
Перед началом сбора образцов тканей пациента должно быть получено информированное согласие от каждого пациента в соответствии с утвержденным протоколом институционального обзора (IRB). Авторы этого протокола получили согласие на работу, описанную в утвержденных протоколах IRB в больнице Университета Колорадо и больнице Иннова Фэрфакс. Данные, собранные с этих культур срезов, не использовались для направления решений по уходу за пациентами.
1. Предварительная нарезка
- Подготовьте средства для обработки ткани и средства для поддержания культуры среза за день до запланированной резекции опухоли и сбора ткани (или используйте ранее созданные носители в течение 2 недель). Добавить 5 мл раствора пенициллина-стрептомицина (10000 Ед / мл) и 5 мл 1 М HEPES до 500 мл DMEM с высокой глюкозой для получения среды для обработки тканей.
- Подготовьте 250 мл среды для поддержания культуры среза, используя основание нейронной среды ( например , нейробазальное) остроумиеHout фенол красный. Дополните эту среду 10 мМ HEPES, 1x B-27, 400 мкМ L-глутамина, дипропионом L-аланил-L-глутамина 600 мкМ, 60 ед. / Мл пенициллина, 60 мкг / мл стрептомицина и 6 ед. / Мл нистатина.
- Храните все носители при температуре 4 ° C не более 2 недель.
2. День хирургии: Приобретение тканей
- В день получения ткани подготовьте 50-100 мл 1% и 2% (мас. / Об.%) Растворов агарозы с низкой температурой плавления в тканевой обрабатывающей среде, используя автоклавную посуду и стерильную технику в ламинарном вытяжном шкафу. Обе концентрации агарозы необходимы для обеспечения непредсказуемого изменения консистенции опухолевой ткани.
- Нагрейте суспензию агарозы, используя микроволновую печь, до тех пор, пока не будет наблюдаться слабое кипение. Поместите раствор агарозы в водяную баню с температурой 37 ° C для поддержания в жидком состоянии до использования.
- Поместите 1 мл среды для поддержания культуры среза в каждую лунку 6-луночного планшета.
- Использовать стерильнуюЩипцы для размещения пустых вставок из ПТФЭ в каждой лунке. Поместите планшет в увлажненный инкубатор с тканевой культурой с водяной рубашкой с 5% -ной атмосферой CO 2, поддерживаемой при 37 ° C.
- Используя стерильную пипетку Пастера в ламинарном вытяжном потоке, вылейте смесь из 95% O 2 /5% CO 2 газа в колбу, содержащую ледяную ткань для обработки тканей в течение примерно 15-30 минут, до получения опухолевой ткани. Использование надокисленных сред минимизирует гипоксию в объемной ткани во время обработки.
- Подготовьте меченые 50 мл конические пробирки (достаточно для желаемого количества отдельных областей опухоли, которые должны быть выделены), содержащие 20 мл аликвот сульфоксированных ледяных обрабатывающих сред для транспортировки ткани между операционной и срезающей установкой.
- В сочетании с нейрохирургом предварительно планируйте область опухоли для получения образца. Выберите область опухоли с усилением контраста, как показано на клиническом изображении пациентаГ (последовательности T1 после гадолиния с магнитно-резонансной томографией (МРТ)). Предыдущий опыт показывает, что эта область дает жизнеспособную опухолевую ткань, в отличие от некротической ткани.
ПРИМЕЧАНИЕ. Было предпринято создание срезов из окружающего (перитуморального) белого вещества; Однако фоновая аутофлуоресценция и снижение плотности опухолевых клеток ограничивали экспериментальную полезность этих срезов. - Получите опухолевую ткань в направлении начала резекции опухоли. Избегайте сбора опухолевой ткани, подверженной обширному биполярному прижиганию, что может поставить под угрозу жизнеспособность ткани, вторичную по отношению к термическому повреждению. Образцы тканей, полученные во время резекции частичной опухоли, демонстрируют повышенную жизнеспособность по сравнению с тканями, полученными при длительных резекциях блока . Это наблюдение может относиться к дифференцированной опухолевой ткани, лишенной кровотока, в результате хирургической резекции и увеличения продолжительности приема.
- При желании, наклейте и сохраните опухолевую ткань в отдельных конических пробирках, чтобы изолировать образцыИз отдельных областей опухоли. ( Т.е. поверхностной и глубокой опухолевой ткани). Точные местоположения тканей могут быть записаны, если / когда имеется интраоперационная хирургическая навигация.
3. Подготовка культуры среза
ПРИМЕЧАНИЕ. Этот протокол требует использования свежей незафиксированной человеческой ткани. Все образцы, как предполагается, являются инфекционными и должны обрабатываться в соответствии с универсальными протоколами патогенов, передающихся через кровь. Надлежащее индивидуальное защитное снаряжение следует надевать всегда. Пинцеты и скальпели должны быть подвергнуты воздействию 15 минут ультрафиолетового излучения перед использованием. Во время использования периодически распыляйте инструменты на 70% этанол (EtOH), позволяя время испарения жидкости перед использованием. Процесс нарезки выполняется полустерильным способом с использованием горизонтального вытяжного колпака с фильтрованным воздухом.
- Поместите кусочки опухолевой ткани в чашку Петри с ледяной обрабатывающей средой. Чтобы вымыть опухолевую ткань и свести к минимуму адгезивные эритроциты, намЕ пипеткой, чтобы осторожно обменивать и отбрасывать носители в чашке Петри три раза.
- Используя скальпель, обрезайте кусочки опухоли в прямоугольные формы коробки. Обрежьте кусочки ткани приблизительно 3 мм x 3 мм x 10 мм. Осторожно удалите любые прикрепленные сосуды с помощью иссечения или нежной тяги с помощью тонких пинцетов.
- Пипеткой 5 - 7 мл 37 ° C агарозы в небольшую кубическую форму (~ 2 см 3 ). Перед использованием убедитесь, что температура раствора агарозы не превышает 37 ° С со стерильным термометром.
- Разрешить агарозе сидеть в течение приблизительно 1 мин на ложе льда.
- Поместите 2-4 опухолевые ткани «полоски» в агарозу с длинной осью, ориентированной вертикально.
ПРИМЕЧАНИЕ. Полоски ткани будут склонны «погружаться» в агарозу до затвердевания. Чтобы избежать этого осложнения, временно удерживайте полоску ткани вертикально, пока агароза еще не затвердеет. - Держите ткань, содержащую агарозную форму, на ложе льда на 2 - 5 мильN для облегчения затвердевания.
- Удалите плесень со льда и осторожно удалите блок агарозы, разрезая боковые стороны формы скальпелем. Избегайте чрезмерного воздействия на блок, который может разрушить агарозу.
- Используйте щедрую каплю цианоакрилатного клея для прикрепления агарозного блока к пластине для образцов вибрато. Дайте клею установить примерно 1 - 2 мин.
- Заполните резервуар вибрации ледяной обрабатывающей средой, чтобы окунуть блок агарозы, прикрепленный к пластине образца.
- Во время нарезки пузырьковую смесь 95% O 2 /5% CO 2 в резервуар вибратома через обрезанную стерильную пластиковую пипетку.
- Установите толщину среза вибрации до 300 - 350 мкм.
- Отрегулируйте скорость движения лезвия и амплитуду лезвия в соответствии с консистенцией ткани. «Жесткая» ткань GBM требует более медленной скорости продвижения лезвия и более высокой амплитуды. Точные значения скорости и амплитуды лопастей будут варьироваться в зависимости от характеристик вибратома.
ПРИМЕЧАНИЕ. Во время нарезки часто возникает несколько проблем. Если полоска ткани удаляется из блока агарозы, попробуйте внедрить ткань в более высокую концентрацию агарозы. Если кусочки опухоли толще желаемого (машинный набор) или асимметричны, увеличьте амплитуду и уменьшите скорость лопасти вибрато. Чтобы гарантировать, что опухолевая ткань не застревает или «тащится» с помощью держателя лезвия, по мере того, как происходит нарезка, аккуратно расположите микрошапуль между держателем лезвия и срезом, когда лезвие перемещается. - Перенесите ломтики ткани в чашку Петри с ледяной обрабатывающей средой, используя микроспутник из нержавеющей стали.
- Получите 6-луночные планшеты, содержащие вставки из ПТФЭ, и средообразующие срединные срезы среза из инкубатора (как описано в разделе 2, стадия 4).
- Щиты пластинчатой ткани с использованием микроспутника из нержавеющей стали. Минимизируйте прямой контакт и манипуляцию с тканью, используя небольшую тонкую кисть щетины, чтобы создать «жидкую волну», чтобы мягко вытолкнуть срез из шпателя aNd на культуральную вставку.
ПРИМЕЧАНИЕ. Минимизируйте количество обрабатываемых сред, введенных поверх вставки для тканевой культуры. Если переносится чрезмерное количество носителей, заставляя срезы плавать, используйте стерильную пипетку Пастера для удаления носителя. - Верните 6-луночные планшеты, содержащие кусочки опухоли, в инкубатор, поддерживаемый при 37 ° С, с атмосферой 5% CO 2 .
ПРИМЕЧАНИЕ. Весь протокол внедрения и нарезки должен быть завершен в течение 90 минут после приема опухолевой ткани из операционной.
4. Обслуживание культуры среза
- Через 12-24 ч переместите культуры срезов, схватив каждую вставку с помощью стерильных щипцов и перенесите на тарелки, содержащие среды для хранения свежих срезов. Убедитесь, что среда для поддержания культуры среза, аликвотированная в каждую лунку, выравнивается в инкубаторе в течение как минимум 15 минут до переноса вставок.
- Переместите вкладыши на новые 6-луночные планшеты со свежим уравновешенным кусочкомКаждые 48 ч.
- При желании, аликвотную культуральную среду для срезов с пипеткой для немедленного использования в биохимических анализах ( т.е. ELISA) или замораживание при -80 ° C для будущего использования.
5. Маркировка опухолевых клеток через зеленый флуоресцентный белок, выражающий ретровирус
ПРИМЕЧАНИЕ. Временная микроскопия для анализа миграции опухолевых клеток требует стабильной, долговременной флуоресцентной маркировки клеток внутри культуры срезов. Предлагается использование ретровируса, поскольку он избирательно заражает делящиеся клетки, тем самым обогащая флуоресцентную маркировку в популяции опухолевых клеток, в отличие от микроглии или других типов клеток, присутствующих в срезе. Стандартизация инфекции предполагает, что вирусный титр 10 4 КОЕ / мкл приводит к достаточной экспрессии зеленого флуоресцентного белка для отслеживания и анализа миграции клеток. Повышенный титр вируса, использование неселективного вируса ( то есть аденовирус, лентивирус) или otЕе средства маркировки всех клеток могут препятствовать идентификации четких границ ячейки во время миграции, что усложняет анализ. Использование альтернативных флуоресцентных маркеров можно использовать и оптимизировать по мере необходимости.
- Получите ретровирус для заражения срезов опухоли либо через стандартные протоколы 5 , 14, либо из коммерчески доступного источника. Разбавьте вирусный супернатант, добавив соответствующий объем в невосстановленную нейронную среду для достижения вирусного титра 10 4 КОЕ / мкл.
- В течение 7-10 дней культуры заражают культуры кусочков опухоли, представляющие интерес, с 5-10 мкл вируса (10 4 КОЕ / мкл). Поместите вирус осторожно по каплям на поверхность каждого среза ткани. Уменьшение объема супернатанта добавляется, если срез плавает на поверхности вставки. Обратные пластины, содержащие срезовые культуры, в инкубатор.
- Оцените срезы для меченых опухолевых клеток, начинающихся через 24 часа после Вирусной инфекции (см. Раздел 6). Эта временная задержка будет варьироваться в зависимости от вирусной инкорпорации и кинетики экспрессии генов флуоресценции. Для использованных здесь вирусных конструкций потребовалось 72 часа для наблюдения прочного флуоресцентного сигнала со стандартным эпифлуоресцентным микроскопом.
ПРИМЕЧАНИЕ. Редко, срезы отображают преимущественно периферическое распределение клеток с маркировкой вируса, что может затруднить конфокальную визуализацию. Чтобы избежать этого осложнения, попытайтесь уменьшить толщину и толщину среза на срезе. Если культура среза имеет более толстую область вблизи центра, это может препятствовать адекватному проникновению питательных веществ, таким образом ограничивая популяцию активного разделения опухолевых клеток. Качественным анализом на экране для этого осложнения является добавление реагента красителя тетразолия ( т. Е. МТТ) в срединную культуральную среду. Области среза, которые не становятся синими после добавления реагента, указывают на отсутствие метаболической активности и ухудшение здоровья среза.
ПРИМЕЧАНИЕ. После успешной трансдукции и здоровья культуры подтверждается, что клетки могут быть отображены в контрольных условиях с последующим равным периодом визуализации в условиях лечения. Используя этот протокол, клетки были успешно отображены и отслеживались в течение 12 часов в каждом состоянии. Однако более короткие или более длительные периоды визуализации и манипулирования окружающей средой также могут быть информативными.
- Загрузка микроскопа
- Перед тем, как сделать изображение, поместите 1 мл свежей срединной среды в посуду с стеклянным днищем.
- Позвольте средству в стеклянной нижней чашке уравновешиваться в инкубаторе в течение 15 мин.
Примечание: в этой точке растворимы маркировки агентов, таких как флуоресцентно конъюгированных лектинов (т.е. Isolectin IB 4 для маркировки микроглии) или лиганд , конъюгированный квантовых точек, могут быть добавлены в срез культуральной среды для идентификации сотыВольеров во время визуализации. - Перенесите вставку, которая будет отображаться на тарелку с стеклянным дном, используя стерильные щипцы в ламинарном вытяжном шкафу. Транспортируйте блюдо на стадию микроскопа.
- Поддерживайте культуры срезов при температуре 37 ° C и 5% CO 2 в закрытом инкубаторе с инкубатором с закрытым микроскопом. Используйте стерильное увлажнение H 2 O инкубационной камеры, если оно доступно для предотвращения избыточного испарения среды (особенно важно для более длинных экспериментов по визуализации).
- Используйте конфокальный микроскоп с длинным рабочим расстоянием 10X воздушный объектив и лазерное возбуждение для однофотонного и / или многофотонного.
ПРИМЕЧАНИЕ. Убедитесь, что объектив объектива микроскопа обеспечивает достаточное рабочее расстояние. В результате добавленной высоты от инкубатора на сцене, тарелки с стеклянным дном и вставки для тканевой культуры важны длительные рабочие расстояния. - Закрепите пластину из стеклянного основания, снимите пластиковую крышку чашки Петри и накройте газо-Проницаемой мембраны.
- Приобретение изображения
- Используйте микроскоп для визуального осмотра среза и найдите подходящее поле с достаточной плотностью флуоресцентно меченых опухолевых клеток между краем среза и центром. Избегайте полей изображения на краю среза из-за повышенной восприимчивости к сдвигу ткани во время визуализации. Для ограничения этого сдвига можно использовать тонкие ломтики.
- Используйте программное обеспечение для обработки изображений в режиме многомерного анализа, чтобы установить первую (нижнюю) и последнюю (верхнюю) границы Z-стека, чтобы все отображаемые позиции содержали видимый флуоресцентный сотовый сигнал. Обработка изображений через 150 - 200 мкм среза с постоянным Z-шагом 10 мкм обеспечивала адекватное разрешение для отслеживания дорожек ячеек (это можно настроить для индивидуальных потребностей в изображении).
- Если микроскоп имеет моторизированную ступень, убедитесь, что для каждого сбора Z-стека достаточно времени. Установите временной интервал между приобретениями равнымВремя сканирования на позицию x количество позиций для изображения ( т.е. отображаемые области опухоли).
ПРИМЕЧАНИЕ. Для одновременного возбуждения зеленых и красных флуорофоров используется двухлинейная программа лазерного сканирования линии с одновременным возбуждением 488 нм и 633 нм. Длина волны выбранного лазерного возбуждения будет варьироваться в зависимости от выраженных индивидуальных флуоресцентных белков. - Поддерживайте равномерную мощность лазера и конфокальные параметры обскуры между отображаемыми областями опухоли. Используйте самую низкую настройку мощности лазера, необходимую для четкой демаркации тел и процессов опухолевых клеток, чтобы ограничить фототоксичность. Специфические единицы параметров изображения ( то есть настройки мощности и конфокальной настройки обводки) будут варьироваться в зависимости от характеристик микроскопа и лазерного источника.
- Компенсируйте возможное испарение среды путем добавления 2 - 3 "буферных" шагов Z-стека в фокальных плоскостях, продвигающихся к цели. Это эффективно предотвращает уход ткани из диапазона приобретения Z-стекаИонов в вертикальной плоскости.
7. Обработка изображения после обработки и слежения за опухоли
ПРИМЕЧАНИЕ. Многие системы конфокальной визуализации оснащены запатентованным программным обеспечением для обработки изображений. Описанные ниже этапы обработки содержат общий протокол, который может выполняться через программные платформы. Конкретные инструкции будут приведены для платформ с открытым исходным кодом, NIH ImageJ и MTrackJ 15 .
- Откройте файл Z-стека. В ImageJ нажмите «Изображение → Стеки → Проект Z». Выберите первый и последний Z-стеки для включения и выберите «Макс. Интенсивность» в качестве типа проекции. Результатом является рендеринг, называемый максимальной проекцией интенсивности (MIP). Создайте MIP из каждого набора изображений Z-стека, захваченных в каждом отображаемом регионе.
- Объединение MIP из каждого региона для создания временного ряда. Нажмите «Изображение → Стеки → Изображения в стек».
- Вручную укажите местоположение«Центроида» клеточного тела, выбирая визуально аппроксимированную центральную точку тела опухолевой клетки. Это достигается щелчком по телу ячейки с помощью функции добавления треков MTrackJ (плагин с открытым исходным кодом для NIH ImageJ).
- Нажмите, чтобы разграничить местоположение тела ячейки в каждом кадре серии изображений. Это создает уникальную «дорожку» для каждой ячейки. Последовательно пометьте ячейки тела ячейки следующей ячейки. Повторяйте этот процесс до тех пор, пока не будут отслеживаться все пути миграции ячеек.
- Как только популяция клеток отслеживается в данной микрообласти опухоли, экспортируйте все координаты дорожки ячейки, используя функцию «измерения» MTrackJ. Сохраните файл в формате .xls, чтобы исходные данные могли быть проанализированы с использованием электронной таблицы или пользовательского программного обеспечения.
- Используйте координаты, записанные для каждой точки вдоль дорожки миграции ячейки, для выполнения количественного анализа, включая вывод скорости миграции, направленности и другой миграцииМетрик, как описано в Parker et al. 16 .
ПРИМЕЧАНИЕ. Все расчетные расстояния и скорости являются недооценками фактических значений. Это связано с преобразованием трехмерных изображений (и путей миграции) в двумерные данные посредством генерации прогнозов максимальной интенсивности.
Результаты
Наша группа успешно сформировала культуры срезов из более чем 50 пациентов, подвергающихся первичной резекции GBM. Этот протокол генерации среза, культуры, ретровирусной маркировки, обработки изображений и миграции был упрощен в воспроизводимый рабочий процесс ( рисунок 1 ). Критически эти органотипические ломтики GBM демонстрируют согласованность с возникновением опухолевой ткани во всей культуре, включая поддержание патологических признаков и микроглии до 15 дней в культуре ( рисунок 2 ). Кроме того, мы использовали эту систему для проведения функциональных анализов реакции опухоли на изменения микроэкологии. В качестве показателя физиологической целостности мы исследовали, как культуры срезов GBM реагируют на гипоксию (1% O 2 ), измеряя производство фактора роста эндотелия сосудов (VEGF), процесс, который происходит в изобилии в микроокружении GBM in vivo 17 ,«18. Мы продемонстрировали, что, размещая культуры срезов в гипоксических условиях, срезы устанавливали быстрый физиологический ответ, вызывая высвобождение VEGF в среду ( рис. 3 ).
Чтобы оценить качественные и количественные аспекты миграции опухолевых клеток, мы использовали временные изображения для создания подробных карт миграции. Эти карты демаркируют все клетки ГБМ, отслеживаемые в пределах микрорайонов опухоли (1 мм 2 ), обеспечивая статическую визуализацию динамического миграционного поведения популяции опухолей. Количественные измерения скорости и направленности миграции (смещение клеток / общее пройденное расстояние) были рассчитаны для каждой клетки, что позволило исследовать изменения параметров миграции по регионам опухолей, образцам опухоли и в ответ на лечение ( рисунок 4 ).
Протокол маркировки и обработки изображенийCribed здесь также обеспечивает достаточное пространственное и временное разрешение для оценки изменений морфологии клеток во время миграции через микроокружение нативной опухоли. Мы наблюдали присутствие морфологически различных подвижных опухолевых клеток и микроглии, смешанных в культуре срезов ( рис. 5А ). Движение опухолевых клеток характеризовалось процессом «поиска и всплеска», который включал повторный выпячивание и отвод филоподий из статической ячейки, за которым следовал короткий период эффективного движения. Области среза визуализации примерно каждые 10 минут также обеспечивали адекватное временное разрешение для записи временных изображений опухолевых клеток, подвергающихся делению клеток. Эти делящиеся клетки приостановились от миграции, завершили митоз, а дочерние клетки повторно инициировали миграцию без задержки, все в течение 3-х таймфреймов ( рис. 5D ). Напротив, микроглия мигрирует с более высокой и более стабильной скоростью, с меньшей направленностью, чем соседние опухолевые клетки,Демонстрируя их относительно неэффективную миграцию ( рис. 5C, 5E-G ). Такие наблюдения могут иметь важное значение для получения информации о биологии, лежащей в основе ответов, связанных с пациентами или клетками, на лечение.
Наконец, мы использовали этот протокол для демонстрации изменчивости пациента к пациенту в параметрах миграции клеток на уровне популяции, включая корреляцию геномной амплификации рецептора эпидермального фактора роста ( EGFR ) с дополненным миграционным потенциалом опухолевых клеток 16 . Кроме того, временная микроскопия опухолевых срезов до и после лечения антиинвазивным препаратом, гефитинибом, продемонстрировала значительное снижение миграции, которое было специфичным для EGFR амплифицированных опухолевых срезов 16 .
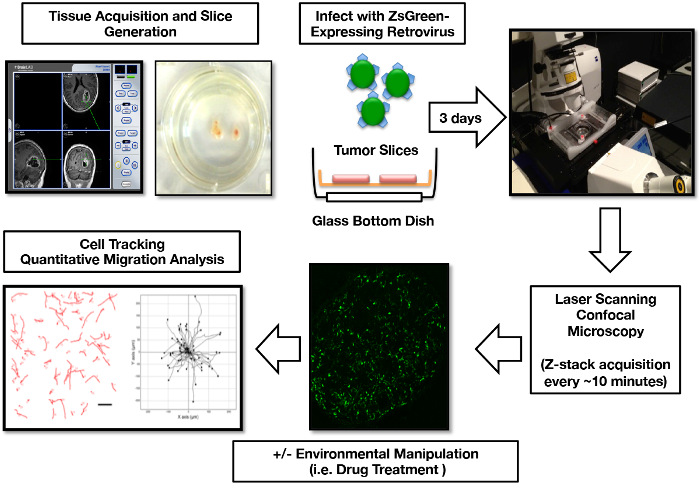
Рисунок 1: Human GBM Органотипический анализ культуры культивирования, обработки изображений и обработки клеток. Опухолевая ткань локализована в конкретном регионе через интраоперационное навигационное оборудование. Выделение на недельный пост, рестриктный ретровирус ZsGreen добавляется к культурам срезов для маркировки митотически активных опухолевых клеток. Через 3 дня после инфицирования готовятся срезы для конфокальной визуализации. Данные 3D-изображения затем обрабатываются в 2D-изображения для отслеживания путей миграции клеток, формирования карт миграции опухолевых клеток и расчета параметров миграции опухолевых клеток. Части этой фигуры были первоначально опубликованы в Parker et al , 2013 16 и воспроизведены с разрешения Oxford University Press. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2. Органотипические фрагменты человеческого GBM сохраняют гистологические особенности во всей культуре Ex Vivo . ( A ) T1 контрастные усиленные МРТ-последовательности были использованы для локализации и документирования области (ов) захвата ткани (стрелка). ( B ) H & E-окрашивание исходной донорной ткани (OR) и срезов на 8-й день культуры из культуры срезов, полученных из ткани, полученной из области, выделенной в A. ( C ). Микроэкологические патологические и клеточные признаки GBM in vivo поддерживаются Во всей культуре срезов. (I, II). Иммуногистохимия для CD68, маркера микроглии / макрофагов при низком (верхнем) и высоком (снизу) увеличении, демонстрирует сохранение микроглиаса в срезах после 15 дней культивирования. Окрашивание H & E на 4-й день культивирования срезов подтверждает поддержание псевдопаллизирующего некроза, патологиюЛогический признак GBM при минимальном (iii) и высоком (iv) увеличении. Шкала шкалы = 200 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Культуры кусочков человеческого GBM секретируют VEGF в ответ на гипоксию. ( A ) В эксперименте использовались индивидуальные культуральные вставки, содержащие 3 одинаковых размера опухолевые срезы, полученные из той же опухолевой области. Срезы поддерживали в нормоксии в течение 12 ч, а затем два 12-часовых интервала гипоксии с добавлением новых носителей до каждого интервала. ( B ) Секреция VEGF в среду, измеренная ELISA (среднее ± стандартное отклонение) от культур срезов, полученных из двух репрезентативных опухолей, была значительно увеличена unГипоксии, чем нормоксия (р <0,05). ( C ) Объединенный анализ культур срезов из 4 различных опухолей показал повышенную секрецию VEGF после последовательных 12-часовых интервалов гипоксии по сравнению с нормоксией (p <0,05). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Данные дорожки пути опухоли позволяют получить количественное определение скорости и направленности клеток. ( A ) Опухолевые клетки с направленностью 1 представляют собой совершенную эффективность вдоль прямого вектора, тогда как те, у кого более низкая направленность, входят в неэффективные извилистые пути, как представлено в этой схеме 16 . Перепечатано с разрешения Оксфордского университетаНажмите. ( B ) Анализ репрезентативных данных дорожки пути («низкое» разрешение ~ 55 мин. Интервалов отслеживания ячейки) демонстрирует клеточную изменчивость в скорости и направленности. ( C ) Направленность по сравнению с скоростью миграции для каждой дорожки ячейки показана для визуализации поведения миграции по популяции клеток (каждая точка представляет собой отдельную ячейку). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Microglia в культурах GBM Slice характеризуется высокой скоростью миграции и низкой направленностью по отношению к опухолевым клеткам. ( A ) Репликация опухолевых клеток, выборочно экспрессирующих ретровирус и ZgGreen с микроглиями с меткой Isolectin-I В 4 -647 конъюгате существует перемешан в опухоли представителя микрорегионе из репрезентативного среза культуры. ( BC ). Пути индивидуально отслеживаемых GBM ( B ) и микроглии ( C ) в одном и том же микрополе опухоли демонстрируют диссонирующие миграционные поведения. Шкала шкалы = 200 мкм. ( D ) Активно мигрирующая опухолевая клетка приостанавливает, убирает свои процессы (наконечник стрелы), подвергается делению клеток, а две дочерние клетки мигрируют в противоположных направлениях (стрелки). Шкала шкалы = 50 мкм. ( E и F ) Microglia демонстрируют повышенную скорость миграции (p <0,0001) и уменьшенную направленность (p <0,0001) по сравнению с опухолевыми клетками в той же области. (G) Распределение опухолевых и микроглиальных клеток на основе скорости и направленности демонстрирует уникальные мигрирующие фенотипы двух популяций клеток.Et = "_ blank"> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Органотипические культуры срезов из раковых тканей человека обеспечивают привлекательную и недоиспользуемую платформу для доклинических трансляционных экспериментов. Отсутствует понимание поведенческого поведения опухолевых клеток в отношении миграции, пролиферации и гибели клеток в микроокружении нативной опухоли. Критически, изучение реакции опухоли на терапию в динамическом, временном разрешении на уровне поведения клеток может пролить свет на новые механизмы устойчивости лечения. Культуры кусочков опухоли человека обеспечивают связь между процессом заболевания человека и текущими методами ex vivo и in vivo 19 . Недавно мы подтвердили методику, описанную здесь как метод изучения миграции GBM, сообщая впервые об измеренных межопухолевых изменениях поведения клеточной миграции, связанных с усилением EGFR и сигналом 16 . В этом исследовании также использовалась модель культивирования среза для тестирования патиNt-специфическая эффективность ингибитора EGFR, гефитиниб, как потенциальная антиинвазивная терапия для GBM 16 .
Некоторые из распространенных ловушек во время среза ткани, ретровирусной инфекции, визуализации и парадигмы анализа изображений обсуждались выше. Однако протокол ретровирусной инфекции требует дополнительного внимания. При варьировании от пациента к пациенту может оказаться сложным титровать плотность вирально меченных опухолевых клеток в каждом срезе. Если недостаточное количество клеток помечено вирусной конструкцией, добавьте дополнительные 5-10 мкл аликвоты ретровирусного супернатанта на поверхность каждого среза ежедневно до достижения желаемой концентрации меченых опухолевых клеток. В культурах первичного среза процент реплицирующихся клеток обычно ниже, чем в трансформированных клеточных линиях, что ограничивает подмножество клеток, допускающих ретровирусное включение в любой момент времени. Альтернативно, если слишком много клеток помечены, предотвращаяУратовую демаркацию путей миграции клеток, разбавить вирусный супернатант нейронными средами для достижения более эффективного эффективного титра. Микроглия, связанная с опухолью, включала флуоресцентный белок, экспрессирующий ретровирус с частотой приблизительно 1% всех меченых клеток. Мы смогли визуально изолировать эти клетки для отдельного анализа, используя лектин, связывающий микроглию, для анализа данных после изображений ( рисунок 5 ).
В патогенезе GBM 20 играют роль микроокружение опухоли, включая аспекты доставки питательных веществ, клеточных взаимодействий и внеклеточного матрикса. Прямые культуры кусочков ГБМ человека устраняют потребность в пассировании в небольших моделях животных или в культуре рассеянных клеток, обеспечивая при этом тщательную рекапитуляцию микроокружения опухоли человека. Кроме того, срезовые культуры обеспечивают равномерный доступ к питательным веществам через образцы, при сохранении взаимодействия клеток-клеток и клеток-ECM. Уменьшая varВ клеточном доступе к питательным веществам, которые, как известно, встречаются в опухолях, мы предполагаем, что наблюдаемые различия в культурах проливают свет на внутренние различия между поведением опухолевых клеток ( т.е. миграцией) на уровне популяции. Однако интерпретация данных, собранных по культурам срезов, полученных из опухолей человека, осложняется присущей меж- и внутрироматозной гетерогенностью. Критически необходимо дальнейшее исследование, чтобы охарактеризовать потенциальные генетические и эпигенетические сдвиги, которые могут возникать при сохранении культивирования культуральных опухолей человека ex vivo .
Использование культуральных срезов опухоли человека параллельно с клиническими испытаниями фазы I / II является многообещающей стратегией для корреляции параметров среза с клиническими результатами пациентов. Валидация этих потенциальных прогнозирующих / прогностических параметров необходима до того, как культуры срезов могут быть использованы для персонализации онкологической терапии. Наша работа, как и у других, демонстрирует возможность проверки достоверности биомаркеров 21, а также быстрое тестирование ex vivo терапевтических агентов в срезах культур из GBM 9 , 16 . Подобные методы культивирования кусочков человека, использующие ткани 22 легкого 22 , толстой кишки 22 , головы и шеи 23 , груди 24 и 25 рака предстательной железы, предполагают, что этот подход является обобщаемым в отношении рака человека.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить д-ра Ли Нисвандера и доктора Раду Массарва за их технический опыт и вклад в протокол конфокальной обработки изображений среза, описанный здесь. Кроме того, благодаря доктору Калену Дионне, который предоставил экспертные знания в отношении оптимизации среза ткани опухоли головного мозга и параметров культуры.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM High Glucose | Invitrogen (Gibco) | 11960-044 | |
| Neurobasal-A Medium, minus phenol red | Invitrogen (Gibco) | 12349-015 | |
| B-27 Supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Penicillin-Streptomycin (10,000 U/mL) | Invitrogen (Gibco) | 15140-122 | |
| GlutaMAX Supplement | Invitrogen (Gibco) | 35050-061 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| HEPES (1 M) | Invitrogen (Gibco) | 15630-080 | |
| Nystatin Suspension | Sigma-Aldrich | N1638-20ML | 10,000 unit/mL in DPBS, aseptically processed, BioReagent, suitable for cell culture |
| UltraPure Low Melting Point Agarose | Invitrogen (Gibco) | 16520-050 | Melts at 65.5 °C, Remains fluid at 37 °C, and sets rapidly below 25 °C. |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 Conjugate | Thermo Fisher (Molecular Probes) | I32450 | Used in media to label Microglia/Macrophages |
| pRetroX-IRES-ZsGreen1 Vector | Clonetech | 632520 | |
| Retro-X Concentrator | Clonetech | 31455 | Binding resin for non-ultracentrifugation concentration of viral supernatants |
| pVSG-G Vector | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| GP2-293 Viral packaging cells | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| Cyanoacrylate Glue (Super Glue) | Sigma-Aldrich | Z105899 | Medium-viscosity |
| Equipment | |||
| Peel-A-Way Embedding Mold (Square - S22) | Polysciences, Inc. | 18646A-1 | Molds for tumor sample embedding |
| Stainless Steel Micro Spatulas | Fisher Scientific | S50823 | Bend instrument 45 degrees at the neck of the spoon blade |
| Curved Fisherbrand Dissecting Fine-Pointed Forceps | Fisher Scientific | 08-875 | |
| Single Edge Razor Blade (American Safety Razors) | Fisher Scientific | 17-989-001 | Blade edge is 0.009" thick. Crimped blunt-edge cover is removed before loading onto vibratome. |
| Leica VT1000 S Vibratome | Leica Biosystems | VT1000 S | |
| Hydrophilic PTFE cell culture insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm pore size |
| 35 mm Glass Bottom Dishes | MatTek | P35G-1.5-20-C Sleeve | 20 mm glass diameter. Coverslip glass thickness 1.5 mm |
| LSM 510 Confocal Micoscope | Zeiss | LSM 510 | 10x Air Objective (c-Apochromat NA 0.45) |
| PECON Stagetop Incubator | PeCON Germany | (Discontinued) | Incubator PM 2000 RBT is a comprable product designed for use with Zeiss Microscopes. |
Ссылки
- Beadle, C., et al. The role of myosin II in glioma invasion of the brain. Mol Biol Cell. 19, 3357-3368 (2008).
- Farin, A., et al. Transplanted glioma cells migrate and proliferate on host brain vasculature: a dynamic analysis. Glia. 53, 799-808 (2006).
- Panopoulos, A., Howell, M., Fotedar, R., Margolis, R. L. Glioblastoma motility occurs in the absence of actin polymer. Mol Biol Cell. 22, 2212-2220 (2011).
- Ivkovic, S., et al. Direct inhibition of myosin II effectively blocks glioma invasion in the presence of multiple motogens. Mol Biol Cell. 23, 533-542 (2012).
- Assanah, M., et al. Glial progenitors in adult white matter are driven to form malignant gliomas by platelet-derived growth factor-expressing retroviruses. J Neurosci. 26, 6781-6790 (2006).
- Chaichana, K. L., et al. Preservation of glial cytoarchitecture from ex vivo human tumor and non-tumor cerebral cortical explants: A human model to study neurological diseases. J Neurosci Methods. 164, 261-270 (2007).
- Grube, S., et al. Overexpression of fatty acid synthase in human gliomas correlates with the WHO tumor grade and inhibition with Orlistat reduces cell viability and triggers apoptosis. J Neurooncol. 118, 277-287 (2014).
- Hovinga, K. E., et al. Inhibition of notch signaling in glioblastoma targets cancer stem cells via an endothelial cell intermediate. Stem Cells. 28, 1019-1029 (2010).
- Merz, F., et al. Organotypic slice cultures of human glioblastoma reveal different susceptibilities to treatments. Neurooncol. 15, 670-681 (2013).
- Xu, J., et al. Vorinostat modulates cell cycle regulatory proteins in glioma cells and human glioma slice cultures. J Neurooncol. 105, 241-251 (2011).
- Verhaak, R. G., et al. Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities. in PDGFRA, IDH1, EGFR, and NF1. Cancer cell. 17, 98-110 (2010).
- Gill, B. J., et al. MRI-localized biopsies reveal subtype-specific differences in molecular and cellular composition at the margins of glioblastoma. Proc Natl Acad Sci USA. 111, 12550-12555 (2014).
- Snuderl, M., et al. Mosaic amplification of multiple receptor tyrosine kinase genes in glioblastoma. Cancer cell. 20, 810-817 (2011).
- Kakita, A., Goldman, J. E. Patterns and dynamics of SVZ cell migration in the postnatal forebrain: monitoring living progenitors in slice preparations. Neuron. 23, 461-472 (1999).
- Meijering, E., Dzyubachyk, O., Smal, I., van Cappellen, W. A. Tracking in cell and developmental biology. Sem Cell Dev Biol. 20, 894-902 (2009).
- Parker, J. J., et al. Gefitinib selectively inhibits tumor cell migration in EGFR-amplified human glioblastoma. Neurooncol. 15, 1048-1057 (2013).
- Brat, D. J., et al. Pseudopalisades in glioblastoma are hypoxic, express extracellular matrix proteases, and are formed by an actively migrating cell population. Cancer Res. 64, 920-927 (2004).
- Shweiki, D., Itin, A., Soffer, D., Keshet, E. Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis. Nature. 359, 843-845 (1992).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15, 647-664 (2014).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. 60, 502-514 (2012).
- Di Cristofori, A., et al. The vacuolar H+ ATPase is a novel therapeutic target for glioblastoma. Oncotarget. 6, 17514-17513 (2015).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proc Natl Acad Sci USA. , 8352-8356 (2010).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. Br J Cancer. 110, 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. J Clin Pathol. 66, 253-255 (2013).
- Maund, S. L., Nolley, R., Peehl, D. M. Optimization and comprehensive characterization of a faithful tissue culture model of the benign and malignant human prostate. Lab Invest. 94, 208-221 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены