Method Article
종양 세포 이동 연구를위한 인간 Glioblastoma Organotypic Slice 문화 모델 및 항 침윤성 약물의 환자 특이 적 효과
요약
glioblastoma (GBM)의 현재 ex vivo 모델은 생리 학적으로 인간 종양 침습 연구에 최적화되어 있지 않습니다. 여기, 우리는 신선한 인간 GBM 조직에서 organotypic 슬라이스 문화의 생성 및 유지를위한 프로토콜을 제시한다. 시간 경과 현미경 및 정량 세포 이동 분석 기술에 대한 설명이 제공됩니다.
초록
Glioblastoma (GBM)는 수술, 화학 요법 및 방사선 요법에도 불구하고 극도로 열악한 임상 예후를 계속 수행합니다. 주변 뇌 실질로 진행성 종양 침입은 지속적인 치료 도전을 나타냅니다. GBM에 대한 안티 - 마이 그 레이션 요법을 개발하기 위해서는 통제 된 실험을 위해 생리적으로 관련된 배경을 제공하는 모델 시스템이 필수적입니다. 여기, 우리는 수술 절제술 동안 얻은 인간의 GBM 조직에서 조각 문화를 생성하기위한 프로토콜을 제시한다. 이러한 배양 물은 동물 이종 이식 물 또는 단일 세포 배양 물을 통과하지 않고 생체 외 실험을 허용한다. 또한, 종양 세포의 이동성 및 치료제에 대한 관련 반응을 정량적으로 연구하기 위해 세포 추적과 함께 시간 경과 레이저 스캐닝 공 초점 현미경을 사용하는 방법을 설명합니다. 절편은 수술 조직 획득 90 분 이내에 재현 가능하게 생성됩니다. Retrovirally 중재 형광 세포 라beling, 공 촛점 이미징 및 종양 세포 이동 분석은 문화의 2 주 이내에 완료됩니다. 우리는 인간 GBM에서 증가 된 철새 행동과 관련된 유전 적 요인을 밝히기 위해 이러한 조각 문화를 성공적으로 사용했습니다. 또한, 우리는 안티 - 마이 그 레이션 요법에 대한 응답으로 환자 - 특정 변형을 감지하는 모델의 능력을 검증했다. 앞으로 인간 GBM 슬라이스 문화는 개인화 된 신경 종양 치료법을 발전시키기 위해 치료제에 대한 종양 감수성을 빠른 생체 내 평가를위한 매력적인 플랫폼입니다.
서문
glioblastoma (GBM)에 대한 실험실 연구는 종양 세포의 이동과 침입과 같은 인간 질병의 필수 병리학 적 특징을 충실히 재구성하는 모델의 부족으로 인해 방해 받고 있습니다. 2 차원 및 3 차원 체외 침윤 분석 및 3D 설치류 슬라이스 배양 모델의 비교 연구는이 두 상황에서 기계적으로 다른 세포 이동 프로그램을 발견하여 2D 시스템에서 인간 질병 1 , 2 , 3으로 의 결과의 번역 가능성을 잠재적으로 제한합니다. 여기에 설명 organotypic 종양 슬라이스 문화 및 이미지 패러다임은 수술 절제에서 얻은 전직 인간의 종양 조직의 조각 내에서 종양 세포 마이 그 레이션의 연구 수 있습니다. 따라서, 시간 경과 공 촛점 현미경과 함께 외과 절제 종양 조직의 슬라이스 문화는 기본에서 종양 세포 이동을 연구하는 플랫폼을 제공합니다조직 용해 또는 배양 passaging없이 microenvironment.
인간 종양 이종 이식, 레트로 바이러스 유발 종양 및 세포 오버레이에서 생성 된 GBM의 설치류 뇌 절편 배양 모델을 사용하여 종양 침습 1 , 2 , 3 , 4 , 5 를 연구하는 광범위한 문헌이있다. 최근에 여러 그룹이 인간 GBM 조직 6 , 7 , 8 , 9 , 10 에서 직접 organotypic 슬라이스 문화의 세대를 설명했다. 그러나, 기술 및 배양 배지를 슬라이싱하는 것과 관련하여 공개 된 프로토콜 간에는 현저한 차이가있다. 더 나아가, organotypic 슬라이스 문화의 사용은 세포 signali의 변화를 포함 정적 실험 종점에 초점을 맞추고있다신장, 증식 및 사망을 초래할 수 있습니다. 여기에 설명 된 프로토콜은 시간 경과 레이저 스캐닝 공 촛점 현미경을 통해 동적 종양 세포 행동의 시간 분해 관찰을 통합하여 이전의 슬라이스 문화 패러다임을 확대합니다. 인간 GBM에서의 inter 11 및 intratumoral 12 , 13 유전 변이의 최근 발견은 종양 세포 거동과이 이질성을 연결시키는 중요성과 치료에 대한 종양 반응에 미치는 영향을 강조한다. 여기에 우리는 거의 실시간으로 종양 세포 이동을 시각화하기 위해 인간 암 조직에서 직접 슬라이스 문화의 사용에 대한 간소하고 재현 가능한 프로토콜을보고합니다.
프로토콜
환자 조직 샘플 채취가 시작되기 전에 승인 된 Institutional Review Board (IRB) 프로토콜에 따라 각 환자로부터 정보에 입각 한 동의를 얻어야합니다. 이 프로토콜의 저자는 콜로라도 병원 (University of Colorado Hospital)과 Inova Fairfax Hospital의 승인 된 IRB 프로토콜하에 기술 된 작업에 대한 동의를 받았습니다. 이 슬라이스 문화에서 수집 된 데이터는 환자 진료 결정을 지시하는 데 사용되지 않았습니다.
1. 사전 슬라이스 준비
- 계획된 종양 절제 및 조직 수집 (또는 2 주 이내에 이전에 생성 된 미디어 활용) 전날에 "조직 처리"미디어와 "슬라이스 배양 유지"미디어를 준비하십시오. 조직 처리 매체를 생성하는 High-Glucose DMEM 500 mL에 페니실린 - 스트렙토 마이신 용액 (10,000 U / mL) 5 mL와 1M HEPES 5 mL를 첨가한다.
- 연결 매체 ( 예 : Neurobasal) 기지 기지를 사용하여 슬라이스 문화 유지 매체의 250 ML를 준비붉은 페놀 레드. 이 배지에 10 mM HEPES, 1x B-27 보충제, 400 μM L- 글루타민, 600 μM L- 알라 닐 -L- 글루타민 디 펩티드, 60 U / mL 페니실린, 60 μg / mL 스트렙토 마이신 및 6 U / mL nystatin을 보충하십시오.
- 모든 매체를 4 ℃에서 2 주 이상 보관하십시오.
2. 수술의 날 : 조직 획득
- 조직 수집 당일, 층류 후드에서 오토 클레이브 유리 제품 및 무균 기술을 사용하여 조직 처리 매질에서 저 융점 아가 로즈의 1 % 및 2 % (wt / vol %) 용액 50 - 100 mL를 준비한다. 아가로 오스의 두 농도는 종양 조직의 일관성에 예측할 수없는 변화를 수용하기 위해 필요합니다.
- 부드러운 비등이 관찰 될 때까지 전자 레인지를 사용하여 아가로 오스 현탁액을 가열합니다. 사용하기 전까지 액체 상태로 유지하기 위해 37 ° C 수조에 아가로 오스 용액을 넣으십시오.
- 6 잘 접시의 각 우물에 슬라이스 문화 유지 보수 미디어 1 ML을 놓으십시오.
- 살균제 사용집게는 각 우물에 빈 PTFE 문화 삽입을 배치합니다. 37 ° C로 유지 된 5 % CO 2 분위기 가습 물 재킷, 조직 배양 인큐베이터에서 플레이트를 놓는다.
- 층류 후드에서 멸균 파스퇴르 피펫을 사용하여 종양 조직을 얻기 전에 약 15 ~ 30 분 동안 얼음으로 찬 조직 처리 매체가 들어있는 플라스크에 95 % O 2 / 5 % CO 2 가스의 혼합물을 버블 링하십시오. supra-oxygenated 매체의 사용은 가공하는 동안 벌크 조직에서 저산소증을 최소화합니다.
- 수술실과 슬라이싱 시설 사이에 조직을 수송하기 위해 supra-oxygenated ice-cold processing media의 20 mL 분량을 포함하는 50 mL 원추형 튜브 (분리 할 개별 종양 부위를 원하는 수만큼 충분)를 준비합니다.
- 신경 외과 의사와 함께, 수술 전 샘플 수집을 위해 종양 영역을 계획합니다. 환자의 임상 적 상상력과 같이 대비 강화 된 종양 영역을 선택하십시오.g (T1 post-gadolinium 자기 공명 영상 (MRI) 시퀀스). 이전의 경험에 따르면이 영역은 괴사 조직과는 달리 생존 가능한 종양 조직을 생성합니다.
참고 : 주위 (peritumoral) 백질에서 조각의 생성이 시도되었다; 그러나, 배경 자기 형광 및 감소 종양 세포 밀도는 이러한 슬라이스의 실험적 유용성을 제한했습니다. - 종양 절제술의 시작 부분에 종양 조직을 얻습니다. 광범위한 양극성 소작에 노출 된 종양 조직 수집을 피하십시오. 이는 열 손상에 이차적 인 조직 생존 능력을 손상시킬 수 있습니다. 일괄 절제 도중에 긴로부터 얻은 조직에 비해 종양 절제 단편 중에 얻은 조직 샘플은 생존을 향상 보여준다. 이 관찰은 외과 적 절제술 및 획득까지의 연장으로 인한 혈류 차등 종양 조직 박탈과 관련 될 수 있습니다.
- 원한다면 종양 조직을 별도의 원추형 튜브에 표지하고 저장하여 시료를 분리하십시오별개의 종양 영역에서. ( 즉, 표면 대 깊은 종양 조직). 수술 중 외과 수술 항행이 가능할 때 / 때 정확한 조직 위치를 기록 할 수 있습니다.
3. 슬라이스 문화 준비
참고 :이 프로토콜은 신선한 수정 인간 조직의 사용이 필요합니다. 모든 샘플은 전염성이 있다고 추정되며 보편적 인 혈액 매개 병원체 프로토콜에 따라 처리해야합니다. 적절한 개인 보호 장비는 항상 착용해야합니다. 포셉과 scalpels는 사용하기 전에 15 분 자외선에 노출되어야합니다. 사용하는 동안 도구를 70 % 에탄올 (EtOH)로 간헐적으로 살포하여 사용하기 전에 액체가 증발 할 수있는 시간을줍니다. 슬라이싱 공정은 여과 된 공기를 갖는 수평 층류 후드를 사용하는 반 멸균 방식으로 수행된다.
- 얼음 감기 처리 매체와 페트리 접시에 장소 종양 조직 조각. 종양 조직을 씻고 부착 적혈구를 최소화하려면부드럽게 교환하고 페트리 접시에있는 미디어를 세 번 버리는 피펫.
- 메스를 사용하여 종양 조각을 직사각형 상자 모양으로 자릅니다. 조직 조각을 3mm x 3mm x 10mm 정도로 자릅니다. 미세한 집게로 절제 또는 완만 한 마찰을 통해 첨부 된 혈관을 조심스럽게 제거하십시오.
- 작은 입방체 모양 (~ 2 cm 3 )의 플라스틱을 넣는 곰팡이로 피펫 5 - 7 mL의 37 ° C 아가로 오스. 사용하기 전에 멸균 온도계로 아가로 오스 액의 온도가 37 ° C 이하인지 확인하십시오.
- 얼음 층에 아가로 오스가 약 1 분 동안 앉아있게하십시오.
- 세로로 긴 축을 가진 아가로 오스에 2 - 4 종양 조직 "스트립"을 놓습니다.
참고 : 조직 스트립은 응고되기 전에 아가로 오스에서 "가라 앉는"경향이 있습니다. 이러한 합병증을 피하기 위해, 아가로 오스가 더욱 응고 될 때까지 조직 스트립을 일시적으로 수직 방향으로 유지하십시오. - 아가로 오스 몰드가 들어있는 티슈를 2 ~ 5 마일응고를 촉진하기 위해 n.
- 얼음에서 곰팡이를 제거하고 메스로 양식의 측면을 절단하여 아가로 오스 블록을 부드럽게 제거하십시오. 블록에 과도한 힘을 가하면 아가로 오스가 파손될 수 있습니다.
- vibratome 표본 플레이트에 아가로 오스 블록을 부착하는 cyanoacrylate 접착제의 관대 한 드롭을 사용하십시오. 약 1 ~ 2 분 동안 접착제를 놓으십시오.
- 샘플 플레이트에 부착 된 아가로 오스 블록을 잠수시키기 위해 빙냉 처리 매체로 vibratome 저장소를 채 웁니다.
- 절단하는 동안, trimmed 멸균 플라스틱 피펫을 통해 vibratome 저수지에 거품 95 % O 2 / 5 % CO 2 가스 혼합물을 거품.
- vibratome 슬라이스 두께를 300 - 350 μm로 설정하십시오.
- 조직의 일관성에 따라 블레이드 진행 속도와 블레이드 진폭을 조정하십시오. "Stiffer"GBM 조직은 블레이드 전진 속도와 진폭이 느립니다. 정확한 블레이드 속도 및 진폭 설정은 vibratome 사양에 따라 다릅니다.
참고 : 슬라이싱하는 동안 일반적으로 몇 가지 문제가 발생합니다. 조직 스트립이 아가로 오스 블록에서 빠지면 조직을 고농도 아가로 오스에 삽입하십시오. 종양 조각이 원하는 것보다 두꺼운 경우 (기계 세트) 또는 비대칭 인 경우, vibratome blade의 진폭과 속도를 증가시킵니다. 종양 조직이 칼날 홀더에 달라 붙지 않거나 칼날 홀더에 "끌려"오지 않도록하려면 칼날이 움직일 때 칼날 홀더와 슬라이스 사이에 미세 주걱을 조심스럽게 배치하십시오. - 스테인레스 스틸 microspatula를 사용하여 얼음 추위 처리 매체와 페트리 접시 조직 조각을 전송하십시오.
- 인큐베이터에서 PTFE 인서트와 평형 슬라이스 배양 배지가 들어있는 6- 웰 플레이트를 얻습니다 (2 절, 4 단계에서 준비).
- 스테인리스 강 마이크로 주걱을 사용하는 플레이트 조직 조각. 작은 주름살 붓을 사용하여 주걱에서 부드럽게 슬라이스를 밀어내는 "유체 파"를 생성하여 조직의 직접 접촉과 조작을 최소화하십시오.배양 물 삽입물 위에 놓는다.
참고 : 조직 배양 물 삽입물 위에 도입되는 처리 매체의 양을 최소화하십시오. 과도한 양의 매체가 옮겨져 조각이 부유하게되면 멸균 된 파스퇴르 피펫을 사용하여 매체를 제거하십시오. - 5 % CO 2 분위기와 37 ° C에서 유지 인큐베이터로 종양 조각이 포함 된 6 잘 접시를 반환합니다.
참고 : 전체 내장 및 슬라이싱 프로토콜은 수술실에서 종양 조직을 확보 한 후 90 분 이내에 완료해야합니다.
4. 슬라이스 문화 정비
- 12 - 24 시간 후, 무균 포셉과 각 삽입 림을 파악하여 슬라이스 문화를 전송하고 신선한 슬라이스 문화 유지 보수 미디어를 포함하는 플레이트로 전송하십시오. 인서트를 옮기기 전에 적어도 15 분 동안 인큐베이터에서 각 웰에 분주 한 슬라이스 배양 배지를 평형화시켜야합니다.
- 신선한 평형 슬라이스 막이있는 새로운 6-well 플레이트로 인서트 이동매 48 시간마다 미디어를 보충하십시오.
- 원할 경우, 생화학 적 분석법 ( 즉, ELISA)에서 즉시 사용하기 위해 피펫으로 분취 한 오래된 배지 배지를 사용하거나 차후의 사용을 위해 -80 ° C에서 동결하십시오.
5. 녹색 형광 단백질 레트로 바이러스를 통해 종양 세포 라벨링
참고 : 종양 세포 이동 분석을위한 저속 현미경 검사에는 슬라이스 배양 내에서 세포의 안정적이고 장기적인 형광 표지가 필요합니다. 레트로 바이러스의 사용은 분할 세포에 선택적으로 감염되어 슬라이스 내에 존재하는 소맥 세포 또는 다른 세포 유형과는 대조적으로 종양 세포 집단 내에서 형광 표지를 풍부하게하기 때문에 바람직하다. 감염의 표준화는 10 4 CFUs / μL의 바이러스 역가가 세포 이동의 추적 및 분석을위한 충분한 녹색 형광 단백질 발현을 가져온다는 것을 암시합니다. 증가 된 바이러스 역가, 비 선택적 바이러스 ( 예 : 아데노 바이러스, 렌티 바이러스) 또는 ot모든 세포를 표시하는 그녀의 수단은 이동 중에 명확한 세포 경계의 식별을 배제 할 수있어 분석을 복잡하게합니다. 대체 형광 마커의 사용은 필요에 따라 활용 및 최적화 될 수 있습니다.
- 표준 프로토콜 5 , 14 또는 상업적으로 이용 가능한 소스 를 통해 종양 조각의 감염에 대한 레트로 바이러스를 얻습니다. 10 4 CFUs / μL의 바이러스 역가를 달성하기 위해 보완되지 않은 연결 매체에 적절한 볼륨을 추가하여 바이러스 뜨는을 희석.
- 문화의 7 ~ 10 일 사이에 5 - 10 μL의 바이러스 (10 4 CFUs / μL)와 관심의 종양 슬라이스 문화를 감염. 바이러스를 각 조직 슬라이스의 표면에 부드럽게 떨어 뜨립니다. 슬라이스가 인서트 표면에서 부유하는 경우 뜨는 볼륨을 줄입니다. 인큐베이터에 슬라이스 배양 물이 들어있는 플레이트를 반환하십시오.
- 24 시간 후 시작되는 표지 된 종양 세포에 대한 조각 평가 바이러스 감염 (섹션 6 참조). 이 시간 지연은 바이러스 결합 및 형광 유전자 발현 동역학에 따라 달라질 것이다. 여기에 사용 된 바이러스 구조에 대해, 72 시간은 표준 epifluorescence 현미경으로 강력한 형광 신호를 관찰해야했습니다.
참고 : 희소하게도, 슬라이스는 공 촛점 이미징을 복잡하게 할 수있는 바이러스로 표지 된 세포의 우세한 주변 분포를 표시합니다. 이러한 복잡성을 피하려면 슬라이스 두께와 두께 편차를 줄이십시오. 슬라이스 배양 물이 중심 근처에 더 두꺼운 영역을 갖는 경우, 이는 충분한 양분 침투를 방지하여 활발히 분열하는 종양 세포의 집단을 제한 할 수있다. 이러한 합병증 화면에 정성 분석은 슬라이스 배양 배지에 테트라 졸륨 염료 시약 (즉 MTT)의 추가이다. 시약을 첨가 한 후 파란색으로 변하지 않는 슬라이스 부분은 신진 대사 활동이 부족하고 슬라이스 상태가 손상되었음을 나타냅니다.
참고 : 성공적인 형질 도입 및 배양 물의 건강이 확인 된 후에, 세포를 대조 조건하에 이미징 한 다음, 처리 조건 하에서 동일한 기간의 이미징을 수행 할 수있다. 이 프로토콜을 사용하여 각 조건에서 12 시간 동안 세포를 성공적으로 이미징하고 추적했습니다. 그러나 더 짧거나 긴 기간의 이미징 및 환경 조작 또한 유익 할 수 있습니다.
- 현미경 로딩
- 이미징하기 전에 유리 바닥 접시에 신선한 슬라이스 미디어 1 ML을 넣으십시오.
- 유리 바닥 접시에 미디어가 인큐베이터에서 15 분 평형 수 있습니다.
참고 :이 시점에서 형광 conjugated lectins ( 즉 , microglia 라벨을위한 Isolectin IB 4 ) 또는 리간드 복합 형 양자점과 같은 가용성 라벨링 에이전트는 세포의 식별을위한 슬라이스 문화 미디어에 추가 할 수 있습니다영상화 중 ure subpopulations. - 층류 후드의 무균 포셉을 사용하여 이미지를 삽입 할 유리 삽입물을 유리 바닥 접시로 옮깁니다. 접시를 현미경 스테이지로 옮깁니다.
- 밀폐 된 현미경 스테이지 탑 배양기에서 37 ° C 및 5 % CO 2 대기에서 슬라이스 배양을 유지합니다. 과도한 증발을 방지하기 위해 가능한 경우 배양 챔버의 무균 H 2 O 가습을 이용하십시오 (특히 긴 이미징 실험에서 중요합니다).
- 단일 광자 및 / 또는 다중 광자에 대해 장거리 작동 거리 10X 공기 대물 렌즈 및 레이저 여기가있는 공 촛점 현미경을 사용하십시오.
참고 : 현미경 대물 렌즈가 적절한 작동 거리를 제공하는지 확인하십시오. 스테이지 탑 배양기, 유리 바닥 접시 및 조직 배양 물 삽입물의 높이가 높아짐에 따라 긴 작업 거리 목표가 중요합니다. - 유리 바닥 판을 고정시키고, 플라스틱 페트리 접시 커버를 제거하고,투과 막.
- 이미지 수집
- 현미경을 사용하여 슬라이스를 육안으로 검사하고, 슬라이스 가장자리와 중심 사이의 형광 라벨이 붙은 종양 세포의 적절한 밀도로 적합한 필드를 찾습니다. 이미징 중 조직 이동의 감수성이 증가하기 때문에 슬라이스 가장자리의 필드를 피하십시오. 이 shift를 제한하기 위해 조직 slice harps가 사용될 수 있습니다.
- 다차원 분석 모드에서 이미징 소프트웨어를 사용하여 이미지화 할 모든 위치에 가시적 인 형광 세포 신호가 포함되도록 첫 번째 (아래) 및 마지막 (최상위) Z- 스택 경계를 설정합니다. 10 μm의 일정한 Z- 스텝을 가진 150 - 200 μm의 슬라이스를 통한 이미징은 세포 경로를 추적하기위한 적절한 해상도를 제공했습니다 (개별 이미징 요구에 맞게 조정할 수 있음).
- 현미경에 전동 스테이지가있는 경우 각 Z 스택 수집에 적절한 시간을 허용하십시오. 획득 간의 시간 간격을 같게 설정하십시오.위치 당 스캔 시간 x 이미지 위치 수 ( 즉, 촬영 된 종양 영역).
참고 : 녹색 및 적색 형광체의 동시 여기를 위해 동시 488 nm 및 633 nm 여기와 함께 듀얼 라인 레이저 라인 스캐닝 프로그램을 사용하십시오. 선택된 레이저 여기 파장은 표현 된 개별 형광 단백질에 따라 다양합니다. - 이미징 된 종양 영역 사이의 균일 한 레이저 출력 및 공 촛점 핀홀 설정을 유지하십시오. 광독성을 제한하기 위해 종양 세포 몸과 과정을 명확히 구분하는 데 필요한 최저 레이저 출력 설정을 활용하십시오. 특정 이미징 매개 변수 단위 ( 즉, 전원 및 공 촛점 핀홀 설정)은 현미경 및 레이저 소스 사양에 따라 다릅니다.
- 목표물쪽으로 진행하는 초점면에 2 - 3 "버퍼"Z 스택 단계를 추가하여 잠재적 인 용지 증발을 보정하십시오. 이것은 효과적으로 조직이 Z 스택 획득 범위를 벗어나는 것을 방지합니다이온이 수직면에 존재한다.
7. 이미지 후 처리 및 종양 세포 추적
참고 : 많은 공 촛점 이미징 시스템에는 독점적 인 이미지 처리 소프트웨어가 장착되어 있습니다. 아래에 설명 된 처리 단계는 소프트웨어 플랫폼에서 수행 할 수있는 일반 프로토콜을 포함합니다. NIH ImageJ와 MTrackJ 15 와 같은 오픈 소스 플랫폼에 대한 구체적인 지침이 제공됩니다.
- Z 스택 파일을 엽니 다. ImageJ에서 "이미지 → 스택 → Z 프로젝트"를 클릭하십시오. 포함 할 첫 번째와 마지막 Z- 스택을 선택하고 "Max Intensity"를 투영 유형으로 선택했습니다. 결과는 최대 강도 투영 (MIP)이라고하는 렌더링입니다. 이미징 된 각 영역에서 캡처 된 Z 스택 이미지의 각 세트에서 MIP를 작성하십시오.
- 각 지역의 MIP를 연결하여 시계열을 만듭니다. "이미지 → 스택 → 이미지를 스택"을 클릭하십시오.
- 수동으로 위치 식별종양 세포 몸체의 시각적으로 근사 된 중심점을 선택함으로써 세포체 "중심"의 위치를 결정할 수있다. 이것은 MTrackJ (NIH ImageJ의 오픈 소스 플러그인 인)의 "add"트랙 기능을 사용하여 셀 본문을 클릭함으로써 수행됩니다.
- 클릭하면 일련의 이미지의 각 프레임에서 셀 본문 위치가 구분됩니다. 이렇게하면 각 셀에 고유 한 "트랙"이 만들어집니다. 계속해서 다음 셀의 셀 본문 위치를 표시합니다. 모든 셀 마이그레이션 경로가 추적 될 때까지이 프로세스를 반복하십시오.
- 주어진 종양 미세 영역에서 세포 집단이 추적되면 MTrackJ의 "측정"기능을 사용하여 모든 세포 추적 좌표를 내 보냅니다. 파일을 .xls 형식으로 저장하면 스프레드 시트 또는 사용자 생성 소프트웨어를 사용하여 원시 데이터를 분석 할 수 있습니다.
- 셀의 이송 경로를 따라 각 포인트에 대해 기록 된 좌표를 사용하여 이송 속도, 방향 및 기타 이송의 유도를 포함한 정량 분석을 수행합니다.메트릭, 후드 등 (16)에 기술 된 바와 같이.
참고 : 계산 된 모든 거리와 속도는 실제 값보다 미달합니다. 이는 최대 강도 투영을 생성하여 3 차원 이미지 (및 마이그레이션 경로)를 2 차원 데이터로 변환하는 데 내재되어 있습니다.
결과
우리 그룹은 초기 GBM 절제술을받은 50 명 이상의 환자로부터 슬라이스 문화를 성공적으로 생성했습니다. 이 슬라이스 생성, 배양, 레트로 바이러스 라벨링, 이미징 및 마이그레이션 분석 프로토콜은 재현 가능한 워크 플로우로 간소화되었습니다 ( 그림 1 ). 비판적으로,이 organotypic GBM 조각 문화 ( 그림 2 ) 최대 15 일 pathologic의 각인 및 microglia의 유지 관리를 포함한 문화를 통해 원래 종양 조직과 일치를 보여줍니다. 또한, 우리는 미세 환경 변화에 대한 종양 반응의 기능적 분석을 수행하기 위해이 시스템을 활용 해 왔습니다. 생리적 무결성 측정으로, 우리는, GBM 슬라이스 배양 혈관 내피 성장 인자 (VEGF), 생체 내 (17)에 넘치게 GBM 미세 환경 내에서 일어나는 프로세스의 생성을 측정함으로써 저산소증 (1 % O 2)에 응답하는 방법을 검토"> 우리는 저산소 상태에서 슬라이스 배양 물을 배치함으로써 급속한 생리적 반응을 일으키고 배지로 VEGF가 방출되도록 유도한다는 것을 입증했다 ( 그림 3 ).
종양 세포 이동의 정성 및 양적 측면을 평가하기 위해 우리는 시간 경과 영상을 이용하여 자세한 이동지도를 생성했습니다. 이지도는 종양 소규모 영역 (1mm 2 )의 범위 내에서 추적 된 모든 GBM 세포를 구분하여 종양 개체의 동적 인 이동 행동을 정적으로 시각화합니다. 이동 속도와 방향성 (세포 이동 / 총 이동 거리)의 정량적 측정을 각 세포에 대해 계산하여 종양 부위, 종양 샘플 및 치료 반응에 따른 이동 매개 변수의 변화를 조사했습니다 ( 그림 4 ).
세포 라벨링 및 이미징 프로토콜 des여기에 기술 된 것은 또한 원주 종양 미세 환경을 통한 이동 중에 세포 형태학의 변화를 평가하기에 충분한 공간적 및 시간적 해상도를 제공한다. 우리는 형태 학적으로 뚜렷한 운동성 종양 세포와 소구류의 존재가 슬라이스 배양 내에서 혼합되어 있음을 관찰했다 ( 그림 5A ). 종양 세포의 움직임은 정체 된 세포에서 필로 포디아 (filopodia)를 반복적으로 돌출 시키거나 후퇴시키는 "탐색 및 파열 (burst and burst)"과정에 의해 특징 지어졌고, 짧은 시간에 효율적인 운동이 이루어졌다. 약 10 분마다 이미징 슬라이스 영역은 또한 세포 분열을 겪고있는 종양 세포의 시간 경과 이미지를 기록하기위한 적절한 시간 해상도를 제공했습니다. 이 분열하는 세포는 이동에서 일시 정지하고 유사 분열을 완료하고 딸 세포는 3 시간 내에 모두 마이그레이션을 재개했습니다 ( 그림 5D ). 대조적으로, 미세 아교 세포는 인접한 종양 세포보다 낮은 방향성으로 더 높고보다 일정한 속도로 이동하며,상대적으로 비효율적 인 이주를 보여줍니다 ( 그림 5C, 5E-G ). 이러한 관찰은 치료에 대한 환자 또는 세포 특이 적 반응의 기본이되는 생물학에 대한 통찰력을 얻는 데 중요 할 수 있습니다.
마지막으로, 우리는 종양 세포 (16)의 증강 철새 잠재력을 가진 표피 성장 인자 수용체 (EGFR) 유전자 증폭의 상관 관계를 포함하여 인구 수준에서 세포 이동의 매개 변수 입증 환자에 대한 환자 변동성이 프로토콜을 사용했다. 또한, 종양 조각의 시간 경과 현미경 이전과 반 침습적 약물, 피티 닙 치료 후, EGFR 증폭 종양 조각 (16)에 특이 마이그레이션에 상당한 감소를 보여 주었다.
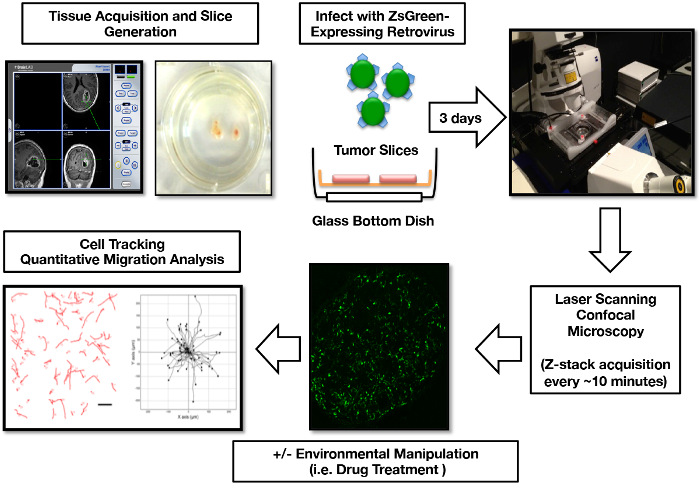
그림 1 : 인간 GBM Organotypic Slice Culture 감염, 영상 및 세포 이동 분석 워크 플로우. 종양 조직은 수술 중 항행 장비 를 통해 특정 지역에 국한됩니다. 1 주일 후 슬라이스, ZsGreen 표현 레트로 바이러스는 mitotically 활성 종양 세포를 레이블 슬라이스 문화에 추가됩니다. 감염 3 일 후, 공 촛점 이미징을위한 조각이 준비되었습니다. 3D 이미징 데이터는 세포 이동 경로 추적, 종양 세포 이동 맵 생성 및 종양 세포 이동 매개 변수 계산을 위해 2D 이미지로 후 처리됩니다. 이 숫자의 일부는 원래 Parker et al , 2013 16에 게시되었으며 Oxford University Press의 허가를 받아 복제되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2. 인간 GBM Organotypic 슬라이스는 전 생체 내 문화를 통해 조직 학적 특징을 유지 합니다. ( A ) T1 조영 향상된 MRI 시퀀스는 조직 획득 (화살표)의 지역을 지역화하고 문서화하는 데 사용되었습니다. ( B ) A.에서 강조 표시된 지역에서 얻은 조직에서 생성 된 슬라이스 문화에서 문화의 8 일째 초기 기증자 조직 (OR) 및 조각의 H & E 얼룩 ( C ) GBM의 Microenvironmental pathologic 및 세포 기능, 생체 내 유지됩니다 슬라이스 문화 전반에 걸쳐. (상단, 하단) 확대 사진에서 microglia / macrophage 마커 인 CD68에 대한 면역 조직 화학 검사는 배양 15 일 후 슬라이스에서 소교 세포의 지속성을 나타냅니다. 슬라이스 배양 4 일째의 H & E 염색은 pseudopallisading necrosis, patho(iii)과 (iv) 배율 모두에서 GBM의 로직 특성. 스케일 바 = 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도표 3 : 인간 GBM 조각 문화는 저산소증에 반응하여 VEGF를 분비합니다. ( A ) 실험은 동일한 종양 영역에서 생성 된 3 개의 유사한 크기의 종양 조각을 포함하는 개별 문화 삽입물을 활용했습니다. 절편은 12 시간 동안 정상 산소 상태로 유지되었으며, 12 시간 간격으로 2 시간의 저산소 상태가 유지되었으며, 각 간격 전에 새로운 매질이 추가되었다. ( B ) 2 개의 대표적인 종양으로부터 생성 된 슬라이스 배양 물로부터 ELISA (평균 ± 표준 편차)에 의해 측정 된 배지로의 VEGF 분비는 유의하게 증가 하였다정상 산소보다 저산소증이었다 (p <0.05). ( C ) 4 가지 종양의 슬라이스 배양 물을 풀 분석 한 결과, 정상 산소와 비교하여 12 시간 간격으로 저산소증을 일으킨 후에 VEGF 분비가 증가하는 것으로 나타났다 (p <0.05). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 : 종양 세포 경로 트랙 데이터는 세포 속도와 방향성의 정량적 결정을 허용합니다. 낮은 방향성과 그 비효율적 지그재그 경로에 관여하는 반면,이 개략도 (16)에 표시된 바와 같이 (1)의 방향성과 (A) 종양 세포는 직선 벡터 따라 최적의 효율성을 나타낸다. 옥스포드 대학의 허가를 받아 증쇄.프레스. ( B ) 전형적인 경로 추적 데이터 ( "저"해상도 ~ 55 분 셀 추적 간격)의 분석은 속도와 방향성의 세포 다양성을 입증합니다. ( C ) 각 셀 트랙에 대한 방향성과 이동 속도는 세포 집단 전체의 이동 거동을 시각화하기 위해 플롯됩니다 (각 점은 개별 셀을 나타냄). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5 : GBM Slice Cultures 내의 Microglia는 종양 세포에 비해 높은 이동 속도와 낮은 방향성으로 특징 지어집니다. ( A ) ZSGreen 레트로 바이러스 및 Isolectin - I 태그의 microglia를 선택적으로 표현 종양 세포 복제 B 4 -647 접합체는 대표적인 슬라이스 배양 물로부터 대표적인 종양 미세 영역에 혼합되어 존재한다. ( BC ) 동일한 종양 미세 영역에서 개별적으로 추적 된 GBM ( B )와 미세 신경 세포 ( C )의 경로는 불일치하는 이동 거동을 보여줍니다. 스케일 바 = 200 μm. ( D ) 활발하게 이동하는 종양 세포가 멈추고, 그 과정을 후퇴하며 (화살촉), 세포 분열을 겪고, 두 딸 세포가 반대 방향 (화살표)으로 이동한다. 스케일 바 = 50 μm. ( E 와 F ) Microglia는 같은 지역의 종양 세포와 비교했을 때 증가 된 이동 속도 (p <0.0001)와 감소 된 방향성 (p <0.0001)을 나타냅니다. (G) 속도와 방향성에 기초한 종양과 소교 세포의 분포는 두 세포 집단의 독특한 철새 표현형을 보여준다.et = "_ blank"> 이 그림의 확대 버전을 보려면 여기를 클릭하십시오.
토론
인간의 암 조직에서 유래 한 organotypic slice culture는 전임상 번역 실험을위한 매력적이고 활용도가 낮은 플랫폼을 제공합니다. 토종 미세 환경에서 이동, 증식 및 세포 사멸과 관련하여 종양 세포의 인구 수준 행동을 이해하는 것은 부족합니다. 비판적으로, 세포 행동의 수준에서 역동적이고 시간 - 해결 방식으로 치료에 종양 반응을 연구 치료 저항의 새로운 메커니즘에 빛을 발산 수 있습니다. 인간의 종양 슬라이스 배양은 인간의 질병 과정과 현재의 생체 내 및 생체 내 모델링 기술 간의 연결 고리를 제공합니다 19 . 최근 EGFR 증폭 16 시그널링에 관련된 세포 이동 동작 최초로 측정 간 종양 변화를보고, GBM 이동을 연구하는 방법으로서, 여기에 기재된 기술을 검증. 이 연구는 또한 슬라이스 배양 모델을 사용하여 파티를 테스트했습니다GBM 16에 대한 잠재적 인 항 침입 치료제로서의 EGFR 억제제 gefitinib의 고유 특이 적 효과.
조직 절단, 레트로 바이러스 감염, 이미징 및 이미지 분석 패러다임의 일반적인 함정 중 일부는 위에 논의되었습니다. 그러나 레트로 바이러스 감염 프로토콜은 더 많은주의를 기울여야합니다. 환자 대 환자의 변화를 고려할 때, 각 슬라이스 내에서 바이러스로 표지 된 종양 세포의 밀도를 적정하는 것은 어려울 수 있습니다. 불충분 한 세포 수가 바이러스 구조물에 의해 분류된다면 레트로 바이러스 상등액의 5-10 μL 분량을 표지 된 종양 세포가 원하는 농도가 될 때까지 매일 각 표면의 표면에 추가하십시오. 기본 슬라이스 배양에서, 복제 세포의 퍼센트는 일반적으로 형질 전환 된 세포주에서보다 낮으며, 따라서 임의 시점에서 레트로 바이러스 결합에 허용되는 세포의 서브 세트를 제한한다. 또는 너무 많은 셀에 라벨이 지정되어 있으면세포 이동 경로의 경계를 촉구하고, 뉴론 배지로 바이러스 상층 액을 희석하여보다 낮은 유효 역가를 달성한다. 종양 관련 미세 아교 세포는 레트로 바이러스를 발현하는 형광 단백질을 모든 표지화 된 세포의 약 1 %의 빈도로 통합시켰다. 우리는 post-imaging 데이터 분석을 위해 microglia binding lectin을 사용하여 별도의 분석을 위해 시각적으로 이들 세포를 분리 할 수있었습니다 ( 그림 5 ).
영양 전달, 세포 - 세포 상호 작용 및 세포 외 기질을 포함한 종양의 미세 환경은 모두 GBM 20 의 병인에 중요한 역할을합니다. 직접적인 인간 GBM 슬라이스 배양은 작은 동물 모델 또는 전파 된 세포 배양 내에서의 passaging의 필요성을 없애 주며 동시에 인간의 종양 미세 환경을보다 자세히 보여줍니다. 또한, 슬라이스 배양은 세포 - 세포 및 세포 -ECM 상호 작용을 유지하면서 샘플을 가로 질러 영양분에 대한 통일 된 접근을 제공합니다. var를 줄임으로써종양 내에서 발생하는 것으로 알려진 영양소에 대한 세포 내 접종에서, 우리는 종양 수준에서 종양 세포 행동 ( 즉, 이동) 사이의 본질적인 차이에 대해 배양 된 관찰 된 차이점을 밝힐 것을 제안한다. 그러나 인간의 종양에서 생성 된 슬라이스 문화를 통해 수집 된 데이터를 해석하는 것은 고유의 종간 및 종양 이형성으로 인해 복잡합니다. 비판적으로, 인간 종양 슬라이스 배양의 생체 내 유지 관리 중에 발생할 수있는 유전 적 및 후 발생 적 교대를 특성화하기 위해서는 추가 연구가 필요합니다.
Phase I / II 임상 시험과 병행하여 인간 종양 슬라이스 배양을 사용하는 것은 슬라이스 매개 변수와 환자 임상 결과를 연관시키는 유망한 전략입니다. 슬라이스 배양이 종양 치료를 개인화하기 위해 사용될 수 있기 전에 이러한 잠재적 예측 / 예후 인자의 검증이 필요합니다. 다른 사람들의 연구뿐만 아니라 우리의 연구는 바이오 마커 검증의 타당성을 입증한다 9 , 16의 슬라이스 배양에서 치료제의 신속한 생체 외 시험을 수행 할 수 있습니다. 폐 22 , 결장 22 , 머리와 목 23 , 유방 24 및 전립선 암 25 조직을 사용하는 유사한 인간 슬라이스 배양 기술은이 접근법이 인간 암에서 일반화 될 수 있음을 제시합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
Lee Niswander 박사와 Rada Massarwa 박사에게 기술 전문 지식과 여기에 설명 된 슬라이스 문화 공 촛점 이미징 프로토콜에 대한 공헌에 감사드립니다. 뇌 종양 조직 슬라이싱 및 배양 변수 최적화에 관한 전문 지식을 제공 한 Kalen Dionne 박사에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| DMEM High Glucose | Invitrogen (Gibco) | 11960-044 | |
| Neurobasal-A Medium, minus phenol red | Invitrogen (Gibco) | 12349-015 | |
| B-27 Supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Penicillin-Streptomycin (10,000 U/mL) | Invitrogen (Gibco) | 15140-122 | |
| GlutaMAX Supplement | Invitrogen (Gibco) | 35050-061 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| HEPES (1 M) | Invitrogen (Gibco) | 15630-080 | |
| Nystatin Suspension | Sigma-Aldrich | N1638-20ML | 10,000 unit/mL in DPBS, aseptically processed, BioReagent, suitable for cell culture |
| UltraPure Low Melting Point Agarose | Invitrogen (Gibco) | 16520-050 | Melts at 65.5 °C, Remains fluid at 37 °C, and sets rapidly below 25 °C. |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 Conjugate | Thermo Fisher (Molecular Probes) | I32450 | Used in media to label Microglia/Macrophages |
| pRetroX-IRES-ZsGreen1 Vector | Clonetech | 632520 | |
| Retro-X Concentrator | Clonetech | 31455 | Binding resin for non-ultracentrifugation concentration of viral supernatants |
| pVSG-G Vector | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| GP2-293 Viral packaging cells | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| Cyanoacrylate Glue (Super Glue) | Sigma-Aldrich | Z105899 | Medium-viscosity |
| Equipment | |||
| Peel-A-Way Embedding Mold (Square - S22) | Polysciences, Inc. | 18646A-1 | Molds for tumor sample embedding |
| Stainless Steel Micro Spatulas | Fisher Scientific | S50823 | Bend instrument 45 degrees at the neck of the spoon blade |
| Curved Fisherbrand Dissecting Fine-Pointed Forceps | Fisher Scientific | 08-875 | |
| Single Edge Razor Blade (American Safety Razors) | Fisher Scientific | 17-989-001 | Blade edge is 0.009" thick. Crimped blunt-edge cover is removed before loading onto vibratome. |
| Leica VT1000 S Vibratome | Leica Biosystems | VT1000 S | |
| Hydrophilic PTFE cell culture insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm pore size |
| 35 mm Glass Bottom Dishes | MatTek | P35G-1.5-20-C Sleeve | 20 mm glass diameter. Coverslip glass thickness 1.5 mm |
| LSM 510 Confocal Micoscope | Zeiss | LSM 510 | 10x Air Objective (c-Apochromat NA 0.45) |
| PECON Stagetop Incubator | PeCON Germany | (Discontinued) | Incubator PM 2000 RBT is a comprable product designed for use with Zeiss Microscopes. |
참고문헌
- Beadle, C., et al. The role of myosin II in glioma invasion of the brain. Mol Biol Cell. 19, 3357-3368 (2008).
- Farin, A., et al. Transplanted glioma cells migrate and proliferate on host brain vasculature: a dynamic analysis. Glia. 53, 799-808 (2006).
- Panopoulos, A., Howell, M., Fotedar, R., Margolis, R. L. Glioblastoma motility occurs in the absence of actin polymer. Mol Biol Cell. 22, 2212-2220 (2011).
- Ivkovic, S., et al. Direct inhibition of myosin II effectively blocks glioma invasion in the presence of multiple motogens. Mol Biol Cell. 23, 533-542 (2012).
- Assanah, M., et al. Glial progenitors in adult white matter are driven to form malignant gliomas by platelet-derived growth factor-expressing retroviruses. J Neurosci. 26, 6781-6790 (2006).
- Chaichana, K. L., et al. Preservation of glial cytoarchitecture from ex vivo human tumor and non-tumor cerebral cortical explants: A human model to study neurological diseases. J Neurosci Methods. 164, 261-270 (2007).
- Grube, S., et al. Overexpression of fatty acid synthase in human gliomas correlates with the WHO tumor grade and inhibition with Orlistat reduces cell viability and triggers apoptosis. J Neurooncol. 118, 277-287 (2014).
- Hovinga, K. E., et al. Inhibition of notch signaling in glioblastoma targets cancer stem cells via an endothelial cell intermediate. Stem Cells. 28, 1019-1029 (2010).
- Merz, F., et al. Organotypic slice cultures of human glioblastoma reveal different susceptibilities to treatments. Neurooncol. 15, 670-681 (2013).
- Xu, J., et al. Vorinostat modulates cell cycle regulatory proteins in glioma cells and human glioma slice cultures. J Neurooncol. 105, 241-251 (2011).
- Verhaak, R. G., et al. Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities. in PDGFRA, IDH1, EGFR, and NF1. Cancer cell. 17, 98-110 (2010).
- Gill, B. J., et al. MRI-localized biopsies reveal subtype-specific differences in molecular and cellular composition at the margins of glioblastoma. Proc Natl Acad Sci USA. 111, 12550-12555 (2014).
- Snuderl, M., et al. Mosaic amplification of multiple receptor tyrosine kinase genes in glioblastoma. Cancer cell. 20, 810-817 (2011).
- Kakita, A., Goldman, J. E. Patterns and dynamics of SVZ cell migration in the postnatal forebrain: monitoring living progenitors in slice preparations. Neuron. 23, 461-472 (1999).
- Meijering, E., Dzyubachyk, O., Smal, I., van Cappellen, W. A. Tracking in cell and developmental biology. Sem Cell Dev Biol. 20, 894-902 (2009).
- Parker, J. J., et al. Gefitinib selectively inhibits tumor cell migration in EGFR-amplified human glioblastoma. Neurooncol. 15, 1048-1057 (2013).
- Brat, D. J., et al. Pseudopalisades in glioblastoma are hypoxic, express extracellular matrix proteases, and are formed by an actively migrating cell population. Cancer Res. 64, 920-927 (2004).
- Shweiki, D., Itin, A., Soffer, D., Keshet, E. Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis. Nature. 359, 843-845 (1992).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15, 647-664 (2014).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. 60, 502-514 (2012).
- Di Cristofori, A., et al. The vacuolar H+ ATPase is a novel therapeutic target for glioblastoma. Oncotarget. 6, 17514-17513 (2015).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proc Natl Acad Sci USA. , 8352-8356 (2010).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. Br J Cancer. 110, 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. J Clin Pathol. 66, 253-255 (2013).
- Maund, S. L., Nolley, R., Peehl, D. M. Optimization and comprehensive characterization of a faithful tissue culture model of the benign and malignant human prostate. Lab Invest. 94, 208-221 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유