Method Article
Ein menschliches Glioblastom Organotypisches Scheibenkulturmodell zur Untersuchung der Tumorzellmigration und patientenspezifischen Wirkungen von antiinvasiven Arzneimitteln
In diesem Artikel
Zusammenfassung
Aktuelle Ex-vivo- Modelle von Glioblastom (GBM) sind nicht für eine physiologisch relevante Untersuchung der menschlichen Tumorinvasion optimiert. Hier stellen wir ein Protokoll zur Erzeugung und Pflege von organotypischen Scheibenkulturen aus frischem menschlichem GBM-Gewebe vor. Es wird eine Beschreibung der Zeitraffer-Mikroskopie und der quantitativen Zellmigrationsanalyse-Techniken gegeben.
Zusammenfassung
Glioblastom (GBM) weiterhin eine extrem schlechte klinische Prognose trotz chirurgischen, chemotherapeutischen und Strahlentherapie zu tragen. Progressive Tumorinvasion in das umliegende Hirnparenchym stellt eine dauerhafte therapeutische Herausforderung dar. Um Anti-Migrationstherapien für GBM zu entwickeln, sind Modellsysteme, die einen physiologisch relevanten Hintergrund für kontrolliertes Experimentieren bieten, unerlässlich. Hier präsentieren wir ein Protokoll zur Erzeugung von Scheibenkulturen aus humanem GBM-Gewebe, das während der chirurgischen Resektion gewonnen wird. Diese Kulturen erlauben Ex-vivo- Experimente ohne Passage durch tierische Xenotransplantate oder Einzelzellkulturen. Weiterhin beschreiben wir die Verwendung von zeitraffer Laserscanning-konfokalen Mikroskopie in Verbindung mit der Zellverfolgung, um das Migrationsverhalten von Tumorzellen quantitativ zu untersuchen und die Resonanz auf Therapeutika zu beurteilen. Scheiben werden innerhalb von 90 min der chirurgischen Gewebeerfassung reproduzierbar erzeugt. Retrovirally-vermittelte fluoreszierende Zelle laBeling, konfokale Bildgebung und Tumorzellmigrationsanalysen werden anschließend innerhalb von zwei Wochen der Kultur abgeschlossen. Wir haben diese Scheibenkulturen erfolgreich eingesetzt, um genetische Faktoren aufzudecken, die mit einem erhöhten Migrationsverhalten im menschlichen GBM verbunden sind. Weiterhin haben wir die Fähigkeit des Modells validiert, eine patientenspezifische Variation in Reaktion auf Anti-Migrationstherapien zu detektieren. Nach vorne gehen menschliche GBM-Slice-Kulturen eine attraktive Plattform für eine schnelle Ex-vivo- Beurteilung der Tumorsensitivität gegenüber therapeutischen Wirkstoffen, um eine personalisierte neuro-onkologische Therapie voranzutreiben.
Einleitung
Die Laborstudie des Glioblastoms (GBM) wird durch einen Mangel an Modellen behindert, die die notwendigen pathologischen Eigenschaften der menschlichen Erkrankung, nämlich die Tumorzellmigration und die Invasion, treu rezitieren. Vergleichende Untersuchungen von 2D- und 3D- In-vitro- Invasions-Assays sowie 3D-Nagetier-Slice-Kulturmodellen haben in diesen beiden Kontexten mechanistisch disparate zelluläre Migrationsprogramme aufgedeckt, die möglicherweise die Übersetzbarkeit von Befunden von 2D-Systemen auf die menschliche Erkrankung 1 , 2 , 3 beschränken . Das hier beschriebene organotypische Tumorscheiben-Kultur- und Bildgebungsparadigma ermöglicht die Untersuchung der Tumorzellmigration innerhalb von ex vivo menschlichem Tumorgewebe, erhalten aus chirurgischer Resektion. So bieten Scheibenkulturen von chirurgisch reseziertem Tumorgewebe in Verbindung mit zeitraffer konfokaler Mikroskopie eine Plattform, um die Tumorzellmigration im Eingeborenen zu untersuchenMikroumgebung ohne Gewebeauflösung oder Kulturpassage.
Es gibt umfangreiche Literatur, die Nagetier-Hirn-Slice-Kulturmodelle von GBM aus menschlichen Tumor-Xenotransplantaten, retroviral-induzierten Tumoren und zellulären Overlays zur Untersuchung der Tumorinvasion 1 , 2 , 3 , 4 , 5 verwendet . Kürzlich haben mehrere Gruppen die Erzeugung von organotypischen Scheibenkulturen direkt aus dem menschlichen GBM-Gewebe 6 , 7 , 8 , 9 , 10 beschrieben . Allerdings gibt es eine deutliche Variation zwischen veröffentlichten Protokollen in Bezug auf Schneidtechnik und Kulturmedien. Weiterhin konzentrierte sich die Verwendung von organotypischen Scheibenkulturen auf statische experimentelle Endpunkte, die Änderungen der Zellsignale beinhaltenNg, Proliferation und Tod. Das hier beschriebene Protokoll dehnt sich auf vorherige Scheibenkulturparadigmen aus, indem die zeitaufgelöste Beobachtung von dynamischen Tumorzellverhalten durch zeitkonstante Laserscanning-konfokale Mikroskopie aufgenommen wird. Die jüngste Entdeckung von inter 11 und intratumoraler 12 , 13 genetischer Variation in humanem GBM unterstreicht die Bedeutung der Verknüpfung dieser Heterogenität mit Tumorzellverhalten und deren Auswirkungen auf die Reaktion des Tumors auf die Therapie. Hier berichten wir über ein stromlinienförmiges und reproduzierbares Protokoll für die Verwendung von direkten Scheibenkulturen aus einem menschlichen Krebsgewebe, um die Tumorzellmigration in nahezu Echtzeit zu visualisieren.
Protokoll
Vor der Einnahme von Patientengewebeproben ist eine Einverständniserklärung von jedem Patienten im Rahmen eines genehmigten Instituts für das Exemplar (IRB) zu erhalten. Die Autoren dieses Protokolls erhielten Zustimmung für die Arbeit, die unter genehmigten IRB-Protokollen an der Universität von Colorado Krankenhaus und Inova Fairfax Krankenhaus beschrieben wurde. Daten, die aus diesen Scheibenkulturen gesammelt wurden, wurden nicht verwendet, um Patientenbetreuungsentscheidungen zu lenken.
1. Vorschneiden Vorbereitung
- Bereiten Sie "Gewebeverarbeitung" Medien und "Slice Kultur Wartung" Medien am Tag vor geplanten Tumor Resektion und Gewebe Sammlung (oder verwenden Sie zuvor generierte Medien innerhalb von 2 Wochen). Füge 5 ml Penicillin-Streptomycin-Lösung (10.000 U / ml) und 5 ml 1 M HEPES zu 500 ml eines High-Glucose-DMEM hinzu, um das Gewebeverarbeitungsmedium zu erzeugen.
- Vorbereiten von 250 ml Schichtkultur-Wartungsmedien unter Verwendung einer Basis von neuronalem Medium ( zB Neurobasal) WitzHülle Phenol rot. Ergänzen Sie dieses Medium mit 10 mM HEPES, 1x B-27 Ergänzung, 400 μM L-Glutamin, 600 μM L-Alanyl-L-glutamin-Dipeptid, 60 U / mL Penicillin, 60 μg / mL Streptomycin und 6 U / mL Nystatin.
- Alle Medien bei 4 ° C für nicht länger als 2 Wochen aufbewahren.
2. Tag der Chirurgie: Tissue Acquisition
- Am Tag der Gewebeerfassung werden 50 - 100 ml 1% und 2% (Gew./Vol.%) Lösungen von Agarose mit niedriger Schmelztemperatur in Gewebeverarbeitungsmedien unter Verwendung von autoklavierter Glaswaren und steriler Technik in einer laminaren Strömungshaube hergestellt. Beide Konzentrationen von Agarose sind erforderlich, um eine unvorhersehbare Veränderung der Tumorgewebskonsistenz zu berücksichtigen.
- Die Agarose-Suspension mit einer Mikrowelle erhitzen, bis ein sanftes Kochen beobachtet wird. Legen Sie die Agarose-Lösung in ein 37 ° C Wasserbad, um in einem flüssigen Zustand bis zur Verwendung zu halten.
- Lege 1 ml Schichtkultur-Wartungsmedium in jede Vertiefung einer 6-Well-Platte auf.
- Verwenden Sie eine sterilePinzette, um leere PTFE-Kultureinsätze in jede Vertiefung zu legen. Legen Sie die Platte in einen befeuchteten, mit Wasser ummantelten Gewebekultur-Inkubator mit einer 5% CO 2 -Atmosphäre, die bei 37 ° C gehalten wird.
- Mit einer sterilen Pasteurpipette in einer laminaren Strömungshaube eine Mischung aus 95% O 2 /5% CO 2 -Gas in einen Kolben mit eiskaltem Gewebeverarbeitungsmedium für etwa 15 bis 30 min vor der Tumorgewebeerfassung einblasen. Die Verwendung von supra-sauerstoffhaltigen Medien minimiert die Hypoxie im Bulk-Gewebe während der Verarbeitung.
- Bereiten Sie markierte 50 ml konische Röhrchen vor (ausreichend für die gewünschte Anzahl einzelner zu lokalisierender Tumorbereiche), die 20 ml Aliquote von supra-oxygenierten eiskalten Verarbeitungsmedien enthält, um Gewebe zwischen dem Operationssaal und der Schneidanlage zu transportieren.
- In Verbindung mit einem Neurochirurgen präoperativ die Tumorregion zur Probenerfassung planen. Wählen Sie eine Tumorregion mit Kontrastverstärkung, wie auf der klinischen Vorstellung des Patienten gezeigtG (T1-post-Gadolinium-Magnetresonanztomographie (MRI) -Sequenzen). Die bisherige Erfahrung legt nahe, dass dieser Bereich ein lebensfähiges Tumorgewebe im Gegensatz zu nekrotischem Gewebe liefert.
HINWEIS: Die Erzeugung von Scheiben aus der umgebenden (peritumoralen) weißen Materie wurde versucht; Allerdings begrenzten die Hintergrund-Autofluoreszenz und die verminderte Tumorzelldichte den experimentellen Nutzen dieser Scheiben. - Erhalten Sie Tumorgewebe bis zum Beginn der Tumorresektion. Vermeiden Sie die Sammlung von Tumorgewebe, die einem ausgedehnten bipolaren Kauterium ausgesetzt sind, was die Lebensfähigkeit des Gewebes aufgrund von thermischen Verletzungen beeinträchtigen kann. Gewebeproben während stückchenweise Tumorresektion erworben demons Lebensfähigkeit erhöht , wenn auf dem Gewebe aus langen en bloc - Resektionen erworben verglichen. Diese Beobachtung kann sich auf das differenzielle Tumorgewebe-Deprivation des Blutflusses als Folge der chirurgischen Resektion und der verlängerten Zeit zum Erwerb beziehen.
- Falls gewünscht, markieren und lagern Tumorgewebe in getrennten konischen Rohren, um Proben zu isolierenAus verschiedenen Tumorregionen. ( Dh oberflächliches vs. tiefes Tumorgewebe). Präzise Gewebestellen können aufgezeichnet werden, wenn / wenn intraoperative chirurgische Navigation verfügbar ist.
3. Schneidekultur Vorbereitung
HINWEIS: Dieses Protokoll erfordert die Verwendung von frischem unfixiertem menschlichem Gewebe. Alle Proben werden als infektiös angenommen und sollten nach universellen Blut übertragenen Pathogenprotokollen behandelt werden. Geeignete persönliche Schutzausrüstung sollte jederzeit angezogen werden. Zangen und Skalpelle sollten vor dem Gebrauch 15 min UV-Licht ausgesetzt werden. Während des Gebrauchs sprühen die Werkzeuge mit 70% Ethanol (EtOH) intermittierend, so dass die Flüssigkeit vor dem Gebrauch verdampfen kann. Der Schneidvorgang wird halbsteril unter Verwendung einer horizontalen laminaren Strömungshaube mit gefilterter Luft durchgeführt.
- Platzieren Sie Tumorgewebestücke in einer Petrischale mit eiskalten Verarbeitungsmedien. Um das Tumorgewebe zu waschen und adhärente rote Blutkörperchen zu minimieren, unsEine Pipette, um das Medium in der Petrischale vorsichtig zu tauschen und zu verwerfen.
- Mit einem Skalpell, schneiden Tumorstücke in rechteckige Box Formen. Trimmgewebe Stücke bis ca. 3 mm x 3 mm x 10 mm. Entfernen Sie vorsichtig alle angebrachten Schiffe durch Exzision oder sanfte Traktion mit feiner Pinzette.
- 5 - 7 ml 37 ° C Agarose in eine kleine würfelförmige (~ 2 cm 3 ) Kunststoff-Einbettungsform pipettieren. Bestätigen Sie die Temperatur der Agarose-Lösung ist nicht größer als 37 ° C mit einem sterilen Thermometer vor Gebrauch.
- Lassen Sie Agarose für ca. 1 min auf einem Eisbett sitzen.
- Legen Sie 2 - 4 Tumorgewebe "Streifen" in Agarose mit langer Achse vertikal vertikal.
HINWEIS: Gewebestreifen neigen dazu, in der Agarose vor der Erstarrung "zu sinken". Um diese Komplikation zu vermeiden, halten Sie den Gewebestreifen vorübergehend in vertikaler Orientierung, bis Agarose weiter verfestigt wird. - Halten Sie das Gewebe mit Agarose-Schimmel auf einem Eisbett für 2 - 5 MeilenUm die Erstarrung zu erleichtern.
- Schimmel aus Eis entfernen und vorsichtig den Agaroseblock entfernen, indem man die Seiten des Formulars mit einem Skalpell schneidet. Vermeiden Sie eine übermäßige Kraft auf den Block, der die Agarose brechen kann.
- Verwenden Sie einen großzügigen Tropfen Cyanacrylat-Kleber, um den Agarose-Block an der Vibratom-Probenplatte zu befestigen. Leim für ca. 1 - 2 min einstellen lassen.
- Füllen Sie das Vibratom-Reservoir mit eiskalten Verarbeitungsmedien, um den an der Probenplatte befestigten Agarose-Block zu tauchen.
- Während des Schneidens blasen Sie 95% O 2 /5% CO 2 -Gasmischung in den Vibratom-Reservoir durch eine getrimmte sterile Plastikpipette.
- Die Vibrationsdicke auf 300 - 350 μm einstellen.
- Stellen Sie die Blattvorschubgeschwindigkeit und die Blattamplitude entsprechend der Gewebekonsistenz ein. "Steifer" GBM-Gewebe erfordert langsame Blättervorschubgeschwindigkeiten und höhere Amplitude. Die exakte Klinge Geschwindigkeit und Amplitude Einstellungen variieren je nach Vibratome Spezifikationen.
HINWEIS: Beim Aufschneiden ergeben sich häufig mehrere Probleme. Wenn der Gewebestreifen aus dem Agaroseblock austritt, versuchen Sie, das Gewebe in eine Agarose höherer Konzentration einzubetten. Wenn die Tumorscheiben dicker als gewünscht sind (Maschinensatz) oder asymmetrisch sind, erhöhen Sie die Amplitude und verringern die Geschwindigkeit der Vibrationsklinge. Um sicherzustellen, dass das Tumorgewebe nicht durch den Klingenhalter geklebt oder "gezogen" wird, während das Aufschneiden auftritt, positionieren Sie den Mikrospatel vorsichtig zwischen den Klingenhalter und die Scheibe, wenn sich die Klinge bewegt. - Übertragen Sie Gewebeschnitte auf Petrischale mit eiskalten Verarbeitungsmedien mit einem Edelstahl-Mikrospatel.
- Erhalten Sie 6-Well-Platten, die PTFE-Inserts und äquilibrierte Scheibenkulturmedien vom Inkubator enthalten (wie in Abschnitt 2, Schritt 4 hergestellt).
- Tellergewebe Scheiben mit einem Edelstahl Mikrospatel. Minimieren Sie den direkten Kontakt und die Manipulation des Gewebes, indem Sie einen kleinen, feinen Borstenpinsel verwenden, um eine "flüssige Welle" zu erzeugen, um die Scheibe vorsichtig aus dem Spatel zu drückenAuf den Kultureinsatz.
HINWEIS: Minimieren Sie die Menge an Verarbeitungsmedien, die auf die Oberseite des Gewebekultureinsatzes eingeführt werden. Wenn übermäßige Mengen an Medien übertragen werden, wodurch die Scheiben schweben, verwenden Sie eine sterile Pasteurpipette, um das Medium zu entfernen. - Die 6-Well-Platten, die Tumorscheiben enthalten, in einen Inkubator geben, der bei 37 ° C mit einer 5% CO 2 -Atmosphäre gehalten wird.
HINWEIS: Das gesamte Einbettungs- und Schneidprotokoll sollte innerhalb von 90 min der Tumorgewebeerfassung aus dem Operationssaal abgeschlossen sein.
4. Scheibe Kultur Wartung
- Nach 12 - 24 h, transportieren Sie die Scheibenkulturen, indem Sie jeden Einsatzrand mit einer sterilen Pinzette ergreifen und auf Platten mit frischen Scheibenkultur-Wartungsmedien übertragen. Vergewissern Sie sich, dass die in jeder Vertiefung aliquotierten Scheibenkultur-Wartungsmedien mindestens 15 Minuten vor dem Übertragen von Einsätzen im Inkubator ausgleichen.
- Bewegen Sie die Einsätze in neue 6-Well-Platten mit frischen, äquilibrierten Slice CulTure media alle 48 h.
- Wenn gewünscht, aliquot altes Scheiben Kulturmedium mit einer Pipette zur sofortigen Verwendung in biochemischen Assays ( dh ELISA) oder einfrieren bei -80 ° C für zukünftige Verwendung.
5. Tumorzellmarkierung über grünes Fluoreszenzprotein, das Retrovirus ausdrückt
ANMERKUNG: Zeitraffer-Mikroskopie zur Analyse der Tumorzellmigration erfordert eine stabile, langfristige fluoreszierende Markierung von Zellen innerhalb der Schichtkultur. Die Verwendung von Retrovirus wird vorgeschlagen, da es selektiv die Trennung von Zellen infiziert, wodurch die fluoreszierende Markierung innerhalb der Tumorzellpopulation im Gegensatz zu Mikroglia oder anderen Zelltypen, die in der Scheibe vorhanden sind, angereichert wird. Standardisierung der Infektion läßt vermuten , dass ein viraler Titer von 10 4 KBE / & mgr; l zu einer ausreichenden grün fluoreszierender Protein - Expression für die Verfolgung und Analyse der Zellmigration. Erhöhter Virustiter, Verwendung von nicht-selektivem Virus ( dh Adenovirus, Lentivirus) oder otIhre Mittel zur Etikettierung aller Zellen können die Identifizierung klarer Zellgrenzen während der Migration ausschließen und damit die Analyse komplizieren. Die Verwendung von alternativen Leuchtstoffmarkern kann nach Bedarf genutzt und optimiert werden.
- Erhalten Sie Retrovirus zur Infektion von Tumorscheiben entweder über Standardprotokolle 5 , 14 oder aus einer handelsüblichen Quelle. Verdünne den viralen Überstand durch das entsprechende Volumen in nicht - ergänztes Medium neuronal Zugabe einen Virustiter von 10 4 KBE / & mgr; l zu erreichen.
- Zwischen 7 - 10 Tagen Kultur infizieren die interessierenden Tumor-Slice-Kulturen mit 5 - 10 μl Virus (10 4 CFUs / μL). Legen Sie das Virus vorsichtig tropfenweise auf die Oberfläche jeder Gewebescheibe. Verringern Sie das überstehende Volumen, wenn die Scheibe auf der Oberfläche des Einsatzes schwimmt. Rücklaufplatten mit Scheibenkulturen zum Inkubator.
- Beurteilen Sie die Scheiben für markierte Tumorzellen ab 24 h nach Virusinfektion (siehe Abschnitt 6). Diese Zeitverzögerung variiert in Abhängigkeit von der viralen Einarbeitung und der Fluoreszenzgenexpressionskinetik. Für die hier verwendeten viralen Konstrukte war 72 h erforderlich, um ein robustes Fluoreszenzsignal mit einem Standard-Epifluoreszenzmikroskop zu beobachten.
HINWEIS: Selten zeigt Slices eine überwiegend periphere Verteilung von viral markierten Zellen, die die konfokale Bildgebung komplizieren können. Um diese Komplikation zu vermeiden, versuchen Sie, die Schichtdicke und die Dickenvariation über die Scheibe zu reduzieren. Wenn die Scheibenkultur eine dickere Region nahe dem Zentrum hat, kann dies eine ausreichende Nährstoffpenetration verhindern, wodurch die Population der aktiv teilenden Tumorzellen begrenzt wird. Ein qualitativer Assay zum Screening auf diese Komplikation ist die Zugabe eines Tetrazoliumfarbstoffreagens ( dh MTT) zu dem Schichtkulturmedium. Bereiche der Scheibe, die nicht blau nach dem Hinzufügen der Reagenz zeigen, zeigen einen Mangel an metabolischen Aktivität und kompromittiert Scheibe Gesundheit.
ANMERKUNG: Nach erfolgreicher Transduktion und Gesundheit der Kultur wird bestätigt, dass Zellen unter Kontrollbedingungen abgebildet werden können, gefolgt von einer gleichzeitigen Bildgebung unter Behandlungsbedingungen. Unter Verwendung dieses Protokolls wurden die Zellen in jeder Bedingung für 12 Stunden erfolgreich abgebildet und verfolgt. Allerdings können auch kürzere oder längere Bild- und Umweltmanipulationen informativ sein.
- Laden des Mikroskops
- Vor der Bildgebung 1 ml frische Scheibenmedien in eine Glasbodenschale geben.
- Lassen Sie das Medium in der Glasbodenschale ein, um sich 15 min in einem Inkubator auszurotten.
HINWEIS: Zu diesem Zeitpunkt können lösliche Markierungsmittel, wie z. B. fluoreszenzkonjugierte Lektine ( dh Isolectin IB 4 für Mikroglia-Markierung) oder Liganden-konjugierte Quantenpunkte, zu den Schichtkulturmedien zur Identifizierung der Zelle hinzugefügt werdenBei der Bildgebung. - Übertragen Sie den Einsatz auf eine Glasbodenschale mit steriler Pinzette in einer laminaren Strömungshaube. Transportieren Sie die Schale zum Mikroskopstadium.
- Pflegen Sie Scheibenkulturen bei 37 ° C und 5% CO 2 -Atmosphäre in einem versiegelten Mikroskop-Bühnen-Inkubator. Verwenden Sie die sterile H 2 O-Befeuchtung der Inkubationskammer, falls vorhanden, um eine übermäßige Medienverdampfung zu vermeiden (besonders wichtig für längere Bildgebungsexperimente).
- Verwenden Sie ein konfokales Mikroskop mit einem langen Arbeitsabstand 10X Luftziel und Laseranregung für Einzelphotonen und / oder Multiphotonen.
HINWEIS: Stellen Sie sicher, dass das Objektiv des Mikroskops einen ausreichenden Arbeitsabstand bietet. Als Ergebnis der zusätzlichen Höhe aus dem Bühnen-Top-Inkubator, Glasbodenschale und Gewebekultureinsatz sind lange Arbeitsentfernungsziele kritisch. - Sichern Sie die Glasbodenplatte, entfernen Sie die Plastik-Petrischalenabdeckung und bedecken Sie sie mit einem Gas-Durchlässige Membran.
- Bildaufnahme
- Verwenden Sie das Mikroskop, um die Scheibe visuell zu untersuchen und ein geeignetes Feld mit einer ausreichenden Dichte von fluoreszenzmarkierten Tumorzellen zwischen der Scheibenkante und dem Zentrum zu lokalisieren. Vermeiden Sie Bildgebungsfelder am Rand der Scheibe, aufgrund der erhöhten Anfälligkeit von Gewebeverschiebungen während der Bildgebung. Zur Verringerung dieser Verschiebung können Gewebe-Scheiben-Harfen eingesetzt werden.
- Verwenden Sie Imaging-Software im multidimensionalen Analysemodus, um die ersten (unteren) und letzten (oberen) Z-Stack-Grenzen zu setzen, so dass alle zu erfassenden Positionen sichtbares fluoreszierendes zelluläres Signal enthalten. Die Bildgebung über 150 - 200 μm der Scheibe mit einem konstanten Z-Schritt von 10 μm lieferte eine adäquate Auflösung für die Verfolgung von Zellpfaden (dies kann für individuelle Bildgebungsbedürfnisse angepasst werden).
- Wenn das Mikroskop eine motorisierte Bühne hat, ist für jede Z-Stack-Erfassung eine ausreichende Zeit zugänglich. Legen Sie das Zeitintervall zwischen den Akquisitionen gleich einScan-Zeit pro Position x Anzahl der Positionen zum Bild ( dh abgebildete Tumorbereiche).
HINWEIS: Zur gleichzeitigen Erregung der grünen und roten Fluorophore wird ein zweizeiliges Laserlinien-Scan-Programm mit gleichzeitiger 488 nm und 633 nm Anregung verwendet. Die gewählte Wellenlänge der Laseranregung variiert je nach den ausgeprägten einzelnen fluoreszierenden Proteinen. - Halten Sie einheitliche Laserleistung und konfokale Pinhole-Einstellungen zwischen den abgebildeten Tumorregionen ein. Nutzen Sie die niedrigste Laserleistungseinstellung, die erforderlich ist, um die Tumorzellenkörper und Prozesse klar zu begrenzen, um die Phototoxizität zu begrenzen. Spezifische bildgebende Parametereinheiten ( dh Leistung und konfokale Pinhole-Einstellungen) variieren je nach Mikroskop- und Laserquellenspezifikation.
- Kompensieren Sie für potenzielle Medien Verdunstung durch Hinzufügen von 2 - 3 "Puffer" Z-Stack-Schritte in den Fokus Ebenen Fortschritte auf das Ziel. Dies verhindert effektiv, dass das Gewebe den Bereich der Z-Stack-Erfassung verlässtIonen in der vertikalen Ebene.
7. Bildnachverarbeitung und Tumorzellverfolgung
HINWEIS: Viele konfokale Bildgebungssysteme sind mit proprietärer Bildverarbeitungssoftware ausgestattet. Die nachfolgend erläuterten Verarbeitungsschritte umfassen ein allgemeines Protokoll, das über Softwareplattformen durchgeführt werden kann. Für die Open-Source-Plattformen, NIH ImageJ und MTrackJ 15, werden spezifische Anweisungen gegeben.
- Öffnen Sie eine Z-Stack-Datei. Klicken Sie in ImageJ auf "Bild → Stapel → Z-Projekt". Wählen Sie den ersten und letzten Z-Stack aus und wählen Sie "Max Intensity" als Projektionstyp. Das Ergebnis ist ein Rendering namens Maximum Intensity Projektion (MIP). Erstellen Sie ein MIP aus jedem Satz von Z-Stack-Bildern, die in jeder Region abgebildet sind.
- Verknüpfen Sie die MIPs aus jeder Region, um eine Zeitreihe zu erstellen. Klicken Sie auf "Bild → Stapel → Bilder zum Stapeln".
- Manuell den Standort identifizierenDes Zellkörpers "Schwerpunkt" durch Auswahl des visuell angenäherten Mittelpunktes des Tumorzellkörpers. Dies geschieht durch Anklicken des Zellenkörpers mit der "Add" -Spurfunktionalität von MTrackJ (ein Open-Source-Plugin für NIH ImageJ).
- Klicken Sie hier, um die Zellenkörperposition in jedem Rahmen der Bildserie abzugrenzen. Dies schafft für jede Zelle einen einzigartigen "Track". Sequenziell markieren Sie die Zellenkörperplätze der nächsten Zelle. Wiederholen Sie diesen Vorgang, bis alle Zellmigrationswege verfolgt werden.
- Sobald eine Population von Zellen in einer gegebenen Tumor-Mikroregion verfolgt wird, exportieren Sie alle Zellspurkoordinaten mit der "Maß" -Funktion von MTrackJ. Speichern Sie die Datei als .xls-Format, damit die Rohdaten mit Hilfe von Tabellenkalkulationen oder benutzergenerierten Software analysiert werden können.
- Verwenden Sie die Koordinaten, die für jeden Punkt entlang einer Zelle Migrationsspur aufgezeichnet wurden, um quantitative Analysen einschließlich Ableitung von Migrationsgeschwindigkeit, Direktionalität und andere Migration durchzuführenMetriken, wie 16 in Parker et al.
HINWEIS: Alle berechneten Entfernungen und Geschwindigkeiten sind Unterschätzungen der Istwerte. Dies ist bei der Umwandlung von dreidimensionalen Bildern (und Migrationswegen) zu zweidimensionalen Daten durch Erzeugung von maximalen Intensitätsprojektionen inhärent.
Ergebnisse
Unsere Gruppe hat erfolgreich Schnittkulturen von über 50 Patienten, die sich einer ersten GBM-Resektion unterziehen, erfolgreich produziert. Dieses Scheibenerzeugungs-, Kultur-, Retroviral-Labeling-, Imaging- und Migrationsanalyse-Protokoll wurde in einen reproduzierbaren Workflow gestrafft ( Abbildung 1 ). Kritisch zeigen diese organotypischen GBM-Scheiben die Übereinstimmung mit dem Ursprung des Tumorgewebes während der Kultur, einschließlich der Erhaltung von pathologischen Kennzeichen und Mikroglia bis zu 15 Tage in Kultur ( Abbildung 2 ). Darüber hinaus haben wir dieses System verwendet, um funktionelle Assays der Tumorreaktion auf mikroumweltliche Veränderungen durchzuführen. Als Metrik der physiologischen Integrität untersuchten wir, wie die GBM-Slice-Kulturen auf Hypoxie (1% O 2 ) reagierten, indem sie die Produktion des vaskulären endothelialen Wachstumsfaktors (VEGF) messen, ein Prozess, der in der GBM-Mikroumgebung in vivo 17 reichlich auftritt ,"> 18. Wir haben gezeigt, dass die Scheiben, indem sie die Scheibenkulturen in hypoxische Zustände platzierten, eine schnelle physiologische Antwort aufgaben, die die VEGF-Freisetzung in das Medium induzierte ( Abbildung 3 ).
Um qualitative und quantitative Aspekte der Tumorzellmigration zu bewerten, nutzten wir die Zeitrafferbilder, um detaillierte Migrationskarten zu generieren. Diese Karten definieren alle GBM-Zellen, die innerhalb der Grenzen von Tumor-Mikroregionen (1 mm 2 ) verfolgt werden, was eine statische Visualisierung des dynamischen Migrationsverhaltens der Tumorpopulation ermöglicht. Für jede Zelle wurden quantitative Messungen der Migrationsgeschwindigkeit und -richtung (Zellverdrängung / Gesamtstrecke) berechnet, was die Untersuchung von Veränderungen der Migrationsparameter über Tumorregionen, Tumorproben und als Reaktion auf die Behandlung ermöglicht ( Abbildung 4 ).
Das Zell-Etikettier- und Imaging-Protokoll desHier ist auch eine genaue räumliche und zeitliche Auflösung verfügbar, um Veränderungen in der Zellmorphologie während der Migration durch die native Tumor-Mikroumgebung zu bewerten. Wir beobachteten die Anwesenheit von morphologisch getrennten beweglichen Tumorzellen und mikroglialen Vermischungen innerhalb der Scheibenkultur ( Abbildung 5A ). Die Tumorzellbewegung wurde durch einen "Such- und Burst" -Prozess charakterisiert, der wiederholte Protrusion und Retraktion von Filopodien aus einer statischen Zelle beinhaltete, gefolgt von einer kurzen Zeit der effizienten Bewegung. Imaging-Slice-Bereiche etwa alle 10 min lieferten auch eine adäquate zeitliche Auflösung, um Zeitrafferbilder von Tumorzellen aufzuzeichnen, die sich einer Zellteilung unterziehen. Diese teilenden Zellen hielten vor Migration, abgeschlossener Mitose, und die Tochterzellen veranlassten die Migration unverzüglich, alle innerhalb eines 3-Stunden-Zeitrahmens ( Abbildung 5D ). Im Gegensatz dazu wandert die Mikroglia mit einer höheren und gleichmäßigeren Geschwindigkeit mit geringerer Richtcharakteristik als benachbarte Tumorzellen,Demonstriert ihre relativ ineffiziente Migration ( Abbildung 5C, 5E-G ). Solche Beobachtungen können wichtig sein, um Einblick in die Biologie zu erhalten, die Patienten- oder zellspezifischen Reaktionen auf die Behandlung zugrunde liegt.
Schließlich nutzten wir dieses Protokoll, um die Patienten-zu-Patienten-Variabilität in Zellmigrationsparametern auf Populationsniveau zu demonstrieren, einschließlich einer Korrelation der genomischen Ampulgierung des epidermalen Wachstumsfaktor-Rezeptors ( EGFR ) mit erhöhtem Migrationspotential von Tumorzellen 16 . Darüber hinaus zeigte die Zeitraffer-Mikroskopie von Tumorscheiben vor und nach der Behandlung mit dem antiinvasiven Arzneimittel Gefitinib eine signifikante Reduktion der Migration, die spezifisch für EGFR- amplifizierte Tumorscheiben 16 war .
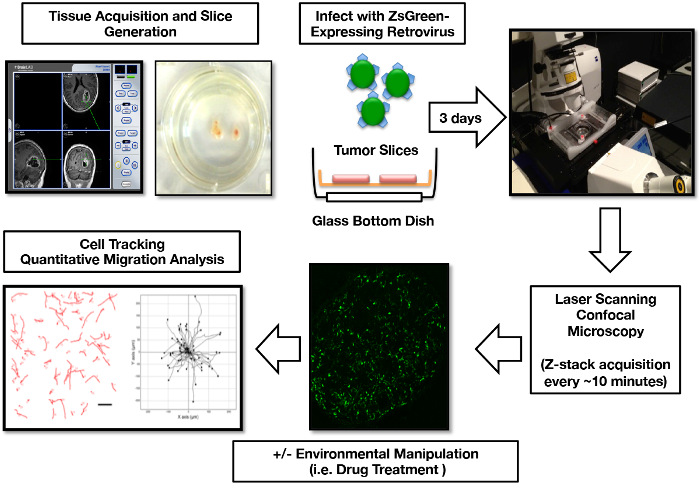
Abbildung 1: Menschliche GBM Organotypische Scheibe Kultur Infektion, Imaging und Zell Migration Analyse Workflow. Tumorgewebe ist über eine intraoperative Navigationsausrüstung zu einer bestimmten Region lokalisiert. Eine Woche nach dem Aufschneiden wird das ZsGreen, das Retrovirus exprimiert, zu den Scheibenkulturen hinzugefügt, um die mitotisch aktiven Tumorzellen zu markieren. 3 Tage nach der Infektion werden die Scheiben für die konfokale Bildgebung vorbereitet. Die 3D-Bildgebungsdaten werden nachträglich in 2D-Bilder für die Zellmigrationspfadverfolgung, die Erzeugung von Tumorzellmigrationskarten und die Berechnung der Tumorzellmigrationsparameter verarbeitet. Teile dieser Figur wurden ursprünglich in Parker et al. , 2013 16 veröffentlicht und mit Genehmigung der Oxford University Press reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Menschliche GBM Organotypische Scheiben behalten histologische Merkmale während der Ex-Vivo- Kultur bei. ( A ) T1-kontrastverstärkte MRI-Sequenzen wurden verwendet, um die Region (en) der Gewebeerfassung (Pfeil) zu lokalisieren und zu dokumentieren. ( B ) H & E-Färbung des anfänglichen Spendergewebes (OR) und der Scheiben am Tag 8 der Kultur aus einer aus Kultur gewonnenen Gewebekultur, die aus der in A. hervorgehobenen Region gewonnen wurde. ( C ) Mikroumwelt-pathologische und zelluläre Merkmale von GBM in vivo werden beibehalten Ganze Schichtkultur. (I, II) Immunhistochemie für CD68, ein Mikroglia / Makrophagen-Marker, bei niedriger (oberer) und hoher (unterer) Vergrößerung, zeigt die Mikroglia-Persistenz in Scheiben nach 15 Tagen Kultur. H & E-Färbung am Tag 4 der Schichtkultur bestätigt die Aufrechterhaltung der Pseudopallisierungsnekrose, ein PathoLogikzeichen von GBM, sowohl bei niedriger (iii) als auch bei hoher (iv) Vergrößerung. Maßstäbe = 200 μm Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3: Menschliche GBM-Scheibenkulturen sekretieren VEGF in Reaktion auf Hypoxie. ( A ) Das Experiment verwendete einzelne Kultureinsätze, die 3 ähnlich große Tumorscheiben enthielten, die aus der gleichen Tumorregion erzeugt wurden. Die Scheiben wurden in der Normoxie für 12 h gehalten, gefolgt von zwei 12-h-Intervallen der Hypoxie, wobei neue Medien vor jedem Intervall hinzugefügt wurden. ( B ) Die VEGF-Sekretion in das durch ELISA gemessene Medium (Mittelwert ± Standardabweichung) aus aus zwei repräsentativen Tumoren erzeugten Scheibenkulturen wurde deutlich erhöhtDer Hypoxie als Normoxie (p <0,05). ( C ) Eine gepoolte Analyse von Scheibenkulturen aus 4 verschiedenen Tumoren zeigte eine erhöhte VEGF-Sekretion nach sequenziellen 12-h-Intervallen der Hypoxie im Vergleich zur Normoxie (p <0,05). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 4: Tumor-Zellpfad-Spurdaten ermöglicht eine quantitative Bestimmung der Zellgeschwindigkeit und -richtung. (A) Tumorzellen mit einer Gerichtetheit von 1 repräsentieren perfekte Effizienz entlang einer geraden Vektor, wohingegen diejenigen mit niedrigerer Direktionalität in ineffizienten Mäanderbahnen eingreifen, wie in diesen schematischen 16 dargestellt. Nachdruck mit Genehmigung der Universität OxfordDrücken Sie. ( B ) Die Analyse der repräsentativen Pfadspurdaten ("niedrige" Auflösung ~ 55 min Zellverfolgungsintervalle) zeigt die zelluläre Variabilität in Geschwindigkeit und Richtcharakteristik. ( C ) Direktionalität gegenüber Migrationsgeschwindigkeit für jede Zellspur ist aufgetragen, um das Migrationsverhalten über die Zellpopulation zu visualisieren (jeder Punkt repräsentiert eine einzelne Zelle). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5: Microglia innerhalb von GBM Slice Cultures zeichnen sich durch hohe Migrationsgeschwindigkeit und niedrige Direktionalität gegenüber Tumorzellen aus. ( A ) Replizieren von Tumorzellen, die selektiv ZsGreen Retrovirus exprimieren und Mikroglia mit einem Isolectin-I markiert sind B 4 -647-Konjugat existieren in einer repräsentativen Tumor-Mikroregion aus einer repräsentativen Schichtkultur vermischt. ( BC ) Die Wege von einzeln verfolgtem GBM ( B ) und Mikroglia ( C ) in der gleichen Tumor-Mikroregion zeigen diskordante Migrationsverhalten. Maßstäbe = 200 μm ( D ) Eine aktiv wandernde Tumorzelle pausiert, zieht ihre Prozesse zurück (Pfeilspitze), unterzieht sich einer Zellteilung und zwei Tochterzellen wandern in entgegengesetzten Richtungen (Pfeile) weg. Maßstäbe = 50 μm. ( E und F ) Microglia zeigt eine erhöhte Migrationsgeschwindigkeit (p <0,0001) und eine verminderte Richtcharakteristik (p <0,0001) im Vergleich zu Tumorzellen in der gleichen Region. (G) Die Verteilung von Tumor- und Mikrogliazellen auf der Grundlage von Geschwindigkeit und Richtcharakteristik zeigt die einzigartigen wandernden Phänotypen der beiden Zellpopulationen.Et = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Organotypische Scheibenkulturen aus menschlichem Krebsgewebe bieten eine attraktive und nicht genutzte Plattform für präklinische Translationsversuche. Das Verständnis von Populationsniveaus von Tumorzellen in Bezug auf Migration, Proliferation und Zelltod in der nativen Tumormikroumgebung fehlt. Kritisch kann das Studium der Tumorreaktion auf die Therapie in einer dynamischen, zeitaufgelösten Weise auf der Ebene des Zellverhaltens Licht auf neue Mechanismen der Behandlungsresistenz werfen. Menschliche Tumorscheibenkulturen stellen eine Verbindung zwischen dem menschlichen Krankheitsprozeß und den gegenwärtigen ex vivo und in vivo Modellierungstechniken dar 19 . Wir haben vor kurzem die hier beschriebene Technik als Methode zur Untersuchung der GBM-Migration validiert und zum ersten Mal messbare intertumorale Variationen des Zellmigrationsverhaltens im Zusammenhang mit der EGFR-Amplifikation und Signalisierung 16 berichtet . Diese Studie nutzte auch das Scheibenkulturmodell, um die Patie zu testenNt-spezifische Wirksamkeit des EGFR-Inhibitors, gefitinib, als potenzielle anti-invasive Therapie für GBM 16 .
Mehrere der häufigen Fallstricke während des Gewebsschneidens, des retroviralen Infektions-, Bildgebungs- und Bildanalyse-Paradigmas wurden oben diskutiert. Das retrovirale Infektionsprotokoll rechtfertigt jedoch weitere Aufmerksamkeit. Bei Patienten-zu-Patienten-Variation kann es sich als schwierig erweisen, die Dichte von viral markierten Tumorzellen innerhalb jeder Scheibe zu titrieren. Wenn unzureichende Anzahl von Zellen durch das virale Konstrukt markiert ist, fügen Sie zusätzliche 5-10 & mgr; l Aliquote des retroviralen Überstandes zu der Oberfläche jeder Schicht täglich hinzu, bis die gewünschte Konzentration an markierten Tumorzellen erreicht ist. In primären Scheibenkulturen ist der Prozentsatz der replizierenden Zellen im Allgemeinen niedriger als in transformierten Zelllinien, wodurch die Untermenge von Zellen, die zu einem retroviralen Einbau zu irgendeinem Zeitpunkt zulässig sind, begrenzt wird. Alternativ, wenn zu viele Zellen markiert sind,Harndrangabgrenzung von Zellmigrationswegen, Verdünnen des Virusüberstandes mit neuronalen Medien, um einen niedrigeren wirksamen Titer zu erreichen. Tumor-assoziierte Mikroglia enthielt das fluoreszierende Protein, das Retrovirus exprimiert, bei einer Frequenz von etwa 1% aller markierten Zellen. Wir konnten diese Zellen für die getrennte Analyse durch die Verwendung eines Mikroglia-bindenden Lektins für post-imaging-Datenanalysen visuell isolieren ( Abbildung 5 ).
Die Tumor-Mikroumgebung einschließlich Aspekte der Nährstoffversorgung, Zell-Zell-Interaktionen und extrazelluläre Matrix spielen bei der Pathogenese von GBM 20 eine Rolle. Direkte menschliche GBM-Slice-Kulturen eliminieren die Notwendigkeit für die Passage in kleinen Tiermodellen oder verbreiteten Zellkultur, während eine enge Rekapitulation der menschlichen Tumor-Mikroumgebung. Weiterhin bieten Scheibenkulturen einen gleichmäßigen Zugang zu Nährstoffen über Proben hinweg, während Zell-Zell- und Zell-ECM-Wechselwirkungen aufrechterhalten werden. Durch reduzierende varIonen im zellulären Zugang zu Nährstoffen, von denen bekannt ist, dass sie innerhalb von Tumoren auftreten, schlagen wir beobachtete Unterschiede in den Kulturen vor, die auf intrinsische Unterschiede zwischen Tumorzellverhalten ( dh Migration) auf Populationsniveau aufmerksam machen. Die Interpretation von Daten, die über die von menschlichen Tumoren erzeugten Schichtkulturen gesammelt wurden, wird jedoch durch inhärente inter- und intra-tumorale Heterogenität kompliziert. Kritisch ist eine weitere Studie erforderlich, um die potenziellen genetischen und epigenetischen Verschiebungen zu charakterisieren, die während der Ex-vivo- Erhaltung von menschlichen Tumor-Slice-Kulturen auftreten können.
Die Verwendung von menschlichen Tumor-Slice-Kulturen parallel zu Phase I / II klinischen Studien ist eine vielversprechende Strategie, um Scheibenparameter mit Patienten klinischen Ergebnissen zu korrelieren. Die Validierung dieser potenziellen prädiktiven / prognostischen Parameter ist notwendig, bevor Schichtkulturen verwendet werden können, um onkologische Therapie zu personalisieren. Unsere Arbeit, sowie die von anderen, zeigt die Machbarkeit der Biomarker-Validierung 21, sowie eine schnelle ex vivo-Untersuchung von therapeutischen Mitteln in Scheibenkulturen aus GBM 9 , 16 . Ähnliche menschliche Scheibe Kultur Techniken mit Lunge 22 , Dickdarm 22 , Kopf und Hals 23 , Brust 24 und Prostatakrebs 25 Gewebe deuten darauf hin, dass dieser Ansatz ist verallgemeinbar über menschliche Krebsarten.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken Dr. Lee Niswander und Dr. Rada Massarwa für ihre technische Expertise und Beiträge zu dem hier beschriebenen Slice Culture Confocal Imaging Protokoll. Weiterhin dank Dr. Kalen Dionne, der Fachwissen zur Optimierung von Hirntumor-Gewebe-Schneid- und Kulturparametern lieferte.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM High Glucose | Invitrogen (Gibco) | 11960-044 | |
| Neurobasal-A Medium, minus phenol red | Invitrogen (Gibco) | 12349-015 | |
| B-27 Supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Penicillin-Streptomycin (10,000 U/mL) | Invitrogen (Gibco) | 15140-122 | |
| GlutaMAX Supplement | Invitrogen (Gibco) | 35050-061 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| HEPES (1 M) | Invitrogen (Gibco) | 15630-080 | |
| Nystatin Suspension | Sigma-Aldrich | N1638-20ML | 10,000 unit/mL in DPBS, aseptically processed, BioReagent, suitable for cell culture |
| UltraPure Low Melting Point Agarose | Invitrogen (Gibco) | 16520-050 | Melts at 65.5 °C, Remains fluid at 37 °C, and sets rapidly below 25 °C. |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 Conjugate | Thermo Fisher (Molecular Probes) | I32450 | Used in media to label Microglia/Macrophages |
| pRetroX-IRES-ZsGreen1 Vector | Clonetech | 632520 | |
| Retro-X Concentrator | Clonetech | 31455 | Binding resin for non-ultracentrifugation concentration of viral supernatants |
| pVSG-G Vector | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| GP2-293 Viral packaging cells | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| Cyanoacrylate Glue (Super Glue) | Sigma-Aldrich | Z105899 | Medium-viscosity |
| Equipment | |||
| Peel-A-Way Embedding Mold (Square - S22) | Polysciences, Inc. | 18646A-1 | Molds for tumor sample embedding |
| Stainless Steel Micro Spatulas | Fisher Scientific | S50823 | Bend instrument 45 degrees at the neck of the spoon blade |
| Curved Fisherbrand Dissecting Fine-Pointed Forceps | Fisher Scientific | 08-875 | |
| Single Edge Razor Blade (American Safety Razors) | Fisher Scientific | 17-989-001 | Blade edge is 0.009" thick. Crimped blunt-edge cover is removed before loading onto vibratome. |
| Leica VT1000 S Vibratome | Leica Biosystems | VT1000 S | |
| Hydrophilic PTFE cell culture insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm pore size |
| 35 mm Glass Bottom Dishes | MatTek | P35G-1.5-20-C Sleeve | 20 mm glass diameter. Coverslip glass thickness 1.5 mm |
| LSM 510 Confocal Micoscope | Zeiss | LSM 510 | 10x Air Objective (c-Apochromat NA 0.45) |
| PECON Stagetop Incubator | PeCON Germany | (Discontinued) | Incubator PM 2000 RBT is a comprable product designed for use with Zeiss Microscopes. |
Referenzen
- Beadle, C., et al. The role of myosin II in glioma invasion of the brain. Mol Biol Cell. 19, 3357-3368 (2008).
- Farin, A., et al. Transplanted glioma cells migrate and proliferate on host brain vasculature: a dynamic analysis. Glia. 53, 799-808 (2006).
- Panopoulos, A., Howell, M., Fotedar, R., Margolis, R. L. Glioblastoma motility occurs in the absence of actin polymer. Mol Biol Cell. 22, 2212-2220 (2011).
- Ivkovic, S., et al. Direct inhibition of myosin II effectively blocks glioma invasion in the presence of multiple motogens. Mol Biol Cell. 23, 533-542 (2012).
- Assanah, M., et al. Glial progenitors in adult white matter are driven to form malignant gliomas by platelet-derived growth factor-expressing retroviruses. J Neurosci. 26, 6781-6790 (2006).
- Chaichana, K. L., et al. Preservation of glial cytoarchitecture from ex vivo human tumor and non-tumor cerebral cortical explants: A human model to study neurological diseases. J Neurosci Methods. 164, 261-270 (2007).
- Grube, S., et al. Overexpression of fatty acid synthase in human gliomas correlates with the WHO tumor grade and inhibition with Orlistat reduces cell viability and triggers apoptosis. J Neurooncol. 118, 277-287 (2014).
- Hovinga, K. E., et al. Inhibition of notch signaling in glioblastoma targets cancer stem cells via an endothelial cell intermediate. Stem Cells. 28, 1019-1029 (2010).
- Merz, F., et al. Organotypic slice cultures of human glioblastoma reveal different susceptibilities to treatments. Neurooncol. 15, 670-681 (2013).
- Xu, J., et al. Vorinostat modulates cell cycle regulatory proteins in glioma cells and human glioma slice cultures. J Neurooncol. 105, 241-251 (2011).
- Verhaak, R. G., et al. Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities. in PDGFRA, IDH1, EGFR, and NF1. Cancer cell. 17, 98-110 (2010).
- Gill, B. J., et al. MRI-localized biopsies reveal subtype-specific differences in molecular and cellular composition at the margins of glioblastoma. Proc Natl Acad Sci USA. 111, 12550-12555 (2014).
- Snuderl, M., et al. Mosaic amplification of multiple receptor tyrosine kinase genes in glioblastoma. Cancer cell. 20, 810-817 (2011).
- Kakita, A., Goldman, J. E. Patterns and dynamics of SVZ cell migration in the postnatal forebrain: monitoring living progenitors in slice preparations. Neuron. 23, 461-472 (1999).
- Meijering, E., Dzyubachyk, O., Smal, I., van Cappellen, W. A. Tracking in cell and developmental biology. Sem Cell Dev Biol. 20, 894-902 (2009).
- Parker, J. J., et al. Gefitinib selectively inhibits tumor cell migration in EGFR-amplified human glioblastoma. Neurooncol. 15, 1048-1057 (2013).
- Brat, D. J., et al. Pseudopalisades in glioblastoma are hypoxic, express extracellular matrix proteases, and are formed by an actively migrating cell population. Cancer Res. 64, 920-927 (2004).
- Shweiki, D., Itin, A., Soffer, D., Keshet, E. Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis. Nature. 359, 843-845 (1992).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15, 647-664 (2014).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. 60, 502-514 (2012).
- Di Cristofori, A., et al. The vacuolar H+ ATPase is a novel therapeutic target for glioblastoma. Oncotarget. 6, 17514-17513 (2015).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proc Natl Acad Sci USA. , 8352-8356 (2010).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. Br J Cancer. 110, 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. J Clin Pathol. 66, 253-255 (2013).
- Maund, S. L., Nolley, R., Peehl, D. M. Optimization and comprehensive characterization of a faithful tissue culture model of the benign and malignant human prostate. Lab Invest. 94, 208-221 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten