Method Article
Un modèle de culture de coupe organotypique du glioblastome humain pour l'étude de la migration des cellules tumorales et des effets spécifiques des patients contre les médicaments anti-invasifs
Dans cet article
Résumé
Les modèles existants ex vivo de glioblastome (GBM) ne sont pas optimisés pour une étude physiologiquement pertinente de l'invasion de tumeur humaine. Ici, nous présentons un protocole pour la génération et la maintenance de cultures de tranches organotypiques à partir de tissu GBM humain frais. Une description de la microscopie temporelle et des techniques quantitatives d'analyse de la migration cellulaire est fournie.
Résumé
Le glioblastome (GBM) continue de présenter un pronostic clinique extrêmement médiocre malgré une intervention chirurgicale, chimiothérapeutique et radiothérapeutique. L'invasion tumorale progressive dans le parenchyme du cerveau environnant représente un défi thérapeutique durable. Pour développer des thérapies anti-migration pour GBM, les systèmes modèles qui fournissent un fond physiologiquement pertinent pour une expérimentation contrôlée sont essentiels. Ici, nous présentons un protocole pour générer des cultures en coupe à partir de tissu GBM humain obtenu lors d'une résection chirurgicale. Ces cultures permettent une expérimentation ex vivo sans passage à travers des xénogreffes animales ou des cultures cellulaires simples. En outre, nous décrivons l'utilisation de la microscopie confocale à balayage laser à temps partiel en conjonction avec le suivi des cellules pour étudier quantitativement le comportement migratoire des cellules tumorales et la réponse associée à la thérapeutique. Les tranches sont reproduites de manière reproductible dans les 90 minutes suivant l'acquisition de tissus chirurgicaux. Cellule fluorescente à médiation rétroviraleL'imagerie confocale et les analyses de migration des cellules tumorales sont complétées dans les deux semaines suivant la culture. Nous avons réussi à utiliser ces cultures en tranche pour découvrir des facteurs génétiques associés à un comportement migratoire accru dans le GBM humain. En outre, nous avons validé la capacité du modèle à détecter les variations spécifiques du patient en réponse aux traitements anti-migration. En avançant, les cultures de tranche GBM humaine sont une plate-forme attrayante pour une évaluation rapide et ex vivo de la sensibilité tumorale aux agents thérapeutiques, afin de favoriser une thérapie neuro-oncologique personnalisée.
Introduction
L'étude en laboratoire du glioblastome (GBM) est entravée par un manque de modèles qui récapitulent fidèlement les caractéristiques pathologiques requises de la maladie humaine, à savoir la migration des cellules tumorales et l'invasion. Les études comparatives des essais d'invasion in vitro 2D et 3D ainsi que des modèles de culture en tranche de rongeurs 3D ont révélé des programmes de migration cellulaire variés mécaniquement dans ces deux contextes, limitant potentiellement la traduction des résultats des systèmes 2D à la maladie humaine 1 , 2 , 3 . La culture de la tranche tumorale organotypique et le paradigme d'imagerie décrit ici permettent l'étude de la migration des cellules tumorales dans des tranches de tissu tumoral humain ex vivo obtenu à partir d'une résection chirurgicale. Ainsi, les cultures en tranche de tissu tumoral réséqué chirurgicalment en conjonction avec une microscopie confocale temporelle fournissent une plate-forme pour étudier la migration de cellules tumorales chez le natifMicroenvironnement sans dissolution tissulaire ou passage à la culture.
Il existe une littérature approfondie employant des modèles de culture de tranche de cerveau de rongeurs de GBM générés à partir de xénogreffes de tumeur humaine, de tumeurs induites par des retrovirus et de superpositions cellulaires pour étudier l'invasion tumorale 1 , 2 , 3 , 4 , 5 . Récemment, plusieurs groupes ont décrit la génération de cultures de tranches organotypiques directement à partir de tissu GBM humain 6 , 7 , 8 , 9 , 10 . Cependant, il existe une variation marquée entre les protocoles publiés en ce qui concerne la technique de découpe et les médias de culture. En outre, l'utilisation de cultures de tranches organotypiques s'est concentrée sur des paramètres expérimentaux statiques qui ont inclus des changements dans les signaux cellulairesNg, la prolifération et la mort. Le protocole décrit ici se développe sur des paradigmes antérieurs de culture en tranche en incorporant une observation résolue dans le temps des comportements dynamiques de cellules tumorales par microscopie confocale à balayage laser. La découverte récente de la variation génétique intra 11 et intratumorale 12 , 13 dans le GBM humain souligne l'importance de lier cette hétérogénéité aux comportements des cellules tumorales et ses implications sur la réponse tumorale au traitement. Ici, nous rapportons un protocole simplifié et reproductible pour l'utilisation de cultures en coupe directe à partir d'un tissu cancéreux humain pour visualiser la migration des cellules tumorales en temps quasi réel.
Protocole
Avant que la collecte des échantillons de tissus de patients ne soit initiée, il faut obtenir un consentement éclairé de chaque patient en vertu d'un protocole approuvé de la Commission de révision institutionnelle (IRB). Les auteurs de ce protocole ont reçu le consentement pour le travail décrit dans les protocoles IRB approuvés à l'Hôpital de l'Université de Colorado et à l'hôpital Inova Fairfax. Les données recueillies à partir de ces cultures en coupe n'ont pas été utilisées pour diriger les décisions en matière de soins aux patients.
1. Préparation au pré-découpage
- Préparer les médias de "traitement des tissus" et les supports de "maintenance de la culture en tranche" avant la résection tumorale et la collecte des tissus (ou utiliser les médias générés précédemment dans les 2 semaines). Ajouter 5 mL de solution de pénicilline-streptomycine (10 000 U / mL) et 5 mL d'HEPES 1 M à 500 mL d'un DMEM à haut glucose pour générer le milieu de traitement des tissus.
- Préparer 250 ml de milieu de conservation de culture en tranche en utilisant une base de milieu neuronal ( p . Ex . , Neurobasal) witHout phénol rouge. Complétez ce milieu avec de l'HEPES 10 mM, un supplément de 1x B-27, une L-glutamine à 400 uM, un dipeptide L-alanyl-L-glutamine 600 μM, une pénicilline 60 U / mL, une streptomycine à 60 μg / mL et une nystatine à 6 U / mL.
- Conservez tous les médias à 4 ° C pendant plus de 2 semaines.
2. Journée de chirurgie: acquisition de tissus
- Le jour de l'acquisition des tissus, prépare 50 à 100 ml de solutions à 1% et 2% (% en poids / volume) d'agarose à basse température de fusion dans des milieux de traitement des tissus à l'aide d'une verrerie autoclavée et d'une technique stérile dans une hotte à flux laminaire. Les deux concentrations d'agarose sont nécessaires pour tenir compte de la variation imprévisible de la consistance du tissu tumoral.
- Chauffer la suspension d'agarose, en utilisant un micro-ondes, jusqu'à ce que l'ébullition douce soit observée. Placer la solution d'agarose dans un bain d'eau à 37 ° C pour maintenir à l'état liquide jusqu'à l'utilisation.
- Placer 1 mL de milieu de maintien de culture en tranche dans chaque puits d'une plaque à 6 puits.
- Utilisez un stérilePince pour placer des inserts de culture PTFE vides dans chaque puits. Placez la plaque dans un incubateur de culture tissulaire humidifié, à l'eau, avec une atmosphère de 5% de CO 2 maintenue à 37 ° C.
- À l'aide d'une pipette Pasteur stérile dans une hotte à flux laminaire, faire buller un mélange de 95% de gaz O 2 /5% de CO 2 dans un flacon contenant des milieux de traitement des tissus glacés pendant environ 15 à 30 minutes, avant l'acquisition du tissu tumoral. L'utilisation de milieux supra-oxygénés minimise l'hypoxie dans le tissu en vrac pendant le traitement.
- Préparer des tubes coniques de 50 ml (suffisamment pour le nombre désiré de régions tumorales individuelles à isoler) contenant des portions aliquotes de 20 ml de milieux de traitement glacés glacés supra-oxygéné pour transporter le tissu entre la salle d'opération et l'installation de tranchage.
- En conjonction avec une neurochirurgie, planifiez de manière préopératoire la région tumorale pour l'acquisition de l'échantillon. Sélectionnez une région de tumeur avec amélioration du contraste comme démontré sur l'imaginaire clinique du patientG (séquences de résonance magnétique post-gadolinium T1 (IRM)). L'expérience précédente suggère que cette zone produit un tissu tumoral viable par opposition au tissu nécrotique.
NOTE: La génération de tranches de la matière blanche (peritumorale) environnante a été tentée; Cependant, l'autofluorescence du fond et la diminution de la densité des cellules tumorales ont limité l'utilité expérimentale de ces tranches. - Obtenir le tissu tumoral vers le début de la résection tumorale. Éviter la collecte de tissu tumoral exposé à une cautérisation bipolaire étendue, ce qui peut compromettre la viabilité tissulaire secondaire aux lésions thermiques. Les échantillons de tissus acquis lors d'une résection tumorale fragmentaire démontrent une viabilité améliorée par rapport aux tissus acquis à partir de longues résections en bloc . Cette observation peut se rapporter à la privation différentielle des tissus tumoraux du flux sanguin résultant d'une résection chirurgicale et d'un délai prolongé pour l'acquisition.
- Si désiré, étiqueter et stocker le tissu tumoral dans des tubes coniques distincts pour isoler les échantillonsDe régions tumorales distinctes. (C'est-à- dire un tissu tumoral superficiel ou profond). Des emplacements précis de tissus peuvent être enregistrés si / lorsque la navigation chirurgicale intra-opératoire est disponible.
3. Préparation de la culture en tranche
NOTE: Ce protocole nécessite l'utilisation de nouveaux tissus humains non fixés. Tous les échantillons sont présumés infectieux et doivent être manipulés selon les protocoles universels de pathogènes transmissibles par voie sanguine. Des équipements de protection individuelle appropriés devraient être enfilés en tout temps. Les pinces et les scalpels doivent être exposés à 15 min de lumière UV avant leur utilisation. Pendant l'utilisation, pulvériser par intermittence les outils avec de l'éthanol à 70% (EtOH), ce qui permet au liquide de s'évaporer avant utilisation. Le processus de découpe est effectué de manière semi-stérile en utilisant un capot de flux laminaire horizontal avec de l'air filtré.
- Placer les morceaux de tissu tumoral dans une boîte de Petri avec des milieux de traitement glacés. Pour laver le tissu tumoral et minimiser les globules rouges adhérents, nousE pipette pour échanger et jeter les médias dans la boîte de Petri trois fois.
- À l'aide d'un scalpel, coupez les morceaux de tumeurs dans des formes de boîtes rectangulaires. Couper les morceaux de tissu à environ 3 mm x 3 mm x 10 mm. Retirez délicatement tous les vaisseaux attachés par excision ou traction douce avec des pinces fines.
- Pipettez 5 à 7 ml d'agarose à 37 ° C dans un moule en plastique en forme de cube (~ 2 cm 3 ). Confirmer la température de la solution d'agarose n'est pas supérieure à 37 ° C avec un thermomètre stérile avant utilisation.
- Laisser l'agarose s'asseoir environ 1 minute sur un lit de glace.
- Placez 2 à 4 bandes de tumeur "bandes" en agarose avec un axe long orienté verticalement.
REMARQUE: Les bandes de tissus tendent à "couler" dans l'agarose avant la solidification. Pour éviter cette complication, maintenir temporairement la bande de tissu dans l'orientation verticale jusqu'à ce que l'agarose soit encore solidifié. - Gardez le tissu contenant du moule d'agarose sur un lit de glace pendant 2 à 5 miN pour faciliter la solidification.
- Retirez le moule de la glace et retirez doucement le bloc d'agarose en coupant les côtés de la forme avec un scalpel. Évitez de placer une force excessive sur le bloc, ce qui peut fracture de l'agarose.
- Utilisez une goutte généreuse de colle de cyanoacrylate pour fixer le bloc d'agarose à la plaque d'échantillon de vibratome. Laisser la colle réglée pour environ 1 à 2 min.
- Remplissez le réservoir vibratome avec des milieux de traitement glacés pour immerger le bloc d'agarose fixé à la plaque de l'échantillon.
- Pendant le tranchage, faire bouillir 95% de mélange de gaz O 2 /5% CO 2 dans le réservoir vibratome à travers une pipette en plastique stérile taillée.
- Réglez l'épaisseur de la tranche de vibratome à 300 à 350 μm.
- Réglez la vitesse d'avance de la pale et l'amplitude de la pale selon la consistance du tissu. Le tissu GBM "plus rigide" nécessite des vitesses d'avance plus lentes de la pale et une amplitude plus élevée. La vitesse exacte de la lame et les réglages d'amplitude varieront selon les spécifications vibratométriques.
REMARQUE: Plusieurs problèmes surviennent généralement lors du tranchage. Si la bande de tissu se désodore du bloc d'agarose, essayez d'intégrer le tissu à une concentration accrue d'agarose. Si les tranches de tumeur sont plus épaisses que souhaité (jeu de machines), ou sont asymétriques, augmentez l'amplitude et diminuez la vitesse de la lame vibratome. Pour s'assurer que le tissu de la tumeur n'est pas collé ou "traîné" par le porte-lame, pendant le découpage, placez soigneusement la microspatule entre le porte-lame et la tranche, au fur et à mesure que la lame se déplace. - Transférer des tranches de tissus sur une boîte à pétri avec des milieux de traitement glacés à l'aide d'une microspatule en acier inoxydable.
- Obtenir des plaques à 6 puits contenant des inserts de PTFE et des milieux de culture en tranches équilibrés à partir de l'incubateur (tel que préparé à la section 2, étape 4).
- Placer des tranches de tissu à l'aide d'une microspatule en acier inoxydable. Minimiser le contact direct et la manipulation du tissu en utilisant un petit pinceau de poils fin pour générer une "onde fluide" pour pousser doucement la tranche de la spatule aSur l'insert de culture.
REMARQUE: minimiser la quantité de milieux de traitement introduits au dessus de l'insert de culture tissulaire. Si des quantités excessives de média sont transférées en provoquant le flottement des tranches, utilisez une pipette Pasteur stérile pour enlever les supports. - Retourner les plaques à 6 puits contenant des tranches de tumeur dans un incubateur maintenu à 37 ° C avec une atmosphère à 5% de CO 2.
REMARQUE: L'intégralité du protocole d'encastrement et de découpe doit être complété dans les 90 minutes suivant l'acquisition de tissus tumoraux dans la salle d'opération.
4. Entretien de la culture de la tranche
- Après 12 à 24 h, transférez les cultures en tranche en saisissant chaque jante d'insertion avec une pince stérile et transférez-les sur des plaques contenant du milieu de maintien de culture de tranche fraîche. Assurez-vous que les milieux de maintenance de la culture en tranche, aliquotes dans chaque puits, s'établissent dans l'incubateur pendant au moins 15 min avant de transférer les inserts.
- Déplacer les inserts sur les nouvelles assiettes à 6 puits avec une coupe équilibrée fraîcheTous les 48 h.
- Si vous le désirez, aliquotez des milieux de culture en tranches avec une pipette pour une utilisation immédiate dans les dosages biochimiques ( c'est-à-dire ELISA) ou géluez à -80 ° C pour une utilisation future.
5. Étiquetage des cellules tumorales via des protéines de fluorescence verte exprimant un rétrovirus
NOTE: La microscopie temporelle pour l'analyse de la migration des cellules tumorales nécessite un étiquetage fluorescent stable et à long terme des cellules dans la culture en tranche. L'utilisation de rétrovirus est suggérée car elle infecte sélectivement les cellules en division, enrichissant ainsi l'étiquetage fluorescent dans la population de cellules tumorales par opposition à la microglie ou à d'autres types de cellules présents dans la tranche. La normalisation de l'infection suggère qu'un titre viral de 10 4 UFC / μL entraîne une expression suffisante de la protéine fluorescente verte pour le suivi et l'analyse de la migration cellulaire. Augmentation du titre viral, utilisation de virus non sélectifs ( c.-à-d. Adenovirus, lentivirus) ou otSon moyen d'étiquetage de toutes les cellules peut empêcher l'identification de limites de cellules claires pendant la migration, ce qui complique l'analyse. L'utilisation de marqueurs fluorescents alternatifs peut être utilisée et optimisée au besoin.
- Obtenir un rétrovirus pour l'infection des tranches de tumeur soit via les protocoles standard 5 , 14, soit à partir d'une source disponible dans le commerce. Diluer le surnageant viral en ajoutant le volume approprié dans un milieu neuronal non additionné pour obtenir un titre viral de 10 4 CFU / μL.
- Entre 7 et 10 jours de culture infectent les cultures de tranches de tumeurs d'intérêt avec 5 à 10 μl de virus (10 4 UFC / μL). Placez le virus doucement goutte à goutte sur la surface de chaque tranche de tissu. Réduire le volume du surnageant ajouté si la tranche flotte sur la surface de l'insert. Plaques de retour contenant des cultures en tranche à l'incubateur.
- Évaluer les tranches de cellules tumorales marquées à partir de 24 h après Infection virale (voir la section 6). Ce délai différera en fonction de l'incorporation virale et de la cinétique d'expression des gènes de fluorescence. Pour les constructions virales utilisées ici, 72 h devaient observer un signal fluorescent robuste avec un microscope à épifluorescence standard.
REMARQUE: Rarement, les tranches affichent une distribution à prédominance périphérique des cellules virales, ce qui peut compliquer l'imagerie confocale. Pour éviter cette complication, essayez de réduire l'épaisseur de la tranche et la variation de l'épaisseur dans la tranche. Si la culture en tranche a une région plus épaisse près du centre, cela peut empêcher une pénétration adéquate des éléments nutritifs, limitant ainsi la population de cellules tumorales actives. Un dosage qualitatif pour détecter cette complication est l'addition d'un réactif de colorant au tétrazolium ( c'est-à-dire MTT) au milieu de culture en tranche. Les zones de la tranche qui ne deviennent pas bleues après l'ajout du réactif indiquent un manque d'activité métabolique et une réduction de la santé des tranches.
NOTE: Une fois que la transduction réussie et la santé de la culture sont confirmées, les cellules peuvent être imagées dans des conditions de contrôle, suivies d'une période d'imagerie identique dans des conditions de traitement. À l'aide de ce protocole, les cellules ont été enregistrées avec succès et suivies pendant 12 heures dans chaque condition. Cependant, des périodes plus courtes ou plus longues d'imagerie et de manipulation de l'environnement peuvent également être informatives.
- Chargement du microscope
- Avant l'imagerie, placer 1 mL de morceaux de morceaux frais dans un plat de fond de verre.
- Laisser les milieux dans le plat de fond de verre équilibrer dans un incubateur pendant 15 min.
REMARQUE: à ce stade, des agents d'étiquetage solubles, tels que des lectines fluorescentes conjuguées ( c'est-à-dire Isolectin IB 4 pour l'étiquetage de la microglie) ou des points quantiques conjugués au ligand, peuvent être ajoutés au milieu de culture en tranche pour l'identification de la celluleSous-populations ular pendant l'imagerie. - Transférer l'insert à imager dans un plat de verre en utilisant des pinces stériles dans une hotte à flux laminaire. Transporter le plat au stade du microscope.
- Maintenir des cultures en tranche à 37 ° C et 5% d'atmosphère de CO 2 dans un incubateur scellé au microscope. Utiliser l'humidification H 2 O stérile de la chambre d'incubation si disponible pour éviter une évaporation excessive des milieux (particulièrement important pour des expériences d'imagerie plus longues).
- Utiliser un microscope confocal avec une longue distance de travail 10X objectif aérien et une excitation laser pour un photon et / ou un photomètre.
REMARQUE: assurez-vous que la lentille d'objectif du microscope offre une distance de travail adéquate. En raison de la hauteur ajoutée de l'incubateur de scène, du plat de fond en verre et de l'insert de culture de tissu, les objectifs de longue distance de travail sont essentiels. - Fixez la plaque de fond en verre, retirez le couvercle de la boîte en plastique Petri et recouvrez-Membrane perméable.
- Acquisition d'image
- Utilisez le microscope pour inspecter visuellement la tranche et localiser un champ approprié avec une densité adéquate de cellules tumorales marquées par fluorescence entre le bord de la tranche et le centre. Évitez les champs d'imagerie au bord de la tranche, en raison de la sensibilité accrue des déplacements de tissus lors de l'imagerie. Des harpes de tranche de tissus peuvent être utilisées pour limiter ce changement.
- Utilisez le logiciel d'imagerie en mode d'analyse multidimensionnelle pour définir les premières limites de la pile Z (supérieure) et dernière (supérieure), de sorte que toutes les positions à imager contiennent un signal cellulaire fluorescent visible. L'imagerie de 150 à 200 μm de la tranche, avec une étape Z constante de 10 μm, a permis une résolution adéquate pour le suivi des chemins de cellules (cela peut être ajusté pour les besoins individuels d'imagerie).
- Si le microscope a un stade motorisé, assurez-vous qu'un temps suffisant est permis pour chaque acquisition de la pile Z. Définir l'intervalle de temps entre acquisitions à égalTemps de balayage par position x nombre de positions à l'image ( c.-à-d . Régions tumorales imagées).
REMARQUE: Pour une excitation simultanée des fluorophores verts et rouges, utilisez un programme de balayage de ligne laser à deux lignes, avec une excitation simultanée de 488 nm et 633 nm. La longueur d'onde de l'excitation laser sélectionnée varie selon les protéines fluorescentes individuelles exprimées. - Maintenir une puissance uniforme du laser et des paramètres de trous de trous confocaux entre les régions tumorales imagées. Utilisez le réglage de puissance laser le plus bas nécessaire pour délimiter clairement les corps et les processus des cellules tumorales pour limiter la phototoxicité. Les unités de paramètres d'imagerie spécifiques ( c.-à-d. Les réglages de puissance et les trous de trous confocaux) varieront selon les spécifications du microscope et des spécifications laser.
- Compenser l'évaporation potentielle des médias en ajoutant 2 - 3 étapes "tampon" Z-stack dans les plans focaux vers l'objectif. Cela empêche efficacement les tissus de quitter la gamme de l'acquisition de Z-stackIons dans le plan vertical.
7. Traitement postérieur de l'image et suivi des cellules tumorales
REMARQUE: De nombreux systèmes d'imagerie confocal sont équipés d'un logiciel de traitement d'image propriétaire. Les étapes de traitement décrites ci-dessous comprennent un protocole général, qui peut être effectué sur les plates-formes logicielles. Des instructions spécifiques seront données pour les plates-formes open-source, NIH ImageJ et MTrackJ 15 .
- Ouvrez un fichier Z-stack. Dans ImageJ, cliquez sur "Image → Stacks → Z Project". Choisissez la première et dernière pile Z à inclure, et choisissez "Max Intensity" comme type de projection. Le résultat est un rendu appelé projection d'intensité maximale (MIP). Créez un MIP à partir de chaque ensemble d'images de pile Z capturées dans chaque région imagée.
- Concaténer les MIP de chaque région pour créer une série chronologique. Cliquez sur "Image → Stacks → Images to Stack".
- Identifiez manuellement l'emplacementDu "centroïde" du corps cellulaire en sélectionnant le point central visuellement approximatif du corps de la cellule tumorale. Ceci est réalisé en cliquant sur le corps de la cellule en utilisant la fonctionnalité de piste "add" de MTrackJ (un plug-in open-source pour NIJ ImageJ).
- Cliquez pour délimiter l'emplacement du corps de la cellule dans chaque image de la série d'images. Cela crée une "piste" unique pour chaque cellule. Séquentiellement, marquer les emplacements du corps cellulaire de la cellule suivante. Répétez ce processus jusqu'à ce que tous les chemins de migration de cellule soient suivis.
- Une fois qu'une population de cellules est suivie dans une micro région tumorale donnée, exportez toutes les coordonnées de la voie cellulaire en utilisant la fonction "mesure" de MTrackJ. Enregistrez le fichier sous forme de format .xls afin que les données brutes puissent être analysées à l'aide d'une feuille de calcul ou d'un logiciel généré par l'utilisateur.
- Utilisez les coordonnées enregistrées pour chaque point le long de la piste de migration d'une cellule, pour effectuer des analyses quantitatives, y compris la dérivation de la vitesse de migration, de la directionnalité et d'autres migrationsMétriques, comme décrit dans Parker et al 16 .
REMARQUE: Toutes les distances et les vitesses calculées sont des sous-estimations des valeurs réelles. Ceci est inhérent à la transformation d'images tridimensionnelles (et de chemins de migration) en données bidimensionnelles grâce à la génération de projections d'intensité maximale.
Résultats
Notre groupe a généré avec succès des cultures en tranches de plus de 50 patients soumis à une résection GBM initiale. Ce protocole de génération, de culture, d'étiquetage rétroviral, d'imagerie et d'analyse de migration a été rationalisé en un flux de travail reproductible ( Figure 1 ). De manière critique, ces tranches de GBM organotypiques démontrent une concordance avec le tissu tumoral originaire à travers la culture, y compris le maintien des signes pathologiques et la microglie jusqu'à 15 jours en culture ( figure 2 ). De plus, nous avons utilisé ce système pour effectuer des analyses fonctionnelles de la réponse tumorale aux changements microenvironnementaux. En tant que mesure de l'intégrité physiologique, nous avons examiné comment les cultures de tranche GBM ont répondu à l'hypoxie (1% O 2 ) en mesurant la production du facteur de croissance endothélial vasculaire (VEGF), processus qui se produit abondamment dans le micro-environnement GBM in vivo 17 ,"> 18. Nous avons démontré qu'en plaçant les cultures de tranche dans des conditions hypoxiques, les tranches montraient une réponse physiologique rapide, induisant la libération de VEGF dans les médias ( Figure 3 ).
Pour évaluer les aspects qualitatifs et quantitatifs de la migration des cellules tumorales, nous avons utilisé les images temporelles pour générer des cartes de migration détaillées. Ces cartes délimitent toutes les cellules GBM suivies dans les limites des microrégions tumorales (1 mm 2 ), fournissant une visualisation statique du comportement migratoire dynamique de la population tumorale. Les mesures quantitatives de la vitesse et de la directionnalité de la migration (déplacement cellulaire / distance totale parcourue) ont été calculées pour chaque cellule, permettant d'étudier les changements dans les paramètres de migration dans les régions tumorales, les échantillons de tumeurs et en réponse au traitement ( Figure 4 ).
Le protocole d'étiquetage et d'imagerie des cellules desCribé ici fournit également une résolution spatiale et temporelle suffisante pour évaluer les changements dans la morphologie cellulaire lors de la migration à travers le microenvironnement de la tumeur natif. Nous avons observé la présence de cellules tumorales mobiles morphologiquement distinctes et microgliales entremêlées dans la culture en tranche ( figure 5A ). Le mouvement de la cellule tumorale a été caractérisé par un processus de «recherche et éclatement» qui impliquait une protrusion et une rétraction répétée de filopodes à partir d'une cellule statique, suivie d'une courte période de mouvement efficace. Les régions de tranche d'imagerie approximativement toutes les 10 minutes ont également fourni une résolution temporelle adéquate pour enregistrer des images temporelles de cellules tumorales subissant une division cellulaire. Ces cellules se sont séparées de la migration, de la mitose complétée et les cellules filles ont réinitialisé la migration sans délai, tout cela dans un délai de 3 heures ( Figure 5D ). En revanche, la microglie migre à une vitesse plus élevée et plus constante, avec une directionalité inférieure à celle des cellules tumorales adjacentes,Démontrant leur migration relativement inefficace ( Figure 5C, 5E-G ). De telles observations peuvent être importantes pour avoir une idée de la biologie qui sous-tend les réponses spécifiques aux patients ou aux cellules au traitement.
Enfin, nous avons utilisé ce protocole pour démontrer la variabilité du patient à patient dans les paramètres de migration cellulaire au niveau de la population, y compris une corrélation de l'amplification génomique du récepteur du facteur de croissance épidermique ( EGFR ) avec le potentiel migratoire augmenté des cellules tumorales 16 . En outre, la microscopie temporelle des tranches de tumeurs avant et après le traitement avec le médicament anti-invasif, le gefitinib, a démontré une réduction significative de la migration, qui était spécifique aux tranches de tumeur amplifiées par EGFR 16 .
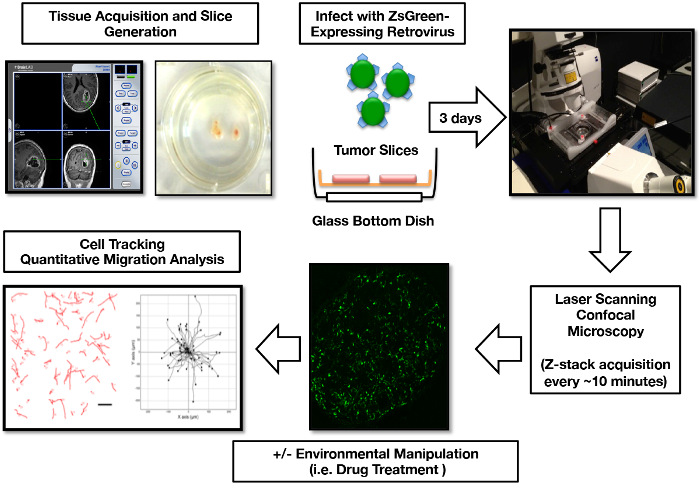
Figure 1: Influence de la culture de la tranche organotypique humaine GBM humaine, imagerie et analyse de la migration cellulaire. Le tissu tumoral est localisé dans une région spécifique via un équipement de navigation intra-opératoire. Une semaine après le découpage, la ZsGreen exprimant un retrovirus est ajoutée aux cultures en tranche pour étiqueter les cellules tumorales mitotiquement actives. 3 jours après l'infection, des tranches sont préparées pour l'imagerie confocal. Les données d'imagerie 3D sont post-traitées en images 2D pour le suivi du chemin de migration cellulaire, la génération de cartes de migration de cellules tumorales et le calcul des paramètres de migration de cellules tumorales. Des portions de ce chiffre ont été publiées à l'origine dans Parker et al , 2013 16 et reproduites avec la permission de Oxford University Press. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2. Les tranches organotypiques GBM humaines conservent les caractéristiques histologiques tout au long de la culture ex Vivo . ( A ) Les séquences d'IRM améliorées par contraste T1 ont été utilisées pour localiser et documenter la (les) région (s) d'acquisition de tissu (flèche). ( B ) La coloration H & E du tissu donneur initial (OR) et des tranches au jour 8 de la culture à partir d'une culture en tranche générée à partir d'un tissu obtenu de la région soulignée en A. ( C ) Les caractéristiques pathologiques et cellulaires micro-ambiantes du GBM, in vivo , sont maintenues Tout au long de la culture en tranche. (I, II) L'immunohistochimie pour CD68, un marqueur de microglie / macrophage, à un grossissement bas (haut) et haut (bas), démontre une persistance microgliale dans des tranches après 15 jours de culture. La coloration H & E au jour 4 de la culture en tranche confirme l'entretien de la nécrose pseudopallisante, un pathoCaractéristique logique de GBM, à un grossissement faible (iii) et élevé (iv). Barres d'échelle = 200 μm. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3: Les cultures de tranche GBM humaine sécrètent le VEGF en réponse à l'hypoxie. ( A ) L'expérience a utilisé des inserts de culture individuels contenant 3 tranches de tumeur de taille similaire générées à partir de la même région tumorale. Les tranches ont été maintenues dans la normoxie pendant 12 h, suivies de deux intervalles d'hypoxie de 12 h, avec de nouveaux médias ajoutés avant chaque intervalle. ( B ) La sécrétion de VEGF dans le milieu mesuré par ELISA (moyenne ± écart-type) à partir de cultures en tranches générées à partir de deux tumeurs représentatives, a été significativement augmentée unDer hypoxie que la normoxie (p <0,05). ( C ) Une analyse groupée de cultures en coupe de 4 tumeurs différentes a démontré une augmentation de la sécrétion de VEGF après des intervalles séquentiels de 12 h d'hypoxie par rapport à la normoxie (p <0,05). Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4: Les données de la voie des voies tumorales permettent de déterminer quantitativement la vitesse et la direction de la cellule. ( A ) Les cellules tumorales avec une directionalité de 1 représentent une efficacité parfaite le long d'un vecteur droit, tandis que ceux qui ont une directionnalité inférieure s'engagent dans des chemins de méandres inefficaces, comme représenté dans ce schéma 16 . Réimprimé avec la permission de l'Université d'OxfordPresse. ( B ) L'analyse des données de parcours de cheminement représentatif (résolution "basse" ~ 55 min des intervalles de suivi des cellules) démontre une variabilité cellulaire de la vitesse et de la directionnalité. ( C ) La directionnalité par rapport à la vitesse de migration pour chaque piste cellulaire est tracée pour visualiser le comportement de migration dans la population cellulaire (chaque point représente une cellule individuelle). Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5: Microglia au sein de GBM Slice Cultures sont caractérisés par une forte vitesse de migration et une faible directionnalité par rapport aux cellules tumorales. ( A ) Réplication des cellules tumorales exprimant sélectivement le retrovirus ZsGreen et le microglie marqué avec un Isolectin-I Le conjugué B 4 -647 existe entremêlé dans une micro-région tumorale représentative d'une culture en tranches représentative. ( BC ) Les chemins de GBM ( B ) et de microglie ( C ) individuellement contrôlés dans la même micro-région tumorale démontrent des comportements de migration discordante. Barres d'échelle = 200 μm. ( D ) Une cellule tumorale activement migrante fait une pause, rétracte ses processus (flèche), subit une division cellulaire et deux cellules filles migrent dans les directions opposées (flèches). Barres à l'échelle = 50 μm. ( E et F ) La microglie démontre une vitesse de migration accrue (p <0,0001) et une directionnalité réduite (p <0,0001) par rapport aux cellules tumorales dans la même région. (G) La répartition des cellules tumorales et microgliales basée sur la vitesse et la directionnalité démontre les phénotypes migratoires uniques des deux populations cellulaires.Et = "_ blank"> Cliquez ici pour voir une version plus grande de cette figure.
Discussion
Les cultures de tranche organotypiques issues de tissus cancéreux humains constituent une plate-forme attrayante et sous-utilisée pour une expérimentation de traduction préclinique. La compréhension des comportements au niveau de la population des cellules tumorales en ce qui concerne la migration, la prolifération et la mort cellulaire dans le microenvironnement tumoral natif est insuffisante. De manière critique, l'étude de la réponse tumorale au traitement d'une manière dynamique, résolue dans le temps au niveau du comportement cellulaire peut éclairer les nouveaux mécanismes de résistance au traitement. Les cultures de tranche de tumeur humaine fournissent un lien entre le processus de la maladie humaine et les techniques de modélisation ex vivo et in vivo existantes 19 . Nous avons récemment validé la technique décrite ici comme une méthode pour étudier la migration GBM, signalant pour la première fois des variations inter-tumorales mesurables dans le comportement de la migration cellulaire liées à l'amplification et à la signalisation de l'EGFR 16 . Cette étude a également utilisé le modèle de culture en tranche pour tester la patienteL'efficacité spécifique du nt de l'inhibiteur de l'EGFR, le gefitinib, en tant que thérapie anti-invasive potentielle pour GBM 16 .
Plusieurs des pièges communs lors de la découpe des tissus, de l'infection rétrovirale, de l'imagerie et du paradigme de l'analyse d'image ont été discutés ci-dessus. Cependant, le protocole d'infection rétrovirale nécessite une attention accrue. Compte tenu de la variation du patient au patient, il peut s'avérer difficile de titrer la densité des cellules tumorales virales dans chaque tranche. Si un nombre insuffisant de cellules est marqué par la construction virale, ajoutez des aliquotes supplémentaires de 5 à 10 μL de surnageant rétroviral à la surface de chaque tranche tous les jours jusqu'à ce que la concentration désirée de cellules tumorales marquées soit atteinte. Dans les cultures de coupes primaires, le pourcentage de cellules répliquées est généralement plus faible que dans les lignées cellulaires transformées, limitant ainsi le sous-ensemble de cellules permissives à l'incorporation rétrovirale à n'importe quel moment. Alternativement, si trop de cellules sont étiquetées, la prévention d'accLa délimitation urrate des chemins de migration cellulaire, diluer le surnageant viral avec des milieux neuronaux pour obtenir un titre effectif inférieur. La microglie associée à une tumeur a incorporé la protéine fluorescente exprimant un retrovirus à une fréquence d'environ 1% de toutes les cellules marquées. Nous avons pu isoler visuellement ces cellules pour une analyse séparée par l'utilisation d'une lectine de liaison à la microglie pour les analyses de données post-imagerie ( Figure 5 ).
Le microenvironnement de la tumeur, y compris les aspects de l'administration des nutriments, les interactions cellule-cellule et la matrice extracellulaire, jouent tous un rôle dans la pathogenèse du GBM 20 . Les cultures directes de tranche de MGF humaine élèvent le besoin de passage dans les petits modèles animaux ou la culture cellulaire disséminée tout en fournissant une récapitulation étroite du micro-environnement de la tumeur humaine. De plus, les cultures en tranche fournissent un accès uniforme aux nutriments à travers les échantillons, tout en maintenant les interactions cellule-cellule et ECM-cellule. En réduisant les varDans le cadre de l'accès cellulaire aux éléments nutritifs qui se révèlent dans les tumeurs, nous proposons que les différences observées dans les cultures éclairent les différences intrinsèques entre les comportements des cellules tumorales ( c'est-à-dire la migration) au niveau de la population. Cependant, l'interprétation des données recueillies à travers les cultures en tranche générées à partir de tumeurs humaines est compliquée par une hétérogénéité intrinsèque et intra-tumorale inhérente. De manière critique, une étude plus approfondie est nécessaire pour caractériser les changements génétiques et épigénétiques potentiels qui peuvent se produire pendant la maintenance ex vivo de cultures de tranche de tumeur humaine.
L'utilisation de cultures de tranche de tumeur humaine en parallèle avec les essais cliniques de phase I / II est une stratégie prometteuse pour corréler les paramètres de la tranche avec les résultats cliniques des patients. La validation de ces paramètres prédictifs / pronostiques potentiels est nécessaire avant que les cultures en tranche puissent être utilisées pour personnaliser la thérapie oncolique. Notre travail, ainsi que celui des autres, démontre la faisabilité de la validation des biomarqueurs 21, ainsi que des tests rapides et ex vivo d'agents thérapeutiques dans des cultures en tranche de GBM 9 , 16 . Des techniques similaires de culture de tranche humaine utilisant le poumon 22 , le côlon 22 , la tête et le cou 23 , le cancer du sein 24 et le cancer de la prostate. Les 25 tissus suggèrent que cette approche est généralisable à travers les cancers humains.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Nous tenons à remercier le Dr Lee Niswander et le Dr Rada Massarwa pour leur expertise technique et leurs contributions au protocole d'imagerie confocale de la culture en coupe décrite ici. Merci encore au docteur Kalen Dionne qui a fourni une expertise en matière d'optimisation des paramètres de coupe et de culture des tissus tumoraux du cerveau.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM High Glucose | Invitrogen (Gibco) | 11960-044 | |
| Neurobasal-A Medium, minus phenol red | Invitrogen (Gibco) | 12349-015 | |
| B-27 Supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Penicillin-Streptomycin (10,000 U/mL) | Invitrogen (Gibco) | 15140-122 | |
| GlutaMAX Supplement | Invitrogen (Gibco) | 35050-061 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| HEPES (1 M) | Invitrogen (Gibco) | 15630-080 | |
| Nystatin Suspension | Sigma-Aldrich | N1638-20ML | 10,000 unit/mL in DPBS, aseptically processed, BioReagent, suitable for cell culture |
| UltraPure Low Melting Point Agarose | Invitrogen (Gibco) | 16520-050 | Melts at 65.5 °C, Remains fluid at 37 °C, and sets rapidly below 25 °C. |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 Conjugate | Thermo Fisher (Molecular Probes) | I32450 | Used in media to label Microglia/Macrophages |
| pRetroX-IRES-ZsGreen1 Vector | Clonetech | 632520 | |
| Retro-X Concentrator | Clonetech | 31455 | Binding resin for non-ultracentrifugation concentration of viral supernatants |
| pVSG-G Vector | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| GP2-293 Viral packaging cells | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| Cyanoacrylate Glue (Super Glue) | Sigma-Aldrich | Z105899 | Medium-viscosity |
| Equipment | |||
| Peel-A-Way Embedding Mold (Square - S22) | Polysciences, Inc. | 18646A-1 | Molds for tumor sample embedding |
| Stainless Steel Micro Spatulas | Fisher Scientific | S50823 | Bend instrument 45 degrees at the neck of the spoon blade |
| Curved Fisherbrand Dissecting Fine-Pointed Forceps | Fisher Scientific | 08-875 | |
| Single Edge Razor Blade (American Safety Razors) | Fisher Scientific | 17-989-001 | Blade edge is 0.009" thick. Crimped blunt-edge cover is removed before loading onto vibratome. |
| Leica VT1000 S Vibratome | Leica Biosystems | VT1000 S | |
| Hydrophilic PTFE cell culture insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm pore size |
| 35 mm Glass Bottom Dishes | MatTek | P35G-1.5-20-C Sleeve | 20 mm glass diameter. Coverslip glass thickness 1.5 mm |
| LSM 510 Confocal Micoscope | Zeiss | LSM 510 | 10x Air Objective (c-Apochromat NA 0.45) |
| PECON Stagetop Incubator | PeCON Germany | (Discontinued) | Incubator PM 2000 RBT is a comprable product designed for use with Zeiss Microscopes. |
Références
- Beadle, C., et al. The role of myosin II in glioma invasion of the brain. Mol Biol Cell. 19, 3357-3368 (2008).
- Farin, A., et al. Transplanted glioma cells migrate and proliferate on host brain vasculature: a dynamic analysis. Glia. 53, 799-808 (2006).
- Panopoulos, A., Howell, M., Fotedar, R., Margolis, R. L. Glioblastoma motility occurs in the absence of actin polymer. Mol Biol Cell. 22, 2212-2220 (2011).
- Ivkovic, S., et al. Direct inhibition of myosin II effectively blocks glioma invasion in the presence of multiple motogens. Mol Biol Cell. 23, 533-542 (2012).
- Assanah, M., et al. Glial progenitors in adult white matter are driven to form malignant gliomas by platelet-derived growth factor-expressing retroviruses. J Neurosci. 26, 6781-6790 (2006).
- Chaichana, K. L., et al. Preservation of glial cytoarchitecture from ex vivo human tumor and non-tumor cerebral cortical explants: A human model to study neurological diseases. J Neurosci Methods. 164, 261-270 (2007).
- Grube, S., et al. Overexpression of fatty acid synthase in human gliomas correlates with the WHO tumor grade and inhibition with Orlistat reduces cell viability and triggers apoptosis. J Neurooncol. 118, 277-287 (2014).
- Hovinga, K. E., et al. Inhibition of notch signaling in glioblastoma targets cancer stem cells via an endothelial cell intermediate. Stem Cells. 28, 1019-1029 (2010).
- Merz, F., et al. Organotypic slice cultures of human glioblastoma reveal different susceptibilities to treatments. Neurooncol. 15, 670-681 (2013).
- Xu, J., et al. Vorinostat modulates cell cycle regulatory proteins in glioma cells and human glioma slice cultures. J Neurooncol. 105, 241-251 (2011).
- Verhaak, R. G., et al. Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities. in PDGFRA, IDH1, EGFR, and NF1. Cancer cell. 17, 98-110 (2010).
- Gill, B. J., et al. MRI-localized biopsies reveal subtype-specific differences in molecular and cellular composition at the margins of glioblastoma. Proc Natl Acad Sci USA. 111, 12550-12555 (2014).
- Snuderl, M., et al. Mosaic amplification of multiple receptor tyrosine kinase genes in glioblastoma. Cancer cell. 20, 810-817 (2011).
- Kakita, A., Goldman, J. E. Patterns and dynamics of SVZ cell migration in the postnatal forebrain: monitoring living progenitors in slice preparations. Neuron. 23, 461-472 (1999).
- Meijering, E., Dzyubachyk, O., Smal, I., van Cappellen, W. A. Tracking in cell and developmental biology. Sem Cell Dev Biol. 20, 894-902 (2009).
- Parker, J. J., et al. Gefitinib selectively inhibits tumor cell migration in EGFR-amplified human glioblastoma. Neurooncol. 15, 1048-1057 (2013).
- Brat, D. J., et al. Pseudopalisades in glioblastoma are hypoxic, express extracellular matrix proteases, and are formed by an actively migrating cell population. Cancer Res. 64, 920-927 (2004).
- Shweiki, D., Itin, A., Soffer, D., Keshet, E. Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis. Nature. 359, 843-845 (1992).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15, 647-664 (2014).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. 60, 502-514 (2012).
- Di Cristofori, A., et al. The vacuolar H+ ATPase is a novel therapeutic target for glioblastoma. Oncotarget. 6, 17514-17513 (2015).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proc Natl Acad Sci USA. , 8352-8356 (2010).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. Br J Cancer. 110, 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. J Clin Pathol. 66, 253-255 (2013).
- Maund, S. L., Nolley, R., Peehl, D. M. Optimization and comprehensive characterization of a faithful tissue culture model of the benign and malignant human prostate. Lab Invest. 94, 208-221 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon