Method Article
A Glioblastoma האדם דגם תרבות פרוסה Organotypic לחקר גידול תאים סרטניים ואפקטים ספציפיים לחולה של תרופות אנטי פולשניות
In This Article
Summary
מודלים vivo לשעבר של גליובלסטומה (GBM) אינם מותאמים למחקר רלוונטי מבחינה פיזיולוגית של הפלישה של הגידול האנושי. כאן, אנו מציגים פרוטוקול לייצור ותחזוקה של תרבויות פרוסה organotypic מרקמת GBM אדם טרי. תיאור של זמן לשגות מיקרוסקופיה ו כמותי תא הגירה טכניקות ניתוח מסופק.
Abstract
Glioblastoma (GBM) ממשיך לשאת פרוגנוזה קלינית ירודה ביותר למרות טיפול כירורגי, כימותרפי, והקרנות. הפלישה המתקדמת של הגידול לתוך פרנכימה במוח מייצגת אתגר טיפולי מתמשך. כדי לפתח טיפולים נגד הגירה עבור GBM, מערכות מודל המספקים רקע רלוונטי מבחינה פיזיולוגית לניסוי מבוקר חיוניים. כאן, אנו מציגים פרוטוקול ליצירת תרבויות פרוסה מרקמת GBM האדם שהושג במהלך כריתה כירורגית. תרבויות אלה מאפשרים ניסויים vivo לשעבר ללא passaging דרך xenografts בעלי חיים או תרבויות תא בודד. יתר על כן, אנו מתארים את השימוש של זמן לשגות לייזר סריקה מיקרוסקופיה confocal בשיתוף עם מעקב תא כדי ללמוד באופן כמותי את ההתנהגות הנדידה של תאים סרטניים התגובה הקשורים לתרפוי. פרוסות הם reproducibly שנוצר בתוך 90 דקות של רכישת רקמות כירורגיות. Retrovirally בתיווך תא פלואורסצנטי להBeling, הדמיה confocal, ותאי הגירה הגידול התא הם השלימו לאחר מכן בתוך שבועיים של תרבות. השתמשנו בהצלחה אלה תרבויות פרוסה לחשוף גורמים גנטיים הקשורים הגדילה את התנהגות הנדידה GBM האדם. יתר על כן, יש לנו אימות של היכולת של המודל לזהות וריאציה ספציפית למטופל בתגובה טיפולים נגד הגירה. לנוע קדימה, תרבויות פרוסות GBM האדם הם פלטפורמה אטרקטיבית להערכה מהירה vivo מהיר של רגישות הגידול לסוכנים טיפוליים, על מנת לקדם טיפול נוירו אונקולוגי אישית.
Introduction
מחקר המעבדה של glioblastoma (GBM), הוא הפריע על ידי חוסר מודלים כי בנאמנות לסכם את המאפיינים הפתולוגיים הנדרשים של המחלה האנושית, כלומר גידול תאים וגידול הפלישה. מחקרים השוואתיים של 2D ו -3 D במבחני הפלישה חוץ גופית, כמו גם מודלים 3D מכרסמים תרבות פרוסה חשפו מכנית שונה תוכניות העברה הסלולר בשני הקשרים אלה, פוטנציאל הגבלת translatability של ממצאים ממערכות 2D למחלה אנושית 1 , 2 , 3 . התרבות organotypic פרוסה התרבות פרדיגמה הדמיה שתוארו כאן מאפשר המחקר של הגירה תא הגידול בתוך פרוסות של רקמה vivo הגידול האנושי לשעבר המתקבל כריתה כירורגית. לפיכך, פרוסות תרבויות של רקמת הגידול רקד כיתוב יחד עם מיקרוסקופיה פרוטוקול זמן לשגות לספק פלטפורמה ללמוד הגירה תא הגידול ילידMicroenvironment ללא פירוק רקמות או תרבות passaging.
יש ספרות מקיפה המעסיקים מכרסמים המוח מודלים התרבות פרוסה של GBM שנוצר xenografts הגידול האנושי, גידולים המושרה רטרובירל, ואת שכבות הסלולר ללמוד הפלישה הגידול 1 , 2 , 3 , 4 , 5 . לאחרונה, כמה קבוצות תיארו את הדור של תרבויות פרוסה organotypic ישירות מ GBM רקמות האדם 6 , 7 , 8 , 9 , 10 . עם זאת, יש וריאציה ניכרת בין הפרוטוקולים שפורסמו לגבי חיתוך טכניקה תרבות התקשורת. יתר על כן, השימוש בתרבויות פרוסה organotypic התמקדה endpoints סטטי סטטי שכלל שינויים Cell signaliNg, התפשטות, ומוות. הפרוטוקול המתואר כאן מרחיב על פרדיגמות תרבות פרוסה קודם על ידי שילוב תצפית נפתרה זמן של התאים תאים סרטניים דינמיים באמצעות מיקרוסקופיית זמן לסרוק מיקרוסקופיה confocal. גילוי אחרון של 11 בין 11 ו intratumoral 12 , 13 וריאציה גנטית האדם GBM מדגיש את החשיבות של קישור הטרוגניות זו עם התאים התא הגידול והשלכותיה על התגובה הגידול לטיפול. כאן, אנו מדווחים פרוטוקול יעיל לשחזור לשימוש של תרבויות פרוסה ישירה מרקמת סרטן האדם לדמיין הגירה תא הגידול כמעט בזמן אמת.
Protocol
לפני תחילת איסוף דגימות רקמת החולה, יש לקבל הסכמה מדעת מכל חולה בהתאם לפרוטוקול מוסמך של מועצת הביקורת המוסדית (IRB). מחברי פרוטוקול זה קיבלו את הסכמת העבודה המתוארת תחת פרוטוקולים מאושרים IRB בבית החולים של אוניברסיטת קולורדו ובית החולים Inova Fairfax. נתונים שנאספו מתרבויות פרוסה אלה לא שימשו להנחיית החלטות הטיפול בחולה.
1. הכנה מראש חיתוך
- הכן "עיבוד רקמות" התקשורת "תחזוקה תרבות פרוסה" התקשורת יום לפני הגידול המתוכנן כריתה אוסף רקמות (או לנצל התקשורת שנוצר בעבר תוך 2 שבועות). הוסף 5 מ"ל של פתרון פניצילין סטרפטומיצין (10,000 U / mL) ו 5 מ"ל של 1 M HEPES ל 500 מ"ל של גלוקוז גבוהה גלוק ליצור בינוני עיבוד רקמות.
- הכן 250 מ"ל של התקשורת פרוסה תחזוקה התקשורת באמצעות בסיס של המדידה העצבית ( למשל , neurobasal) שנינותאדום פנול אדום. להשלים את המדיום הזה עם 10 מ"מ HEPES, 1x B-27 תוספת, 400 מיקרומטר L- גלוטמין, 600 מיקרומטר L-alanyl- dipeptide L- גלוטמין, 60 פניצילין U / מ"ל, 60 מיקרוגרם / מ"ל סטרפטומיצין, ו 6 U / mL ניסטטין.
- חנות כל התקשורת ב 4 מעלות צלזיוס למשך לא יותר מ 2 שבועות.
2. יום של כירורגיה: רכישת רקמות
- ביום רכישת רקמות, להכין 50-100 מ"ל של 1% ו 2% (wt / vol%) פתרונות של טמפרטורת נמוכות agarose טמפרטורת עיבוד רקמות באמצעות כלי זכוכית autoclaved וטכניקה סטרילית במכסה המנוע זרימה למינרית. שני הריכוזים של agarose נדרשים כדי להתאים וריאציה בלתי צפוי בעקביות רקמות הגידול.
- מחממים את ההשעיה agarose, באמצעות מיקרוגל, עד רתיחה עדין הוא ציין. מניחים את הפתרון agarose באמבט מים 37 מעלות צלזיוס כדי לשמור במצב נוזלי עד לשימוש.
- מקום 1 מ"ל של התקשורת פרוסה תחזוקה התקשורת היטב כל צלחת 6-היטב.
- השתמש סטרילימלקחיים למקום ריק מוסיף PTFE תרבות בכל טוב. מניחים את הצלחת בתוך humidified, מעוטר במים, רקמה תרבות חממה עם 5% CO 2 אווירה שמרו על 37 מעלות צלזיוס.
- באמצעות פיפטה פסטר סטרילית ב מכסה המנוע זרימה למינרית, בועה תערובת של 95% O 2 /5% CO 2 גז לתוך בקבוק המכיל קרח עיבוד רקמות קר רקמת כ 15 עד 30 דקות, לפני רכישת רקמות הגידול. השימוש בחמצן מעל חמצן ממזער את חוסר חמצן ברקמה בתפזורת במהלך העיבוד.
- הכן שכותרתו 50 צינורות חרוטי מ"ל (מספיק עבור מספר הרצוי של אזורים בודדים הגידול להיות מבודד) המכיל 20 aliquots מ"ל של מעל חמצן קרח עיבוד קר התקשורת להעביר רקמות בין חדר ניתוח מתקן חיתוך.
- יחד עם נוירוגורגן, מראש אופרטיבי את אזור הגידול עבור רכישת מדגם. בחר אזור גידול עם שיפור הניגוד כפי שמוצג על הדמיון הקליני של המטופלG (T1 שלאחר gadolinium תהודה מגנטית הדמיה (MRI) sequences). ניסיון קודם מציע כי האזור הזה מניב רקמת גידול קיימא לעומת רקמות נמק.
הערה: הדור של פרוסות מן הסביבה (סביבתי) החומר הלבן ניסה; עם זאת, autofluorescence רקע ירידה בצפיפות תאים סרטניים הגביל את כלי הניסוי של פרוסות אלה. - השגת רקמת הגידול לקראת תחילת כריתה הגידול. הימנע אוסף של רקמת הגידול חשוף דו קוטבית דו קוטבית, אשר עלול לפגוע הכדאיות רקמות משני פגיעה תרמית. דגימות רקמות שנרכשו במהלך כריתת הגידול הגידולי מדגימות יכולת משופרת בהשוואה לרקמות שנרכשו מן resculations ארוך הגוש en . תצפית זו עשויה להתייחס הפרדת גידול רקמת הגידול של זרימת הדם כתוצאה כריתה כירורגית זמן מורחב לרכישה.
- אם תרצה, התווית ולאחסן רקמות הגידול צינורות חרוטי נפרד לבודד דגימותמאזורים סרטניים שונים. ( כלומר, רקמה גידולים שטחית לעומת עמוקה). מיקומי רקמה מדויקים ניתן להקליט אם / כאשר ניווט כירורגי תוך -
3. הכנת תרבות פרוסה
הערה: פרוטוקול זה מחייב שימוש של רקמות אנושיות טריות. כל הדגימות הן presumed להיות זיהומיות, ויש לטפל בהם על פי פרוטוקולים פתוגניים הדם המוביל דם אוניברסלי. ציוד מגן אישי מתאים צריך להיות לבוש בכל עת. מלקחיים אזמלים צריך להיות חשוף 15 דקות של אור UV לפני השימוש. במהלך השימוש, לרסס לסירוגין את הכלים עם אתנול 70% (EtOH), המאפשר זמן לנוזל להתאדות לפני השימוש. תהליך חיתוך מתבצע בצורה סטרילית למחצה ניצול מכסה המנוע זרימה למינרית אופקית עם אוויר מסונן.
- מקום חתיכות רקמות הגידול בצלחת פטרי עם קרח עיבוד קר. כדי לשטוף את רקמת הגידול ולמזער תאי דם אדומים חסיד, אותנופיפטה אה בעדינות להחליף ולהשליך את התקשורת בצלחת פטרי שלוש פעמים.
- באמצעות איזמל, לחתוך חתיכות הגידול לתוך צורות תיבת מלבני. חתוך חתיכות רקמות כדי משוער 3 מ"מ x 3 מ"מ x 10 מ"מ. בזהירות להסיר את כל כלי המצורפת באמצעות כריתה או מתיחה עדינה עם מלקחיים בסדר.
- פיפטה 5 - 7 מ"ל של 37 מעלות צלזיוס C לתוך קוביית בצורת קטן (~ 2 ס"מ 3 ) עובש פלסטיק הטבעה. אישור הטמפרטורה של פתרון agarose הוא לא יותר מ 37 מעלות צלזיוס עם מדחום סטרילי לפני השימוש.
- אפשר agarose לשבת במשך כ 1 דקות על מצע של קרח.
- מקום 2 - 4 רקמות הגידול "רצועות" לתוך agarose עם ציר ארוך בכיוון אנכית.
הערה: רצועות רקמות נוטים "לשקוע" ב agarose לפני מיצוק. כדי למנוע את הסיבוך הזה, להחזיק באופן זמני את רצועת רקמות בכיוון אנכי עד agarose הוא התמצקות נוספת. - שמור את הרקמה המכילה agarose עובש על המיטה של קרח עבור 2 - 5 ק"מN כדי להקל על התמצקות.
- הסר עובש מן הקרח בעדינות להסיר את הבלוק agarose ידי חיתוך הצדדים של הטופס עם אזמל. הימנע הצבת כוח מופרז על הבלוק, אשר עשוי לשבור את agarose.
- השתמש ירידה נדיבה של דבק cyanoacrylate כדי להצמיד את בלוק agarose לצלחת vibratome הדגימה. תן דבק להגדיר כ 1 - 2 דקות.
- מלאו את המאגר vibratome עם קר כקרח עיבוד התקשורת להטביע את הבלוק agarose מודבקת לצלחת הדגימה.
- במהלך חיתוך, בועה 95% O 2 /5% CO 2 תערובת גז לתוך המאגר vibratome דרך פיפטה פלסטיק סטרילי trimmed.
- הגדר את עובי פרוסת vibratome ל 300 - 350 מיקרומטר.
- כוונן את מהירות הלהב מראש ואת משרעת הלהב לפי עקביות רקמות. "Stiffer" GBM רקמות דורש איטי מראש במהירויות מראש ומשרעת גבוהה יותר. מהירות הלהב המדויק והגדרות המשרעת ישתנו בהתאם למפרטי vibratome.
הערה: מספר בעיות נפוצות מתעוררות בעת החיתוך. אם רצועת רקמה dislodges מתוך בלוק agarose, ניסיון הטבעת הרקמה ב agarose ריכוז גבוה יותר. אם פרוסות הגידול הן עבות יותר מאשר הרצוי (מכונת להגדיר), או הם אסימטריים, להגדיל את משרעת ולהפחית את מהירות הלהב vibratome. כדי להבטיח רקמת הגידול אינו תקוע או "נגרר" על ידי בעל הלהב, כמו חיתוך מתרחש, בזהירות המיקום microspatula בין להב הלהב לפרוסה, כמו הלהב נע. - העברת פרוסות רקמות לצלחת פטרי עם קרח עיבוד קר עיבוד באמצעות microspatula נירוסטה.
- להשיג 6-גם צלחות המכיל PTFE מוסיף equilibrated פרוסת תרבות התקשורת מחממה (כפי שהוכן בסעיף 2, שלב 4).
- צלחת פרוסות רקמות באמצעות microspatula נירוסטה. מזעור מגע ישיר מניפולציה של רקמות באמצעות מכחול קטן קטן זיפים כדי ליצור "נוזל גל" בעדינות לדחוף את הפרוסה מן המרית aNd אל להכניס את התרבות.
הערה: מזעור כמות של עיבוד חומרי הציג על גבי תרבית רקמות להוסיף. אם כמויות מופרזות של התקשורת מועברים גורם פרוסות לצוף, להשתמש פיפטה פסטר סטרילית להסיר מדיה. - להחזיר את 6 צלחות היטב המכיל פרוסות הגידול לחממה שמרו על 37 מעלות צלזיוס עם 5% CO 2 אווירה.
הערה: כל פרוטוקול הטבעה פרוסת צריך להיות מושלם בתוך 90 דקות של רכישת רקמת הגידול מחדר הניתוח.
4. תחזוקה תרבות פרוסה
- לאחר 12 - 24 שעות, להעביר את התרבויות פרוסה על ידי אחיזה כל שולי להוסיף עם מלקחיים סטרילית, ולהעביר צלחות המכילות מדיה פרוסה טריים התקשורת תחזוקה. ודא את התרבות פרוסה תחזוקה התקשורת aliquoted לתוך כל equilibrates גם באינקובטור לפחות 15 דקות לפני העברת מוסיף.
- העברת מוסיף צלחות 6-טוב חדש עם טריים equilibrated פרוסה קולTure התקשורת כל 48 שעות.
- אם תרצה, aliquot הישן פרוסה תרבות התקשורת עם פיפטה לשימוש מיידי מבחני ביוכימיים ( כלומר ELISA) או להקפיא ב -80 מעלות צלזיוס לשימוש עתידי.
5. תא תאים תיוג באמצעות חלבון פלואורסצנטי הירוק ביטוי רטרווירוס
הערה: זמן לשגות מיקרוסקופיה לניתוח הגירה תא הגידול דורש יציב, לטווח ארוך תיוג פלורסנט של תאים בתוך התרבות פרוסה. השימוש רטרווירוס מוצע כי זה מדביק באופן סלקטיבי חלוקת תאים, ובכך להעשיר תיוג פלורסנט בתוך האוכלוסייה התא הגידול בניגוד microglia או סוגי תאים אחרים הנמצאים בתוך הפרוסה. סטנדרטיזציה של זיהום עולה כי titer ויראלי של 10 4 CFUs / תוצאות μL מספיק חלבון ירוק ביטוי חלבון למעקב וניתוח של נדידת תאים. גידולים נגיפיים מוגברים, שימוש בוירוס לא סלקטיבי ( כלומר , אדנווירוס, lentivirus) או otפירושה של תיוג כל התאים עשוי למנוע זיהוי של גבולות תאים ברורים במהלך הגירה, ובכך לסבך את הניתוח. השימוש סמנים ניאון חלופי ניתן להשתמש אופטימיזציה לפי הצורך.
- השג רטרווירוס לזיהום של פרוסות הגידול באמצעות פרוטוקולים סטנדרטיים 5 , 14 או ממקור זמין מסחרית. לדלל את supernatant ויראלי על ידי הוספת נפח מתאים לתוך המדידה העצבית unsupplemented להשיג titer ויראלי של 10 4 CFUs / μL.
- בין 7 - 10 ימים של תרבות להדביק את התרבויות פרוסה הגידול של עניין עם 5-10 μL של וירוס (10 4 CFUs / μL). מניחים את הנגיף בעדינות dropwise על פני השטח של כל פרוסת רקמות. הקטנת נפח supernatant הוסיף אם הפרוסה צף על פני השטח של הכנס. חזור צלחות המכילות תרבויות פרוסה חממה.
- להעריך את הפרוסות עבור תאים שכותרתו תאים מתחילים בשעה 24 שעות לאחר זיהום ויראלי (ראה סעיף 6). עיכוב הפעם ישתנה תלוי שילוב ויראלי פלואורסצנטי ביטוי גנים קינטיקה. עבור מבנים ויראליים המשמשים כאן, 72 שעות נדרש לראות אות פלואורסצנטי חזקים עם מיקרוסקופ epifluorescence סטנדרטי.
הערה: לעתים רחוקות, פרוסות להציג התפלגות פריפריה בעיקר של תאים שכותרתו ויראלי, אשר יכול לסבך הדמיה confocal. כדי למנוע את הסיבוך הזה, מנסים להפחית את עובי הפרוסה וריאציה עובי על פני הפרוסה. אם תרבות פרוסה יש אזור עבה ליד המרכז, זה עשוי למנוע חדירה מזין נאותה, ובכך להגביל את האוכלוסייה של חלוקת תאים סרטניים פעיל. Assay איכותי המסך עבור סיבוך זה הוא תוספת של מגיב צבע tetrazolium ( כלומר MTT) לתקשורת תרבות פרוסה. אזורים של פרוסה כי לא הופכים כחול לאחר הוספת מגיב מצביעים על חוסר פעילות מטבולית בריאות הפרוסה נפגעת.
הערה: לאחר התמרה מוצלחת ובריאות של התרבות הוא אישר, תאים עשויים להיות צילמו בתנאי שליטה, ואחריו תקופה שווה של הדמיה בתנאים הטיפול. באמצעות פרוטוקול זה, תאים צילמו בהצלחה במעקב במשך 12 שעות בכל מצב. עם זאת, תקופות קצרות או ארוכות יותר של הדמיה מניפולציה סביבתיים עשוי גם להיות אינפורמטיבי.
- טעינת המיקרוסקופ
- לפני ההדמיה, במקום 1 מ"ל של מדיה פרוסה טריים לתוך צלחת תחתית זכוכית.
- אפשר התקשורת בצלחת התחתונה זכוכית כדי לאזן בחממה במשך 15 דקות.
הערה: בשלב זה מסיס תיוג סוכנים, כגון lectins מצומדות fluorescently ( כלומר Isolectin IB 4 עבור תיוג microglia) או נקודות ליגנד קוונטית מצומדות, ניתן להוסיף את התקשורת תרבות פרוסת זיהוי של התאתת אוכלוסיות קטנות במהלך ההדמיה. - מעבירים את הכנס כדי להיות צילמו על צלחת תחתית זכוכית באמצעות מלקחיים סטרילית במנדף זרימה למינרית. מעבירים את הצלחת לשלב המיקרוסקופ.
- לשמור על תרבויות פרוסה ב 37 מעלות צלזיוס ו 5% CO 2 אווירה במיקרוסקופ אטום הבמה חממה העליון. לנצל סטרילי H 2 O לחות של חדר הדגירה אם זמין כדי למנוע אידוי מדיה מוגזמת (חשוב במיוחד עבור ניסויים הדמיה יותר).
- לנצל מיקרוסקופ confocal עם עבודה ארוכה מרחק 10X האוויר המטרה עירור לייזר עבור פוטון יחיד ו / או פוטון רב.
הערה: ודא כי העדשה המיקרוסקופ אובייקטיבי מספק מרחק עבודה נאותה. כתוצאה מן הגובה הנוסף של חממה הבמה, צלחת תחתית זכוכית, ואת התרבות רקמות להוסיף, עבודה ארוכה יעדי המרחק הם קריטיים. - אבטח את צלחת התחתונה זכוכית, להסיר את צלחת פטרי פלסטיק לכסות, ולכסות עם גז,קרום חדיר.
- רכישת תמונה
- השתמש במיקרוסקופ כדי לבחון ויזואלית את הפרוסה, ולאתר שדה מתאים עם צפיפות נאותה של תאים סרטניים שכותרתו fluorescently בין קצה הפרוסה למרכז. הימנע שדות הדמיה בקצה של פרוסה, בשל רגישות מוגברת של משמרות רקמות במהלך ההדמיה. פרוסות רקמות ניתן להשתמש כדי להגביל את המעבר הזה.
- השתמש בתוכנת הדמיה במצב ניתוח רב ממדי כדי להגדיר את הראשון (התחתון) ואת האחרון (העליון) Z- מחסנית גבולות, כך שכל עמדות להיות צילמו להכיל גלוי ניאון האות הסלולר. הדמיה באמצעות 150 - 200 מיקרומטר של פרוסה, עם Z- צעד קבוע של 10 מיקרומטר בתנאי רזולוציה נאותה עבור מעקב אחר שבילי תאים (זה יכול להיות מותאם לצרכי הדמיה בודדים).
- אם המיקרוסקופ יש שלב ממונע, להבטיח זמן הולם מותר עבור כל Z- מחסנית הרכישה. הגדר את מרווח הזמן בין הרכישות לשיוויוןזמן סריקה למיקום x מספר עמדות לתמונה ( כלומר אזורים סרטניים מדומים).
הערה: לקבלת עירור סימולטני של fluorophores ירוק ואדום, לנצל את הקו כפול קו לייזר תוכנית סריקה, עם 488 ננומטר סימולטני ו 633 ננומטר ננומטר. אורך הגל של עירור לייזר שנבחרו ישתנו בהתאם חלבונים ניאון בודדים לידי ביטוי. - לשמור על כוח לייזר אחיד הגדרות חור חריץ confocal בין אזורי הגידול הדומה. לנצל את צריכת החשמל הלייזר הנמוך ביותר הנדרש כדי לקבוע בבירור את גופי התא הגידול ותהליכים להגביל phototoxicity. יחידות ספציפיות של הדמיית הדמיה ( כלומר , הגדרות חשמל וקונפאליה) ישתנו בהתאם למיקרוסקופ ומפרט מקור הלייזר.
- פיצוי על אידוי מדיה פוטנציאליים על ידי הוספת 2 - 3 "חיץ" Z- מחסנית צעדים במטוסי מוקד לקידום לקראת המטרה. זה מונע למעשה את הרקמה לעזוב את טווח Z- מחסנית הרכשיונים במישור האנכי.
7. תמונה שלאחר עיבוד מעקב תאים סרטניים
הערה: רבים מערכות הדמיה confocal מצוידים תוכנה קניינית עיבוד תמונה. שלבי העיבוד הנזכרים להלן מהווים פרוטוקול כללי, אשר ניתן לבצע על פני פלטפורמות תוכנה. הוראות ספציפיות יינתנו עבור פלטפורמות קוד פתוח, NIH ImageJ ו- MTrackJ 15 .
- פתח קובץ Z-stack. ב- ImageJ, לחץ על "תמונה ← ערימות → פרוייקט Z". בחר את הראשון ואחרון Z- מחסנית לכלול, ובחרה "מקס אינטנסיביות" כסוג הקרנה. התוצאה היא עיבוד בשם היטל עוצמת מקסימלית (MIP). יצירת MIP מכל קבוצה של Z- מחסנית תמונות שנתפסו בכל אזור צילמו.
- לשרשר את MIPs מכל אזור כדי ליצור סדרה של זמן. לחץ על "תמונה → ערימות → תמונות לערימה".
- זהה את המיקום באופן ידנישל הגוף התא "centroid" על ידי בחירת נקודת מרכז קרובה חזותית של הגוף תא הגידול. זה נעשה על ידי לחיצה על הגוף התא באמצעות "להוסיף" פונקציונליות המסלול של MTrackJ (קוד פתוח תוסף עבור NIH ImageJ).
- לחץ כדי לסמן את מיקום גוף התא בכל מסגרת של סדרת התמונות. זה יוצר "מסלול" ייחודי לכל תא. ברצף, סמן את תא הגוף מיקומים של התא הבא. חזור על תהליך זה עד למעקב אחר כל נתיבי ההעברה של תאים.
- לאחר אוכלוסייה של תאים במעקב באזור נתון הגידול מיקרו, לייצא את כל הקואורדינטות מסלול התא באמצעות "למדוד" הפונקציה של MTrackJ. שמור את הקובץ כפורמט .xls כך הנתונים הגולמיים ניתן לנתח באמצעות גיליון אלקטרוני או תוכנות שנוצרו על ידי המשתמש.
- השתמש בקואורדינטות שהוקלטו לכל נקודה לאורך מסלול ההעברה של תא, כדי לבצע ניתוחים כמותיים, כולל הגזירה של מהירות הגירה, כיווניות והגירה אחרתמדדים, כמתואר פארקר ואח 16.
הערה: כל המרחקים והמהירויות המחושבים הם מתחת לאומדנים של הערכים בפועל. דבר זה טמון בהפיכתן של תמונות תלת-מימדיות (ונתיבי הגירה) לנתונים דו-ממדיים באמצעות יצירת תחזיות אינטנסיביות מקסימליות.
תוצאות
הקבוצה שלנו יצרה בהצלחה תרבויות פרוסה של מעל 50 חולים עוברים כריתה ראשונית GBM. זה פרוסה דור, תרבות, retroviral תיוג, הדמיה, פרוטוקול ניתוח הגירה כבר יעיל לתוך זרימת עבודה לשחזור ( איור 1 ). באופן ביקורתי, אלה פרוסות GBM organotypic להפגין קונקורדנציה עם רקמת הגידול שמקורם בכל התרבות, כולל תחזוקה של סימפטומים פתולוגיים microglia עד 15 ימים בתרבות ( איור 2 ). בנוסף, יש לנו utilised מערכת זו כדי לבצע מבחני תפקודית של תגובת הגידול לשינויים microenvironmental. כערך של שלמות פיזיולוגית, בדקנו כיצד תרבויות פרוסות GBM מגיבות להיפוקסיה (1% O 2 ) על ידי מדידת הייצור של גורם גדילת כלי הדם האנדותל (VEGF), תהליך המתרחש בשפע בתוך המיקרו-סביבה ב- GBM ב- vivo 17 ,"18. הוכחנו כי על ידי הנחת התרבויות פרוסה בתנאים היפוקסיים, פרוסות רכוב תגובה פיזיולוגית מהירה, שגורמת שחרור VEGF לתוך התקשורת ( איור 3 ).
כדי להעריך את ההיבטים האיכותיים והכמותיים של הגירה תא הגידול אנו ניצלו את זמן לשגות תמונות כדי ליצור מפות הגירה מפורט. מפות אלה מסמנות את כל תאי ה- GBM שנמצאים במעקב בתוך גבולות של מיקרואורגיונים סרטניים (1 מ"מ 2 ), ומציגים ראיה סטטית של התנהגות הנדידה הדינמית של אוכלוסיית הגידול. מדדים כמותיים של מהירות הגירה וכיווניות (עקירה תא / מרחק כולל נסע) חושבו עבור כל תא, מה שמאפשר חקירת שינויים בפרמטרים הגירה ברחבי אזורים סרטניים, דגימות הגידול, בתגובה לטיפול ( איור 4 ).
תא תיוג פרוטוקול הדמיה desCribed כאן גם מספק מספיק רזולוציה מרחבית וטמפורלית להעריך שינויים מורפולוגיה התא במהלך הגירה דרך microenvironment הגידול הטבעי. ראינו את נוכחותם של תאים סרטניים נייחים מבחינה מורפולוגית ו microglial intermingled בתוך התרבות פרוסה ( איור 5 א ). תנועת תאי הגידול התאפיינה בתהליך "חיפוש והתפוצצות", שכלל בליטה חוזרת ונשנית של פילופודיה מתא סטטי, ואחריו תקופה קצרה של תנועה יעילה. אזורים הדמיה פרוסה על כל 10 דקות גם סיפקו רזולוציה טמפורלית נאותה כדי להקליט זמן לשגות תמונות של תאים סרטניים העוברים חלוקת התא. תאים אלה מחלקים נעצר מן ההגירה, השלמת mitosis, ובתאי הבת מחדש יזום הגירה ללא דיחוי, כל בתוך מסגרת זמן 3 שעות ( איור 5D ). לעומת זאת, microglia נודדים במהירות גבוהה ועקבית יותר, עם כיווניות נמוכה יותר מאשר תאים סרטניים סמוכים,הוכחת ההגירה שלהם לא יעיל יחסית ( איור 5 ג, 5E-G ). תצפיות אלו עשויות להיות חשובות להשגת תובנה לגבי הביולוגיה שבבסיס תגובות לטיפול בחולה או בתא.
לבסוף, השתמשנו בפרוטוקול זה להפגין השתנות המטופל אל המטופל פרמטרים הגירה תאים ברמת האוכלוסייה, כולל מתאם של הגדילה הגדילה הגופנית גורם הגדילה EGFR (עם EGFR ) עם פוטנציאל הגדילה הנדידה של תאים סרטניים 16 . בנוסף, מיקרוסקופית זמן לשגות של פרוסות הגידול לפני ואחרי הטיפול עם התרופה נגד פולשני, gefitinib, הפגינו ירידה משמעותית הגירה, אשר היה ספציפי EGFR מוגבר פרוסות הגידול 16 .
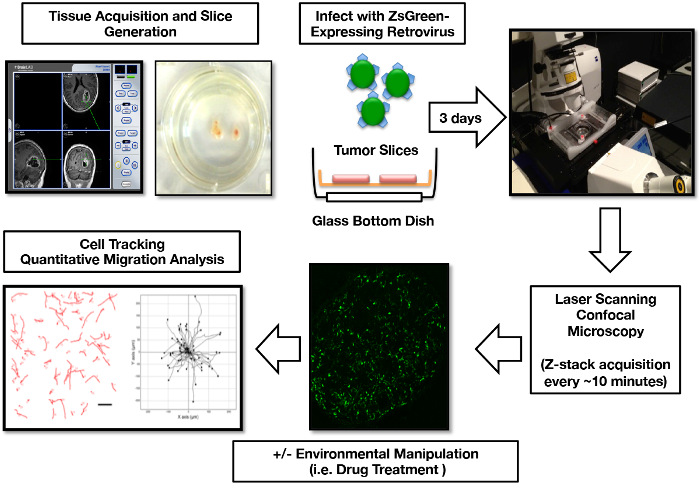
איור 1: Rong> אדם GBM Organotypic פרוסה תרבות זיהום, הדמיה, ותא הגירה זרימת עבודה ניתוח. רקמת הגידול ממוקמת לאזור מסוים באמצעות ציוד ניווט תוך-עיני. שבוע לאחר פרוסה שלאחר, הרושם ZsGreen להביע הוסיף לתרבויות פרוסה לתייג את התאים הסרטניים פעילים mitotically. 3 ימים לאחר ההדבקה, פרוסות מוכנים הדמיה confocal. נתוני הדמיה 3D הוא שלאחר עיבוד לתמונות 2D עבור מעקב אחר נתיב העברת תאים, הדור של תאים הגירה תאים הגידול, וחישוב של תאים פרמטרים הגירה תא. חלקים של דמות זו פורסמו במקור ב Parker et al , 2013 16 ו לשכפל באישור של אוניברסיטת אוקספורד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
"1"> 
איור 2. האדם GBM פרוסות Organotypic לשמור על תכונות היסטולוגית לאורך תרבות Vivo לשעבר . ( A ) בניגוד לרמות MRI משופרת שימשו כדי לתעד ולתעד את האזור (ים) של רכישת רקמות (חץ). ( ב ) מכתים H & E של רקמות התורם הראשוני (OR) ופרוסות ביום 8 של התרבות מתרבות פרוסה שנוצר הרקמה המתקבל באזור מודגשת א ( ג ) Microenvironmental תכונות פתולוגיות הסלולר של GBM, in vivo , נשמרים לאורך תרבות פרוסה. (I, II) אימונוהיסטוכימיה עבור CD68, מיקרוגליה / מאקרופאג סמן, בהגדלה נמוכה (למעלה) גבוה (התחתון), מדגים התמדה מיקרוגליגל פרוסות לאחר 15 ימים של תרבות. מכתים H & E ביום 4 של תרבות פרוסה מאשרת תחזוקה של נמק pseudopallisading, פאטוההיגיון ההיגיון של GBM, הן בהגדלה נמוכה (iii) גבוה (iv). סולם ברים = 200 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 3: תרבויות GBM האדם פרוסה Secret VEGF בתגובה היפוקסיה. ( א ) הניסוי מנוצל מוסיף תרבות הפרט המכיל 3 דומה בגודל פרוסות הגידול שנוצר מאותו אזור הגידול. הפרוסות נשמרו נורמוקסיה במשך 12 שעות, ואחריו שני 12 שעות של היפוקסיה, עם התקשורת החדשה נוספה לפני כל מרווח. ( B ) הפרשת VEGF לתקשורת הנמדדת על ידי ELISA (ממוצע סטיית תקן) מתרבויות פרוסה שנוצרו משני גידולים מייצגים,Hypoxia deroxia מאשר noxoxia (p <0.05). ( ג ) ניתוח משולב של תרבויות פרוסה מ 4 גידולים שונים הפגינו הפרשת VEGF לאחר 12 שעות רצופות של היפוקסיה בהשוואה לנורוקסיה (p <0.05). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 4: נתיב תא הגידול מסלול נתונים מאפשר קביעת כמותית של מהירות התא ו כיווניות. ( א ) תאי הגידול עם כיווניות של 1 מייצגים יעילות מושלמת לאורך וקטור ישר, ואילו אלה עם כיווניות נמוכה לעסוק נתיבים מתפתל יעיל, כפי המיוצג זה סכמטי 16 . הודפס באישור מאוניברסיטת אוקספורדללחוץ. ( ב ) ניתוח של נתיב מסלול נתיב נתונים (רזולוציה "נמוכה" ~ 55 דקות מעקב תא intervals) מדגים השונות הסלולרית במהירות כיווניות. ( ג ) כיווניות לעומת מהירות הגירה עבור כל מסלול התא הוא זממו כדי לחזות התנהגות הגירה על פני האוכלוסייה התא (כל נקודה מייצג תא בודד). אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 5: Microglia בתוך תרבויות SlM GBM מאופיינים על ידי מהירות הגירה גבוהה כיווניות נמוכה יחסית לתאי גידול. ( A ) שכפול תאים סרטניים להביע באופן סלקטיבי ZsGreen רטרווירוס ו microglia שתייגת עם Isolectin-I B 4 - 647 מצומד קיים intermingled בגידול נציג מיקרו באזור מן התרבות פרוסה נציג. ( BC ) שבילים של GBM במעקב בנפרד ( B ) ו microglia ( C ) באותו הגידול מיקרו באזור להראות התנהגויות הגירה מתואמת. סולם ברים = 200 מיקרומטר. ( ד ) הפסקות תאים בתאי הגירה פעילים, משחזר את התהליכים (ראש חץ), עובר חלוקה לתא, ושני תאי בת נודדים בכיוונים מנוגדים (חיצים). סולם ברים = 50 מיקרומטר. ( E ו- F ) Microglia מדגימה את מהירות ההגירה המוגברת (p <0.0001) ואת הכיווניות המופחתת (p <0.0001) בהשוואה לתאי גידול באותו אזור. (G) ההפצה של תאים תאים microglial מבוסס על מהירות כיווניות מדגים פנוטיפים נודדות ייחודי של שתי אוכלוסיות תאים.Et = "_ blank"> אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Discussion
תרבויות פרוסה Organotypic מרקמת סרטן האדם לספק פלטפורמה אטרקטיבית underutilized עבור ניסויים טרנסציוניים pre-Clinical. ההבנה של התנהגויות ברמת האוכלוסייה של תאים סרטניים לגבי הגירה, התפשטות, ומוות של תאים microenvironment הגידול המקומי הוא חסר. באופן ביקורתי, לימוד תגובת הגידול לטיפול באופנה דינמית, נפתרת בזמן ברמת ההתנהגות של התא, עשוי לשפוך אור על מנגנונים חדשים של התנגדות לטיפול. תרבויות גידול פרוסה אנושית לספק קישור בין תהליך המחלה האנושית הנוכחית vivo לשעבר בטכניקות דוגמת vivo 19 . לאחרונה אימתנו את הטכניקה המתוארת כאן כשיטה לחקר נדידת GBM, ודיווחו לראשונה על שינויים בין גידולים בין גידולים שונים בהתנהגות נדידת תאים הקשורה להגברה של EGFR ולאותות 16 . מחקר זה גם ניצל את המודל תרבות פרוסה לבחון את הפאטיNt ספציפיות של מעכב EGFR, gefitinib, כטיפול אנטי פולשני פוטנציאלי עבור GBM 16 .
כמה מן החסרונות הנפוצים במהלך פרוסת רקמות, זיהום retroviral, הדמיה, פרדיגמה ניתוח התמונה כבר דנו לעיל. עם זאת, פרוטוקול זיהום retroviral מחייב תשומת לב נוספת. בהתחשב וריאציה המטופל אל החולה, זה עשוי להוכיח אתגר טיטרציה הצפיפות של תאים סרטניים שכותרתו ויראלי בתוך כל פרוסה. אם מספרים מספיקים של תאים מתויגים על ידי לבנות ויראלי, להוסיף נוסף 5-10 μL aliquots של supernatant retroviral על פני השטח של כל פרוסה היומי עד הריכוז הרצוי של תאים סרטניים שכותרתו מושגת. בתרבויות פרוסה העיקרי, אחוז התאים משכפל הוא בדרך כלל נמוך יותר מאשר שורות תאים הופכים, ובכך להגביל את המשנה של תאים מתירנית שילוב רטוברויאל בכל נקודת זמן. לחלופין, אם תאים רבים מדי מתויגים, מניעת accתיחום אוראט של נתיבי נדידת תאים, לדלל את supernatant ויראלי עם התקשורת העצבית כדי להשיג טיטר יעיל נמוך. הגידול הקשורים microglia שולבו חלבון פלואורסצנטי להביע רטרווירוס בתדירות של כ 1% מכלל התאים שכותרתו. הצלחנו לבודד מבחינה ויזואלית תאים אלה לניתוח נפרד על ידי שימוש microinia מחייב lectin לנתח שלאחר הדמיה מנתח נתונים ( איור 5 ).
הגידול microenvironment הגידול כולל היבטים של משלוח מזין, אינטראקציות תא תא, מטריקס תאיים כל לשחק תפקיד הפתוגנזה של GBM 20 . האדם ישיר תרבויות GBM פרוסה לחסל את הצורך passaging בתוך מודלים בעלי חיים קטנים או תרבות תאים מופץ, תוך מתן סיכום קרוב של microenvironment הגידול האנושי. יתר על כן, תרבויות פרוסה לספק גישה אחידה חומרים מזינים על פני דגימות, תוך שמירה על התא תא תא אינטראקציות ECM. על ידי הקטנת varIations בגישה הסלולרית אל חומרים מזינים אשר ידועים להתרחש בתוך גידולים, אנו מציעים הבדלים נצפו בתרבויות לשפוך אור על ההבדלים המהותיים בין התאים התא הגידול ( כלומר הגירה) ברמת האוכלוסייה. עם זאת, פרשנות נתונים שנאספו על פני תרבויות פרוסה שנוצר מגידולים אנושיים הוא מסובך על ידי הטרוגניות בין interra ו intra-tumoral. באופן ביקורתי, מחקר נוסף נדרש כדי לאפיין את הפוטנציאל הגנטי epigenetic משמרות שעלולות להתרחש במהלך vivo לשעבר תחזוקה של תרבויות גידול פרוסה האדם.
השימוש בתרבויות פרוסה של גידול אנושי במקביל לניסוי קליני שלב I / II הוא אסטרטגיה מבטיחה לקשר בין פרמטרים לפרוסות לבין תוצאות קליניות של המטופל. אימות של פרמטרים אלה פוטנציאל / ניבוי פוטנציאליים הוא הכרחי לפני תרבויות פרוסה ניתן להשתמש כדי להתאים אישית את הטיפול האונקולוגי. העבודה שלנו, כמו גם של אחרים, מדגימה הכדאיות של אימות ביומרקרSup class = "xref"> 21, וכן בדיקה מהירה vivo לשעבר של סוכני טיפול בתרבויות פרוסה מ GBM 9 , 16 . דומה טכניקות פרוסה אנושית תרבות באמצעות ריאות 22 , המעי הגס 22 , הראש והצוואר 23 , השד 24 , סרטן הערמונית 25 רקמות ממליצים גישה זו היא generalisable על פני סרטן האדם.
Disclosures
למחברים אין מה לגלות.
Acknowledgements
ברצוננו להודות ד"ר לי Niswander וד"ר ראדה Massarwa על המומחיות הטכנית שלהם תרומות לפרוסה פרוטוקול confocal הדמיה פרוטוקול המתואר כאן. תודה רבה לד"ר קאלן Dionne שסיפק מומחיות לגבי אופטימיזציה של המוח חיתוך רקמת הגידול ופרמטרים תרבות.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM High Glucose | Invitrogen (Gibco) | 11960-044 | |
| Neurobasal-A Medium, minus phenol red | Invitrogen (Gibco) | 12349-015 | |
| B-27 Supplement (50x), serum free | Invitrogen (Gibco) | 17504-044 | |
| Penicillin-Streptomycin (10,000 U/mL) | Invitrogen (Gibco) | 15140-122 | |
| GlutaMAX Supplement | Invitrogen (Gibco) | 35050-061 | |
| L-Glutamine (200 mM) | Invitrogen (Gibco) | 25030-081 | |
| HEPES (1 M) | Invitrogen (Gibco) | 15630-080 | |
| Nystatin Suspension | Sigma-Aldrich | N1638-20ML | 10,000 unit/mL in DPBS, aseptically processed, BioReagent, suitable for cell culture |
| UltraPure Low Melting Point Agarose | Invitrogen (Gibco) | 16520-050 | Melts at 65.5 °C, Remains fluid at 37 °C, and sets rapidly below 25 °C. |
| Isolectin GS-IB4 from Griffonia simplicifolia, Alexa Fluor 647 Conjugate | Thermo Fisher (Molecular Probes) | I32450 | Used in media to label Microglia/Macrophages |
| pRetroX-IRES-ZsGreen1 Vector | Clonetech | 632520 | |
| Retro-X Concentrator | Clonetech | 31455 | Binding resin for non-ultracentrifugation concentration of viral supernatants |
| pVSG-G Vector | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| GP2-293 Viral packaging cells | Clonetech | 631530 | part of the Retro-X Universal Retroviral Expression System |
| Cyanoacrylate Glue (Super Glue) | Sigma-Aldrich | Z105899 | Medium-viscosity |
| Equipment | |||
| Peel-A-Way Embedding Mold (Square - S22) | Polysciences, Inc. | 18646A-1 | Molds for tumor sample embedding |
| Stainless Steel Micro Spatulas | Fisher Scientific | S50823 | Bend instrument 45 degrees at the neck of the spoon blade |
| Curved Fisherbrand Dissecting Fine-Pointed Forceps | Fisher Scientific | 08-875 | |
| Single Edge Razor Blade (American Safety Razors) | Fisher Scientific | 17-989-001 | Blade edge is 0.009" thick. Crimped blunt-edge cover is removed before loading onto vibratome. |
| Leica VT1000 S Vibratome | Leica Biosystems | VT1000 S | |
| Hydrophilic PTFE cell culture insert | EMD Millipore | PICM0RG50 | 30 mm, hydrophilic PTFE, 0.4 µm pore size |
| 35 mm Glass Bottom Dishes | MatTek | P35G-1.5-20-C Sleeve | 20 mm glass diameter. Coverslip glass thickness 1.5 mm |
| LSM 510 Confocal Micoscope | Zeiss | LSM 510 | 10x Air Objective (c-Apochromat NA 0.45) |
| PECON Stagetop Incubator | PeCON Germany | (Discontinued) | Incubator PM 2000 RBT is a comprable product designed for use with Zeiss Microscopes. |
References
- Beadle, C., et al. The role of myosin II in glioma invasion of the brain. Mol Biol Cell. 19, 3357-3368 (2008).
- Farin, A., et al. Transplanted glioma cells migrate and proliferate on host brain vasculature: a dynamic analysis. Glia. 53, 799-808 (2006).
- Panopoulos, A., Howell, M., Fotedar, R., Margolis, R. L. Glioblastoma motility occurs in the absence of actin polymer. Mol Biol Cell. 22, 2212-2220 (2011).
- Ivkovic, S., et al. Direct inhibition of myosin II effectively blocks glioma invasion in the presence of multiple motogens. Mol Biol Cell. 23, 533-542 (2012).
- Assanah, M., et al. Glial progenitors in adult white matter are driven to form malignant gliomas by platelet-derived growth factor-expressing retroviruses. J Neurosci. 26, 6781-6790 (2006).
- Chaichana, K. L., et al. Preservation of glial cytoarchitecture from ex vivo human tumor and non-tumor cerebral cortical explants: A human model to study neurological diseases. J Neurosci Methods. 164, 261-270 (2007).
- Grube, S., et al. Overexpression of fatty acid synthase in human gliomas correlates with the WHO tumor grade and inhibition with Orlistat reduces cell viability and triggers apoptosis. J Neurooncol. 118, 277-287 (2014).
- Hovinga, K. E., et al. Inhibition of notch signaling in glioblastoma targets cancer stem cells via an endothelial cell intermediate. Stem Cells. 28, 1019-1029 (2010).
- Merz, F., et al. Organotypic slice cultures of human glioblastoma reveal different susceptibilities to treatments. Neurooncol. 15, 670-681 (2013).
- Xu, J., et al. Vorinostat modulates cell cycle regulatory proteins in glioma cells and human glioma slice cultures. J Neurooncol. 105, 241-251 (2011).
- Verhaak, R. G., et al. Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities. in PDGFRA, IDH1, EGFR, and NF1. Cancer cell. 17, 98-110 (2010).
- Gill, B. J., et al. MRI-localized biopsies reveal subtype-specific differences in molecular and cellular composition at the margins of glioblastoma. Proc Natl Acad Sci USA. 111, 12550-12555 (2014).
- Snuderl, M., et al. Mosaic amplification of multiple receptor tyrosine kinase genes in glioblastoma. Cancer cell. 20, 810-817 (2011).
- Kakita, A., Goldman, J. E. Patterns and dynamics of SVZ cell migration in the postnatal forebrain: monitoring living progenitors in slice preparations. Neuron. 23, 461-472 (1999).
- Meijering, E., Dzyubachyk, O., Smal, I., van Cappellen, W. A. Tracking in cell and developmental biology. Sem Cell Dev Biol. 20, 894-902 (2009).
- Parker, J. J., et al. Gefitinib selectively inhibits tumor cell migration in EGFR-amplified human glioblastoma. Neurooncol. 15, 1048-1057 (2013).
- Brat, D. J., et al. Pseudopalisades in glioblastoma are hypoxic, express extracellular matrix proteases, and are formed by an actively migrating cell population. Cancer Res. 64, 920-927 (2004).
- Shweiki, D., Itin, A., Soffer, D., Keshet, E. Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis. Nature. 359, 843-845 (1992).
- Shamir, E. R., Ewald, A. J. Three-dimensional organotypic culture: experimental models of mammalian biology and disease. Nat Rev Mol Cell Biol. 15, 647-664 (2014).
- Charles, N. A., Holland, E. C., Gilbertson, R., Glass, R., Kettenmann, H. The brain tumor microenvironment. Glia. 60, 502-514 (2012).
- Di Cristofori, A., et al. The vacuolar H+ ATPase is a novel therapeutic target for glioblastoma. Oncotarget. 6, 17514-17513 (2015).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proc Natl Acad Sci USA. , 8352-8356 (2010).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. Br J Cancer. 110, 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. J Clin Pathol. 66, 253-255 (2013).
- Maund, S. L., Nolley, R., Peehl, D. M. Optimization and comprehensive characterization of a faithful tissue culture model of the benign and malignant human prostate. Lab Invest. 94, 208-221 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved