Method Article
Протоколы Прочная гербицидам тестирования в различных сорняков
В этой статье
Резюме
A robust and flexible approach to confirm herbicide resistance in weed populations is presented. This protocol allows the herbicide resistance levels to be inferred and applied to a wide range of weed species and herbicides with minor adaptations.
Аннотация
Robust protocols to test putative herbicide resistant weed populations at whole plant level are essential to confirm the resistance status. The presented protocols, based on whole-plant bioassays performed in a greenhouse, can be readily adapted to a wide range of weed species and herbicides through appropriate variants. Seed samples from plants that survived a field herbicide treatment are collected and stored dry at low temperature until used. Germination methods differ according to weed species and seed dormancy type. Seedlings at similar growth stage are transplanted and maintained in the greenhouse under appropriate conditions until plants have reached the right growth stage for herbicide treatment. Accuracy is required to prepare the herbicide solution to avoid unverifiable mistakes. Other critical steps such as the application volume and spray speed are also evaluated. The advantages of this protocol, compared to others based on whole plant bioassays using one herbicide dose, are related to the higher reliability and the possibility of inferring the resistance level. Quicker and less expensive in vivo or in vitro diagnostic screening tests have been proposed (Petri dish bioassays, spectrophotometric tests), but they provide only qualitative information and their widespread use is hindered by the laborious set-up that some species may require. For routine resistance testing, the proposed whole plant bioassay can be applied at only one herbicide dose, so reducing the costs.
Введение
Гербициды наиболее широко используется борьба с сорняками мера, на которые приходится до 50% рынка защиты растений в мире 1. Они относительно недорогие инструменты, избегать трудоемких и трудоемким почвы практики выращивания, и в конечном итоге привести к экономически эффективным, безопасным и выгодным пищевой продукции 2. Тем не менее, большая фенологические и генетическая изменчивость присутствует во многих видов сорняков, вместе с чрезмерной зависимости от использования гербицидов, часто приводит к выбору устойчивых к гербициду населения сорняков. Введение селективных гербицидов с очень конкретной цели метаболического 3-5 резко увеличилось количество случаев сопротивления на протяжении многих лет. На сегодняшний день, 240 видов сорняков (140 двудольных и однодольных 100) по всему миру развивались устойчивость к гербицидам разных сайтах действий (SOA) 4. Это главная забота для борьбы с сорняками и более в общем для устойчивого производства сельскохозяйственных культур.
e_content "> Раннее обнаружение сопротивления на основе надежных тестов, часто выполняемых в теплице, является ключевым шагом в управлении устойчивые к гербицидам сорняков. Различные подходы были разработаны в соответствии с целями, необходимого уровня точности, времени и имеющихся ресурсов, а а также видов сорняков считается 6-12. Тем не менее, когда подтверждение статуса сопротивления новой сорняками биотипу требуется (т.е. группа лиц, которые имеют несколько физиологических характеристик, в том числе способность к выживанию одного или более гербицидов, принадлежащие к Особую группу использовали в дозе, которые обычно контролируют их), прочный целое растение биоанализа должна быть выполнена в контролируемой среде 4, 11.Биотип редко устойчивы только к одному гербициду. Каждый биотипа поэтому характеризуется определенной схеме сопротивление, т.е., количество и тип SoA гербицидов Он устойчив к и от данного сопротивленияУровень каждой гербицида 13. Ранний и надежное определение образцу креста или множественной резистентностью 5, 14 имеет важное значение для управления полевой устойчивости.
Стоит отметить, что сопротивление гербицида не имеет ничего общего с естественной толерантности, что некоторые виды сорняков экспонат к некоторым гербицидам, например, двудольных видов против АССаза ингибирующих гербицидов, видов однодольных против 2,4-D, полевого хвоща против глифосата.
Эта статья представляет собой жесткий подход для тестирования предполагаемый устойчивые к гербицидам биотипов, отобранных в тех областях, где были зарегистрированы плохой контроль по гербицида (ов). Соответствующие варианты в стандартных протоколов в отношении видов сорняков, участвующих представлены. Преимущества более альтернативных методов / протоколов на основе либо в целых растений биоанализа с использованием только одну дозу гербицида, 15 или обработки семян в чашках Петри 8 связаны с более высокой reliability и возможность выведения уровень сопротивления из-за включения двух гербицидов дозах в экспериментах. Тем не менее, для обычного тестирования сопротивления, те же методы могут быть применены только в одной дозе гербицида, таким образом уменьшая затраты.
А также позволяет подтверждение статуса сопротивления, полученная информация может быть использована для оптимизации и следующие шаги исследований и / или разработке эффективных стратегий управления стойкость.
протокол
1. Отбор проб и семян хранения
- Монитор возделанные поля для необоснованного плохой работы гербицидов, то есть не из-за неблагоприятных климатических условий или низких гербицидов качества.
- Сбор семян выборку из одного вида в то время, и назначить уникальный код. Зрелые семена, как правило, собранные до уборки урожая с растений, которые выжили лечения (ы) к гербицидам. Своевременное монитор для наблюдения, если семена пролил материнского растения, когда зрелый.
- Заполните форму для каждого образца с указанием присвоенного уникальный код, название вида, даты сбора, координаты GPS, муниципалитет, имя фермера, размер поля, уровень заражения, культуры, гербицид (ы), используемых в течение сезона и исторических записей поля ,
- Собирают семена от не менее 30 случайно выбранных растений, которые являются репрезентативными поле инвазии. Убедитесь, что образец семян содержит по меньшей мере 5000 зрелых семян. Для облигатных скрещивания видов сорняков(Например, Lolium SPP. Amaranthus или SPP.), Уменьшить количество растений до 10-15, сохраняя общее количество семян около 5000 11.
- Суб-образец поле, если патчи сорняков разбросаны на больших площадях (более гектара) выбраны в качестве различных Гербицидустойчивые биотипы.
- Семена Хранить в негерметичных бумажные мешки меченных уникальный код, присваиваемый.
- Разрешить влаге испариться, но не подвергайте семена с высокой температурой (например, не оставлять их в машине под солнцем) или к экстремальным температурным колебаниям, чтобы избежать индукции вторичного покоя.
- Чистый (удалить семена плевел, де-Халл, и т.д.) и сохранять их при комнатной температуре в сухом помещении. После проведения первых испытаний сопротивления, хранить семена в течение длительного периода времени в темной комнате при температуре 4 ° С, предпочтительно в вакуумной запечатанных полиэтиленовых пакетах. В этом случае семена сохраняют жизнеспособность в течение значительно более длительного времени.
2. Семенной состояния покоя
ПРИМЕЧАНИЕ: покоя семян обеспечивает гибкую и эффективную механизм, который позволяет адаптировать сорняки и сохраняются в агроэкосистемах. Чтобы разорвать покоя и позволяют прорастание семян, различные протоколы должны быть использованы в зависимости от видов сорняков, т.е. типа покоя 16.
Есть три основных способа удаления покоя:
- Яровизация
ПРИМЕЧАНИЕ: Для получения одновременное прорастание и появление всходов, в период посевной яровизации в пределах от нескольких дней до недели необходимо удалить физиологического покоя из многих видов: например,. Амарант запрокинутый, Марь альбомов, Lolium SPP, Овсюг, горца Persicaria , Фаларид рагайоха 17-19. Длительный срок до 15 дней требуется для мак самосейка, Cyperus difformis и Ammania coccinea и до 30 дней для Schoenoplectus mucronatus 20.- Положите несколько деионизированной воды в пластиковой посуды. Вырезать два слоя фильтровальной бумаги и замочить их в воде, снять излишки. Поместите воздушные сушат семена на бумаге. Передача пластиковой посуды в холодильнике при 4 ° С в течение требуемого периода времени.
- Скарификация
Примечание: Некоторые виды сорняков, более непокорных к прорастанию, чем другие из-за механического покоя, т.е. семян характеристик покрытия и необходимость использования химической скарификацией с использованием серной кислоты, чтобы прорасти 21.- Приготовьте стакан с концентрированной серной кислотой (95-98%). Подготовьте стакан, полный воды. Положите семена в конверт из нетканого материала.
- Замачивание например, Echinochloa SPP., Или сорго семена halepense в течение 20 мин или 5 мин, соответственно, в концентрированной серной кислоте.
- Возьмите конверт из стакана с помощью пинцета и положите его в стакан с водой. Открытьконверт, положить семена в небольшом дуршлаг и тщательно промойте их под проточной водой.
- Замочите семена в течение 2 мин в хлороформе. Промыть семена деионизированной водой и высушите их с впитывающей бумагой. Замочить семена в 80% -ной серной кислоты в течение 5 мин.
- Положите семена в небольшом дуршлаг и тщательно промойте их под проточной водой.
- Послеуборочная созревания семян
ПРИМЕЧАНИЕ: Семена других видов сорняков не прорастают вообще в течение нескольких месяцев после наступления срока платежа, независимо от метода, используемого для нарушения покоя.- Храните семена в течение, по крайней мере 3-4 месяцев при комнатной температуре и низкой влажности, а затем следуйте приведенным выше протоколы для состояния покоя (например, Oryza Sativa вар. Sylvatica или P. rhoeas).
3. прорастание семян
- Место семена проращивают для в платик блюда, содержащие 0,6% (м / об) агар с 0,1% нитрата калия (KNO 3) добавил:
- Приготовьте раствор агара 0,6% + 0,1% KNO 3 деионизированной воды. Растворите агар в микроволновой печи.
- Налейте раствор агара в пластиковой посуды. Охладить субстрат, а затем положить в семенах.
- Поместите пластиковые блюда в шкафу прорастания около недели с условиями освещенности и температуры в зависимости от оптимальных условий для каждого вида сорняков. Для большинства зимних видов температурный диапазон 15/25 ° C ночь / день и 12 часов фотопериод с неоновыми трубками, обеспечивающими плотность фотосинтетического потока фотонов (PPFD) 15-30 мкмоль м -2 с -1. Для многих летних видов, температурный диапазон 15/30 ° C ночь / день.
Вариант: Sекоторые виды, такие как S. halepense, должны тепловую обработку. Поэтому после скарификации, семена S. halepense подвергаются следующих условиях: циклы 4 ч при 45 ° С и 20 ч при 24 ° С в течение трех дней в прорастания кабинета, а затем три дня в нормальных условиях.
4. Рассада Пересадка и рост
- Пересадка пятнадцати до двадцати саженцы в пластиковых лотках (325 х 265 х 95 мм), заполненной стандартной смеси заливки (60% пылевато-суглинистой почве, 15% песка, 15% agriperlite и 10% торфа - по объему).
Примечание: Пересадка, вместо непосредственного посева, позволяет равномерное стояния растений на той же стадии роста, которые будут получены, что является важным условием для оптимизации производительности обработки гербицидом. - Определить каждый лоток со штрих-кодом, включая всю информацию для уникальной идентификации: код населения, гербицид испытывается, повторить номер и прогрессивного номер лотка <./ LI>
- Место лотки в отапливаемых теплиц и водных растений, необходимых для поддержания подложки или вблизи потенциала поля.
Примечание: температура роста варьирует в зависимости от вида сорняков. Часто испытания проводятся в осенне / зима / весна, так свет дополняется использованием 400 Вт металлогалогенные лампы, которые обеспечивают PPFD около 150 мкмоль м -2 с -1 и 12 ч фотопериода 24, 19. Видов сорных Лето с С 4 фотосинтеза цикл, как правило, требуют более высокую интенсивность света и, следовательно, испытания проводятся в конце весны-лета или дополнить интенсивность света составляет около 400 мкмоль м -2 с -1 с 14 ч фотопериода. - Используйте другой протокол для некоторых видов сорняков, паразитирующих рисовые, например, А. Plantago-адиаИса, С. mucronatus и С. difformis, как описано в 22.
- Пересадка рассады в полистирола лотки с 24 круглыми клетками (диаметр 55 мм, 64 мм глубиной) FILпривело 60% пылевато-суглинистой почве, 30% песка и 10% торфа (по объему).
- Установите лотки в 12 см глубиной пластиковые контейнеры, заполненные водой и задранной на резьбовых стержней из нержавеющей стали, чтобы предотвратить их плавающей (рисунок 1).
- Поддержание уровня воды в контейнерах на 1-2 см ниже уровня поверхности почвы и добавить 1,5 г сульфата меди в каждом контейнере (который содержит 10-12 л воды), чтобы избежать увеличения количества водорослей.
5. гербицидов
- Процедуры с предварительно гербицидов:
- После примерно трех дней в прорастания кабинета, как описано в разделе 3, пересадить прорастающие семена в пластиковых лотках, содержащих субстрат, описанный выше, и покрыть слоем почвы (около 1 см). Это очень важный шаг для того, чтобы гарантировать, что саженцы не будут возникать из-за эффекта гербицида, а не чрезмерного заглубления.
- Возьмите подложку поля Капагород путем размещения лотков, которые имеют несколько отверстий на дне, на тарелках, заполненных водой.
- Однажды после пересадки, лечить лотки с довсходовой гербицида 25.
- Держите субстрат на или вблизи потенциала поля, добавляя воду по мере необходимости и сверху и снизу от капиллярного блюдце. Эта процедура способствует постоянство гербицида на нужную глубину (то есть, где прорастающие семена) для хорошей эффективности лечения.
- Процедуры с послевсходовых гербицидов:
- Спрей растений, когда они достигают стадии 2-3 листьев (т.е. стадии роста 12-13 расширенного масштаба роста ВВСН 26).
- Начиная со следующего дня после лечения, установить систему орошения соответствии с требованиями водных видов сорняков и сезона (например, для Echinochloa SPP. Это доставляет воду на 3 мин 4 раза в день, через равные промежутки времени с 9 утра до 9 вечера). Вода дисняются с помощью автоматической системы орошения дождеванием.
Вариант: глифосат применяется на заводе стадии BBCH 14-21.
- Подготовка и распространение гербицидов.
ПРИМЕЧАНИЕ: Все гербициды (пре- и пост-всходов) применяются в качестве коммерческих препаратах с рекомендованными поверхностно на две дозы, рекомендуется доза поле (1x) и в три раза, что (3x).- При необходимости, подготовить раствор ПАВ в объеме в соответствии с инструкциями на этикетках; конечная концентрация обычно выражается в процентах от конечного объема (например, 0,3%) или в объеме, который будет распространен на единицу площади (например, 1 л га -1).
- Используйте раствор ПАВ в качестве растворителя для гербицида (растворенное вещество) раствора для того, чтобы сохранить правильную концентрацию активного ингредиента. Подготовка наиболее концентрированного раствора гербицида, первый (3x). Рассчитать количество коммерческий продукт должен быть растворен в растворе поверхностно-активного вещества (или в деионизованной воде, еслиПоверхностно-активное вещество не является необходимым), используя следующее уравнение:
Доза трава = [(доза поле х доза макс) х V плавник] / V-дель-
Где: Доза травы гербицид = доза (мл), доза доза поле = гербицид поле (га -1 мл), доза макс = максимальная доза доставлены, V ребра = Окончательный объем раствора (L), V = объем дель сделанному скамья опрыскиватель (L га -1). - Развести (2: 1, об / об) гербицидным раствором 3 раза, чтобы подготовить менее концентрированную один (1x). Эта процедура уменьшает шанс сделать ошибки при взвешивании или пипетки гербициды. Раствор концентрации гербицида выражена как объем, который будет распространен на единицу площади (л га -1).
- Начало последовательность обработки с более низкой дозе гербицида (1x). Таким образом, нет необходимости промывать распыления шкаф между двумя группами лечения с тем же гербицида.
- Распределить гербицид SOLUTIOп использовании Precision Настольные распылитель поставляя 300 L га -1 (± 1%), при давлении 215 кПа и скорости 0,75 м с -1, с бумом оснащен тремя плоскими вентилятора (Extended Range) гидравлических насадок ,
- Промыть корпус распыления в два раза, когда гербицид изменить с помощью хлорной извести на 1% (об / об), а затем промыть.
Вариант: глифосат применяется с объемом распыления 200 л га -1 27.
ПРИМЕЧАНИЕ: Особое внимание должно быть уделено при высокой биологической гербициды, такие сульфометурон или флазасульфурон сульфонилмочевины используются. В последнем случае сделать одну промывание раствором хлорной и другой с аммиаком (2,5% об / об), с последующим тщательным ополаскиванием водой.
6. Сбор и анализ данных
- Через считывания штрих-кода, который автоматически идентифицирует каждый лоток, запишите количество растений, которые пережили лечение, а также визуального Ориентировочная биомассы (ВЭБ). Растения задницуessed как мертвые, если они не показывают активный рост, независимо от цвета кожи или другой внешний вид.
- Сделать оценку три или четыре недели после лечения (WAT) в зависимости от гербицидов проверенных (например, три WAT ингибиторов АССазы и четыре WAT ингибиторов ALS или глифосата).
- Оценить общую эффективность лечения путем включения восприимчивого населения (проверьте S) во всех экспериментах, то есть население, собранную на сайте, который не был редко или обрабатывают гербицидами.
- Экспресс выживание растений в процентах от количества обработанных растений, подсчитывали непосредственно перед обработкой гербицидом, и вычислить стандартную ошибку (SE) за среднее значение (среднее значение из двух повторностей).
- ВЭБ получается через визуальное сравнение растительной биомассы между обработанных и не обработанных проверку того же населения 25, 28. А счет, начиная с 10 для растений, не затронутых гербицида (по сравнению с не обработанной проверки) до 0 когдарастения явно мертв, дается каждого лотка лечение.
- Приписывать населения к четырем категориям на основе результатов, полученных из процедур с двумя гербицидам дозах: S, когда менее чем 5% растений пережили 1x гербицид дозы, SR когда выжившие в диапазоне от 5% до 20% на 1х доз гербицидов, R, когда более чем 20% растений сохранились 1x дозы гербицидов и RR, когда оставшиеся в живых более 20% при гербицид дозы 1x и более 10% в дозе гербицида 3x 17.
Результаты
Чтобы оценить состояние сопротивления предполагаемого стойкого населения, очень важно, чтобы включать в себя неустойчивого в анализе с целью проверки эффективности гербицида. Результаты скринингового теста, проведенные на P. населения rhoeas, сорняк засоряет поля пшеницы, сообщается на рисунке 2, где эффективность четырех послевсходовых гербицидов на восприимчивого проверки (09-36) и на подозреваемого стойкой одного (10-91) представлены. Населения 09-36 полностью контролируется ALS ингибитор йодосульфурон то время как только одно растение выжили доза 1x из двух других гербицидов ALS испытанных, флорасулам и трибенурон-метил (рисунок 2). Вместо этого, около 60% растений популяции 10-91 выжили оба гербицида дозы йодосульфурон и Трибенурон-метил и около 50% выжили 1x дозу флорасулам. Эти результаты подтверждают, что население 10-91 обладает высокой устойчивостью (ОР) для йодосульфурон и Трибенурон-метил и устойчивы(R), чтобы флорасулам. Отличается ответ наблюдался с 2,4-D, гербицида, имеющего различное SoA (т.е., он имитирует эндогенный ауксин), широко используются для управления двудольные сорняки в пшенице. Только 33% растений S проверки были убиты с этим гербицидом в дозе 1х и значение ВЭБ> 20% (рисунок 2). Отсутствие эффективности на чеке населения не подтверждает, если население 10-91 устойчив к этому гербициду или нет. В этом случае рекомендуется снова выполнить эксперимент и, если результаты подтвердятся, чтобы изменить S население. Пример хорошего управления неустойчивого сообщается на рисунке 3. В Echinochloa SPP. Население 07-16L полностью контролируется всеми гербицидов в рекомендуемый поля дозы (1x). В этом случае можно утверждать, что население 08-42 обладает высокой перекрестной устойчивости ко всем ингибиторов ALS испытанных, т.е. азимсульфурон, биспирибак-Na, имазамокс и penoxsulam. Не обработанные чЭк обоих популяций сообщили слева. Эти растения используются для вычисления ВЭБ; количество биомассы визуально оценивается лоток лоток дает 10 баллов к не обработанной проверки, а затем присвоения баллов от 0, для репликации без каких-либо зеленой растительной ткани, до 10, когда биомасса сравнима с не обработанной проверить (рисунок 3).
Другим примером выхода сообщается на рисунке 4, где выживание растений в Lolium SPP. к глифосату показано. Популяции проверенные были собраны в основе пшеницы систем земледелия, где глифосат оказывает различное давление отбора (то есть, время от времени или 1-2 процедуры в год или 3-более раз в год). Растения опрыскивают в стадии кущения в начале (BBCH 14-21) с помощью двух доз глифосата: 480 и 1440 г к.э. га -1, которые представляют минимальный и максимальный рекомендуется доза поле для однолетних сорняков (т.е. therophytes) При этом рост мвозраст. Данные были собраны четыре недели после лечения. На основании обоих экспериментах, семь из протестированных популяций была выживаемость 80% или более (популяций 343, 383, 384, 403, 509, 512 и 537) по самой низкой дозе, но применяется только 50% растений популяции 403 и 509 пережил самую высокую дозу глифосата. Один население было выживаемость около 40% при дозе 1x, в то время как только немногие растения населения 509 пережил самую низкую дозу и население 508 полностью контролируется на любой дозе. Таким образом, эти эксперименты показали различные уровни устойчивости к глифосату, что часто отражается историю области использования гербицидов. Уровень устойчивости к глифосату была выше, для населения, которые были более интенсивно обработанных: т.е., количество полевых условиях в год, и количество лет давления отбора была выше.
Протокол, описанный в одном гербицида (рис 4) могут быть применены к многочисленным другим лицам, сиситемахаренда SoA; В этом случае сопротивление шаблон из одного или нескольких популяций может быть определена. Пример сопротивления изменчивости картина Echinochloa SPP. популяции представлены в таблице 1. Исторические данные использования гербицидов и управления культур, полученных от фермера показали, что АЛС-ингибирующие гербициды выбора агент (т.е., penoxsulam или имазамокс). Поэтому измерение сопротивления проводили с тремя ALS-гербицидов, ингибирующих (азимсульфурон, penoxsulam и имазамоксу), принадлежащих к различным химическим семей, и один гербицид, имеющим другую SOA, АССазных-ингибирующим гербицидам профоксидим. Восприимчивы проверка (07-16L) был полностью контролируется всех испытанных гербицидов (таблица 1). Три модели сопротивления были обнаружены: тринадцать населения привели как устойчивый только к ингибиторам ALS, четыре популяции привели как устойчивый только ингибитора АССаза профоксидим и три популяции показали кратное сопротивление шаблон для обоих ингибиторов АССазы профоксидим и ингибиторов АЛС. В каждой модели сопротивления можно выделить различные биотипов, например, четыре популяции, устойчивые к ингибиторам ALS выжили только процедуры с сульфонилмочевины азимсульфурон а два мульти-резистентных популяций выжил только лечение с ингибитором ALS азимсульфурон но были вполне контролируемые penoxsulam и имазамокс.

Рисунок 1. Пример С difformis, а сорняки наводнивших рисовые эксперимент настройки. лотки из полистирола помещают в пластиковые контейнеры и заблокирован резьбовых стержней из нержавеющей стали, чтобы предотвратить их плавающими. Воды поддерживается на 1-2 см ниже уровня поверхности почвы, чтобы имитировать условия рисовые риса. Снимок был сделан через четыре недели после лечения.p_upload / 52923 / 52923fig1large.jpg "цель =" _ пустое "> Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2. Реакция двух P. населения rhoeas пост-гербициды. Влияние йодосульфурон, Трибенурон, флорасулам и 2,4-D проходят в дозе рекомендуется поля (1x) и в три раза, что (3x) на выживаемость растений (синие полосы) и визуальная оценка биомассы ( ВЭБ; красные столбики) восприимчивых проверки (09-36) и стойкого населения (10-91). Оценка была сделана через четыре недели после обработки гербицидом. Выживание растений и ВЭБ выражаются в процентах от числа обработанных растений и ВЭБ не обработанных проверок (%). Горизонтальная линия на 20% выживания растений представляет собой дискриминационную порог между устойчивостью и уязвимых групп населения, когда растения обрабатывают на дозы 1x. Вертикальные линиипредставляют стандартные ошибки, рассчитанные на среднего значения двух повторах. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3. Визуальные результаты скрининга на двух Echinochloa SPP. популяции. восприимчивы проверка, 07-16L (S), и устойчивы населения, 08-42, были протестированы с четырьмя ингибиторов ALS (зарегистрированных на праве) в двух дозах, 1x и 3x, (зарегистрированных в нижней). Для S проверки только результаты доз 1x сообщается, потому что все растения были уже контролируется на этой дозе. Три примера ВЭБ счетом сообщается в красный: 0 = все растения мертвы, 10 = все растения выжили и биомассы сравнимо с не обработанной (NT) проверки (отчетный слева), 5 = биомасса составляет примерно половину того, что в Лоток не обработанныепроверить. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
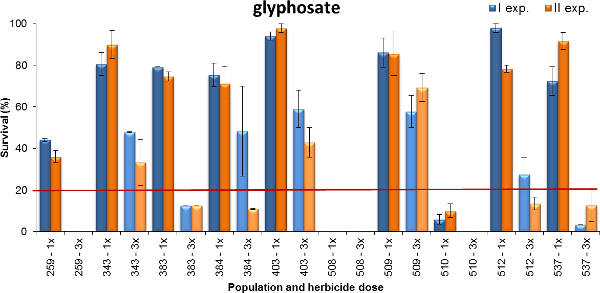
Рисунок 4. Процент выживания растений в течение десяти Lolium SPP. популяции испытания с выживанием растений глифосата. записанного в двух экспериментах (синий баров и оранжевые баров для опыта. I и II, соответственно). Данные выражены в процентах (%) от количества обработанных растений. Два восприимчивых проверяет, были полностью контролируется в дозе 1х и, следовательно, не сообщается в графе. Две дозы были испытаны, минимум (1x = 480 г к.э. га -1) и максимум (3x = 1440 г к.э. га -1) дозы сообщили на этикетке продукта. Горизонтальная линия на 20% выживания растений представляет собой дискриминационную порог между устойчивостью и уязвимых групп населения, когда растения были удовольствиеред в дозе 1х. Вертикальные полосы представляют стандартные ошибки, рассчитанные на среднего значения двух повторах. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
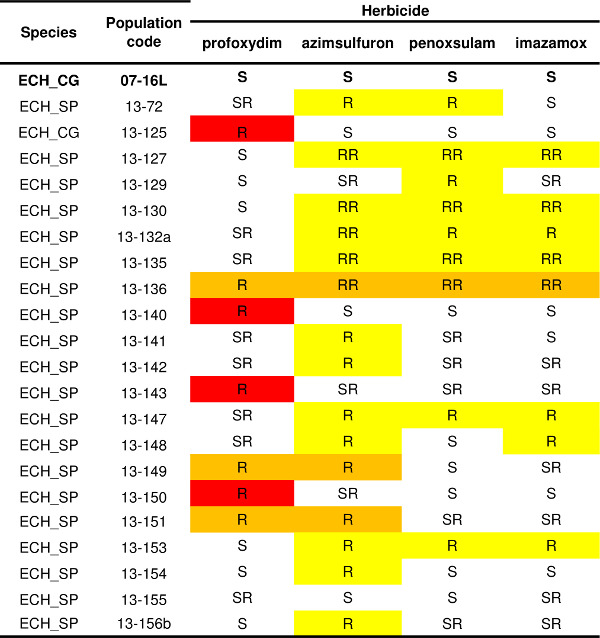
Таблица 1. Сопротивление статус двадцати одного популяций Echinochloa SPP. Подвержены проверка (07-16L) сообщается жирным шрифтом. Уровни сопротивления приведены для каждого из четырех испытываемых гербицидов (один АССазы ингибитор профоксидим и три ингибиторы ALS, азимсульфурон, penoxsulam и имазамокс) в соответствии с четыре категории: S = менее 5% растений выжили гербицид дозы 1x, SR = выживание растений колебалась от 5% до 20% в 1x доз гербицидов, R = более 20% растений сохранились 1x гербицид дозы, ОР = выживание растений был более, чем 20% в дозе гербицида1x и более 10% при дозе в 3 раза. Различные модели сопротивления выделены: красный = сопротивление только ингибитора АССазного, желтый = сопротивление только в ингибитором ALS (ов), оранжевый = сопротивление ингибитора АССазного и по крайней мере один ингибитор ALS.
Обсуждение
Несколько шагов в протоколах имеют решающее значение для успешной оценки устойчивости к гербицидам в популяции: 1) семена должны быть собраны, когда зрелый из растений, которые выжили лечения (ы) к гербицидам. Созревание семян на материнском растении важно избегать трудностей в прорастания семян более поздней; 2) надлежащее хранение семян рекомендуется избегать распространения плесени, что бы предотвратить прорастание; 3) рассада должна рассматриваться в нужное стадии роста, как сообщает на этикетке упаковки гербицидов. Необходимо соблюдать осторожность, так что растения, которые будут рассматриваться достигли приблизительно такой же стадии роста; 4) к гербицидам растворы должны быть подготовлены и обработаны с точностью так, чтобы растения опрыскивают правильной концентрации активного ингредиента, следовательно, избежать ошибок непроверяемые; 5) после каждой обработки гербицидом рекомендуется тщательно очистить распыления шкаф и посуда, используемая для приготовления растворов, чтобы избежатьЗагрязнение в следующем гербицидной обработки, особенно когда речь идет о высокой биологической активностью гербицидов.
Протоколы, представленные здесь, могут быть легко адаптированы к широкому кругу видов сорняков с необходимыми изменениями в зависимости от вида и гербицидов, представляющих интерес. В частности, методы сломать покоя семян и всходов шаги, которые должны быть пересмотрены для каждого нового вида сорняков (см разделы 2 и 3). Оборудование для орошения иногда требуется корректировки при различных гербицидов используются, например, глифосат требует различных настроек распыления кабинета (см раздел 5.3) и растения обрабатывают на более поздней стадии роста, чем с большинством гербицидов.
Время и пространство, необходимое для выполнения этих протоколов может быть ограничивающим фактором и не могут быть пригодны для рутинного тестирования. Тем не менее, чтобы ограничить стоимость, могут быть использованы только одна доза гербицида. Таким образом, информация по-прежнему может быть получен от того тон устойчив населения. Потенциальным ограничением подхода связано с тем, что нет устойчивых проверки не включены в экспериментах. В самом деле, из-за большого количества биотипов оцененных (т.е. различных видов и гербициды, участвующих), многие проверки должны быть включены в каждом эксперименте, тем самым увеличивая затраты.
Тем не менее, преимущества по сравнению с альтернативными методами / протоколов на основе цельных растений биоанализа с использованием только одного гербицида, дозу 15 связаны с более высокой надежностью и возможностью выведения уровень сопротивления. Быстрее и менее дорогие диагностические тесты скрининга были также разработаны в естественных условиях или в пробирке (например, чашки Петри биопробы 8, спектрофотометрические анализы на гербицида целевого фермента 29). Тем не менее, они только обеспечивают качественную информацию и требуют определенную предварительную работу, иногда кропотливую, чтобы определить дозу гербицида, для различения разрешенииistant и восприимчивые растения. Анализы в пробирке также должны быть адаптированы в соответствии с активного ингредиента.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
The research was supported by the National Research Council (CNR) of Italy. The authors thank GIRE members for collecting seed samples and are grateful to Alison Garside for revising the English.
Материалы
| Name | Company | Catalog Number | Comments |
| Paper bags | Celcar SAS | ||
| Plastic dishes | ISI plast S.p.A. | SO600 | Transparent plastic |
| Sulfuric acid 95-98% | Sigma-Aldrich | 320501 | |
| Non-woven fabric | Carretta Tessitura | Art.TNT17 | Weight 17 g m-2 |
| Chloroform >99.5% | Sigma-Aldrich | C2432 | |
| Agar | Sigma-Aldrich | A1296 | |
| Potassium nitrate >99.0% | Sigma-Aldrich | P8394 | |
| Plastic containers | Giganplast | 1875/M | 600 x 400 x 110 mm |
| Plastic trays | Piber plast | G1210A | 325 x 265 x 95 mm |
| Polystyrene trays | Plastisavio | S24 | 537 x 328 x 72 mm, 24 round cells (6x4) |
| Copper sulfate | Sigma-Aldrich | 451657 | |
| Agriperlite | Blu Agroingross sas | AGRI100 | |
| Peat | Blu Agroingross sas | TORBA250 | |
| Germination cabinet | KW | W87R | |
| Nozzles | Teejet | XR11002-VK, TP11001-VH | The second type of nozzles are used only for glyphosate |
| Barcode generator | Toshiba TEC | SX4 | |
| Labels with barcode | Felga | TT20200 | Stick-in labels with rounded corners |
| Barcode reader | Cipherlab | 8300-L | Portable data terminal |
| Bench sprayer | Built in house | ||
| Herbicides included in the results: | |||
| Commercial product | Active ingredient | Company | Comments |
| Altorex | imazamox | BASF | |
| Azimut | florasulam | Dow AgroSciences | |
| Biopower | Bayer Crop Science | Surfact to be used with Hussar WG | |
| Dash | BASF | Surfact to be used with Altorex | |
| Granstar | tribenuron-methyl | Dupont | |
| Gulliver | azimsulfuron | Dupont | |
| Hussar WG | iodosulfuron | Bayer Crop Science | |
| Nominee | bispyribac-Na | Bayer Crop Science | |
| Roundup | glyphosate | Monsanto | |
| Trend | Dupont | Surfact to be used with Granstar and Gulliver | |
| Viper | penoxsulam | Dow AgroSciences | |
| Weedone LV4 | 2,4-D | Isagro | |
Ссылки
- Massa, D., Kaiser, Y. I., Andújar-Sánchez, D., Carmona-Alférez, R., Mehrtens, J., Gerhards, R. Development of a geo-referenced database for weed mapping and analysis of agronomic factors affecting herbicide resistance in Apera spica-venti L. Beauv. (Silky Windgrass). Agronomy. 3 (1), 13-27 (2013).
- Powles, S. B., Shaner, D. L. . Herbicides Resistance and World Grains. , 308 (2001).
- Sattin, M. Herbicide resistance in Europe: an overview. Proc. BCPC International Congress. , 131-138 (2005).
- Jasieniuk, M., Le Corre, V. Deciphering the evolution of herbicide resistance in weeds. Trends Genet. 29 (11), 649-658 (2013).
- Heap, I. M. Identification and documentation of herbicide resistance. Phytoprotection. 75 (4), 85-90 (1994).
- Beckie, H. J., Heap, I. M., Smeda, R. J., Hall, L. M. Screening for herbicide resistance in weeds. Weed Technol. 14 (2), 428-445 (2000).
- Tal, A., Kotoula-Syka, E., Rubin, B. Seed-bioassay to detect grass weeds resistant to acetyl coenzyme A carboxylase inhibiting herbicides. Crop Prot. 19, 467-472 (2000).
- Boutsalis, P. Syngenta Quick-Test: a rapid whole-plant test for herbicide resistance. Weed Technol. 15 (2), 257-263 (2001).
- Menchari, Y., et al. Weed response to herbicides: regional-scale distribution of herbicide resistance alleles in the grass weed Alopecurus myosuroides. New Phytol. 171 (4), 861-874 (2006).
- Burgos, N. R., et al. Review: confirmation of resistance to herbicides and evaluation of resistance levels. Weed Sci. 61 (1), 4-20 (2013).
- Owen, M. J., Martinez, N. J., Powles, S. B. Multiple herbicide-resistant Lolium rigidum. (annual ryegrass) now dominates across the Western Australian grain belt. Weed Res. 54 (3), 314-324 (2014).
- Beckie, H. J., Tardif, F. J. Herbicide cross resistance in weeds). Crop Prot. 35, 15-28 (2012).
- Moss, S. R., et al. The occurrence of herbicide-resistant grass-weeds in the United Kingdom and a new system for designating resistance in screening assays. Proc. BCPC Weeds. , 179-184 (1999).
- Baskin, C. C., Baskin, J. M. . Seeds, Ecology, Biogeography and Evolution of dormancy and Germination. , 27-42 (1998).
- Sattin, M., Gasparetto, M. A., Campagna, C. Situation and management of Avena sterilis. ssp. ludoviciana. and Phalaris paradoxa. resistant to ACCase inhibitors in Italy. Proc. BCPC - Weeds. , 755-762 (2001).
- Scarabel, L., Varotto, S., Sattin, M. A European biotype of Amaranthus retroflexus. cross-resistant to ALS inhibitors and response to alternative herbicides. Weed Res. 47 (6), 527-533 (2007).
- Collavo, A., Panozzo, S., Lucchesi, G., Scarabel, L., Sattin, M. Characterisation and management of Phalaris paradoxa. resistant to ACCase-inhibitors. Crop Prot. 30 (3), 293-299 (2011).
- Scarabel, L., Carraro, N., Sattin, M., Varotto, S. Molecular basis and genetic characterisation of evolved resistance to ALS-inhibitors in Papaver rhoeas. Plant Sci. 166 (3), 703-709 (2004).
- Panozzo, S., Scarabel, L., Tranel, P. J., Sattin, M. Target-site resistance to ALS inhibitors in the polyploid species Echinochloa crus-galli. Pestic. Biochem. Phys. 105 (2), 93-101 (2013).
- Sattin, M., Berto, D., Zanin, G., Tabacchi, M. Resistance to ALS inhibitors in rice in north-western Italy. Proc. BCPC. Weeds. , 783-790 (1999).
- Scarabel, L., Berto, D., Sattin, M. Dormancy breaking and germination of Alisma plantago-aquatica. and Scirpus mucronatus. Aspects of Applied Biology. 69, 285-292 (2003).
- Collavo, A., Strek, H., Beffa, R., Sattin, M. Management of an ACCase-inhibitor-resistant Lolium rigidum. population based on the use of ALS inhibitors: weed population evolution observed over a 7 years field-scale investigation. Pest Manag. Sci. 69 (2), 200-208 (2013).
- Scarabel, L., Panozzo, S., Savoia, W., Sattin, M. Target-site ACCase-resistant Johnsongrass (Sorghum halepense). selected in summer dicot crops. Weed Technol. 28 (2), 307-315 (2014).
- Hess, M., Barralis, H., Bleiholder, H., Buhur, L., Eggers, T., Hack, H., Strauss, R. Use of the extended BBCH scale - general for the description of the growth stages of mono- and dicotyledonous weed species. Weed Res. 37 (6), 433-441 (1997).
- Collavo, A., Sattin, M. First glyphosate-resistant Lolium. spp. biotypes found in a European annual arable cropping system also affected by ACCase and ALS resistance. Weed Res. 54 (4), 325-334 (2014).
- Scarabel, L., Cenghialta, C., Manuello, D., Sattin, M. Monitoring and management of imidazolinone-resistant red rice (Oryza sativa. L., var. sylvatica.) in Clearfield® Italian paddy rice. Agronomy. 2 (4), 371-383 (2012).
- Zelaya, I. A., Anderson, J. A. H., Owen, M. D. K., Landes, R. D. Evaluation of spectrophotometric and HPLC methods for shikimic acid determination in plants: Models in glyphosate-resistant and-susceptible crops. J. Agric. Food Chem. 59 (6), 2202-2212 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены