Method Article
Protokolle für Robust Herbizidresistenz Testing in verschiedene Unkrautarten
In diesem Artikel
Zusammenfassung
A robust and flexible approach to confirm herbicide resistance in weed populations is presented. This protocol allows the herbicide resistance levels to be inferred and applied to a wide range of weed species and herbicides with minor adaptations.
Zusammenfassung
Robust protocols to test putative herbicide resistant weed populations at whole plant level are essential to confirm the resistance status. The presented protocols, based on whole-plant bioassays performed in a greenhouse, can be readily adapted to a wide range of weed species and herbicides through appropriate variants. Seed samples from plants that survived a field herbicide treatment are collected and stored dry at low temperature until used. Germination methods differ according to weed species and seed dormancy type. Seedlings at similar growth stage are transplanted and maintained in the greenhouse under appropriate conditions until plants have reached the right growth stage for herbicide treatment. Accuracy is required to prepare the herbicide solution to avoid unverifiable mistakes. Other critical steps such as the application volume and spray speed are also evaluated. The advantages of this protocol, compared to others based on whole plant bioassays using one herbicide dose, are related to the higher reliability and the possibility of inferring the resistance level. Quicker and less expensive in vivo or in vitro diagnostic screening tests have been proposed (Petri dish bioassays, spectrophotometric tests), but they provide only qualitative information and their widespread use is hindered by the laborious set-up that some species may require. For routine resistance testing, the proposed whole plant bioassay can be applied at only one herbicide dose, so reducing the costs.
Einleitung
Herbizide sind die am häufigsten verwendete Unkrautbekämpfungsmaßnahme, einem Anteil von bis zu 50% der globalen Pflanzenschutzmarkt 1. Sie sind relativ billig Werkzeuge, vermeiden arbeitsintensive und zeitraubende Bodenbearbeitung Praktiken und letztlich in kostengünstige, sichere und rentable Nahrungsmittelproduktion 2 führen. Doch der große phänologischen und genetische Variabilität vorhanden in vielen Unkrautarten, zusammen mit einer zu starken Abhängigkeit von Herbiziden, führt häufig zu der Auswahl von herbizidresistenten Unkrautpopulationen. Die Einführung von selektiven Herbiziden mit einem sehr spezifischen metabolischen Ziel 3-5 hat sich dramatisch die Anzahl von Widerstands Fällen über die Jahre. Bis heute haben 240 Unkrautarten (140 Dikotyledonen und Monokotyledonen 100) weltweit Resistenz gegen verschiedene Herbizidwirkorten (SOA) 4 entwickelt. Dies ist ein wichtiges Anliegen für die Unkrautbekämpfung und allgemeiner für eine nachhaltige Pflanzenproduktion.
e_content "> Früherkennung von Widerstand, auf der Grundlage zuverlässiger Tests im Gewächshaus häufig durchgeführt wird, ist ein wichtiger Schritt, um Herbizid-resistenten Unkräutern zu verwalten. Verschiedene Ansätze wurden nach den Zielen, erforderliche Genauigkeit, Zeit und Ressourcen zur Verfügung entwickelt, wie sowie der Unkrautarten berücksichtigt 6-12. Wenn jedoch eine Bestätigung der Resistenz Status einer neuen Unkraut Biotyp erforderlich (dh eine Gruppe von Personen, die mehrere physiologische Merkmale teilen, einschließlich der Fähigkeit, ein oder mehrere Herbizide a gehör überleben bestimmten Gruppe in einer Dosis, die normalerweise zu steuern würde sie verwendet wird), muss eine robuste ganze Pflanze Bioassay in einer kontrollierten Umgebung, 4, 11 durchgeführt werden.Ein Biotop ist selten beständig gegen nur ein Herbizid. Jedes Biotyp ist daher durch einen gewissen Widerstandsstruktur, dh die Anzahl und Art von SOA der Herbizide sie resistent gegen charakterisiert und durch einen gegebenen WiderstandStufe zu jedem Herbizid 13. Die frühe und zuverlässige Bestimmung des Musters der Quer oder Mehrfachresistenz 5, 14 wichtig für die Feldresistenzmanagement.
Es ist erwähnenswert, dass Herbizidresistenz hat nichts mit der natürlichen Toleranz tun wert, dass einige Unkrautarten weisen in Richtung einiger Herbizide, zB dicot Arten vs. ACCase-hemmenden Herbizide, monokotylen Arten vs. 2,4-D, Equisetum arvense vs. Glyphosat.
Dieser Beitrag stellt einen robusten Ansatz für die Prüfung mutmaßlichen herbizidresistenter Biotypen in Bereichen, in denen eine schlechte Kontrolle von Herbizid (en) ausgewiesen wurden abgetastet. Relevante Varianten den Standardprotokollen in an den betreffenden Unkrautarten vorgestellt. Die Vorteile gegenüber alternativen Techniken / Protokolle, die entweder auf ganze Pflanze Bioassays unter Verwendung von nur einem Herbizid Dosis 15 oder Behandlung von Saatgut in Petrischalen 8 sind mit dem höheren zuverlässigen un bezogenenility und die Möglichkeit Ableiten der Widerstand wegen der Einbeziehung von zwei Herbiziddosen in den Experimenten. Aber für Routineresistenztests, die gleichen Methoden können nur an einer Herbizid-Dosis aufgebracht werden, so dass die Verringerung der Kosten.
Sowie die Möglichkeit Bestätigung des Widerstandszustand kann die erhaltenen Informationen sowohl für die Optimierung folgende Forschungsschritte und / oder der Ausarbeitung Sound Resistenzmanagementstrategien verwendet werden.
Protokoll
1. Seed Probenahme und Lagerung
- Überwachen Sie bestellten Feldern für ungerechtfertigt schlechter Herbizidleistung, dh nicht durch ungünstige klimatische Bedingungen oder Qualität Herbizidbehandlungen gering.
- Sammeln einer Samenprobe von einer Spezies zu einer Zeit und einem eindeutigen Code zuordnen. Reifen Samen werden in der Regel vor der Getreideernte aus Pflanzen, die die Herbizidbehandlung (en) überlebt hatten, gesammelt. Rechtzeitige Monitor zu beobachten, ob die Samen werden von Mutterpflanze, wenn fällig zu vergießen.
- Füllen Sie ein Formular für jede Probe, die den zugewiesenen eindeutigen Code, Namen von Arten, Abholtermin, GPS-Koordinaten, Gemeinde, Name des Landwirts, Feldgröße, Befall, Ernte, Herbizid (en) während der Saison verwendet und historischen Aufzeichnungen des Feldes .
- Sammeln Samen von mindestens 30 zufällig ausgewählten Pflanzen, die repräsentativ für die Feldbefall sind. Stellen Sie sicher, dass die Samenprobe enthält mindestens 5.000 reifen Samen. Für ein obligat Auskreuzung Unkrautarten(ZB Lolium spp. Oder Amaranthus spp.), Die Zahl der Pflanzen auf 10-15, wobei die Gesamtzahl an Samen rund 5.000 11.
- Teilstichprobe des Feldes, wenn Flecken von Unkraut auf großen Flächen (mehr als ein Hektar) verstreut verschiedene herbizidresistenter Biotypen ausgewählt sind.
- Shop Samen in nicht versiegelten Tüten mit dem eindeutigen Code zugeordnet gekennzeichnet.
- Damit die Feuchtigkeit verdunsten, aber keine Samen zu hoher Temperatur (dh verhindern, dass sie in einem Auto unter der Sonne) oder extremen Temperaturschwankungen ausgesetzt werden, um die Induktion der Sekundärkeimruhe zu vermeiden.
- Clean (entfernen Spreu, de-Rumpf Samen, etc.) und speichern Sie sie bei Raumtemperatur in einem trockenen Raum. Nach der Durchführung des ersten Widerstandstests, speichern die Samen für lange Zeiträume in einem dunklen Raum bei 4 ° C, vorzugsweise im Vakuum-versiegelten Plastiktaschen. Auf diese Weise werden Samen zu erhalten ihre Lebensfähigkeit für eine deutlich längere Zeit.
2. Samenruhe Brechen
HINWEIS: Samenruhe bietet eine flexible und effiziente Mechanismus, Unkraut ermöglicht, sich anzupassen und bleiben in Agrarökosystemen. Um Ruhe zu brechen und die Keimung der Samen zu ermöglichen, unterschiedliche Protokolle in Abhängigkeit von Unkrautarten, das heißt, die Art der Keimruhe 16 verwendet werden.
Es gibt drei Möglichkeiten, um Ruhephase zu entfernen:
- Vernalisation
HINWEIS: Zum gleichzeitigen Keimung und Keimlings Entstehung, über einen Zeitraum von Saatgut Vernalisation im Bereich von wenigen Tagen bis zu einer Woche zu erhalten, ist erforderlich, um physiologische Keimruhe von vielen Arten entfernen: z. B., Amaranthus retroflexus, Chenopodium album, Lolium spp, Avena fatua, Polygonum persicaria , Phalaris paradoxa 17-19. Eine längere Laufzeit von bis zu 15 Tagen ist für Papaver rhoeas, Cyperus difformis und Ammania coccinea für Schoenoplectus mucronatus erforderlich und bis zu 30 Tage 20.- Setzen Sie etwas entionisiertem Wasser in Plastikschalen. Schneiden Sie zwei Schichten aus Filterpapier und genießen sie in Wasser, zu entfernen überschüssige. Platzieren des luftgetrockneten Samen auf dem Papier. Übertragen Sie die Kunststoffschalen mit einem Kühlschrank bei 4 ° C für den erforderlichen Zeitraum.
- Vertikutieren
ANMERKUNG: Manche Unkrautarten sind persistenteren um Keimung als andere aufgrund mechanischer Dormanz dh Samenschale Eigenschaften und erfordern die Verwendung eines chemischen Skarifikation Verwendung von Schwefelsäure auf 21 auskeimen.- Bereiten Sie ein Becherglas mit konzentrierter Schwefelsäure (95-98%). Bereiten Sie einen Becher voll Wasser. Legen Sie die Samen in einem Umschlag aus Vliesstoff.
- Einweichen zB Echinochloa spp., Sorghum halepense Samen für 20 min oder 5 min jeweils in konzentrierter Schwefelsäure.
- Nehmen Sie den Umschlag aus dem Becherglas mit einer Pinzette und legen Sie sie in den Becher voll Wasser. Öffne dasUmschlag, legen Sie die Samen in einem kleinen Sieb und spülen Sie sie gründlich unter fließendem Wasser.
- Weichen Sie die Samen für 2 Minuten in Chloroform. Spülen Sie die Samen mit VE-Wasser und trocknen Sie sie mit saugfähigem Papier. Tauchen die Samen in 80% iger Schwefelsäure 5 min.
- Legen Sie die Samen in einem kleinen Sieb und spülen Sie sie gründlich unter fließendem Wasser.
- Nach der Ernte Samenreifung
HINWEIS: Samen von anderen Unkrautarten gar nicht keimen für ein paar Monate nach der Reife, unabhängig von der verwendeten Methode zur Keimruhe zu brechen.- Bewahren Sie die Samen für die Dauer von mindestens 3-4 Monate bei RT und niedrige Luftfeuchtigkeit und folgen Sie den oben genannten Protokolle für Ruhebruch (zB Oryza sativa var. Sylvatica oder P. rhoeas).
3. Samenkeimung
- Platz Samen in Plas gekeimt werdentic Gerichte, die 0,6% (m / v) Agar mit 0,1% Kaliumnitrat (KNO 3) hinzugefügt:
- Es wird eine Lösung von Agar bei 0,6% + 0,1% KNO 3 unter Verwendung von deionisiertem Wasser. Auflösen des Agar in einer Mikrowelle.
- Gießen Sie die Agar-Lösung in Kunststoffschalen. Kühle das Substrat und dann in den Samen gelegt.
- Zeigen Plastikschalen in einer Keimschrank für etwa eine Woche mit Licht- und Temperaturbedingungen in Abhängigkeit von den optimalen Bedingungen für jede Unkrautarten. Für die meisten Winter-Arten, ist der Temperaturbereich 15/25 ° C Nacht / Tag und 12 Stunden Photoperiode mit Neonröhren Bereitstellung einer photo Photonenflußdichte (PPFD) von 15-30 & mgr; mol m -2 s -1. Für viele Arten Sommer, ist der Temperaturbereich 15/30 ° C Nacht / Tag.
Variante: Some-Arten, wie S. halepense, müssen einer Wärmebehandlung. Daher nach der scarification, Samen von S. bei 45 ° C und 20 h bei 24 ° C für drei Tage in der Keimschrank bei normalen Bedingungen Zyklen von 4 Stunden, und dann drei Tage halepense werden den folgenden Bedingungen unterzogen.
4. Setzling Topfen und Wachstums
- Transplant fünfzehn bis zwanzig Jungpflanzen in Plastikschalen (325 x 265 x 95 mm) mit einem Standard-Blumenerde mischen gefüllt (60% schlammigen Lehmboden, 15% Sand, 15% und 10% agriperlite Torf - nach Volumen).
HINWEIS: Umpflanzen anstelle Direktsaat, ermöglicht eine einheitliche Stand der Pflanzen an der gleichen Wachstumsphase zu erhalten, was eine wichtige Voraussetzung, um die Leistung der Herbizidbehandlung optimiert ist. - Kennzeichnen Sie jeden Tablett mit einem Barcode mit allen Informationen für die eindeutige Identifikation: Bevölkerung Code, Herbizid getestet wird, replizieren Nummer und progressive Fachnummer <./ Li>
- Platz Tabletts in beheizbaren Wintergärten und Wasserpflanzen, wie gebraucht, um das Substrat an oder nahe der Feldkapazität zu erhalten.
HINWEIS: Die Wachstumstemperatur variiert je nach den Unkrautarten. Oft Tests werden im Herbst / Winter / Frühjahr getan, also Licht mit 400 W Halogen-Metalldampflampen, die eine PPFD von etwa 150 & mgr; mol m -2 s -1 und bieten einen 12 Stunden Photoperiode 24, 19. Sommer Unkrautarten, ergänzt C 4 Photosynthesezyklus erfordern in der Regel höhere Lichtintensität und damit Tests werden im späten Frühjahr-Sommer getan oder ergänzt Lichtintensität etwa 400 & mgr; mol m -2 s -1 mit einer 14 Stunden Photoperiode. - Verwenden Sie ein anderes Protokoll für einige Unkrautarten befallen Rohreis, zB A. Plantago-aquatica, S. mucronatus und C. difformis wie in 22 beschrieben.
- Die Sämlinge in Polystyrol-Schalen mit 24 Rundzellen (55 mm Durchmesser, 64 mm tief) filführte mit 60% schlammigen Lehmboden, 30% Sand und 10% Torf (nach Volumen).
- Setzen Sie die Fächer in 12 cm tiefe Kunststoffbehälter mit Wasser gefüllt und Lattengroß unten durch verschraubter Edelstahlstangen ihnen schwimmenden (Abbildung 1) zu verhindern.
- Pflegen Wasserstand in den Behältern bei 1-2 cm unter dem Niveau der Bodenoberfläche und fügen Sie 1,5 g Kupfersulfat, um jeden Behälter, um das Algenwachstum zu vermeiden (die 10-12 l Wasser enthält).
5. Herbizidbehandlungen
- Behandlungen mit Vorauflauf-Herbizide:
- Nach etwa drei Tage in der Keimschrank, wie in Kapitel 3 beschrieben, zu transplantieren die keimenden Samen in Kunststoffschalen, die das oben beschriebene Substrat und Deckel mit einer Schicht des Bodens (etwa 1 cm). Dies ist ein kritischer Schritt, um sicherzustellen, dass Keimlinge nicht aufgrund der Herbizideffekt anstatt eines übermäßigen Eingrabtiefe austreten.
- Nehmen Sie das Substrat, um Feld capaStadt, indem Sie die Fächer, die ein paar Löcher am Boden haben, auf Untertassen mit Wasser gefüllt.
- Einen Tag nach der Transplantation, behandeln Sie die Fächer mit dem Vorauflaufherbizid 25.
- Halten des Substrats an oder nahe der Feldkapazität durch Zugabe von Wasser nach Bedarf sowohl von oben und unten durch die Kapillarwirkung von der Untertasse. Dieses Verfahren begünstigt die Dauerhaftigkeit des Herbizids in die richtige Tiefe (dh, wo die keimenden Samen sind) für eine gute Wirksamkeit der Behandlung.
- Behandlungen mit Nachauflaufherbizide:
- Spray Pflanzen, wenn sie die 2-3-Blatt-Stadium zu erreichen (dh Wachstumsstufe 12-13 des erweiterten BBCH Wachstumsskala 26).
- Ausgehend von dem Tag nach der Behandlung, setzen Sie das Bewässerungssystem nach den Wasserbedarf der Unkrautarten und der Saison (zB für Echinochloa spp. Es liefert Wasser für 3 min 4 Mal pro Tag, in regelmäßigen Abständen von 9 Uhr bis 9 Uhr). Wasser ist disverteilt unter Verwendung einer automatischen Sprinkleranlage Bewässerungssystem.
Variante: Glyphosat ist bei Pflanzenstadium BBCH 14-21 angelegt.
- Herbizidzubereitung und -verteilung.
HINWEIS: Alle Herbizide (Pre- und Post-emergence) als mit handelsüblichen Formulierungen empfohlen Tenside in zwei Dosen angewendet wird, empfiehlt Feld Dosis (1x) und drei Mal, dass (3x).- Bei Bedarf bereiten die Tensid-Lösung in der Masse nach den Anweisungen auf dem Etikett; die Endkonzentration in der Regel in Prozent des Endvolumens (zB 0,3%) ausgedrückt, oder als Volumen pro Flächeneinheit (beispielsweise 1 L ha -1) verteilt werden.
- Verwenden der Tensidlösung als Lösungsmittel für das Herbizid (solute) -Lösung, um die richtige Konzentration des Wirkstoffs zu halten. Bereiten Sie die am stärksten konzentrierten Herbizidlösung zuerst (3x). Berechnung der Menge des Handelsprodukts in der Tensidlösung (gelöst oder in entionisiertem Wasser, wenn einTensid ist nicht erforderlich) unter Verwendung der folgenden Gleichung:
Dosis Kräuter = [(Dose Feld x Dose max) x V fin] / V del
Wo: Dose Kraut = Herbizid Dosis (ml), Dose field = Herbizid Feld Dosis (ml ha -1), Dose max = maximale Dosis geliefert, V = fin endgültige Volumen der Lösung (L), V = del durch die gelieferte Volumen Bank Spritze (L ha -1). - Verdünnte (2: 1, v / v) der Herbizid-Lösung 3x, die weniger konzentriert (1x) herzustellen. Dieses Verfahren verringert die Chance, Fehler zu machen, wenn Wiegen oder Pipettieren der Herbizide. Herbizidlösung-Konzentration, ausgedrückt als Volumen pro Flächeneinheit (L ha -1) verteilt werden.
- Start des Ablaufs der Behandlung mit der niedrigeren Dosis Herbizid (1x). Auf diese Weise gibt es keine Notwendigkeit, die Spritzgehäuse zwischen zwei Behandlungen mit dem gleichen Herbizid waschen.
- Verteilen Sie das Herbizid solution unter Verwendung eines Präzisionsbank Spritzen liefert 300 l ha -1 (± 1%), bei einem Druck von 215 kPa und einer Geschwindigkeit von 0,75 m sec -1, mit einem Ausleger mit drei Flat-Fan (extended range) Hydraulikdüsen ausgestattet .
- Zweimal Waschen Sie die Spritzen Schrank, wenn das Herbizid mit Bleichmittel 1% verändert (v / v) und dann ausspülen.
Variante: Glyphosat ist mit einem Spritzvolumen von 200 l ha -1 27 angelegt.
HINWEIS: Besondere Aufmerksamkeit zu zahlen, wenn hoch biologische Herbizide, wie die Sulfonylharnstoffe Sulfometuron oder Flazasulfuron, verwendet werden. Im letzteren Fall zu tun einem Waschen mit einer Bleichlösung und eine mit Ammoniak (2,5% v / v), gefolgt von einer sorgfältigen Spülung mit Wasser.
6. Sammlung und Analyse der Daten
- Durch einen Barcode-Leser, der jedes Fach automatisch identifiziert, notieren Sie die Anzahl der Pflanzen, die die Behandlung sowie die Visual Geschätzte Biomasse (VEB) überlebt. Pflanzen sind assals tot, wenn sie keine aktive Wachstum unabhängig von der Farbe oder andere Erscheinung zeigen Essed.
- Den Beurteilungs drei oder vier Wochen nach der Behandlung (WAT) in Abhängigkeit von den getesteten Herbiziden (zB drei WAT für ACCase Inhibitoren und vier WAT für ALS-Inhibitoren oder Glyphosate).
- Bewerten Sie die allgemeine Wirksamkeit der Behandlung, indem ein anfällig Bevölkerung (Check S) in allen Versuchen, das heißt, eine Bevölkerung in einer Website, die nie oder selten mit Herbiziden behandelt wurden, gesammelt.
- Express Plant Survival als Prozentsatz der Anzahl der behandelten Pflanzen, zählte kurz vor der Herbizidbehandlung, und die Berechnung der Standardfehler (SE) pro Mittelwert (Mittelwert der zwei Wiederholungen).
- VEB wird durch einen visuellen Vergleich der pflanzlichen Biomasse erhalten zwischen behandelten und nicht-behandelten Kontrolle der gleichen Population 25, 28. Eine Punktzahl, die von 10 für Pflanzen, die nicht durch das Herbizid (gegenüber der nicht behandelten Kontroll) betroffen 0 Wanndie Pflanzen sind eindeutig tot, wird jedem behandelten Schale gegeben.
- Zuschreiben Bevölkerung in vier Kategorien auf der Grundlage der von Behandlungen mit zwei Herbiziddosen erhaltenen Ergebnisse: S, wenn weniger als 5% der Pflanzen überlebten die Herbiziddosis 1x, SR, wenn Überlebende lag im Bereich von 5% bis 20% an Herbiziddosis 1x, R, wenn mehr als 20% der Pflanzen überlebten die Herbiziddosis 1x und RR, wenn Überlebende sind mehr als 20% an Herbiziddosis 1x und mehr als 10% an Herbiziddosis 3x 17.
Ergebnisse
Um den Widerstand Status eines mutmaßlichen resistenten Population zu bewerten, ist es von grundlegender Bedeutung für eine anfällig Prüfung in dem Test, um die Herbizid-Wirksamkeit zu überprüfen sind. Die Ergebnisse eines Screening-Tests auf P. geführt rhoeas Populationen, Unkraut befallen Weizenfeldern, sind in Abbildung 2, in der die Wirksamkeit von vier Nachauflaufherbizide auf einem anfälligen Scheck (09-36) und an der vermuteten beständig ein (10 bis 91) werden vorgestellt wiesen. Population 09-36 wurde vollständig von den ALS-Inhibitor gesteuert Iodosulfuron, während nur eine Pflanze überlebt Dosis 1x der beiden anderen ALS Herbizide getestet, Florasulam und Tribenuron-methyl (Abbildung 2). Stattdessen etwa 60% der Pflanzen Population 10-91 lebten beide Herbiziddosen Iodosulfuron und Tribenuron-methyl, und etwa 50% überlebten den 1x Dosis Florasulam. Diese Ergebnisse bestätigen, dass Bevölkerung 10-91 ist sehr widerstandsfähig (RR) zu Iodosulfuron und Tribenuron-methyl und beständig(R) Florasulam. Eine andere Reaktion wurde mit 2,4-D, ein Herbizid mit einer unterschiedlichen SoA (dh endogene Auxin imitiert) beobachtet, häufig verwendet, um zweikeimblättrige Unkräuter in Weizen zu kontrollieren. Nur 33% der Pflanzen der S-Check wurden mit diesem Herbizid bei Dosis 1x getötet und die VEB-Wert betrug> 20% (Abbildung 2). Die fehlende Wirksamkeit auf dem Scheck Bevölkerung nicht bestätigen, wenn Bevölkerung 10-91 ist resistent gegen dieses Herbizid oder nicht. In diesem Fall empfiehlt es sich, den Versuch erneut durchzuführen, und wenn die Ergebnisse bestätigt werden, um die Bevölkerung zu ändern. Ein Beispiel für eine gute Kontrolle des anfälligen Prüfung ist in Figur 3 angegeben. Die Echinochloa spp. Bevölkerung 07-16L wurde komplett von allen Herbiziden in der empfohlenen Dosis Feld (1x) gesteuert. In diesem Fall ist es möglich, festzustellen, dass 08 bis 42 Einwohnern ist sehr Quer resistent gegen alle ALS-Inhibitoren getestet, dh, Azimsulfuron, Bispyribac-Na, Imazamox und Penoxsulam. Die nicht behandelten check beider Populationen ist links angegeben. Diese Pflanzen werden verwendet, um die VEB berechnen; die Menge an Biomasse wird visuell abgeschätzt Horde um Horde geben einen Wert von 10 zu der nicht behandelten Kontrolle und dann Zuordnen einer Punktzahl von 0, für die Replikation ohne grünen Pflanzengewebe, auf 10, wenn die Biomasse ist vergleichbar mit dem nicht behandelten Check (Abbildung 3).
Ein weiteres Beispiel für die Ausgabe ist in Figur 4, wo das Überleben der Pflanze von Lolium spp gemeldet. Glyphosat ist gezeigt. Die untersuchten Populationen wurden in Weizenbasis Anbausystemen gesammelt, wo Glyphosat übt verschiedene Selektionsdruck (dh gelegentlich oder 1-2 Behandlungen pro Jahr oder 3-mal mehr pro Jahr). 480 und 1440 g ae ha -1, die die minimale und maximale empfohlene Dosis für Feld einjährigen Unkräutern (dh Therophyten) zu dieser Wachstums st darstellen: Die Pflanzen wurden in einem frühen Stadium der Bestockung mit zwei Dosen von Glyphosat besprüht (BBCH 14-21)Alter. Daten wurden vier Wochen nach der Behandlung gesammelt. Basierend auf diesen beiden Experimenten sieben der geprüften Populationen eine Überlebensrate von 80% oder mehr (Populationen 343, 383, 384, 403, 509, 512 und 537) bei der niedrigsten Dosis angewendet, aber nur 50% der Pflanzen von Populationen 403 und 509 überlebten die höchste Dosis Glyphosat. Eine Bevölkerung hatte eine Überlebensrate von rund 40% bei 1x Dosis, während nur ein paar Pflanzen von 509 Einwohnern überlebte den niedrigsten Dosis und der Bevölkerung 508 wurde vollständig unabhängig von der Dosis gesteuert. Zusammenfassend zeigten diese Experimente verschiedenen Ebenen der Resistenz gegen Glyphosat, die oft reflektiert das Feld Geschichte der Herbizidverbrauch. Die Höhe der Glyphosat-Resistenz war höher für die Bevölkerung, die intensiver behandelt worden war: dh höher war die Zahl der Feldanwendungen pro Jahr und Anzahl der Jahre der Selektionsdruck.
Das für ein Herbizid (Abbildung 4) beschriebenen Protokoll kann auf zahlreiche andere mit verschie aufgebracht werdenmieten SoA; auf diese Weise das Widerstandsmuster aus einer oder mehreren Populationen bestimmt werden. Ein Beispiel einer Widerstandsstruktur Variabilität Echinochloa spp. Bevölkerung ist in Tabelle 1 angegeben. Historische Aufzeichnungen des Herbizideinsatzes und des Pflanzenanbaus vom Bauern erhalten darauf hin, dass ALS-inhibierenden Herbiziden waren die Auswahlmittel (dh Penoxsulam oder Imazamox). Die Beständigkeitstest wurde daher mit drei ALS-inhibierenden Herbiziden (Azimsulfuron, Penoxsulam und Imazamox), um verschiedene chemische Familien gehören, und ein Herbizid mit einer anderen SoA, die ACCase-Hemmer-Herbizid Profoxydim durchgeführt. Die anfälligen Prüfung (07-16L) wurde vollständig durch alle getesteten Herbiziden (Tabelle 1) gesteuert. Drei Resistenzmuster wurden entdeckt: dreizehn Populationen führte als resistent nur für ALS-Inhibitoren, führte vier Populationen als resistent nur auf die ACCase-Inhibitor Profoxydim und drei Populationen zeigten eine multiple Resistenzmuster sowohl für die ACCase-Inhibitor Profoxydim und ALS-Inhibitoren. Innerhalb jedes Widerstandsstruktur ist es möglich, verschiedene Biotypen zB vier Populationen beständig ALS-Inhibitoren lebten nur Behandlungen mit dem Sulfonylharnstoff Azimsulfuron, während zwei der multi-resistenten Populationen überlebten nur die Behandlung mit dem ALS-Inhibitor Azimsulfuron wurden aber ganz durch Penoxsulam gesteuert und zeichnen Imazamox.

Abbildung 1. Beispiel C difformis, ein Unkrautarten befallen Rohreis Versuchsaufbau. Polystyrol-Schalen werden in Kunststoffbehälter gestellt und mit verschraubter Edelstahlstangen blockiert, um zu verhindern schweben. Bei 1-2 cm unter dem Niveau der Bodenoberfläche wird Wasser gehalten, um Rohreis Bedingungen nachzuahmen. Fotografie wurde vier Wochen nach der Behandlung.p_upload / 52923 / 52923fig1large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Reaktion von zwei P. rhoeas Populationen Nachauflaufherbizide. Wirkung von Iodosulfuron, Tribenuron, Florasulam und 2,4-D getestet in der empfohlenen Dosis Feld (1x) und drei Mal, dass (3x) auf das Überleben der Pflanze (blaue Balken) und visuelle Einschätzung Biomasse ( VEB; rote Balken) des anfälligen Scheck (09-36) und aus einem widerstandsfähigen Bevölkerung (10-91). Die Beurteilung erfolgt vier Wochen nach der Herbizidbehandlung wurde. Überleben der Pflanze und VEB sind als Prozentsatz der Zahl der behandelten Pflanzen und die VEB der nicht-behandelten Kontrollen (%) ausgedrückt. Die horizontale Linie bei 20% des Pflanzenlebens stellt die Unterscheidungsschwelle zwischen resistente und anfällige Bevölkerungsgruppen, wenn Pflanzen in Dosis 1x behandelt. Vertikale Balkenstellen Standardfehler des Mittelwertes der beiden Replikaten berechnet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. Visuelle Ergebnisse eines Screenings auf zwei Echinochloa spp. Populationen. Die anfälligen Prüfung 07-16L (S) und der resistenten Population, 08-42 wurden mit vier ALS-Inhibitoren (rechts angegeben) in zwei Dosierungen, 1x und 3x, (unten angegeben) getestet. Für die S-Check nur Ergebnisse der Dosis 1x gemeldet werden, da alle Pflanzen wurden bereits mit dieser Dosis gesteuert. Drei Beispiele von VEB Punktzahl sind rot gemeldet: 0 = alle Pflanzen abgestorben, 10 = alle Pflanzen überlebt und Biomasse ist vergleichbar mit der nicht behandelten (NT) Check (links berichtete), ist 5 = Biomasse etwa die Hälfte, dass in eine Schale des nicht-behandeltenzu überprüfen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
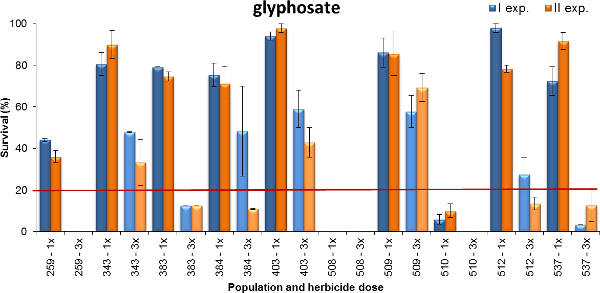
Abbildung 4. Prozentualer Anteil der Pflanzenlebens für zehn Lolium spp. Populationen mit Glyphosat. Plant Survival in zwei Experimenten (blaue Balken und orangen Balken für exp. I bzw. II) aufgezeichnet getestet. Die Daten werden als Prozentsatz (%) der Zahl der behandelten Pflanzen ausgedrückt. Zwei anfällig Kontrollen wurden vollständig bei einer Dosis 1x gesteuert und sind daher nicht in der graphischen Darstellung angegeben. Zwei Dosen wurden getestet, die minimale (1x = 480 g ae ha -1) und die maximale (3x = 1440 g ae ha -1) Dosen auf dem Produktetikett angegeben. Die horizontale Linie bei 20% des Pflanzenlebens stellt die Unterscheidungsschwelle zwischen resistente und anfällige Bevölkerungsgruppen, wenn Pflanzen waren treated auf Dosis 1x. Vertikalen Balken stellen die Standardfehler des Mittelwertes der beiden Replikaten berechnet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
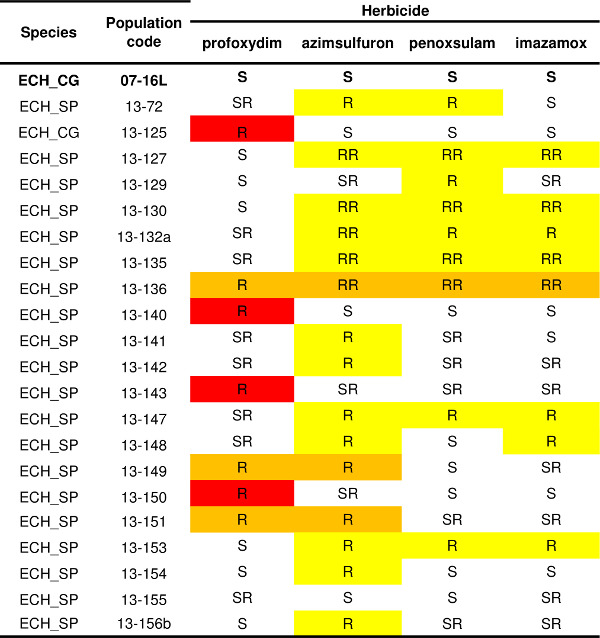
Tabelle 1 Resistance Status einundzwanzig Populationen von Echinochloa spp. Anfällig Scheck (07-16L) ist fett angegeben. Widerstandsstufen für jedes der vier getesteten Herbizide nach vier Kategorien gemeldet (ein ACCase-Inhibitor, Profoxydim und drei ALS-Inhibitoren, Azimsulfuron, Penoxsulam und Imazamox): S = weniger als 5% der Pflanzen überlebten das Herbizid Dosis 1x, SR = Pflanzen Überleben reichte von 5% bis 20% an Herbiziddosis 1x, R = mehr als 20% der Pflanzen überlebten die Herbiziddosis 1x, RR = Anlagenüberlebenszeit betrug mehr als 20% an Herbiziddosis1x und mehr als 10% bei einer Dosis 3x. Verschiedene Resistenzmuster werden hervorgehoben: rot = Widerstand nur ACCase-Inhibitor, gelb = Widerstand nur an ALS-Inhibitor (en), orange = Widerstand gegen die ACCase-Inhibitor und mindestens einem ALS-Inhibitor.
Diskussion
Mehrere Schritte innerhalb der Protokolle sind entscheidend für eine erfolgreiche Bewertung der Herbizidresistenz in einer Population: 1) Samen sollten gesammelt werden, wenn fällig aus Pflanzen, die die Herbizidbehandlung (en) überlebt hatte. Reifung der Samen auf der Mutterpflanze ist von entscheidender Bedeutung, um Schwierigkeiten bei der Keimung der Samen später zu vermeiden; 2) die fachgerechte Lagerung von Samen wird empfohlen, um die Proliferation von Formen, die Keimung verhindern würden, zu vermeiden; 3) Sämlinge sollten auf der rechten Wachstumsphase behandelt werden, wie auf dem Etikett des Herbizids Paket gemeldet. Muss darauf geachtet werden, dass den zu behandelnden Pflanzen etwa die gleiche Wachstumsstufe erreicht werden; 4) die Herbizidlösungen sollten vorbereitet und mit einer Genauigkeit bearbeitet werden, so dass die Pflanzen mit der richtigen Konzentration des Wirkstoffs vermeidet daher Fehler unverifiable gesprüht wird; 5) nach jeder Herbizidbehandlung wird empfohlen, gründlich reinigen Sprühen Schrank und Glaswaren verwendet, um die Lösungen herzustellen, um zu vermeidenVerunreinigungen im folgenden Herbizidbehandlung, insbesondere bei superaktive Herbizide handelt.
Die hier angegebenen Protokolle können leicht an eine Vielzahl von Unkrautarten mit den notwendigen Modifikationen je nach Tierart und Herbizide von Interesse angepasst werden. Insbesondere sollten Verfahren zur Samenruhe zu brechen und für die Keimung sind Schritte, die für jede neue Unkrautarten überdacht werden sollte (siehe Abschnitte 2 und 3). Spritzgeräte braucht manchmal Anpassungen bei anderen Herbiziden verwendet werden, zum Beispiel Glyphosat erfordert unterschiedliche Einstellungen des Spritzschrank (siehe Abschnitt 5.3) und Anlagen werden zu einem späteren Wachstumsphase als bei den meisten Herbiziden behandelt.
Der Raum und Zeit benötigt, um diese Protokolle durchführen können ein einschränkender Faktor sein und ist möglicherweise nicht für Routinetests sein. Um jedoch die Kosten zu begrenzen, kann nur ein Herbizid Dosis verwendet werden. Auf diese Weise können Informationen immer noch auf, ob t erhaltener Bevölkerung ist beständig. Eine mögliche Einschränkung der Ansatz wird auf die Tatsache, dass keine resistenten Prüfungen in den Experimenten eingeschlossen bezogen. In der Tat, aufgrund der großen Anzahl von Biotypen ausgewertet (dh verschiedene Arten und Herbizide beteiligt), viele Kontrollen sollten in jedem Experiment eingeschlossen, so die Kosten erhöht.
Allerdings sind die Vorteile gegenüber alternativen Techniken / Protokolle, die auf ganzen Pflanze Bioassays unter Verwendung von nur einem Herbizid Dosis 15 zur höheren Zuverlässigkeit und der Möglichkeit Ableiten der Widerstands Ebene. Schneller und preiswerter Diagnosesiebungtests ebenfalls erdacht, in vivo oder in vitro (beispielsweise Petrischale Bioassays 8 spektrophotometrischen Tests an Herbizid Zielenzym 29). Allerdings bieten sie nur qualitative Informationen und erfordern einige Vorarbeiten, manchmal mühsam, um die Herbiziddosis zur Unterscheidung zwischen res identifizierenistant und anfälligen Pflanzen. Die in-vitro-Assays müssen auch nach dem verwendeten Wirkstoff angepasst werden.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
The research was supported by the National Research Council (CNR) of Italy. The authors thank GIRE members for collecting seed samples and are grateful to Alison Garside for revising the English.
Materialien
| Name | Company | Catalog Number | Comments |
| Paper bags | Celcar SAS | ||
| Plastic dishes | ISI plast S.p.A. | SO600 | Transparent plastic |
| Sulfuric acid 95-98% | Sigma-Aldrich | 320501 | |
| Non-woven fabric | Carretta Tessitura | Art.TNT17 | Weight 17 g m-2 |
| Chloroform >99.5% | Sigma-Aldrich | C2432 | |
| Agar | Sigma-Aldrich | A1296 | |
| Potassium nitrate >99.0% | Sigma-Aldrich | P8394 | |
| Plastic containers | Giganplast | 1875/M | 600 x 400 x 110 mm |
| Plastic trays | Piber plast | G1210A | 325 x 265 x 95 mm |
| Polystyrene trays | Plastisavio | S24 | 537 x 328 x 72 mm, 24 round cells (6x4) |
| Copper sulfate | Sigma-Aldrich | 451657 | |
| Agriperlite | Blu Agroingross sas | AGRI100 | |
| Peat | Blu Agroingross sas | TORBA250 | |
| Germination cabinet | KW | W87R | |
| Nozzles | Teejet | XR11002-VK, TP11001-VH | The second type of nozzles are used only for glyphosate |
| Barcode generator | Toshiba TEC | SX4 | |
| Labels with barcode | Felga | TT20200 | Stick-in labels with rounded corners |
| Barcode reader | Cipherlab | 8300-L | Portable data terminal |
| Bench sprayer | Built in house | ||
| Herbicides included in the results: | |||
| Commercial product | Active ingredient | Company | Comments |
| Altorex | imazamox | BASF | |
| Azimut | florasulam | Dow AgroSciences | |
| Biopower | Bayer Crop Science | Surfact to be used with Hussar WG | |
| Dash | BASF | Surfact to be used with Altorex | |
| Granstar | tribenuron-methyl | Dupont | |
| Gulliver | azimsulfuron | Dupont | |
| Hussar WG | iodosulfuron | Bayer Crop Science | |
| Nominee | bispyribac-Na | Bayer Crop Science | |
| Roundup | glyphosate | Monsanto | |
| Trend | Dupont | Surfact to be used with Granstar and Gulliver | |
| Viper | penoxsulam | Dow AgroSciences | |
| Weedone LV4 | 2,4-D | Isagro | |
Referenzen
- Massa, D., Kaiser, Y. I., Andújar-Sánchez, D., Carmona-Alférez, R., Mehrtens, J., Gerhards, R. Development of a geo-referenced database for weed mapping and analysis of agronomic factors affecting herbicide resistance in Apera spica-venti L. Beauv. (Silky Windgrass). Agronomy. 3 (1), 13-27 (2013).
- Powles, S. B., Shaner, D. L. . Herbicides Resistance and World Grains. , 308 (2001).
- Sattin, M. Herbicide resistance in Europe: an overview. Proc. BCPC International Congress. , 131-138 (2005).
- Jasieniuk, M., Le Corre, V. Deciphering the evolution of herbicide resistance in weeds. Trends Genet. 29 (11), 649-658 (2013).
- Heap, I. M. Identification and documentation of herbicide resistance. Phytoprotection. 75 (4), 85-90 (1994).
- Beckie, H. J., Heap, I. M., Smeda, R. J., Hall, L. M. Screening for herbicide resistance in weeds. Weed Technol. 14 (2), 428-445 (2000).
- Tal, A., Kotoula-Syka, E., Rubin, B. Seed-bioassay to detect grass weeds resistant to acetyl coenzyme A carboxylase inhibiting herbicides. Crop Prot. 19, 467-472 (2000).
- Boutsalis, P. Syngenta Quick-Test: a rapid whole-plant test for herbicide resistance. Weed Technol. 15 (2), 257-263 (2001).
- Menchari, Y., et al. Weed response to herbicides: regional-scale distribution of herbicide resistance alleles in the grass weed Alopecurus myosuroides. New Phytol. 171 (4), 861-874 (2006).
- Burgos, N. R., et al. Review: confirmation of resistance to herbicides and evaluation of resistance levels. Weed Sci. 61 (1), 4-20 (2013).
- Owen, M. J., Martinez, N. J., Powles, S. B. Multiple herbicide-resistant Lolium rigidum. (annual ryegrass) now dominates across the Western Australian grain belt. Weed Res. 54 (3), 314-324 (2014).
- Beckie, H. J., Tardif, F. J. Herbicide cross resistance in weeds). Crop Prot. 35, 15-28 (2012).
- Moss, S. R., et al. The occurrence of herbicide-resistant grass-weeds in the United Kingdom and a new system for designating resistance in screening assays. Proc. BCPC Weeds. , 179-184 (1999).
- Baskin, C. C., Baskin, J. M. . Seeds, Ecology, Biogeography and Evolution of dormancy and Germination. , 27-42 (1998).
- Sattin, M., Gasparetto, M. A., Campagna, C. Situation and management of Avena sterilis. ssp. ludoviciana. and Phalaris paradoxa. resistant to ACCase inhibitors in Italy. Proc. BCPC - Weeds. , 755-762 (2001).
- Scarabel, L., Varotto, S., Sattin, M. A European biotype of Amaranthus retroflexus. cross-resistant to ALS inhibitors and response to alternative herbicides. Weed Res. 47 (6), 527-533 (2007).
- Collavo, A., Panozzo, S., Lucchesi, G., Scarabel, L., Sattin, M. Characterisation and management of Phalaris paradoxa. resistant to ACCase-inhibitors. Crop Prot. 30 (3), 293-299 (2011).
- Scarabel, L., Carraro, N., Sattin, M., Varotto, S. Molecular basis and genetic characterisation of evolved resistance to ALS-inhibitors in Papaver rhoeas. Plant Sci. 166 (3), 703-709 (2004).
- Panozzo, S., Scarabel, L., Tranel, P. J., Sattin, M. Target-site resistance to ALS inhibitors in the polyploid species Echinochloa crus-galli. Pestic. Biochem. Phys. 105 (2), 93-101 (2013).
- Sattin, M., Berto, D., Zanin, G., Tabacchi, M. Resistance to ALS inhibitors in rice in north-western Italy. Proc. BCPC. Weeds. , 783-790 (1999).
- Scarabel, L., Berto, D., Sattin, M. Dormancy breaking and germination of Alisma plantago-aquatica. and Scirpus mucronatus. Aspects of Applied Biology. 69, 285-292 (2003).
- Collavo, A., Strek, H., Beffa, R., Sattin, M. Management of an ACCase-inhibitor-resistant Lolium rigidum. population based on the use of ALS inhibitors: weed population evolution observed over a 7 years field-scale investigation. Pest Manag. Sci. 69 (2), 200-208 (2013).
- Scarabel, L., Panozzo, S., Savoia, W., Sattin, M. Target-site ACCase-resistant Johnsongrass (Sorghum halepense). selected in summer dicot crops. Weed Technol. 28 (2), 307-315 (2014).
- Hess, M., Barralis, H., Bleiholder, H., Buhur, L., Eggers, T., Hack, H., Strauss, R. Use of the extended BBCH scale - general for the description of the growth stages of mono- and dicotyledonous weed species. Weed Res. 37 (6), 433-441 (1997).
- Collavo, A., Sattin, M. First glyphosate-resistant Lolium. spp. biotypes found in a European annual arable cropping system also affected by ACCase and ALS resistance. Weed Res. 54 (4), 325-334 (2014).
- Scarabel, L., Cenghialta, C., Manuello, D., Sattin, M. Monitoring and management of imidazolinone-resistant red rice (Oryza sativa. L., var. sylvatica.) in Clearfield® Italian paddy rice. Agronomy. 2 (4), 371-383 (2012).
- Zelaya, I. A., Anderson, J. A. H., Owen, M. D. K., Landes, R. D. Evaluation of spectrophotometric and HPLC methods for shikimic acid determination in plants: Models in glyphosate-resistant and-susceptible crops. J. Agric. Food Chem. 59 (6), 2202-2212 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten